吡咯烷衍生物,以及包含其的用于预防或治疗
β-淀粉样蛋白或tau蛋白相关疾病的药物组合物
技术领域
1.本发明涉及一种新型吡咯烷衍生物或其药学上可接受的盐、以及包含其的具有β-淀粉样蛋白和/或tau蛋白聚集抑制效果、和/或β-淀粉样蛋白和/或酪蛋白的聚集体降解效果、和/或β-淀粉样蛋白和/或tau蛋白相关疾病预防和/或治疗效果的药物组合物、以及含有所述吡咯烷衍生物或其药学上可接受的盐的蛋白降解靶向嵌合体化合物。
背景技术:
2.代表性的退行性脑神经疾病阿尔茨海默病的主要病理特征是形成肽聚集体,其被称为老年斑(senile plaque),这会引发突触功能障碍及神经细胞的死亡。这种老年斑的主要成分是有40-42氨基酸长度的β-淀粉样蛋白(beta-amyloid;aβ)。β-淀粉样蛋白单体是富含低聚物、原纤维(protofibril)及β折叠的纤维,容易自组装(self-assemble),与神经毒性的发病有关。
3.另外,最近众所周知,由于tau蛋白具有非正常结构而形成包涵体(inclusion body),并产生退行性脑疾病,因此tau蛋白正在成为这些疾病的新靶子。据悉,tau蛋白是稳定微管所需的物质,如果其过度积累,微管就会崩溃,正常神经细胞的网络就会瓦解。由于tau蛋白的积累和神经细胞的聚集引起的疾病被称为tau蛋白病(tauopathy),其被认为是多种退行性脑疾病的原因。
4.因此,需要开发一种能够抑制β-淀粉样蛋白和/或tau蛋白的聚集(积累)或降解聚集体,从而可应用于治疗退行性脑神经疾病的药物。
技术实现要素:
5.技术问题
6.为了解决所述现有技术的问题,本发明提供一种新型化合物或其药学上可接受的盐、包含其的药物或食品组合物、以及所述化合物的用途,其能够抑制β-淀粉样蛋白和/或tau蛋白的聚集(积累)或降解聚集体,从而可应用于治疗退行性脑神经疾病。
7.另外,本发明提供一种含有所述新型化合物或其药学上可接受的盐的蛋白降解靶向嵌合体化合物、包含其的药学或食品组合物、以及所述化合物的用途。
8.技术方案
9.本发明的一例提供一种吡咯烷衍生物或其药学上可接受的盐,由以下化学式i、ii、iii、iv或v表示:
[0010][0011]
在所述化学式i中,x1和x2可以相同或不同,各自为nh、o或s,y为nh或o,r为h或碳原子数为1至6个的烷基(六元环内的“n”表示其以取代任意选自组成环的6个碳中的一个的方式存在);
[0012][0013]
在所述化学式ii中,x1和x2可以相同或不同,各自为nh、o或s,y为nh、o或s,r为h或碳原子数为1至6个的烷基;
[0014][0015]
在所述化学式iii中,x1和x2可以相同或不同,各自为nh、o或s(例如x1为nh或s,x2为nh、o或s),r为h或碳原子数为1至6个的烷基;
[0016][0017]
在所述化学式iv中,x1和x2可以相同或不同,各自为nh、o或s(例如x1为nh或s,x2为o或s),r为h或碳原子数为1至6个的烷基;
[0018][0019]
在所述化学式v中,x1和x2可以相同或不同,各自为nh、o或s(例如x1为nh或s,x2为o或s),r为h或碳原子数为1至6个的烷基。
[0020]
本发明的另一例提供一种用于抑制β-淀粉样蛋白和/或tau蛋白的聚集的药物组合物,其包含选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中
的至少一种作为有效成分。
[0021]
本发明的另一例提供一种抑制β-淀粉样蛋白和/或tau蛋白的聚集的方法,其包括以下步骤:将至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐以药学有效量施于需要抑制β-淀粉样蛋白和/或tau蛋白的聚集的患者。
[0022]
本发明的另一例提供一种至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐在用于抑制β-淀粉样蛋白和/或tau蛋白的聚集中的用途、或在制备用于抑制β-淀粉样蛋白和/或tau蛋白的聚集的组合物中的用途。
[0023]
本发明的另一例提供一种用于降解β-淀粉样蛋白和/或tau蛋白的聚集体的药物组合物,其包含选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种作为有效成分。
[0024]
本发明的另一例提供一种降解β-淀粉样蛋白和/或tau蛋白的聚集体的方法,其包括以下步骤:将至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐以药学有效量施于需要降解β-淀粉样蛋白和/或tau蛋白的聚集体的患者。
[0025]
本发明的另一例提供一种至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐在用于降解β-淀粉样蛋白和/或tau蛋白的聚集体中的用途、或在制备用于降解β-淀粉样蛋白和/或tau蛋白的聚集体的组合物中的用途。
[0026]
本发明的另一例提供一种用于保护脑神经细胞的组合物,其包含选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种作为有效成分。其中,所述保护脑神经细胞包括保护脑神经细胞免受由β-淀粉样蛋白或tau蛋白的聚集(积累)引起的损伤。
[0027]
本发明的另一例提供一种保护脑神经细胞的方法,其包括以下步骤:将至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐以药学有效量施于需要保护脑神经细胞的患者。
[0028]
本发明的另一例提供一种至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐在用于保护脑神经细胞中的用途、或在制备用于保护脑神经细胞的组合物中的用途。
[0029]
本发明的另一例提供一种用于预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的组合物,其包含选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种作为有效成分。
[0030]
本发明的另一例提供一种用于预防和/或改善β-淀粉样蛋白和/或tau蛋白相关疾病的保健功能性食品,其包含选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种作为有效成分。
[0031]
本发明的另一例提供一种预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的方法,其包括以下步骤:将至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐以药学有效量施于需要预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的患者。
[0032]
本发明的另一例提供一种至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐在用于预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病中的用途、或在制备用于预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的组合物中
的用途。
[0033]
所述β-淀粉样蛋白和/或tau蛋白相关疾病可以选自淀粉样蛋白疾病、tau蛋白病(tauopathy)以及一些β-淀粉样蛋白和/或tau蛋白相关退行性脑神经疾病,例如,痴呆(如阿尔茨海默病(alzheimer's disease)、血管性痴呆等)、轻度认知障碍(mild cognitive impairment)、大脑淀粉样血管病、康氏综合征、淀粉样脑卒中(stroke)、系统性淀粉样变性、荷兰(dutch)型淀粉样变性、tau蛋白病、路易体痴呆(dementia with lewy bodies,dlb)、多发性梗塞性痴呆(multi-infarct dementia,mid)、额颞叶变性(frontotemporal lobar degeneration,ftld)、皮克病(pick's disease)、皮质基底节变性(corticobasal degeneration,cbd)、进行性核上性麻痹(progressive supernuclear,psp)、帕金森氏病、亨廷顿氏病等。
[0034]
有益效果
[0035]
本说明书提供的由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐具有优异的β-淀粉样蛋白和/或tau蛋白聚集抑制和/或聚集体降解效果,可以有效地应用于预防和/或治疗由β-淀粉样蛋白和/或tau蛋白的聚集和/或积累引起的各种脑神经疾病。
附图说明
[0036]
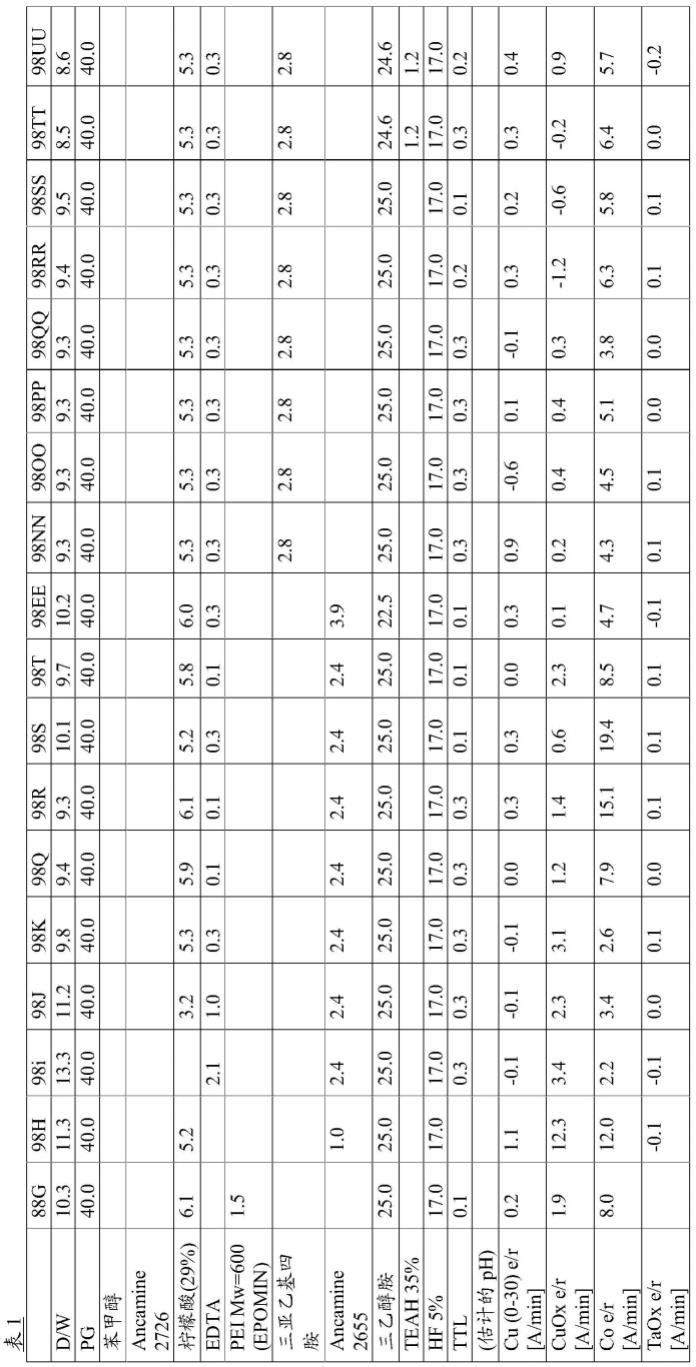
图1a及图1b为确认含有本发明化合物的tau-1及tau-2蛋白降解靶向嵌合体化合物在三种经磷酸化的tau中显示降解活性的图。具体地,图1a为对tau-1及tau-2的降解活性进行蛋白印迹并通过image quant las 4000(ge healthcare,il,usa)获得的图像,图1b表示使用image j程序对所述图像定量的结果。
[0037]
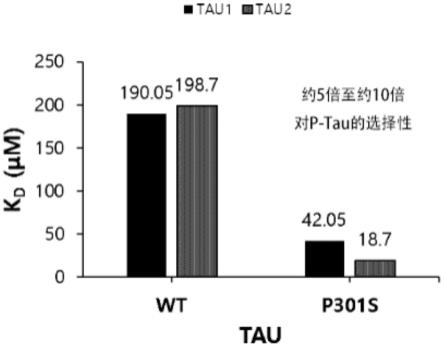
图2是示出含有本发明的化合物的tau-1及tau-2protac化合物对无病证wt tau和病症p301s tau蛋白的结合力(kd)的图。
具体实施方式
[0038]
下面将更详细描述本说明书所提供的发明。
[0039]
首先,本发明的一实施例提供一种吡咯烷衍生物或其药学上可接受的盐,由以下化学式i、ii、iii、iv或v表示:
[0040][0041]
在所述化学式i中,x1和x2可以相同或不同,各自为nh、o或s,y为nh或o,r为h或碳原子数为1至6个的烷基(六元环内的“n”表示其以取代任意选自组成环的6个碳中的一个的方式存在);
[0042][0043]
在所述化学式ii中,x1和x2可以相同或不同,各自为nh、o或s,y为nh、o或s,r为h或碳原子数为1至6个的烷基;
[0044][0045]
在所述化学式iii中,x1和x2可以相同或不同,各自为nh或s(例如x1为nh或s,x2为nh、o或s),r为h或碳原子数为1至6个的烷基;
[0046][0047]
在所述化学式iv中,x1和x2可以相同或不同,各自为nh、o或s(例如x1为nh或s,x2为o或s),r为h或碳原子数为1至6个的烷基;
[0048][0049]
在所述化学式v中,x1和x2可以相同或不同,各自为nh、o或s(例如x1为nh或s,x2为o或s),r为h或碳原子数为1至6个的烷基。
[0050]
具体地,在所述化学式i至v中,r可以为h或碳原子数为1至4个的烷基,更具体地,r可以为h、甲基、乙基或异丙基。
[0051]
具体地,所述化学式i至v中的可以为
但不限于此。
[0052]
具体地,所述化学式i中的可以为可以为但不限于此。
[0053]
具体地,所述化学式ii中的可以为可以为但不限于此。
[0054]
具体地,所述吡咯烷衍生物可以选自以下表1中记载的化合物。
[0055]
【表1】
[0056]
[0057]
[0058]
[0059]
[0060]
[0061]
[0062]
[0063]
[0064]
[0065]
[0066]
[0067]
[0068]
[0069]
[0070]
[0071]
[0072]
[0073]
[0074]
[0075]
[0076]
[0077]
[0078]
[0079]
[0080]
[0081]
[0082]
[0083]
[0084]
[0085]
[0086]
[0087]
[0088][0089]
所述药学上可接受的盐可以选自所述吡咯烷衍生物的酸性盐、碱性盐、酸或碱的加成盐,以及其立体化学/光学异构体形式。这些盐没有特别限定,包括在施用目标对象中保留母体化合物(parent compound)活性而不产生任何不良作用的任何盐。所述酸性盐包括无机酸盐和有机酸盐,例如,可以是利用选自乙酸、硝酸、天冬氨酸、磺酸、硫酸、马来酸、谷氨酸、甲酸、琥珀酸、磷酸、邻苯二甲酸、丹宁酸、酒石酸、氢溴酸、丙酸、苯磺酸、苯甲酸、硬脂酸、甲苯基酸、乳酸、重碳酸、重硫酸、重酒石酸、草酸、丁酸、依地酸钙、樟脑磺酸、碳酸、氯苯甲酸、柠檬酸、乙二胺四乙酸、甲苯磺酸、乙二磺酸、乙磺酸、富马酸、葡庚糖酸、双羟萘酸、葡萄糖酸、乙二醇对氨基苯胂酸、硝酸甲酯、聚半乳糖醛酸、己基雷锁辛酸、丙二酸、异羟肟酸、盐酸、氢碘酸、羟萘酸、羟乙磺酸、乳糖酸、扁桃酸、丙酸酯十二烷基硫酸、黏液酸、萘磺酸、粘康酸、对硝基甲磺酸、环拉酸、泛酸、磷酸一氢盐、磷酸二氢盐、水杨酸、氨基磺酸、磺胺酸、甲磺酸和茶氯酸中的酸形成的盐。另外,所述碱性盐可以选自:铵盐、碱金属盐或碱土金属盐如锂盐、钠盐、钾盐、镁盐、钙盐等;具有有机碱的盐,如苄星盐、n-甲基-d-葡糖胺盐、海巴胺盐;以及具有氨基酸如精氨酸、赖氨酸的盐等。通过用合适的酸或碱处理还可将转化为游离形式。术语“加成盐(additional salt)”包括可由所述吡咯烷衍生物及其盐形成的溶剂化合物。溶剂化合物可以包括水合物、醇化物等。
[0090]
另外,人β-淀粉样蛋白(beta-amyloid)是一种含有约36~43个氨基酸的肽分子,也是在阿尔茨海默病患者的大脑中表达的淀粉样蛋白斑块的主要成分,并且已知与阿尔茨海默病的发病有关。所述β-淀粉样蛋白肽分子可以通过用β-分泌酶(beta secretase)和γ-分泌酶(gamma secretase)切割淀粉样蛋白前体蛋白(amyloid precursor protein(app);uniprotkb p05067)而获得。β-淀粉样蛋白肽分子聚集形成神经细胞毒性寡聚物,导致脑神经疾病。
[0091]
阿尔茨海默病的主要病理学特征之一是神经原纤缠结(neurofibrillary tangles;nft),其由tau蛋白的过度磷酸化导致的双螺旋丝(paired helical filaments;phfs)组成。tau蛋白以交替链接的异构体形式存在,其含有相当于微管结合域的重复序列的3或4个拷贝(copy)。神经原纤缠结(neurofibrillary tangles;nft)为由tau蛋白的过度磷酸化导致的双螺旋丝(paired helical filaments;phfs)组成的,其已知为如阿尔茨海默病等脑神经疾病的主要病理学特征之一。过度磷酸化的tau蛋白的聚集体会导致微管的
不稳定,从而阻碍通过外显子传输各种信号。
[0092]
在本说明书中,已确认所述由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐不仅对β-淀粉样蛋白和/或tau蛋白的聚集具有抑制活性,而且对聚集体也具有降解活性。
[0093]
因此,本发明提供一种所述由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐在抑制β-淀粉样蛋白和/或tau蛋白的聚集;降解β-淀粉样蛋白和/或tau蛋白的聚集体;保护脑神经细胞;以及预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病中的医药用途。
[0094]
具体地,本发明的一例提供一种用于抑制β-淀粉样蛋白和/或tau蛋白的聚集的药物组合物,其包含选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种作为有效成分。
[0095]
本发明的另一例提供一种抑制β-淀粉样蛋白和/或tau蛋白的聚集的方法,其包括以下步骤:将至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐以药学有效量施于需要抑制β-淀粉样蛋白和/或tau蛋白的聚集的患者。
[0096]
本发明的另一例提供一种至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐在用于抑制β-淀粉样蛋白和/或tau蛋白的聚集中的用途、或在制备用于抑制β-淀粉样蛋白和/或tau蛋白的聚集的组合物中的用途。
[0097]
本发明的另一例提供一种用于降解β-淀粉样蛋白和/或tau蛋白的聚集体的药物组合物,其包含选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种作为有效成分。
[0098]
本发明的另一例提供一种降解β-淀粉样蛋白和/或tau蛋白的聚集体的方法,其包括以下步骤:将至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐以药学有效量施于需要降解β-淀粉样蛋白和/或tau蛋白的聚集体的患者。
[0099]
本发明的另一例提供一种至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐在用于降解β-淀粉样蛋白和/或tau蛋白的聚集体中的用途、或在制备用于降解β-淀粉样蛋白和/或tau蛋白的聚集体的组合物中的用途。
[0100]
本发明的另一例提供一种用于保护脑神经细胞的组合物,其包含选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种作为有效成分。其中,所述保护脑神经细胞包括保护脑神经细胞免受由β-淀粉样蛋白或tau蛋白的聚集(积累)引起的损伤。
[0101]
本发明的另一例提供一种保护脑神经细胞的方法,其包括以下步骤:将至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐以药学有效量施于需要保护脑神经细胞的患者。
[0102]
本发明的另一例提供一种至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐在用于保护脑神经细胞中的用途、或在制备用于保护脑神经细胞的组合物中的用途。
[0103]
本发明的另一例提供一种用于预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的组合物,其包含选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种作为有效成分。
[0104]
本发明的另一例提供一种用于预防和/或改善β-淀粉样蛋白和/或tau蛋白相关疾病的保健功能性食品,其包含选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种作为有效成分。
[0105]
本发明的另一例提供一种预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的方法,其包括以下步骤:将至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐以药学有效量施于需要预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的患者。
[0106]
本发明的另一例提供一种至少一种选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐在用于预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病中的用途、或在制备用于预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的组合物中的用途。
[0107]
如本文所用,“β-淀粉样蛋白和/或tau蛋白相关疾病”是指前述β-淀粉样蛋白和/或tau蛋白的聚集(积累)会引起的所有脑神经疾病。本发明的一例中,所述β-淀粉样蛋白和/或tau蛋白相关疾病可例示为:痴呆(例如,阿尔茨海默病(alzheimer's disease)、血管性痴呆等)、轻度认知障碍(mild cognitive impairment)、大脑淀粉样血管病、康氏综合征、淀粉样脑卒中(stroke)、系统性淀粉样变性、荷兰(dutch)型淀粉样变性、tau蛋白病、路易体痴呆(dementia with lewy bodies,dlb)、多发性梗塞性痴呆(multi-infarct dementia,mid)、额颞叶变性(frontotemporal lobar degeneration,ftld)、皮克病(pick's disease)、皮质基底节变性(corticobasal degeneration,cbd)、进行性核上性麻痹(progressive supernuclear,psp)、帕金森氏病、亨廷顿氏病等,但不限于此,其可以选自由β-淀粉样蛋白和/或tau蛋白的聚集(aggregation)和/或积累引起的任何疾病。
[0108]
如本文所用,术语“治疗”包括病理症状的减轻或改善,疾病部位的减少,疾病进展的延迟或缓解,疾病状态或症状的改善、减轻或稳定,部分或完全恢复,生存期的延长和其他有益治疗结果等的所有含义。术语“预防”包括对没有特定疾病的对象起作用以预防所述特定疾病的发病、延迟其发病时期或降低其发病频率的所有机制和/或效果的含义。术语“保护脑神经细胞”包括抑制脑神经细胞的损伤和/或死亡的所有机制和/或效果的含义。
[0109]
在一例中,除了所述有效成分(选自由化学式i、ii、iii、iv及v的吡咯烷衍生物及其药学上可接受的盐中的至少一种)以外,所述药物组合物还可以包含选自药学上可接受的载体、赋形剂、稀释剂、填充剂、增量剂、湿润剂、崩解剂、乳化剂(表面活性剂)、润滑剂、甜味剂、调味剂、悬浮液、保存剂等中的至少一种佐剂。所述佐剂可以根据所述药物组合物所采用的剂型进行适当调节,并且可以包括选自药学领域中常用的所有佐剂中的至少一种。在一具体例中,所述药学上可接受的载体通常在药物的制剂化中使用,并且可以为选自乳糖、右旋糖、蔗糖、海藻糖、精氨酸、组氨酸、山梨糖醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟苯甲酯、羟苯丙酯、滑石、硬脂酸镁、矿物油等中的至少一种,但不限于此。
[0110]
所述有效成分(选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种)的有效量,或所述药物组合物可以以口服或非口服方式给药。在非口服给药的情况下,可以通过静脉内注射、皮下注射、肌内注射、腹膜内注射、内皮给药、鼻内给药、肺内给药、直肠内给药或病变部位局部给药等来进行。在口服给药的情况下,所述
药物组合物可以包衣活性成分以防止活性成分在胃中降解,或者可以配制成可防止在胃中降解的剂型。
[0111]
如本文所述,术语“药学有效量”可以指在药物组合物中可以表现出所需药理学效果的有效成分(即,选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种)的含量或剂量。所述药学有效量或有效成分可以根据诸如制剂化方法、给药方式、患者的年龄、体重、性别、病理状况、饮食、给药时间、给药间隔、给药途径、排泄速度和反应敏感性等因素适当地确定。例如,所述有效成分的日剂量或单剂量范围可以为0.0001mg/kg至1000mg/kg(体重)、0.001mg/kg至500mg/kg、0.01mg/kg至100mg/kg、0.1mg/kg至50mg/kg或0.5mg/kg至20mg/kg,但不限于此。所述日剂量或单剂量可以以单位剂量的形式配制成单一制剂,或者通过适当地划分用量来配制,或者通过将其装入多剂量容器来制备。
[0112]
所述药物组合物中有效成分(即,选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种)的含量可以根据药物组合物的使用形式、患者的状况、所需效果等适当地调整,例如,按重量百分比计可以为:0.0001%至99.9%、0.001%至99.9%、0.01%至99.9%、0.1%至99.9%、0.5%至99.9%、1%至99.9%、5%至99.9%、10%至99.9%、15%至99.9%、20%至99.9%、25%至99.9%、30%至99.9%、35%至99.9%、40%至99.9%、45%至99.9%、50%至99.9%、55%至99.9%、0.0001%至90%、0.001%至90%、0.01%至90%、0.1%至90%、0.5%至90%、1%至90%、5%至90%、10%至90%、15%至90%、20%至90%、25%至90%、30%至90%、35%至90%、40%至90%、45%至90%、50%至90%、55%至90%、0.0001%至70%、0.001%至70%、0.01%至70%、0.1%至70%、0.5%至70%、1%至70%、5%至70%、10%至70%、15%至70%、20%至70%、25%至70%、30%至70%、35%至70%、40%至70%、45%至70%、50%至70%、55%至70%、0.0001%至50%、0.001%至50%、0.01%至50%、0.1%至50%、0.5%至50%、1%至50%、5%至50%、10%至50%、15%至50%、20%至50%、25%至50%、30%至50%、35%至50%、40%至50%、45%至50%、0.0001%至40%、0.001%至40%、0.01%至40%、0.1%至40%、0.5%至40%、1%至40%、5%至40%、10%至40%、15%至40%、20%至40%、25%至40%、30%至40%或35%至40%,但不限于此。
[0113]
所述药物组合物可以为水性或油性介质中的溶液、悬浮液、糖浆剂或乳化剂的形式,或者可以配制成散剂、粉剂、颗粒剂、片剂或胶囊剂等的形式,并且为了进行制剂化,可以进一步包含分散剂或稳定剂。
[0114]
所述药物组合物的施用对象可以为哺乳类,其包括:包括人类、猴子等的灵长类;包括小鼠、大鼠等的啮齿类,或从所述哺乳类中分离出的细胞、组织或其培养物。
[0115]
所述保健功能性食品是使用容易在日常膳食中缺乏的营养素、对人体有用的原料或成分(以下称为“功能性原料”)制备的食品,并且是指有助于维持健康、预防和/或改善某些疾病或症状的任何食品,对其最终产品形式没有特别限制。例如,所述保健功能性食品可以选自各种食品、饮料组合物、食品添加剂等,但不限于此。
[0116]
所述保健功能性食品中有效成分(即,选自由化学式i、ii、iii、iv及v表示的吡咯烷衍生物及其药学上可接受的盐中的至少一种)的含量可以根据食品的形式、所需用途等适当地调整,没有特别限制,例如,按重量百分比计可以为食品总重量的0.0001%至99%、
0.0001%至95%、0.0001%至90%、0.0001%至80%、0.0001%至50%、0.001%至99%、0.001%至95%、0.001%至90%、0.001%至80%、0.001%至50%、0.01%至99%、0.01%至95%、0.01%至90%、0.01%至80%、0.01%至50%、0.1%至99%、0.1%至95%、0.1%至90%、0.1%至80%、0.1%至50%、0.1%至30%、0.1%至10%、1%至99%、1%至95%、1%至90%、1%至80%、1%至50%、1%至30%、1%至10%、10%至99%、10%至95%、10%至90%、10%至80%、10%至50%、10%至30%、25%至99%、25%至95%、25%至90%、25%至80%、25%至50%、25%至30%、40%至99%、40%至95%、40%至90%、40%至80%、40%至50%、50%至99%、50%至95%、50%至90%、50%至80%、60%至99%、60%至95%、60%至90%或60%至80%,但不限于此。
[0117]
所述保健功能性食品可以进一步包含选自各种营养素、维生素、矿物(电解质)、如合成风味剂或天然风味剂等的风味剂、着色剂、增味剂(奶酪、巧克力等)、果胶酸或其盐、海藻酸或其盐、有机酸、保护性胶体增稠剂、ph调节剂、稳定剂、防腐剂、甘油、醇和用于碳酸饮料的碳酸化剂等中的至少一种。相对于每100重量份的所有保健功能性食品,这些添加剂的比例通常在0.001重量份至约20重量份的范围内选择,但不限于此。
[0118]
本发明的另一例提供一种含有所述吡咯烷衍生物或其药学上可接受的盐的蛋白降解靶向嵌合体(protac,以下称为“protac”化合物)化合物、以及所述吡咯烷衍生物或其药学上可接受的盐在制备所述蛋白降解靶向嵌合体化合物中的用途。
[0119]
在一具体例中,除了所述吡咯烷衍生物或其药学上可接受的盐以外,所述蛋白降解靶向嵌合体化合物还可以含有靶结合配体(即,靶向蛋白的残基),优选地,可表示所述吡咯烷衍生物或其药学上可接受的盐与靶结合配体可通过连接基团,如结合部或化学连接残基相互连接的结构。如本领域技术人员能理解的,可合成本发明所述的蛋白降解靶向嵌合体化合物使得各官能残基的数量和位置可根据需要改变。
[0120]
在一具体的实现例中,本发明的蛋白降解靶向嵌合体化合物可以为由以下化学式vi表示的tau-1化合物((z)-n-(2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚啉-4-基)-2-(2-(2-(2-(4-((3-((1-乙基-5-氧代-2-硫代咪唑烷-4-亚基)甲基)-1h-吡咯并[3,2-b]吡啶-1-基)甲基)-1h-1,2,3-三唑-1-基)乙氧基)乙氧基)乙氧基)乙酰胺),或由化学式vii表示的tau-2化合物((z)-n-(2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚啉-4-基)-2-(2-(2-(4-((3-((1-乙基-5-氧代-2-硫代咪唑烷-4-亚基)甲基)-1h-吲哚-1-基)甲基)-1h-1,2,3-三唑-1-基)乙氧基)乙氧基)乙酰胺)。
[0121]
[化学式vi]
[0122][0123]
[化学式vii]
[0124][0125]
在一具体实施例中,本发明的tau-1及tau-2化合物在三种磷酸化的tau中显示有效的降解活性,并且对于治疗脑疾病有用,特别是有选择性地结合于病症p301s,而几乎不结合于无病证wt tau,因此可以确认它们显示优异的选择性。
[0126]
因此,本发明提供所述蛋白降解靶向嵌合体化合物在抑制β-淀粉样蛋白和/或tau蛋白的聚集;降解β-淀粉样蛋白和/或酪蛋白的聚集体;抑制β-淀粉样蛋白和/或tau蛋白的聚集;保护脑神经细胞;以及预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病中的医药用途。
[0127]
本发明的另一例提供一种抑制β-淀粉样蛋白和/或tau蛋白的聚集的方法,其包括以下步骤:将所述蛋白降解靶向嵌合体以药学有效量施于需要抑制β-淀粉样蛋白和/或tau蛋白的聚集的患者。
[0128]
本发明的另一例提供所述蛋白降解靶向嵌合体化合物在抑制β-淀粉样蛋白和/或tau蛋白的聚集中的用途、或其在制备用于抑制β-淀粉样蛋白和/或tau蛋白的聚集的组合物中的用途。
[0129]
本发明的另一例提供一种用于降解β-淀粉样蛋白和/或tau蛋白的聚集体的药物组合物,其包含所述蛋白降解靶向嵌合体化合物作为有效成分。
[0130]
本发明的另一例提供一种降解β-淀粉样蛋白和/或tau蛋白的聚集体的方法,其包括以下步骤:将所述蛋白降解靶向嵌合体以药学有效量施于需要降解β-淀粉样蛋白和/或tau蛋白的聚集体的患者。
[0131]
本发明的另一例提供所述蛋白降解靶向嵌合体化合物在降解β-淀粉样蛋白和/或tau蛋白的聚集体中的用途、或其在制备用于降解β-淀粉样蛋白和/或tau蛋白的聚集体的组合物中的用途。
[0132]
本发明的另一例提供一种用于保护脑神经细胞的药物组合物,其包含所述蛋白降解靶向嵌合体化合物作为有效成分。其中,所述保护脑神经细胞包括保护脑神经细胞免受由β-淀粉样蛋白或tau蛋白的聚集(积累)引起的损伤。
[0133]
本发明的另一例提供一种保护脑神经细胞的方法,其包括以下步骤:将所述蛋白降解靶向嵌合体以药学有效量施于需要保护脑神经细胞的患者。
[0134]
本发明的另一例提供所述蛋白降解靶向嵌合体化合物在保护脑神经细胞中的用途、或其在制备用于保护脑神经细胞的组合物中的用途。
[0135]
本发明的另一例提供一种用于预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的组合物,其包含所述蛋白降解靶向嵌合体化合物作为有效成分。
[0136]
本发明的另一例提供一种用于预防和/或改善β-淀粉样蛋白和/或tau蛋白相关疾病的保健功能性食品,其包含所述蛋白降解靶向嵌合体化合物作为有效成分。
[0137]
本发明的另一例提供一种预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的方法,其包括以下步骤:将所述蛋白降解靶向嵌合体以药学有效量施于需要预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的患者。
[0138]
本发明的另一例提供所述蛋白降解靶向嵌合体化合物在用于预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病中的用途、或其在制备用于预防和/或治疗β-淀粉样蛋白和/或tau蛋白相关疾病的组合物中的用途。
[0139]
至于这些蛋白降解靶向嵌合体化合物的用途、药物组合物以及食品组合物的相关记载,可以应用前述本发明的吡咯烷衍生物或其药学上可接受的盐的用途及组合物的相关记载。
[0140]
实施方式
[0141]
下面将参考实施例更详细地描述本发明,这些实施例仅是示例性的,并不旨在限制本发明的范围。本领域技术人员显然可以在不脱离本发明要旨的范围内修改以下描述的实施例。
[0142]
实施例1.吡咯烷衍生物的合成
[0143]
步骤1
[0144]
将醛(3mmol)和二酮(1.0eq)放入醋酸(3ml)中,在常温下搅拌。然后放入醋酸铵(3.0eq),滴注完成后使温度逐渐上升,在95℃下混合2小时。通过薄层色谱法(thin layer chromatography;tlc)确认反应完成后,经过过滤得到结晶。在己烷和乙酸乙酯条件下,将上述得到的结晶精炼为再结晶,并得到了目的化合物。
[0145]
步骤2
[0146]
将从所述步骤1中得到的化合物(0.5mmol)溶解在甲醇和水混合的溶剂(1ml)中(比例(以体积为准)=1:1.5)。在常温下滴注氢氧化钠(1.0eq)后,搅拌15分钟。然后,以30μl的量放入cocl
2-dmg complex(在dmf 5ml中溶解42mg的氯化钴和250mg的二甲基乙二肟的溶液)后,再在常温下搅拌15分钟。然后,放入氢氧化硼钠(1.3eq)后,在50℃下搅拌24小时。反应结束时,将反应液冷却至常温,然后用水结束反应,并添加乙酸乙酯以提取有机层。用盐水清洗有机层后,用亚硫酸钠去除水分。对从减压蒸馏溶剂所获得的残渣利用prep hplc进行分离精炼,以获得目的化合物。
[0147]
如上所述获得的化合物如下:
[0148]
【表2】
[0149]
[0150]
[0151]
[0152]
[0153]
[0154]
[0155]
[0156]
[0157]
[0158]
[0159]
[0160]
[0161]
[0162]
[0163]
[0164]
[0165]
[0166]
[0167]
[0168]
[0169]
[0170]
[0171]
[0172]
[0173]
[0174]
[0175]
[0176]
[0177]
[0178]
[0179]
[0180]
[0181]
[0182]
[0183]
[0184]
[0185]
[0186]
[0187]
[0188]
[0189]
[0190]
[0191]
[0192]
[0193]
[0194]
[0195]
[0196]
[0197]
[0198]
[0199]
[0200]
[0201]
[0202]
[0203]
[0204]
[0205]
[0206]
[0207][0208]
实施例2:抑制β-淀粉样蛋白聚集试验
[0209]
通过利用硫黄素t(thioflavin t;tht)的硫黄素测定法(thioflavin assay)测量试验化合物对β-淀粉样蛋聚集的抑制效果。由于当tht结合于β-淀粉样蛋白聚集体等β折叠(β-sheet)丰富的结构时会显示荧光,因此可以从通过微空板荧光读数仪的荧光强度知道
各个化合物对β-淀粉样蛋白的聚集抑制程度。为了使用于硫黄素测定法,将硫黄素t(sigma-aldrich)溶解于50mm的甘氨酸缓冲液(glycine buffer,ph 8.5)以使其浓度变为5mm。然后,使用50mm的甘氨酸缓冲液(ph 8.5)将其稀释至5μm,并在避光的暗室保存。
[0210]
将aβ(β-淀粉样蛋白;人aβ1-42单体(uniprotkb-p05067,a.a.672-713))溶解于二甲基亚砜(dimethyl sulfoxide;dmso)以使其浓度变为10mm,将所述实施例1中合成的每个化合物(50um,500um;以下称为“试验化合物”)与β-淀粉样蛋白混合,以使其最终浓度变为25μm,然后在37℃下诱导β-淀粉样蛋白聚集(aggregation)3天。
[0211]
将完成反应的反应液以25μl的量分别添加到96孔(well)荧光分析板的每个孔中,然后将所准备的硫磺素t溶液以75μl的量分别添加到每个孔中。在室温的暗室条件下进行5分钟反应后,使用多功能微孔板读数仪(multi-mode microplate reader)在excitation(激发波长)450nm和emission(发射波长)485nm下测量荧光值。
[0212]
将仅处理β-淀粉样蛋白以聚集3天的组(对照组)的荧光值转换为%值并将其表示为100,并且将从每个试验化合物处理组所测得的荧光值转换为其相对值,其结果如表3所示。
[0213]
【表3】
[0214]
[0215]
[0216][0217]
β-淀粉样蛋白聚集抑制活性(相对于对照组的百分比(%of control))
[0218]
(n.t.:未测试(not tested))
[0219]
如上表3所示,可以确认本说明书提供的化合物与对照组相比,表现少则约5%以上,多则75%以上的β-淀粉样蛋白聚集抑制活性。
[0220]
实施例3:降解β-淀粉样蛋白聚集体试验
[0221]
将aβ(β-淀粉样蛋白;人aβ1-42单体(uniprotkb-p05067,a.a.672-713))溶解于二甲基亚砜(dimethyl sulfoxide;dmso)以使其浓度变为10mm,并使用蒸馏水使其稀释为250um,在37℃培养3天以诱导聚集体的形成。如上所述,将每个试验化合物以50um或500um的量分别添加到诱导聚集的β-淀粉样蛋白中,以使其最终浓度变为25μm,并在37℃下进一步培养3天以进行反应。
[0222]
根据硫黄素t(tht)测试法(assay)(参见实施例2)对各试验化合物的聚集体的降解效果进行测量。具体地,将所述完成反应的反应液以25μl的量分别添加到96孔荧光分析板的每个孔中,然后将硫磺素t溶液以75μl的量分别添加到每个孔中。在室温的暗室条件下进行5分钟反应后,使用多功能微孔板读数仪(multi-mode microplate reader)在excitation(激发波长)450nm和emission(发射波长)485nm下测量荧光值。
[0223]
将仅处理β-淀粉样蛋白以聚集3天的组(对照组)的荧光值转换为%值并将其表示为100,将所测得的荧光值转换为其相对值,其结果如表4所示。
[0224]
【表4】
[0225]
试验化合物50um500umdn20429668.9017.28dn20429786.8028.19dn20429859.377.79dn204299n.t.80.07dn20430390.6633.65dn20430497.4773.11dn20428983.6654.07
dn204286n.t.94.23dn20429488.6474.80dn20467386.8930.52dn204807n.t.53.56dn204808n.t.73.30dn20480995.1425.32dn20481174.6428.97dn204812n.t.89.68dn20481458.02-40.60dn204816n.t.92.41dn204817n.t.78.39dn20481895.0835.83dn205107n.t.91.94dn205109n.t.83.20dn205353n.t.90.19dn205354n.t.64.83dn20535593.8044.61dn20578051.3135.73dn20578185.7655.35
[0226]
β-淀粉样蛋白聚集体降解活性(相对于对照组的百分比)
[0227]
(n.t.未测试)
[0228]
如上表4所示,可以确认本说明书提供的化合物与对照组相比,表现少则约5%以上,多则90%以上的β-淀粉样蛋白聚集体降解活性。
[0229]
实施例4.抑制tau蛋白聚集试验
[0230]
通过将tau蛋白(k18 wild typ)溶解于磷酸盐缓冲液(phosphate-buffered saline(pbs),ph 7.4))以使其浓度变为1mg/ml来准备tau蛋白溶液。为了诱导tau蛋白的聚集,在所述1mg/ml的tau蛋白溶液中放入0.1mg/ml的肝素(heparin)和100μm的二硫苏糖醇(dithiothreitol;dtt),并在37℃下培养5天。此时,混合每个试验化合物(50um,500um),以使其最终浓度变为0.5mg/ml,并一起培养。
[0231]
通过硫黄素t(tht)测定法(参见实施例2),根据荧光的强度,测量各个化合物对tau蛋白聚集的抑制效果。更具体地,将完成反应的反应液以25μl的量分别添加到96孔荧光分析板的每个孔中,然后将所准备的硫黄素t溶液以75μl的量分别添加到每个孔中。在室温的暗室条件下进行5分钟反应后,使用多功能微孔板读数仪(multi-mode microplate reader)在excitation(激发波长)450nm和emission(发射波长)485nm下测量荧光值。
[0232]
将仅处理tau蛋白以聚集5天的组(对照组)的荧光值转换为%值并将其表示为100,并且将从每个试验化合物处理组所测得的荧光值转换为其相对值,其结果如表5所示。
[0233]
【表5】
[0234][0235]
[0236][0237]
tau蛋白聚集抑制活性(相对于对照组的百分比)
[0238]
(n.t.:未测试)
[0239]
如上表5所示,可以确认本说明书提供的化合物与对照组相比,表现少则约5%以上,多则90%以上的tau蛋白聚集抑制活性。
[0240]
实施例5.降解tau蛋白聚集体试验
[0241]
通过将(tau)蛋白(k18 wild typ)溶解于磷酸盐缓冲液(pbs,ph 7.4)以使其浓度变为1mg/ml来准备tau蛋白溶液。在tau蛋白溶液中放入0.1mg/ml的肝素和100μm的二硫苏糖醇(dtt),并在37℃下培养5天以诱导tau聚集体的形成。如上所述,将每个试验化合物以50um或500um的量分别添加到诱导聚集的tau蛋白中,以使其最终浓度变为0.5mg/ml,并在37℃下再培养5天以进行反应。
[0242]
根据硫黄素t(tht)测定法(参见实施例2)对各试验化合物的聚集体的降解效果进行测量。具体地,将所述完成反应的反应液以25μl的量分别添加到96孔荧光分析板的每个孔中,然后将硫黄素t溶液以75μl的量分别添加到每个孔中。在室温的暗室条件下进行5分钟反应后,使用多功能微孔板读数仪(multi-mode microplate reader)在excitation(激发波长)450nm和emission(发射波长)485nm下测量荧光值。
[0243]
将仅处理tau蛋白以聚集5天的组(对照组)的荧光值转换为%值并将其表示为100,将所测得的荧光值转换为其相对值,其结果如表6所示。
[0244]
【表6】
[0245]
[0246][0247]
tau蛋白聚集体降解活性(相对于对照组的百分比)
[0248]
(n.t.:未测试)
[0249]
如上表6所示,可以确认本说明书提供的化合物与对照组相比,表现少则约10%以上,多则90%以上的tau蛋白聚集体降解活性。
[0250]
实施例6.制备含有本发明化合物的tau protac化合物
[0251]
6-1.制备(z)-n-(2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚啉-4-基)-2-(2-(2-(2-(4-((3-((1-乙基-5-氧代-2-硫代咪唑烷-4-亚基)甲基)-1h-吡咯并[3,2-b]吡啶-1-基)甲基)-1h-1,2,3-三唑-1-基)乙氧基)乙氧基)乙氧基)乙酰胺((z)-n-(2-(2,6-dioxopiperidin-3-yl)-1,3-dioxoisoindolin-4-yl)-2-(2-(2-(2-(4-((3-((1-ethyl-5-oxo-2-thioxoimidazolidin-4-ylidene)methyl)-1h-pyrrolo[3,2-b]pyridin-1-yl)
methyl)-1h-1,2,3-triazol-1-yl)ethoxy)ethoxy)ethoxy)acetamide;tau-1)
[0252][0253]
为了制备含有本发明化合物的tau protac化合物即tau-1化合物,进行了以下方法。
[0254]
在按1∶1混合水与叔丁醇的溶液中放入(z)-3-乙基-5-((1-(2-丙炔-1-基)-1h-吡咯并[3,2-b]吡啶-3-基)亚甲基)-2-硫代咪唑烷-4-酮((z)-3-ethyl-5-((1-(prop-2-yn-1-yl)-1h-pyrrolo[3,2-b]pyridin-3-yl)methylene)-2-thioxoimidazolidin-4-one,1eq)和2-(2-(2-(2-叠氮乙氧基)乙氧基)乙氧基)-n-(2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚啉-4-基)乙酰胺(2-(2-(2-(2-azidoethoxy)ethoxy)ethoxy)-n-(2-(2,6-dioxopiperidin-3-yl)-1,3-dioxoisoindolin-4-yl)acetamide,1eq),然后添加1m硫酸铜水溶液(5mol%)和抗坏血酸钠(sodium ascorbate,0.3eq)。在常温下搅拌4小时。反应结束时,在反应液中放入氨水溶液后结束反应,进一步添加乙酸乙酯以提取有机层。用盐水清洗有机层后,用亚硫酸钠去除水分。对从减压蒸馏溶剂所获得的残渣利用prep hplc进行分离精炼,以获得目的化合物。
[0255][0256]1h nmr(400mhz,cdcl3)δ10.362(s,1h),8.765(d,j=8.4hz,1h),8.605(s,1h),8.544(d,j=4.2hz,1h),7.942(d,j=8.2hz,1h),7.795(s,2h),7.700(t,j=7.6hz,1h),
3.739(m,1h),3.641(t,j=8.2hz,3h),2.788-2.929(m,2h),2.6525(s,1h),2.240(t,j=8.0hz,1h),1.334(t,j=7.2hz,3h)
[0263]
实施例7.确认在tau protac的hek293t p301l突变细胞株中磷酸化的tau降解活性
[0264]
为了评估本发明的化合物的磷酸化的tau降解活性,进行了如下试验。
[0265]
具体地,购买了addgene公司的prk5-egfp-tau p301l载体(vector(addgene,ma,usa))以在hek293t细胞中稳定地表达p301l,已知该p301l为病症tau的代表性突变。利用fugene hd转染试剂(transfection reagent(promega,wi,usa))将p301l载体(vector)插入到hek293t细胞后使其稳定。去除细胞后,通过荧光激活细胞分选(fluorescence-activated cell sorting(bd facs ariaⅲ,bd bioscience,nj,usa))设备来仅分离了插入载体(vector)的细胞。将分离的细胞培养2~3天后,经过2次重新去除并使用facs设备来分离培养的步骤,最终获得hek293t p301突变细胞株。
[0266]
将确保的细胞注入到6孔板(well plate)中,并经过18个小时的稳定化后,对各个孔进行处理以使其实施例化合物的最终浓度分别变为1μm、10μm。对于对照组,将用作实施例化合物的溶剂的dmso处理为相同的浓度(0.01%)。处理72小时后,使用裂解缓冲液(lysis buffer)提取蛋白质并进行定量后,进行了蛋白印迹试验。通过4-20%mini-protein tgx预制蛋白凝胶(precast protein gel(bio-rad,ca,usa))对蛋白质样品进行电泳,并将其转移至pvdf膜(membrane(immobilon-p,merck,darmstadt,germany))。此后,作为一抗的p-tau at8(#mn1020)、p-tau s396(#44-752g)、p-tau s356(#44-751g),使用thermofisher scientific(ma,usa)公司的抗体,而gapdh(sc-47724)则使用了santa cruz biotechnology(tauz biotechnology,ta)公司的抗体。作为二抗的rabbit/mouse igg,使用了genetex(ca,usa)公司的抗体。通过image quant las 4000(ge healthcare,il,usa)获得的图像和使用image j程序对其定量的结果如图1所示。
[0267]
参照图1,对于p-tau at8(s202,t205),其在实施例6-1中制备的tau-1protac的10μm处理组中,与对照组相比,具有26%的降解活性,在实施例6-2中制备的tau-2protac分别在1μm、10μm的浓度中显示59%、53%的降解活性。对于p-tau(s396),tau-1protac在1μm、10μm的浓度下均显示67%的降解活性,而tau-2protac在1μm的浓度下显示30%的降解活性。此外,对于p-tau(s356),tau-1protac在10μm的浓度处理组中显示81%的降解活性,而tau-2protac在1μm中显示62%,在10μm中显示80%的磷酸化的tau降解活性。结果表明,在处理tau-1、tau-2protac时,在三种磷酸化的tau中显示有效的降解活性,tau-1protac对p-tau s396具有更有效的降解活性,而tau-2protac对p-tau s202、t205、s356具有更有效的降解活性。因此,本发明实施例的化合物具有磷酸化的tau的降解活性,特别是对于治疗磷酸化的tau引起的脑疾病很有用。
[0268]
实施例8.确认tau protac的wt tau和pathologic tau之间的结合力(kd)
[0269]
为了证明仅选择性地降解本发明的化合物的磷酸化tau,进行了如下试验。
[0270]
为了从生物物理的角度上分析已知为病症tau的代表性突变的p301s和tau protac会选择性结合,将无病症tau和病症tau p301s tau放入prset-b载体(vector)并采用克隆方法来获得了质粒。为了蛋白质的过度表现而采用了star plyss细胞(cell),在约od600 0.4-0.6下将1mm iptg注入到培养基。通过热休克(heat shock,95℃)将溶解在裂解
缓冲液(lysis buffer)中的细胞内蛋白质排出细胞外,利用阳离子交换色谱(cation exchange chromatography)和体积排除色谱(size exclusion chromatography)确保高纯度(》95%)的wt tau和p301s tau。
[0271]
通过spr试验确认了确保的蛋白质和tau protac之间的结合。使用了附有葡聚糖(dextran)的cm5传感器芯片(sensorchip),将蛋白质附着在芯片(chip)上后,流过tau protac,同时通过响应单元(response unit;ru)来确认了蛋白质和化合物之间的结合,而且通过依赖浓度的动力学分析(kinetic assay)方法来确认了对蛋白质的结合力(kd)。tau protac化合物和无病症wt tau、病症p301s tau之间的结合力结果示于图2。如图2中所示,可以确认tau protac选择性地与病症p301s结合,而几乎不与无病症wt tau结合。结果表明,tau-1 protac 1及tau-2 protac化合物分别以190.05μm、198.7μm的量结合于tau,即,结合力相当弱或相不结合。相反,tau-1 protac 1及tau-2 protac化合物分别以42.05μm、18.74μm的量结合于病症p301s tau。因此,本发明一实施例的化合物通过选择性地结合于p301s tau来仅降解病症tau,而不降解无病证wt tau,对于治疗脑疾病很有用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。