用于治疗自身免疫性疾病的哌啶基胺化合物
1.本发明涉及可用于哺乳动物的治疗和/或预防的有机化合物,尤其涉及可用于治疗全身性红斑狼疮或狼疮肾炎的tlr7和/或tlr8和/或tlr9的拮抗剂。
技术领域
2.自身免疫性结缔组织病(ctd)包括典型的自身免疫综合征,诸如全身性红斑狼疮(sle)、原发性干燥综合征(psjs)、混合性结缔组织病(mctd)、皮肌炎/多发性肌炎(dm/pm)、类风湿关节炎(ra)和系统性硬化症(ssc)。除ra以外,对患者来说,没有真正有效且安全的疗法。sle代表典型的ctd,其患病率为20-150/100,000,并在不同器官引起广泛的炎症和组织损伤,从皮肤和关节的常见症状到肾、肺或心力衰竭。传统上,sle已使用非特异性抗炎药或免疫抑制剂进行治疗。但是,长期使用免疫抑制药物,例如,皮质类固醇仅部分有效,并伴有非预期毒性和副作用。贝利尤单抗是过去50年中唯一获得fda批准的用于狼疮的药物,尽管仅对部分sle患者具有适度延迟的疗效(navarra,s.v.等人,lancet 2011,377,721.)。其他生物制剂,诸如抗cd20 mab、抗特定细胞因子的mab或其可溶受体,在大多数临床研究中均失败了。因此,需要新型疗法,其在更大比例的患者群组中提供持续改善,并且对于在许多自身免疫以及自身炎症性疾病中的长期使用而言更安全。
3.toll样受体(tlr)是模式识别受体(prr)的重要家族,可以引发多种免疫细胞产生广泛的免疫应答。核内体tlr 7、tlr8和tlr9作为天然的宿主防御传感器,可识别衍生自病毒、细菌的核酸;具体地,tlr7/tlr8和tlr9分别识别单链rna(ssrna)和单链cpg-dna。然而,trl7/trl8/trl9的异常核酸传感被认为是广泛的自身免疫和自身炎性疾病的关键节点(krieg,a.m.等人,immunol.rev.2007,220,251.jim
é
nez-dalmaroni,m.j.等人,autoimmun rev.2016,15,1.chen,j.q.等人,clinical reviews in allergy&immunology 2016,50,1.)因此,tlr7/8/9代表了治疗自身免疫性疾病和自身炎症性疾病的新治疗靶点,针对这些疾病,不存在有效的不含类固醇和无细胞毒性的口服药物,并且从非常上游就抑制了这些途径可能会带来令人满意的治疗效果。从安全角度来看,因为存在多个核酸传感途径(例如其他tlr、cgas/sting),所以这种冗余仍应允许在存在tlr7/8/9抑制的情况下对感染做出应答。因此,我们提议并发明了靶向和抑制tlr7/8/9的口服化合物,用于治疗自身免疫性疾病和自身炎症性疾病。
技术实现要素:
4.本发明涉及式(i)或(ia)的新型化合物,
5.6.其中
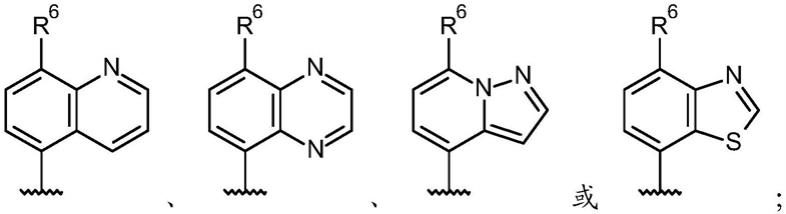
7.r1为
8.其中r6为氰基或卤素;
9.r2为c
1-6
烷基;
10.r3为h或卤素;
11.r4为h、卤素或羟基;
12.r5为被哌嗪基取代的1,3-二氢吡咯并[3,4-c]吡啶基;
[0013]
被哌嗪基取代的2,3,3a,7a-四氢-1h-茚基氨基;
[0014]
被哌嗪基取代的3,4-二氢-1h-异喹啉基;
[0015]
被哌嗪基取代的5,7-二氢吡咯并[3,4-b]吡啶基;
[0016]
被哌嗪基取代的5,7-二氢吡咯并[3,4-d]嘧啶基;
[0017]
被哌嗪基取代的异吲哚啉基;或
[0018]-nr
5ar5b
;其中
[0019]r5a
为h或c
1-6
烷基;
[0020]r5b
为1,2,3,4-四氢异喹啉基c
1-6
烷基;
[0021]
5,6,7,8-四氢-1,6-萘啶基c
1-6
烷基;
[0022]
异吲哚啉基c
1-6
烷基;
[0023]
被哌嗪基取代的苯基(羟基)c
1-6
烷基;
[0024]
苯基c
1-6
烷基,所述苯基c
1-6
烷基被一个或两个独立地选自(c
1-6
烷基)2吡啶基、氨基哌啶基、氨基吡咯烷基、c
1-6
烷基哌嗪基、卤素、哌嗪基和哌啶基的取代基取代;
[0025]
被哌嗪基取代的吡嗪基c
1-6
烷基;
[0026]
被哌嗪基取代的哒嗪基c
1-6
烷基;
[0027]
被哌嗪基或被c
1-6
烷基哌嗪基取代的吡啶基c
1-6
烷基;
[0028]
或
[0029]
被哌嗪基或被c
1-6
烷基哌嗪基取代的嘧啶基c
1-6
烷基;
[0030]
或其药用盐、对映体或非对映体。
[0031]
本发明的另一目的涉及式(i)或(ia)的新型化合物、其生产、基于根据本发明化合物的药物及其制备以及式(i)或(ia)的化合物作为tlr7和/或tlr8和/或tlr9拮抗剂的用途,及用于治疗或预防全身性红斑狼疮或狼疮肾炎的用途。式(i)或(ia)的化合物显示出优异的tlr7和/或tlr8和/或tlr9拮抗活性。另外,式(i)或(ia)的化合物还显示出良好的细胞毒性、溶解性、人微粒体稳定性和sdpk特征,以及低cyp抑制作用。
具体实施方式
[0032]
定义
[0033]
术语“c
1-6
烷基”表示含有1至6个,特别是1至4个碳原子的饱和、直链或支链烷基,例如,甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基等。特别地,“c
1-6
烷基”基团为甲基、乙基和正丙基。
[0034]
术语“卤素”和“卤代”在本文中可互换使用,表示氟、氯、溴或碘。
[0035]
术语“杂环基”表示3至12个环原子的单价饱和或部分不饱和的单环或双环体系,其包含1个、2个或3个选自n、o和s的杂原子,剩余的环原子为碳。在特定的实施例中,杂环基是4至10个环原子的单价饱和的单环体系,其包含1个、2个或3个选自n、o和s的环杂原子,剩余的环原子为碳。杂环基可以是完全或部分饱和的。单环饱和杂环基的实例是氮丙啶基、环氧乙烷基、氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、四氢-噻吩基、吡唑烷基、咪唑烷基、噁唑烷基、异噁唑烷基、噻唑烷基、哌啶基、四氢吡喃基、四氢噻喃基、哌嗪基、吗啉基、硫代吗啉基、1,1-二氧代-硫代吗啉-4-基、氮杂环庚烷基、二氮杂环庚烷基、高哌嗪基或氧氮杂环庚烷基。部分饱和的单环杂环基的示例为二氢呋喃基、咪唑啉基、二氢噁唑基、四氢吡啶基和二氢吡喃基。双环杂环基的示例为1,3-二氢吡咯并[3,4-c]吡啶基;2,3,3a,7a-四氢-1h-茚基氨基;3,4-二氢-1h-异喹啉基;5,7-二氢吡咯并[3,4-b]吡啶基;5,7-二氢吡咯并[3,4-d]嘧啶基;异吲哚啉基;氮杂双环[3.2.1]辛烷基;氮杂双环[3.3.1]壬烷基;氮杂螺[3.3]庚烷基;氧杂氮杂双环[3.3.1]壬烷基;氧杂二氮杂螺[4.5]癸烷基;二氮杂双环[2.2.2]辛烷基;二氮杂双环[3.2.1]辛烷基;二氮杂双环[4.2.0]辛烷基;二氮杂螺[2.5]辛烷基;二氮杂螺[3.3]庚烷基;二氮杂螺[3.4]辛烷基;二氮杂螺[3.5]壬烷基;二氮杂螺[3.6]癸烷基;二氮杂螺[4.4]壬烷基;二氮杂螺[4.5]癸烷基;二氮杂螺[5.5]十一烷基;氧杂二氮杂双环[3.3.1]壬烷基;氧杂二氮杂螺[5.5]十一烷基;和氧代二氮杂螺[4.4]壬烷基。单环或双环杂环基可进一步被卤素、羟基、氨基、氨基c
1-6
烷基、氨基c
1-6
烷基羰基、c
1-6
烷基羰基氨基、(c
1-6
烷基)2氨基、氨基甲酰基、c
1-6
烷基、卤代c
1-6
烷基、苯基、苯基c
1-6
烷基或杂环基取代。
[0036]
术语“对映体”表示化合物的两种立体异构体,它们是彼此不可重叠的镜像。
[0037]
术语“非对映体”表示具有两个或更多个手性中心并且其分子并非彼此镜像的立体异构体。非对映体具有不同的物理性质,例如熔点、沸点、光谱特性和反应性。
[0038]
术语“药用盐”表示在生物学上或其他方面不是不期望的盐。“药用盐”包括酸加成盐和碱加成盐两者。
[0039]“药用酸加成盐”是指与无机酸和有机酸形成的那些药用盐,所述无机酸诸如盐酸、氢溴酸、硫酸、硝酸、碳酸、磷酸等,所述有机酸可以选自脂肪族、脂环族、芳族、芳脂族、杂环、羧酸和磺酸类有机酸,诸如甲酸、乙酸、丙酸、乙醇酸、葡萄糖酸、乳酸、丙酮酸、草酸、苹果酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、天冬氨酸、抗坏血酸、谷氨酸、邻氨基苯甲酸、苯甲酸、肉桂酸、扁桃酸、双羟萘酸、苯乙酸、甲磺酸、乙磺酸、对甲苯磺酸、和水杨酸等。
[0040]
术语“药用碱加成盐”表示与有机或无机碱形成的那些药用盐。可接受的无机碱的示例包括钠、钾、铵、钙、镁、铁、锌、铜、锰和铝盐。衍生自药用有机无毒碱的盐包括伯胺、仲胺和叔胺,取代胺(包括天然存在的取代胺)、环胺和碱性离子交换树脂(诸如异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、2-二乙氨基乙醇、氨丁三醇、二环己胺,赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、哈胺(hydrabamine)、胆碱、甜菜碱、乙二胺、葡糖胺、甲基葡
糖胺、可可碱、嘌呤、哌嗪、哌啶、n-乙基哌啶和多胺树脂)的盐。
[0041]
术语“药物活性代谢物”表示通过特定化合物或其盐在体内的代谢产生的药理活性产物。进入人体后,大多数药物均是化学反应的底物,可能改变其物理性质和生物学效应。这些通常影响本发明化合物极性的代谢转化改变了药物在体内分布和从体内排泄的方式。然而,在某些情况下,药物代谢是治疗效果所必需的。
[0042]
术语“治疗有效量”是表示本发明的化合物或分子的量,当将其施用于受试者时,(i)治疗或预防特定疾病、病症或疾患,(ii)减弱、改善或消除特定疾病、病症或疾患的一种或多种症状,或(iii)预防或延迟本文所述的特定疾病、病症或疾患的一种或多种症状的发作。治疗有效量取决于化合物,所治疗的疾病状态,所治疗疾病的严重程度,受试者的年龄和相对健康状况,给药途径和形式,主治医学或兽医的判断和其他因素。
[0043]
术语“药物组合物”表示包含治疗有效量的活性药物成分和一起施用于有此需要的哺乳动物(例如人)的药用赋形剂的混合物或溶液。
[0044]
tlr7和/或tlr8和/或tlr9的拮抗剂
[0045]
本发明涉及式(i)化合物,
[0046][0047]
其中
[0048]
r1为
[0049]
其中r6为氰基或卤素;
[0050]
r2为c
1-6
烷基;
[0051]
r3为h或卤素;
[0052]
r4为h、卤素或羟基;
[0053]
r5为被哌嗪基取代的1,3-二氢吡咯并[3,4-c]吡啶基;
[0054]
被哌嗪基取代的2,3,3a,7a-四氢-1h-茚基氨基;
[0055]
被哌嗪基取代的3,4-二氢-1h-异喹啉基;
[0056]
被哌嗪基取代的5,7-二氢吡咯并[3,4-b]吡啶基;
[0057]
被哌嗪基取代的5,7-二氢吡咯并[3,4-d]嘧啶基;
[0058]
被哌嗪基取代的异吲哚啉基;或
[0059]-nr
5ar5b
;其中
[0060]r5a
为h或c
1-6
烷基;
[0061]r5b
为1,2,3,4-四氢异喹啉基c
1-6
烷基;
[0062]
5,6,7,8-四氢-1,6-萘啶基c
1-6
烷基;
[0063]
异吲哚啉基c
1-6
烷基;
[0064]
被哌嗪基取代的苯基(羟基)c
1-6
烷基;
[0065]
苯基c
1-6
烷基,所述苯基c
1-6
烷基被一个或两个独立地选自(c
1-6
烷基)2吡啶基、氨基哌啶基、氨基吡咯烷基、c
1-6
烷基哌嗪基、卤素、哌嗪基和哌啶基的取代基取代;
[0066]
被哌嗪基取代的吡嗪基c
1-6
烷基;
[0067]
被哌嗪基取代的哒嗪基c
1-6
烷基;
[0068]
被哌嗪基或被c
1-6
烷基哌嗪基取代的吡啶基c
1-6
烷基;
[0069]
或
[0070]
被哌嗪基或被c
1-6
烷基哌嗪基取代的嘧啶基c
1-6
烷基;
[0071]
或其药用盐、对映体或非对映体。
[0072]
本发明的进一步实施例为(ii)式(ia)化合物,
[0073][0074]
其中
[0075]
r1为
[0076]
其中r6为氰基或卤素;
[0077]
r2为c
1-6
烷基;
[0078]
r3为h或卤素;
[0079]
r4为h、卤素或羟基;
[0080]
r5为被哌嗪基取代的1,3-二氢吡咯并[3,4-c]吡啶基;
[0081]
被哌嗪基取代的2,3,3a,7a-四氢-1h-茚基氨基;
[0082]
被哌嗪基取代的3,4-二氢-1h-异喹啉基;
[0083]
被哌嗪基取代的5,7-二氢吡咯并[3,4-b]吡啶基;
[0084]
被哌嗪基取代的5,7-二氢吡咯并[3,4-d]嘧啶基;
[0085]
被哌嗪基取代的异吲哚啉基;或
[0086]-nr
5ar5b
;其中
[0087]r5a
为h或c
1-6
烷基;
[0088]r5b
为1,2,3,4-四氢异喹啉基c
1-6
烷基;
[0089]
5,6,7,8-四氢-1,6-萘啶基c
1-6
烷基;
[0090]
异吲哚啉基c
1-6
烷基;
[0091]
被哌嗪基取代的苯基(羟基)c
1-6
烷基;
[0092]
苯基c
1-6
烷基,所述苯基c
1-6
烷基被一个或两个独立地选自(c
1-6
烷基)2吡啶基、氨基哌啶基、氨基吡咯烷基、c
1-6
烷基哌嗪基、卤素、哌嗪基和哌啶基的取代基取代;
[0093]
被哌嗪基取代的吡嗪基c
1-6
烷基;
[0094]
被哌嗪基取代的哒嗪基c
1-6
烷基;
[0095]
被哌嗪基或被c
1-6
烷基哌嗪基取代的吡啶基c
1-6
烷基;
[0096]
或
[0097]
被哌嗪基或被c
1-6
烷基哌嗪基取代的嘧啶基c
1-6
烷基;
[0098]
或其药用盐、对映体或非对映体。
[0099]
本发明的另一实施例是(iii),其是根据(i)或(ii)所述的式(i)或(ia)的化合物,其中
[0100]
r1为
[0101]
其中r6为氰基或卤素;
[0102]
r2为c
1-6
烷基;
[0103]
r3为h;
[0104]
r4为h;
[0105]
r5为被哌嗪基取代的3,4-二氢-1h-异喹啉基;
[0106]
被哌嗪基取代的5,7-二氢吡咯并[3,4-b]吡啶基;
[0107]
被哌嗪基取代的异吲哚啉基;或
[0108]-nr
5ar5b
;其中
[0109]r5a
为h或c
1-6
烷基;
[0110]r5b
为1,2,3,4-四氢异喹啉基c
1-6
烷基;
[0111]
5,6,7,8-四氢-1,6-萘啶基c
1-6
烷基;
[0112]
苯基c
1-6
烷基,所述苯基c
1-6
烷基被一个或两个独立地选自(c
1-6
烷基)2吡啶基、氨基哌啶基、氨基吡咯烷基、c
1-6
烷基哌嗪基、卤素、哌嗪基和哌啶基的取代基取代;
[0113]
被哌嗪基取代的吡嗪基c
1-6
烷基;
[0114]
被哌嗪基或被c
1-6
烷基哌嗪基取代的吡啶基c
1-6
烷基;
[0115]
或
[0116]
被哌嗪基或被c
1-6
烷基哌嗪基取代的嘧啶基c
1-6
烷基;
[0117]
或其药用盐、对映体或非对映体。
[0118]
本发明的进一步实施例为(iv)根据(iii)所述的式(i)或(ia)化合物,其中
[0119]
r1为
[0120]
其中r6为氰基或氯;
[0121]
r2为甲基;
[0122]
r3为h;
[0123]
r4为h;
[0124]
r5为((氨基哌啶基)苯基)甲基氨基;((氨基吡咯烷基)苯基)甲基氨基;((二甲基吡啶基)苯基)甲基氨基;((甲基哌嗪基)苯基)甲基氨基;((甲基哌嗪基)吡啶基)甲基氨基;((甲基哌嗪基)嘧啶基)甲基氨基;(5,6,7,8-四氢-1,6-萘啶基)甲基氨基;(氟(哌嗪基)苯基)甲基氨基;(哌嗪基苯基)乙基氨基;(哌嗪基苯基)甲基氨基;(哌嗪基吡嗪基)甲基氨基;(哌嗪基吡啶基)甲基氨基;(哌嗪基嘧啶基)甲基氨基;(哌啶基苯基)甲基氨基;1,2,3,4-四氢异喹啉基甲基氨基;甲基((哌嗪基苯基)甲基)氨基;哌嗪基-3,4-二氢-1h-异喹啉基;哌嗪基-5,7-二氢吡咯并[3,4-b]吡啶基;或哌嗪基异吲哚啉基;
[0125]
或其药用盐、对映体或非对映体。
[0126]
本发明的进一步实施例为(v)根据(iii)所述的式(i)或(ia)化合物,其中根据权利要求3所述的化合物,其中r1为为其中r6为氰基。
[0127]
本发明的进一步实施例为(vi)根据(v)所述的式(i)或(ia)化合物,其中r2为甲基。
[0128]
本发明的进一步实施例为(vii)根据(vi)所述的式(i)或(ia)化合物,其中
[0129]
r5为被哌嗪基取代的5,7-二氢吡咯并[3,4-b]吡啶基;或
[0130]-nr
5ar5b
;其中
[0131]r5a
为h;
[0132]r5b
为被哌嗪基取代的苯基c
1-6
烷基;或被哌嗪基取代的嘧啶基c
1-6
烷基。
[0133]
本发明的进一步实施例为(viii)根据(vii)所述的式(i)或(ia)化合物,其中r5为哌嗪基-5,7-二氢吡咯并[3,4-b]吡啶基;(哌嗪基苯基)甲基氨基或(哌嗪基嘧啶基)甲基氨基。
[0134]
本发明的进一步实施例为(ix)根据(i)或(ii)所述的式(i)或(ia)化合物,其中
[0135]
r1为其中r6为氰基;
[0136]
r2为c
1-6
烷基;
[0137]
r3为h;
[0138]
r4为h;
[0139]
r5为r5为被哌嗪基取代的5,7-二氢吡咯并[3,4-b]吡啶基;或
[0140]-nr
5ar5b
;其中
[0141]r5a
为h;
[0142]r5b
为被哌嗪基取代的苯基c
1-6
烷基;或被哌嗪基取代的嘧啶基c
1-6
烷基;
[0143]
或其药用盐、对映体或非对映体。
[0144]
本发明的进一步实施例为(x)根据(ix)所述的式(i)或(ia)化合物,其中
[0145]
r1为其中r6为氰基;
[0146]
r2为甲基;
[0147]
r3为h;
[0148]
r4为h;
[0149]
r5为哌嗪基-5,7-二氢吡咯并[3,4-b]吡啶基;(哌嗪基苯基)甲基氨基或(哌嗪基嘧啶基)甲基氨基;
[0150]
或其药用盐、对映体或非对映体。
[0151]
本发明的另一实施例为(xi)作为以下项的式(i)或(ia)的特定化合物:
[0152]
5-[(3s,5r)-3-甲基-5-[(4-哌嗪-1-基苯基)甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0153]
5-[(3s,5r)-3-甲基-5-[[4-(4-哌啶基)苯基]甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0154]
8-[(3s,5r)-3-甲基-5-[(4-哌嗪-1-基苯基)甲基氨基]-1-哌啶基]喹喔啉-5-甲腈;
[0155]
5-[(3r,5s)-3-[(2-氟-4-哌嗪-1-基-苯基)甲基氨基]-5-甲基-1-哌啶基]喹啉-8-甲腈;
[0156]
5-[(3s,5r)-3-甲基-5-[(5-哌嗪-1-基-2-吡啶基)甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0157]
5-[(3s,5r)-3-甲基-5-[[3-(4-甲基哌嗪-1-基)苯基]甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0158]
5-[(3s,5r)-3-甲基-5-[[4-(4-甲基哌嗪-1-基)苯基]甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0159]
5-[(3s,5r)-3-甲基-5-[(3-哌嗪-1-基苯基)甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0160]
5-[(3s,5r)-3-甲基-5-[甲基-[(4-哌嗪-1-基苯基)甲基]氨基]-1-哌啶基]喹啉-8-甲腈;
[0161]
5-[(3s,5r)-3-甲基-5-[甲基-[(4-哌嗪-1-基苯基)甲基]氨基]-1-哌啶基]喹啉-8-甲腈;
[0162]
5-[(3s,5r)-3-甲基-5-(1,2,3,4-四氢异喹啉-6-基甲基氨基)-1-哌啶基]喹啉-8-甲腈;
[0163]
5-[(3s,5r)-3-甲基-5-(5-哌嗪-1-基异吲哚啉-2-基)-1-哌啶基]喹啉-8-甲腈;
[0164]
5-[(3r,5s)-3-[[4-(3-氨基吡咯烷-1-基)苯基]甲基氨基]-5-甲基-1-哌啶基]喹啉-8-甲腈;
[0165]
5-[(3r,5s)-3-[[4-(3-氨基-1-哌啶基)苯基]甲基氨基]-5-甲基-1-哌啶基]喹啉-8-甲腈;
[0166]
5-[(3r,5s)-3-[[4-(2,6-二甲基-4-吡啶基)苯基]甲基氨基]-5-甲基-1-哌啶基]喹啉-8-甲腈;
[0167]
5-[(3s,5r)-3-甲基-5-[[2-(4-甲基哌嗪-1-基)嘧啶-5-基]甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0168]
5-[(3s,5r)-3-甲基-5-[(2-哌嗪-1-基嘧啶-5-基)甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0169]
7-[(3s,5r)-3-甲基-5-[[5-(4-甲基哌嗪-1-基)-2-吡啶基]甲基氨基]-1-哌啶基]-1,3-苯并噻唑-4-甲腈;
[0170]
4-[(3s,5r)-3-甲基-5-[(4-哌嗪-1-基苯基)甲基氨基]-1-哌啶基]吡唑并[1,5-a]吡啶-7-甲腈;
[0171]
(3r,5s)-1-(8-氯-5-喹啉基)-5-甲基-n-[(4-哌嗪-1-基苯基)甲基]哌啶-3-胺;
[0172]
5-[(3s,5r)-3-甲基-5-(3-哌嗪-1-基-5,7-二氢吡咯并[3,4-b]吡啶-6-基)-1-哌啶基]喹啉-8-甲腈;
[0173]
5-[顺式-3-甲基-5-(6-哌嗪-1-基-3,4-二氢-1h-异喹啉-2-基)-1-哌啶基]喹啉-8-甲腈;
[0174]
5-[(3s,5r)-3-甲基-5-[(5-哌嗪-1-基嘧啶-2-基)甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0175]
5-[(3s,5r)-3-甲基-5-[1-(4-哌嗪-1-基苯基)乙基氨基]-1-哌啶基]喹啉-8-甲腈;
[0176]
5-[(3s,5r)-3-甲基-5-[[2-[(3r)-3-甲基哌嗪-1-基]嘧啶-5-基]甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0177]
5-[(3s,5r)-3-甲基-5-[[2-[(3s)-3-甲基哌嗪-1-基]嘧啶-5-基]甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0178]
5-[(3s,5r)-3-甲基-5-(5,6,7,8-四氢-1,6-萘啶-2-基甲基氨基)-1-哌啶基]喹啉-8-甲腈;和
[0179]
5-[(3s,5r)-3-甲基-5-[(5-哌嗪-1-基吡嗪-2-基)甲基氨基]-1-哌啶基]喹啉-8-甲腈;
[0180]
或其药用盐、对映体或非对映体。
[0181]
专利wo2015057655中公开了多种化合物,其显示了表1中汇总的tlr7和tlr9效力数据。从化学结构的角度来看,表1中的化合物的特征在于具有式(a)所示的结构。更具体地,哌啶环被在其尾部连接到芳基或杂芳基的线性碱性中心(氨基)取代。根据专利wo2015057655公开的效力数据,式(a)化合物仅表现出良好的tlr7效力,但遭受了tlr9效力的损失。
[0182]
同时,合成了wo2015057655中公开的化合物的更多类似物,诸如甚至更接近本发明化合物的化合物r1和化合物r2,以确认sar(结构-活性-关系)。然而,根据表2所示的效力数据,基于式(a)的结构修饰仍然不能提高tlr9的效力。因此,本领域技术人员不会从wo2015057655公开的信息中获得任何启发来进一步优化这种化学结构。
[0183][0184]
令人惊讶地,本发明的化合物显著改善了tlr9效能(与er-899552相比>10倍),同时保持了优异的tlr7和tlr8效能。在另一实施例中,与参考化合物r1和r2相比,本发明化合物的人微粒体稳定性得到极大改善(参见表3)。
[0185]
表1.wo2015057655中公开的化合物的tlr7和tlr9效能
[0186]
[0187][0188]
根据本发明中描述的方法合成参考化合物r1和r2。
[0189][0190]
合成
[0191]
本发明的化合物可以通过任何常规方法制备。在以下方案和示例中提供了合成这些化合物及其原料的合适方法。除非另有说明,否则所有取代基,特别是r1至r5如上所定义。此外,除非另有明确说明,否则所有反应、反应条件、缩写和符号均具有有机化学领域普通技术人员众所周知的含义。
[0192]
制备式(i)、(ia)、(viii)、(xi)、(xii)、(xiv)或(xx)化合物的一般合成路线如下所示。
[0193]
方案1
[0194][0195]
其中x为卤素;r7为杂环基;r8为c
1-6
烷基或羟基c
1-6
烷基;r9和r
10
与它们所连接的碳
原子一起形成杂环基;r
11
为芳基或杂芳基。
[0196]
本发明的化合物的合成从卤化物ii开始。卤化物ii与式iii化合物之间发生的buchwald-hartwig胺化反应提供式iv化合物,反应在催化剂诸如ruphos pd-g2和碱诸如cs2co3存在下进行(参考:acc.chem.res.1998,31,805-818;chem.rev.2016,116,12564-12649;topics in current chemistry,2002,219,131-209;这些文献以引用方式并入本文)。式iv化合物在酸性条件(诸如hcl在etoac中和tfa在dcm中)下的脱保护反应给出化合物v,其可以转化为式viii化合物,该转化通过与式vi化合物在碱(诸如dipea和k2co3)存在下的亲核取代反应或通过与式vii化合物的还原胺化反应和随后的适当脱保护反应进行。替代性地,式v化合物可以与醛ix反应以给出式x化合物。式x化合物与胺之间的buchwald-hartwig胺化反应提供可能具有合适的保护基团例如boc的式xi化合物,该保护基团可以在酸性条件下去除以得到最终化合物。钯催化的式x化合物与硼酸r
11-b(oh)2之间的铃木-宫浦(suzuki-miyaura)反应提供式xii化合物。
[0197]
方案2
[0198][0199]
其中环a为杂环基;r9和r
10
如上文所定义。
[0200]
式v化合物可以与二溴化物化合物在碱(诸如dipea和k2co3)存在下反应以给出式xiii化合物。xiii与胺之间的buchwald-hartwig胺化反应提供可能具有合适的保护基团例如boc的式xiv化合物,该保护基团可以在酸性条件下去除以得到最终化合物。
[0201]
方案3
[0202][0203]
其中pg为保护基团,诸如bn和cbz;m为1或2;n为1或2;环a、r
11
和r
12
如上文所定义。
[0204]
式xv化合物与xvi之间的还原胺化反应提供式xvii化合物,该化合物随后与r
11r12
nh在buchwald-hartwig胺化条件下偶联以给出式xviii化合物。随后,式xviii化合物
在h2存在下的脱保护提供式xix化合物。式xix化合物与上述卤化物ii之间的buchwald-hartwig胺化反应提供可能具有合适的保护基团例如boc的式xx化合物,该保护基团可以在酸性条件下去除以得到最终化合物。
[0205]
本发明还涉及制备式(i)或(ia)的化合物的方法,所述方法包括以下任何步骤:
[0206]
a)式(v)化合物,
[0207][0208]
与化合物(vi)在碱存在下的亲核取代反应;
[0209]
b)式(v)化合物,
[0210][0211]
与化合物(vii)的还原胺化反应;
[0212]
c)式(x)化合物,
[0213][0214]
与胺的buchwald-hartwig胺化反应;
[0215]
d)式(x)化合物,
[0216][0217]
与硼酸的铃木-宫浦反应;
[0218]
e)式(xiii)化合物,
[0219][0220]
与胺的buchwald-hartwig胺化反应;
[0221]
f)式(xix)化合物,
[0222][0223]
与卤化物(ii)的buchwald-hartwig胺化反应;
[0224]
在步骤a)中,碱可以为例如k2co3或dipea。
[0225]
根据上述方法生产的式(i)或(ia)的化合物也是本发明的目的。
[0226]
本发明的化合物可以以非对映体或对映体的混合物形式获得,它们可以通过本领域熟知的方法分离,例如,(手性)hplc或sfc。
[0227]
适应症和治疗方法
[0228]
本发明提供了可以用作tlr7和/或tlr8和/或tlr9拮抗剂的化合物,其抑制通过tlr7和/或tlr8和/或tlr9通路的活化以及相应的下游生物学事件,包括但不限于通过产生所有类型的细胞因子和各种形式的自身抗体介导的先天性和适应性免疫应答。因此,本发明的化合物可用于在表达此类受体的所有类型的细胞中阻断tlr7和/或tlr8和/或tlr9,所述细胞包括但不限于浆细胞样树突细胞、b细胞、t细胞、巨噬细胞、单核细胞、中性粒细胞、角质形成细胞、上皮细胞。如此,该化合物可用作全身性红斑狼疮和狼疮肾炎的治疗剂或预防剂。
[0229]
本发明提供了治疗或预防有需要的患者的全身性红斑狼疮和狼疮肾炎的方法。
[0230]
另一实施例包括治疗或预防需要这种治疗的哺乳动物中全身性红斑狼疮和狼疮肾炎的方法,其中所述方法包括向所述哺乳动物施用治疗有效量的式(i)的化合物、其立体异构体、互变异构体、前药或药用盐。
[0231]
实例
[0232]
通过参考以下实施例将更全面地理解本发明。但是,它们不应被解释为限制本发明的范围。
[0233]
缩写
[0234]
通过参考以下实施例将更全面地理解本发明。但是,它们不应被解释为限制本发明的范围。
[0235]
本文使用的缩写如下:
[0236]
dce:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯乙烷
[0237]
dipea或diea:
ꢀꢀꢀꢀ
n,n-二异丙基乙胺
[0238]
dibal-h:
ꢀꢀꢀꢀꢀꢀꢀꢀ
氢化二异丁基铝
[0239]
dma:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二甲基乙酰胺
[0240]
dmap:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-二甲基氨基吡啶
[0241]
dmf:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二甲基甲酰胺
[0242]
dppp:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,3-双(二苯基膦基)丙烷
[0243]
ea或etoac:
ꢀꢀꢀꢀꢀꢀ
乙酸乙酯
[0244]
fa:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲酸
[0245]
hatu:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化六氟磷酸盐
[0246]
ic
50
:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
半抑制浓度
[0247]
ipa:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异丙醇
[0248]
lcms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液相色谱-质谱
[0249]
ms:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
质谱
[0250]
nbs:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n-溴琥珀酰胺
[0251]
pe:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
石油醚
[0252]
prep-hplc:
ꢀꢀꢀꢀꢀꢀ
制备型高效液相色谱
[0253]
rt:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
室温
[0254]
rt:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
保留时间
[0255]
ruphos pd g2:
ꢀꢀꢀ
氯(2-二环己基膦基-2',6'-二异丙氧基-1,1'-联苯)[2-(2'-氨基-1,1'-联苯)]钯(ii)第2代
[0256]
sfc:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
超临界流体色谱
[0257]
tfa:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三氟乙酸
[0258]
tlc:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
薄层色谱法
[0259]
v/v
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
体积比
[0260]
lysa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
冻干溶解度测定
[0261]
hlm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
人肝微粒体
[0262]
一般实验条件
[0263]
使用以下仪器之一通过快速色谱法纯化中间体和最终化合物:i)biotage sp1系统和quad 12/25 cartridge模块。ii)isco combi-flash色谱仪。硅胶品牌和孔径:i)kp-sil粒径:40-60μm;ii)cas登录号:硅胶:63231-67-4,粒径:47-60微米硅胶;iii)青岛海洋化学有限公司的zcx,孔:200-300或300-400。
[0264]
中间体和最终化合物在反相色谱柱上通过制备型hplc纯化,反相色谱柱使用xbridge
tm prep-c18(5μm,obdtm 30
×
100mm)色谱柱,sunfire
tm prep-c18(5μm,obd
tm 30
×
100mm)色谱柱,phenomenex synergi-c18(10μm,25
×
150mm)或phenomenex gemini-c18(10μm,25
×
150mm)。waters autop纯化系统(样品管理器2767,泵2525,检测器:micromass zq和uv 2487,溶剂系统:乙腈和0.1%氢氧化铵在水中的溶液;乙腈和0.1%fa在水中的溶液,或乙腈和0.1%tfa在水中的溶液)。或gilson-281纯化系统(泵322,检测器:uv 156,溶剂系统:乙腈和0.05%氢氧化铵在水中的溶液;乙腈和0.225%fa在水中的溶液;乙腈和0.05%hcl在水中的溶液;乙腈和0.075%tfa在水中的溶液;或乙腈和水)。
[0265]
为了进行sfc手性分离,中间体分离通过手性柱(daicel chiralpak ic,5μm,30
×
250mm)、as(10μm,30
×
250mm)或ad(10μm,30
×
250mm),使用mettler toledo multigram iii系统sfc、waters 80q制备型sfc或thar 80制备型sfc,溶剂系统:co2和ipa(0.5%tea的ipa溶液)或co2和meoh(0.1%nh3·
h2o的meoh溶液),背压100bar,在254或220nm处检测uv。
[0266]
使用lc/ms(waters
tm alliance 2795-micromass zq、shimadzu alliance 2020-micromass zq或agilent alliance 6110-micromass zq)获得化合物的lc/ms光谱,lc/ms
条件如下(运行时间3或1.5分钟):
[0267]
酸性条件i:a:0.1%tfa在h2o中的溶液;b:0.1%tfa在乙腈中的溶液;
[0268]
酸性条件ii:a:0.0375%tfa在h2o中的溶液;b:0.01875%tfa在乙腈中的溶液;
[0269]
碱性条件i:a:0.1%nh3·
h2o在h2o中的溶液;b:乙腈;
[0270]
碱性条件ii:a:0.025%nh3·
h2o在h2o中的溶液;b:乙腈;
[0271]
中性条件:a:h2o;b:乙腈。
[0272]
质谱(ms):通常仅报告表示母体质量的离子,除非另有说明,否则所引用的质量离子为正质量离子(mh)
。
[0273]
使用bruker avance 400mhz获得nmr谱。
[0274]
微波辅助反应在biotage initiator sixty微波合成仪中进行。所有涉及对空气敏感的试剂的反应均在氩气或氮气气氛下进行。除非另有说明,否则试剂按原样购自商业供应商,未经进一步纯化。
[0275]
制备实例
[0276]
以下实例旨在说明本发明的含义,但绝不代表对本发明含义的限制:
[0277]
实例1
[0278]
5-[(3s,5r)-3-甲基-5-[(4-哌嗪-1-基苯基)甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0279][0280]
根据以下方案制备标题化合物:
[0281][0282]
步骤1:n-[(3r,5s)-1-(8-氰基-5-喹啉基)-5-甲基-3-哌啶基]氨基甲酸叔丁酯(化合物1b)的制备
[0283]
向5-溴喹啉-8-甲腈(化合物1a,400mg,1.72mmol)、n-[(3r,5s)-5-甲基-3-哌啶基]氨基甲酸叔丁酯(368mg,1.72mmol)(参考:wo2015/057655)、ruphos g2(133mg,172μmol)和cs2co3(839mg,2.57mmol)在二噁烷(20ml)中的混合物中充入n2,并加热至80℃,保持过夜。冷却后,将固体滤出并且用etoac(20ml)洗涤。将合并的滤液浓缩。残余物通过色谱法(用在pe中的etoac(10%-50%)洗脱)纯化,得到化合物1b,为淡黄色固体。250mg,lcms(m h)
:367.
[0284]
步骤2:5-[(3r,5s)-3-氨基-5-甲基-1-哌啶基]喹啉-8-甲腈盐酸盐(化合物1c)的制备
[0285]
将((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基甲酸叔丁酯(化合物1b,250mg,682μmol)在含1m hcl的etoac(15ml)中的混合物在23℃搅拌16小时,然后将混合物过滤以给出化合物1c,为橙色固体。200mg,lcms(m h)
:267.
[0286]
步骤3:4-[4-[[[(3r,5s)-1-(8-氰基-5-喹啉基)-5-甲基-3-哌啶基]氨基]甲基]苯基]哌嗪-1-甲酸叔丁酯(化合物1e)的制备
[0287]
将5-((3r,5s)-3-氨基-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物1c,50mg,188μmol)、4-(4-甲酰基苯基)哌嗪-1-甲酸叔丁酯(化合物1d,109mg,375μmol)、et3n(26.2μl,188μmol)、acoh(10.7μl,188μmol)和三乙酰氧基硼氢化钠(119mg,563μmol)在dcm(10ml)中的混合物在23℃搅拌2小时。滤除不溶解的物质,然后将滤液浓缩并且通过prep-hplc纯化以给出化合物1e,为淡黄色固体。15mg,lcms(m h)
:541.
[0288]
步骤4:5-[(3s,5r)-3-甲基-5-[(4-哌嗪-1-基苯基)甲基氨基]-1-哌啶基]喹啉-8-甲腈(实例1)的制备
[0289]
将4-(4-((((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)甲基)苯基)哌嗪-1-甲酸叔丁酯(化合物1e,15mg,25.9μmol)在dcm/tfa(2:1)(2ml)中的混合物在23℃搅拌1小时,然后浓缩混合物。将残余物溶于水中,然后冷冻干燥以给出实例1,为棕色固体(18mg)。lcms(m h)
:441,1h nmr(400mhz,甲醇-d4)δppm:9.05(dd,j=1.6,4.3hz,1h),8.65(dd,j=1.7,8.6hz,1h),8.22(d,j=8.1hz,1h),7.74(dd,j=4.4,8.6hz,1h),7.49(d,j=8.7hz,2h),7.37(d,j=8.1hz,1h),7.12(d,j=8.7hz,2h),4.38-4.22(m,2h),3.89(br,1h),3.82-3.71(m,1h),3.49(dd,j=3.7,6.4hz,5h),3.43-3.37(m,4h),2.94(t,j=11.0hz,1h),2.66-2.45(m,2h),2.24(br,1h),1.45-1.31(m,1h),1.11(d,j=6.6hz,3h)。
[0290]
实例2
[0291]
5-[(3s,5r)-3-甲基-5-[[4-(4-哌啶基)苯基]甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0292][0293]
根据以下方案制备标题化合物:
[0294]
[0295]
步骤1:4-(4-甲酰基苯基)哌啶-1-甲酸叔丁酯(化合物2b)的制备
[0296]
在-78℃,向4-(4-溴苯基)哌啶-1-甲酸叔丁酯(化合物2a,340mg,1mmol)在干燥thf(20ml)中的溶液中缓慢加入正丁基锂(4.16ml,5mmol)。10分钟后,加入dmf(1ml)并将混合物在室温搅拌30分钟。将反应混合物倒入20ml h2o中,然后用etoac萃取。有机层用水和盐水洗涤,然后浓缩以给出化合物2b(250mg),为淡黄色油状物,其不经进一步纯化即用于下一步。lcms(m h)
:290.
[0297]
步骤2:5-[(3s,5r)-3-甲基-5-[[4-(4-哌啶基)苯基]甲基氨基]-1-哌啶基]喹啉-8-甲腈(实例2)的制备
[0298]
类似于实例1,使用化合物2b代替化合物1d,制备标题化合物。获得实例2,其为浅棕色固体(14mg)。lcms(m h)
:440,1h nmr(400mhz,甲醇-d4)δppm:9.03(dd,j=1.7,4.2hz,1h),8.58(dd,j=1.6,8.6hz,1h),8.19(d,j=7.9hz,1h),7.70(dd,j=4.2,8.6hz,1h),7.53(d,j=8.3hz,2h),7.41(d,j=8.2hz,2h),7.34(d,j=8.1hz,1h),4.36(q,j=12.9hz,2h),3.86(br,1h),3.78(br,1h),3.60-3.46(m,3h),3.23-3.09(m,3h),3.05-2.85(m,2h),2.63-2.46(m,2h),2.24(br,1h),2.07(br,2h),1.99-1.84(m,2h),1.12(d,j=6.7hz,3h)
[0299]
实例3
[0300]
8-[(3s,5r)-3-甲基-5-[(4-哌嗪-1-基苯基)甲基氨基]-1-哌啶基]喹喔啉-5-甲腈
[0301][0302]
根据以下方案制备标题化合物:
[0303][0304]
实例3的制备:
[0305]
类似于实例1的制备方法,使用8-溴喹喔啉-5-甲腈(化合物3a)(参考:wo2017/106607)代替化合物物1a,制备标题化合物。获得实例3,为淡棕色固体(58mg)。lcms(m h)
:442,1h nmr(400mhz,甲醇-d4)δppm:9.07-8.87(m,2h),8.16(d,j=8.3hz,1h),7.49(d,j=8.7hz,2h),7.31(d,j=8.4hz,1h),7.12(d,j=8.8hz,2h),4.84(td,j=1.7,11.7hz,1h),4.39-4.22(m,2h),4.03(br,1h),3.74-3.63(m,1h),3.52-3.45(m,4h),3.43-3.35(m,4h),3.00(t,j=11.3hz,1h),2.74(t,j=11.8hz,1h),2.46(br d,j=11.9hz,1h),2.20-2.04(m,1h),1.37(q,j=11.8hz,1h),1.12(d,j=6.6hz,3h)。
[0306]
实例4
[0307]
5-[(3r,5s)-3-[(2-氟-4-哌嗪-1-基-苯基)甲基氨基]-5-甲基-1-哌啶基]喹啉-8-甲腈
[0308][0309]
根据以下方案制备标题化合物:
[0310][0311]
步骤1:5-((3r,5s)-3-((4-溴-2-氟苄基)氨基)-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物4a)的制备
[0312]
将5-((3r,5s)-3-氨基-5-甲基哌啶-1-基)喹啉-8-甲腈盐酸盐(化合物1c,60mg,198μmol)、4-溴-2-氟苯甲醛(40.2mg,198μmol)、et3n(55.2μl,396μmol)、醋酸(594μmol)和三乙酰氧基硼酸钠(126mg,594μmol)在dce(10ml)中的混合物在室温搅拌3小时,然后浓缩混合物,并且粗制残余物通过快速色谱法(用在己烷中的0%至50%etoac洗脱)纯化以给出化合物4a(50mg),为黄色固体。lcms(m h)
:554.
[0313]
步骤2:4-(4-((((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)甲基)-3-氟苯基)哌嗪-1-甲酸叔丁酯(化合物4b)的制备
[0314]
向5-((3r,5s)-3-((4-溴-2-氟苄基)氨基)-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物4a,50mg,110μmol)、哌嗪-1-甲酸叔丁酯(41mg,220μmol)、ruphos g2(8.57mg,11μmol)和cs2co3(108mg,331μmol)在二噁烷(5ml)中的混合物中充入n2,并将混合物在100℃加热16小时。冷却后,滤除固体,并且浓缩滤液。残余物通过制备型hplc纯化以给出化合物4b(30mg),为淡黄色固体。lcms(m h)
:559.
[0315]
步骤3:5-[(3r,5s)-3-[(2-氟-4-哌嗪-1-基-苯基)甲基氨基]-5-甲基-1-哌啶基]喹啉-8-甲腈(实例4)的制备
[0316]
将4-(4-((((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)甲基)-3-氟
苯基)哌嗪-1-甲酸叔丁酯(化合物4b,30mg,53.7μmol)在含1m hcl的etoac(10ml)中的混合物在室温搅拌16小时,然后真空去除溶剂。将残余物冻干以给出实例4(24mg),为橙色固体。lcms(m h)
:459.1h nmr(400mhz,甲醇-d4)δppm:9.12(dd,j=1.6,4.6hz,1h),8.88(dd,j=1.6,8.6hz,1h),8.32(d,j=8.2hz,1h),7.89(dd,j=4.7,8.6hz,1h),7.53(t,j=8.9hz,1h),7.46(d,j=8.2hz,1h),6.99-6.87(m,2h),4.47-4.27(m,2h),3.97(br,1h),3.90-3.78(m,1h),3.60-3.48(m,5h),3.40-3.37(m,4h),3.02(t,j=11.1hz,1h),2.65(t,j=11.7hz,1h),2.54(br,1h),2.34-2.18(m,1h),1.48-1.26(m,1h),1.12(d,j=6.6hz,3h)。
[0317]
实例5
[0318]
5-[(3s,5r)-3-甲基-5-[(5-哌嗪-1-基-2-吡啶基)甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0319][0320]
根据以下方案制备标题化合物:
[0321][0322]
类似于实例4的制备方法,使用5-溴-吡啶-2-甲醛代替4-溴-2-氟苯甲醛,制备标题化合物。获得实例5,其为浅棕色固体(14mg)。lcms(m h)
:442,1h nmr(400mhz,甲醇-d4)δppm:9.08(dd,j=1.6,4.5hz,1h),8.77(dd,j=1.6,8.6hz,1h),8.51(d,j=2.8hz,1h),8.27(d,j=8.1hz,1h),7.87-7.66(m,3h),7.42(d,j=8.1hz,1h),4.63-4.45(m,2h),3.98(br,1h),3.87(br,1h),3.70-3.60(m,4h),3.58-3.47(m,1h),3.45-3.38(m,4h),3.04(t,j=11.0hz,1h),2.63(t,j=11.7hz,1h),2.53(br,1h),2.27(br,1h),1.43(q,j=12.1hz,1h),1.12(d,j=6.7hz,3h)。
[0323]
实例6
[0324]
5-[(3s,5r)-3-甲基-5-[[3-(4-甲基哌嗪-1-基)苯基]甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0325][0326]
根据以下方案制备标题化合物:
[0327][0328]
将5-((3r,5s)-3-氨基-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物1c,50mg,188μmol)、3-(4-甲基哌嗪-1-基)苯甲醛(77mg,375μmol)、et3n(26.2μl,188μmol)、acoh(10.7μl,188μmol)和三乙酰氧基硼氢化钠(119mg,563μmol)在dcm(10ml)中的混合物在23℃搅拌2小时,然后过滤固体。将滤液浓缩并通过制备型hplc纯化,给出实例6(3.6mg),为淡黄色固体。lcms(m h)
:455,1h nmr(400mhz,甲醇-d4)δppm:8.86(dd,j=1.7,4.2hz,1h),8.31(dd,j=1.6,8.6hz,1h),8.00(d,j=8.1hz,1h),7.49(dd,j=4.3,8.6hz,1h),7.21-7.04(m,2h),6.90(s,1h),6.85-6.72(m,2h),3.72(s,2h),3.59(br d,j=9.0hz,1h),3.31(br d,j=10.1hz,1h),3.15-3.05(m,4h),2.97(br t,j=10.8hz,1h),2.56-2.47(m,4h),2.47-2.32(m,2h),2.24(s,3h),2.12(br d,j=12.8hz,1h),1.95(br s,1h),1.05-0.84(m,4h)。
[0329]
实例7
[0330]
5-[(3s,5r)-3-甲基-5-[[4-(4-甲基哌嗪-1-基)苯基]甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0331][0332]
类似于实例6的制备方法,使用4-(4-甲基哌嗪-1-基)苯甲醛代替3-(4-甲基哌嗪-1-基)苯甲醛,制备标题化合物。获得实例7,其为淡黄色固体(6mg)。lcms(m h)
:455,1h nmr(400mhz,甲醇-d4)δppm:8.85(dd,j=1.6,4.3hz,1h),8.31(dd,j=1.6,8.6hz,1h),7.99(d,j=8.1hz,1h),7.50(dd,j=4.2,8.6hz,1h),7.22-7.03(m,3h),6.85(d,j=8.7hz,2h),3.67(s,2h),3.61-3.48(m,1h),3.42-3.26(m,1h),3.13-3.00(m,4h),2.94(tt,j=4.0,10.9hz,1h),2.66-2.46(m,4h),2.40(dt,j=7.5,11.2hz,2h),2.25(s,3h),2.10(br d,j=12.6hz,1h),2.01-1.85(m,1h),1.09-0.78(m,4h)。
[0333]
实例8
[0334]
5-[(3s,5r)-3-甲基-5-[(3-哌嗪-1-基苯基)甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0335][0336]
类似于实例1的制备方法,使用4-(3-甲酰基苯基)哌嗪-1-甲酸叔丁酯代替化合物1d,制备标题化合物。获得实例8,其为淡黄色固体(53mg)。lcms(m h)
:441,1h nmr(400mhz,甲醇-d4)δppm:9.12(dd,j=1.5,4.7hz,1h),8.88(dd,j=1.5,8.6hz,1h),8.32(d,j=8.2hz,1h),7.89(dd,j=4.7,8.6hz,1h),7.52-7.35(m,3h),7.17-7.06(m,2h),4.43-4.27(m,2h),4.01(br d,j=9.8hz,1h),3.85(br t,j=11.4hz,1h),3.62-3.48(m,5h),3.45-3.38(m,4h),3.06(t,j=11.1hz,1h),2.66(t,j=11.7hz,1h),2.55(br d,j=11.9hz,1h),2.35-2.17(m,1h),1.44(q,j=12.0hz,1h),1.12(d,j=6.6hz,3h)。
[0337]
实例9
[0338]
5-[(3s,5r)-3-甲基-5-[甲基-[(4-哌嗪-1-基苯基)甲基]氨基]-1-哌啶基]喹啉-8-甲腈
[0339][0340]
根据以下方案制备标题化合物:
[0341]
[0342]
步骤1:4-[4-[[[(3r,5s)-1-(8-氰基-5-喹啉基)-5-甲基-3-哌啶基]-甲基-氨基]甲基]苯基]哌嗪-1-甲酸叔丁酯(化合物9a)的制备
[0343]
将5-((3r,5s)-3-氨基-5-甲基哌啶-1-基)喹啉-8-甲腈盐酸盐(化合物1c,50mg,165μmol)、4-(4-甲酰基苯基)哌嗪-1-甲酸叔丁酯(52.7mg,182μmol)、tea(23μl,165μmol)、acoh(9.45μl,165μmol)和三乙酰氧基硼氢化钠(105mg,495μmol,当量:3)在dcm(10ml)中的混合物在室温搅拌2小时,然后加入甲醛(4.96mg,165μmol,当量:1),并在室温搅拌2小时。过滤固体,将滤液浓缩并通过硅胶(在ea中的0%-70%pe,ea含有10%meoh)纯化,以给出化合物9a(40mg),为淡黄色固体。lcms(m h)
:555.
[0344]
步骤2:5-[(3s,5r)-3-甲基-5-[甲基-[(4-哌嗪-1-基苯基)甲基]氨基]-1-哌啶基]喹啉-8-甲腈(实例9)的制备
[0345]
将4-(4-((((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)(甲基)氨基)甲基)苯基)哌嗪-1-甲酸叔丁酯(化合物9a,40mg,72.1μmol)在含1m hcl的ea(10ml)中的混合物在室温搅拌16小时,然后过滤混合物以给出实例9(26mg),为淡黄色固体。lcms(m h)
:455,1h nmr(400mhz,甲醇-d4)δppm:9.08-8.98(m,1h),8.60(ddd,j=1.5,8.6,11.9hz,1h),8.20(dd,j=3.2,7.9hz,1h),7.71(ddd,j=4.2,8.6,10.9hz,1h),7.52(d,j=8.7hz,1h),7.48-7.33(m,2h),7.13(dd,j=8.7,17.9hz,2h),4.58(dd,j=5.4,13.1hz,1h),4.27(dd,j=4.6,13.1hz,1h),3.99-3.82(m,2h),3.58-3.44(m,5h),3.45-3.37(m,4h),3.22(br d,j=8.1hz,1h),2.84(d,j=6.5hz,3h),2.61(dt,j=6.7,11.7hz,1h),2.46(br s,1h),2.33-2.19(m,1h),1.71-1.52(m,1h),1.17
–
1.13(m,3h)。
[0346]
实例10
[0347]
5-[(3s,5r)-3-甲基-5-[甲基-[(4-哌嗪-1-基苯基)甲基]氨基]-1-哌啶基]喹啉-8-甲腈
[0348][0349]
类似于实例4的制备方法,使用5-溴-吡啶-2-甲醛代替4-溴-2-氟苯甲醛,制备标题化合物。获得实例10,其为浅棕色固体(28mg)。lcms(m h)
:442,1h nmr(400mhz,甲醇-d4)δppm:9.10(br s,1h),8.88(br s,1h),8.49-8.22(m,3h),7.87(br s,1h),7.60-7.39(m,2h),4.45(br s,2h),4.19-3.80(m,6h),3.64-3.42(m,5h),3.18-3.03(m,1h),2.78-2.50(m,2h),2.30(br s,1h),1.48(br s,1h),1.13(br s,3h)。
[0350]
实例11
[0351]
5-[(3s,5r)-3-甲基-5-(1,2,3,4-四氢异喹啉-6-基甲基氨基)-1-哌啶基]喹啉-8-甲腈
[0352][0353]
类似于实例2的制备方法,使用6-溴-3,4-二氢-1h-异吲哚啉-2-甲酸叔丁酯代替化合物2b,制备标题化合物。获得实例11,其为浅棕色固体(35mg)。lcms(m h)
:412,1h nmr(400mhz,甲醇-d4)δppm:8.98(dd,j=1.5,4.6hz,1h),8.73(dd,j=1.5,8.6hz,1h),8.18(d,j=8.1hz,1h),7.75(dd,j=4.6,8.6hz,1h),7.46-7.37(m,2h),7.33(d,j=8.1hz,1h),7.24(d,j=7.8hz,1h),4.36-4.19(m,4h),3.88(br d,j=9.8hz,1h),3.80-3.66(m,1h),3.43(t,j=6.4hz,3h),3.08(t,j=6.4hz,2h),2.93(t,j=11.1hz,1h),2.52(t,j=11.7hz,1h),2.44(br d,j=12.1hz,1h),2.23-2.08(m,1h),1.38-1.25(m,1h),1.01(d,j=6.6hz,3h)。
[0354]
实例12
[0355]
5-[(3s,5r)-3-甲基-5-(5-哌嗪-1-基异吲哚啉-2-基)-1-哌啶基]喹啉-8-甲腈
[0356][0357]
根据以下方案制备标题化合物:
[0358][0359]
步骤1:5-((3r,5s)-3-(5-溴异吲哚啉-2-基)-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物12a)的制备
[0360]
将5-((3r,5s)-3-氨基-5-甲基哌啶-1-基)喹啉-8-甲腈盐酸盐(化合物1c,50mg,165μmol)、4-溴-1,2-双(溴甲基)苯(170mg,495μmol)和dipea(64mg,86.5μl,495μmol)在dcm(10ml)中的混合物在40℃搅拌16小时,然后浓缩混合物,并且粗制残余物通过快速色谱法(用在己烷中的0%至60%etoac洗脱)纯化以给出化合物12a(50mg),为淡黄色固体。lcms(m h)
:448.
[0361]
步骤2:4-(2-((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)异吲哚啉-5-基)哌嗪-1-甲酸叔丁酯(化合物12b)的制备
[0362]
向5-((3r,5s)-3-(5-溴异吲哚啉-2-基)-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物12a,50mg,112μmol)、哌嗪-1-甲酸叔丁酯(41.6mg,224μmol)、ruphos g2(8.68mg,11.2μmol)和cs2co3(72.8mg,224μmol)在二噁烷(5ml)中的混合物中充入n2。将混合物在100℃加热16小时。冷却后,过滤不溶解的物质,并且用ea(10ml)洗涤。将合并的滤液浓缩并通过快速色谱法(用己烷中的10%至80%etoac洗脱)纯化,以给出化合物12b(30mg),为淡黄色固体。lcms(m h)
:553.
[0363]
步骤3:5-[(3s,5r)-3-甲基-5-(5-哌嗪-1-基异吲哚啉-2-基)-1-哌啶基]喹啉-8-甲腈(实例12)的制备
[0364]
将4-(2-((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)异吲哚啉-5-基)哌
嗪-1-甲酸叔丁酯(化合物12b,30mg,54.3μmol)在含1m hcl的ea(10ml)中的混合物在室温搅拌16小时,然后浓缩反应混合物,并且将粗制残余物通过制备型hplc纯化以给出实例12(4mg),为淡黄色固体。lcms(m h)
:453,1h nmr(400mhz,甲醇-d4)δppm:8.88(dd,j=1.6,4.2hz,1h),8.50(dd,j=1.6,8.6hz,1h),8.05(d,j=8.1hz,1h),7.56(dd,j=4.2,8.6hz,1h),7.20(d,j=8.1hz,1h),7.04(d,j=8.1hz,1h),6.89-6.70(m,2h),3.91(br d,j=11.4hz,4h),3.71(br d,j=11.2hz,1h),3.45-3.31(m,1h),3.08-2.96(m,5h),2.94-2.85(m,4h),2.62(t,j=10.9hz,1h),2.43(t,j=11.4hz,1h),2.26(br d,j=12.5hz,1h),2.08(br s,1h),1.16-1.02(m,1h),0.97(d,j=6.7hz,3h)。
[0365]
实例13
[0366]
5-[(3r,5s)-3-[[4-(3-氨基吡咯烷-1-基)苯基]甲基氨基]-5-甲基-1-哌啶基]喹啉-8-甲腈
[0367][0368]
根据以下方案制备标题化合物:
[0369][0370]
类似于实例4的制备方法,使用5-溴-吡啶-2-甲醛代替4-溴-2-氟苯甲醛并且使用n-吡咯烷-3-基氨基甲酸叔丁酯代替哌嗪-1-甲酸叔丁酯,制备标题化合物。获得实例13,其为浅棕色固体(2mg)。lcms(m h)
:441,1h nmr(400mhz,甲醇-d4)δppm:8.98(dd,j=1.5,4.2hz,1h),8.46(d,j=8.2hz,1h),8.13(d,j=7.9hz,1h),7.65(dd,j=4.1,8.4hz,1h),7.24-7.19(m,3h),6.59(d,j=8.4hz,2h),3.85-3.67(m,4h),3.58-3.39(m,4h),3.21-3.10(m,2h),2.62-2.49(m,2h),2.41-2.19(m,2h),2.08(br s,1h),2.01-1.91(m,1h),1.14-0.99(m,4h)。
[0371]
实例14
[0372]
5-[(3r,5s)-3-[[4-(3-氨基-1-哌啶基)苯基]甲基氨基]-5-甲基-1-哌啶基]喹啉-8-甲腈
[0373][0374]
根据以下方案制备标题化合物:
[0375][0376]
类似于实例4的制备方法,使用5-溴-吡啶-2-甲醛代替4-溴-2-氟苯甲醛并且使用n-(3-哌啶基)氨基甲酸叔丁酯代替哌嗪-1-甲酸叔丁酯,制备标题化合物。获得实例14,其为浅棕色固体(2mg)。lcms(m h)
:455,1h nmr(400mhz,甲醇-d4)δppm 9.03(d,j=4.2hz,1h),8.43(d,j=8.6hz,1h),8.24-8.11(m,1h),7.75-7.60(m,1h),7.33-7.29(m,3h),7.08(br d,j=8.6hz,2h),3.83(br d,j=10.6hz,1h),3.62(br d,j=11.9hz,2h),3.54-3.42(m,4h),3.21-3.05(m,4h),2.68-2.38(m,2h),2.11-2.04(m,2h),1.97-1.92(m,2h),1.85-1.69(m,2h),1.12(d,j=6.5hz,3h)。
[0377]
实例15
[0378]
5-[(3r,5s)-3-[[4-(2,6-二甲基-4-吡啶基)苯基]甲基氨基]-5-甲基-1-哌啶基]喹啉-8-甲腈
[0379][0380]
根据以下方案制备标题化合物:
[0381][0382]
向5-((3r,5s)-3-((4-溴苄基)氨基)-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物13a,50mg,115μmol)、(2,6-二甲基吡啶-4-基)硼酸(34.7mg,230μmol)、na2co3(24.3mg,230μmol)和pdcl2(dppf)(9.38mg,11.5μmol)在二噁烷/水(5:1)(6ml)中的混合物中充入n2,并将混合物在100℃加热16小时。冷却后,将固体滤出并且用ea(10ml)洗涤。然后将合并的滤液浓缩,并且将残余物通过制备型hplc纯化以给出实例15(40mg),为淡黄色固体。lcms(m h)
:462,1h nmr(400mhz,甲醇-d4)δppm:9.03(dd,j=1.7,4.2hz,1h),8.60(dd,j=1.6,8.6hz,1h),8.20(d,j=8.1hz,1h),8.11-7.99(m,4h),7.78(d,j=8.3hz,2h),7.70(dd,j=4.3,8.6hz,1h),7.35(d,j=7.9hz,1h),4.49(q,j=13.0hz,2h),3.97-3.76(m,2h),3.58-3.45(m,1h),2.94(t,j=10.9hz,1h),2.81(s,6h),2.63-2.49(m,2h),2.28(br s,1h),1.37(q,j=11.9hz,1h),1.13(d,j=6.6hz,3h)。
[0383]
实例16
[0384]
5-[(3s,5r)-3-甲基-5-[[2-(4-甲基哌嗪-1-基)嘧啶-5-基]甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0385][0386]
根据以下方案制备标题化合物:
[0387][0388]
步骤1:5-((3r,5s)-3-(((2-氯嘧啶-5-基)甲基)氨基)-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物16a)的制备:
[0389]
将5-((3r,5s)-3-氨基-5-甲基哌啶-1-基)喹啉-8-甲腈盐酸盐(化合物1c,100mg,330μmol)、2-氯嘧啶-5-甲醛(47.1mg,330μmol)、dipea(57.7μl,330μmol)、acoh(18.9μl,330μmol)和三乙酰氧基硼氢化钠(210mg,991μmol)在dcm(15ml)中的混合物在室温搅拌2小时,然后将反应混合物用etoac稀释,用水和盐水洗涤。然后浓缩有机层,并且将残余物通过硅胶柱纯化以给出化合物16a(100mg),为淡黄色油状物。lcms(m h)
:393.
[0390]
步骤2:5-[(3s,5r)-3-甲基-5-[[2-(4-甲基哌嗪-1-基)嘧啶-5-基]甲基氨基]-1-哌啶基]喹啉-8-甲腈(实例16)的制备:
[0391]
将5-((3r,5s)-3-(((2-氯嘧啶-5-基)甲基)氨基)-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物16a,50mg,127μmol)、1-甲基哌嗪(127mg,1.27mmol)和dipea(22μl,1.27mmol)在dmf(5ml)中的混合物在100℃加热16小时。反应溶液通过制备型hplc纯化,以给出实例16(40mg),为淡黄色固体。lcms(m h)
:457,1h nmr(400mhz,甲醇-d4)δppm:9.03(dd,j=1.6,4.2hz,1h),8.68-8.52(m,3h),8.20(d,j=8.1hz,1h),7.70(dd,j=4.3,8.6hz,1h),7.36(d,j=8.1hz,1h),4.38-4.21(m,2h),3.90(br d,j=10.9hz,1h),3.85-3.69(m,2h),3.60(br s,1h),3.54-3.47(m,1h),3.37-3.33(m,4h)3.28-3.22(m,1h),2.98(s,3h),2.94-2.87(m,1h),2.65-2.46(m,3h),2.27(br s,1h),1.37-1.28(m,1h),1.12(d,j=6.6hz,3h)。
[0392]
实例17
[0393]
5-[(3s,5r)-3-甲基-5-[(2-哌嗪-1-基嘧啶-5-基)甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0394][0395]
根据以下方案制备标题化合物:
[0396][0397]
步骤1:4-(5-((((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)甲基)嘧啶-2-基)哌嗪-1-甲酸叔丁酯(化合物17a)的制备:
[0398]
将5-((3r,5s)-3-(((2-氯嘧啶-5-基)甲基)氨基)-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物16a,50mg,127μmol)、哌嗪-1-甲酸叔丁酯(237mg,1.27mmol)和dipea(222μl,1.27mmol)在dmf(5ml)中的混合物在100℃加热16小时。反应溶液通过制备型hplc纯化,以给出化合物17a(30mg),为淡黄色固体。lcms(m h)
:543.
[0399]
步骤2:5-[(3s,5r)-3-甲基-5-[(2-哌嗪-1-基嘧啶-5-基)甲基氨基]-1-哌啶基]喹啉-8-甲腈(实例17)的制备:
[0400]
将4-(5-((((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)甲基)嘧啶-2-基)哌嗪-1-甲酸叔丁酯(化合物17a,30mg,55.3μmol)在含1m hcl的ea(5ml)中的混合物在室温搅拌16小时,然后浓缩反应以给出实例17(20mg),为橙色固体。lcms(m h)
:443,1h nmr(400mhz,甲醇-d4)δppm:9.10(dd,j=1.5,4.5hz,1h),8.84(dd,j=1.5,8.6hz,1h),8.63(s,2h),8.30(d,j=8.1hz,1h),7.86(dd,j=4.6,8.6hz,1h),7.45(d,j=8.1hz,1h),4.42-4.23(m,2h),4.20-4.11(m,4h),3.99(br d,j=10.8hz,1h),3.85(br t,j=11.2hz,1h),3.59-3.48(m,1h),3.33
–
3.25(m,4h),3.01(t,j=11.1hz,1h),2.64(t,j=11.7hz,1h),2.55(br d,j=12.5hz,1h),2.26(br s,1h),1.40(q,j=12.0hz,1h),1.13(d,j=6.6hz,3h)。
[0401]
实例18
[0402]
7-[(3s,5r)-3-甲基-5-[[5-(4-甲基哌嗪-1-基)-2-吡啶基]甲基氨基]-1-哌啶基]-1,3-苯并噻唑-4-甲腈
[0403][0404]
根据以下方案制备标题化合物:
[0405][0406]
步骤1:(5-氟-2-碘-苯基)硫脲(化合物18b)的制备
[0407]
在10-20℃,向5-氟-2-碘-苯胺(化合物18a,20.0g,84.38mmol)在thf(375ml)中的溶液中加入苯甲酰基异硫氰酸酯(27.5g,168.8mmol)。在20℃下,将该反应混合物搅拌16小时。去除溶剂并用etoh(80ml)洗涤固体。将中间体溶于甲醇(429ml)中,然后加入碳酸钾(35g,253mmol)在水(50ml)中的溶液。将反应在70℃加热4小时。去除溶剂,并且将残余物通过硅胶纯化以给出化合物18b(19g),为白色固体。
[0408]
步骤2:7-氟-4-碘-1,3-苯并噻唑-2-胺(化合物18c)的制备
[0409]
在10℃,向(5-氟-2-碘-苯基)硫脲(化合物18b,20g,67.54mmol)在氯仿(359ml)中的溶液中加入溴(3.47ml,67.54mmol)。将反应在80℃加热4小时。冷却至室温后,加入meoh(50ml),并且用na2s2o3水溶液和nahco3水溶液淬灭反应混合物。分离后,有机层用盐水(100ml)洗涤,并且经无水na2so4干燥。过滤后,去除溶剂,并且将残余物通过硅胶纯化以给出化合物18c(67g),为白色固体。lcms(m h)
:295.
[0410]
步骤3:7-氟-4-碘-1,3-苯并噻唑(化合物18d)的制备
[0411]
向7-氟-4-碘-1,3-苯并噻唑-2-胺(化合物18c,4g,13.6mmol)在1,4-二噁烷(84.26ml)中的溶液中加入亚硝酸叔丁酯(2.8g,27.2mmol)。将反应在80℃加热18小时。去除溶剂,并且将残余物通过硅胶纯化以给出化合物18d(35g),为黄色固体。lcms(m h)
:280.
[0412]
步骤4:7-氟-1,3-苯并噻唑-4-甲腈(化合物18e)的制备
[0413]
将氰化锌(1.5ml,23.65mmol)和肆(三苯基膦)钯(0)(660.0mg,0.570mmol)加入7-氟-4-碘-1,3-苯并噻唑(化合物18d,44g,15.77mmol)在dma(156ml)中的溶液中。将反应混合物在100℃加热18小时。将反应用ea(200ml)稀释,用水(100ml)和盐水(50ml)洗涤。将有机层浓缩,并且将残余物通过快速柱色谱法纯化以给出化合物18e(23g),为白色固体。lcms(m h)
:179.
[0414]
步骤5:n-[(3r,5s)-1-(4-氰基-1,3-苯并噻唑-7-基)-5-甲基-3-哌啶基]氨基甲酸叔丁酯(化合物18f)的制备
[0415]
将7-氟-1,3-苯并噻唑-4-甲腈(化合物18e,70.0mg,0.390mmol)、n-[(3r,5s)-5-甲基-3-哌啶基]氨基甲酸叔丁酯(101.0mg,0.470mmol)和dipea(0.21ml,1.18mmol)在dma(5ml)中的混合物在130℃搅拌16小时。加入水(50ml),用ea(50ml)萃取混合物,浓缩有机层,将残留物通过制备型tlc(ea:pe=1:2,rf:0.3)纯化以得到化合物18f(120mg),为黄色胶状物。lcms(m h)
:373.
[0416]
步骤6:7-[(3r,5s)-3-氨基-5-甲基-1-哌啶基]-1,3-苯并噻唑-4-甲腈(化合物18h)的制备
[0417]
在冰浴中,向n-[(3r,5s)-1-(4-氰基-1,3-苯并噻唑-7-基)-5-甲基-3-哌啶基]氨基甲酸叔丁酯(化合物18f,120.0mg,0.320mmol)在dcm(5ml)中的溶液中加入三氟乙酸(1.85ml,24mmol)。将混合物在25℃搅拌1小时,将其真空浓缩。向残余物中加入冰水(20ml),并且将混合物用饱和na2co3(20ml)中和,用dcm(50ml)萃取。将有机层干燥并浓缩以得到化合物18h(80mg),为黄色胶状物。lcms(m h)
:273.
[0418]
步骤7:5-(4-甲基哌嗪-1-基)吡啶-2-甲醛(化合物18k)的制备
[0419]
向5-氟-2-甲酰基吡啶(化合物18j,160.0mg,1.28mmol)在dma(5ml)中的溶液中加入1-甲基哌嗪(192.15mg,1.92mmol)和k2co3(530.3mg,3.84mmol)。在120℃下,将该混合物搅拌12小时。加入水(50ml)后,然后用etoac(50ml)萃取混合物。将有机层真空浓缩,并且将残余物通过快速柱色谱法纯化以得到化合物18k(200mg),为白色固体。lcms(m h)
:206.
[0420]
步骤8:7-[(3s,5r)-3-甲基-5-[[5-(4-甲基哌嗪-1-基)-2-吡啶基]甲基氨基]-1-哌啶基]-1,3-苯并噻唑-4-甲腈(实例18)的制备
[0421]
向7-[(3r,5s)-3-氨基-5-甲基-1-哌啶基]-1,3-苯并噻唑-4-甲腈(化合物18h,
30.0mg,0.110mmol)在甲醇(2ml)中的溶液中加入5-(4-甲基哌嗪-1-基)吡啶-2-甲醛(化合物18k,45.22mg,0.220mmol)和醋酸(0.66mg,0.010mmol)。将混合物在25℃搅拌15小时,加入硼氢化钠(20.84mg,0.550mmol)。在25℃搅拌0.5小时后,向反应混合物中加入水(50ml),然后用dcm(50ml)萃取。将有机层浓缩,并且将残余物通过制备型hplc纯化以得到实例18(18mg),为无色胶状物。lcms(m h)
:462,1h nmr(400mhz,甲醇-d4)δppm:9.40(s,1h),8.36(d,j=2.8hz,1h),7.88(d,j=8.0hz,1h),7.48-7.43(m,1h),7.43-7.37(m,1h),7.15(d,j=8.3hz,1h),4.31(d,j=2.0hz,2h),4.18-4.08(m,1h),3.79(br d,j=9.0hz,1h),3.47-3.37(m,5h),3.09-3.00(m,4h),2.93(t,j=11.4hz,1h),2.66(s,3h),2.62-2.53(m,1h),2.39(br d,j=12.5hz,1h),2.07-1.92(m,1h),1.31(q,j=12.0hz,1h),1.08(d,j=6.5hz,3h)。
[0422]
实例21
[0423]
4-[(3s,5r)-3-甲基-5-[(4-哌嗪-1-基苯基)甲基氨基]-1-哌啶基]吡唑并[1,5-a]吡啶-7-甲腈
[0424][0425]
类似于实例1的制备方法,使用4-氯吡唑并[1,5-a]吡啶-7-甲腈代替化合物1a,制备标题化合物。获得实例21,其为浅棕色固体(150mg)。lcms(m h)
:430,1h nmr(400mhz,甲醇-d4)δppm:8.07(d,j=2.3hz,1h),7.48(dd,j=8.3,16.8hz,3h),7.12(d,j=8.8hz,2h),6.83(d,j=2.4hz,1h),6.68(d,j=7.9hz,1h),4.40-4.19(m,2h),3.86(br d,j=8.8hz,1h),3.66-3.53(m,1h),3.50-3.45(m,4h),3.43-3.37(m,5h),2.89(t,j=11.5hz,1h),2.59(t,j=12.0hz,1h),2.48(br d,j=12.1hz,1h),2.09(br d,j=5.0hz,1h),1.43-1.29(m,1h),1.12(d,j=6.6hz,3h)。
[0426]
实例22
[0427]
(3r,5s)-1-(8-氯-5-喹啉基)-5-甲基-n-[(4-哌嗪-1-基苯基)甲基]哌啶-3-胺
[0428][0429]
类似于实例1的制备方法,使用5-溴-8-氯喹啉代替化合物1a,制备标题化合物。获得实例22,其为浅棕色固体(55mg)。lcms(m h)
:450,1h nmr(400mhz,甲醇-d4)δppm:9.00
(dd,j=1.7,4.3hz,1h),8.70(dd,j=1.7,8.5hz,1h),7.90(d,j=8.2hz,1h),7.72(dd,j=4.3,8.5hz,1h),7.46(d,j=8.8hz,2h),7.32(d,j=8.2hz,1h),7.12(d,j=8.8hz,2h),4.28(q,j=13.0hz,2h),3.79-3.66(m,2h),3.55-3.45(m,4h),3.43-3.37(m,5h),2.91-2.77(m,1h),2.58-2.43(m,2h),2.25-2.17(m,1h),1.43-1.29(m,1h),1.10(d,j=6.6hz,3h)。
[0430]
实例23
[0431]
5-[(3s,5r)-3-甲基-5-(3-哌嗪-1-基-5,7-二氢吡咯并[3,4-b]吡啶-6-基)-1-哌啶基]喹啉-8-甲腈
[0432][0433]
根据以下方案制备标题化合物:
[0434][0435]
步骤1:5-溴-2,3-双(溴甲基)吡啶(化合物23b)的制备:
[0436]
将5-溴-2,3-二甲基吡啶(化合物23a,1g,5.37mmol)、nbs(2.1g,11.8mmol)和过氧化苯甲酰(130mg,537μmol)在ccl4(50ml)中的混合物在80℃搅拌6小时,然后将反应混合物
浓缩,并且将粗制残余物通过快速色谱法(硅胶,40g,在己烷中的0%至10%etoac)纯化以给出化合物23b(1g),为淡橙色油状物。lcms(m h)
:342.
[0437]
步骤2:5-[(3s,5r)-3-甲基-5-(3-哌嗪-1-基-5,7-二氢吡咯并[3,4-b]吡啶-6-基)-1-哌啶基]喹啉-8-甲腈(实例23)的制备
[0438]
类似于实例12的制备方法,使用化合物23b代替4-溴-1,2-双(溴甲基)苯,制备标题化合物。获得实例23,其为橙色固体(22mg)。lcms(m h)
:454,1h nmr(400mhz,甲醇-d4)δppm:9.09(dd,j=1.5,4.5hz,1h),8.81(dd,j=1.7,8.6hz,1h),8.41(d,j=2.6hz,1h),8.30(d,j=8.1hz,1h),7.83(dd,j=4.6,8.6hz,1h),7.69(s,1h),7.49(d,j=8.1hz,1h),4.97(br s,,2h),4.87(br s,2h),4.17(br t,j=11.2hz,1h),4.03(br d,j=12.1hz,1h),3.67-3.50(m,5h),3.47-3.39(m,4h),3.25-3.11(m,1h),2.74-2.54(m,2h),2.33(br s,1h),1.53(q,j=12.1hz,1h),1.15(d,j=6.6hz,3h)。
[0439]
实例24
[0440]
5-[顺式-3-甲基-5-(6-哌嗪-1-基-3,4-二氢-1h-异喹啉-2-基)-1-哌啶基]喹啉-8-甲腈
[0441][0442]
根据以下方案制备标题化合物:
[0443][0444]
步骤1:2-(顺式-1-苄基-5-甲基哌啶-3-基)-6-溴-1,2,3,4-四氢异喹啉(化合物24b)的制备
[0445]
将1-苄基-5-甲基哌啶-3-酮(化合物24a,1g,4.92mmol)、6-溴-1,2,3,4-四氢异喹啉(1.04g,4.92mmol)和三乙酰氧基硼氢化钠(3.13g,14.8mmol)在dcm(15ml)中的混合物在室温搅拌2小时。将反应混合物用ea稀释,用水和盐水洗涤。将有机层浓缩,并且将残余物通过制备型hplc纯化以给出顺式异构体化合物24b(150mg)及其反式异构体24b’(500mg),为无色油状物。顺式异构体:lcms(m h)
:399,1h nmr(400mhz,甲醇-d4)δppm:7.39-7.23(m,7h),6.99(d,j=8.2hz,1h),3.84-3.70(m,2h),3.61(s,2h),3.19(br d,j=10.4hz,1h),2.84-2.74(m,3h),2.21(t,j=7.6hz,1h),2.10-2.02(m,2h),1.96(t,j=10.8hz,1h),1.76(br dd,j=4.5,11.2hz,1h),1.66-1.56(m,1h),1.26(t,j=7.1hz,1h),1.11-0.99(m,1h),0.98-0.88(m,3h)。
[0446][0447]
对于化合物24b,观察到c3'-h与c5'-h的noesy相关性。对于化合物24b,未观察到
c3'-h与c5'-h的noesy相关性。
[0448]
步骤2:4-[2-(顺式-1-苄基-5-甲基-3-哌啶基)-3,4-二氢-1h-异喹啉-6-基]哌嗪-1-甲酸叔丁酯(化合物24c)的制备
[0449]
向2-(顺式-1-苄基-5-甲基哌啶-3-基)-6-溴-1,2,3,4-四氢异喹啉(化合物24b,150mg,376μmol)、哌嗪-1-甲酸叔丁酯(140mg,751μmol)、cs2co3(367mg,1.13mmol)和ruphos g2(29.2mg,37.6μmol)在二噁烷(5ml)中的混合物中充入n2。将反应混合物在100℃加热16小时。冷却后,过滤不溶解的物质,并且用ea(10ml)洗涤。将合并的滤液浓缩并通过快速色谱法(用己烷中的10%至80%etoac洗脱)纯化,以给出化合物24c(100mg),为无色油状物。lcms(m h)
:505.
[0450]
步骤3:4-[2-(顺式-5-甲基哌啶-3-基)-1,2,3,4-四氢异喹啉-6-基]哌嗪-1-甲酸叔丁酯(化合物24d)的制备
[0451]
将4-[2-(顺式-1-苄基-5-甲基-3-哌啶基)-3,4-二氢-1h-异喹啉-6-基]哌嗪-1-甲酸酯(化合物24c,100mg,198μmol)和pd-c(50mg)在meoh/etoac(1:2)(15ml)中的混合物在氢气球下在室温搅拌24小时。滤除不溶解的物质,并浓缩滤液以给出化合物24d(80mg),为无色油状物。lcms(m h)
:415.
[0452]
步骤4:4-[2-[顺式-1-(8-氰基-5-喹啉基)-5-甲基-3-哌啶基]-3,4-二氢-1h-异喹啉-6-基]哌嗪-1-甲酸叔丁酯(化合物24e)的制备
[0453]
向5-溴喹啉-8-甲腈(101mg,434μmol)、4-[2-(顺式-5-甲基哌啶-3-基)-1,2,3,4-四氢异喹啉-6-基]哌嗪-1-甲酸叔丁酯(化合物24d,90mg,217μmol)、ruphos g2(16.9mg,21.7μmol)和cs2co3(106mg,326μmol)在二噁烷(5ml)中的混合物中充入n2。将混合物在80℃加热过夜。冷却后,将固体滤出并且用ea(10ml)洗涤。将合并的滤液浓缩,并且将残余物通过制备型hplc纯化以给出化合物24e(22mg),为淡黄色固体。lcms(m h)
:567.
[0454]
步骤5:5-[顺式-3-甲基-5-(6-哌嗪-1-基-3,4-二氢-1h-异喹啉-2-基)-1-哌啶基]喹啉-8-甲腈(实例24)的制备
[0455]
将4-[2-[顺式-1-(8-氰基-5-喹啉基)-5-甲基-3-哌啶基]-3,4-二氢-1h-异喹啉-6-基]哌嗪-1-甲酸叔丁酯(化合物24e,20mg,35.3μmol)在含1m hcl的ea(5ml)中的混合物在室温搅拌16小时。然后将溶液浓缩以给出实例24(18mg),为橙色固体。lcms(m h)
:467.1h nmr(400mhz,甲醇-d4)δppm:9.10(d,j=4.6hz,1h),8.92-8.76(m,1h),8.30(dd,j=2.1,7.9hz,1h),7.85(ddd,j=4.7,8.8,13.8hz,1h),7.49(dd,j=1.7,8.2hz,1h),7.19(t,j=6.9hz,1h),7.02(dd,j=2.5,8.5hz,1h),6.95(br s,1h),4.56(br s,2h),4.12-3.87(m,3h),3.64-3.51(m,2h),3.51-3.35(m,9h),3.29-3.10(m,2h),2.71-2.60(m,1h),2.60-2.45(m,1h),2.31(br d,j=6.8hz,1h),1.69-1.48(m,1h),1.15(d,j=6.6hz,3h)。
[0456]
实例25
[0457]
5-[(3s,5r)-3-甲基-5-[(5-哌嗪-1-基嘧啶-2-基)甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0458][0459]
类似于实例4的制备方法,使用5-溴-嘧啶-2-甲醛代替4-溴-2-氟苯甲醛,制备标题化合物。获得实例25(14mg),为橙色固体。lcms(m h)
:443,1h nmr(400mhz,甲醇-d4)δppm:9.08(dd,j=1.5,4.4hz,1h),8.76(dd,j=1.5,8.6hz,1h),8.64(s,2h),8.27(d,j=7.9hz,1h),7.81(dd,j=4.5,8.6hz,1h),7.42(d,j=8.2hz,1h),4.65-4.47(m,2h),3.98(br d,j=10.9hz,1h),3.92-3.82(m,1h),3.67-3.59(m,4h),3.55-3.35(m,5h),3.05(t,j=11.1hz,1h),2.63(t,j=11.7hz,1h),2.52(br d,j=12.3hz,1h),2.27(br d,j=3.9hz,1h),1.42(q,j=12.0hz,1h),1.12(d,j=6.6hz,3h)。
[0460]
实例26
[0461]
5-[(3s,5r)-3-甲基-5-[1-(4-哌嗪-1-基苯基)乙基氨基]-1-哌啶基]喹啉-8-甲腈
[0462][0463]
根据以下方案制备标题化合物:
[0464][0465]
步骤1:4-(4-乙酰基苯基)哌嗪-1-甲酸叔丁酯(化合物26b)的制备
[0466]
向1-(4-溴苯基)乙烷-1-酮(化合物26a,400mg,2.01mmol)、哌嗪-1-甲酸叔丁酯(749mg,4.02mmol)、ruphos g2(156mg,201μmol)和cs2co3(1.31g,4.02mmol)在二噁烷(15ml)中的混合物中充入n2。将混合物在100℃加热16小时。冷却后,将固体滤出并且用ea(10ml)洗涤。将合并的滤液浓缩,并且将残余物通过硅胶纯化以给出化合物26b(400mg),为白色固体。lcms(m h)
:305.
[0467]
步骤2:4-(4-(1-(((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)乙基)苯基)哌嗪-1-甲酸叔丁酯(化合物26b)的制备
[0468]
将5-((3r,5s)-3-氨基-5-甲基哌啶-1-基)喹啉-8-甲腈(40mg,150μmol)、4-(4-乙酰基苯基)哌嗪-1-甲酸叔丁酯(化合物26b,68.6mg,225μmol)和异丙醇钛(iv)(220μl,751μmol)、分子筛(500mg)在甲苯(10ml)中的混合物在100℃搅拌16小时。将反应混合物浓缩后,将残余物溶解在dcm(10ml)中以形成溶液,加入三乙酰氧基硼氢化钠(159mg,751μmol),并在室温搅拌30分钟。滤除固体,并且浓缩滤液。将残余物通过hplc纯化以给出化合物26c(16mg),为淡黄色固体。lcms(m h)
:555.
[0469]
步骤3:5-[(3s,5r)-3-甲基-5-[1-(4-哌嗪-1-基苯基)乙基氨基]-1-哌啶基]喹啉-8-甲腈(实例26)的制备
[0470]
将4-(4-(1-(((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)乙基)苯基)哌嗪-1-甲酸叔丁酯(化合物26c,16mg,28.8μmol)在含hcl的ea(1m,5ml)中的混合物在室温搅拌16小时。将混合物浓缩以给出实例26(15mg),为橙色固体。lcms(m h)
:455,1h nmr(400mhz,甲醇-d4)δppm:9.06(ddd,j=1.6,4.4,13.3hz,1h),8.48(dd,j=1.5,8.6hz,1h),8.21(dd,j=2.0,8.0hz,1h),7.73(ddd,j=4.5,8.7,13.5hz,1h),7.50(d,j=8.8hz,1h),7.42(d,j=8.8hz,1h),7.36-7.26(m,1h),7.11(t,j=8.6hz,2h),4.64-4.54(m,1h),3.92(br d,j=8.9hz,0.5h),3.57-3.38(m,10.5h),3.00-2.81(m,1h),2.69-2.44(m,1.5h),
2.32(br d,j=13.0hz,0.5h),2.12(br s,1h),1.70(dd,j=6.8,13.1hz,3h),1.41-1.28(m,1h),1.07(t,j=6.6hz,3h)。
[0471]
实例28
[0472]
5-[(3s,5r)-3-甲基-5-[[2-[(3r)-3-甲基哌嗪-1-基]嘧啶-5-基]甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0473][0474]
类似于实例17的制备方法,使用(3r)-3-甲基哌嗪-1-甲酸叔丁酯代替哌嗪-1-甲酸叔丁酯,制备标题化合物。获得实例28,其为橙色固体(83mg)。lcms(m h)
:457,1h nmr(400mhz,甲醇-d4)δppm:9.13(dd,j=1.5,4.7hz,1h),8.93(dd,j=1.6,8.6hz,1h),8.65(s,2h),8.34(d,j=8.1hz,1h),7.92(dd,j=4.8,8.6hz,1h),7.49(d,j=8.2hz,1h),4.87(br s,1h),4.42-4.24(m,2h),4.03(br d,j=14.1hz,1h),3.91-3.82(m,1h),3.58-3.35(m,5h),3.25-3.12(m,2h),3.04(t,j=11.1hz,1h),2.67(t,j=11.7hz,1h),2.55(br d,j=12.3hz,1h),2.35-2.21(m,1h),1.49-1.27(m,4h),1.13(d,j=6.6hz,3h)。
[0475]
实例29
[0476]
5-[(3s,5r)-3-甲基-5-[[2-[(3s)-3-甲基哌嗪-1-基]嘧啶-5-基]甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0477][0478]
类似于实例17的制备方法,使用(3s)-3-甲基哌嗪-1-甲酸叔丁酯代替哌嗪-1-甲酸叔丁酯,制备标题化合物。获得实例29,其为橙色固体(63mg)。lcms(m h)
:457,1h nmr(400mhz,甲醇-d4)δppm:9.14(dd,j=1.5,4.8hz,1h),8.97(dd,j=1.5,8.6hz,1h),8.65(s,2h),8.35(d,j=8.2hz,1h),7.94(dd,j=4.8,8.6hz,1h),7.50(d,j=8.2hz,1h),4.87(br s,1h),4.43-4.25(m,2h),4.03(br d,j=9.9hz,1h),3.92-3.83(m,1h),3.58-3.35(m,4h),3.25-3.13(m,2h),3.05(t,j=11.1hz,1h),2.68(t,j=11.6hz,1h),2.56(br d,j=12.1hz,1h),2.28(br d,j=6.4hz,1h),1.45-1.35(m,4h),1.13(d,j=6.7hz,3h)。
[0479]
实例30
[0480]
5-[(3s,5r)-3-甲基-5-(5,6,7,8-四氢-1,6-萘啶-2-基甲基氨基)-1-哌啶基]喹啉-8-甲腈
[0481][0482]
根据以下方案制备标题化合物:
[0483][0484]
步骤1:7,8-二氢-5h-1,6-萘啶-2,6-二甲酸o6-叔丁酯o2-甲酯(化合物30b)的制备
[0485]
向圆底烧瓶中加入2-氯-7,8-二氢-5h-1,6-萘啶-6-甲酸叔丁酯(化合物30a,950.0mg,3.54mmol)、pd(aco)2(158.73mg,0.710mmol)、dppp(291.6mg,0.710mmol)、et3n(1788.54mg,17.68mmol)和甲醇(50ml)。将混合物在co(6080mmhg)下在100℃搅拌16小时。然后将混合物浓缩,并且将残余物通过硅胶柱色谱法(ea/pe=1/3 to 1/1)纯化以得到化合物30b(930mg),为淡黄色固体。lcms(m h)
:293.
[0486]
步骤2:2-(羟基甲基)-7,8-二氢-5h-1,6-萘啶-6-甲酸叔丁酯(化合物30c)的制备
[0487]
在n2下在-70℃,向7,8-二氢-5h-1,6-萘啶-2,6-二甲酸o6-叔丁酯o2-甲酯(化合物30b,930.0mg,3.18mmol)在thf(50ml)中的溶液中加入dibal-h(15.91ml,15.91mmol)。将混合物在-70℃搅拌0.5小时,然后缓慢升温至25℃。将混合物在25℃搅拌1小时,然后用饱和酒石酸钾钠水溶液(50ml)淬灭。将所得混合物在25℃搅拌1小时并分离。水相用dcm(30ml)萃取两次。将有机相合并,用盐水(50ml)洗涤,经na2so4干燥并浓缩。将残余物通过硅胶色谱法(dcm/meoh=20/1)纯化以提供化合物30c(320mg),为无色油状物。lc/ms(m h)
:265.
[0488]
步骤3:2-(溴甲基)-7,8-二氢-5h-1,6-萘啶-6-甲酸叔丁酯(化合物30d)的制备
[0489]
向圆底烧瓶中充入2-(羟基甲基)-7,8-二氢-5h-1,6-萘啶-6-甲酸叔丁酯(320.0mg,1.21mmol)、三苯基膦(960.0mg,3.66mmol)和dcm(40ml)。在n2下在0℃加入四溴化碳(1208mg,3.65mmol)。升温至25℃并在25℃搅拌16小时后,将混合物浓缩,并且将残余物通过硅胶柱色谱法(pe/ea=2/1)纯化,以得到化合物30d(260mg)。lc/ms(m h)
:327.
[0490]
步骤4:2-((((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)甲基)-7,8-二氢-5h-1,6-萘啶-6-甲酸叔丁酯(化合物30e)的制备。
[0491]
将5-((3r,5s)-3-氨基-5-甲基哌啶-1-基)喹啉-8-甲腈盐酸盐(化合物1c,50mg,165μmol)、2-(溴甲基)-7,8-二氢-5h-1,6-萘啶-6-甲酸叔丁酯(化合物30d,54mg,165μmol)和碳酸氢钠(41.6mg,495μmol)在dmf(5ml)中的混合物在60℃搅拌16小时。滤除固体,并且将滤液通过制备型hplc纯化以给出化合物30e(30mg),为淡黄色固体。lc/ms(m h)
:513.
[0492]
步骤5:5-[(3s,5r)-3-甲基-5-(5,6,7,8-四氢-1,6-萘啶-2-基甲基氨基)-1-哌啶基]喹啉-8-甲腈(实例30)的制备
[0493]
将2-((((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)甲基)-7,8-二氢-5h-1,6-萘啶-6-甲酸叔丁酯(化合物30e,20mg,39μmol)在含1m hcl的ea(10ml)中的混合物在室温搅拌16小时,然后浓缩反应以给出实例30(20mg),为橙色固体。lcms(m h)
:413,1h nmr(400mhz,dmso-d6)δppm 9.80(br s,2h),9.64(br s,2h),9.07(dd,j=1.5,4.2hz,1h),8.50(d,j=7.1hz,1h),8.29(d,j=7.9hz,1h),7.85-7.66(m,2h),7.49(d,j=7.9hz,1h),7.30(d,j=8.1hz,1h),4.50-4.28(m,4h),3.96(br d,j=12.5hz,1h),3.70(br s,1h),3.54-3.38(m,3h),3.22-3.10(m,2h),2.95(t,j=11.3hz,1h),2.45-2.32(m,1h),2.06(br s,1h),1.39(q,j=12.1hz,1h),1.00(d,j=6.6hz,3h)。
[0494]
实例31
[0495]
5-[(3s,5r)-3-甲基-5-[(5-哌嗪-1-基吡嗪-2-基)甲基氨基]-1-哌啶基]喹啉-8-甲腈
[0496]
[0497]
根据以下方案制备标题化合物:
[0498][0499]
步骤1:5-(4-(叔丁氧基羰基)哌嗪-1-基)吡嗪-2-甲酸(化合物31b)的制备
[0500]
将5-溴吡嗪-2-甲酸(化合物31a,1g,4.93mmol)、哌嗪-1-甲酸叔丁酯(1.84g,9.85mmol)和dipea(4.3ml,24.6mmol)在dmso(20ml)中的混合物在110℃搅拌2小时。冷却至室温后,白色固体沉淀并收集,以得到化合物31b(1.5g)。lcms(m h)
:309.
[0501]
步骤2:4-(5-(甲氧基(甲基)氨基甲酰基)吡嗪-2-基)哌嗪-1-甲酸叔丁酯(化合物31c)的制备
[0502]
将5-(4-(叔丁氧基羰基)哌嗪-1-基)吡嗪-2-甲酸(化合物31b,1g,3.24mmol)、n,o-二甲基羟胺盐酸盐(949mg,9.73mmol)、hatu(1.85g,4.86mmol)和dipea(2.83ml,16.2mmol)在dmf(20ml)中的混合物在室温搅拌2小时。将混合物用ea稀释,用水和盐水洗涤。将有机层干燥并浓缩,并且将粗制残余物通过快速色谱法(硅胶,在己烷中的0%至40%etoac)纯化以给出化合物31c(0.9g),为淡黄色固体。lcms(m h)
:352.
[0503]
步骤3:4-(5-甲酰基吡嗪-2-基)哌嗪-1-甲酸叔丁酯(化合物31d)的制备
[0504]
在-78℃,将dibal-h(1.71ml,1.71mmol)逐滴加入到4-(5-(甲氧基(甲基)氨基甲酰基)吡嗪-2-基)哌嗪-1-甲酸叔丁酯(化合物31c,300mg,854μmol)在thf(5ml)中的溶液中。将反应混合物在室温搅拌2小时后,用水淬灭反应,并且用ea萃取。将有机层干燥并且浓缩,以给出化合物31d(150mg),为淡黄色油状物。lcms(m h)
:293.
[0505]
步骤4:4-(5-((((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)甲基)
吡嗪-2-基)哌嗪-1-甲酸叔丁酯(化合物31e)的制备
[0506]
将5-((3r,5s)-3-氨基-5-甲基哌啶-1-基)喹啉-8-甲腈(化合物1c,100mg,375μmol)、4-(5-甲酰基吡嗪-2-基)哌嗪-1-甲酸叔丁酯(165mg,563μmol)、tea(52.3μl,375μmol)、acoh(21.5μl,375μmol)和三乙酰氧基硼氢化钠(239mg,1.13mmol)在dcm(15ml)中的混合物在室温搅拌2小时。将反应混合物倒入10ml饱和nahco3水溶液中,并且用etoac(20ml)萃取。将有机层浓缩,并且将粗制残余物通过制备型hplc纯化以给出化合物31e(80mg),为淡黄色固体。lcms(m h)
:543.
[0507]
步骤5:5-[(3s,5r)-3-甲基-5-[(5-哌嗪-1-基吡嗪-2-基)甲基氨基]-1-哌啶基]喹啉-8-甲腈(实例31)的制备
[0508]
将4-(5-((((3r,5s)-1-(8-氰基喹啉-5-基)-5-甲基哌啶-3-基)氨基)甲基)吡嗪-2-基)哌嗪-1-甲酸叔丁酯(化合物31e,80mg,147μmol)在含1m hcl的ea(10ml)中的混合物在室温搅拌16小时。将溶液浓缩以给出实例31(70mg),为橙色固体。lcms(m h)
:443,1h nmr(400mhz,dmso-d6)δppm:9.76(br d,j=4.8hz,2h),9.51(br s,2h),9.07(dd,j=1.6,4.2hz,1h),8.56-8.22(m,4h),7.71(dd,j=4.2,8.6hz,1h),7.29(d,j=8.2hz,1h),4.39-4.20(m,2h),3.97(br d,j=10.5hz,1h),3.93-3.84(m,4h),3.62(br s,1h),3.40(br d,j=9.4hz,1h),3.19(br s,4h),2.93(t,j=11.2hz,1h),2.56(s,1h),2.39(br d,j=12.0hz,1h),2.01(br d,j=13.7hz,1h),1.37(br d,j=12.0hz,1h),0.99(d,j=6.5hz,3h)。
[0509]
实例32
[0510]
为了确定本发明的化合物在hek293-blue-htlr-7/8/9细胞测定中的活性,进行以下测试。
[0511]
hek293-blue-htlr-7细胞测定:
[0512]
稳定的hek293-blue-htlr-7细胞系购自invivogen(cat.#:hkb-htlr7,san diego,california,usa)。这些细胞最初设计用于通过监测nf-κb活化来研究人tlr7刺激。将seap(分泌的胚胎碱性磷酸酶)报告基因置于与五个nf-κb和ap-1结合位点融合的ifn-β最小启动子的控制下。通过用tlr7配体刺激hek-blue htlr7细胞使nf-κb和ap-1活化以诱导seap。因此,在配体(诸如r848(resiquimod))的刺激下孵育20小时,报告基因表达被tlr7拮抗剂降低。使用quanti-blue
tm
试剂盒(cat.#:rep-qb1,invivogen,san diego,ca,usa)在640nm波长下测定细胞培养上清液seap报告基因的活性,在碱性磷酸酶存在的条件下该检测培养基变成紫色或蓝色。
[0513]
在含有4.5g/l葡萄糖、50u/ml青霉素、50mg/ml链霉素、100mg/ml normocin、2mm l-谷氨酰胺、10%(v/v)热灭活的胎牛血清的dulbecco's modified eagle培养基(dmem)的96孔板中以170μl的体积将hek293-blue-htlr7细胞以个细胞/ml的密度孵育,在上述dmem中,在最终dmso存在的条件下以1%的最终稀释度添加20μl供试化合物和10μl的20um r848,在37℃的co2培养箱中进行20小时的培养。然后将每个孔中的20μl上清液与180μl quanti-blue底物溶液在37℃下孵育2小时,并使用分光光度计在下读取吸光度。tlr7活化导致下游nf-κb活化的信号传导通路已被广泛接受,因此对类似的报告基因检测方法进行了修改以评估tlr7拮抗剂。
[0514]
hek293-blue-htlr-8细胞测定:
[0515]
稳定的hek293-blue-htlr-8细胞系购自invivogen(cat.#:hkb-htlr8,san diego,california,usa)。这些细胞最初设计用于通过监测nf-κb活化来研究人tlr8刺激。将seap(分泌的胚胎碱性磷酸酶)报告基因置于与五个nf-κb和ap-1结合位点融合的ifn-β最小启动子的控制下。通过用tlr8配体刺激hek-blue htlr8细胞使nf-κb和ap-1活化以诱导seap。因此,在配体(诸如r848)的刺激下孵育20小时,报告基因表达被tlr8拮抗剂降低。使用quanti-blue
tm
试剂盒(cat.#:rep-qb1,invivogen,san diego,ca,usa)在640nm波长下测定细胞培养上清液seap报告基因的活性,在碱性磷酸酶存在的条件下该检测培养基变成紫色或蓝色。
[0516]
在含有4.5g/l葡萄糖、50u/ml青霉素、50mg/ml链霉素、100mg/ml normocin、2mm l-谷氨酰胺、10%(v/v)热灭活的胎牛血清的dulbecco's modified eagle培养基(dmem)的96孔板中以170μl的体积将hek293-blue-htlr8细胞以个细胞/ml的密度孵育,在上述dmem中,在最终dmso存在的条件下以1%的最终稀释度添加20μl供试化合物和10μl的60um r848,在37℃的co2培养箱中进行20小时的培养。然后将每个孔中的20μl上清液与180μl quanti-blue底物溶液在37℃下孵育2小时,并使用分光光度计在下读取吸光度。tlr8活化导致下游nf-κb活化的信号传导通路已被广泛接受,因此对类似的报告基因检测方法进行了修改以评估tlr8拮抗剂。
[0517]
hek293-blue-htlr-9细胞测定:
[0518]
稳定的hek293-blue-htlr-9细胞系购自invivogen(cat.#:hkb-htlr9,san diego,california,usa)。这些细胞最初设计用于通过监测nf-κb活化来研究人tlr9刺激。将seap(分泌的胚胎碱性磷酸酶)报告基因置于与五个nf-κb和ap-1结合位点融合的ifn-β最小启动子的控制下。通过用tlr9配体刺激hek-blue htlr9细胞使nf-κb和ap-1活化以诱导seap。因此,在配体(诸如odn2006(cat.#:tlrl-2006-1,invivogen,san diego,california,usa))的刺激下孵育20小时,报告基因表达被tlr9拮抗剂降低。使用quanti-blue
tm
试剂盒(cat.#:rep-qb1,invivogen,san diego,california,usa)在640nm波长下测定细胞培养上清液seap报告基因的活性,在碱性磷酸酶存在的条件下该检测培养基变成紫色或蓝色。
[0519]
在含有4.5g/l葡萄糖、50u/ml青霉素、50mg/ml链霉素、100mg/ml normocin、2mm l-谷氨酰胺、10%(v/v)热灭活的胎牛血清的dulbecco's modified eagle培养基(dmem)的96孔板中以170μl的体积将hek293-blue-htlr9细胞以个细胞/ml的密度孵育,在上述dmem中,在最终dmso存在的条件下以1%的最终稀释度添加20μl供试化合物和10μl的20um odn2006,在37℃的co2培养箱中进行20小时的培养。然后将每个孔中的20μl上清液与180μl quanti-blue底物溶液在37℃下孵育2小时,并使用分光光度计在下读取吸光度。tlr9活化导致下游nf-κb活化的信号传导通路已被广泛接受,因此对类似的报告基因检测方法进行了修改以评估tlr9拮抗剂。
[0520]
式(i)化合物具有《1μm,尤其是《0.1μm的人类tlr7和/或tlr8抑制活性(ic
50
值)。此外,一些化合物还具有人tlr9抑制活性《1μm,特别是《0.2μm。表2显示了本发明化合物的活性数据。
[0521]
表2:本发明化合物在hek293-blue-htlr-7/8/9细胞测定中的活性
[0522]
[0523][0524]
*0.0032针对tlr7和tlr8的最低测试浓度
[0525]
实例33
[0526]
人微粒体稳定性测定
[0527]
人微粒体稳定性测定用于早期评估人肝微粒体中供试化合物的代谢稳定性。具有高代谢稳定性的化合物被认为是所希望的,因为它们可以提供有利的体内pk特征,并因此在所靶向的组织或器官中充分暴露
[0528]
将人肝微粒体(cat.no.:452117,corning,usa;cat.no.:h2610,xenotech,usa)在37℃下于100mm磷酸钾缓冲液(ph 7.4)中预孵育10分钟。通过添加nadph再生系统来引发反应。最终的孵育混合物在100mm磷酸钾缓冲液(ph 7.4)中含1μm供试化合物、0.5mg/ml肝微粒体蛋白、1mm mgcl2、1mm nadp、1单位/ml异柠檬酸脱氢酶和6mm异柠檬酸。在37℃下孵育0、3、6、9、15和30分钟后,将300μl冷乙腈(包括内标)添加到100μl孵育混合物中以终止反应。沉淀和离心后,通过lc-ms/ms测定样品中残留的化合物量。还制备并分析了零和30分钟无nadph再生系统的对照。通过上述测定确定,本发明的化合物显示出良好的人肝微粒体稳定性。
[0529]
表3.人肝微粒体对本发明化合物的稳定性
[0530]
[0531]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。