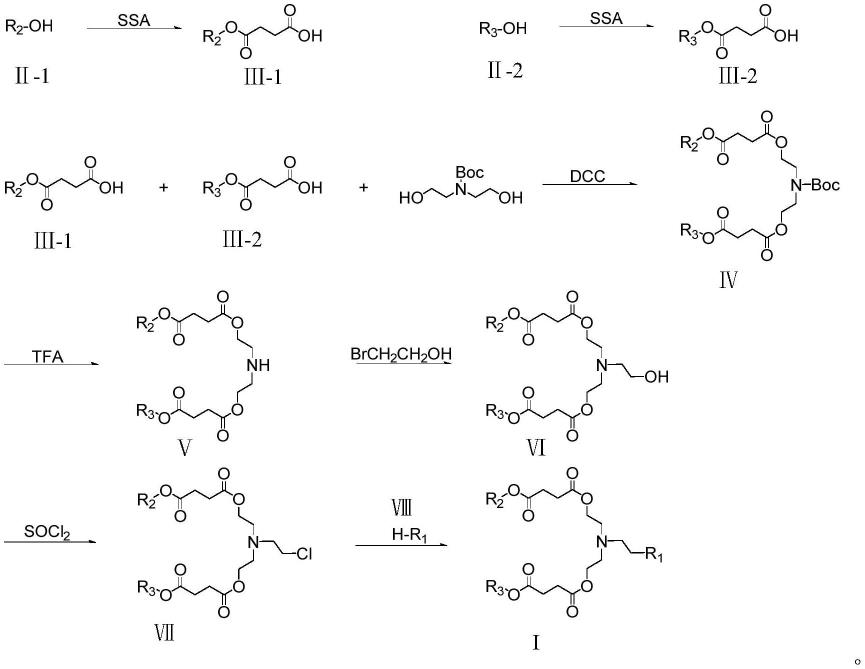
1.本发明属于生物技术领域,特别是涉及非病毒基因载体及制备方法,具体地说,涉及一种含有多个酯键的可电离脂质的合成及其在基因递送领域中的应用。
背景技术:
2.基因治疗是指通过修改或操纵基因表达或改变活细胞的生物学特性,从而实现治疗或治愈疾病目标的技术。主要作用机制涉及以下几种:用健康的基因拷贝替代致病基因,灭活导致功能不正常的致病基因,将新的或修饰的基因引入体内以帮助治疗疾病等。
3.脂质体发展的近30年来,从广泛使用的季铵盐头部、胍基头部到多胺头部阳离子脂质,已经形成了比较完善的脂质体载体系统,但这些载体系统仍然存在许多问题,如介导基因的转运效率还有待提高;对靶组织无定向识别性;阳离子脂质体/dna复合物进入细胞后,核酸被束缚于内涵体中,释放困难,不利于在细胞质或细胞核中表达,从而无法达到治疗目的。
技术实现要素:
4.为解决现有技术中的技术问题,本发明的目的在于提供一类细胞毒性小,在体外基因转染效率高的含有多个酯键型可电离叔胺脂质及其合成方法和应用。本发明通过头部的亲核取代反应,对头部进行修饰,以及将酸酐和不同醇进行反应合成多种疏水尾,通过多个酯键连接键相连,得到多种含有多个酯键的叔胺脂质,并将其和蔗糖酯复配得到脂质体纳米载体,克服了传统脂质体递送效率低的局限性,同时具有ph敏感的连接键,并且显示出高效率递送质粒dna、sirna和mrna的能力,为基因治疗癌症提供了广阔的应用前景。
5.本发明的采用的技术方案如下:
6.本发明的目的之一是提供一类含有多个酯键的可电离叔胺脂质,包括具有通式i的结构:
[0007][0008]
其中:
[0009]
r1选自羟基、二甲胺、二乙胺、二丙胺、二乙醇胺、3-甲胺基-1,2-丙二醇、n,n,n'-三甲基乙二胺、n'-[2-(二甲基氨基)乙基]-n,n-二甲基乙二胺、四氢吡咯、3-羟基吡咯烷、哌啶、4-羟基哌啶、吗啉、硫代吗啉,优选为羟基、二甲胺、四氢吡咯、哌啶、吗啉;
[0010]
r2选自c
1-32
的饱和或不饱和的烷基,优选为c
8-20
的饱和或含有一个双键的烷基,更优选c
10-20
的饱和或含有一个双键的烷基,例如壬烷基、癸烷基、十二烷基、十八烷基、9-烯基
十八烷基和辛基十二烷基,进一步优选为辛基十二烷基;
[0011]
r3选自c
1-32
的饱和或不饱和的烷基,优选为c
8-20
的饱和或含有一个双键的烷基,更优选c
10-20
的饱和或含有一个双键的烷基,例如壬烷基、癸烷基、十二烷基、十八烷基、9-烯基十八烷基和辛基十二烷基,进一步优选为辛基十二烷基;
[0012]
r2和r3可以相同,也可以不同。
[0013]
本发明的目的之二是提供一种上述可电离叔胺类脂的合成方法,所述合成方法步骤如下:
[0014]
1)将醇类化合物
ⅱ‑
1加入氯仿后,加入含丁二酸酐(ssa)的氯仿溶液,滴完后在40~60℃油浴中反应18~24小时,反应后,30~40℃旋蒸掉溶剂(氯仿),进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10~1:30),得到中间体
ⅲ‑
1;
[0015]
将醇类化合物
ⅱ‑
2加入氯仿后,再滴入含丁二酸酐的氯仿溶液,在40~60℃下反应18~24小时,反应后,30~40℃旋蒸掉溶剂(氯仿),进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10~1:30),得到中间体
ⅲ‑
2;
[0016]
醇类化合物
ⅱ‑
1和醇类化合物
ⅱ‑
2可以相同,也可以不同,醇类化合物
ⅱ‑
1、醇类化合物
ⅱ‑
2可以分别独立选自c
1-32
的饱和或不饱和的醇,优选为c
8-20
的饱和或含有一个双键的醇,更优选c
10-20
的饱和或含有一个双键的醇,例如壬醇、癸醇、十二醇、十八醇、油醇和辛基十二醇,进一步优选为辛基十二醇。
[0017]
其中,在中间体
ⅲ‑
1的制备过程中,醇类化合物
ⅱ‑
1与丁二酸酐的摩尔比为0.05~0.25:1~2;醇类化合物
ⅱ‑
1与氯仿的比例为0.05~0.25mol:50~200ml;含丁二酸酐的氯仿溶液中丁二酸酐与氯仿的比例为1~2mol:50~100ml;含丁二酸酐的氯仿溶液的滴加速率为每3~5秒一滴;
[0018]
在中间体
ⅲ‑
2的制备过程中,醇类化合物
ⅱ‑
2与丁二酸酐的摩尔比为0.05~0.25:1~2;醇类化合物
ⅱ‑
2与氯仿的比例为0.05~0.25mol:50~200ml;含丁二酸酐的氯仿溶液中丁二酸酐与氯仿的比例为1~2mol:50~100ml;含丁二酸酐的氯仿溶液的滴加速率为每3~5秒一滴。
[0019]
2)将步骤1)制备的中间体
ⅲ‑
1和中间体
ⅲ‑
2加入氯仿后,再滴入含二(2-羟乙基)氨基甲酸叔丁酯、二环己基碳二亚胺(dcc)的氯仿溶液,滴完后在25~50℃下反应24~48小时,反应后,30~40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10~1:30),得到中间体ⅳ;
[0020]
其中,步骤1)制备的中间体ⅲ、二(2-羟乙基)氨基甲酸叔丁酯与二环己基碳二亚胺的摩尔比为0.5~1:0.25~0.5:0.5~1;步骤1)制备的中间体ⅲ与氯仿的比例为0.5~1mol:50~100ml;
[0021]
含二(2-羟乙基)氨基甲酸叔丁酯和二环己基碳二亚胺的氯仿溶液中二环己基碳二亚胺与氯仿的比例为0.25~0.5mol:0.5~1mol:50~100ml;
[0022]
含二(2-羟乙基)氨基甲酸叔丁酯和二环己基碳二亚胺的氯仿溶液的滴加速率为3~5秒一滴。
[0023]
3)向三氟乙酸(tfa)中加入步骤2)制备的中间体ⅳ,在25~50℃下搅拌24~48小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1~5:1),得到中间体
ⅴ
。
[0024]
其中,步骤2)制备的中间体ⅳ与三氟乙酸的比例为0.5~1mol:20ml~50ml。
[0025]
4)向步骤3)制备的中间体
ⅴ
中加入碳酸钾、硫酸钠和甲苯,油浴加热到80~100℃,再加入2-溴乙醇,在80~100℃下反应20~24h;反应后在50~70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1~10:1),得到含有一个羟基头部的可电离叔胺脂质化合物ⅵ;
[0026]
其中,步骤3)制备的中间体
ⅴ
、碳酸钾、硫酸钠、2-溴乙醇的比例为0.5~1mol:0.5~1mol:1~2mol:5~10ml;
[0027]
步骤3)制备的中间体
ⅴ
与甲苯的比例为0.5~1mol:100~200ml。
[0028]
5)将步骤4)制备的含有一个羟基头部的可电离叔胺脂质溶于二氯亚砜(socl2)中,在80~100℃下反应20~24h;反应后在50~70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1~8:1),得到中间体ⅶ。
[0029]
其中,含有一个羟基头部的可电离叔胺脂质化合物ⅵ与二氯亚砜的比例为0.5~1mol:10~20ml。
[0030]
6)向步骤5)制备的中间体ⅶ加入碳酸钾、仲胺类衍生物、thf,在60~80℃下反应20~24h;反应后在30~40℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,30~40℃烘干,得到除了含有一个羟基头部之外的其他目标产物。
[0031]
其中,步骤5)制备的中间体ⅶ、碳酸钾、仲胺类衍生物的比例为0.5~1mol:1~2mol:20~50ml;步骤5)制备的中间体ⅶ与thf的比例为0.5~1mol:50~200ml。
[0032]
7)将步骤6)得到的产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10~1:30)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物。
[0033]
反应式如下:
[0034][0035]
本发明的目的之三是提供上述可电离叔胺脂质制备的可电离叔胺脂质体,利用叔胺脂质的两亲性结构,可以自组装形成脂质体载体;该可电离叔胺脂质和蔗糖酯复配形成的粒径大小为90~100nm左右的均一稳定的表面带有正电荷的脂质体。
[0036]
本发明的目的之四是提供上述可电离叔胺脂质体的制备方法,包括如下步骤:
[0037]
(1)将叔胺可电离脂质与助剂蔗糖酯(hlb1~16)按照质量比1:1~10:1比例溶解于氯仿中形成溶液;
[0038]
其中,叔胺可电离脂质与氯仿的比例为1~10mg:1~5ml;
[0039]
(2)将步骤(1)得到的溶液在氮气下吹成均匀薄膜,真空干燥18h~24h;
[0040]
其中,真空干燥的条件为:真空度-0.10~-0.06mpa,温度20~25℃。
[0041]
(3)在10~80℃下,用磷酸缓冲液(ph 5.5~7.4)水化1~6h(优选为60~80℃下水化1~2h),30~40℃超声震荡至透明(优选为超声频率为90~100hz下超声),得到叔胺脂质体,所述叔胺脂质体的浓度为1~10mg/ml。
[0042]
本发明的目的之五是提供一种可电离叔胺脂质体/基因复合物,所述可电离叔胺脂质体/基因复合物是由所述可电离叔胺脂质体与质粒dna、sirna或mrna通过静电相互作用形成分散在水相中均一稳定的纳米颗粒。其中可电离叔胺脂质体与质粒dna、sirna和mrna的质量比为1:1~8:1。
[0043]
本发明的目的之六是提供上述可电离叔胺脂质体/基因复合物的制备方法,所述制备方法步骤如下:
[0044]
(1)取所述可电离叔胺脂质体分散在细胞培养液(dmem或rpmi1640)中,混匀,使可电离叔胺脂质体的浓度为1.0~2.0μg/μl;
[0045]
(2)将质粒dna、sirna或mrna稀释在细胞培养液(dmem或rpmi1640)中,混匀,使质
粒dna的浓度为0.5~1.0μg/μl(优选为0.8~1.0μg/μl),sirna或mrna的浓度为0.2~0.3μg/μl;
[0046]
(3)按照脂质体与基因质量比1:1~8:1比例,将步骤(1)和步骤(2)两稀释液混匀,室温放置10~40min,即可得到电离叔胺脂质体/基因复合物。
[0047]
本发明的目的之七提供上述可电离叔胺脂质体/基因复合物在治疗肿瘤中的应用,该复合物在细胞转染中递送rna和dna的效率与商品化基因转染试剂lipo3000相当,所述肿瘤细胞包括肺癌细胞(如非小细胞肺癌细胞),但不限于上述细胞。可电离叔胺脂质体/基因复合物可在基因治疗中的应用,主要包括如下:
[0048]
(1)所述电离叔胺脂质体/基因复合物可进入癌细胞中,完成目的基因在细胞内的转染。
[0049]
(2)所述细胞为肺癌细胞(a549)。不同氮磷比下获得的所述叔胺脂质体/基因复合物在a549细胞内的转染效率会有所差异。
[0050]
(3)本发明提供的可电离叔胺脂质体/基因复合物适用于包括编码荧光素酶、绿色荧光蛋白等报告基因在内的质粒dna,也适用于其他各种实验所需的sirna和mrna。该载体能高效运载质粒dna、sirna和mrna转染细胞。
[0051]
本发明的作用机理大致如下:本发明提供的一类可电离叔胺脂质,同时具有疏水和亲水特性,其疏水部分来源于双长碳链,亲水部分取自于具有良好生物相容性的叔胺头部,由于叔胺可与带负电的核酸结合,能有效压缩核酸,同时对细胞具有良好的亲和性,从而可提高载体的转染效率。
[0052]
本发明可电离叔胺类脂表现出优良的生物相容性,具有良好的递送效果,可在细胞液中不被降解,当进入细胞后在酸性和水解酶的存在下释放将基因释放,治疗协同增效的作用,还解决了基因治疗中的载体递送效率低的问题,在基因治疗中具有广阔的应用前景。
[0053]
本发明与现有技术相比具有如下优点:
[0054]
1、本发明通过修饰亲水头部的种类和疏水尾链的长度与不饱和度,制备多种可电离叔胺脂质,并将其与蔗糖酯复合制备多种叔胺脂质体。由于叔胺脂质体富含阳离子,具有压缩基因的能力,可以分别与质粒dna、sirna和mrna复合,能够形成纳米级的阳离子脂质体/基因复合物。可电离叔胺脂质体/基因复合物为酸敏感型,在酸性条件下能够促进基因的释放,提高递送效率。
[0055]
2、本发明可电离叔胺脂质的亲水头部,具有良好的缓冲能力,能够有效降低阳离子头部带来的毒性;疏水尾链能够促进脂质体产生锥形结构,增强脂质体的逃逸能力,并提高基因递送效率;含有多个酯键,生物降解性好,细胞中含有能够降解酯键的酶,使基于酯键连接的阳离子脂质能够从酯键断开,形成多个低毒性的小分子酸、醇和胺,从而近一步降低叔胺脂质的细胞毒性,并提高基因递送效率。
[0056]
3、本发明可电离叔胺脂质含有带支链结构或不带支链结构的疏水尾链,相比不带支链结构的疏水尾链,带支链结构的疏水尾链能够增加尾部横截面,产生更多的锥形结构,使内涵体逃逸的能力更强,基因递送效率更高;可电离叔胺脂质含有饱和碳链或不饱和碳链作为疏水尾链,在疏水尾链相同碳原子的条件下,相比饱和碳链的疏水尾链,带有不饱和碳链的疏水尾链由于具有更强的质子化能力和稳定性,使脂质体能够压缩更多的基因物
质。
[0057]
4、本发明的可电离叔胺脂质的合成方法简单,所采用的反应试剂及得到的产物无毒无污染,且原料成本低,具有较好的推广性;反应过程中,条件温和,副产物少且易提纯;利用可电离叔胺脂质制备可电离叔胺脂质体、以及脂质体/基因复合物的方法也便捷,适用于推广。
[0058]
5、可电离叔胺脂质体/基因复合物的递送效率与商品化试剂lipo3000相当,可电离叔胺脂质体可作为新型高效低毒的非病毒基因载体和转染试剂,并将有望成为用于临床基因治疗的新型基因载体。
附图说明
[0059]
图1为实施例3制备的可电离叔胺脂质化合物qeox10的核磁氢谱图;
[0060]
图2为实施例3制备的可电离叔胺脂质化合物qeox10的质谱图;
[0061]
图3为实施例6制备的可电离叔胺脂质化合物qedi10的核磁氢谱图;
[0062]
图4为实施例6制备的可电离叔胺脂质化合物qedi10的质谱图;
[0063]
图5为实施例16和17制备的可电离叔胺脂质体的粒径图;
[0064]
图6为实施例16和17中可电离叔胺脂质体可电离叔胺脂质体的zeta电位图;
[0065]
图7为实施例24中可电离叔胺脂质体与质粒sirna的结合能力检测图;
[0066]
图8为实施例25中可电离叔胺脂质体运载pgfp-n1质粒转染a549细胞的绿色荧光蛋白表达图;
[0067]
图9为实施例25中采用细胞仪检测可电离叔胺脂质体运载pgfp-n1质粒转染a549细胞的荧光素酶表达图;
[0068]
图10为实施例26中可电离叔胺脂质体运载sirna转染a549细胞的luciferase基因沉默图;
[0069]
图11为实施例27中可电离叔胺脂质体运载egfp mrna转染a549细胞荧光强度表达图;
[0070]
图12为实施例28中采用cck8法检测可电离叔胺脂质体细胞转染过程中对a549细胞毒性图。
具体实施方式
[0071]
为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行阐述,但是这些阐述只是为进一步说明本发明的特征和优点,而不是对本发明权利要求的限制。
[0072]
本说明书中,以下述十五种可电离叔胺化合物为例进行说明。含oh、双酯键连接键以及2,3和4个碳链作为疏水尾链,分别用deox10,teox10,qeox10表示;含二甲胺、双酯键连接键以及2,3和4个碳链作为疏水尾链,分别用dedi10,tedi10,和qedi10表示;含四氢吡咯、双酯键连接键以及2,3和4个碳链作为疏水尾链,分别用depy10、qepy10和qepy10表示;含哌嗪、双酯键连接键以及2,3和4个碳链作为疏水尾链,分别用depi10、qepi10和depi10表示;含二甲胺、双酯键连接键以及0,1,2不饱和十八碳链作为疏水尾链,分别用demi18、oemi18和qlmi18表示。
[0073]
实施例1阳离子叔胺脂质化合物deox10的合成
[0074]
1)将15.8g癸醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10),得到羧酸中间体;
[0075]
2)将25.8g步骤1)制备的羧酸中间体加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0076]
3)向三口烧瓶中加入三氟乙酸20ml和68.5g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=3:1),得到中间体;
[0077]
4)向三口烧瓶中加入58.5g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应24h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物,产率52%,其结构式如下:
[0078][0079]
实施例2阳离子叔胺脂质化合物teox10的合成
[0080]
1)将15.8g癸醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体1;
[0081]
将29.8g辛基十二醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体2;
[0082]
2)将15.7g步骤1)得到的羧酸中间体1和19.9步骤1)制备的羧酸中间体2加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,30℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0083]
3)向三口烧瓶中加入三氟乙酸20ml和74.2g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=5:1),得到中间体;
[0084]
4)向三口烧瓶中加入64.2g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫
酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应24h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物,产率48%,其结构式如下:
[0085][0086]
实施例3阳离子叔胺脂质化合物qeox10的合成
[0087]
1)将29.9g辛基十二醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,30℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体;
[0088]
2)将39.8g步骤1)制备的羧酸中间体加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,36℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0089]
3)向三口烧瓶中加入三氟乙酸20ml和79.8g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=5:1),得到中间体;
[0090]
4)向三口烧瓶中加入69.8g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml。在100℃下反应20h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物,产率43%,其结构式如下:
[0091][0092]
实施例4阳离子叔胺脂质化合物dedi10的合成
[0093]
1)将15.8g癸醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10),得到羧酸中间体;
[0094]
2)将25.8g步骤1)制备的羧酸中间体加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24
小时,反应后,30℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0095]
3)向三口烧瓶中加入三氟乙酸20ml和68.5g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=3:1),得到中间体;
[0096]
4)向三口烧瓶中加入58.5g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应22h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物;
[0097]
5)将步骤4)制备的可电离叔胺脂质62.9g溶于20ml二氯亚砜中,80℃下反应24h;反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1),得到中间体;
[0098]
6)步骤5)制备的中间体64.8g,加入反应釜中,加入1.38g碳酸钾,20ml二甲胺,100ml thf,在60℃下反应24h;反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,35℃烘干,得到目标粗产物;
[0099]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率43%,其结构式如下:
[0100][0101]
实施例5阳离子叔胺脂质化合物tedi10的合成
[0102]
1)将15.8g癸醇加入含有50ml氯仿的的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体1;
[0103]
将29.8g辛基十二醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体2;
[0104]
2)将15.7g步骤1)制备的羧酸中间体1和19.9步骤1)制备的羧酸中间体2加入50ml氯仿后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴滴入三口烧瓶中,滴完后在室温反应24小时,反应后,40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0105]
3)向三口烧瓶中加入三氟乙酸20ml和74.2g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=5:1),得到中间
体;
[0106]
4)向三口烧瓶中加入64.2g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应24h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物;
[0107]
5)将步骤4)制备的可电离叔胺脂质68.5g溶于20ml二氯亚砜中,80℃下反应24h;反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1),得到中间体;
[0108]
6)步骤5)制备的中间体70.3g,加入反应釜中,加入1.38g碳酸钾,20ml二甲胺,100ml thf,在60℃下反应24h;反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,35℃烘干,得到目标粗产物;
[0109]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,其结构式如下:
[0110][0111]
实施例6阳离子叔胺脂质化合物qedi10的合成
[0112]
1)将29.9g辛基十二醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,30℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体;
[0113]
2)将39.8g步骤1)制备的羧酸中间体加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0114]
3)向三口烧瓶中加入三氟乙酸20ml和79.8g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=5:1),得到中间体;
[0115]
4)向三口烧瓶中加入69.8g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应24h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物。
[0116]
5)将步骤4)制备的可电离叔胺脂质74.2g溶于40ml二氯亚砜中,80℃下反应24h;反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水
混合溶剂(v/v=2:1),得到中间体;
[0117]
6)步骤5)制备的中间体76.1g,加入反应釜中,加入1.38g碳酸钾,20ml二甲胺,100ml thf,在60℃下反应23h,反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,35℃烘干,得到目标粗产物;
[0118]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率63%,其结构式如下:
[0119][0120]
实施例7阳离子叔胺脂质化合物depy10的合成
[0121]
1)将15.8g癸醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10),得到羧酸中间体;
[0122]
2)将25.8g步骤1)制备的羧酸中间体加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0123]
3)向三口烧瓶中加入三氟乙酸20ml和68.5g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=3:1),得到中间体;
[0124]
4)向三口烧瓶中加入58.5g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应24h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物;
[0125]
5)将步骤4)制备的可电离叔胺脂质62.9g溶于20ml二氯亚砜中,80℃下反应20h;反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1),得到中间体;
[0126]
6)步骤5)制备的中间体64.8g,加入反应釜中,加入1.38g碳酸钾,20ml四氢吡咯,100ml thf,在60℃下反应20h;反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,35℃烘干,得到目标粗产物;
[0127]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率52%,其结构式如下:
[0128][0129]
实施例8阳离子叔胺脂质化合物tepy10的合成
[0130]
1)将15.8g癸醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体1;
[0131]
将29.8g辛基十二醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体2;
[0132]
2)将15.7g步骤1)制备的羧酸中间体1和19.9步骤1)制备的羧酸中间体2加入50ml氯仿后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,30℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0133]
3)向三口烧瓶中加入三氟乙酸20ml和74.2g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=5:1),得到中间体;
[0134]
4)向三口烧瓶中加入64.2g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应22h。反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物;
[0135]
5)将步骤4)制备的可电离叔胺脂质68.5g溶于20ml二氯亚砜中,80℃下反应23h;反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1)得到中间体;
[0136]
6)步骤5)制备的中间体70.3g,加入反应釜中,加入1.38g碳酸钾,20ml四氢吡咯,100ml thf,在60℃下反应24h;反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,35℃烘干,得到目标粗产物;
[0137]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率56%,其结构式如下:
[0138][0139]
实施例9阳离子叔胺脂质化合物qepy10的合成
[0140]
1)将29.9g辛基十二醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10),得到羧酸中间体;
[0141]
2)将39.8g步骤1)制备的羧酸中间体加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,40℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0142]
3)向三口烧瓶中加入三氟乙酸20ml和68.5g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=3:1),得到中间体;
[0143]
4)向三口烧瓶中加入58.5g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应24h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物;
[0144]
5)将步骤4)制备的可电离叔胺脂质62.9g溶于20ml二氯亚砜中,80℃下反应20h;反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1),得到中间体;
[0145]
6)步骤5)制备的中间体64.8g,加入反应釜中,加入1.38g碳酸钾,20ml四氢吡咯,100ml thf,在60℃下反应20h;反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,35℃烘干,得到目标粗产物;
[0146]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率52%,其结构式如下:
[0147][0148]
实施例10阳离子叔胺脂质化合物depi10的合成
[0149]
1)将15.8g癸醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g
和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,33℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10),得到羧酸中间体;
[0150]
2)将25.8g步骤1)制备的羧酸中间体加入50ml氯仿后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0151]
3)向三口烧瓶中加入三氟乙酸20ml和68.5g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=3:1),得到中间体;
[0152]
4)向三口烧瓶中加入58.5g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应22h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物;
[0153]
5)将步骤4)制备的可电离叔胺脂质62.9g溶于20ml二氯亚砜中,80℃下反应21h。反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1),得到中间体;
[0154]
6)步骤5)制备的中间体64.8g,加入反应釜中,加入1.38g碳酸钾,20ml哌啶,100ml thf,在60℃下反应22h;反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,36℃烘干,得到目标粗产物;
[0155]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率53%,其结构式如下:
[0156][0157]
实施例11阳离子叔胺脂质化合物tepi10的合成
[0158]
1)将15.8g癸醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,34℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体1;
[0159]
将29.8g辛基十二醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,34℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体2;
[0160]
2)将15.7g步骤1)制备的羧酸中间体1和19.9步骤1)制备的羧酸中间体2加入50ml
氯仿后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0161]
3)向三口烧瓶中加入三氟乙酸20ml和74.2g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=5:1),得到中间体;
[0162]
4)向三口烧瓶中加入64.2g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml。在100℃下反应22h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物;
[0163]
5)将步骤4)制备的可电离叔胺脂质68.5g溶于20ml二氯亚砜中,80℃下反应21h。反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1),得到中间体;
[0164]
6)步骤5)制备的中间体70.3g,加入反应釜中,加入1.38g碳酸钾,20ml哌啶,100ml thf,在60℃下反应22h;反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,35℃烘干,得到目标粗产物;
[0165]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率54%,其结构式如下:
[0166][0167]
实施例12阳离子叔胺脂质化合物qepi10的合成
[0168]
1)将29.9g辛基十二醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,33℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10),得到羧酸中间体;
[0169]
2)将39.8g步骤1)制备的羧酸中间体加入50ml氯仿后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0170]
3)向三口烧瓶中加入三氟乙酸20ml和68.5g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=3:1),得到中间体;
[0171]
4)向三口烧瓶中加入58.5g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应22h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物;
[0172]
5)将步骤4)制备的可电离叔胺脂质62.9g溶于20ml二氯亚砜中,80℃下反应21h。反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1),得到中间体;
[0173]
6)步骤5)制备的中间体64.8g,加入反应釜中,加入1.38g碳酸钾,20ml哌啶,100ml thf,在60℃下反应22h;反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,36℃烘干,得到目标产物;
[0174]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率53%,其结构式如下:
[0175][0176]
实施例13阳离子叔胺脂质化合物demi18的合成
[0177]
1)将27.1g十八醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10),得到羧酸中间体;
[0178]
2)将37.0g步骤1)制备的羧酸中间体加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,33℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0179]
3)向三口烧瓶中加入三氟乙酸20ml和91.0g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=3:1),得到中间体;
[0180]
4)向三口烧瓶中加入81.0g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应23h;反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物。
[0181]
5)将步骤4)制备的可电离叔胺脂质85.4g溶于20ml二氯亚砜中,80℃下反应22h;反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1),得到中间体;
[0182]
6)步骤5)制备的中间体87.2g,加入反应釜中,加入1.38g碳酸钾,20ml吗啉,100ml thf,在60℃下反应23h;反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1)抽滤,35℃烘干,得到目标粗产物;
[0183]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率54%,其结构式如下:
[0184][0185]
实施例14阳离子叔胺脂质化合物oemi18的合成
[0186]
1)将13.5十八醇加入含有50ml氯仿的三口烧瓶后,向两个烧瓶的滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体1;
[0187]
将13.4g油醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:15),得到羧酸中间体2;
[0188]
2)将18.5g步骤1)制备的羧酸中间体1和18.4g步骤1)制备的羧酸中间体2加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0189]
3)向三口烧瓶中加入三氟乙酸20ml和90.9g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=5:1),得到中间体;
[0190]
4)向三口烧瓶中加入80.9g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应22h。反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物;
[0191]
5)将步骤4)制备的可电离叔胺脂质85.3g溶于20ml二氯亚砜中,80℃下反应23h;反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1),得到中间体;
[0192]
6)步骤5)制备的中间体87.1g,加入反应釜中,加入1.38g碳酸钾,20ml吗啉,100ml thf,在60℃下反应23h。反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1)抽滤,33℃烘干,得到目标粗产物。
[0193]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用
硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率55%,其结构式如下:
[0194][0195]
实施例15阳离子叔胺脂质化合物qlmi18的合成
[0196]
1)将26.8g油醇加入含有50ml氯仿的三口烧瓶后,向滴液漏斗中加入丁二酸酐15g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在60℃油浴中反应24小时,反应后,35℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:10),得到羧酸中间体;
[0197]
2)将36.8g步骤1)制备的羧酸中间体加入50ml氯仿后,向滴液漏斗中加入二(2-羟乙基)氨基甲酸叔丁酯17.4g,二环己基碳二亚胺20.6g和100ml氯仿的混合溶液,将滴液漏斗中的混合溶液以3秒一滴的速率滴入三口烧瓶中,滴完后在室温反应24小时,反应后,33℃旋蒸掉溶剂,进行重结晶提纯,重结晶溶剂为甲醇/水混合溶剂(v/v=1:20),得到中间体;
[0198]
3)向三口烧瓶中加入三氟乙酸20ml和90.8g步骤2)制备的中间体,室温搅拌24小时,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=3:1),得到中间体;
[0199]
4)向三口烧瓶中加入80.8g步骤3)制备的中间体,之后加入13.8g碳酸钾、1.42g硫酸钠和200ml甲苯,油浴加热到100℃,再加入2-溴乙醇10ml,在100℃下反应23h。反应后在70℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1),得到含有一个羟基头部的可电离叔胺脂质化合物;
[0200]
5)将步骤4)制备的可电离叔胺脂质85.2g溶于20ml二氯亚砜中,80℃下反应22h;反应后在50℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=2:1),得到中间体;
[0201]
6)步骤5)制备的中间体87.1g,加入反应釜中,加入1.38g碳酸钾,20ml吗啉,100ml thf,在60℃下反应23h;反应后在30℃下旋转蒸发掉溶剂,用dmf/水的混合溶剂进行重结晶;重结晶溶剂为dmf/水混合溶剂(v/v=1:1);抽滤,35℃烘干,得到目标粗产物;
[0202]
7)步骤6)得到的目标粗产物使用柱层析法进行纯化,粗产物溶解在氯仿中,使用硅胶柱纯化该粗产物,用甲醇/氯仿(v/v=1:10)混合试剂进行洗脱,用旋转蒸发法去除溶剂,冻干,即得到目标可电离叔胺脂质化合物,产率54%,其结构式如下:
[0203]
[0204]
实施例16用阳离子叔胺脂质化合物qeox10制备可电离叔胺脂质体
[0205]
称量1mg的实施例3制备的可电离叔胺脂质qeox10与1:1质量比的蔗糖酯l1695溶于1ml三氯甲烷溶剂中,待充分溶解后,在氮气下吹成均匀薄膜,真空干燥20h使溶剂全部挥发(真空度为-0.09mpa,常温),加入1000μl ph7.4磷酸缓冲液,在80℃左右水化5h,超声频率为100hz下35℃超声震荡至澄清透明,制得可电离叔胺脂质体qeox10,浓度为1mg/ml。
[0206]
采用激光散射粒度仪(horiba纳米粒度仪sz-100)在25℃,光散射角度90
°
条件下测定制备的可电离叔胺脂质体的粒径及其zeta电位,用移液枪取20μl上述可电离叔胺脂质体qeox10稀释于1mlph=7.4磷酸缓冲液中分别进行粒径和zeta电位检测,结果见图5和6。
[0207]
实施例17用阳离子叔胺脂质化合物qedi10制备可电离叔胺脂质体
[0208]
称量2mg的实施例6制备的叔胺脂质qedi10溶于10ml三氯甲烷,加入蔗糖酯l1695(qedi10与蔗糖酯的质量比为1:1),待充分溶解后,在氮气下吹成均匀薄膜,真空干燥24h使溶剂全部挥发(真空度为-0.09mpa,常温),用2mlph=7.4磷酸缓冲液浸泡6h,使膜脱落,在20℃左右反复超声震荡(震荡频率为100hz)至澄清透明,制得浓度为1mg/ml的阳离子叔胺脂质体qedi10。
[0209]
采用激光散射粒度仪(horiba纳米粒度仪sz-100)在25℃,光散射角度90
°
条件下测定制备的可电离叔胺脂质体的粒径及其zeta电位,用移液枪取20μl上述可电离叔胺脂质体qedi10稀释于1ml ph=7.4磷酸缓冲液中分别进行粒径和zeta电位检测,结果见图5和6。
[0210]
实施例18qeox10脂质体/dna复合物的制备
[0211]
如实施例16中所述方法制备得到可电离叔胺脂质体。取1mg/ml脂质体qeox10 1μg,用无血清dmem培养基稀释到50μl;取1mg/ml质粒dna 1μg,用无血清dmem培养基稀释到50μl;两稀释液混合(脂质体与dna质量比为1:1),轻微漩涡震荡,室温孵育10min,得到qeox10脂质体/dna复合物。
[0212]
按照上述方法可制备脂质体与dna质量比分别为1:1、2:1、3:1、4:1、6:1的qeox10脂质体/dna复合物。
[0213]
实施例19qedi10脂质体/dna复合物的制备
[0214]
如实施例17中所述方法制备得到可电离叔胺脂质体。取1mg/ml脂质体qedi10 1μg,用无血清dmem培养基稀释到50μl;取1mg/ml质粒dna1μg,用无血清dmem培养基稀释到50μl;两稀释液混合(脂质体与dna质量比为1:1),轻微漩涡震荡,室温孵育10min,得到qedi10脂质体/dna复合物。
[0215]
按照上述方法可制备脂质体与dna质量比分别为2:1、3:1、4:1、5:1、6:1、7:1的qedi10脂质体/dna复合物。
[0216]
实施例20qeox10脂质体/sirna复合物的制备
[0217]
如实施例16中所述方法制备得到可电离叔胺脂质体,取脂质体1mg/ml qeox10 0.9μg,用无血清dmem培养基稀释到25μl;取0.3μg/μl sirna0.3μg,用无血清dmem培养基稀释到25μl;两稀释液混合(脂质体与sirna质量比为3:1),轻微漩涡震荡,室温孵育20min,得到qeox10脂质体/sirna复合物。
[0218]
按照上述方法可制备脂质体与sirna质量比分别为1:1、2:1、4:1、5:1、6:1、7:1的qeox10脂质体/sirna复合物。
[0219]
实施例21qedi10脂质体/sirna复合物的制备
[0220]
如实施例17中所述方法制备得到可电离叔胺脂质体,取脂质体1mg/ml qedi10 0.9μg,用无血清dmem培养基稀释到25μl;取0.3μg/μl sirna0.3μg,用无血清dmem培养基稀释到25μl;两稀释液混合(脂质体与sirna质量比为3:1),轻微漩涡震荡,室温孵育20min,得到qedi10脂质体/sirna复合物。
[0221]
按照上述方法可制备脂质体与sirna质量比分别为1:1、2:1、4:1、5:1、6:1、7:1的qedi10脂质体/sirna复合物。
[0222]
实施例22qeox10脂质体/mrna复合物的制备
[0223]
如实施例16中所述方法制备得到可电离叔胺脂质体,取脂质体1mg/ml qeox10 0.9μg,用无血清dmem培养基稀释到25μl;取0.3μg/μl mrna0.3μg,用无血清dmem培养基稀释到25μl;两稀释液混合(脂质体与mrna质量比为3:1),轻微漩涡震荡,室温孵育20min,得到qeox10脂质体/mrna复合物。
[0224]
实施例23qedi10脂质体/mrna复合物的制备
[0225]
如实施例17中所述方法制备得到可电离叔胺脂质体,取脂质体1mg/ml qedi10 0.9μg,用无血清dmem培养基稀释到25μl;取0.3μg/μl mrna0.3μg,用无血清dmem培养基稀释到25μl;两稀释液混合(脂质体与mrna质量比为3:1),轻微漩涡震荡,室温孵育20min,得到qedi10脂质体/mrna复合物。
[0226]
实施例24脂质体结合sirna凝胶电泳
[0227]
采用琼脂糖凝胶电泳延滞实验,检测可电离叔胺脂质体与质粒dna在不同质量比时其相应的电荷比情况,进一步得出压缩的有效比例。将实施例16和17制备的叔胺脂质体分别与sirna按叔胺脂质体与sirna质量比依次为0:1、1:1、2:1、3:1、4:1、5:1、6:1、7:1的比例分别稀释于25μl dmem培养液中轻微漩涡震荡混匀,室温孵育20min,取2μl的loading buffer依次加入上述20μl叔胺脂质体与质粒dna复合物中混匀,并依次上样于1.2%的琼脂糖凝胶上样孔中,电压设为90v,电泳40min。制胶时已加入核酸染液na-red,电泳结束后直接在凝胶成像系统gene genius bio-imaging system(syngene公司)中观察dna延滞情况。电泳结果如附图7所示,其中泳道0为~7分别为阳离子叔胺脂质体与sirna按质量比依次为0:1、1:1、2:1、3:1、4:1、5:1、6:1、7:1的脂质体/sirna复合物,其中a为可电离叔胺脂质体qeox10结合sirna电泳图,b为可电离叔胺脂质体qedi10结合sirna电泳图。结果显示,由qedi10制备的叔胺脂质体都能有效压缩sirna,随着脂质体浓度逐渐增加,游离出来的sirna条带逐渐减弱,在n/p大于4:1时,sirna即能完全被脂质体压缩;由qeox10制备的脂质体压缩sirna的能力相对较差,在n/p大于6:1时,sirna完全被脂质体压缩。
[0228]
实施例25运载pgfp-n1质粒转染a549细胞
[0229]
将a549细胞种植于24孔细胞培养板中,每孔加细胞浓度约为1.0
×
105个/孔,孵育24h后,使在转染日细胞密度达80~90%。将实施例16和17制备的脂质体与pgfp-n1质粒分别按照脂质体与pgfp-n1质粒质量比为1:1,2:1,3:1,4:1和6:1的比例复合,复合后总体积为100μl。将复合物加到细胞培养板中,培养4-5h,更换含血清10%和1%抗生素的培养基,培育48h。绿色荧光蛋白基因表达的产物gfp能激射峰值508nm的绿色荧光,采用倒置荧光显微镜进行基因表达分析。阳性细胞发出明亮的绿色荧光,而阴性细胞则无,gfp阳性细胞越多,信号越强,表明转染率越高。观察倍数10
×
10。采用商品化基因转染试剂lipo 3000做对照。
[0230]
实验结果如附图8和9所示,2个脂质体均能够运载pgfp-n1质粒转染a549细胞,其中,脂质体qedi10在n/p比为3:1时,转染效率最高,与商品化基因转染试剂lipo 3000转染效率相当。
[0231]
实施例26rna干扰a549细胞
[0232]
细胞铺板没有计数,取基本长满的a549细胞,加到12孔板中,每孔加2ml,培养约24h,细胞密度约为50-60%。每孔加入200μl实施例24和25制备的脂质体/sirna复合物(脂质体与sirna质量比为1:1~4:1),转染18h,换生长培养基培养30h。将细胞用dpbs洗1次,每孔加入600μl裂解液,20min后,移至96孔白板中,每孔加20μl,加80μl普洛麦格e151a检测液,用多功能酶标仪(biotek)检测相对酶活力。取裂解液5μl加到96孔透明板中,以热电公司的pierce bca protein assay试剂盒为标准对照测定总蛋白含量。
[0233]
图10为2种可电离叔胺脂质体运载sirna转染a549细胞沉默luciferase基因的能力,商品化基因转染试剂lipo 3000为空白对照。结果显示:2种可电离叔胺脂质体转染a549细胞后,luciferase基因的表达水平均受到不同程度的抑制。其中,脂质体qedi10/sirna与空白组相比,荧光素酶基因的沉默效率可达80%,与商品化基因转染试剂lipo 3000沉默效率相当。
[0234]
实施例27mrna的转染a549细胞
[0235]
细胞铺板没有计数,取基本长满的a549细胞,加到12孔板中,每孔加2ml,培养约24h,细胞密度约为50-60%。每孔加入200μl脂质体/mrna复合物(脂质体与egfp mrna质量比为3:1)转染24h,胰酶消化,收集细胞,通过流式细胞仪检测脂质体递送mrna的荧光强度。
[0236]
图11为2种可电离叔胺脂质体运载egfp mrna转染a549细胞的能力,商品化基因转染试剂lipo 3000为空白对照。结果显示:2个脂质体均能够运载egfp mrna转染a549细胞。其中,脂质体qedi10/mrna的转染效率与商品化基因转染试剂lipo 3000相当。
[0237]
实施例28细胞毒性研究(cck8法)
[0238]
采用cck8法对转染效率较高的阳离子脂质体进行细胞毒性试验,以商品化基因转染试剂lipo 3000为对照。将a549细胞种植于96孔细胞培养板中,每孔加细胞培养液(含双抗和血清)100μl,浓度约为1.0
×
106个/孔,孵育24h,使在转染日细胞密度达80~90%。移去生长培养基,用100μl培养基清洗,再用等量(100μl)培养基替换。将实施例16和实施例17制备的脂质体与质粒dna(pgfp-n1)分别按照1:1,3:1,5:1,7:1,9:1和10:1的比例复合加到细胞培养板中。细胞培养24h后,每孔中加入20μl cck8(sigma,5mg/ml),孵育培养4~4.5h。用酶标仪在570nm波长处测定其吸光值,以空白对照(未转染细胞)的吸光值为100%,计算转染后细胞存活的百分率(%)。计算公式为:细胞存活率(%)=[a]
样品
/[a]
对照
×
100%。
[0239]
实验结果如图12,横坐标为所制备的可电离叔胺脂质体与dna质量比为1:1~10:1。2个脂质体对a549细胞的毒性都不大,细胞存活率在95%以上。与商品化基因转染试剂lipo 3000相比,细胞存活率明显提高。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。