1.本发明属于生物技术领域,具体涉及一组染色体不稳定区域和病原微生物基因组在制备诊断肺癌和肺部感染的试剂或试剂盒中的应用。
背景技术:
2.原发性肺癌(primary lung cancer,plc)是世界范围内最常见的恶性肿瘤。从病理和治疗角度,肺癌大致可以分为非小细胞肺癌(non small cell lung cancer,nsclc)和小细胞肺癌(small cell lung cancer,sclc)两大类,其中非小细胞肺癌约占80%-85%,其余为小细胞肺癌。
3.肺部感染是常见的呼吸系统疾病,呼吸道与外界相通,全身血液均流经肺脏,故肺脏易遭受身体内外微生物的侵袭。病毒和细菌引起的呼吸道感染最为常见。既往以肺炎链球菌感染的细菌性肺炎为主,占80-90%,余为链球菌、克莱布斯氏杆菌、葡萄球菌等感染所致。当前细菌感染的情况有所变化,医院外所患肺炎虽仍以肺炎链球菌感染为主,但金黄色葡萄球菌性肺炎、革兰氏阴性杆菌肺炎也明显增多。住院患者所得肺炎(医院内感染所致)中革兰氏阴性杆菌肺炎明显增加,其中以克莱布斯氏杆菌、绿脓杆菌感染最为多见。另真菌感染也增多。由于微生物分离培养技术改进,已能成功地诊断肺炎菌质体、厌氧菌以及新的病原微生物,如军团菌属、细胞巨病毒、肺孢子虫所致的肺部感染。这种病原微生物的变化,可能与患者高龄、病重、免疫疾病增加;肾上腺皮质激素、免疫抑制剂、细胞毒性药物、抗生素的应用;各种插管、气管切开、呼吸机的应用以及器官移植有关。
4.染色体不稳定通常与肿瘤相关,具体包括整个染色体或者染色体片段拷贝的缺失或扩增。含有与肿瘤发生相关的染色体或者染色体片段的扩增和缺失经常是肿瘤发生所特有的,检测肿瘤染色体不稳定区域对于研究肿瘤发生和开发肿瘤诊断技术都至关重要。当前临床上有使用原位荧光杂交的方法对染色体上部分区域的不稳定性进行检测,但缺少对患者整个基因组层面染色体不稳定性的分布特征。
5.肺部感染病原微生物确认临床上需要进行培养,对培养条件、操作人员要求高,通量不足,无法满足高通量检测。而且感染病原微生物来源多样,每种微生物培养条件不同,在未知的条件下培养条件无法确定,容易造成部分感染源未被培养得到,造成假阴性。通过测序技术可以对病原进行鉴别,不需要培养,且检测灵敏度高,对浓度低、不易培养的微生物也有很好的检测能力。
6.现有技术中还未有同时对肺部感染和肺癌进行检测的二代测序试剂盒。
技术实现要素:
7.本发明使用二代测序技术,通过分析肺癌染色体不稳定和病原微生物基因组信息,筛选出适宜表征肺癌的14个区域和微生物基因组,通过该方法可以对肺癌和肺部感染的临床早期诊断和制定个体化治疗方案提供科学依据。通过二代测序可以同时检测人和微生物基因组,通过染色体不稳定区域诊断是否有肿瘤发生,通过检测微生物基因组对感染
微生物进行鉴别,使用该方法同时对肺癌和肺部感染进行诊断。
8.本发明中涉及的染色体不稳定区域的编号依据本领域惯用编号规则进行限定,例如不稳定区3q在本领域惯用规则中指第3号染色体的长臂,不稳定区域7p指7号染色体短臂。
9.本发明中,“基因组”指生物体所有遗传物质的总和。这些遗传物质包括dna或rna(病毒rna)。
10.本发明中,“检测”是指对受试者进行是否患病的检测,其检测结果可以是患病或者不患病,可以是一次性检测,也可以是长期连续的检测,可以是局部组织的检测,也可以是系统地检测。
11.本发明中,“筛查”是指对受试群体进行患病可能进行检测,其并不限于针对有患病症状的群体,同时适用无症状群体,主要目的在于在疾病初期进行检测以及时应对,防止症状的发生,并采取有效的治疗,防止各种后遗症发生。
12.本发明中,“诊断”一般指针对有患病症状的个体或群体进行是否患病确认,但某些情况下也可以是无患病症状的个体或群体。
13.本发明中,“预后评估”是指根据经验预测的疾病发展情况,包括对疾病的近期和远期疗效、转归恢复或进展程度的评估。
14.本发明中,“病情监测”是指长期地、连续地收集、核对、分析疾病的动态分布和影响因素的资料,并将信息及时上报和反馈,以便及时采取干预措施。
15.一方面,本发明提供了染色体不稳定区域和病原微生物基因组在制备用于肺部疾病的检测、筛查、诊断、预后评估或病情监测的试剂或试剂盒中的用途。
16.所述的染色体不稳定区域包括:2p、3p、3q、6p、7p、8q、9p、12p、17p、17q、18q、20q、21p、21q;所述的病原微生物基因组包括细菌、真菌、病毒中任意一种或多种的基因组。
17.具体地,所述的染色体不稳定包括整个染色体或者染色体片段拷贝的缺失或扩增。
18.具体地,所述的7p区域的扩增可导致表皮生长因子egfr(原癌基因)高表达;所述的9p区域16位点抑癌基因的缺失,导致细胞周期调控的异常;所述的17p缺失导致抑癌基因tp53不能表达,促进肿瘤进展。
19.具体地,所述的14个不稳定区域在肺癌患者中总的携带率高达89.3%。
20.优选地,所述的细菌包括但不限于:肺炎链球菌、金黄色葡萄球菌、甲型溶血性链球菌、肺炎克雷白杆菌、流感嗜血杆菌、铜绿假单胞菌、埃希大肠杆菌、绿脓杆菌。
21.优选地,所述的真菌包括但不限于:白色念珠菌、曲霉、放射菌。
22.优选地,所述的病毒包括但不限于:冠状病毒、腺病毒、流感病毒、巨细胞病毒、单纯疱疹病毒。
23.所述的肺部疾病为肺癌和/或肺部感染。
24.具体地,所述的肺部疾病包括肺癌和肺部感染中的一种情形或两种情形同时发生。
25.具体地,所述的应用为通过二代测序对染色体不稳定区域和微生物基因组进行检测。
26.另一方面,本发明提供了染色体不稳定区域和病原微生物基因组在制备用于治疗
或辅助治疗肺部疾病的药物中的用途。
27.所述的染色体区域包括:2p、3p、3q、6p、7p、8q、9p、12p、17p、17q、18q、20q、21p、21q;所述的病原微生物基因组包括细菌、真菌、dna病毒中任意一种或多种的基因组。
28.具体地,所述的染色体不稳定包括整个染色体或者染色体片段拷贝的缺失或扩增。
29.所述的肺部疾病为肺癌和/或肺部感染。
30.具体地,所述的肺部疾病包括肺癌和肺部感染中的一种情形或两种情形同时发生。
31.具体地,所述的应用为通过二代测序对染色体不稳定区域和微生物基因组进行检测。
32.又一方面,本发明提供了一种用于肺部疾病的检测、筛查、诊断、预后评估或病情监测的试剂盒。
33.所述的试剂盒通过二代测序进行检测。
34.具体地,所述的试剂盒包括但不限于:诊断肺癌和肺部感染的试剂盒、肺癌和肺部感染早期筛查试剂盒、肺癌和肺部感染病情监测试剂盒、肺癌和肺部感染预后评估试剂盒。
35.所述的试剂盒中包括用于检测染色体不稳定区域和病原微生物基因组的试剂;所述的染色体不稳定区域包括:2p、3p、3q、6p、7p、8q、9p、12p、17p、17q、18q、20q、21p、21q;所述的病原微生物基因组包括细菌、真菌、dna病毒中任意一种或多种的基因组。
36.具体地,所述的试剂或试剂盒还包含:阳性参考品、阴性参考品、缓冲液、酶、文库接头、可检测标签、核酸提取试剂、核酸纯化试剂中的一种或多种。
37.进一步具体地,所述的酶包含打断酶、dna聚合酶、dna连接酶中的一种或多种。
38.进一步具体地,所述的阳性参考品为混合有前述的14个区域变异的细胞系和混合有前述的相关病原的基因组;所述的阴性参考品为无染色体变异、无病原基因组的细胞系。
39.具体地,所述的试剂盒中还包括测序引物,所述的测序引物包括p7端标签引物和p5端标签引物。
40.优选地,所述的p7端标签引物选自seq id no.1-8中的一种或多种,所述的p5端标签引物选自seq id no.9-16中的一种或多种。
41.可选择地,所述的试剂盒可通过以下方法进行结果检测:数字pcr、原位荧光杂交、核酸探针杂交法等。
42.可选择地,所述试剂盒还包含临床上用于肺癌的检测、筛查、诊断、预后评估或病情监测和肺部感染的检测、诊断的其它试剂,以辅助或验证通过检测上述14个染色体区域所得到的结果。
43.优选地,所述的试剂或试剂盒可检测的临床样品包括但不限于:肺泡灌洗液(冲洗液)、胸腔积液(胸水)等。
44.又一方面,本发明还提供了前述肺部疾病相关的试剂盒的操作方法。
45.具体地,所述的操作方法包括以下步骤:
46.(1)从检测对象获得待测样品;
47.(2)待测样品与检测试剂接触;
48.(3)检测前述的14个染色体区域和病原微生物基因组;
49.(4)根据检测结果进行肺癌的检测、筛查、诊断、预后评估或病情监测和肺部感染的检测、诊断。
50.本发明的有益效果:
51.本发明收集临床确诊的肺癌患者、肺部感染患者和健康人的肺泡灌洗液(冲洗液)、胸腔积液(胸水)样本,通过提取人源和微生物的基因组dna,并进行全基因组测序,进而比较肿瘤患者与对照的染色体异常情况,感染患者和健康人微生物基因组情况。阐述肺癌所特有的染色体不稳定性分布特征,公开了肺癌癌患者14个常见染色体不稳定区域,总的携带率高达83.9%;并同时检测患者感染源,与临床培养结果一致性达到90%,具有非常高的可替代性,这对临床肺癌的检测、筛查、诊断、预后评估或病情监测和肺部感染的检测、诊断的具有很大的意义,为下一步进行早期诊断和制定个体化治疗方案提供科学依据。
附图说明
52.图1为3q 、7p 、8q 染色体不稳定分析结果图;其中a为3q ,b为7p ,c为8q 。
53.图2为9p-染色体不稳定分析结果图。
54.图3为17p-、17q 染色体不稳定分析结果图;其中a为17p-,b为17q 。
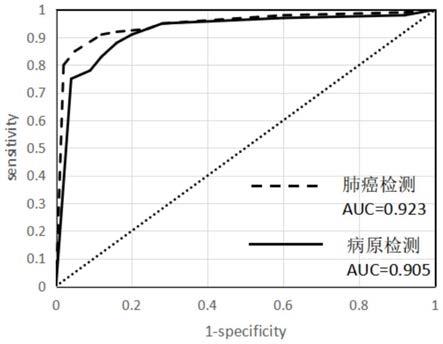
55.图4为本发明14个染色体区域和病原检测的roc曲线图,其中auc为roc曲线下面积。
56.需要特别说明的是,图1-3为分析软件直出图,当前条件下可以判定检测结果。
具体实施方式
57.下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
58.实施例1肺泡灌洗液人源和微生物基因组dna提取
59.本实施例选用的试剂盒购自qiagen公司(货号:80204)。
60.a.将肺泡灌洗液转移至50ml离心管中,加入同体积的1
×
pbs缓冲液,震荡混匀,进行1600g离心10min,小心倒去上清液,再用移液枪小心吸弃剩余的上清液。
61.b.加入350μl 1
×
buffer rl/dtt至新的1.5ml离心管中,用一次性20号针头的注射器小心抽打裂解液至少5次打散细胞。
62.c.把dna纯化柱装在2ml收集管中。把细胞裂解液转移至gdna过滤柱中。14000g离心2min。
63.d.取dna纯化柱装在2ml收集管中。加入500μl buffer dw1至柱子中,静置2min。10000g离心30-60s。
64.e.倒弃流出液,把柱子装回收集管中。加入500μl buffer rw2至柱子中。10000g离心30-60s。
65.f.倒弃流出液,把柱子装回收集管中。加入500μl buffer rw2至柱子中。10000g离心30-60s。
66.g.倒弃流出液,把柱子套回空的收集管。13000g离心2min。
67.h.将dna柱子装在1.5ml离心管中。加入30-50μl预热至65℃无核酸酶水至柱子膜中央。室温静置3min。13000g离心1min。
68.i.弃去dna柱,把dna保存于2-8℃或-20℃。
69.实施例2染色体不稳定区域和病原微生物dna的检测
70.本实施例中相关建库试剂盒购自neb公司,货号:e7645s;磁珠购自beckman公司,货号:a63882。
71.包括以下步骤:
72.1、基因组片段化:取实施例1中制备的20ng人/微生物基因组dna,配制如表1所示的酶切反应体系,按照表2程序进行反应。本实施例中人基因组dna的浓度为2ng/μl,反应体系中需加入10μl。
73.如果人基因组dna为无细胞的游离dna,如血液中的cfdna,则不需要经过基因组片段化,直接进入下步操作。
74.表1
75.dna打断反应体系基因组dna10μl打断酶3μl缓冲buffer7μl无核酸水补至35μl
76.振荡混匀、离心(避免气泡)后在pcr仪上运行以下程序:
77.表2
[0078][0079]
2、接头连接反应:将接头连接预混液、接头连接增强剂按照所检测的样本数目吸取适当的体积进行混合后,吸取15.5μl混合液加入到上一步的末端处理反应混合液中,振荡混匀、离心后再吸取1.5μl实施例1中制备的混合接头加入到上述反应液中,振荡混匀、离心。最终形成下表3中的反应体系。
[0080]
表3
[0081]
接头连接反应体系末端修复反应混合液(上一步)35μl接头连接预混液15μl接头连接增强剂0.5μl混合接头1.5μl总体系52μl
[0082]
将上述体系置于pcr仪中,运行程序:20℃,30min,热盖关闭。
[0083]
3、连接反应后纯化步骤:
[0084]
a、提前从磁珠试剂盒中取出文库纯化磁珠,室温静置至少30min,使用前需混匀。
[0085]
b、将上述步骤中的接头连接反应液转移到相应编号的1.5ml离心管,加入46μl重悬的文库纯化磁珠,使用适当量程的移液器匀速吸打20次,室温孵育5min。
[0086]
c、将离心管置于磁力架上,待溶液澄清后,弃上层清液。
[0087]
d、向其中加入新鲜配置的200μl 80%的乙醇,静置30s后,弃上层清液。
[0088]
e、重复步骤d一次。
[0089]
f、磁力架上取下离心管,瞬时离心3sec,离心管放回磁力架上,吸弃掉残留的80%乙醇,注意不要吸到磁珠。打开管盖,室温晾干2-10min。
[0090]
g、待磁珠成亚光色,离心管中加入16μl low te缓冲液(或者无核酸酶水),轻微震荡使磁珠重悬,室温孵育5min。
[0091]
h、将离心管置于磁力架上,静置2min。待溶液澄清后,取15μl上清留待下一步扩增反应。
[0092]
4、pcr扩增:依下表4,加入相应试剂至pcr管中:
[0093]
表4
[0094]
pcr反应体系接头连接纯化后产物15μlpcr扩增酶预混液25μlpcr扩增通用引物5μlpcr扩增标签引物5μl总体系50μl
[0095]
其中,p7端标签引物和p5端标签引物经由生工生物(上海)公司合成。具体序列如下:
[0096]
表5
[0097]
[0098][0099]
p7端标签引物选自seq id no.1-8,p5端标签引物选自seq id no.9-16,任意组合均能达到检测效果。本实施例中选用p7-01和p5-01。
[0100]
将混合好的pcr管放入至pcr仪中,运行以下程序:
[0101]
表6
[0102][0103]
5、pcr产物纯化参考步骤3纯化步骤,其中:
[0104]
步骤b中重悬的文库纯化磁珠的用量为22.5μl;
[0105]
步骤g中low te缓冲液(或者无核酸酶水)加入量为31μl;
[0106]
步骤h中取30μl上清留待下一步操作。
[0107]
6、文库定量上机
[0108]
上述纯化文库使用agilent bioanalyzer生物芯片分析系统对片段大小进行分析,使用hs assay kit对文库质量浓度进行测量,通过质量浓度和片段大小计算文库摩尔浓度,根据上测序仪说明书使用illumina hiseq x-ten进行测序。
[0109]
结果分析讨论:
[0110]
上机测序数据经过本发明所述数据分析方法后,得到染色体测序深度分布图,如图1-3所示。
[0111]
分析结果由两部分组成:
[0112]
一部分为染色体变异情况,结果包括染色体编号,染色体分区以及染色体测序深度分布。染色体测序深度分布区域中圆点为染色体小区域拷贝数分布情况,当其在纵轴scores值在-3到3之间时判定无不稳定发生,当其scores值大于3时判定为扩增,当其scores值小于-3时判定为缺失,对于发生扩增或缺失的区域使用灰色背景与正常区域进行区分。通过分析结果查看是否有上述染色体不稳定发生,若发生判定为肿瘤,若未发生判定为非肿瘤。
[0113]
另一部分为微生物检测情况。输出结果包括微生物种属和对应测序支持reads数,通过检测到微生物致病性和检测reads数判断感染的是否发生、由哪种微生物感染引起。检测结果见表7。
[0114]
表7病原微生物检测结果示例
[0115][0116]
图4为本发明14个染色体区域和病原检测的roc曲线图,其中auc为roc曲线下面积。
[0117]
实施例3检测样本验证
[0118]
选取临床样本116例(肺癌患者56例,感染患者60例)和健康样本42例,参考实施例1和实施例2进行检测,结果如下:肿瘤患者检出染色体拷贝数变异者47例,感染患者检出病原微生物与培养结果一致54例,感染患者检出染色体异常5例,健康人检出染色体异常1例、病原微生物感染5例。结果表明:本发明专利对于肺癌检测灵敏度83.9%,特异性94.1%;本试剂盒对于肺部病原微生物感染检测正确检出率90%,特异性88%。综上,本试剂盒可以很好的用于肺癌和肺部病原感染的检测,为临床诊断提供支持。
[0119]
对比例
[0120]
参照实施例1和实施例2设置以下对比例:
[0121][0122]
通过对比例发现,当检测不稳定区域减少(对比例1和2)时,相对本发明检测特异性变化不明显,但灵敏度有显著性下降,临床使用意义显著降低;当检测不稳定区域增加(对比例3)时,灵敏度和特异性变化都不明显,相对本发明并没有显著变化,但检测费用需要增加。因此,本发明染色体异常组合既能保证临床检测性能,同时又不显著增加检测费用,是当前最优的检测组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。