一株高产
γ-聚谷氨酸的耐盐芽孢杆菌及其发酵条件优化
技术领域
1.本发明属于生物技术领域,涉及一株高产γ-聚谷氨酸的耐盐芽孢杆菌及其发酵条件优化。
背景技术:
2.γ-聚谷氨酸(γ-pga),又称为纳豆胶、多聚谷氨酸,是一种由l型谷氨酸和d型谷氨酸通过α-氨基(α-amino)和γ-羧基(γ-caboxyl)之间的酰胺键连接所构成的高分子聚合物。γ-pga分子量高达10兆道尔顿,具有优良的水溶性,超强的吸附性,生物降解性和安全性。γ-pga作为保水剂、絮凝剂、吸附剂、药物载体等广泛应用于化妆品、医药、食品、污水处理和农业等各个方面。
3.γ-pga首先在纳豆中被发现,后来研究发现多种芽孢杆菌如枯草芽孢杆菌(bacillussubtilis)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)和地衣芽孢杆菌(bacilluslicheniformis)等可以合成γ-pga。目前γ-pga生产菌株分为两类,一类是谷氨酸非依赖型菌株,这类菌株γ-pga产量低,限制了其在工业生产中的应用;另一类是谷氨酸依赖型菌株,虽然在工业生产中获得了高产量的γ-pga,但是由于外源添加大量的谷氨酸,增加了生产成本。据报道,基因工程菌b.subtilis s18-3-vgb 在发酵过程中γ-pga 的产量达到60.5g/l,相对于野生菌提高了2.07倍,发酵速率为0.84g/l/h,底物转化率约为1.5g
γ-聚谷氨酸
/g
谷氨酸
(su et.al,improved poly-gamma-glutamic acid production bychromosomal integration of the vitreoscilla hemoglobin gene(vgb)in bacillus subtilis. bioresource technology.2010;101(12):4733-4736),这是文献报道的最高转化率。领先生物农业股份有限公司利用地衣芽孢杆菌生产多聚谷氨酸,产量为38
–
44g/l,生产速率为1.03-1.47g/l/h,但是转化率低于1.0g
γ-聚谷氨酸
/g
谷氨酸
(cn 104694437 b.2018.04.27)。
4.虽然γ-pga的生产取得了重要进展,但是还存在发酵周期长,生产速率低,转化率低,生产成本高的问题,而且目前工业应用的γ-pga生产菌株种类比较少。因此筛选新的γ-pga生产菌株,优化发酵条件,提高产量、产率及转化率,降低生产成本,具有很大的工业应用价值。
技术实现要素:
5.本发明要解决的技术问题是提供一株高效生产γ-pga的高转化率菌株及发酵生产γ-pga的方法,发酵周期短,底物转化率高、产物产量高,生产成本低,为工业应用奠定了基础。
6.本发明的一个目的是提供一株耐盐芽孢杆菌。
7.本发明提供的耐盐芽孢杆菌(bacillus halotolerans)f29,其保藏号为cgmccno.23662。
8.上述耐盐芽孢杆菌或其菌悬液或其培养液或其发酵液在如下1)-3)中至少一种或
具有如下1)-3)中至少一种功能产品中的应用也是本发明保护的范围:
9.1)生产γ-多聚谷氨酸;
10.2)提高γ-多聚谷氨酸产量;
11.3)提高γ-多聚谷氨酸转化率。
12.本发明另一个目的是提供一种生产γ-多聚谷氨酸的方法。
13.本发明提供的方法,包括如下步骤:发酵上述耐盐芽孢杆菌,得到γ-多聚谷氨酸。
14.所述发酵采用培养基含有谷氨酸;
15.在本发明的实施例中,谷氨酸以谷氨酸钠形式存在。
16.所述发酵采用培养基中的c源为蔗糖、葡萄糖、果糖、甘油、木糖或阿拉伯糖;
17.和/或,所述发酵采用培养基中的n源为氯化铵、硫酸铵、蛋白胨、胰蛋白胨或酵母粉。
18.上述方法中,所述发酵的温度28-42℃。
19.上述方法中,所述发酵的ph值为5.0-8.5。
20.上述方法中,所述发酵过程中,还包括如下步骤:在发酵体系中总糖浓度低于10g/l时,向发酵体系中补加蔗糖。
21.上述发酵采用培养基包括蔗糖、谷氨酸钠、硫酸铵、k2hpo4、mgso4·
7h2o、fecl3·
6h2o、cacl2、mnso4·
h2o和nacl。
22.初始发酵培养基中,所述蔗糖(3%)、谷氨酸钠(2%)、硫酸铵(0.5%)、k2hpo4(0.05%)、mgso4·
7h2o(0.05%)、fecl3·
6h2o(0.0004%)、cacl2(0.015%)、mnso4·
h2o(0.0104%)和nacl(0.05%),%均为质量百分含量。
23.每l最优发酵培养基为:蔗糖77.58g,谷氨酸钠43.02g,k2hpo42.23g,其余组分为硫酸铵5g,mgso4·
7h2o0.5g,fecl3·
6h2o0.04g,cacl20.15g,mnso4·
h2o0.104g,nacl0.5g,蒸馏水溶解并定容到1l。
24.最优发酵条件:发酵培养基初始ph5.5,培养温度37℃。
25.本发明还提供了一种提高γ-多聚谷氨酸转化率的方法,包括上述方法中的步骤。
26.本发明还提供了一种产品,包括上述耐盐芽孢杆菌或其菌悬液或其培养液或其发酵液。
27.上述产品具有如下至少一种功能:
28.1)生产γ-多聚谷氨酸;
29.2)提高γ-多聚谷氨酸产量;
30.3)提高γ-多聚谷氨酸转化率。
31.本发明从有机培养的大豆中分离了一株新型高效生产γ-多聚谷氨酸的耐盐芽孢杆菌f29。通过优化发酵条件,γ-聚谷氨酸的产量可达到50.9g/l,发酵速率1.36g/l/h,底物转化率为2.23g
γ-聚谷氨酸
/g
谷氨酸钠
,是已有研究的两倍以上。本发明利用耐盐芽孢杆菌生产多聚谷氨酸,在产量、产率尤其是转化率方面具有很强的优势,在工业应用中可以大大节约生产成本。
32.保藏说明
33.菌种名称:耐盐芽孢杆菌
34.拉丁名:bacillushalotolerans
35.菌株编号:f29
36.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
37.保藏机构简称:cgmcc
38.地址:北京市朝阳区北辰西路1号院3号
39.保藏日期:2021年10月25日
40.保藏中心登记入册编号:cgmcc no.23662
附图说明
41.图1为菌体及菌落形态图:a为100倍显微镜下的单细胞形态;b为平板培养基上的菌落形态。
42.图2为耐盐芽孢杆菌f29进化树。
43.图3为碳源对菌株生产γ-多聚谷氨酸的影响。
44.图4为氮源对菌株生产γ-多聚谷氨酸的影响。
45.图5为ph对菌株生产γ-多聚谷氨酸的影响。
46.图6为温度对菌株生产γ-多聚谷氨酸的影响。
47.图7为蔗糖和谷氨酸钠交互作用响应3d图。
48.图8为蔗糖和磷酸氢二钾交互作用响应3d图。
49.图9为谷氨酸钠和磷酸氢二钾交互作用响应3d图。
50.图10为耐盐芽孢杆菌f29在5l发酵罐中补料发酵曲线。
51.图11为γ-多聚谷氨酸标准曲线。
52.图12为l-谷氨酸标准曲线。
具体实施方式
53.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
54.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
55.下面将结合案例对本发明的目的、技术方案和有益效果进行详细的说明,以方便技术人员理解。
56.实施例1、产γ-多聚谷氨酸耐盐芽孢杆菌f29的分离筛选和鉴定
57.一、产γ-多聚谷氨酸耐盐芽孢杆菌f29的分离筛选
58.1、有机培养的大豆从天津市东丽区空港经济区东五道菜市场购买。首先称取10 克大豆加入到90ml无菌水中,在沸腾水浴锅中煮5分钟,以除去部分非芽孢类菌株,室温冷却后备用。
59.2、取冷却后的液体1ml,放入盛有9ml无菌水试管中,即为10-1
稀释度的菌液,再从10-1
稀释度的菌液中取1ml放入盛有9ml无菌水的试管中,即为10-2
稀释度的菌液,以此类推制成10-3
、10-4
稀释度的菌液。
60.3、配置分离培养基:酵母粉5g,胰蛋白胨10g,氯化钠10g,葡萄糖20g,谷氨酸钠10g,琼脂20g,蒸馏水溶解并定容到1l;ph 6.8~7.2,115℃灭菌20min。
61.倒平板,每个培养皿倒大约20ml的培养基,平板静置,冷却凝固后备用。
62.4、将稀释菌液10-1
、10-2
、10-3
、10-4
分别涂布于平板上,每个梯度涂5个培养皿。
63.5、将培养皿倒置于37℃培养箱中,培养24~48h。
64.6、用无菌接种针挑选表面皱褶、有粘性的单菌落,在新的固体平板上划线培养;纯化3次可得纯化后的单菌落。
65.7、将步骤6得到的纯化菌株接种到含有3ml液体种子培养基的玻璃试管中,37℃,200rpm培养12h,然后以1%接种量接种到含有50ml发酵培养基的250ml摇瓶中,37℃,200rpm/min发酵24h。
66.采用ctab显色法测定γ-多聚谷氨酸的产量。菌株f29产生最高浓度的γ-多聚谷氨酸。
67.上述液体种子培养基配方:胰蛋白胨10g,酵母粉5g,氯化钠10g,葡萄糖20g,谷氨酸钠10g,单蒸水溶解并定容到1l;ph6.8~7.2;115℃灭菌20min。
68.上述发酵培养基配方:葡萄糖30g,氯化铵5g,谷氨酸钠20g,k2hpo40.5g,mgso4·
7h2o0.5g,fecl3·
6h2o0.04g,cacl20.15g,mnso4·
h2o0.104g,nacl0.5g,单蒸水溶解并定容至1l;ph6.8~7.2;115℃灭菌20min。
69.二、产γ-多聚谷氨酸耐盐芽孢杆菌f29的鉴定
70.1、形态学鉴定
71.细胞为杆状,菌体大小为0.3-1μm。菌落呈白色,菌落较大,表面凸起,光滑粘稠,边缘皱褶,革兰氏阳性,产芽孢。菌体及菌落形态见图1。
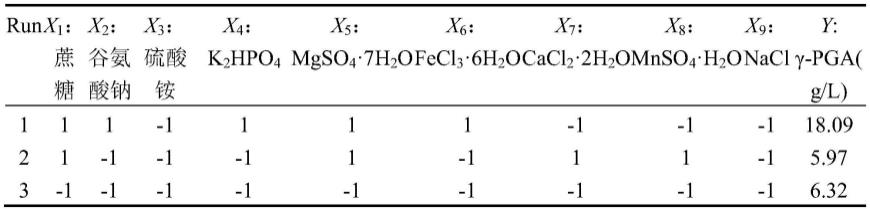
72.2、分子鉴定
73.上述一筛选得到的能高效合成γ-多聚谷氨酸的菌株f29,提取基因组,用27f(agagtttgatcctggctcag)和1492r(tacggctaccttgttacgactt)引物扩增得到16srdna序列。
74.将16srdna序列测序分析,结果如序列1所示。
75.将上述序列1与ezbiocloud上的模式菌株对比,并利用mega7软件采用neighbor-joining算法构建进化树(图2)。f29与bacillushalotoleransatcc25096在同一分支,结合前面的形态学鉴定结果,鉴定f29为耐盐芽孢杆菌bacillushalotolerans。
76.将菌株f29于2021年10月25日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmccno.23662,分类命名为bacillushalotolerans。
77.实施例2、耐盐芽孢杆菌f29发酵条件优化
78.一、耐盐芽孢杆菌f29发酵产γ-多聚谷氨酸的单因子条件摸索实验
79.将实施例1获得的耐盐芽孢杆菌f29单菌落接种于装有50ml种子培养基的250ml摇瓶中,在温度37℃,转速200rpm/min的条件下培养12h,获得耐盐芽孢杆菌f29种子液。
80.1、不同碳源对耐盐芽孢杆菌f29产γ-多聚谷氨酸的影响
81.将上述f29种子液以1%接种量接种到含有50ml不同c源的发酵培养基的250ml摇瓶中,37℃,200rpm/min发酵24h。
82.上述不同c源的发酵培养基配方:c源30g,氯化铵5g,谷氨酸钠20g,k2hpo40.5g,mgso4·
7h2o0.5g,fecl3·
6h2o0.04g,cacl20.15g,mnso4·
h2o0.104g,nacl0.5g,单蒸水溶解并定容至1l;ph7.2;115℃灭菌20min。
83.上述c源分别为蔗糖、葡萄糖、果糖、甘油、木糖或阿拉伯糖。
84.采用ctab显色法测定γ-多聚谷氨酸的产量,方法如下:
85.(1)γ-多聚谷氨酸标准液的配置:精确称取γ-多聚谷氨酸标准品(上海麦克林生化科技有限公司;cas号:25513-46-6)0.1g,在100ml容量瓶中用蒸馏水溶解并定容,得到1g/l的标准液。并进行梯度稀释,依次得到0.1g/l,0.2g/l,0.3g/l,0.4g/l,0.5g/l的γ-多聚谷氨酸标准液。
86.(2)γ-多聚谷氨酸的纯化:发酵得到的发酵液经12000r/min离心10min,除去菌体,取上清液100μl,加入到含有900μl的4%(w/v,g:ml)三氯乙酸(tca)溶液中,50℃加热10min以除去溶液中的蛋白质,12000r/min离心10min,取上清即为制得的样品液。稀释适当倍数后进行测定。
87.(3)ctab溶液的制备:配置2%(w/v,g:ml)的naoh溶液,并以此为溶剂,加入ctab至终浓度为0.07m。
88.(4)ctab比浊法测定:精确取50μl标准液或者样品液,加入到装有450μl蒸馏水的1.5ml离心管中,准确加入500μlctab试液,充分混匀,静止3min。将反应液倒入1mm比色皿中,测定波长在400nm下的吸光度(a400),以加入500μl蒸馏水的反应液作为空白。所得到的标准曲线如图11所示。
89.发酵液中γ-多聚谷氨酸的浓度为od400/0.9615
×
稀释倍数
90.检测生物量方法如下所示:将种子液分别接种到3瓶含有30ml发酵培养基的摇瓶中,培养24h后测600nm下的吸光度(od600),5000rpm离心20min,收集菌体,用蒸馏水洗三次,将菌体冷冻干燥,称重。所得到的菌体平均od600为12.47,菌体平均干重为0.155g,换算成菌体1od=0.414g干重。生物量的计算方法为:将发酵液稀释到合适的倍数,在600nm波长下测吸光度(od600),生物量=od600
×
0.414
×
稀释倍数
91.γ-多聚谷氨酸和生物量检测结果如图3所示,耐盐芽孢杆菌f29生产γ-多聚谷氨酸的最佳碳源为蔗糖,γ-多聚谷氨酸的产量为8.05g/l。
92.2.不同氮源对耐盐芽孢杆菌f29产γ-多聚谷氨酸的影响
93.将上述f29种子液以1%接种量接种到含有50ml不同n源的发酵培养基的250ml摇瓶中,37℃,200rpm/min发酵24h。
94.上述不同n源的发酵培养基配方:蔗糖30g,n源5g,谷氨酸钠20g,k2hpo40.5g,mgso4·
7h2o0.5g,fecl3·
6h2o0.04g,cacl20.15g,mnso4·
h2o0.104g,nacl0.5g,单蒸水溶解并定容至1l;ph7.2;115℃灭菌20min。
95.上述n源分别为氯化铵、硫酸铵、蛋白胨、胰蛋白胨或酵母粉。
96.采用ctab显色法测定γ-多聚谷氨酸的产量。
97.检测生物量。
98.γ-多聚谷氨酸和生物量检测结果如图4所示,耐盐芽孢杆菌f29生产γ-多聚谷氨酸的最佳氮源为硫酸铵,γ-多聚谷氨酸的产量为9.65g/l。
99.3.不同ph对耐盐芽孢杆菌f29产γ-多聚谷氨酸的影响
100.将上述f29种子液以1%接种量分别接种到含有50ml不同ph值的发酵培养基的250ml摇瓶中,37℃,200rpm/min发酵24h。
101.上述不同ph值的发酵培养基配方:蔗糖30g,硫酸铵5g,谷氨酸钠20g,k2hpo40.5g,mgso4·
7h2o0.5g,fecl3·
6h2o0.04g,cacl20.15g,mnso4·
h2o0.104g,nacl0.5g,单
蒸水溶解并定容至1l;调节发酵培养基的ph分别为ph5.0,ph5.5,ph6.0,ph6.5,ph7.0,ph7.5,ph8.0和ph8.5,得到不同ph值的发酵培养基。115℃灭菌20min。
102.采用ctab显色法测定γ-多聚谷氨酸的产量。
103.检测生物量。
104.γ-多聚谷氨酸和生物量检测结果如图5可知,耐盐芽孢杆菌f29生产γ-多聚谷氨酸的最佳ph为5.5,γ-多聚谷氨酸的产量为11.26g/l。
105.4.不同温度对耐盐芽孢杆菌f29产γ-多聚谷氨酸的影响
106.对菌株生产γ-多聚谷氨酸的发酵温度设置了4个值,分别为28℃,32℃,37℃和42℃。
107.将上述f29种子液以1%接种量分别接种到含有50ml发酵培养基的250ml摇瓶中,分别在28℃,32℃,37℃和42℃,200rpm/min发酵24h。
108.上述发酵培养基配方:蔗糖30g,硫酸铵5g,谷氨酸钠20g,k2hpo40.5g,mgso4·
7h2o0.5g,fecl3·
6h2o0.04g,cacl20.15g,mnso4·
h2o0.104g,nacl0.5g,单蒸水溶解并定容至1l;调节发酵培养基的ph为5.5。115℃灭菌20min。
109.采用ctab显色法测定γ-多聚谷氨酸的产量。
110.检测生物量。
111.γ-多聚谷氨酸和生物量检测结果如图6可知,耐盐芽孢杆菌f29生产γ-多聚谷氨酸的最佳温度为37℃,γ-多聚谷氨酸的产量为9.10g/l。
112.二、耐盐芽孢杆菌f29产γ-多聚谷氨酸的优化实验
113.1.plackett-burman实验设计筛选显著影响因子
114.选择蔗糖,硫酸铵,谷氨酸钠,k2hpo4,mgso4·
7h2o,fecl3·
6h2o,cacl2,mnso4·
h2o和nacl9个影响因子,利用designexpert10.0.4软件对每个因子取两水平来进行实验组合,共进行12轮实验,如表1。每个因子在两水平的浓度以及方差分析结果如表2。每个实验组合进行三次实验,接种量为1%,培养温度37℃,初始ph5.5,摇床转速200rpm/min,培养24~48小时,不同时间段检测γ-多聚谷氨酸的浓度,取每个组合的最高浓度作为响应值。
115.表1为plackett-burman实验设计组合与结果
116.[0117][0118]
表2为影响因子在两水平上的真实浓度以及方差分析结果
[0119][0120]
根据表2的方差分析结果可知,该模型达到显著水平(p《0.05)。蔗糖、谷氨酸钠、硫酸铵、k2hpo4、fecl3·
6h2o和cacl2·
2h2o对γ-多聚谷氨酸的产量具有显著影响 (p《0.05)。蔗糖、谷氨酸钠、k2hpo4和fecl3·
6h2o对γ-多聚谷氨酸的产量具有正相关,表明浓度越高γ-多聚谷氨酸产量越高。硫酸铵和cacl2·
2h2o对多聚谷氨酸产量具有负相关,表明浓度越高γ-多聚谷氨酸产量越低。fecl3·
6h2o的p值0.0443,接近0.05,说明影响很小。因此选择蔗糖、谷氨酸钠和k2hpo4进行响应面分析设计实验。
[0121]
2.face-to-face中心复合点实验设计
[0122]
根据plackett-burman实验结果,选择蔗糖、谷氨酸钠和k2hpo4为自变量,以γ
‑ꢀ
多聚谷氨酸的产量为响应值,运用face-to-face中心复合点实验原理,应用 design-expert 10.0.4软件设计三因素三水平响应面分析实验,具体设计以及对应的γ
‑ꢀ
多聚谷氨酸产量详见表3,根据考察因子的分析结果以及响应面三维模型,确定最优化培养基组成。
[0123]
表3为face-to-face中心复合点实验因素水平及编码水平表和实验结果
[0124][0125]
face-to-face中心复合点设计实验结果方差分析见表4。
[0126]
表4为face-to-face中心复合点设计实验结果方差分析表
[0127][0128][0129]
根据表4中的实验结果,软件进行分析拟合出多项式回归方程,所得γ-多聚谷氨
酸产量的拟合回归方程为:
[0130]
y=20.05-0.48x1 0.65x2 0.37x4 0.72x1x
4-2.59x
12-2.25x
22-0.74x
42
[0131]
该拟合方程的方差分析结果见表4,由表4可知,该模型达到显著水平(p《0.05)。失拟项的p=0.4376》0.05,失拟项差异不显著,表明实验过程中误差小,该回归方程对实验拟合程度较好。模型的回归系数r2=0.9834,说明该模型对γ-多聚谷氨酸产量的分析和预测较可靠。
[0132]
3、响应面优化培养基组成
[0133]
响应面3d图形便于直接观察各个变量值与响应值之间的关系以及两两变量之间的交互作用。由图7-9可以看出,蔗糖、谷氨酸钠和磷酸氢二钾交互作用对γ-多聚谷氨酸产量的影响。响应面值y随着各个因子的增加先达到最高值,然后再逐渐降低,说明每个因子对γ-多聚谷氨酸的产量都存在最佳值,超过最佳值,会产生抑制作用,这也与回归分析结果中每个因子的平方项系数都是负值相吻合。对于每个影响因子,若曲线越陡峭,表明响应面值y对于因子的改变越敏感,此因子的交互作用对γ-多聚谷氨酸的产量影响也越大;反之曲面坡度越平缓,因子的改变对响应值的影响就越小。蔗糖和谷氨酸钠对γ-多聚谷氨酸产量的影响最大,表4回归分析结果也与此相吻合,蔗糖和谷氨酸钠的p值分别为0.0089和0.0014,远远小于0.05。
[0134]
由回归方程可以得到γ-多聚谷氨酸的每1l最优化发酵培养基为:蔗糖77.58g,谷氨酸钠43.02g,k2hpo42.23g,其余组分为硫酸铵5g,mgso4·
7h2o0.5g,fecl3·
6h2o0.04g,cacl20.15g,mnso4·
h2o0.104g,nacl0.5g,蒸馏水溶解并定容到1l,初始ph5.5,培养温度37℃。γ-多聚谷氨酸最大产量为20.16g/l。
[0135]
4.最优化培养基验证
[0136]
将上述一获得的耐盐芽孢杆菌f29种子液接种到装有50ml上述3得到的最优化发酵培养基的250ml摇瓶中,接种量1%,37℃,200rpm/min发酵48h,进行三次重复实验。
[0137]
采用ctab显色法测定γ-多聚谷氨酸的产量,结果γ-多聚谷氨酸的产量为20.67g/l。实际值与理论值非常接近,表明该回归模型能够很好地反映培养基各组分的浓度对γ-多聚谷氨酸产量的影响,证明了采用培养基优化法提高γ-多聚谷氨酸产量的可行性。
[0138]
实施例3、γ-多聚谷氨酸产量和产率的进一步提高
[0139]
1、固体平板培养
[0140]
将实施例1获得的耐盐芽孢杆菌f29接种于固体平板上,37℃培养12h,得到活化的固体培养菌株,备用。
[0141]
上述固体平板培养基配方为:胰蛋白胨10g,酵母粉5g,氯化钠10g,葡萄糖20g,谷氨酸钠10g,琼脂粉20g,单蒸水溶解并定容到1l;ph6.8~7.2。
[0142]
2、摇瓶种子培养
[0143]
取上述步骤1所制备的固体培养菌株,挑选单菌落接入到装有50ml液体培养基的250ml摇瓶中,37℃,200rpm/min培养12h,得到摇瓶种子液,备用。
[0144]
上述液体培养基配方与固体平板培养基配方一致,只是不加入琼脂粉。
[0145]
3、发酵罐培养
[0146]
将上述步骤2培养好的种子液接种于5l含有实施例2获得的最优化发酵培养基的发酵罐中发酵,最优化发酵培养基的装液量为3l,接种量为发酵体积的5%,培养温度37℃,
搅拌速度600rpm/min(biotech-5jg;上海保兴生物设备工程有限公司),在0-12h,通气量维持在2vvm,12h之后,通气量维持在3vvm,以此通过控制转速和通气量维持溶氧5%以上。当蔗糖浓度低于10g/l时,一次性补加一瓶蔗糖溶液。培养 48小时后,收集发酵液,即得到含有γ-多聚谷氨酸的发酵液。
[0147]
上述发酵培养基为实施例3所述的最优化培养基。
[0148]
上述补料的蔗糖溶液组成为:100g蔗糖加50ml水装入250ml摇瓶中,115℃灭菌20min。
[0149]
采用ctab显色法测定不同发酵时间发酵液中γ-多聚谷氨酸的产量。
[0150]
检测生物量。
[0151]
用如下方法检测l-谷氨酸:
[0152]
标准品处理:精确称取l-谷氨酸标准品(北京索莱宝科技有限公司;cas:56-86-0) 0.1g,在100ml容量瓶中用蒸馏水溶解并定容,得到1g/l的l-谷氨酸标准液。并进行梯度稀释,依次得到0.2g/l,0.4g/l,0.6g/l,0.8g/l,的l-谷氨酸标准液。标准液通过0.2μm滤膜,待用。
[0153]
样品处理:
[0154]
氨基酸检测方法:发酵得到的发酵液经12000r/min离心10min,取上清液50μl,加入到含有950μl的蒸馏水中,混匀。通过0.2μm滤膜,待用。
[0155]
agilent 1260infinity液相色谱仪,配备四元泵、液体自动进样器、柱温箱和dad 检测器。选用的色谱柱为agilent zorbax eclipse plus c18(4.6
×
150mm,3.5μm)。
[0156]
衍生化试剂opa和fmoc从安捷伦公司购买。
[0157]
流动相a)10mmol/l磷酸氢二钠和10mm硼酸钠溶液,用盐酸将ph调节为 8.2;b)甲醇:乙腈:水,45:45:10(体积比v:v:v)。
[0158]
自动进样程序为:1)吸取2.5μl硼酸盐缓冲液;2)吸取1.0μl样品;3)在清洗口将3.5μl混合液混合5次;4)等待0.2分钟;5)吸取0.5μl opa;6)在清洗口将4μl混合液混合10次;7)吸取0.4μl fmoc;8)在清洗口将4.4μl混合液混合 10次;9)吸取32μl稀释剂;10)在清洗口将20μl混合液混合8次;11)进样; 12)等待0.1分钟;13)阀切换至旁路。
[0159]
梯度程序为:
[0160][0161]
检测器:338nm。色谱柱温度40℃。
[0162]
根据标准品浓度与峰面积,得到标准曲线(图12),如下:
[0163]
样品中l-谷氨酸的含量为:峰面积/1476
×
稀释倍数。
[0164]
agilent 1260infinity液相色谱仪,配备四元泵、液体自动进样器、柱温箱和rid 检测器。选用的色谱柱为伯乐aminex hpx-87p色谱柱(300
×
78mm;9μm)。流动相为色谱级纯水;色谱柱温度65℃。进样时间20min,进样体积20μl。以蔗糖、果糖和葡萄糖标品制作标准曲线,根据峰面积以及标准曲线计算发酵液中每种糖的含量,从而得到总糖含量。
[0165]
最大发酵速率为:γ-pga产量在36h达到48.98g/l,发酵速率为 48.98/36=1.36g/l/h。
[0166]
转化率计算方法为:在48h,初始谷氨酸43.68g/l,发酵结束后剩余20.93g/l,消耗 22.75g/l,产生了50.91g/lγ-pga。谷氨酸到γ-pga的转化率为50.91/22.75=2.23g/g。
[0167]
结果如图10所示,可以看出,在48小时γ-多聚谷氨酸产量可达到50.9g/l,最大发酵速率1.36g/l/h,转化率为2.23g
γ-聚谷氨酸
/g
谷氨酸
。
[0168]
最后说明的是,以上优选实施例仅用于说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但对于本领域的技术人员而言,在形式上和细节上对其作出各种各样的改变仍属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
