1.本发明属于生物检测领域,具体地,涉及肾上腺高血压的基因检测panel。
背景技术:
2.高血压根据发病原因可分为原发性高血压和继发性高血压。原发性高血压 是指病因不明确的高血压;继发性高血压是指病因明确的高血压,即由其他器 官或系统的疾病(原发病)所导致的高血压,又称为症状性高血压。继发性高 血压的发病率大约占高血压的总体发病率的10%~20%,肾上腺性高血压是继 发性高血压中常见的类型,约占继发性高血压的20%以上,肾上腺性高血压是 指由各种原因导致肾上腺相关激素分泌增加从而引起血压升高,包括原发性醛 固酮增多症(原醛症)、库欣综合征和嗜铬细胞瘤和副神经节瘤等。与原发性 高血压相比,肾上腺性高血压具有起病年轻、伴有激素分泌异常,常伴有高血 压以外的其他损害、高血压多为顽固性、并发症多,致死率与致残率较高、确 诊后可通过手术或药物得到根治或有效治疗的特点。
3.目前肾上腺性高血压的诊断仍主要依靠临床表现、生化检查,以及影像学 检查等,缺点是临床表现不典型、生化指标检出率低,且易受外界因素干扰等 而导致误诊或漏诊。例如常见的肾上腺性高血压原醛症,目前不少医生(甚至 专科医生)尚停留在根据“高血压伴低血钾”的线索来筛查原醛症的“初级水平”。 据研究报道,仅少部分原醛症患者存在低钾血症,醛固酮腺瘤患者约50%表现 有低钾血症,而特发性醛固酮增多症的患者中仅17%表现有低钾血症。因此, 低钾血症对于原醛症的诊断价值有限,敏感性非常低。
4.研究表明,肾上腺性高血压发生与基因突变存在密切的关系,已有不少基 因明确与其发生发展相关。这些与肾上腺性高血压发生发展相关的基因突变多 数分布于整个编码区,没有明显的突变热点,胚系突变和体细胞突变均与疾病 的发生相关,并且体细胞突变的占比不低,如醛固酮瘤的kcnj5基因体细胞突 变率为50%~60%,亚洲国家醛固酮瘤的kcnj5突变率高达65%~80%。
5.因此,本领域需求一种基因检测产品,其联合临床表征与目前的筛查手段 相结合的方式,以提高诊断的效率,让更多的患者更早的接受相应的治疗,提 高患者的生活质量,弥补目前临床诊断不足的问题。
技术实现要素:
6.有鉴于此,第一方面,本发明提供了一种肾上腺高血压的基因检测panel, 其包括:
7.kcnj5、cacna1d、atp1a1、atp2b3、ctnnb1、clcn2、cyp11b2、 cacna1h中的至少两个;
8.sdha、sdhb、sdhc、sdhd、sdhaf2、fh、vhl、epas1、csde1、 maml3、ret、nf1、max、tmem127、hras、egln1、egln2、kif1b、 dlst、fgfr1、idh1、h3f3a、mdh2、aco1、slc25a11、got2中的至少 两个;以及
9.usp8、gnas、rasd1、prkar1a、aip、cables1、men1、cdkn1b、 tsc1、tsc2、rb1、tp53、prkaca、apc、armc5、gipr、mc2r、pde11a、 prkacb、pde8b、znrf3、cdkn2a、cdk4、mdm2、daxx、atrx、cdkn1c、 wtx、crebbp、ep300中的至少两个。
10.研究表明,与原醛症的发生相关的常见基因包括atp1a、atp2b3、 cacna1d、cacna1h、ctnnb1、prkaca等数十个。嗜铬细胞瘤和副神 经节瘤(pheochromocytoma and paraganglioma,ppgl)是目前已知的遗传度最 高的神经内分泌肿瘤。目前认为,ppgl的发生与致病基因的突变有关,约70% 的ppgl患者可检测到明确的致病基因,其中40%的患者存在胚系突变。目前 研究发现了至少30个与ppgl发生有关的致病基因。库欣综合征(cushing’s disease)是又称皮质醇增多症,是由各种病因导致的高皮质醇血症,作用于靶器 官,引起的以向心性肥胖、高血压、糖代谢异常、低钾血症和骨质疏松为典型 表现的一种综合征。目前研究发现了至少30个与库欣综合征发生有关的致病基 因,包括usp8、gnas、rasd1、prkar1a、aip、cables1、men1、ret、 cdkn1b、tsc1、tsc2、rb1、tp53、nf1、vhl、prkaca、apc、armc5、 gipr等,这些基因主要是通过影响皮质醇的的过量分泌从而导致疾病的发生。 选取特异有效基因集合对疾病的辅助诊断非常关键,漏选会降低检测敏感度, 多选则会增加成本和操作难度。本专利发明通过查询大量疾病数据库和文献研 究中关于肾上腺高血压相关疾病研究记录,包括omim、clinvar、disease、 genereviews,选取有充分证据可以导致肾上腺性高血压的基因/变异,这些证 据包括基因、蛋白功能研究、家系遗传性研究、人群变异分析等。最终选取了 本发明使用的64个肾上腺性高血压的相关基因的各种组合,其对应基因名称列 举如上(所述基因的相关信息可参见在线《人类孟德尔遗传》(omim,onlinemendelian inheritance in man)数据库https://www.omim.org/)。使用这些基因 的组合能够最大限度的增加灵敏度并降低成本和操作难度。
11.使用上述本发明的基因检测panel,结合生物学和生物信息学的相关手段, 可以对潜在的致病性突变进行筛选,从而可以结合临床筛查手段和临床表型提 高对原发性醛固酮增多症、库欣综合征(皮质醇增多症),以及嗜铬细胞瘤和 副神经节瘤的诊断的效率,弥补目前临床诊断不足的问题。同时灵敏度高,成 本和操作难度低。
12.其中,kcnj5、cacna1d、atp1a1、atp2b3、ctnnb1、clcn2、cyp11b2、 cacna1h为原发性醛固酮增多症相关基因;sdha、sdhb、sdhc、sdhd、 sdhaf2、fh、vhl、epas1、csde1、maml3、ret、nf1、max、tmem127、 hras、egln1、egln2、kif1b、dlst、fgfr1、idh1、h3f3a、mdh2、aco1、slc25a11、got2为嗜铬细胞瘤和副神经节瘤相关基因;以及usp8、 gnas、rasd1、prkar1a、aip、cables1、men1、cdkn1b、tsc1、tsc2、 rb1、tp53、prkaca、apc、armc5、gipr、mc2r、pde11a、prkacb、 pde8b、znrf3、cdkn2a、cdk4、mdm2、daxx、atrx、cdkn1c、 wtx、crebbp、ep300为皮质醇增多症相关基因。
13.更进一步地,本发明提供了一种肾上腺高血压的基因检测panel,其包括:
14.kcnj5、cacna1d、atp1a1、atp2b3、ctnnb1、clcn2、cyp11b2、 cacna1h中的至少三个;
15.sdha、sdhb、sdhc、sdhd、sdhaf2、fh、vhl、epas1、csde1、 maml3、ret、nf1、max、tmem127、hras、egln1、egln2、kif1b、 dlst、fgfr1、idh1、h3f3a、mdh2、aco1、slc25a11、got2中的至少 三个;以及
16.usp8、gnas、rasd1、prkar1a、aip、cables1、men1、cdkn1b、 tsc1、tsc2、rb1、tp53、
prkaca、apc、armc5、gipr、mc2r、pde11a、 prkacb、pde8b、znrf3、cdkn2a、cdk4、mdm2、daxx、atrx、cdkn1c、 wtx、crebbp、ep300中的至少三个。
17.更进一步地,本发明提供了一种肾上腺高血压的基因检测panel,其包括:
18.kcnj5、cacna1d、atp1a1、atp2b3、ctnnb1、clcn2、cyp11b2、 cacna1h中的至少五个;
19.sdha、sdhb、sdhc、sdhd、sdhaf2、fh、vhl、epas1、csde1、 maml3、ret、nf1、max、tmem127、hras、egln1、egln2、kif1b、 dlst、fgfr1、idh1、h3f3a、mdh2、aco1、slc25a11、got2中的至少 五个;以及
20.usp8、gnas、rasd1、prkar1a、aip、cables1、men1、cdkn1b、 tsc1、tsc2、rb1、tp53、prkaca、apc、armc5、gipr、mc2r、pde11a、 prkacb、pde8b、znrf3、cdkn2a、cdk4、mdm2、daxx、atrx、cdkn1c、 wtx、crebbp、ep300中的至少五个。
21.使用上述本发明的基因检测panel,其检测的灵敏度更高,漏检率更低。
22.更进一步地,本发明提供了一种肾上腺高血压的基因检测panel,其包括:
23.kcnj5、cacna1d、atp1a1、atp2b3、ctnnb1、clcn2、cyp11b2、 cacna1h;
24.sdha、sdhb、sdhc、sdhd、sdhaf2、fh、vhl、epas1、csde1、 maml3、ret、nf1、max、tmem127、hras、egln1、egln2、kif1b、 dlst、fgfr1、idh1、h3f3a、mdh2、aco1、slc25a11、got2;以及
25.usp8、gnas、rasd1、prkar1a、aip、cables1、men1、cdkn1b、 tsc1、tsc2、rb1、tp53、prkaca、apc、armc5、gipr、mc2r、pde11a、 prkacb、pde8b、znrf3、cdkn2a、cdk4、mdm2、daxx、atrx、cdkn1c、 wtx、crebbp、ep300。
26.使用上述本发明的基因检测panel,能够最大程度的提升检测的灵敏度和覆 盖范围,使得漏检率更低。
27.第二方面,本发明提供了一种肾上腺高血压的基因检测panel,其包括:
28.kcnj5、sdhb、prkaca;和
29.cacna1d、atp1a1、atp2b3、ctnnb1、clcn2、cyp11b2、cacna1h 中的至少两个;和
30.sdha、sdhc、sdhd、sdhaf2、fh、vhl、epas1、csde1、maml3、 ret、nf1、max、tmem127、hras、egln1、egln2、kif1b、dlst、 fgfr1、idh1、h3f3a、mdh2、aco1、slc25a11、got2中的至少两个; 以及
31.usp8、gnas、rasd1、prkar1a、aip、cables1、men1、cdkn1b、 tsc1、tsc2、rb1、tp53、apc、armc5、gipr、mc2r、pde11a、prkacb、 pde8b、znrf3、cdkn2a、cdk4、mdm2、daxx、atrx、cdkn1c、 wtx、crebbp、ep300中的至少两个。
32.进一步地,本发明提供了一种肾上腺高血压的基因检测panel,其包括:
33.kcnj5、sdhb、prkaca;和
34.cacna1d、atp1a1、atp2b3、ctnnb1、clcn2、cyp11b2、cacna1h 中的至少三个;和
35.sdha、sdhc、sdhd、sdhaf2、fh、vhl、epas1、csde1、maml3、 ret、nf1、max、tmem127、hras、egln1、egln2、kif1b、dlst、 fgfr1、idh1、h3f3a、mdh2、aco1、slc25a11、got2中的至少三个; 以及
36.usp8、gnas、rasd1、prkar1a、aip、cables1、men1、cdkn1b、 tsc1、tsc2、rb1、tp53、apc、armc5、gipr、mc2r、pde11a、prkacb、 pde8b、znrf3、cdkn2a、cdk4、mdm2、daxx、atrx、
cdkn1c、 wtx、crebbp、ep300中的至少三个。
37.更进一步地,本发明提供了一种肾上腺高血压的基因检测panel,其包括:
38.kcnj5、sdhb、prkaca;和
39.cacna1d、atp1a1、atp2b3、ctnnb1、clcn2、cyp11b2、cacna1h 中的至少五个;和
40.sdha、sdhc、sdhd、sdhaf2、fh、vhl、epas1、csde1、maml3、 ret、nf1、max、tmem127、hras、egln1、egln2、kif1b、dlst、 fgfr1、idh1、h3f3a、mdh2、aco1、slc25a11、got2中的至少五个; 以及
41.usp8、gnas、rasd1、prkar1a、aip、cables1、men1、cdkn1b、 tsc1、tsc2、rb1、tp53、apc、armc5、gipr、mc2r、pde11a、prkacb、 pde8b、znrf3、cdkn2a、cdk4、mdm2、daxx、atrx、cdkn1c、 wtx、crebbp、ep300中的至少五个。
42.使用上述本发明的基因检测panel,其检测的灵敏度更高,漏检率更低。
43.在一个具体的实施方案中,本发明提供了肾上腺高血压的第一基因检测 panel,其包括:
44.kcnj5、cacna1d;
45.sdhb、sdhd;以及
46.prkaca、apc。
47.在一个具体的实施方案中,本发明提供了肾上腺高血压的第二基因检测 panel,其包括:
48.kcnj5、clcn2;
49.sdhb、tmem127;以及
50.prkaca、cdkn1b。
51.在一个具体的实施方案中,本发明提供了肾上腺高血压的第三基因检测 panel,其包括:
52.cacna1d、clcn2;
53.sdhd、tmem127;以及
54.apc、cdkn1b。
55.在一个具体的实施方案中,本发明提供了肾上腺高血压的第四基因检测 panel,其包括:
56.kcnj5、cacna1d、atp1a1;
57.sdha、sdhb、sdhd;以及
58.prkaca、apc、armc5。
59.在一个具体的实施方案中,本发明提供了肾上腺高血压的第五基因检测 panel,其包括:
60.kcnj5、clcn2、cyp11b2;
61.sdhd、vhl、epas1;以及
62.prkaca、apc、cdkn1b。
63.在一个具体的实施方案中,本发明提供了肾上腺高血压的第六基因检测 panel,其包括:
64.cyp11b2、clcn2、cyp11b2;
65.sdhb、dlst、fgfr1;以及
66.daxx、apc、cdkn1b。
67.在一个具体的实施方案中,本发明提供了肾上腺高血压的第七基因检测 panel,其包括:
68.kcnj5、atp2b3、ctnnb1;
69.sdhd、sdhaf2、fh;以及
70.prkar1a、rb1、tp53。
71.在一个具体的实施方案中,本发明提供了肾上腺高血压的第八基因检测 panel,其包括:
72.kcnj5、cacna1d、atp1a1、atp2b3、ctnnb1;
73.sdha、sdhb、sdhc、sdhd、sdhaf2;以及
74.prkar1a、rb1、tp53、prkaca、apc。
75.在一个具体的实施方案中,本发明提供了肾上腺高血压的第九基因检测 panel,其包括:
76.kcnj5、cacna1d、atp1a1、clcn2、ctnnb1;
77.sdha、sdhb、kif1b、dlst、fgfr1;以及
78.prkar1a、usp8、gnas、prkaca、apc。
79.在一个具体的实施方案中,本发明提供了肾上腺高血压的第十基因检测 panel,其包括:
80.kcnj5、cacna1d、cacna1h、clcn2、atp2b3;
81.sdha、sdhb、tmem127、hras、egln1;以及
82.prkar1a、cdkn1b、gnas、prkaca、pde11a。
83.在一个具体的实施方案中,本发明提供了肾上腺高血压的第十一基因检测 panel,其包括:
84.kcnj5、cacna1d、atp1a1、atp2b3、ctnnb1、clcn2、cyp11b2、 cacna1h;
85.sdha、sdhb、sdhc、sdhd、sdhaf2、fh、vhl、epas1、csde1、 maml3、ret、nf1、max、tmem127、hras、egln1、egln2、kif1b、 dlst、fgfr1、idh1、h3f3a、mdh2、aco1、slc25a11、got2;以及
86.usp8、gnas、rasd1、prkar1a、aip、cables1、men1、cdkn1b、 tsc1、tsc2、rb1、tp53、prkaca、apc、armc5、gipr、mc2r、pde11a、 prkacb、pde8b、znrf3、cdkn2a、cdk4、mdm2、daxx、atrx、cdkn1c、 wtx、crebbp、ep300。
87.另一方面,本发明还提供上述基因panel在辅助诊断肾上腺高血压患者病 因的装置中的应用。
88.又一方面,本发明还提供上述基因panel在辅助诊断肾上腺高血压患者病 因的试剂中的应用。
89.又一方面,本发明提供了如上所述用途所制备的试剂。
90.进一步地,所述试剂为基因芯片、检测突变的pcr引物和探针、高通量测 序所用试剂。
91.在一些具体的实施方案中,基因芯片包括针对上述panel的捕获探针。进 一步地,
对应设计捕获探针的区域如表1所示。
92.在一些具体的实施方案中,高通量测序所用试剂包括nextseq 500 midoutput kit v2.5或nextseq 500 mid output kit v2。
93.又一方面,本发明提供了一种辅助诊断肾上腺高血压患者病因的装置,其 包括:
94.检测模块,包括检测如上所述的基因panel的试剂;
95.数据处理模块,包括处理所述检测模块获得的数据,并与参考序列进行比 对,获得序列比对结果;以及
96.筛选模块,包括对所述序列比对结果进行注释并筛选潜在突变基因。
97.所述参考序列为所提及的上述基因在参考基因组(hg19)上的序列。
98.又一方面,本发明一种基因突变的筛选方法,包括针对测试对象利用上述 的基因panel通过检测并结合生物信息学分析进行数据处理和基因突变筛选。
99.在一个具体的实施方案中,一种基因突变的筛选方法,包括针对测试对象 利用上述的基因panel通过高通量测序并结合生物信息学分析进行数据处理和 基因突变筛选。
100.在一个具体的实施方案中,一种基因突变的筛选方法,包括针对测试对象 利用上述的基因panel通过芯片捕获并结合生物信息学分析进行数据处理和基 因突变筛选。
101.在一个具体的实施方案中,一种基因突变的筛选方法,包括针对测试对象 利用上述的基因panel通过pcr筛选并结合生物信息学分析进行数据处理和基 因突变筛选。
102.在一些具体的实施方案中,数据处理和基因突变筛选包括测序数据下机后, 将通过对数据进行质控,比对、比对预处理及重比对,单核苷酸突变(snvs) calling、短插入/缺失(indels)突变calling、融合、拷贝数变异(cnvs)、结 果过滤及注释得到检测结果。得到的初步突变结果将根据变异(snv、indel、 cnv、融合)与疾病之间的关系,结合受检者临床表型、家族史和具体研究文 献,依据acmg/amp指南把变异分成5类:致病、疑似致病、意义未明、疑 似良性、良性。通过以上筛选步骤得到受检者基因突变信息。
附图说明
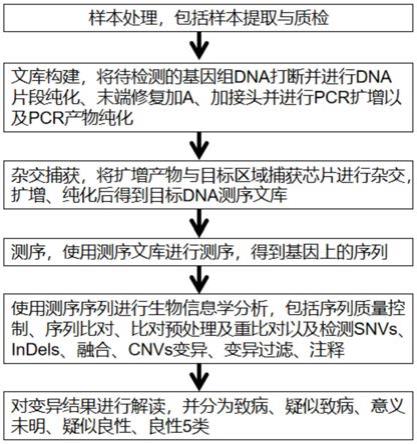
103.图1为本发明检测方法的流程图。
具体实施方式
104.本发明的检测方法流程如图1所示,而下文将结合具体实施方案和实施例, 具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技 术人员应理解,这些具体实施方案和实施例是用于说明本发明,而非限制本发 明。
105.实施例1、待测样本处理
106.1.1、样本提取
107.使用商品化试剂盒qiaamp dna ffpe tissue kit,按照说明书进行提取。
108.1.2、dna样本质量要求
109.提取后的dna使用dsdna hs assay kit定量,dna总量应不少于 0.2μg;使用nanodrop检测纯度,od260/280应不低于1.8。
110.注:提取后的样本dna,如不立即进行后续实验,可在-20℃以下保存12 个月。
111.2、文库构建
112.2.1、dna打断
113.a、dna投入量为0.1μg~0.5μg,选择破碎片段大小为150bp~300bp。
114.b、使用新芝超声破碎仪超声打断。推荐打断条件如下:
115.超声打断总时间40min,功率40%,打断模式:超声5s,停5s。
116.2.2、片段化纯化
117.a、ampurexp磁珠在使用前充分漩涡震荡混匀。
118.b、加入样品体积0.6倍的核酸纯化试剂,用移液器上下混匀10次。
119.c、室温下静置5min后,置于磁力分离架上5min,直至上清澄清。
120.d、小心吸取上清转移至含有0.9倍的核酸纯化试剂,用移液器上下混匀 10次。
121.e、室温下静置5min后,置于磁力分离架上5min,直至上清澄清。小心移 去上清。
122.f、置于磁力分离架上,加入200μl新鲜配制的80%乙醇,室温静置30sec, 吸弃上清。
123.g、重复步骤d,并尽量去除所有残留乙醇溶液。
124.h、离心管留于磁力架上室温开盖5min干燥,使乙醇全部挥发。
125.i、加入43μl无酶水,使用移液器上下混匀10次。室温孵育5min。
126.j、置于1.5ml磁力架上5min,取41μl dna溶液进入下一步文库构建实 验。
127.2.3、末端修复加a
128.a、在0.2ml pcr管中,如下配制文库混合液1。
129.组分加样量(μl)片段化dna4110
×
t4 pnk缓冲液5dntp mix(25mm)0.7t4 dna聚合酶1.2t4 pnk1.2klenow fragment0.7taq dna连接酶0.2总体积50
130.b、使用移液器上下吹吸将液体混匀,快速离心收集液体。
131.c、将文库混合液1置于pcr热循环仪中按照以下条件进行孵育。
132.2.4加接头
133.a、孵育完成后按下表向装有混合液1的反应管中加入试剂盒内相应组分 试剂,完成混合液2配制(配置过程于冰上完成)。
134.组分加样量(μl)2
×
rapid连接酶缓冲液40adapter(10μm)6t4 dna连接酶4总体积50
135.b、使用移液器上下吹吸将液体混匀,快速离心收集液体。将反应管置于 pcr仪上,20℃孵育20min。
136.2.5、adaptor连接产物纯化
137.a、ampurexp磁珠在使用前充分漩涡震荡混匀。
138.b、连接反应完成后,立即加入连接反应体积0.8倍的核酸纯化试剂。使用 移液器上下混匀10次。
139.c、室温下静置5min后,置于磁力分离架上5min,直至上清澄清。小心移 去上清。
140.d、置于磁力分离架上,加入200μl新鲜配制的80%乙醇,室温静置30sec, 吸弃上清。
141.e、重复步骤d,并尽量去除所有残留乙醇溶液。
142.f、离心管留于磁力架上室温开盖5min干燥,保证所有乙醇全部挥发。
143.g、加入22.5μl无酶水,使用适宜量程的移液器上下混匀10次。室温孵 育5min。
144.h、置于磁力架上5min,取20μl dna溶液进入pcr扩增。
145.2.6、pcr扩增
146.a、如下加入试剂,配制混合液3(配置过程于冰上完成):
[0147][0148]
b、使用移液器上下吹吸将液体混匀,短暂离心收集液体。
[0149]
c、将配制好的混合液3置于pcr仪,按以下反应程序扩增:
[0150][0151]
2.7、pcr产物纯化
[0152]
a、ampurexp磁珠在使用前充分漩涡震荡混匀。
[0153]
b、连接反应完成后,立即加入连接反应体积0.8倍的核酸纯化试剂。使用 移液器上下混匀10次。
[0154]
c、室温下静置5min后,置于磁力分离架上5min,直至上清澄清。小心移 去上清。
[0155]
d、置于磁力分离架上,加入200μl新鲜配制的80%乙醇,室温静置30sec, 吸弃上清。
[0156]
e、重复步骤d,并尽量去除所有残留乙醇溶液。
[0157]
f、离心管留于磁力架上室温开盖5min干燥,保证所有乙醇全部挥发。
[0158]
g、加入32.5μl无酶水,使用适宜量程的移液器上下混匀10次。室温孵 育5min。
[0159]
h、置于磁力架上5min,取30μl dna溶液进入下一步文库富集。取1μl 使用dsdna hs assay kit进行dna定量。
[0160]
实施例2、捕获探针合成
[0161]
据上述筛选出的目的基因总计64个基因,进行panel设计。设计区域为各 基因外显子区。探针设计使用twist提供的设计网站,依据上述要求提交设计。 将设计得到的探针进行比对分析,针对覆盖度低的基因增加探针覆盖度,使得 覆盖度达到99.9%以上。最终调整完成的目标区域大小为161kb,目标区域覆 盖度为100%,设计完成的最终探针包交于twist进行合成,合成的探针待捕获 使用。设计捕获探针的区域如表1所示。
[0162]
表1基因目标区域
[0163]
[0164]
[0165]
[0166]
[0167]
[0168]
[0169]
[0170]
[0171][0172]
实施例3、杂交捕获
[0173]
3.1、文库杂交
[0174]
a、文库池常包含多个不同样本文库,根据文库dna浓度计算文库池进入 量,混合获得文库池。文库池dna总量为1.5μg。
[0175]
b、文库池dna混合方案,根据下列公式计算每个样本文库加入体积
[0176]
v=x/c
[0177]
说明:当n=1~3时,x(ng)=500;当n=4~8时;x(ng)=1500/n。
[0178]
n为样本数量,c为dna定量浓度,v为样本杂交体积。
[0179]
根据上表计算计算每个样本的文库富集进入量,从而混合各样本得到文库 池。
[0180]
c、文库池按下表加入试剂,于1.5ml离心管中配制混合液4。
[0181]
组分加样量(μl)twist probe panel4μniversal blockers8blocker solution5
[0182]
d、使用移液器上下吹吸将液体混匀,短暂离心收集液体。
[0183]
e、使用可控温真空干燥仪,建议设置干燥温度60℃,打开管盖,直至混 合液4干燥完全。
[0184]
f、另取0.2ml pcr管,按下表加入试剂盒内相应组分,配制混合液5:
[0185][0186]
g、将50μl混合液5加入到干燥后混合液4的反应管中,室温静置10min。 使用移液器上下吹吸10次,完全溶解dna后,转移至新的pcr管中。
[0187]
h、pcr管置于pcr仪并设定程序:95℃加热10分钟,60℃,加热4小 时。
[0188]
3.2、文库捕获和清洗
[0189]
a、捕获磁珠和纯化磁珠提前拿出来室温平衡30min;410μl fast washbuffer预热66℃,700μl wash buffer2预热48℃。
[0190]
b、100μl捕获磁珠加入0.2ml pcr管,漩涡震荡15s,短暂离心,上磁 力架,澄清后,缓慢吸弃上清,不要有残留,也不要吸到磁珠。
[0191]
c、加入200μl fast binding bμffer,拿下磁力架,震荡混匀10s,再放到 磁力架上,澄清后,缓慢吸弃上清,不要有残留,也不要吸到磁珠。
[0192]
d、重复c两遍。
[0193]
e、将含200μl binding buffer的链霉素磁珠快速加入到放置在pcr仪中 的杂交产物(保持温度60℃)中,移液器吹打混匀,不要漩涡。室温孵育15min, 在垂直混匀仪上保持轻微摇动。孵育完后放置在磁力架上1min,澄清后,吸弃 上清。
[0194]
f、加入200μl的66℃fast wash buffer漩涡震荡10s,稍加离心,直接 pcr仪上66℃孵育5min,放到磁力架1min,澄清后,缓慢吸弃上清,不要有 残留,也不要吸到磁珠。
[0195]
g、加入200μl的66℃fast wash buffer漩涡震荡10s,稍加离心,直接 pcr仪上66℃孵育5min后,吹打混匀,转入新的0.2ml pcr管中,放到磁力 架1min,澄清,缓慢吸弃上清,不要有残留,也不要吸到磁珠。
[0196]
h、加入200μl的48℃wash buffer2漩涡震荡10s,稍加离心,直接pcr 仪上66℃孵育5min后,放到磁力架1min,澄清后,缓慢吸弃上清,不要有残 留,也不要吸到磁珠。
[0197]
i、重复h两遍。
[0198]
j、加入21μl的超纯水震荡混匀,重悬磁珠备用(注意必须带磁珠进行 pcr)。
[0199]
k、如下配制反应液至0.2ml pcr管。
[0200][0201]
将重悬磁珠22.5μl(体积若不够补水至22.5μl)加入有反应液的0.2mlpcr管,震荡混匀,短暂离心,放入pcr仪器中,反应程序如下:98℃45s; 98℃15s,60℃30s,72℃30s,14循环;72℃2min,4℃。
[0202]
3.3、pcr反应后纯化
[0203]
a、将上一步产物转入1.5ml离心管中,加入90μl(1.8
×
)twist beads, 吹打混匀,静置5min,上磁力架,澄清后,去掉上清,不可吸到磁珠。
[0204]
b、加入200μl 80%乙醇漂洗磁珠,在磁力架上旋转0.2ml pcr管两次, 小心移除上清,不可吸到磁珠。
[0205]
c、加入200μl 80%乙醇漂洗磁珠,在磁力架上吹吸乙醇,使磁珠更聚集, 小心移除上清,不可吸到磁珠。
[0206]
d、放置于金属浴中37℃烘干至磁珠表面无明显反光,加入34μl h2o洗 脱,吹打混匀,静置3min,上磁力架上;
[0207]
e、待溶液澄清后转移33μl上清至新的1.5ml的离心管中(核对样本编 号,做好唯一性标记),震荡混匀,取1μl qb定量,记录浓度,样本-20℃保 存。
[0208]
4、测序
[0209]
4.1、文库预处理
[0210]
4.1.1、准备变性试剂:取200μl1n文库变性液浓储,加800μl无酶水配 置成0.2n文库变性液,涡旋混匀,短暂离心,室温放置备用。
[0211]
4.1.2、文库变性:取5μl文库(4nm)至低吸附管管底,再加入5μl 0.2n 文库变性液,吹打混匀。关闭管盖室温孵育5min,之后立即置于冰上。
[0212]
4.1.3、文库稀释:变性后的10μl文库中加入990μl冰上预冷的稀释缓冲 液,混匀后快速离心,置于冰上备用。
[0213]
4.2、上样
[0214]
4.2.1、使用洁净的1ml枪头刺穿load samples(装入样品)孔的封箔,将 1300μl已制备文库注入load samples(装入样品)孔中。避免接触封箔。
[0215]
4.2.2、加载样品后检查孔中是否有气泡,如果有气泡在工作台轻轻敲打试 剂盒以释放气泡。
[0216]
4.2.3、将加载好样品的测序试剂盒使用nextseq cn500测序仪进行测序。
[0217]
5、数据分析
[0218]
测序数据下机后,对数据进行生物信息学分析,检测基因上的突变。具体 步骤如下:
[0219]
5.1、数据质控:采用fastq(v2)对每个样本文库每个lane的fastq数据文 件进行去接头、去低质量(如包含过多的
‘
n’)reads过滤,得到高质量的cleanreads,并生成过滤统计(包括接头统计、数据过滤前后q20、q30、gc含量、 碱基质量分布等)。
[0220]
5.2、比对:使用比对软件bwa-mem2(v2.0)将clean reads比对到人类参 考基因组grch37上,得到reads在基因组上的比对信息文件bam。
[0221]
5.3、比对预处理及重比对:包括使用in-house scripts对bam结果进行过 滤(去除多比对位置的reads记录)、picard tools(v1.92)对bam进行基因 组位置排序、gatk对bam进行重比对、samtools(v1.9)对同一个文库样本 不同lane的bam文件进行合并、picardtools对合并后的bam文件做目标区 域捕获芯片的覆盖度、深度、捕获效率、均一性,可比对序列和碱基的数量等 统计。
[0222]
5.4、单核苷酸突变(snvs)calling:采用samtools对最终的bam生成 mpileup文件,并采用in-house scripts对snvs进行calling。大致原理为:通过 对每一个位点的碱基型进行扫描,得到碱基分布表,再通过过滤条件,找出可 疑的突变;采用annovar对突变结果注释。
[0223]
5.5、短插入/缺失(indels)突变calling:采用in-house scripts对bam文 件中的每一个记录进行扫描,找到所有可疑的缺失和插入;采用annovar对 突变结果注释。
[0224]
5.6、融合:采用in-house scripts对bam进行过滤(过滤掉完全比对的条 目),再从原始fastq reads文件里提取fusion fq reads,采用fusionscan软件对 以上reads做融合分析。
[0225]
5.7、拷贝数变异(cnvs):通过in-house scripts对每个位点的深度统计, 并对背景库做矫正后得到每个区段的相对拷贝数。
[0226]
5.8、结果过滤及注释:通过建立的背景库、突变特征等对以上原始snvs、 indels、fusion、cnvs结果做过滤,得到最终突变结果;如果有对照gdna样 本,会对结果做“体细胞”或“遗传(杂合/纯合)”注释。
[0227]
6、结果解读
[0228]
结果解读主要是解释变异(snv、indel、cnv、融合)与疾病之间的关系, 依据acmg/amp指南把变异分成5类:致病、疑似致病、意义未明、疑似良 性、良性,通过使用内部软件结合人工实现。其中人工处理包括结合受检者临 床表型、家族史和具体研究文献对变异证据进行调整。
[0229]
具体如下:
[0230]
6.1、加载数据库:加载疾病数据库和自定义数据库。
[0231]
6.2、收集变异信息:对输入的变异信息逐个读取基本变异信息、人群变异 频率数据、疾病变异数据、变异功能预测数据以及变异保守性等其他数据信息。
[0232]
6.3、处理解读证据:
[0233]
i)使用收集的变异信息,依次判断每个变异是否满足致病性或者良性证据。 其中致病性证据包括:极强致病的(pvs)、强致病的(ps)、中等致病的(pm)、弱 致病的(pp),良性证据包括:独立良性(ba)、强良性的(bs)、弱良性的(bp)。ii) 组合变异证据,根据acmg/amp
组合规则给每个变异分类:致病、疑似致病、 意义未明、疑似良性、良性。
[0234]
实施例4、本发明基因panel检测临床样本
[0235]
本发明所使用的的基因panel,如下表2所示。
[0236]
表2、本发明所使用的基因panel
[0237][0238][0239]
使用如上所述的方法,用本发明所提及的11个基因panel对35例临床样 本进行检
测之后进行临床诊断。其临床检测结果如表3所示,而基因panel检 测结果如下表4所示。
[0240]
表3、临床检测结果
[0241]
样本编号相关疾病3原发性醛固酮增多症4皮质醇增多症6原发性醛固酮增多症9原发性醛固酮增多症14皮质醇增多症12原发性醛固酮增多症15原发性醛固酮增多症18原发性醛固酮增多症22皮质醇增多症24嗜铬细胞瘤和副神经节瘤28嗜铬细胞瘤和副神经节瘤33嗜铬细胞瘤和副神经节瘤
[0242]
表4、基因panel检测结果
[0243]
[0244][0245]
从上表可以看出,本发明所涉及的基因检测panel均能够在一定程度上辅 助检测相关临床疾病,为医生的及时诊断提供方向,其灵敏度高,漏检率低, 时间短,成本和操作难度低。
[0246]
实施例5、本发明基因panel灵敏度检测
[0247]
选取三个不同突变的标准品,以初始dna投入量为0.1μg进行dna打断 后平行测试3批次0.5%、1%、2%、3%、4%、5%突变频率的标准品,每批次 每个浓度的标准品测试10次,取10次测试的突变频率的平均值,具体数据如 下表5所示。结果显示:不同检测限待测位点均能稳定检出,待检位点总体与 梯度存在线性关系,在投入量为0.1μg的条件下,突变检测下限(分析灵敏度) 为0.5%,表明该检测方法灵敏度高。
[0248]
表5、灵敏度检测
[0249]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。