1.本发明涉及一株可发酵石斛且其发酵液可改善皮肤质量的植物乳杆菌,属于发酵工程领域以及医药技术领域。
背景技术:
2.石斛为兰科石斛属植物,开始记载于《神农本草经》,是我国一味传统的名贵中药,自古以来就有“药中黄金”的美誉。石斛味甘,性微寒,具有益胃生津,滋阴清热的功效。研究表明,石斛中含有的主要活性成分为石斛多糖、石斛碱、氨基酸、芪类及其衍生物以及多种挥发性成分,其具有增强人体免疫能力、缓解身体疲劳、抗氧化、抑制衰老、降低血压、降低血糖、抑制肿瘤细胞等独特功效。
3.研究发现,石斛经过发酵后,其生理活性增强,发酵液中的总糖、还原糖及多糖分子量分布都会发生显著的变化,同时微生物生长过程中还会合成各种对人体有益的酶。在某些条件下,经发酵后的石斛提取液,其抗氧化能力,降血糖能力和调节人体脂肪代谢能力都有不同程度的提升,发酵也极大的改善了石斛在护肤方面的应用价值,而这种护肤作用的提升主要来自于发酵对石斛活性成分的改变。
4.近年来,肠道益生菌被广泛研究,被证明具有绝对安全性和广泛的功效潜能。利用益生菌发酵中药原料,挖掘能够发酵中药,提高发酵后发酵液的活性的菌株和发酵工艺,不但可以节约石斛资源,还可以提高中药的有效性及应用范围。植物乳杆菌是常用于发酵植物源食品的菌种,通过增加抗氧化物质的含量来提高食品的生物活性。
5.皮肤作为保护人体免受外界环境侵袭的屏障,是抵御外界机械、化学、物理及生物等各种刺激的第一道防线。而uv照射或臭氧、苯并芘等污染物诱导细胞产生大量的活性氧(reactive oxygen species,ros),生成脂质过氧化物,诱发氧化应激损伤及炎症反应,打破体内氧化/抗氧化系统平衡,使机体组织衰退、生理功能低下,损伤皮肤屏障,导致皮肤老化。
6.人体内活性氧生成过多,会打破活性氧生成与清除的动态平衡,体内抗氧化系统不能及时清除,导致细胞处于氧化应激状态,过多的自由基损伤细胞内dna,破坏蛋白质和脂质结构,使细胞活力降低、衰老甚至死亡。皮肤如果长期暴露在此状态下,会出现皮肤干燥,皮肤粗糙,色素沉着,皮肤松弛,弹性减少,出现皱纹等。
7.随着人们对皮肤状态,皮肤质量的关注度增加,对护肤产品的需求及更深入的研究也随之增加。健康,绿色的植物提取物也随之称为主流。但是,植物未经发酵直接提取的提取液,在护肤功效方面的效果无明显提升。而利用微生物生长代谢,植物的有效成分通过酵解后,含量有所提升,从而增加了原有功效,或者生成了原本不具有的有效成分,从而产生新的功效。
8.近年来,随着石斛活性物质和功效成分的研究越来越多,石斛在化妆品中的应用逐渐受到重视。但是,目前尚无能有效发酵石斛原料,使其发酵后的发酵液具有显著功效的发酵工艺。因此,利用现代发酵工程技术使发酵过程中限制性因素得到解决,使中药原料得
到充分的开发利用,提高其有效成分,筛选出一株益生菌能够发酵石斛原料,且发酵后的提取液在改善皮肤质量方面具有显著提升,具有重要价值。
技术实现要素:
9.为了得到一种可提高石斛发酵液预防或治疗皮肤抵御衰老能力,且可显著改善皮肤质量的方法,本发明筛选出了一株植物乳杆菌(lactobacillus plantarum)ccfm1188。此植物乳杆菌ccfm1188可发酵石斛,石斛发酵液具有改善皮肤质量的作用,具体体现在:(1)植物乳杆菌ccfm1188在石斛发酵培养基中快速增殖,石斛发酵培养基中的植物乳杆菌增殖超过3.6
×
108cfu/ml;(2)石斛发酵液提高了h2o2诱导的hacat细胞的存活率,且优于石斛原料未发酵和植物乳杆菌ccfm1188发酵液,hacat细胞的存活率分别是石斛原料未发酵液和植物乳杆菌ccfm1188发酵液的1.16倍和1.12倍;(3)石斛发酵液提高了d
‑
半乳糖诱导的hacat细胞的存活率,且优于石斛原料未发酵和植物乳杆菌ccfm1188发酵液,hacat细胞的存活率分别是石斛原料未发酵液和植物乳杆菌ccfm1188发酵液的1.24倍和1.26倍;(4)石斛发酵液显著改善d
‑
半乳糖诱导的hacat细胞氧化损伤程度,且优于石斛原料未发酵和植物乳杆菌ccfm1188发酵液;(5)石斛发酵液能够提高d
‑
半乳糖诱导的hacat细胞的抗氧化能力,且优于石斛原料未发酵和植物乳杆菌ccfm1188发酵液;(6)能抵御d
‑
半乳糖诱导的hacat细胞衰老,对d
‑
半乳糖产生的细胞毒性具有一定的保护作用。因此,植物乳杆菌(lactobacillus plantarum)发酵石斛发酵液在制备预防或治疗皮肤抵御衰老,改善皮肤质量的产品中,具有巨大的应用前景。
10.本发明提供了一株植物乳杆菌(lactobacillus plantarum)ccfm1188,所述植物乳杆菌ccfm1188保藏于广东省微生物菌种保藏中心,其保藏编号为gdmcc no:61730,保藏日期为2021年06月21日,保藏地址为广州市先烈中路100号大院59号楼5楼,广东省微生物研究所。
11.所述植物乳杆菌来源于四川眉山丹棱县的样本,该菌株经测序分析,其16s rdna序列如seq id no.1所示,将测序得到的序列在genebank中进行核酸序列比对,结果显示菌株ccfm1188与植物乳杆菌的相似度为:97.88%,因此,该菌株ccfm1188为植物乳杆菌,命名为植物乳杆菌(lactobacillus plantarum)ccfm1188。
12.所述植物乳杆菌ccfm1188的微生物形态学特征为:圆端直杆菌,单个、成对或短链状;通常缺乏鞭毛,但能运动;革兰氏阳性,不生芽孢。兼性厌氧,表面菌落直径约3mm,凸起,呈圆形,表面光滑,细密,色白,偶尔呈浅黄或深黄色。
13.本发明还提供了上述植物乳杆菌ccfm1188在发酵含有石斛的原料中的应用。
14.本发明还提供了一种石斛发酵液,所述石斛发酵液是将上述植物乳杆菌ccfm1188接种至含有石斛的发酵培养基中进行发酵。
15.在本发明的一种实施方式中,所述植物乳杆菌在石斛发酵培养基中的接种量至少为1.0
×
106cfu/ml。
16.在本发明的一种实施方式中,所述植物乳杆菌在石斛发酵培养基中的接种量为1.0
×
106~1.0
×
107cfu/ml。
17.在本发明的一种实施方式中,所述发酵培养基包括:40~80g/l的石斛,10~40g/l的增殖因子,0.1~0.8g/l的微量元素,0.5~1.5ml/l的吐温;所述增殖因子为酵母浸粉、酵
母提取物、酵母蛋白胨、胰蛋白胨、大豆蛋白胨等其中的一种或多种;所述微量元素为硫酸镁和/或硫酸锰。
18.在本发明的一种实施方式中,所述石斛发酵培养基的初始ph值为5.5~7.0。
19.本发明还提供了一种发酵石斛及提取石斛发酵液的方法,所述方法的具体步骤如下:
20.(1)将上述植物乳杆菌ccfm1188接种至含有石斛的培养基中进行发酵,得到发酵液;
21.(2)将步骤(1)中的发酵液离心去除沉淀,获得石斛发酵上清液;
22.(3)将步骤(2)中的发酵上清液进行灭菌,获得无菌石斛发酵上清液。
23.在本发明的一种实施方式中,步骤(1)中所述石斛原料发酵培养基的组成为干重40~80g/l的石斛,10~40g/l的增殖因子,0.1~0.8g/l的微量元素和0.5~1.5ml/l的吐温。
24.在本发明的一种实施方式中,所述石斛的制备方法为将新鲜或干石斛粉碎至颗粒小于60目。
25.在本发明的一种实施方式中,所述增殖因子为酵母浸粉、酵母提取物、酵母蛋白胨、胰蛋白胨、大豆蛋白胨等其中的一种或多种。
26.在本发明的一种实施方式中,所述微量元素为硫酸镁或硫酸锰的一种或两种。
27.在本发明的一种实施方式中,所述石斛发酵培养基的初始ph值为5.5~7.0。
28.在本发明的一种实施方式中,所述灭菌的条件为温度115
‑
121℃,时间15~20min。
29.在本发明的一种实施方式中,步骤(1)中所述植物乳杆菌在石斛发酵培养基中的接种量为1
×
106~1.0
×
107cfu/ml。
30.在本发明的一种实施方式中,步骤(1)中所述发酵温度为32~38℃。
31.在本发明的一种实施方式中,步骤(1)中所述发酵ph为5.5~7.0。
32.在本发明的一种实施方式中,步骤(1)中所述发酵时间为15~24h。
33.在本发明的一种实施方式中,步骤(2)中所述离心的条件为:6000~10000g,时间为5~20min。
34.在本发明的一种实施方式中,步骤(2)中所述超声处理的条件为:温度25~80℃,超声功率200~500w,时间为10~30min。
35.本发明还提供了一种产品,所述产品包含上述植物乳杆菌ccfm1188,或包含上述石斛发酵液。
36.在本发明的一种实施方式中,所述产品中,植物乳杆菌ccfm1188的添加量至少为1.0
×
106cfu/ml。
37.在本发明的一种实施方式中,所述产品为食品、药品或化妆品。
38.在本发明的一种实施方式中,所述产品为保健品。
39.在本发明的一种实施方式中,所述药品含有植物乳杆菌ccfm1188或上述石斛发酵液、药物载体和/或药用辅料。
40.在本发明的一种实施方式中,所述药物载体包含微囊、微球、纳米粒以及脂质体;所述药用辅料包含赋形剂以及附加剂。
41.在本发明的一种实施方式中,所述食品是含有植物乳杆菌ccfm1188或其发酵代谢
物,或上述石斛发酵液的食品。
42.在本发明的一种实施方式中,所述食品是使用植物乳杆菌ccfm1188或含植物乳杆菌ccfm1188的发酵剂生产得到的乳制品、豆制品或果蔬制品。
43.在本发明的一种实施方式中,所述食品是含有植物乳杆菌ccfm1188的固体饮料。
44.在本发明的一种实施方式中,所述化妆品为护肤品或洗护用品。
45.在本发明的一种实施方式中,所述药品包含涂抹行为药品。
46.在本发明的一种实施方式中,还含有附加剂。
47.在本发明的一种实施方式中,所述附加剂为软膏剂、防腐剂和/或抗氧化剂。
48.在本发明的一种实施方式中,所述涂抹型药品的剂型为膏剂、膜剂或凝胶剂。
49.本发明还提供了上述植物乳杆菌ccfm1188,或上述石斛发酵液在制备预防和/或缓解皮肤衰老,改善皮肤质量的产品中的应用。
50.在本发明的一种实施方式中,所述产品为食品、药品或化妆品。
51.有益效果
52.本发明提供了一株植物乳杆菌(lactobacillus plantarum)ccfm1188,此植物乳杆菌ccfm1188能够发酵石斛,采用本发明的植物乳杆菌ccfm1188发酵得到的石斛发酵液具有改善皮肤质量的作用,具体体现在:
53.(1)该石斛发酵液提高了h2o2诱导的hacat细胞的存活率,且优于石斛原料未发酵和植物乳杆菌ccfm1188发酵液,hacat细胞的存活率分别是石斛原料未发酵液和植物乳杆菌ccfm1188发酵液的1.16倍和1.12倍;
54.(2)该石斛发酵液提高了d
‑
半乳糖诱导的hacat细胞的存活率,且优于石斛原料未发酵和植物乳杆菌ccfm1188发酵液,hacat细胞的存活率分别是石斛原料未发酵液和植物乳杆菌ccfm1188发酵液的1.24倍和1.26倍;
55.(3)该石斛发酵液显著改善d
‑
半乳糖诱导的hacat细胞氧化损伤程度,且优于石斛原料未发酵和植物乳杆菌ccfm1188发酵液;
56.(4)该石斛发酵液能够提高d
‑
半乳糖诱导的hacat细胞的抗氧化能力,且优于石斛原料未发酵和植物乳杆菌ccfm1188发酵液;
57.可见,植物乳杆菌(lactobacillus plantarum)发酵石斛发酵液在制备预防或治疗皮肤质量的产品中,具有巨大的应用前景。
58.生物材料保藏
59.一株植物乳杆菌(lactobacillus plantarum)ccfm1188,分类学命名为lactobacillus plantarum,已于2021年06月21日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:61730,保藏地址为广州市先烈中路100号大院59号楼5楼,广东省微生物研究所。
附图说明
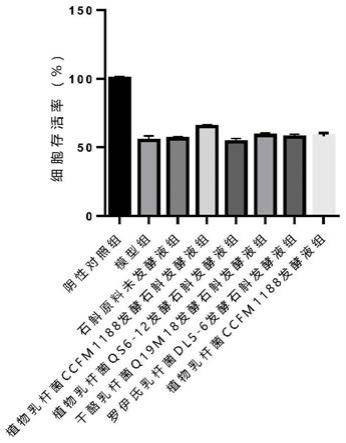
60.图1:不同组别促进h2o2诱导的hacat细胞增殖的效果对比。
61.图2:不同组别促进d
‑
半乳糖诱导的hacat细胞增殖的效果对比。
62.图3:不同组别提高d
‑
半乳糖诱导的hacat细胞t
‑
aoc抗氧化能力的效果对比。
63.图4:不同组别提高d
‑
半乳糖诱导的hacat细胞中sod酶活力水平的效果对比。
64.图5:不同组别提高d
‑
半乳糖诱导的hacat细胞中cat酶活力水平的效果对比。
具体实施方式
65.皮肤覆盖于人体表面,是人体最大的器官之一。皮肤由表皮和真皮两部分组成,其中表皮的关键功能是在生物体和外界之间形成屏障,对人体有重要的保护作用。皮肤角质形成细胞(keratinocytes,kcs)是表皮的主要组成部分,而人永生化皮质形成细胞(hacat细胞)属于成人表皮细胞自发转化而来的细胞系,它与人体正常的角质形成细胞有相同的增殖、分化特性和遗传稳定性,常被用于生物医学领域,作为体外研究的细胞系,比如皮肤修复愈合、防晒和抗衰老等研究。并且,角质形成细胞是研究皮肤氧化损伤重要组成部分。因此,下述实施例中使用经h2o2,d
‑
半乳糖诱导处理的人永生化皮质形成细胞作为氧化损伤细胞模型进行细胞实验。
66.下述实例中涉及的人永生化皮质形成细胞(hacat细胞)购自中国典型培养物保藏中心;下述实例中涉及的dmem培养基购自赛默飞世尔(苏州)仪器有限公司;下述实例中涉及的胎牛血清(fbs)、青霉素、链霉素和胰蛋白酶购自西格玛奥德里奇(上海)贸易有限公司;下述实例中涉及的mtt工作液及维生素c购自北京索莱宝科技有限公司;下述实施例中涉及的t
‑
aoc,sod和cat的试剂盒购自南京森贝伽生物科技有限公司。下述实施例中所涉及的石斛购自北京东方淼森生物科技有限公司。
67.下述实施例中所涉及的植物乳杆菌qs6
‑
12公开于mao bingyong,yin ruimin,li xiaoshu,cui shumao,zhang hao,zhao jianxin,chen wei.comparative genomic analysis of lactiplantibacillus plantarum isolated from different niches.[j].genes,2021,12(2):论文当中,所述干酪乳杆菌q19m18保藏于江南大学食品生物技术中心菌种保藏中心,从青海西宁乳品样本中筛选得到;所述罗伊氏乳杆菌dl5
‑
6由保藏于江南大学食品生物技术中心菌种保藏中心,从云南大理邓川县奶牛样本中筛选得到。
[0068]
下述实施例的计算方法如下:
[0069]
1)活菌数的检测方法:采用国标《gb 4789.35
‑
2016食品安全国家标准食品微生物学检测乳酸菌检测》。
[0070]
2)细胞存活率=(给药组od
‑
空白组od)/(阴性组od
‑
空白组od)
×
100%。
[0071]
3)细胞抑制率=1
‑
细胞存活率。
[0072]
下述实施例中涉及的培养基如下:
[0073]
mrs液体培养基:蛋白胨10g/l、牛肉膏10g/l、葡萄糖20g/l、无水乙酸钠2g/l、酵母粉5g/l、柠檬酸氢二铵2g/l、k2po4·
3h2o 2.6g/l、mgso4·
7h20 0.1g/l、mnso
4 0.05g/l、吐温
‑
80 1ml/l,ph 6.2~6.4。
[0074]
mrs固体培养基:在mrs液体培养基的基础上添加20g/l的琼脂。
[0075]
石斛发酵培养基:石斛40g/l、酵母浸粉10g/l、七水硫酸镁0.58g/l、硫酸锰0.25g/l、吐温80 1ml/l后混合均匀,添加纯净水定容,调节ph值至7.0。
[0076]
完全培养基:5%胎牛血清(fbs)、100u/ml青霉素、100mg/ml链霉素、95%dmem培养基。
[0077]
实施例1:菌株的筛选与鉴定
[0078]
具体步骤如下:
[0079]
1、筛选
[0080]
样本来源于四川眉山丹棱县,将样本经预处理后,在20%甘油中保存于
‑
80℃冰箱,取出解冻后,混匀并吸取0.5ml样本加到4.5ml生理盐水中,以含有9g/l生理盐水进行梯度稀释,选择合适的梯度稀释液涂布在mrs固体培养基上,于37℃培养48h,挑取植物乳杆菌的典型菌落至mrs固体培养基上划线纯化,挑取单菌落转接至mrs液体培养基增菌,30%甘油保藏,得到菌株,命名为ccfm1188;其中,植物乳杆菌的典型菌落直径约3mm,凸起,呈圆形,表面光滑,细密,色白,偶尔呈浅黄或深黄色。
[0081]
2、鉴定
[0082]
提取菌株ccfm1188的基因组,将菌株ccfm1188的16s rdna进行扩增和测序(由苏州金唯智生物科技有限公司进行,ccfm1188的16s rdna核苷酸序列如seq id no.1所示),将该序列在ncbi中进行核酸序列比对,结果显示菌株ccfm1188与植物乳杆菌的相似度为:97.88%,因此,该菌株ccfm1188为植物乳杆菌,命名为植物乳杆菌(lactobacillus plantarum)ccfm1188。
[0083]
实施例2:采用植物乳杆菌发酵石斛制备得到的石斛发酵液
[0084]
具体步骤如下:
[0085]
1、菌株的活化与培养
[0086]
(1)将所有容器和工具灭菌。
[0087]
(2)取菌种ccfm1188保藏管震荡均匀后用无菌接种环蘸取少量菌液在mrs固体培养基划线纯化。静置一段时间后,将平板倒置于37℃恒温培养箱中48h。培养结束后挑取单菌落接种于5ml的mrs液体培养基中,静置于37℃恒温培养箱中培养12~18h。即得菌株ccfm1188的活化液,将制备得到的活化液按照上述方法连续活化两代,每次接种量均为2%(v/v);制备得到经活化后的种子液。
[0088]
2、植物乳杆菌ccfm1188发酵石斛发酵液的制备
[0089]
(1)配制石斛发酵培养基:40g/l石斛、10g/l的酵母浸粉、0.58g/l的七水硫酸镁、0.25g/l的硫酸锰和1ml/l的吐温80后混合均匀,添加纯净水定容,调节ph值至7.0,于115℃条件下加热20min灭菌;
[0090]
(2)将步骤(1)中灭过菌的石斛发酵培养基冷却到40℃以下,于无菌环境下,在石斛发酵培养基中以终浓度为1
×
106cfu/ml的添加量加入步骤1中制备得到的植物乳杆菌ccfm1188种子液,在温度37℃,ph值为7.0条件下恒温恒ph发酵15~16h,此时,活菌数达到3.6
×
108cfu/ml;继续发酵至24h,达到发酵终点,获得含有石斛的发酵液,其中植物乳杆菌ccfm1188的活菌数为:8.6
×
108cfu/ml。
[0091]
(3)将步骤(2)中的含有石斛的发酵液在超声清洗机中以500w功率,80℃,超声10min后,8000g离心5min,离心除掉菌体和石斛发酵液的残渣,得到含有石斛的发酵上清液。将含有石斛的发酵上清液于115℃条件下加热20min灭菌,得到无菌的石斛发酵上清液,此时,石斛发酵液中不含有植物乳杆菌活菌。
[0092]
对照:
[0093]
将不采用植物乳杆菌发酵的含有石斛的发酵液命名为石斛原料未发酵液,制备方法如下:
[0094]
(1)配制石斛原料未发酵液:40g/l石斛、10g/l的酵母浸粉、0.58g/l的七水硫酸
镁、0.25g/l的硫酸锰和1ml/l的吐温80后混合均匀,添加纯净水定容,调节ph值至7.0,于115℃条件下加热20min灭菌;
[0095]
(2)将步骤(1)中的含有石斛的发酵液在超声清洗机中以500w功率,80℃,超声10min后,8000g离心5min,离心除掉石斛原料未发酵液的残渣,得到含有石斛的上清液。将含有石斛的上清液于115℃条件下加热20min灭菌,得到无菌的石斛上清液,此时,石斛未发酵液中不含有活菌。
[0096]
3、植物乳杆菌ccfm1188发酵液的制备
[0097]
(1)配制植物乳杆菌ccfm1188的发酵培养基:蛋白胨10g/l、牛肉膏10g/l、葡萄糖20g/l、无水乙酸钠2g/l、酵母粉5g/l、柠檬酸氢二铵2g/l、k2po4·
3h2o 2.6g/l、mgso4·
7h20 0.1g/l、mnso
4 0.05g/l、吐温80 1ml/l,ph 6.2~6.4,于115℃条件下加热20min灭菌;
[0098]
(2)将步骤(1)中灭过菌的植物乳杆菌ccfm1188的发酵培养基冷却至40℃以下,于无菌环境下,在植物乳杆菌ccfm1188的发酵培养基中以终浓度为1
×
106cfu/ml的添加量加入步骤1中制备得到的植物乳杆菌ccfm1188种子液,在温度37℃的恒温培养箱中发酵12~18h,此时,活菌数达到3.6
×
108cfu/ml,得到菌液;
[0099]
(3)植物乳杆菌ccfm1188发酵液:取步骤(2)制备得到的菌液在8000rpm条件下离心15min后,取上清,调节ph至7.2~7.4;0.22μm一次性滤器过滤除菌,分装后于
‑
20℃冰箱保存。
[0100]
实施例3:植物乳杆菌发酵石斛发酵液对h2o2诱导的hacat细胞存活的影响
[0101]
具体步骤如下:
[0102]
1、细胞培养
[0103]
将冻存的hacat细胞37℃复温后,1000rpm离心5min,取沉淀;将沉淀用完全培养基洗涤一次后,用完全培养基重悬细胞,得到细胞重悬液;将细胞重悬液接种至10cm培养皿,于37℃、气相含5%(v/v)co2的细胞培养箱中培养,次日更换完全培养基继续于37℃、气相含5%(v/v)co2的细胞培养箱中培养。细胞生长至培养皿的70%~80%密度时进行传代培养,培养方法为:37℃、气相含5%(v/v)co2的细胞培养箱中培养。
[0104]
选取生长状态良好的hacat细胞,将hacat细胞经浓度为2.5g/l的胰蛋白酶消化后离心、用完全培养基重悬,进行细胞计数,得到细胞重悬液;将细胞重悬液按照5
×
103个/孔接种于96孔培养板中,每孔100μl,将96孔培养板置于37℃、气相含5%(v/v)co2的细胞培养箱中培养24h;更换含500μm h2o2的完全培养基处理细胞2h,后扣掉培养基。
[0105]
2、不同发酵液的制备:
[0106]
植物乳杆菌ccfm1188发酵石斛发酵液组:按照实施例2的方法制备得到植物乳杆菌ccfm1188发酵石斛发酵液;
[0107]
植物乳杆菌qs6
‑
12发酵石斛发酵液组:按照实施例2的方法,区别在于,调整植物乳杆菌ccfm1188为植物乳杆菌qs6
‑
12,制备得到植物乳杆菌qs6
‑
12发酵石斛发酵液;
[0108]
干酪乳杆菌q19m18发酵石斛发酵液组,按照实施例2的方法,区别在于,调整植物乳杆菌ccfm1188为干酪乳杆菌q19m18,制备得到干酪乳杆菌q19m18发酵石斛发酵液;
[0109]
罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组,按照实施例2的方法,区别在于,调整植物乳杆菌ccfm1188为罗伊氏乳杆菌dl5
‑
6,制备得到罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液;
[0110]
石斛原料未发酵液组:按照实施例2中对照的方法制备得到的石斛原料未发酵液
组;
[0111]
植物乳杆菌ccfm1188发酵液组:按照实施例2的方法制备得到植物乳杆菌ccfm1188发酵液组。
[0112]
3、不同的发酵液对hacat细胞存活率的影响
[0113]
(1)各个组别分别如下:
[0114]
空白对照组:只含mtt工作液,无细胞作为空白对照组;
[0115]
阴性对照组:步骤1中未经h2o2处理过的细胞作为阴性对照组;
[0116]
模型组:步骤1中经h2o2处理过2h的细胞作为模型组;
[0117]
(2)不同乳杆菌发酵石斛发酵液组的制备方法:
[0118]
分别将步骤2制备得到的石斛原料未发酵液、植物乳杆菌ccfm1188发酵液、植物乳杆菌ccfm1188发酵石斛发酵液、植物乳杆菌qs6
‑
12发酵石斛发酵液、干酪乳杆菌q19m18发酵石斛发酵液、罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液的上清与完全培养基按照体积比为0.05%:99.5%的比例进行混合,分别制备得到混合液;
[0119]
(3)混合后,向步骤1中含有经h2o2处理过的hacat细胞96孔板中,每孔添加100μl的步骤(2)中制备得到的混合液,并培养48h;
[0120]
阴性对照组与模型组分别添加100μl的完全培养基,培养48h;
[0121]
各组培养条件均为:37℃、气相含5%(v/v)co2的细胞培养箱中培养。
[0122]
每组设置5个复孔,mtt法检测细胞存活率。
[0123]
结果如表1及图1所示。
[0124]
表1:不同菌株发酵石斛发酵液对h2o2诱导的hacat细胞存活的影响
[0125]
组别细胞存活率(%)阴性对照组100.00
±
1.67模型组55.09
±
3.28石斛原料未发酵液组56.30
±
1.68植物乳杆菌ccfm1188发酵液组58.26
±
2.13植物乳杆菌ccfm1188发酵石斛发酵液组65.04
±
1.40植物乳杆菌qs6
‑
12发酵石斛发酵液组54.03
±
2.23干酪乳杆菌q19m18发酵石斛发酵液组58.65
±
1.74罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组57.46
±
2.18
[0126]
由图1及表1可知,以阴性对照组增殖存活率为100.00%,模型组增殖存活率为55.09%,石斛原料未发酵液组存活率为56.30%,植物乳杆菌ccfm1188发酵液组存活率为58.26%,而植物乳杆菌ccfm1188发酵石斛发酵液组存活率为65.04%,是模型组存活率的1.18倍,是石斛原料未发酵液组存活率的1.16倍,是植物乳杆菌ccfm1188发酵液组存活率的1.12倍,显著促进了细胞的增殖(p<0.001)。植物乳杆菌qs6
‑
12发酵石斛发酵液组存活率为54.03%,干酪乳杆菌q19m18发酵石斛发酵液组存活率为58.65%,罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组存活率为57.46%。
[0127]
可见,相比于石斛原料未发酵液组,植物乳杆菌ccfm1188发酵液组,植物乳杆菌qs6
‑
12发酵石斛发酵液组,干酪乳杆菌q19m18发酵石斛发酵液组,罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组,植物乳杆菌ccfm1188发酵石斛发酵液更能够显著促进hacat细胞生长,缓解
细胞氧化损伤。
[0128]
实施例4:植物乳杆菌发酵石斛发酵液对d
‑
半乳糖诱导的hacat细胞存活的影响
[0129]
具体步骤如下:
[0130]
1、细胞培养
[0131]
将冻存的hacat细胞37℃复温后,1000rpm离心5min,取沉淀;将沉淀用完全培养基洗涤一次后,用完全培养基重悬细胞并计数,得到细胞重悬液;将细胞重悬液接种至10cm培养皿,于37℃、气相含5%(v/v)co2的细胞培养箱中培养,次日更换完全培养基继续于37℃、气相含5%(v/v)co2的细胞培养箱中培养。细胞生长至培养皿的70%~80%密度时进行传代培养,培养方法为:37℃、气相含5%(v/v)co2的细胞培养箱中培养。
[0132]
选取生长状态良好的hacat细胞,将hacat细胞经浓度为2.5g/l的胰蛋白酶消化后离心、用完全培养基重悬,进行细胞计数,得到细胞重悬液;将细胞重悬液按照5
×
103个/孔接种于96孔培养板中,每孔100μl;将96孔培养板置于37℃、气相含5%(v/v)co2的细胞培养箱中培养24h;更换含30g/l d
‑
半乳糖的完全培养基处理细胞24h。
[0133]
2、不同发酵液的制备:
[0134]
按照实施例3步骤2的方法,分别制备得到植物乳杆菌ccfm1188发酵石斛发酵液组,植物乳杆菌qs6
‑
12发酵石斛发酵液组,干酪乳杆菌q19m18发酵石斛发酵液组,罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组;石斛原料未发酵液组;植物乳杆菌ccfm1188发酵液组。
[0135]
3、不同的发酵液对hacat细胞存活率的影响
[0136]
(1)各个组别分别如下:
[0137]
空白对照组:只含mtt工作液,无细胞作为空白对照组;
[0138]
阴性对照组:未经d
‑
半乳糖处理过的细胞作为阴性对照组;
[0139]
模型组:经d
‑
半乳糖处理过的细胞作为模型组;
[0140]
(2)不同乳杆菌发酵石斛发酵液组的制备方法:
[0141]
分别将步骤2石斛原料未发酵液、植物乳杆菌ccfm1188发酵液、植物乳杆菌ccfm1188发酵石斛发酵液、植物乳杆菌qs6
‑
12发酵石斛发酵液、干酪乳杆菌q19m18发酵石斛发酵液、罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液的上清与完全培养基按照体积比为10%:90%的比例进行混合,分别制备得到混合液;
[0142]
(3)混合后,向步骤1中经d
‑
半乳糖处理过的hacat细胞96孔板中,每孔添加100μl的步骤(2)中制备得到的混合液,并培养24h;
[0143]
阴性对照组和模型组添加100μl的完全培养基,培养24h;
[0144]
每组设置5个复孔,mtt法检测细胞存活率。
[0145]
各组培养条件均为:37℃、气相含5%(v/v)co2的细胞培养箱中培养,结果表2及图2所示。
[0146]
表2:不同菌株发酵石斛发酵液对d
‑
半乳糖诱导的hacat细胞存活的影响
[0147]
组别细胞存活率(%)阴性对照组100.00
±
0.00模型组63.04
±
0.70石斛原料未发酵液组67.43
±
0.85植物乳杆菌ccfm1188发酵液组66.15
±
0.91
植物乳杆菌ccfm1188发酵石斛发酵液组83.52
±
0.96植物乳杆菌qs6
‑
12发酵石斛发酵液组62.94
±
1.38干酪乳杆菌q19m18发酵石斛发酵液组58.87
±
0.71罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组64.45
±
1.10
[0148]
由图2表2可知,以阴性对照组增殖存活率为100.00%,模型组增殖存活率为63.04%,石斛原料未发酵液组存活率为67.43%,植物乳杆菌ccfm1188发酵液组存活率为66.15%,而植物乳杆菌ccfm1188发酵石斛发酵液组存活率为83.52%,是模型组存活率的1.32倍,是石斛原料未发酵液组存活率的1.24倍,是植物乳杆菌ccfm1188发酵液组存活率的1.26倍,显著促进了细胞的增殖(p<0.001)。植物乳杆菌qs6
‑
12发酵石斛发酵液组存活率为62.94%,干酪乳杆菌q19m18发酵石斛发酵液组存活率为58.87%,罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组存活率为64.45%。
[0149]
可见,相比于石斛未发酵液组,植物乳杆菌ccfm1188发酵液组,植物乳杆菌qs6
‑
12发酵石斛发酵液组,干酪乳杆菌q19m18发酵石斛发酵液组,罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组,植物乳杆菌ccfm1188发酵石斛发酵液更能够显著促进hacat细胞生长,缓解细胞氧化损伤。
[0150]
实施例5:植物乳杆菌发酵石斛发酵液对d
‑
半乳糖诱导的hacat细胞t
‑
aoc抗氧化能力影响
[0151]
具体步骤同实施例4,分别将实施例4中步骤3制备得到的各组hacat细胞(同时,增设阳性对照组,详见具体步骤)进行t
‑
aoc抗氧化能力检测,t
‑
aoc法又称abts法。abts
是一种能够相对稳定存在于水溶液中的自由基,其可以通过电子转移被清除。由于不易受外界因素干扰,abts
法能够较为准确地体现样品的抗氧化活性。
[0152]
具体步骤如下:
[0153]
增设阳性对照组:
[0154]
将维生素c与完全培养基按照体积比为5%:95%的比例进行混合,制备得到混合液;混合后,向按照实施例4步骤1的方法制备得到的经d
‑
半乳糖处理过的hacat细胞96孔板中,添加100μl上述混合液,并培养24h;培养条件:37℃、气相含5%(v/v)co2的细胞培养箱中培养。
[0155]
分别采用pbs溶液洗涤各个组别(包括上述阳性对照组)得到的细胞两次,然后分别将细胞刮入pbs溶液中,在4℃、12000g条件下超声离心5min,以充分破碎细胞并释放胞内物,取上清液,
‑
80℃保存。t
‑
aoc抗氧化能力检测使用测定试剂盒进行测定,结果表3及图3所示。
[0156]
表3:不同菌株发酵得到的石斛发酵液对细胞的抗氧化能力的影响
[0157]
组别t
‑
aoc(单位:u/ml)阴性对照组4.59
±
0.05阳性对照组22.38
±
0.23石斛原料未发酵液组9.95
±
0.06植物乳杆菌ccfm1188发酵液组10.26
±
0.08植物乳杆菌ccfm1188发酵石斛发酵液组23.82
±
0.12植物乳杆菌qs6
‑
12发酵石斛发酵液组12.24
±
0.07
干酪乳杆菌q19m18发酵石斛发酵液组5.94
±
0.07罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组5.88
±
0.02
[0158]
由图3及表3可知,植物乳杆菌ccfm1188发酵石斛发酵液能够提高细胞的抗氧化能力(p<0.001),植物乳杆菌ccfm1188发酵石斛发酵液对abts
自由基的清除效果高于阳性对照组,是石斛原料未发酵液组抗氧化能力的2.39倍,是植物乳杆菌ccfm1188发酵液组抗氧化能力的2.32倍。而植物乳杆菌qs6
‑
12发酵石斛发酵液、干酪乳杆菌q19m18发酵石斛发酵液、罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液并没有显著提高细胞的抗氧化能力。
[0159]
因此,植物乳杆菌ccfm1188发酵石斛发酵液具有良好的抗氧化效果,同时能以抗氧化的方式来保护hacat细胞衰老。
[0160]
实施例6:植物乳杆菌发酵石斛发酵液对d
‑
半乳糖诱导的hacat细胞sod酶活力水平的影响
[0161]
具体步骤同实施例4,分别将实施例4中步骤3制备得到的各组hacat细胞(同时,增设阳性对照组,详见具体步骤)进行胞内sod酶活检测,具体步骤如下:
[0162]
增设阳性对照组:
[0163]
将维生素c与完全培养基按照体积比为5%:95%的比例进行混合,制备得到混合液;混合后,向按照实施例4步骤1的方法制备得到的经d
‑
半乳糖处理过的hacat细胞96孔板中,添加100μl上述混合液,并培养24h;培养条件:37℃、气相含5%(v/v)co2的细胞培养箱中培养。
[0164]
分别采用pbs溶液洗涤各个组别(包括上述阳性对照组)得到的细胞两次,然后分别将细胞刮入pbs溶液中,在4℃、12000g条件下超声离心5min,以充分破碎细胞并释放胞内物,取上清液进行胞内sod酶活检测。sod使用测定试剂盒进行测定。结果表4及图4所示:
[0165]
表4:不同菌株发酵得到的石斛发酵液对细胞的sod酶活力水平的影响
[0166]
组别sod(单位:u/l)阴性对照组70.99
±
10.53阳性对照组816.67
±
3.70石斛原料未发酵液组218.37
±
2.21植物乳杆菌ccfm1188发酵液组240.62
±
3.58植物乳杆菌ccfm1188发酵石斛发酵液组749.38
±
9.13植物乳杆菌qs6
‑
12发酵石斛发酵液组245.68
±
2.14干酪乳杆菌q19m18发酵石斛发酵液组169.75
±
4.66罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组108.21
±
3.62
[0167]
由图4及表4可知,正常hacat细胞的sod酶活力为70.99u/l。加入石斛未发酵液、植物乳杆菌ccfm1188发酵液、植物乳杆菌ccfm1188发酵石斛发酵液、植物乳杆菌qs6
‑
12发酵石斛发酵液、干酪乳杆菌q19m18发酵石斛发酵液、罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液分别处理24h后,sod酶活力分别为218.37、240.62、749.38、245.68、169.75、108.21u/l,从数据分析结果可知,植物乳杆菌ccfm1188发酵石斛发酵液加入细胞培养24h后,其sod酶活力相比正常hacat细胞提高了10.56倍,较石斛未发酵液提高了3.43倍,较植物乳杆菌ccfm1188提高了3.11倍,细胞的抗氧化酶活力提高后,进一步检验了其抗氧化能力,也验证了其抗衰老能力,而植物乳杆菌qs6
‑
12发酵石斛发酵液、干酪乳杆菌q19m18发酵石斛发酵液、罗伊氏
乳杆菌dl5
‑
6发酵石斛发酵液并没有明显提高细胞sod酶活力。
[0168]
实施例7:植物乳杆菌发酵石斛发酵液对d
‑
半乳糖诱导的hacat细胞cat酶活力水平的影响
[0169]
具体步骤同实施例4,分别将实施例4中步骤3制备得到的各组hacat细胞(同时,增设阳性对照组,详见具体步骤)进行cat酶活力检测,具体步骤如下:
[0170]
增设阳性对照组:
[0171]
将维生素c与完全培养基按照体积比为5%:95%的比例进行混合,制备得到混合液;混合后,向按照实施例4步骤1的方法制备得到的经d
‑
半乳糖处理过的hacat细胞96孔板中,添加100μl上述混合液,并培养24h;培养条件:37℃、气相含5%(v/v)co2的细胞培养箱中培养。
[0172]
分别采用pbs溶液洗涤各个组别(包括上述阳性对照组)得到的细胞两次,然后分别将细胞刮入pbs溶液中,在4℃、12000g条件下超声离心5min,以充分破碎细胞并释放其中氧化物质,取上清液进行cat酶活力检测。cat使用测定试剂盒进行测定。结果表5所示:
[0173]
表5:不同菌株发酵得到的石斛发酵液对细胞的cat酶活力水平的影响
[0174]
组别cat(单位:u/l)阴性对照组99.84
±
4.25阳性对照组355.01
±
3.56石斛原料未发酵液组137.62
±
1.66植物乳杆菌ccfm1188发酵液组144.32
±
2.01植物乳杆菌ccfm1188发酵石斛发酵液组345.48
±
2.87植物乳杆菌qs6
‑
12发酵石斛发酵液组155.67
±
0.85干酪乳杆菌q19m18发酵石斛发酵液组89.66
±
2.61罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液组85.62
±
3.26
[0175]
由图5及表5可知,正常hacat细胞的cat酶活力为99.84u/l。加入石斛原料未发酵液、植物乳杆菌ccfm1188发酵液、植物乳杆菌ccfm1188发酵石斛发酵液、植物乳杆菌qs6
‑
12发酵石斛发酵液、干酪乳杆菌q19m18发酵石斛发酵液、罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液分别处理24h后,cat酶活力分别为137.62、144.32、345.48、155.67、89.66、85.62u/l,从数据分析结果可知,植物乳杆菌ccfm1188发酵石斛发酵液加入细胞培养24h后,其cat酶活力相比正常hacat细胞提高了3.46倍,较石斛未发酵液提高了2.51倍,较植物乳杆菌ccfm1188发酵液提高了2.39倍,细胞的抗氧化酶活力提高后,进一步检验了其抗氧化能力,也验证了其抗衰老能力,而植物乳杆菌qs6
‑
12发酵石斛发酵液、干酪乳杆菌q19m18发酵石斛发酵液、罗伊氏乳杆菌dl5
‑
6发酵石斛发酵液并没有明显提高细胞cat酶活力。
[0176]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。