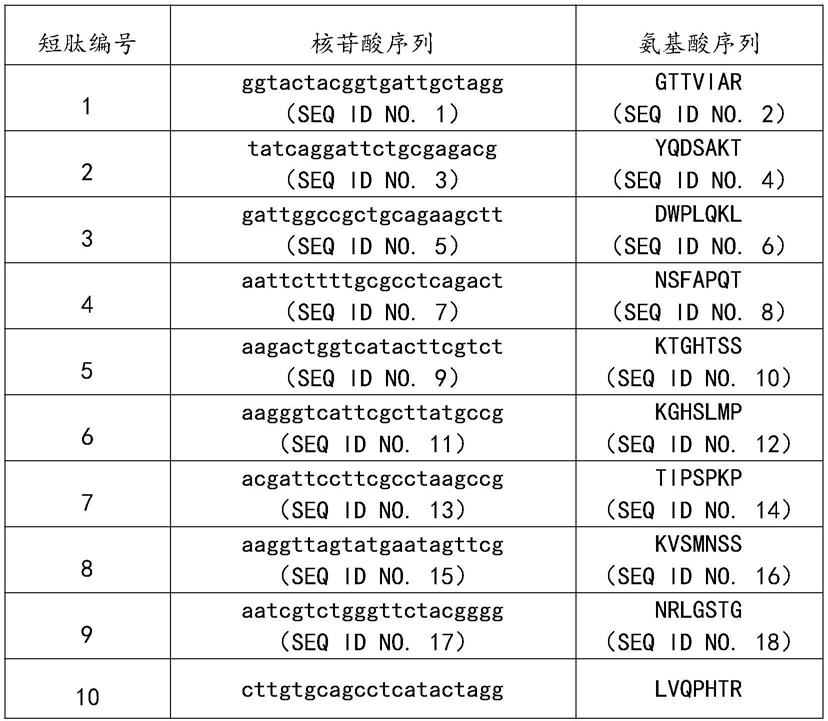
1.本发明涉及白细胞介素2基因启动子,尤其是涉及大黄鱼白细胞介素2基因启动子序列及其应用。
背景技术:
2.白细胞介素2(interleukin,il-2)是一种多效性细胞因子,可调节cd4
t淋巴细胞的发育和分化、促进b淋巴细胞增殖和抗体产生,被认为在调控抗病原感染的免疫应答中发挥重要作用(gaffen s,liu kd,overview of interleukin-2function,production and clinicalapplications[j],2004,cytokine,28(3):109-123)。在前期研究中,从大黄鱼脾脏组织中克隆大黄鱼白细胞介素2基因(il-2)的全长cdna序列,在毕赤酵母中完成其去信号肽片段的重组表达与纯化,证实其可在大黄鱼体内诱导大黄鱼脾脏、肾脏中与t淋巴细胞发育与分化相关的细胞因子及转录因子表达上调,说明大黄鱼il-2可能参与t淋巴细胞的发育与分化(mu p,wang y,ao j,et al.molecular cloning and bioactivity of an il-2homologue in large yellow croaker(larimichthyscrocea)[j].fish shellfish immunology.2018,81:309-317)。在此基础上,为研究大黄鱼il-2基因的表达调控机制,从大黄鱼基因组中进一步克隆il-2基因的5’侧翼启动子序列,经报告基因检测实验证实该启动子序列具有较强的启动子活性。免疫刺激物lps、poly(i:c)对其活性影响不大,但t细胞活化剂pha、con-a、ci、pma等可刺激il-2基因启动子活性显著上调。大黄鱼il-2启动子序列的克隆和活性验证,在理论上将为研究il-2基因的表达调控机理提供良好的实验系统,在应用方面为利用该启动子构建表达载体高效表达外源基因或将其应用于转基因鱼构建创造条件,具有重要的理论和实际意义。
技术实现要素:
[0003]
本发明的第一目的在于提供大黄鱼il-2基因启动子的序列。
[0004]
本发明的第二目的在于提供一种大黄鱼il-2基因启动子的活性分析方法。
[0005]
本发明的第三目的在于提供一种大黄鱼il-2基因启动子的应用。
[0006]
所述大黄鱼il-2基因启动子的序列为:
[0007][0008]
所述一种大黄鱼il-2基因启动子的活性分析方法包括以下步骤:
[0009]
1)采用clontech绿色荧光蛋白表达系统对该启动子活性进行定性分析,采用promega公司双荧光素酶报告基因检测系统对该启动子活性进行定量分析,并分析免疫刺激物大肠杆菌脂多糖lps、人工合成双链rna poly(i:c)以及t细胞活化剂植物凝集素pha、刀豆蛋白con-a、钙离子霉素ci、佛波酯pma等对其活性的影响;
[0010]
2)将大黄鱼il-2基因启动子区片段插入clontech公司绿色荧光蛋白报告基因载体pegfp1中,使绿色荧光蛋白基因位于该启动子的控制下,得到重组表达载体pegfp1-il2p,将该重组载体转染鲤鱼上皮瘤细胞(epc)中,45~50h后在荧光显微镜下观察绿色荧光蛋白的表达情况;
[0011]
3)将大黄鱼il-2基因启动子序列插入promega公司荧光素酶报告基因载体pgl3-basic中,使萤火虫荧光素酶基因位于该启动子的控制下,得到重组表达载体pgl3-il2p;用pgl3-il2p和海肾荧光素酶报告基因载体prl-tk共转染鲤鱼epc细胞,45~50h后收集转染细胞;利用双荧光素酶报告基因检测系统分别检测萤火虫荧光素酶和海肾荧光素酶的酶活性值,通过计算二者酶活性值的比值得出转染细胞中荧光素酶的相对活性;
[0012]
4)以空载体pgl3-basic和海肾荧光素酶报告基因载体prl-tk共转染人jurkat-t细胞的荧光素酶相对活性作为对照,计算出该启动子的相对活性;再用pbs、lps、poly(i:c)、pha、con-a、ci、pma及ci pma刺激pgl3-il2p和prl-tk共转染的jurkat-t细胞,通过分析各处理组荧光素酶相对活性的变化,确定大黄鱼il-2基因启动子的活性是否受刺激物诱导的影响。
[0013]
所述大黄鱼il-2基因启动子的克隆及其启动子活性的鉴定,可在构建大黄鱼il-2基因的表达调控机制实验系统中应用。
[0014]
所述大黄鱼il-2基因启动子可用于构建重组真核表达载体在鱼类或哺乳类细胞中高效表达外源基因中应用。
[0015]
所述大黄鱼il-2基因启动子可在构建转基因鱼中应用。
[0016]
本发明具有以下突出优点和技术效果:
[0017]
本发明采用基因组步移的方法从大黄鱼基因组中扩增克隆大黄鱼il-2基因启动子,提供大黄鱼il-2基因启动子序列,并证实其启动子活性;经报告基因分析实验证明该大
黄鱼il-2基因启动子可在鲤鱼上皮瘤细胞epc中启动绿色荧光蛋白和萤火虫荧光素酶基因的表达;该启动子在人jurkat-t细胞中可被t细胞活化剂pha、con-a、ci及pma诱导激活,但不能被免疫刺激剂lps及poly(i:c)诱导激活。因此,该大黄鱼il-2基因启动子的克隆及其强启动子活性的鉴定,在理论上将为研究大黄鱼il-2基因的表达调控机制提供良好的实验系统,在应用方面为利用该启动子构建重组表达载体高效表达外源基因或将该启动子应用于转基因鱼构建创造条件,具有重要的理论和实际意义。
附图说明
[0018]
图1为采用绿色荧光蛋白表达系统定性分析大黄鱼il-2基因启动子的活性。将重组表达载体pegfp1-il2p转染鲤鱼上皮瘤epc细胞,48h后观察绿色荧光蛋白表达情况。green表示荧光显微镜观察结果,bright表示光学显微镜观察结果。上图放大倍数100倍(100
×
),下图放大倍数200倍(200
×
)。
[0019]
图2为采用双荧光素酶报告基因检测系统定量分析大黄鱼il-2基因启动子的活性。图中pgl3-basic表示空载体pgl3-basic转染epc细胞的荧光素酶相对活性(作为对照);pgl3-il2p表示重组载体pgl3-il2p转染epc细胞的荧光素酶相对活性。如图2所示,重组载体pgl3-il2p转染epc细胞中的荧光素酶相对活性为空载体pgl3-basic转染epc细胞的3.15倍,说明大黄鱼il-2基因启动子可以较好地启动荧光素酶报告基因的转录。每个实验设3次重复,每次重复设3个平行。误差靶代表平均值的标准差。
[0020]
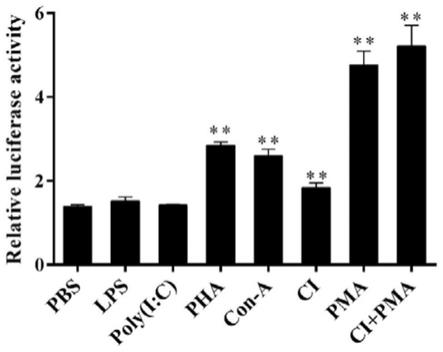
图3为jurkat-t细胞在不同免疫刺激或t细胞活化剂的刺激下大黄鱼il-2基因启动子的活性变化。将含大黄鱼il-2启动子序列的重组载体pgl3-pil2转染至jurkat t(e62)细胞,以海肾荧光素酶报告质粒prl-tk作为内参,转染12h后向细胞培养液中分别加入pbs以及终浓度为50μg/mllps、50μg/mlpoly(i:c)、10μg/ml pha、10μg/ml con-a、1μg/ml ci、0.1μg/mlpma或1μg/ml ci 0.1μg/mlpma,再过24h后收取细胞检测大黄鱼il-2启动子活性。结果显示,经lps或poly(i:c)刺激后,大黄鱼il-2启动子活性无明显变化,而pha、con-a、ci、pma等t细胞活化剂则可分别诱导大黄鱼il-2启动子活性上调2.8倍、2.6倍、1.8倍和4.8倍,ci和pma共同刺激可诱导启动子活性上调5.2倍。每个实验设3次重复,每次重复设3个平行。误差靶代表平均值的标准差。**代表p<0.01。
具体实施方式
[0021]
以下实施例将结合附图对本发明作进一步的说明。
[0022]
1.大黄鱼il-2基因启动子的克隆
[0023]
1.1采用clontech公司的genomewalker universal kit试剂盒分别构建4种限制性内切酶的大黄鱼基因组单酶切文库,所用的4种dna核酸内切酶为drai、ecorv、pvuii和stui。
[0024]
具体操作为:
[0025]
1.1.1基因组纯度分析。
[0026]
①
取1μl大黄鱼基因组dna在0.6%的琼脂糖凝胶上电泳。
[0027]
②
用核酸内切酶dra i试酶切,反应体系为:
[0028][0029]
1.1.2基因组酶切消化。
[0030]
①
标记5个1.5ml的离心管d1、d2、d3、d4和一个阳性对照。
[0031]
②
各内切酶酶切体系组分包括:
[0032][0033]
③
低速涡旋5~10s并瞬时离心,37℃酶切过夜。
[0034]
1.1.3基因组dna纯化。
[0035]
①
在上述每一个反应管中加入等体积的苯酚。
[0036]
②
低速涡旋5~10s并瞬时离心。
[0037]
③
把上层水相转移至另外一个1.5ml离心管中,并加入等体积的氯仿。
[0038]
④
低速涡旋5~10s并瞬时离心,转移上层水相至一新的离心管中,并向水相加入2倍体积预冷的95%乙醇,1/10体积的乙酸钠(ph4.5)和20μg的糖苷。
[0039]
⑤
低速涡旋5~10s并在4℃条件下以14000r/min离心15min。
[0040]
⑥
弃上清并用100μl预冷的80%乙醇洗涤,然后在4℃条件下以14000r/min离心10min。
[0041]
⑦
弃上清并在空气中干燥后用20μl te缓冲液(ph7.5)溶解。
[0042]
1.1.4接头adaptor连接到经上述4种限制性内切酶分别消化的基因组片段上。
[0043][0044]
②
连接条件:16℃过夜连接
[0045]
③
终止连接条件:70℃5min。
[0046]
④
每管加入75μl te缓冲液(ph7.5),即获得4种限制性内切酶的大黄鱼基因组单酶切文库,用于启动子的克隆。
[0047]
1.2采用两轮降落pcr方法扩增出大黄鱼il-2基因启动子序列,具体步骤按genome walker universal kit试剂盒说明书进行。具体步骤如下:
[0048]
1.2.1第一轮降落pcr反应体系:
[0049][0050]
1.2.2第二轮降落pcr:分别以第一轮pcr产物为模板,利用巢式接头引物ap2和基因特异引物gsp2进行,其他成分和反应体系与第一轮相同。
[0051][0052][0053]
1.3扩增得到的pcr产物连接到takara公司pmd18t-simple vector载体进行序列测定与组装,从而获得该大黄鱼il-2基因启动子序列。
[0054]
2.大黄鱼il-2基因启动子的活性分析
[0055]
2.1含大黄鱼il-2基因启动子片段的重组表达载体pegfp-il2p的构建,将大黄鱼il-2基因启动子片段插入clontech公司绿色荧光蛋白报告基因载体pefgfp-1中,使绿色荧光蛋白基因的表达受il-2启动子控制,构建得到的重组载体命名为pefgfp1-il2p。具体步骤:
[0056]
①
合成带有xho i酶切位点的正向引物:5'-gctcgagaactaaacttgtgctg-3',
[0057]
带有hind iii酶切位点的反向引物:5'-aagcttcatattcagc tggaaggctt-3'。
[0058]
②
用takara公司高保真taq酶hs dna polymerase进行pcr扩增。pcr反应体系为:
[0059][0060]
pcr反应程序如下:
[0061][0062]
返回至第2步,35个循环
[0063]
5.72℃
ꢀꢀꢀꢀ
10min
[0064]
6.4℃
ꢀꢀꢀꢀꢀ
暂停反应
[0065]
③
在1%琼脂糖凝胶上进行电泳,用omega公司胶回收试剂盒进行pcr产物回收。
[0066]
④
回收后的pcr产物和载体pegfp1分别按照下列酶切体系进行xho i/hind iii双酶切:
[0067][0068]
⑤
用omega公司胶回收试剂盒分别回收上述经xho i/hind iii双酶切的pcr产物和载体pegfp-1,并用takara公司t4 dna连接酶按以下连接体系于16℃进行连接过夜:
[0069][0070]
⑥
上述连接产物转化大肠杆菌e.coli dh5α感受态细胞,经菌落pcr筛选阳性克隆,用omega公司小量质粒试剂盒提取质粒,经测序确认启动子片段插入正确,从而获得含大黄鱼il-2基因启动子片段的重组载体pegfp1-il2p。
[0071]
2.2在荧光显微镜下观察绿色荧光蛋白表达情况分析大黄鱼il-2基因启动子的基础活性。
[0072]
①
挑选状态较好的epc细胞接种至96孔板中(1
×
105细胞/孔),加入l15培养基,转入恒温培养箱28℃中过夜培养,使其贴壁并长至对数生长期。l15培养基配方:l15基础培养基,10%gibco公司澳洲胎牛血清。
[0073]
②
转染前2h更换细胞培养基。转染时,于1.5ml ep管中加入30μll15培养基、0.6μg重组质粒pegfp1-il2p及转染试剂(promega),吹打混匀后室温孵育15min转染epc细胞(做三孔平行)。同时,用0.6μg空载体pegfp1转染的epc细胞作为对照。
[0074]
③
转染48h后在荧光显微镜(奥林巴斯ix70)下观察每组细胞中绿色荧光蛋白的表达情况。
[0075]
2.3含大黄鱼il-2基因启动子片段的重组荧光素酶报告基因载体pgl3-il2p的构建,将大黄鱼il-2基因启动子片段插入promega公司荧光素酶报告基因载体pgl3-basic中,使萤火虫荧光素酶(luciferase)报告基因的表达受大黄鱼il-2启动子控制,构建得到的重组载体命名为pgl3-il2p。
[0076]
具体步骤:
[0077]
①
合成带有xho i酶切位点的正向引物:5'-ccgctcgagaactaaacttgtgctg-3',带有hind iii酶切位点的反向引物:5'-aagcttcatattcagc tggaaggctt-3'。
[0078]
②
用takara公司高保真taq酶hs dna polymerase进行pcr扩增。
[0079]
pcr反应体系为:
[0080][0081]
pcr程序如下:
[0082]
[0083]
③
在1%琼脂糖凝胶上进行电泳,用omega公司胶回收试剂盒进行pcr产物回收。
[0084]
④
回收后的pcr产物和载体pgl3-basic分别按照下列酶切体系进行xho i/hind iii双酶切:
[0085][0086]
于37℃酶切反应过夜。
[0087]
⑤
用omega公司胶回收试剂盒分别回收上述经xho i/hind iii双酶切的pcr产物和载体pgl3-basic,并用takara公司t4dna连接酶按以下连接体系于16℃进行连接过夜:
[0088][0089][0090]
⑥
上述连接产物转化大肠杆菌e.coli dh5α感受态细胞,经菌落pcr筛选阳性克隆,用小量质粒提取试剂盒提取质粒,并经测序确认启动子片段插入的正确性,从而获得含大黄鱼il-2基因启动子片段的重组载体pgl3-il2p。
[0091]
2.4采用双荧光素酶报告基因检测系统分析大黄鱼il-2基因启动子的基础活性
[0092]
(1)挑选状态较好的epc细胞接种至96孔板中(1
×
105细胞/孔),加入l15培养基,转入恒温培养箱28℃中过夜培养,使其贴壁并长至对数生长期。
[0093]
l15培养基配方:l15基础培养基,10%gibco公司澳洲胎牛血清。
[0094]
(2)转染前2h更换细胞培养基。转染时,于1.5ml ep管中加入30ul l15培养基、0.6μg重组质粒pgl3-il2p、6ng海肾荧光素酶内参报告基因载体prl-tk以及转染试剂(promega),吹打混匀后室温孵育15min共转染epc细胞(做三孔平行)。同时,用0.6μg空载体pgl3-basic和6ng prl-tk共转染的epc细胞作为对照。48h后收集转染细胞,用双荧光素酶报告基因检测系统分别读取萤火虫荧光素酶和海肾荧光素酶的酶活性值,通过计算二者酶活性值的比值得出转染细胞中荧光素酶的相对活性(参见图1)。同时,以空载体pgl3-basic和prl-tk共同转染的epc细胞作为对照,计算出该启动子的相对活性。荧光素酶酶活测定的方法参考promega公司双萤光素酶报告基因检测系统说明书进行,具体步骤为:
[0095]
①
转染epc细胞48h后,吸去上层培养基,用pbs缓冲液洗涤细胞2次;
[0096]
②
每孔加入100μl plb裂解液(passive lysis buffer,试剂盒提供)于室温下裂解细胞15min,期间轻缓晃动培养板,使其裂解完全,离心收集细胞裂解液上清;
[0097]
③
在检测管中将100μl荧光素酶测试试剂ii larii和20μl上述细胞裂解液上清混合,萤火虫荧光素酶的活性立即用化学发光检测仪luminometer td 20/20测量;
[0098]
④
向检测管中加入100μl stop&glo试剂,将上述反应猝灭,同时启动海肾荧光素酶反应,测量海肾荧光素酶活性;
[0099]
⑤
分别读取萤火虫荧光素酶和海肾荧光素酶的酶活性值,计算二者酶活性值的比值得出转染细胞中荧光素酶的相对活性。同时,以空载体pgl3-basic和prl-tk共同转染的epc细胞作为对照,计算出该启动子的相对活性(参见图2)。
[0100]
2.5免疫刺激物或t细胞活化剂刺激实验
[0101]
1)将重组载体pgl3-il2p、prl-tk转染至jurkat t细胞,转染后12小向细胞培养液中分别加入pbs或终浓度为50μg/mllps、50μg/mlpoly(i:c)、10μg/ml pha、10μg/ml con-a、1μg/ml ci、0.1μg/mlpma或1μg/ml ci 0.1μg/mlpma,以不加刺激的细胞为阴性对照,24h后按上述实验步骤收取细胞检测大黄鱼il-2启动子活性。
[0102]
2)经lps或poly(i:c)刺激后,大黄鱼il-2启动子活性无明显变化(参见图3),而pha、con-a、ci、pma等t细胞活化剂则可显著增强lcil-2启动子活性(参见图3)。分别诱导大黄鱼il-2启动子活性上调2.8倍、2.6倍、1.8倍和4.8倍,而ci和pma共同刺激可诱导lcil-2启动子活性上调5.2倍(p<0.01)。说明大黄鱼il-2的表达可能受t细胞活化信号调控。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。