抗cd19抗体及其应用
技术领域
1.本发明涉及生物医药领域。更特别地,涉及一种抗cd19抗体,以及该抗体在制备b细胞恶性肿瘤检测剂和治疗药物中的应用。
背景技术:
2.b细胞恶性肿瘤是常见的血液恶性肿瘤,尽管多数患者对目前的一线治疗有反应,但复发率高,预后差,仍然是难治的恶性肿瘤之一。近年,以cd19作为b细胞恶性肿瘤免疫治疗的分子靶点受到极大的关注。
3.cd19是正常及恶性b淋巴细胞特异性表面蛋白,几乎不在其他细胞表面表达,参与pi3/akt通路的调节,在b细胞的增殖与分化中起到很至关重要的作用。由于cd19在b淋巴细胞表达的特异性和肿瘤细胞表达的广泛性,且在b细胞恶性转化过程中不丢失,而造血干细胞及pro-b细胞不表达cd19,治疗停止后,b细胞可以得到有效的补充,因此cd19其成为一个颇具潜力的b淋巴细胞恶性肿瘤免疫治疗的分子靶点。
4.1993年,一种来源于骆驼科的新型天然抗体被发现。该抗体天然缺失轻链而只由重链组成,其重链包含两个恒定区(ch2和ch3)、一个铰链区和一个重链可变区(variable heavy chain domain,vhh,即抗原结合位点),该重链可变区的相对分子质量约为13kda,仅为常规抗体的1/10,且分子高度和直径均在纳米级别,是目前可获得的最小的功能性抗体片段,因此又被称为纳米单抗(nanobody,nb)。因纳米单抗稳定性高(90℃条件下仍不会降解)、亲和力高、与人源抗体同源性超过80%、毒性和免疫原性均较低等特点,最近纳米单抗被广泛用于免疫诊断试剂盒研发、影像学研发以及针对肿瘤、炎症、传染病和神经系统疾病等领域的抗体药物研发。
5.目前,美国市场已有一些cd19-cart细胞治疗药物,但是国内目前尚无针对b细胞恶性肿瘤的细胞治疗药物上市,因此迫切需要开发针对cd19的抗体,用于制备b细胞恶性肿瘤等与cd19相关的疾病的治疗药物。
技术实现要素:
6.本发明通过用抗原免疫羊驼,获取羊驼源纳米单抗及其vhh,用于b细胞恶性肿瘤治疗。基于这些研究,本发明提供了一种可结合cd19的纳米抗体,包括3个互补决定区cdr1-3,序列分别如seq id no:1-3所示。
7.在一个具体实施方案中,所述纳米还包括4个框架区fr1-4,所述fr1-4与所述cdr1-3交错排列。例如,可将fr1-4序列设计为如seq id no:4-7所示(羊驼源),但本发明的范围不限于此。抗体的特异性识别和结合能力主要由cdr区序列决定,fr序列影响不大,可根据物种来设计,这是本领域公知的。可设计人源、鼠源或骆驼源的fr区序列来连接上述cdr,从而得到一个可结合cd19的纳米抗体。
8.本发明还提供了上述纳米抗体在检测细胞表面cd19中的应用。
9.本发明还提供了上述多肽在制备cd19相关疾病例如b细胞恶性肿瘤的治疗药物中
的应用。
10.本发明还提供了上述多肽在制备cat t细胞治疗剂中的应用。
11.本发明还提供了上述多肽的核酸编码序列及其在制备基因治疗药物中的应用。
12.在一个实施方案中,所述核酸编码序列为dna编码序列或rna编码序列。
13.本发明针对b细胞恶性肿瘤进行纳米抗体药物开发,通过制备人cd19蛋白、免疫羊驼、利用噬菌体库展示纳米单抗的平台技术等,筛选到特异性结合cd19的纳米抗体vhh,鉴定了其cdr序列,并构建了人源化的纳米抗体;同时利用流式细胞术鉴定其结合b细胞淋巴瘤细胞的能力。本发明为b细胞恶性肿瘤的临床治疗提供潜在的纳米抗体新药。
附图说明
14.图1为cd19第3次免疫羊驼一周后的抗血清效价检测曲线。
15.图2为cd19第4次免疫羊驼一周后的抗血清与表达cd19的raji细胞上cd19反应的流式效价检测曲线,rpmi8226不表达cd19,为阴性对照细胞。
16.图3为cd19-vhh噬菌体抗体文库为模板扩增的pcr产物的电泳图。
17.图4为cd19-vhh噬菌体抗体文库的淘选鉴定,其中,a为噬菌体文库针对cd19蛋白淘选后elisa检测统计图;b为从第二轮(2
nd
)、第三轮(3
rd
)和第四轮(4
th
)淘选后的噬菌体抗体文库分别挑选40、48、48个克隆进行噬菌体elisa检测统计图.
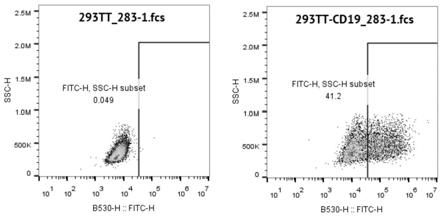
18.图5为c19nb283抗体与瞬转表达cd19膜蛋白的293tt细胞的流式结合检测结果。
19.图6为c19nb283抗体与raji细胞的流式结合检测结果。
具体实施方式
20.1.免疫原的制备
21.我们依据ncbi网站上human cd19的蛋白序列和基因序列信息,分析并设计了可有效诱导羊驼产生针对human cd19蛋白的特异性抗体的多肽scd19,在c端连接his-tag(scd19-his)或兔fc(scd19-rfc)用于后续纯化及检测。
22.2.羊驼免疫与抗血清的获得
23.用250μg scd19-rfc蛋白与250μl弗氏完全佐剂的乳化混合物对羊驼进行初免,在第14天、28天、42天用scd19-rfc蛋白与250μl弗氏不完全佐剂加强免疫3次,第3次和第4次免疫1周后,采血检测抗血清滴度;第4次免疫1周后,采血100ml用于噬菌体抗体库的构建。
24.抗血清效价通过elisa检测,用浓度为0.5μg/ml的scd19蛋白包被检测板,每孔加入梯度稀释的抗血清或者纯化的抗体100μl(对照为免疫前羊驼血清),37℃孵育1.5h,洗涤2次,每孔加入1:10000稀释的辣根过氧化物酶标记的goat anti-llamma igg(h l)二抗,37℃孵育1h,洗涤4-6次后,加100μl tmb底物,37℃孵育10min,50μl 0.2m的h2so4中止反应,测定od 450nm。elisa检测血清效价规定为在od450是空白对照的2.1倍以上并且大于0.2的最高稀释倍数。
25.结果如图1及图2所示,图1所示为3免后的抗血清效价为0.36
×
106。图2所示为4免后的血清结合raji细胞表面cd19的流式效价,为4
×
103。由此可见,该抗原可诱导羊驼产生特异性针对raji细胞表面cd19蛋白的高滴度抗血清。
26.3.vhh噬菌体库构建及淘选
27.收集100ml免疫后羊驼的外周血,利用淋巴细胞分离液(ge ficoll-paque plus)分离获得羊驼的pbmc,根据trizol操作手册,提取rna,并利用oligo(dt)反转为cdna,通过引物扩增,以及分子克隆等技术,将羊驼的vhh基因克隆至phagemid质粒,转化tg1细菌,得到vhh噬菌体库。为了进一步鉴定cd19-vhh噬菌体库是否构建成功,通过pcr扩增免疫cd19羊驼的vhh目的基因,可以看出目的条带为500bp,大小符合预期(图3),说明该cd19-vhh噬菌体抗体文库里含有vhh基因。挑选33个克隆进行测序,测序结果显示,序列多样性为96.9%;比对结果显示,差异序列大多在cdr结合区。经检测,该构建得到一个cd19-vhh噬菌体抗体文库的库容为1.27
×
109,阳性率为100%,序列多样性(diversity)为96.9%,有效插入率(in frame rate)为94.2%。
28.在m13ko7辅助噬菌体的帮助下,用vhh-phagemid转化的细菌,进行噬菌体抗体库的复苏,并用peg/nacl进行沉淀。将包被有50μg/ml的cd19-his蛋白进行四次富集噬菌体抗体库。将富集的噬菌体,洗脱、转化、涂板、挑取单克隆进行噬菌体与cd19蛋白elisa的结合鉴定,将结合读值与blank对照比值大于5的克隆进行测序,并克隆至表达载体pvax1,转染293f细胞表达生产纳米单抗。
29.淘选后的文库与cd19蛋白进行结合检测。噬菌体elisa结果显示,没有富集前的cd19-vhh噬菌体文库与cd19蛋白的结合读值为0.12,经过一轮、二轮、三轮富集后的噬菌体文库读值分别为0.15、0.19、0.35(图4a)。为了进一步验证富集后的文库中结合cd19-vhh蛋白的阳性噬菌体率,从第2轮、第3轮、第4轮富集后的文库里分别挑选了40、48、48个克隆进行单个噬菌体elisa检测。结果显示,第2轮文库里,5%的单个噬菌体克隆为阳性,第3轮文库里10.4%的噬菌体克隆为阳性,在第4轮文库里39.6%的噬菌体克隆为阳性,而且结合的平均读值在3.0左右(图4b),通过cd19蛋白淘选成功地富集了高结合力的cd19-vhh噬菌体文库。
30.4.vhh原核表达文库的构建及vhh表达
31.对上述四轮淘选富集后的4th-cd19-vhh噬菌体抗体文库进行pcr扩增;获取并纯化抗体库中所有vhh的基因片段,将vhh的基因片段克隆至原核表达载体,转化ss320菌株,构建vhh的原核表达抗体库;将原核表达抗体库涂布平板,过夜培养,次日随机挑选单克隆菌落2000个,使用iptg诱导表达抗体上清,对抗体上清与cd19蛋白进行elisa结合检测。
32.有细菌上清与cd19蛋白结合,同时不与空白对照结合,scd19结合的读值/空白对照的读值大于3.0。其中获得编号为c19nb283的抗体,其与cd19抗体结合活性较好,od450target/od450 blank的值为32.80。经测序,该抗体的cdr1-3的序列分别如seq id no:1-3所示,fr1-4的序列如seq id no:4-7所示
33.5.fortebio检测vhh抗体与cd19蛋白的亲和力
34.将抗体c19nb283以ahc生物传感器进行loading,检测c19nb283与cd19蛋白的亲和力水平。将ahc生物传感器以0.02%pbst平衡后,loading抗体上清,时间200s,再次以0.02%pbst平衡后,结合cd19蛋白,时间180s,于0.02%pbst中解离,时间180s,以fortebio数据分析软件8.0版本,1:1结合模式拟合分析,得出c19nb283与cd19蛋白的亲和力数据如表1所示。
35.表1抗体c19nb283与cd19蛋白的亲和力相关数据
36.loading sample idresponsekd(m)kon(1/ms)kdis(1/s)rmaxfull r^2
c192830.11211.35e-092
·
04e 052.75e-040.11640
·
9825
37.6.流式细胞法检测vhh抗体与肿瘤细胞的结合
38.将c19nb283与经瞬转表达cd19膜蛋白的293tt细胞或阴性对照细胞即未转染的293tt细胞分别混合孵育,100μl/样品,4℃1h;以0.5%pbsf洗涤两遍后,加入荧光二抗,4℃30min;以0.5%pbsf洗涤两遍后,上机检测。流式结果显示,c19nb283抗体可细胞表面cd19蛋白结合(图5)。使用表达cd19的raji细胞进行流式检测,以未表达抗体的上清作为一抗阴性对照,结果可见c19nb283可与raji细胞结合(图6)。使用人源化的vhh抗体亦得到类似的结果。可见,抗体c19nb283具有靶向结合b细胞恶性肿瘤的能力,同时有可能通过靶向肿瘤细胞表面的cd19分子,促进巨噬细胞的吞噬作用,从而达到治疗或者抑制肿瘤生长的效果,因此抗体c19nb283有潜力成为治疗肿瘤的新型抗体药物。
39.因为c19nb283能够识别细胞表面的cd19分子,因此c19nb283抗体序列也可以应用于car(chimeric antigen receptor,抗原嵌合受体,由vhh序列融合第三代或者第四代cd28-4-1bb-cd3zeta分子序列构成)细胞治疗肿瘤的治疗。另外因为c19nb283能识别肿瘤细胞表面的cd19分子,因此vhh可以通过偶联药物用于adc(antibody-drug conjugate,抗体偶联药物)治疗或者偶联同位素用于依赖抗体的分子影像诊断等,为肿瘤的临床治疗提供潜在的纳米新药。
40.7.使用aav病毒载体装载的人源化vhh进行体内实验
41.腺相关病毒载体(aav)源于非致病的野生型腺相关病毒,由于其安全性好、宿主细胞范围广(分裂和非分裂细胞)、免疫源性低,在体内表达外源基因时间长等特点,被视为最有前途的基因转移载体之一,在世界范围内的基因治疗和疫苗研究中得到广泛应用。
42.aav helper-free病毒包装系统购于cell biolabs,san diego usa。将上述vhh的dna编码序列通过分子克隆技术插入到paav-mcs质粒;通过测序证明构建成功后,将构建好的质粒paav-ab与phelper和paav-dj质粒按照质量比1:1:1的方式使用pei转染试剂共转染aav-293t细胞。转染后分别于48、72、96和120小时收集上清,并用5xpeg8000(sigma)进行浓缩,最后用1.37g/ml氯化铯进行纯化。纯化的aav溶解于pbs里,进行鉴定和分装后保存于-80℃。
43.immunodeficientnod.cg-prkdcscidil2rgtm1wjl/szj(ncg)小鼠购自南京大学模式动物所,与nsg小鼠类似,该小鼠在scid小鼠基础上缺失了il2受体基因,导致体内没有小鼠t细胞,b细胞以及极少量的nk细胞。1.0-15x107pbmc腹腔注射进4-6周的ncg小鼠体内;三周后,采血流式检测人t细胞,通过染色人的cd45
、cd3
、cd4
和cd8
。人cd45阳性细胞的比例到达5%以上,判定为小鼠人源化成功。将上述小鼠腹腔注射raji细胞3*106/只,一周后,使小鼠接受aav-vvh(1x10
11
gc/100μl)肌肉注射,以aav-gfp为对照组。结果显示,aav-vvh对b细胞淋巴瘤有治疗作用。
44.以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。