1.本发明涉及有机合成领域,尤其涉及一种吲哚啉并四氢吡喃类化合物及其制备方法。
背景技术:
2.不对称去芳构化是有机合成领域的一个难点,目前主要的研究方向为富电子芳香化合物,例如吲哚、萘酚等,主要利用这类化合物固有的亲核性。近些年,3-硝基吲哚,作为一类贫电子的杂芳烃类化合物,已经引起了有机化学家广泛的兴趣,特别在钯催化的去芳构化[3 2]环加成反应领域具有非常重要的地位。
[0003]
然而,目前为止仅有2例关于钯催化的3-硝基吲哚参与的去芳构化[4 2]环加成反应,且都是π-烯丙基钯1,4-[n,c]偶极活性中间体与3-硝基吲哚反应(chin.chem.lett.,2019,30,1512
–
1514;synlett.,2020,31,916
–
924)。
[0004]
进一步说,到目前为止,π-烯丙基钯1,4-[o,c]偶极活性中间体与3-硝基吲哚的去芳构化[4 2]环加成反应还未见报道,很可能是氧的亲核能力比碳和氮弱,导致第一步的去芳构化加成很难进行。
[0005]
另外一方面,烯基碳酸酯在钯的作用下,能够形成π-烯丙基钯1,4-[o,c]偶极活性中间体,已经被成功运用于[4 2]环加成反应中,而在去芳构化方面的研究还未见报道。
技术实现要素:
[0006]
本发明的目的之一,就在于提供一类新的吲哚啉并四氢吡喃类化合物,以解决上述问题。
[0007]
为了实现上述目的,本发明采用的技术方案是这样的:吲哚啉并四氢吡喃类化合物,具有如下结构式(ⅰ)所示的结构:
[0008][0009]
上述结构式中,r1基为吸电子取代基,r2基为单取代基或多取代基,所述取代基选自氢,烷基,烷氧基,硝基或卤素中的一种。
[0010]
作为优选的技术方案,所述吸电子取代基选自对甲基苯磺酰基,苯磺酰基,酰基或酯基中的一种。
[0011]
本发明首次公开了一类新的吲哚啉并四氢吡喃类化合物及其制备方法,该化合物含有易官能化基团,便于衍生合成其他手性多环化合物,可以为新药的研发及药物的筛选提供更多候选分子。
[0012]
本发明实现了π-烯丙基钯1,4-[o,c]偶极活性中间体和3-硝基吲哚的去芳构化[4 2]反应,其具有非常重要的意义:不仅是第一例运用π-烯丙基钯1,4-[o,c]偶极活性中
间体实现贫电子芳杂环的去芳构化反应,并且生成的吲哚啉并四氢吡喃类化合物广泛存在于生活活性分子中,具有多样性的生物活性,是开发新药的重要来源。
[0013]
更具体而言,本发明公开的上述化合物的应用价值在于:现有的吲哚啉并四氢吡喃类化合物许多都具有很好的生物活性,可以合理预测本发明所合成的这一大类化合物也具有一定的生物活性,从而为药物活性的筛选提供充足的化合物源;另外,可以为新药的研发及药物的筛选尤其是高通量筛选提供更多候选分子,丰富了该类化合物库。
[0014]
本发明的目的之二,在于提供一种上述的吲哚啉并四氢吡喃类化合物的制备方法,采用的技术方案为:在反应试管中加入pd2(dba)3·
chcl3和配体,然后加入溶剂,搅拌络合后,依次加入3-硝基吲哚(ⅱ)和烯基碳酸酯(ⅲ),待反应完毕后,分离纯化得到吲哚啉并四氢吡喃类化合物(ⅰ),其中,
[0015]
所述3-硝基吲哚(ⅱ)具有如下结构:
[0016][0017]
所述烯基碳酸酯(ⅲ)具有如下结构:
[0018][0019]
其反应式为:
[0020][0021]
作为优选的技术方案:所述搅拌络合的时间为1-30min,进一步优选为5min,能够在保证效率的同时络合完全。
[0022]
作为优选的技术方案:所述反应溶剂选自甲苯、均三甲苯、二氯甲烷、氯仿、四氢呋喃、乙醚、乙腈、乙醇、甲醇、1,4-二氧六环、氯苯中的一种或者多种混合。
[0023]
所述反应溶剂进一步优选乙腈,因为反应的收率最高。
[0024]
作为优选的技术方案:所述配体为膦配体,进一步优选三苯基膦,因为收率高且三苯基膦易得便宜。
[0025]
作为优选的技术方案:所述催化剂(pd2(dba)3·
chcl3/pph3)用量最低为1mol%。
[0026]
作为优选的技术方案:所述反应温度为0℃至50℃。
[0027]
进一步优选40℃,因为反应的收率高,且能耗较低。
[0028]
与现有技术相比,本发明的优点在于:本发明实现了第一例π-烯丙基钯1,4-[o,c]偶极活性中间体和3-硝基吲哚的去芳构化[4 2]环加成反应,首次公开了一系列新的吲哚啉并四氢吡喃类化合物及其合成方法,该类化合物含有易官能化基团,便于衍生合成其
他手性多环化合物,可以为新药的研发及药物的筛选尤其是高通量筛选提供更多候选分子,丰富了该类化合物库;而且,本发明的方法具有反应条件温和、原料与催化剂易得、操作简单、催化剂用量低(可低至1mol%)、收率高(99%yield)等优点。
附图说明
[0029]
图1为实施例1制得的i-a的氢谱图;
[0030]
图2为实施例1制得的i-a的碳谱图;
[0031]
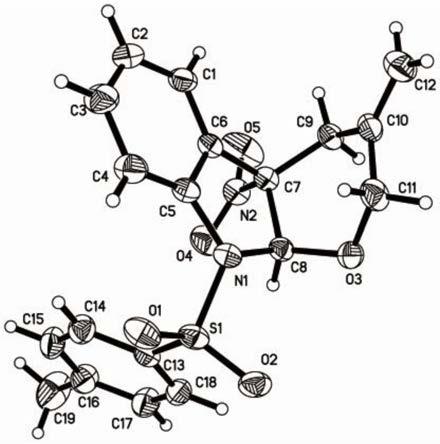
图3为实施例1制得的i-a的单晶图。
具体实施方式
[0032]
下面将结合附图对本发明作进一步说明。
[0033]
本发明所用的原料、溶剂、催化剂、分子筛等等,均为市购。
[0034]
实施例1:合成化合物
ⅰ‑a[0035][0036]
在一根干燥的反应试管中加入称入pd2(dba)3·
chcl3和配体,然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
a 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后,粗产品经柱色谱分离纯化得化合物i-a,不同的反应条件如表1所示,具体反应过程如下:
[0037][0038]
表1不同的反应条件
[0039][0040]
[0041]
表1中,“x”代表催化剂pd2(dba)3·
chcl3的量,“y”代表配体的量。
[0042]
从表1中可见,采用催化剂pd2(dba)3·
chcl35 mol%和pph3(15mol%)、乙腈作溶剂、反应温度为40℃,是更为优选的方案。
[0043]
所得化合物i-a为白色固体,经hplc检测纯度为》99%;》20:1dr,m.p.148.4-150.2℃。
[0044]
结构鉴定:氢谱1h nmr(600mhz,cdcl3)见图1:δ7.80(d,j=8.4hz,2h),7.61(d,j=8.2hz,1h),7.42-7.38(m,1h),7.32(d,j=7.6hz,1h),7.26(d,j=8.4hz,2h),7.11-7.07(m,1h),6.51(s,1h),4.87(d,j=2.3hz,1h),4.75(d,j=2.3hz,1h),4.30(dd,j=15.8,1.8hz,1h),4.08(dd,j=15.8,2.2hz,1h),3.31(dt,j=14.0,1.8hz,1h),3.21(d,j=14.0hz,1h),2.38(s,3h).碳谱
13
c nmr(151mhz,cdcl3)见图2:δ145.1,142.6,136.8,134.7,132.5,129.9,127.7,126.0,125.1,124.6,114.5,111.9,92.7,91.6,63.0,36.2,21.7.hrms(esi-tof)calcd.for c
19h19
n2o5s[m h]
387.1009;found:387.1006。
[0045]
单晶衍衍射实验:
[0046]
单晶培养:将实施例1中得到的主要组分化合物i-a(40mg)溶于20ml乙醇中,于室温下静置7天,有单晶析出,收集单晶进行单晶衍射测试,见图3。
[0047]
测试参数如表2所示:
[0048]
表2单晶测试参数
[0049][0050]
[0051]
实施例2:合成化合物i-b
[0052][0053]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
b 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-b。
[0054]
白色固体;35.9mg,收率为97%;》20:1dr;m.p.174.3-175.0℃。
[0055]
结构鉴定:1h nmr(300mhz,dmso-d6)δ7.98(d,j=7.5hz,2h),7.75-7.68(m,1h),7.64-7.57(m,2h),7.55-7.44(m,3h),7.20-7.10(m,1h),6.52(s,1h),4.92(s,1h),4.75(s,1h),4.26(d,j=15.7hz,1h),3.70(d,j=15.7hz,1h),3.45(d,j=14.2hz,1h),3.33-3.26(m,1h).
13
c nmr(101mhz,dmso-d6)δ141.9,137.2,137.0,134.3,132.5,129.5,127.4,126.0,125.4,124.5,113.3,111.5,91.7,90.9,62.2,33.8.hrms(esi-tof)calcd.for c
18h16
n2nao5s[m na]
395.0672;found:395.0675。
[0056]
实施例3:合成化合物i-c
[0057][0058]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
c 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol。反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-c。
[0059]
无色油状物;11.9mg,收率为48%;》20:1dr;。
[0060]
结构鉴定:1h nmr(600mhz,dmso-d6)δ8.75(s,1h),8.15-8.10(m,1h),7.68-7.64(m,1h),7.43-7.38(m,2h),5.27(s,1h),5.05(s,2h),5.02(s,1h),4.52(s,2h),1.95(s,3h).
13
c nmr(151mhz,dmso-d6)δ169.9,138.9,135.2,133.4,127.7,124.4,124.2,120.3,119.7,116.2,112.3,64.1,49.1,20.4.hrms(esi-tof)calcd.for c
14h15
n2o4[m h]
275.1026;found:275.1027。
[0061]
实施例4:合成化合物i-d
[0062][0063]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
d 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol。反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-d。
[0064]
白色固体;25.2mg,收率为88%;》20:1dr;m.p.93.4-94.5℃。
[0065]
结构鉴定:1h nmr(400mhz,dmso-d6)δ7.81-7.67(m,1h),7.59(dd,j=7.6,1.3hz,
1h),7.52-7.43(m,1h),7.19-7.13(m,1h),6.37(s,1h),4.97(s,1h),4.80(s,1h),4.28(dd,j=15.3,1.4hz,1h),3.90-3.82(m,4h),3.48(d,j=14.2hz,1h),3.37(dt,j=14.2,1.8hz,1h).
13
c nmr(101mhz,dmso-d6)δ152.4,143.0,137.5,132.1,125.6,125.2,123.8,114.6,111.4,91.8,88.5,62.8,53.3,34.4.hrms(esi-tof)calcd.for c
14h14
n2nao5[m na]
313.0795;found:313.0799。
[0066]
实施例5:合成化合物i-e
[0067][0068]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
e 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-e。
[0069]
黄色固体;25.9mg,收率为71%;》20:1dr;m.p.59.0-60.8℃。
[0070]
结构鉴定:1h nmr(400mhz,dmso-d6)δ7.75(s,1h),7.59(d,j=7.0hz,1h),7.50-7.45(m,3h),7.44-7.39(m,2h),7.36(d,j=7.0hz,1h),7.19-7.12(m,1h),6.45(s,1h),5.34(s,2h),4.97(s,1h),4.80(s,1h),4.29(d,j=15.4hz,1h),3.88(dd,j=15.4,1.9hz,1h),3.49(d,j=14.2hz,1h),3.38(dt,j=14.2,1.9hz,1h).
13
c nmr(101mhz,dmso-d6)δ151.7,143.0,137.5,135.9,132.2,128.5,128.2,127.6,125.7,125.2,123.9,114.6,111.4,91.7,88.6,67.3,62.8,34.3.hrms(esi-tof)calcd.for c
20h18
n2nao5[m na]
389.1108;found:389.1113。
[0071]
实施例6:合成化合物i-f
[0072][0073]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
f 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol。反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-f。
[0074]
白色固体;28.7mg,收率为86%;》20:1dr;m.p.33.8-35.0℃
[0075]
结构鉴定:1h nmr(600mhz,dmso-d6)δ7.83-7.59(m,1h),7.55(d,j=7.4hz,1h),7.48-7.43(m,1h),7.15-7.10(m,1h),6.29(s,1h),4.96(s,1h),4.79(s,1h),4.27(d,j=15.4hz,1h),3.88(d,j=15.4hz,1h),3.43(d,j=14.3hz,1h),3.40-3.39(m,1h),1.53(s,9h).
13
c nmr(151mhz,dmso-d6)δ150.8,143.2,137.7,132.1,125.8,125.0,123.5,114.7,111.3,91.7,88.7,82.2,62.9,34.4,27.8.hrms(esi-tof)calcd.for c
17h20
n2nao5[m na]
355.1264;found:355.1274。
[0076]
实施例7:合成化合物i-g
[0077][0078]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
g 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-g。
[0079]
白色固体;41.4mg,收率为98%;》20:1dr;m.p.109.6-111.8℃
[0080]
结构鉴定:1h nmr(400mhz,dmso-d6)δ7.87(d,j=8.4hz,2h),7.50-7.44(m,2h),7.42-7.37(m,2h),7.17(dd,j=7.0,1.9hz,1h),6.46(s,1h),4.94(d,j=2.1hz,1h),4.79(d,j=2.1hz,1h),4.40(dd,j=16.0,1.6hz,1h),3.96(dd,j=16.0,2.1hz,1h),3.53(d,j=14.0hz,1h),3.43-3.39(m,1h),2.36(s,3h).
13
c nmr(101mhz,dmso-d6)δ145.3,144.3,136.9,134.0,133.7,130.8,130.0,127.8,125.2,123.0,112.4,111.3,92.8,91.7,62.4,32.2,21.1.hrms(esi-tof)calcd.for c
19h17
cln2nao5s[m na]
443.0439;found:443.0444。
[0081]
实施例8:合成化合物i-h
[0082][0083]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
h 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-h。
[0084]
白色固体;46.0mg,收率为99%;》20:1dr;m.p.69.2-71.4℃;
[0085]
结构鉴定:1h nmr(400mhz,dmso-d6)δ7.87(d,j=8.4hz,2h),7.53(dd,j=8.0,1.1hz,1h),7.41-7.35(m,3h),7.32(dd,j=8.0,1.1hz,1h),6.46(s,1h),4.92(d,j=2.2hz,1h),4.79(d,j=2.2hz,1h),4.40(dd,j=16.0,1.6hz,1h),3.99(dd,j=16.0,2.0hz,1h),3.59(d,j=14.0hz,1h),3.40(dt,j=14.0,2.0hz,1h),2.36(s,3h).
13
c nmr(101mhz,dmso-d6)δ145.2,144.4,136.8,133.9,133.7,129.9,128.5,127.8,124.6,119.3,112.8,111.2,93.4,91.7,62.4,32.1,21.1.hrms(esi-tof)calcd.for c
19h17
brn2nao5s[m na]
488.9915;found:488.9918。
[0086]
实施例9:合成化合物i-i
[0087][0088]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
i 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol。反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-i。
[0089]
白色固体;40.6mg,收率99%;》20:1dr;m.p.99.3-100.5℃;
[0090]
结构鉴定:1h nmr(600mhz,dmso-d6)δ7.84(d,j=8.3hz,2h),7.38(d,j=8.3hz,2h),7.33-7.29(m,2h),6.89(dd,j=6.1,2.4hz,1h),6.32(s,1h),5.02(d,j=2.4hz,1h),4.78(d,j=2.4hz,1h),4.34(d,j=15.9hz,1h),3.93(d,j=15.9hz,1h),3.40-3.37(m,2h),2.34(s,3h),2.19(s,3h).
13
c nmr(151mhz,dmso-d6)δ145.0,142.8,137.5,136.9,134.3,132.1,130.0,127.7,126.8,124.2,111.1,111.0,93.5,91.6,62.8,32.9,21.1,17.8.hrms(esi-tof)calcd.for c
20h20
n2nao5s[m na]
423.0985;found:423.0992。
[0091]
实施例10:合成化合物i-j
[0092][0093]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
j 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-j。
[0094]
白色固体;38.3mg,收率95%;》20:1dr;m.p.152.4-155.2℃。
[0095]
结构鉴定:1h nmr(300mhz,dmso-d6)δ7.83(d,j=8.1hz,2h),7.55-7.47(m,2h),7.40(d,j=8.1hz,2h),7.36-7.28(m,1h),6.49(s,1h),4.93(s,1h),4.78(s,1h),4.31(d,j=15.8hz,1h),3.77(d,j=15.8hz,1h),3.45(d,j=14.1hz,1h),3.29(d,j=14.1hz,1h),2.36(s,3h);
[0096]
13
c nmr(101mhz,dmso-d6)δ158.8(d,j=241.6hz),145.0,138.4(d,j=2.0hz),136.8,134.1,130.0,127.7(d,j=9.0hz),127.5,119.4(d,j=23.9hz),115.0(d,j=8.5hz),113.0(d,j=25.3hz),111.8,91.6(d,j=1.9hz),91.4,62.3,33.9,21.0;
[0097]
hrms(esi-tof)calcd.for c
19h17
fn2nao5s[m na]
427.0734;found:427.0740。
[0098]
实施例11:合成化合物i-k
[0099][0100]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
k 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-k。
[0101]
白色固体;40.6mg,收率97%;》20:1dr;m.p.113.0-115.4℃。
[0102]
结构鉴定:1h nmr(300mhz,dmso-d6)δ7.85(d,j=8.4hz,2h),7.70(dd,j=1.7,0.9hz,1h),7.55-7.47(m,2h),7.41(d,j=8.1hz,2h),6.49(s,1h),4.94(s,1h),4.78(s,1h),4.29(d,j=15.8hz,1h),3.73(d,j=15.8hz,1h),3.50(d,j=14.3hz,1h),3.29(d,j=14.3hz,1h),2.36(s,3h);
[0103]
13
c nmr(101mhz,dmso-d6)δ145.1,141.0,136.7,134.1,132.4,130.0,128.3,127.8,127.5,125.7,114.9,111.9,91.4,91.2,62.3,33.6,21.1;
[0104]
hrms(esi-tof)calcd.for c
19h17
cln2nao5s[m na]
443.0439;found:443.0445。
[0105]
实施例12:合成化合物i-l
[0106][0107]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
l 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-l。
[0108]
白色固体;46.4mg,收率99%;》20:1dr;m.p.154.8-156.4℃
[0109]
结构鉴定:1h nmr(400mhz,dmso-d6)δ7.85(d,j=8.3hz,2h),7.81(d,j=2.1hz,1h),7.64(dd,j=8.7,2.1hz,1h),7.45(d,j=8.7hz,1h),7.41(d,j=8.3hz,2h),6.49(s,1h),4.94(s,1h),4.78(s,1h),4.29(d,j=16.0hz,1h),3.72(dd,j=16.0,2.1hz,1h),3.51(d,j=14.1hz,1h),3.28(dt,j=14.1,2.1hz,1h),2.36(s,3h);
[0110]
13
c nmr(101mhz,dmso-d6)δ145.1,141.4,136.7,135.2,134.1,130.0,128.4,128.1,127.5,116.0,115.3,111.9,91.4,91.2,62.3,33.5,21.1;
[0111]
hrms(esi-tof)calcd.for c
19h17
brn2nao5s[m na]
488.9915;found:488.9917。
[0112]
实施例13:合成化合物i-m
[0113][0114]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
m 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-m。
[0115]
白色固体;36.6mg,收率89%;》20:1dr;m.p.169.2-171.9℃;
[0116]
结构鉴定:1h nmr(400mhz,dmso-d6)δ8.17(d,j=1.5hz,1h),7.94-7.90(m,3h),7.61(d,j=8.5hz,1h),7.44(d,j=8.1hz,2h),6.61(s,1h),4.95(d,j=2.2hz,1h),4.78(d,j=2.2hz,1h),4.28(dd,j=15.8,1.8hz,1h),3.61(dd,j=15.8,2.0hz,1h),3.54(d,j=14.2hz,1h),3.33-3.28(m,1h),2.37(s,3h);
[0117]
13
c nmr(101mhz,dmso-d6)δ145.5,145.4,137.1,136.3,134.1,130.2,127.6,126.9,118.0,113.7,112.2,106.4,91.2,90.9,62.3,33.4,21.1;
[0118]
hrms(esi-tof)calcd.for c
20h17
n3nao5s[m na]
434.0781;found:434.0784。
[0119]
实施例14:合成化合物i-n
[0120][0121]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后
加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
n 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-n。
[0122]
白色固体;38.9mg,收率97%;》20:1dr;m.p.134.0-136.2℃;
[0123]
结构鉴定:1h nmr(600mhz,dmso-d6)δ7.83(d,j=8.4hz,2h),7.39-7.37(m,3h),7.28(s,1h),7.26(d,j=8.4hz,1h),6.47(s,1h),4.92(d,j=2.2hz,1h),4.76(d,j=2.2hz,1h),4.26(dd,j=15.7,1.9hz,1h),3.74(dd,j=15.7,2.2hz,1h),3.41(s,1h),3.28(dt,j=14.1,2.2hz,1h),2.34(s,3h),2.22(s,3h);
[0124]
13
c nmr(151mhz,dmso-d6)δ144.8,139.8,137.1,134.3,134.0,133.0,129.9,127.5,126.2,125.3,113.3,111.5,91.9,91.1,62.2,33.9,21.0,20.3;
[0125]
hrms(esi-tof)calcd.for c
20h20
n2nao5s[m na]
423.0985;found:423.0995。
[0126]
实施例15:合成化合物i-o
[0127][0128]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
o 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-o。
[0129]
白色固体;40.4mg,收率96%;》20:1dr;m.p.149.5-151.6℃;
[0130]
结构鉴定:1h nmr(400mhz,dmso-d6)δ7.89(d,j=8.4hz,2h),7.56(d,j=8.2hz,1h),7.46-7.41(m,3h),7.22(dd,j=8.2,1.9hz,1h),6.54(s,1h),4.92(d,j=2.3hz,1h),4.77(d,j=2.1hz,1h),4.28(dd,j=15.8,1.5hz,1h),3.70(dd,j=15.9,2.1hz,1h),3.45(d,j=14.1hz,1h),3.29(dt,j=14.0,2.0hz,1h),2.37(s,3h);
[0131]
13
c nmr(101mhz,dmso-d6)δ145.3,143.2,136.9,136.7,134.1,130.1,127.5,127.2,125.0,124.4,113.0,111.8,91.3,91.2,62.2,33.6,21.1;
[0132]
hrms(esi-tof)calcd.for c
19h17
cln2nao5s[m na]
443.0439;found:443.0446。
[0133]
实施例16:合成化合物i-p
[0134][0135]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
p 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-p。
[0136]
白色固体;36.0mg,收率为90%;》20:1dr;m.p.160.2-162.3℃;
[0137]
结构鉴定:1h nmr(600mhz,dmso-d6)δ7.87(d,j=8.4hz,2h),7.40(d,j=8.4hz,2h),7.34(d,j=7.8hz,1h),7.29(s,1h),6.93(d,j=7.8hz,1h),6.49(s,1h),4.90(d,j=2.4hz,1h),4.74(d,j=2.4hz,1h),4.24(dd,j=15.8,1.8hz,1h),3.68(dd,j=15.8,2.2hz,1h),3.39(s,1h),3.27(dt,j=14.0,2.0hz,1h),2.35(s,3h),2.33(s,3h);
[0138]
13
c nmr(151mhz,dmso-d6)δ144.9,142.9,142.2,137.2,134.5,130.0,127.5,125.2,125.1,123.3,113.7,111.5,91.7,91.2,62.2,33.9,21.5,21.1;
[0139]
hrms(esi-tof)calcd.for c
20h20
n2nao5s[m na]
423.0985;found:423.0989。
[0140]
实施例17:合成化合物i-q
[0141][0142]
在一根干燥的反应试管中加入pd2(dba)3·
chcl3(5mol%)和pph3(15mol%),然后加入溶剂,搅拌络合5分钟后,依次加入3-硝基吲哚
ⅱ‑
q 0.1mmol,烯基碳酸酯
ⅲ‑
a 0.15mmol;反应完全后(24h),粗产品经柱色谱分离纯化得化合物i-q。
[0143]
白色固体;35.9mg,收率为90%;》20:1dr;m.p.149.0-151.2℃;
[0144]
结构鉴定:1h nmr(400mhz,dmso-d6)δ7.72(d,j=8.3hz,2h),7.45-7.39(m,3h),7.28(d,j=7.5hz,1h),7.22-7.16(m,1h),6.63(s,1h),4.90(s,1h),4.77(s,1h),4.38(d,j=15.2hz,1h),3.93(d,j=15.2hz,1h),3.37(s,2h),2.38(s,3h),2.14(s,3h);
[0145]
13
c nmr(101mhz,dmso-d6)δ144.4,142.0,136.9,136.8,135.1,130.1,129.2,127.4,126.6,126.1,123.7,111.9,92.0,91.8,63.6,35.5,21.1,20.3;
[0146]
hrms(esi-tof)calcd.for c
20h20
n2nao5s[m na]
423.0985;found:423.0990。
[0147]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。