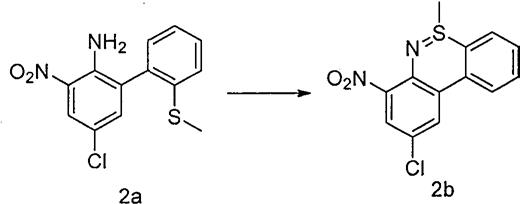
1.本发明涉及绿色化学和有机合成技术领域,具体涉及一种新的含芳基、芳杂环、吡啶环、烷基、烯基、脂环烃、酯基、氰基、羧基的[1,2]噻嗪类衍生物的绿色方法。
背景技术:
[0002]
噻嗪类化合物是一类重要的含氮杂环化合物,具有一定的药物作用和广泛的生物活性,也是许多天然产物以及药物活性分子的中间体,在医药、农用化学、生物化学以及材料化学领域中都有着广泛的应用。其中,[1,2]噻嗪类衍生物中硫亚胺的形成是生物组织发育的必要条件,同时硫亚胺也在有机合成中扮演了硝基转移试剂的角色,在电环化、芳烷硫胺化等反应中发挥着关键作用。除此之外,[1,2]噻嗪类衍生物也可作为荧光探针,在各种检测和标记中,如测定金属离子、农药残留、生物分子含量、示踪生物分子,标记大分子等方面得到大范围的应用。
[0003]
目前已开发了许多针对硫醚与氨基环合,合成[1,2]噻嗪类衍生物的方法,包括n-溴代丁二酰亚胺(nbs)、间氯过氧苯甲酸(m-cpba)、次氯酸叔丁酯(t-buocl)、二甲基亚砜 (dmso/h
)、高碘酸钠(naio4)、金属催化法(如pb(oac)4、oso4)、过氧单磺酸钾 (oxone-kbr)和酶转化(如卤过氧化物酶),但这些方法大多存在不足之处,如强氧化剂的大范围使用易产生安全问题,反应过程中会产生有毒有害的副产物对环境和人体健康都构成重大的威胁等。因此,开发一种绿色、安全、廉价、适用范围广的制备[1,2]噻嗪类衍生物的方法意义重大。
技术实现要素:
[0004]
本发明的目的在于开发一种绿色、高效的合成[1,2]噻嗪类衍生物的方法,用于制备由分子内环合形成的含芳基、芳杂环、吡啶环、烷基、烯基、脂环烃、酯基、氰基、羧基的[1,2] 噻嗪类衍生物。
[0005]
本发明采用的技术方案为:
[0006]
一种绿色的制备[1,2]噻嗪类衍生物的方法:
[0007]
在室温、中性条件下,以mbr
x
(m为fe
2
、fe
3
、ce
3
等)为催化剂,过氧化氢为唯一氧化剂,催化硫醚与氨基环合。
[0008]
反应以母核含烷烃、烯烃、芳烃、噁唑、噻唑、吡唑、咪唑等及其衍生物的硫醇为原料,如图,r可为烷烃、烯烃、炔烃、脂环烃、芳烃、噁唑、噻唑、噻吩、噻嗪、吡唑、咪唑、吡啶、等不同官能团,以及常用的保护基团包括tips、tbs、bn、ac、bz、piv和boc等。
[0009]
进一步地,所述催化剂为cebr3、febr3、febr2以及feso
4-kbr、fecl
3-kbr、fe(no3)3‑ꢀ
kbr、ce(no3)
3-kbr、cecl
3-kbr、ce(otf)
3-kbr等金属(fe
2
、fe
3
、ce
3
等)和溴化物的组合中的任意一种。
[0010]
进一步地,所述反应所用过氧化氢浓度为3-30%,过氧化氢与原料化合物的摩尔比为3
‑ꢀ
6∶1。
[0011]
进一步地,所述反应于溶剂中进行,所用溶剂为乙醇、乙腈、四氢呋喃以及其它与水互溶的溶剂中的任意一种与水组成的混合溶剂。
[0012]
进一步地,所述反应的较佳反应时间为0.5-2h。
[0013]
进一步地,所述反应的处理方法为,反应结束后用na2s2o3溶液淬灭,采用有机溶剂 (如乙酸乙酯、二氯甲烷)萃取。收集有机相,无水硫酸钠干燥,过滤,浓缩,即得。
[0014]
本发明具有以下优点:
[0015]
本发明首次实现了以h2o2为氧化剂的广泛底物合成和放大量制备[1,2]噻嗪类衍生物。在中性条件下由mbrx-h2o2原位生成rbs催化合成[1,2]噻嗪类衍生物。催化反应绿色可持续,且副产物为h2o,解决了许多其他强氧化剂催化反应带来的坏境破坏和产率低等问题。本发明避免了使用昂贵且复杂的催化剂,反应条件温和,反应过程简单,产率高,安全环保,符合绿色化学理念,适用性更加广泛,具有广阔的发展前景和应用前景,有望在有机合成、医药、农药及探针等领域中得到广泛应用。
附图说明
[0016]
图1和图2是实施例1的1h-nmr及
13
c-nmr谱图
[0017]
图3和图4是实施例2的1h-nmr及
13
c-nmr谱图
[0018]
图5和图6是实施例3的1h-nmr及
13
c-nmr谱图
[0019]
图7和图8是实施例4的1h-nmr及
13
c-nmr谱图
[0020]
图9和图10是实施例5的1h-nmr及
13
c-nmr谱图
[0021]
图11和图12是实施例6的1h-nmr及
13
c-nmr谱图
[0022]
图13和图14是实施例7的1h-nmr及
13
c-nmr谱图
[0023]
图15和图16是实施例8的1h-nmr及
13
c-nmr谱图
[0024]
图17和图18是实施例9的1h-nmr及
13
c-nmr谱图
[0025]
图19和图20是实施例10的1h-nmr及
13
c-nmr谱图
[0026]
图21和图22是实施例11的1h-nmr及
13
c-nmr谱图
[0027]
图23和图24是实施例12的1h-nmr及
13
c-nmr谱图
[0028]
图25和图26是实施例13的1h-nmr及
13
c-nmr谱图
[0029]
图27和图28是实施例14的1h-nmr及
13
c-nmr谱图
[0030]
图29和图30是实施例15的1h-nmr及
13
c-nmr谱图
具体实施方式
[0031]
以下实施例中的1h-nmr及
13
c-nmr谱均在室温条件下测定,记录在400mhz光谱仪上,1h-nmr为400mhz,
13
c-nmr为100mhz,光谱仪来自布鲁克公司。
[0032]
下面用具体实施方案详述本发明,但本发明实施不局限于这些实施例:
[0033]
实施例1
[0034][0035]
将etoh/h2o(3/1)23ml、1a(1g,4.64mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.40mmol,0.26g),h2o2水溶液(30%,14.0mmol,1.4ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物1b(产率:cebr3:91%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ7.95(d,j=8.1hz,1h),7.88(dd,j=7.9, 1.5hz,1h),7.58(dt,j=8.1,4.4hz,1h),7.45-7.36(m,2h),7.29(ddd,j=8.4,7.0,1.6hz,1h), 7.21(dd,j=8.1,1.4hz,1h),6.96(ddd,j=8.2,7.0,1.4hz,1h),2.33(s,3h).
13
c-nmr(101mhz,cdcl3)δ149.0,132.5,131.7,130.4,127.5,125.9,124.7,124.4,124.1,123.6,120.7,119.6,32.1. hrms(esi
)(m/z)calcd.for c
13h12
ns[m h]
214.0685;found 214.0690.
[0036]
实施例2:
[0037][0038]
将etoh/h2o(3/1)17ml、2a(1g,3.40mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.02mmol,0.38g),h2o2水溶液(30%,10.2mmol,1.1ml),在室温下搅拌反应3h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物2b(产率:febr2:53%;cebr3: 58%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.30-7.18(m,2h),7.02(td,j =7.5,1.0hz,1h),6.79(d,j=7.8hz,1h),3.48(s,2h),3.18(s,3h).
13
c-nmr(100mhz,cdcl3) δ:175.1,145.2,127.9,124.5,124.3,122.4,108.1,35.8,26.2.ir 3388.3,3057.4,1695.9,1611.2, 1464.8,1346.0,1263.0,1125.9,1089.0,753.7,655.4cm-1
;hrms(ci
)(m/z)calcd.for c9h9no [m]
147.0679;found 147.0687.
[0039]
实施例3:
[0040]
[0041]
将etoh/h2o(3/1)20ml、3a(1g,3.89mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.17mmol,0.44g),h2o2水溶液(30%,11.7mmol,1.2ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物3b(产率:cebr3:63%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ7.86(dd,j=8.5,2.1hz,1h),7.71(d,j =2.1hz,1h),7.44-7.35(m,1h),7.29(dd,j=8.0,1.2hz,1h),7.26-7.18(m,2h),6.76(d,j=8.5 hz,1h),4.04(s,2h),2.50(s,3h),2.38(s,3h).
13
c-nmr(101mhz,cdcl3)δ196.5,148.7,138.8, 135.9,132.2,130.5,130.2,128.9,127.8,125.1,124.9,124.5,114.4,26.2,15.3.hrms(esi
)(m/z) calcd.for c
15h16
nos[m h]
258.0947;found 258.0944.
[0042]
实施例4:
[0043][0044]
将etoh/h2o(3/1)19ml、4a(1g,3.74mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.12mmol,0.43g),h2o2水溶液(30%,11.2mmol,1.1ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物4b(产率:cebr3:96%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ8.92(d,j=8.2hz,1h),8.78(s,1h),8.63 (s,1h),7.90(d,j=9.1hz,1h),7.70-7.57(m,2h),7.56-7.42(m,2h),2.33(s,3h).
13
c-nmr(101 mhz,cdcl3)δ154.1,143.1,142.9,140.6,139.8,131.9,131.6,131.1,130.5,130.2,128.0,124.6, 120.6,114.7,28.6.hrms(esi
)(m/z)calcd.for c
15h12
n3s[m h]
266.0746;found 266.0737.
[0045]
实施例5:
[0046][0047]
将etoh/h2o(3/1)19ml、5a(1g,4.16mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.25mmol,0.47g),h2o2水溶液(30%,12.5mmol,1.3ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物5b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ8.05(dd,j=8.0,1.5hz,1h),7.94(d,j =8.1hz,1h),7.64(ddd,j=8.1,6.2,2.6hz,1h),7.59(dd,j=7.5,1.5hz,1h),7.54-7.45(m,2h), 6.93(t,j=7.7hz,1h),2.43(s,3h).
13
c-nmr(101mhz,cdcl3)δ152.86,135.14,132.31,131.40. 128.69,128.20,125.11,124.67,122.68,121.17,118.60,118.53,108.41,
33.29.hrms(esi
)(m/z)calcd.forc
14h11
n2s[m h]
239.0637;found239.0631.
[0048]
实施例6:
[0049][0050]
将etoh/h2o(3/1)19ml、6a(1g,4.02mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.20mmol,0.46g),h2o2水溶液(30%,12.0mmol,1.2ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物6b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(400mhz,chloroform-d)δ7.78(d,j=8.0hz,1h),7.67-7.54(m,2h),7.48-7.35(m,2h),6.95(ddd,j=12.2,7.7,1.4hz,1h),2.32(s,3h).
13
c-nmr(100mhz,cdcl3)δ:152.0(dd,j=250.3,14.0hz),146.6(dd,j=9.7,1.8hz),144.92(dd,j=239.2,13.9hz),132.0,131.3,128.0,124.6,124.4,122.7,116.6(dd,j=5.6,2.7hz),113.2(d,j=17.5hz),111.9(dd,j=18.7,2.1hz),32.0.hrms(esi )(m/z)calcd.forc
13h10
f2ns[m h]
250.0497;found250.0505.ir3018.5,2920.1,1717.3,1556.7,1482.1,1396.0,1261.2,1173.0,1131.0,1067.9,1031.9,990.8,929.9,890.8,850.6,801.3cm-1.
[0051]
实施例7:
[0052][0053]
将etoh/h2o(3/1)19ml、7a(1g,4.11mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.23mmol,0.47g),h2o2水溶液(30%,12.3mmol,1.3ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物7b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(400mhz,chloroform-d)δ7.39-7.33(m,1h),7.28-7.24(m,1h),7.23-7.18(m,2h),6.81(dd,j=8.7,2.9hz,1h),6.75(d,j=8.7hz,1h),6.66(d,j=2.8hz,1h),3.75(s,3h),2.38(s,3h).
13
cnmr(101mhz,chloroform-d)δ152.6,138.5,137.2,137.2,130.3,128.5,127.2,124.9,124.6,117.1,115.6,115.2,55.7,15.3.hrms(esi
)(m/z)calcd.forc
14h16
nos[m h]
246.0947;found246.0944.ir3441.6,3352.2,2987.2,2920.5,2825.4,1595.1,1500.0,1461.2,1425.1,1323.9,1274.6,1243.4,1207.9,1170.3,1083.9,1036.4,959.5,878.7,819.4cm-1
.
[0054]
实施例8:
[0055][0056]
将etoh/h2o(3/1)19ml、8a(1g,3.72mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.11mmol,0.42g),h2o2水溶液(30%,11.1mmol,1.1ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物8b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(400mhz,chloroform-d)δ7.97(d,j=8.0hz,1h),7.87(t,j =1.9hz,1h),7.59(ddd,j=8.1,5.0,1.9hz,1h),7.47-7.32(m,3h),7.16(d,j=8.5hz,1h),2.35 (d,j=1.4hz,3h),1.38(d,j=1.4hz,9h).
13
c-nmr(101mhz,chloroform-d)δ145.6,142.5, 132.8,131.7,128.1,127.3,125.2,124.6,124.6,123.6,120.4,120.0,34.4,32.0,31.6.hrms(esi
) (m/z)calcd.for c17h20ns[m h]
270.1311;found270.1303.ir 2957.0,1666.3,1597.5,1475.6, 1433.8,1398.0,1362.1,1257.6,1142.4,1034.1,932.7,866.6,829.7cm-1
.
[0057]
实施例9:
[0058][0059]
将etoh/h2o(3/1)19ml、9a(1g,4.08mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.22mmol,0.46g),h2o2水溶液(30%,12.2mmol,1.3ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物9b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(400mhz,dmso-d6)δ7.84(d,j=8.1hz,1h),7.62-7.50(m, 1h),7.48-7.36(m,3h),7.01-6.90(m,1h),2.37(s,3h),2.27(s,3h).
13
c-nmr(100mhz,cdcl3) δ:152.0(d,j=175.5hz),138.7,131.2(d,j=7.6hz),127.4(d,j=2.8hz),126.9,123.2,120.3, 119.5,119.1,116.1(d,j=8.1hz),113.8(d,j=22.3hz),102.4(d,j=22.7hz),27.1,13.9. hrms(esi
)(m/z)calcd.for c
14h13
fns[m h]
246.0747;found 246.0750.
[0060]
实施例10:
[0061][0062]
将etoh/h2o(3/1)19ml、5a(1g,4.05mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.21mmol,0.46g),h2o2水溶液(30%,12.1mmol,1.2ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物5b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(400mhz,chloroform-d)δ7.90(d,j=8.1hz,1h),7.78(d,j=8.4hz,1h),7.59(dp,j=7.9,2.9,2.3hz,1h),7.51-7.34(m,2h),7.19(t,j=1.8hz,1h),6.91(dt,j=8.4,1.8hz,1h),2.35(s,3h).
13
cnmr(101mhz,chloroform-d)δ150.5,136.0,132.0,127.8,125.3,125.2,124.6,124.5,123.0,119.8,119.2,32.3.hrms(esi
)(m/z)calcd.forc
13h11
clns[m h]
248.0295;found248.0289.ir3045.8,1580.5,1529.2,1457.4,1379.7,1260.1,1210.4,1130.1,1080.4,997.7,954.7,928.,866.9,820.6cm-1
.
[0063]
实施例11:
[0064][0065]
将etoh/h2o(3/1)19ml、11a(1g,4.15mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.24mmol,0.47g),h2o2水溶液(30%,12.4mmol,1.3ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物11b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(400mhz,chloroform-d)δ7.94(d,j=8.1hz,1h),7.61-7.51(m,2h),7.45-7.35(m,2h),7.06(s,1h),2.36(s,6h),2.28(s,3h).
13
cnmr(101mhz,chloroform-d)δ144.8,133.6,132.8,132.5,131.4,127.8,127.2,124.9,124.2,123.7,122.1,120.3,31.8,21.0,18.6.hrms(esi
)(m/z)calcd.forc
15h16
ns[m h]
242.0998;found242.1006.
[0066]
实施例12:
[0067]
[0068]
将etoh/h2o(3/1)19ml、12a(1g,4.40mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.32mmol,0.50g),h2o2水溶液(30%,13.2mmol,1.3ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物12b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(400mhz,chloroform-d)δ7.94(d,j=8.0hz,1h),7.69(s, 1h),7.57(dt,j=8.8,4.6hz,1h),7.40(d,j=4.4hz,2h),7.12(s,2h),2.38(s,3h),2.31(d,j= 1.2hz,3h).
13
c-nmr(101mhz,chloroform-d)δ146.2,132.4,131.6,131.5,128.8,127.4,125.7, 124.6,124.4,124.3,123.7,120.6,31.8,21.0.hrms(esi
)(m/z)calcd.for c
14h14
ns[m h]
228.0841;found 228.0849.
[0069]
实施例13:
[0070][0071]
将etoh/h2o(3/1)19ml、13a(1g,4.11mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.23mmol,0.47g),h2o2水溶液(30%,12.3mmol,1.3ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物13b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(400mhz,chloroform-d)δ7.35(dt,j=7.9,4.4hz,1h), 7.28-7.23(m,1h),7.22-7.18(m,2h),6.97(d,j=8.3hz,1h),6.42(dd,j=8.3,2.5hz,1h), 6.35(d,j=2.5hz,1h),3.80(s,3h),2.38(s,3h).
13
c nmr(101mhz,chloroform-d)δ160.5, 145.0,139.2,136.9,131.4,130.8,128.3,124.8,124.4,118.9,104.1,101.0,55.1,15.2.hrms(esi
) (m/z)calcd.for c
14h14
nos[m h]
244.0791;found 244.0803.
[0072]
实施例14:
[0073][0074]
将etoh/h2o(3/1)19ml、14a(1g,4.69mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.11mmol,0.42g),h2o2水溶液(30%,11.1mmol,1.1ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物14b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(400mhz,chloroform-d)δ8.62(d,j=2.0hz,1h),8.08
‑ꢀ
8.02(m,1h),7.91(dd,j=8.6,2.0hz,1h),7.62(ddd,j=8.3,6.8,2.0hz,1h),7.48-7.40(m,2h), 7.17(d,j=8.6hz,1h),3.91(s,3h),2.37(s,3h).
13
c-nmr(101mhz,chloroform-d)δ
167.3, 154.4,132.2,132.2,131.1,128.1,126.6,125.5,124.9,124.7,122.3,120.6,119.7,51.8,32.8.hrms (esi
)(m/z)calcd.for c
15h14
no2s[m h]
272.0740;found 272.0736.
[0075]
实施例15:
[0076][0077]
将etoh/h2o(3/1)19ml、15a(1g,4.33mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(1.30mmol,0.49g),h2o2水溶液(30%,13.0mmol,1.3ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物15b(产率:cebr3:90%)。该化合物的表征数据如下:1h-nmr(700mhz,cdcl3)δ7.85(d,j=8.1hz,1h),7.84-7.78(m, 1h),7.55(dt,j=8.1,4.3hz,1h),7.37(d,j=3.9hz,2h),6.85(dd,j=10.8,2.7hz,1h),6.64 (ddd,j=8.7,8.1,2.7hz,1h),2.31(s,3h).
13
c-nmr(100mhz,cdcl3)δ:164.7(d,j=140.8hz), 151.1(d,j=6.7hz),131.6,131.4,126.9,125.2(d,j=5.9hz),124.0,123.7,122.0,116.6(d,j=1.4 hz),110.7,106.7,31.7.hrms(esi
)(m/z)calcd.for c
13h11
fns[m h]
232.0591;found 248.0908.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。