一种检测淋巴细胞表面pd-1受体的抗体组合物及其应用
技术领域
1.本发明属于医学检测技术领域,尤其涉及一种检测淋巴细胞表面pd-1受体的抗体组合物及其应用。
背景技术:
2.程序性死亡蛋白1(programmed cell death protein-1,简称pd-1)是一个50~55kd的免疫球蛋白超家族i型跨膜糖蛋白,属于cd28超家族成员之一,主要表达于活化的淋巴细胞及单核细胞中,其与配体pd-l1/pd-l2相互作用,参与外周组织中的免疫应答的抑制。正常情况下,免疫系统会对聚集在淋巴结或脾脏的外来抗原产生反应,促进具有抗原特异性的t细胞增殖,而程序性细胞死亡蛋白-1(pd-1)与配体pd-l1/pd-l2结合,可传导抑制性信号,从而抑制t细胞的增殖。pd-1分子通过其表达水平的高低来调节免疫反应的强度和广度。
3.在临床中通过pd-1/pd-l1轴免疫筛查点抑制剂药物时,依据国内外相关专家的共识,主要将对肿瘤组织通过免疫组织化学染色检测pd-l1表达作为伴随诊断的首选方案,但其准确性、标准化判断等仍存在不小的问题。同时,活检组织标本来源困难,不能实现多次检测及动态观察的目的。
4.检测外周血中pd-1的表达水平是了解pd-1/pd-l1轴整体情况的有用标志,可以实现多次检测、动态观察,帮助临床医生了解机体的免疫状态,同时有助于对病程进展的判断、治疗方案的制定、药物疗效及预后的分析,从而做出更准确的评估。
5.因此,如何提供一种可以快速、准确地检测人外周血或骨髓液中淋巴细胞表面pd-1受体的产品及方法,已成为亟待解决的问题。
技术实现要素:
6.针对现有技术的不足和实际需求,本发明提供一种检测淋巴细胞表面pd-1受体的抗体组合物及其应用,配合流式细胞仪可以对淋巴细胞表面的pd-1表达水平进行检测,操作简单,灵敏度高,特异性好,只需1个小时就能完成检测,应用价值高。
7.为达此目的,本发明采用如下技术方案:
8.第一方面,本发明提供了一种检测淋巴细胞表面pd-1受体的抗体组合物,所述检测淋巴细胞表面pd-1受体的抗体组合物包括抗pd-1抗体,以及抗cd45抗体、抗cd3抗体、抗cd4抗体或抗cd8抗体中的任意一种或至少两种的组合。
9.本发明中,所述抗cd45抗体、抗cd3抗体、抗cd4抗体和抗cd8抗体可以标记细胞膜表面抗原cd45、cd3、cd4和cd8,定性区分出淋巴细胞,再用pd-1抗体对淋巴细胞进行检测,快速、精准地分析淋巴细胞pd-1的表达情况。
10.本发明中,采用流式细胞术检测淋巴细胞pd-1受体的表达情况。流式细胞术(flow cytometry,fcm)是一种在功能水平上对单细胞或其他生物粒子进行定量分析和分选的检测手段,它可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数,配合上述抗体
组合物,可以对淋巴细胞表面pd-1受体的表达情况进行快速、准确的分析。
11.优选地,所述抗pd-1抗体包括pd-1-apc荧光单克隆抗体。
12.优选地,所述抗cd45抗体包括cd45-qb500荧光单克隆抗体。
13.优选地,所述抗cd3抗体包括cd3-percp荧光单克隆抗体。
14.优选地,所述抗cd4抗体包括cd4-fitc荧光单克隆抗体。
15.优选地,所述抗cd8抗体包括cd8-pe荧光单克隆抗体。
16.优选地,所述pd-1-apc荧光单克隆抗体在检测淋巴细胞表面pd-1受体的抗体组合物中的重量份数为8~13份,例如可以是8份、9份、10份、11份、12份或13份等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
17.优选地,所述cd45-qb500荧光单克隆抗体在检测淋巴细胞表面pd-1受体的抗体组合物中的重量份数为4~6份,例如可以是4份、4.5份、5份、5.5份或6份等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
18.优选地,所述cd3-percp荧光单克隆抗体在检测淋巴细胞表面pd-1受体的抗体组合物中的重量份数为5~12份,例如可以是5份、6份、7份、8份、9份、10份、11份或12份等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
19.优选地,所述cd4-fitc荧光单克隆抗体在检测淋巴细胞表面pd-1受体的抗体组合物中的重量份数为5~12份,例如可以是5份、6份、7份、8份、9份、10份、11份或12份等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
20.优选地,所述cd8-pe荧光单克隆抗体在检测淋巴细胞表面pd-1受体的抗体组合物中的重量份数为5~12份,例如可以是5份、6份、7份、8份、9份、10份、11份或12份等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
21.优选地,以重量份数计,所述检测淋巴细胞表面pd-1受体的抗体组合物包括pd-1-apc荧光单克隆抗体8~13份、cd45-qb500荧光单克隆抗体4~6份、cd3-percp荧光单克隆抗体5~12份、cd4-fitc荧光单克隆抗体5~12份和cd8-pe荧光单克隆抗体5~12份。
22.第二方面,本发明提供了一种检测淋巴细胞表面pd-1受体的试剂盒,所述检测淋巴细胞表面pd-1受体的试剂盒包括第一方面所述的检测淋巴细胞表面pd-1受体的抗体组合物。
23.优选地,所述检测淋巴细胞表面pd-1受体的试剂盒还包括红细胞裂解液和辅助试剂。
24.优选地,所述辅助试剂包括磷酸盐缓冲液。
25.第三方面,本发明提供一种检测淋巴细胞表面pd-1受体表达率的方法,所述方法包括:
26.使用第一方面所述的检测淋巴细胞表面pd-1受体的抗体组合物和/或第二方面所述的检测淋巴细胞表面pd-1受体的试剂盒,对样本进行检测。
27.优选地,所述方法包括:
28.将样本与所述的检测淋巴细胞表面pd-1受体的抗体组合物混合,避光孵育,裂解红细胞后,上机检测,并进行分析。
29.优选地,所述分析包括:
30.设置淋巴细胞门,获取淋巴细胞;
31.在淋巴细胞中圈图,得到各群淋巴细胞的pd-1受体表达率。
32.作为优选技术方案,本发明所述检测淋巴细胞表面pd-1受体表达率的方法,包括以下步骤:
33.将样本与所述的检测淋巴细胞表面pd-1受体的抗体组合物混合,避光孵育;
34.使用红细胞裂解液裂解红细胞,并进行清洗;
35.收集细胞,上机检测,并进行分析;
36.所述分析包括:
37.设置淋巴细胞门,获取淋巴细胞;
38.在淋巴细胞中圈图,得到各群淋巴细胞的pd-1受体表达率。
39.作为优选技术方案,本发明所述检测淋巴细胞表面pd-1受体表达率的方法,具体包括以下步骤:
40.(1)在流式上样管底部加入cd45-qb500荧光单克隆抗体4~6份、cd3-percp荧光单克隆抗体5~12份、cd4-fitc荧光单克隆抗体5~12份和cd8-pe荧光单克隆抗体5~12份,以及pd-1-apc荧光单克隆抗体8~13份。
41.(2)吸取混匀的骨髓血或外周血样本,加入管底,避免样本碰到流式上样管管壁。
42.(3)涡动混匀,室温避光孵育15~20分钟。
43.(4)向管内加入0.5~3ml红细胞裂解液,涡动混匀,室温避光孵育8~12分钟。
44.(5)300g离心4~7分钟,弃上清。
45.(6)向管内加入2~5ml磷酸盐缓冲液,涡动混匀,300g离心4~7分钟,弃上清。
46.(7)向管内加入0.5~1ml磷酸盐缓冲液并完全混合。
47.(8)用200目滤网过滤样本中的悬浊物后上机检测。
48.(9)分析:
49.设置淋巴细胞门,获取淋巴细胞;
50.在淋巴细胞中圈图,得到各群淋巴细胞的pd-1受体表达率。
51.相比于现有技术,本发明具有如下有益效果:
52.(1)流式细胞术检测分析迅速,通量高,可同时分析上万个细胞,并同时从一个细胞中测得多个参数,本发明中的检测淋巴细胞表面pd-1受体的抗体组合物配合流式细胞术,可以快速、精度地评价免疫检查点(pd-1)标志物的表达水平;
53.(2)本发明中的检测淋巴细胞表面pd-1受体的试剂盒可对外周血、骨髓液等多种样本进行检测,操作简便,检测效率高,仅需1小时即可完成检测,并且可以实现多次检测、动态观察,弥补了对肿瘤组织进行免疫组织化学染色检测表达的复查困难、结果判断无标准化的缺陷,可满足临床对于快速检测、指导用药、判断疾病预后的需求。
附图说明
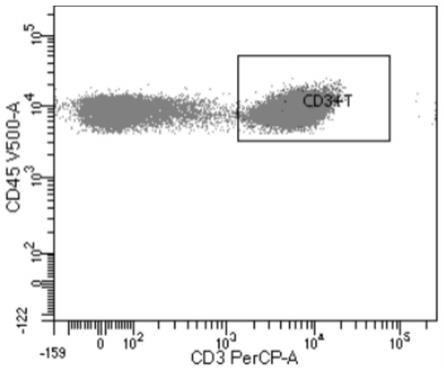
54.图1为外周血中cd3 t淋巴细胞的流式检测结果;
55.图2为外周血中cd3 cd4 的t淋巴细胞及cd3 cd8 的t淋巴细胞的流式检测结果;
56.图3为外周血中cd3 t淋巴细胞pd-1表达的阴性对照的流式检测结果;
57.图4为外周血中cd3 cd4 的t淋巴细胞pd-1表达的阴性对照的流式检测结果;
58.图5为外周血中cd3 cd8 的t淋巴细胞pd-1表达的阴性对照的流式检测结果;
59.图6为外周血中cd3 t淋巴细胞pd-1表达率的流式检测结果;
60.图7为外周血中cd3 cd4 的t淋巴细胞pd-1表达率的流式检测结果;
61.图8为外周血中cd3 cd8 的t淋巴细胞pd-1表达率的流式检测结果;
62.图9为骨髓中cd3 t淋巴细胞的流式检测结果;
63.图10为骨髓中cd3 cd4 的t淋巴细胞及cd3 cd8 的t淋巴细胞的流式检测结果;
64.图11为骨髓中cd3 t淋巴细胞pd-1表达的阴性对照的流式检测结果;
65.图12为骨髓中cd3 cd4 的t淋巴细胞pd-1表达的阴性对照的流式检测结果;
66.图13为骨髓中cd3 cd8 的t淋巴细胞pd-1表达的阴性对照的流式检测结果;
67.图14为骨髓中cd3 t淋巴细胞pd-1表达率的流式检测结果;
68.图15为骨髓中cd3 cd4 的t淋巴细胞pd-1表达率的流式检测结果;
69.图16为骨髓中cd3 cd8 的t淋巴细胞pd-1表达率的流式检测结果。
具体实施方式
70.为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
71.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
72.材料与方法:
73.pd-1-apc荧光单克隆抗体购自天津旷博同生生物技术有限公司,货号a6024r12;
74.cd45-qb500荧光单克隆抗体购自天津旷博同生生物技术有限公司,货号a6015v32;
75.cd4-fitc/cd8-pe/cd3-percp荧光单克隆抗体购自天津旷博同生生物技术有限公司,货号z6410011。
76.实施例1
77.本实施例提供一种检测淋巴细胞表面pd-1受体的抗体组合物,以重量份数计,所述检测淋巴细胞表面pd-1受体的抗体组合物包括pd-1-apc荧光单克隆抗体10份、cd45-qb500荧光单克隆抗体5份、cd3-percp荧光单克隆抗体7份、cd4-fitc荧光单克隆抗体7份和cd8-pe荧光单克隆抗体7份;
78.其中,所述cd45-qb500荧光单克隆抗体、cd3-percp荧光单克隆抗体和cd4-fitc荧光单克隆抗体为组合试剂cd4-fitc/cd8-pe/cd3-percp荧光单克隆抗体,共添加21份。
79.实施例2
80.本实施例提供一种检测淋巴细胞表面pd-1受体的抗体组合物,以重量份数计,所述检测淋巴细胞表面pd-1受体的抗体组合物包括pd-1-apc荧光单克隆抗体8份、cd45-qb500荧光单克隆抗体6份、cd3-percp荧光单克隆抗体5份、cd4-fitc荧光单克隆抗体5份和cd8-pe荧光单克隆抗体5份;
81.其中,所述cd45-qb500荧光单克隆抗体、cd3-percp荧光单克隆抗体和cd4-fitc荧光单克隆抗体为组合试剂cd4-fitc/cd8-pe/cd3-percp荧光单克隆抗体,共添加15份。
82.实施例3
83.本实施例提供一种检测淋巴细胞表面pd-1受体的抗体组合物,以重量份数计,所述检测淋巴细胞表面pd-1受体的抗体组合物包括pd-1-apc荧光单克隆抗体13份、cd45-qb500荧光单克隆抗体4份、cd3-percp荧光单克隆抗体12份、cd4-fitc荧光单克隆抗体12份和cd8-pe荧光单克隆抗体12份;
84.其中,所述cd45-qb500荧光单克隆抗体、cd3-percp荧光单克隆抗体和cd4-fitc荧光单克隆抗体为组合试剂cd4-fitc/cd8-pe/cd3-percp荧光单克隆抗体,共添加36份。
85.实施例4
86.本实施例提供一种检测淋巴细胞表面pd-1受体的试剂盒,所述检测淋巴细胞表面pd-1受体的试剂盒包括实施例1中的检测淋巴细胞表面pd-1受体的抗体组合物;
87.所述检测淋巴细胞表面pd-1受体的试剂盒还包括红细胞裂解液和辅助试剂,所述辅助试剂为磷酸盐缓冲液。
88.实施例5
89.与实施例4的区别仅在于,使用实施例2中的检测淋巴细胞表面pd-1受体的抗体组合物替换实施例1中的检测淋巴细胞表面pd-1受体的抗体组合物,其余原料及组分与实施例4相同。
90.实施例6
91.与实施例4的区别仅在于,使用实施例3中的检测淋巴细胞表面pd-1受体的抗体组合物替换实施例1中的检测淋巴细胞表面pd-1受体的抗体组合物,其余原料及组分与实施例4相同。
92.测试例1
93.本测试例使用实施例4中的检测淋巴细胞表面pd-1受体的试剂盒,对血液样本中淋巴细胞表面pd-1受体的表达率进行检测,步骤如下:
94.(1)取两支流式上样管,一支管底加入pd-1-apc荧光单克隆抗体10份、cd45-qb500荧光单克隆抗体5份和cd4-fitc/cd8-pe/cd3-percp荧光单克隆抗体21份;另外一支加入cd45-qb500荧光单克隆抗体5份和cd4-fitc/cd8-pe/cd3-percp荧光单克隆抗体21份(作为阴性对照)。
95.(2)分别吸取100μl混匀的外周血样本,分别加入两支流式上样管的管底,避免样本碰到流式上样管管壁。
96.(3)涡动混匀,室温避光孵育20分钟。
97.(4)分别向两支管内各加入1ml红细胞裂解液,涡动混匀,室温避光孵育10分钟。
98.(5)300g离心5分钟,弃上清。
99.(6)分别向两支管内各加入3ml磷酸盐缓冲液,涡动混匀,300g离心5分钟,弃上清。
100.(7)分别向两支管内加入0.5ml磷酸盐缓冲液并完全混合。
101.(8)用200目滤网过滤样本中的悬浊物后上流式细胞仪进行检测。
102.(9)分析:
103.在cd45/ssc上设置淋巴细胞门,获取1万个淋巴细胞后停止吸样;
104.使用流式细胞仪圈图,得出各群淋巴细胞的pd-1受体表达率。
105.检测结果如图1~图8所示,其中,图1为外周血中cd3 t淋巴细胞的流式检测结果;
图2为外周血中cd3 cd4 的t淋巴细胞及cd3 cd8 的t淋巴细胞的流式检测结果;图3为外周血中cd3 t淋巴细胞pd-1表达的阴性对照的流式检测结果;图4为外周血中cd3 cd4 的t淋巴细胞pd-1表达的阴性对照的流式检测结果;图5为外周血中cd3 cd8 的t淋巴细胞pd-1表达的阴性对照的流式检测结果;图6为外周血中cd3 t淋巴细胞pd-1表达率的流式检测结果;图7为外周血中cd3 cd4 的t淋巴细胞pd-1表达率的流式检测结果;图8为外周血中cd3 cd8 的t淋巴细胞pd-1表达率的流式检测结果。
106.对图片数据进行整理,结果如表1所示。
107.表1
108.项目结果(%)参考值(%)提示总t淋巴细胞44.156.0~86.0
↓
辅助t淋巴细胞42.327.0~51.0-细胞毒性t淋巴细胞50.715.0~44.0
↑
总t淋巴细胞pd-1表达率34.25.61~29.43
↑
辅助t淋巴细胞pd-1表达率36.46.60~34.34
↑
细胞毒性t淋巴细胞pd-1表达率42.94.21~44.89-109.由上述图片以表格可以看出,样本中总t淋巴细胞比例偏低,cd3 cd8 的细胞毒性t淋巴细胞比例偏高,总t淋巴细胞和辅助性t淋巴细胞的pd-1表达率均升高,t淋巴细胞增殖受到抑制。
110.上述结果表明采用本技术中的检测淋巴细胞表面pd-1受体的抗体组合物,配合流式检测技术,可以对外周血样本中淋巴细胞表面pd-1受体的表达情况进行快速、精准的检测,方法简单,用时较短,结果准确,在临床检测及用药指导中具有重要的意义。
111.测试例2
112.本测试例使用实施例5中的检测淋巴细胞表面pd-1受体的试剂盒,对血液样本中淋巴细胞表面pd-1受体的表达率进行检测,检测方法与测试例1中的相同。
113.测试例3
114.本测试例使用实施例6中的检测淋巴细胞表面pd-1受体的试剂盒,对血液样本中淋巴细胞表面pd-1受体的表达率进行检测,检测方法与测试例1中的相同。
115.结果显示,测试例2、测试例3的检测结果与测试例1的结果十分接近。出于节省篇幅的目的,此处便不再进行赘述。
116.测试例4
117.本测试例使用实施例4中的检测淋巴细胞表面pd-1受体的试剂盒,对骨髓样本中淋巴细胞表面pd-1受体的表达率进行检测,步骤如下:
118.(1)取两支流式上样管,一支管底加入pd-1-apc荧光单克隆抗体10份、cd45-qb500荧光单克隆抗体5份和cd4-fitc/cd8-pe/cd3-percp荧光单克隆抗体21份;另外一支加入cd45-qb500荧光单克隆抗体5份和cd4-fitc/cd8-pe/cd3-percp荧光单克隆抗体21份(作为阴性对照)。
119.(2)分别吸取100μl混匀的骨髓液样本,分别加入两支流式上样管的管底,避免样本碰到流式上样管管壁。
120.(3)涡动混匀,室温避光孵育20分钟。
121.(4)分别向两支管内各加入1ml红细胞裂解液,涡动混匀,室温避光孵育10分钟。
122.(5)300g离心5分钟,弃上清。
123.(6)分别向两支管内各加入3ml磷酸盐缓冲液,涡动混匀,300g离心5分钟,弃上清。
124.(7)分别向两支管内加入0.5ml磷酸盐缓冲液并完全混合。
125.(8)用200目滤网过滤样本中的悬浊物后上流式细胞仪进行检测。
126.(9)分析:
127.在cd45/ssc上设置淋巴细胞门,获取1万个淋巴细胞后停止吸样;
128.使用流式细胞仪圈图,得出各群淋巴细胞的pd-1受体表达率。
129.检测结果如图9~图16所示,其中,图9为骨髓中cd3 t淋巴细胞的流式检测结果;图10为骨髓中cd3 cd4 的t淋巴细胞及cd3 cd8 的t淋巴细胞的流式检测结果;图11为骨髓中cd3 t淋巴细胞pd-1表达的阴性对照的流式检测结果;图12为骨髓中cd3 cd4 的t淋巴细胞pd-1表达的阴性对照的流式检测结果;图13为骨髓中cd3 cd8 的t淋巴细胞pd-1表达的阴性对照的流式检测结果;图14为骨髓中cd3 t淋巴细胞pd-1表达率的流式检测结果;图15为骨髓中cd3 cd4 的t淋巴细胞pd-1表达率的流式检测结果;图16为骨髓中cd3 cd8 的t淋巴细胞pd-1表达率的流式检测结果。
130.对图片数据进行整理,结果如表2所示。
131.表2
[0132][0133][0134]
上述图片及表格可以看出,骨髓样本中cd3 cd8 的细胞毒性t淋巴细胞比例略高,总t淋巴细胞和辅助性t淋巴细胞的pd-1表达率均升高。
[0135]
上述结果表明采用本技术中的检测淋巴细胞表面pd-1受体的抗体组合物,配合流式检测技术,可以对骨髓样本中淋巴细胞表面pd-1受体的表达情况进行快速、精准的检测,方法简单,用时较短,结果准确,在临床检测及用药指导中具有重要的意义。
[0136]
综上所述,本发明所述检测淋巴细胞表面pd-1受体的抗体组合物可以对淋巴细胞进行定性区分,并分别检测各个类群的淋巴细胞表面pd-1受体的表达量,结果准确,灵敏度好,检测效率高;所述检测方法容易操作,用时较短,实现了对相关样本的持续检测及动态观察,有助于判断机体的免疫状态、病程进展,为药物治疗提供了指导。
[0137]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。