1.本发明属于有机合成,具体涉及一种制备环硫脲化合物的方法。
背景技术:
2.芳基环硫脲化合物在农业、化学、医药领域具有广泛的应用,吸引了众多化学家和医药学家浓厚的兴趣。农业上,异硫脲类衍生物可以用做除草剂、杀虫剂、杀螨剂等。化学合成上,异硫脲结构的化合物可被用作催化剂和过渡金属催化的配体。在医药方面应用更广,拥有很好的抗病毒、抗组胺活性。因此,越来越多的异硫脲药物分子被合成与设计,表现出非常有意义的生物学作用,有效促进了医药学领域的发展,已经有hiv
‑
1抑制剂、抗感染剂、中枢神经剂和缬氨酸蛋白抑制剂等方面的研究[(a) ma c, wu a, wu y, et al. arch. pharm. 2013, 346, 891
‑
900. (b) mugnaini c, manetti f, este j a, clotet
‑
codina i, et al. bioorg. med. chem. lett.2006, 16, 3541
‑
3544. (c) srivastava v k, kumar p, agarwal j c, et al. pharmazie. 1981, 36, 441. (d) rogovoy b, vvedenskiy v, cai x, et al. wo 2003095396, 2003]:现有技术使用异硫脲和芳基异氰酸酯之间的易位交换反应和重氮盐与n
‑
苯硫脲的s
‑
芳基化反应,但其原料不易获得,制备比较繁琐,原子经济性差,工业合成成本较高。金属催化的方法虽然基本适用于各种环硫脲化合物的合成,但也存在一些缺点。如需要高温、反应时间长,催化剂负载量大,试剂价格昂贵,且容易造成金属废弃物污染。因此,开发无金属催化、原料廉价、非空气敏感的反应系统制备环硫脲化合物是非常需要的。
技术实现要素:
[0003]
本发明公开了一种制备环硫脲化合物的方法,操作十分简便,无需金属催化,原料廉价易得,官能团耐受性好。为s
‑
芳基异硫脲砌块的药物合成提供了一种优秀方案,对未来的药物合成发展具有重大意义。
[0004]
本发明采用如下技术方案:一种制备环硫脲化合物的方法,以环硫脲与碘苯为底物,在金属氢化物存在下、溶剂中反应,得到环硫脲化合物。
[0005]
本发明中,碘苯的化学结构式如下:环硫脲的化学结构式如下:、本发明环硫脲化合物的化学结构式如下:、上述结构式中,r选自氢、卤素、烷基、氟烷基或者烷氧基;进一步的,环硫脲中,取代基可以为一个,也可以为多个。
[0006]
本发明公开的环硫脲与碘苯的反应在金属氢化物存在下、溶剂中进行,无需其他物质,室温下反应2~10小时,得到产物环硫脲化合物为单一产物。
[0007]
本发明中,金属氢化物为氢化钠、氢化钾、氢化钙、氢化锂等;金属氢化物的用量为环硫脲摩尔量的3~5倍。进一步的,碘苯的用量为环硫脲摩尔量的1~3倍。
[0008]
本发明中,溶剂为二甲基乙酰胺dma、四氢呋喃thf、乙腈ch3cn、乙二醇二甲醚dme、甲苯toluene中的一种或几种,优选为thf和dma,两者体积比优选为(4~8)∶1。
[0009]
金属催化可用于环硫脲化合物的合成,但也存在一些缺点,如需要高温、反应时间长,催化剂负载量大,试剂价格昂贵,且容易造成金属废弃物污染。因此,开发无金属催化、原料廉价、非空气敏感的反应系统制备环硫脲化合物是非常需要的。近几年,化学家们开始尝试直接使用n位取代的咪唑与二硫化物发生亲核取代反应,无需金属催化剂方便的生成s
‑
芳基化咪唑,但需要使用n
‑
buli进行脱质子化,反应需无水、无氧氛围,安全性差。本发明在nah作用下使用碘苯与环硫脲化合物进行亲核加成反应,实现了首次利用环硫脲作为第一反应原料直接碘苯与进行c
‑
s偶联生成环硫脲化合物,具有很好的区域选择性。该方案操作十分简便,无需金属催化,原料廉价易得,官能团耐受性好。为环硫脲化合物砌块的药物合成提供了一种优秀方案,对未来的药物合成发展具有重大意义。
附图说明
[0010]
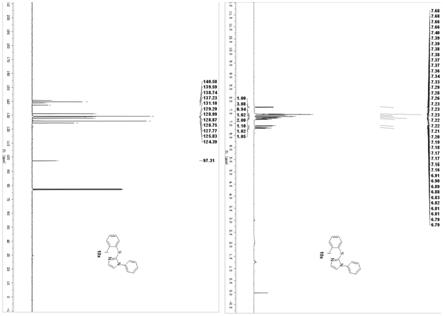
图1为化合物10x的核磁谱图。
具体实施方式
[0011]
环硫脲化合物结构存在于许多化学分子中,广泛应用于功能材料和药物领域,吸
(s, 1h), 7.57 (d, j = 7.6 hz, 2h), 7.47 (t, j = 7.3 hz, 2h), 7.39 (t, j = 7.1 hz, 1h), 6.81 (d, j = 18.5 hz, 2h)。
[0018]
部分原料结构式如下:部分原料结构式如下:部分原料结构式如下:部分原料结构式如下:部分原料结构式如下:部分原料结构式如下:部分原料结构式如下:实施例一将nah(1.2 mmol, 4.0 equiv)称量于反应瓶中,悬于无水thf(0.8 ml)中搅拌,在搅拌过程中滴加环硫脲9(0.3 mmol, 1.0 equiv,溶于0.2 ml dma),加完后在室温下搅拌2min,然后加入二碘苯2a(0.6 mmol, 2.0 equiv,溶于0.2 ml thf),继续在室温下搅拌,tlc监测反应完成。反应完成后,加入冰水和四氢呋喃淬灭反应,乙酸乙酯萃取3次,合并有机层,用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,旋干溶剂,加入适量硅胶粉拌样,快速柱层析分离,得到产品环硫脲化合物10。
[0019]
r为氢时,反应3小时结束,收率70%;r为4
‑
cl时,反应2小时结束,收率88%;r为3
‑
cl时,反应10小时结束,收率64%;r为3
‑
cf3时,反应4小时结束,收率68%;r为4
‑
me时,反应4小时结束,收率66%;r为2
‑
me时,反应4小时结束,收率50%;r为4
‑
meo时,反应10小时结束,收率59%。
[0020]
实施例二将nah(1.2 mmol, 4.0 equiv)称量于反应瓶中,悬于无水thf(0.8 ml)中搅拌,在搅拌过程中滴加环硫脲9ae(0.3 mmol, 1.0 equiv,溶于0.2 ml dma),加完后在室温下搅拌1.5min,然后加入二碘苯2a(0.6 mmol, 2.0 equiv,溶于0.2 ml thf),继续在室温下搅
拌,tlc监测反应完成。4小时反应完成后,加入冰水和四氢呋喃淬灭反应,乙酸乙酯萃取3次,合并有机层,用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,旋干溶剂,加入适量硅胶粉拌样,快速柱层析分离,得到产品环硫脲化合物10ae,收率60%。
[0021]
上述产物环硫脲化合物的核磁数据如下:1h nmr (400 mhz, cdcl3) δ 7.67 (dd, j = 7.9, 1.3 hz, 1h), 7.40
ꢀ–ꢀ
7.35 (m, 3h), 7.33 (d, j = 1.3 hz, 1h), 7.29 (d, j = 1.3 hz, 1h), 7.24
ꢀ–ꢀ
7.20 (m, 2h), 7.20
ꢀ–ꢀ
7.15 (m, 1h), 6.90 (dd, j = 8.0, 1.5 hz, 1h), 6.81 (td, j = 7.8, 1.5 hz, 1h). 13
c nmr (101 mhz, cdcl3) δ 140.58, 139.59, 138.74, 137.23, 131.10, 129.29, 128.99, 128.87, 128.75, 127.77, 125.83, 124.39, 97.31。
[0022]1h nmr (400 mhz, cdcl3) δ 7.70 (dd, j = 7.9, 1.3 hz, 1h), 7.36 (m, 3h), 7.26 (s, 1h), 7.22
ꢀ–ꢀ
7.13 (m, 3h), 6.90 (dd, j = 8.0, 1.5 hz, 1h), 6.83 (td, j = 7.7, 1.5 hz, 1h). 13
c nmr (101 mhz, cdcl3) δ 140.24, 139.75, 138.92, 135.72, 134.79, 131.33, 129.54, 129.08, 128.97, 128.00, 127.14, 124.26, 97.50。
[0023]1h nmr (400 mhz, cdcl3) δ 7.70 (dd, j = 7.9, 1.3 hz, 1h), 7.38
ꢀ–ꢀ
7.30 (m, 3h), 7.27 (d, j = 0.8 hz, 1h), 7.22
ꢀ–ꢀ
7.18 (m, 2h), 7.15
ꢀ–ꢀ
7.09 (m, 1h), 6.95 (dd, j = 8.0, 1.5 hz, 1h), 6.84 (td, j = 7.8, 1.5 hz, 1h). 13
c nmr (101 mhz, cdcl3) δ 139.97, 139.71, 139.05, 138.15, 134.84, 131.23, 130.28, 129.45, 128.98, 128.93, 128.10, 126.20, 124.15, 124.14, 97.91。
[0024]1h nmr (400 mhz, cdcl3) δ 7.66 (dd, j = 7.9, 1.3 hz, 1h), 7.63 (d, j = 7.8 hz, 1h), 7.53 (t, j = 7.8 hz, 1h), 7.47
ꢀ–ꢀ
7.39 (m, 2h), 7.35 (d, j = 1.4 hz, 1h), 7.30 (d, j = 1.4 hz, 1h), 7.21
ꢀ–ꢀ
7.15 (m, 1h), 6.93 (dd, j = 8.0, 1.5 hz, 1h), 6.86
ꢀ–ꢀ
6.78 (m, 1h). 13
c nmr (101 mhz, cdcl3) δ 139.85, 139.74, 139.19, 137.65, 131.86 (d, j = 33.3 hz), 131.41, 129.72 (d, j = 70.7 hz), 129.34, 128.96, 128.15, 125.59 (q, j = 11.1 hz), 124.67, 124.20, 122.94 (q, j = 11.1 hz), 121.96, 97.74. 19
f nmr (377 mhz, cdcl3) δ
ꢀ‑
62.73。
[0025]1h nmr (400 mhz, cdcl3) δ 7.78 (dd, j = 7.9, 1.1 hz, 1h), 7.41 (d, j = 1.1 hz, 1h), 7.35 (d, j = 1.2 hz, 1h), 7.31
ꢀ–ꢀ
7.25 (m, 3h), 7.20 (d, j = 8.3 hz, 2h), 6.97 (dd, j = 8.0, 1.3 hz, 1h), 6.90 (td, j = 7.7, 1.4 hz, 1h), 2.46 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 140.81, 139.60, 138.84, 138.72, 134.77, 131.03, 129.87, 128.88, 127.70, 125.61, 124.47, 97.18, 21.24。
[0026]1h nmr (400 mhz, cdcl3) δ 7.65 (dd, j = 7.9, 1.3 hz, 1h), 7.32 (m, 2h), 7.28
ꢀ–ꢀ
7.25 (m, 1h), 7.21
ꢀ–ꢀ
7.16 (m, 1h), 7.15
ꢀ–ꢀ
7.10 (m, 2h), 7.04 (dd, j = 7.9, 1.5 hz, 1h), 6.93 (d, j = 7.8 hz, 1h), 6.84
ꢀ–ꢀ
6.77 (m, 1h), 1.98 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 140.03, 139.61, 139.51, 136.27, 135.35, 131.11, 130.98, 129.89, 129.50, 128.74, 127.96, 127.55, 126.65, 124.36, 98.49, 17.54。
[0027]1h nmr (400 mhz, cdcl3) δ 7.69 (dd, j = 7.9, 1.2 hz, 1h), 7.31 (d, j = 1.2 hz, 1h), 7.24 (d, j = 1.2 hz, 1h), 7.18 (td, j = 8.0, 1.3 hz, 1h), 7.15
ꢀ–ꢀ
7.09 (m, 2h), 6.87 (dt, j = 4.2, 2.7 hz, 3h), 6.81 (td, j = 7.7, 1.5 hz, 1h), 3.81 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 159.74, 140.84, 139.60, 138.96, 130.97, 130.20, 128.87, 127.70, 127.08, 124.68, 114.42, 97.18, 55.68。
[0028]
11
h nmr (400 mhz, cdcl3) δ 7.98
ꢀ–ꢀ
7.81 (m, 2h), 7.58
ꢀ–ꢀ
7.47 (m, 2h), 7.46
ꢀ–ꢀ
7.34 (m, 3h), 7.31 (s, 1h), 7.23 (dd, j = 10.6, 8.5 hz, 2h), 7.16
ꢀ–ꢀ
7.06 (m, 2h), 6.79
ꢀ–ꢀ
6.64 (m, 1h). 13
c nmr (101 mhz, cdcl3) δ 140.81, 139.88, 139.43, 134.11, 133.61, 130.93, 130.16, 130.06, 129.85, 128.73, 128.28, 127.97, 127.46, 126.79, 125.56, 125.30, 125.10, 122.34, 98.92。
[0029]
实施例三将kh(1.2 mmol, 4.0 equiv)称量于反应瓶中,悬于无水thf(0.8 ml thf)中搅拌,在搅拌过程中滴加硫脲9x(0.3 mmol, 1.0 equiv,溶于0.2 ml dma),加完后在室温下搅拌2min,然后加入二碘苯2a(0.6 mmol, 2.0 equiv,溶于0.2 ml thf),继续在室温下搅拌,3小时后,加入冰水和四氢呋喃淬灭反应,乙酸乙酯萃取3次,合并有机层,用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,旋干溶剂,加入适量硅胶粉拌样,快速柱层析分离,得不到产品环硫脲化合物。
[0030]
本发明使用碘苯,在nah作用下与环硫脲进行亲核加成反应,实现了首次利用碘苯直接与硫脲进行c
‑
s偶联生成环硫脲化合物,可直接使用,进一步的,本发明的产物带有碘苯,可采用常规方法与炔基、巯基、哌嗪等基团反应,得到更多药物分子。另外,卤素与硫的存在也使得本发明的产物可作为阻燃改性剂用于功能材料,对未来的小分子合成发展具有重大意义。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。