1.本发明涉及蛋白质工程或基因工程技术领域,特别是涉及一种毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法。
背景技术:
2.溶菌酶(lysozyme)由于其抗菌性、抗病毒、提高免疫力等特性而作为一种新型抗菌肽受到了广泛关注。与传统的抗生素不同,溶菌酶可以水解细菌细胞壁的β
‑
1,4糖苷键,破坏细胞壁的结构使细菌溶解死亡,因此不必担心耐药性问题。溶菌酶有着良好的杀灭微生物的效果,在畜牧业、食品产业、临床医学等方面广泛应用,也引起世界卫生组织、粮食农业组织的关注。
3.溶菌酶又称胞壁质酶(muramidase)或n
‑
乙酰胞壁质聚糖水解酶(n
‑
acetylmuramide glycanohydrolase),是一种能水解细菌中黏多糖的碱性酶。溶菌酶可分为动物溶菌酶、植物溶菌酶、微生物溶菌酶,其中动物溶菌酶又分为鸡型溶菌酶(c型溶菌酶)、鹅型(g型)溶菌酶、无脊椎型溶菌酶三种。人源溶菌酶属于c型溶菌酶,由130个氨基酸组成,其相对分子量为14700da。相比其他类型溶菌酶,人源溶菌酶具有酶活力高、热稳定性高等优点,并且是人体内源蛋白质。而由于原料来源和纯化成本等原因,人源溶菌酶的制备量无法满足各领域的需求。目前存在多种利用真核或原核宿主生产人源溶菌酶的方式,但是在酶活和产量上处于不能让人满意的状态。
技术实现要素:
4.本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
5.鉴于上述和/或现有提高人源溶菌酶分泌效率及酶活方法中存在的问题,提出了本发明。
6.因此,本发明其中一个目的是,克服现有提高人源溶菌酶分泌效率及酶活方法的不足,提供一种在毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法。
7.为解决上述技术问题,根据本发明的一个方面,本发明提供了如下技术方案:一种在毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法,其包括如下步骤:
8.优化碱基序列:将毕赤酵母密码子偏好性优化编码的碱基序列人工合成并构建到质粒中,得到重组质粒;
9.优化启动子并且优化发酵条件:对于重组质粒中的诱导型启动子更换为组成型启动子,并对两种启动子进行生产强度比较以及发酵条件优化;
10.信号肽优化:将hlyz的分泌信号肽进行优化,验证信号肽优化后的结果;
11.敲除基因:敲除vps10
‑
1、vps10
‑
2中的一个或两个基因形成单敲除或者双敲除菌株;
12.共表达伴侣蛋白:将敲除基因完成后的菌株实现伴侣蛋白共表达,并且验证其是否能够稳定并且提高酶活;
13.发酵罐水平优化:将完成上述优化的菌株进行5l发酵罐发酵条件探讨,探明最佳发酵条件。
14.作为本发明所述毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法中的一种优选方案,其中优化碱基序列中,所述毕赤酵母密码子偏好性优化编码的碱基序列为hlyz。
15.作为本发明所述毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法中的一种优选方案,其中优化碱基序列中,所述质粒为ppic9k。
16.作为本发明所述毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法中的一种优选方案,其中优化碱基序列中,所述启动子的种类包括诱导性启动子和组成型启动子中的一种或一种以上,所述启动子包括p
aox1
、p
gap
中的一种或两种。
17.作为本发明所述毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法中的一种优选方案,其中优化碱基序列中,使用的限制性核酸内切酶为ecorⅰ和notⅰ。
18.作为本发明所述毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法中的一种优选方案,其中优化启动子并且优化发酵条件中,诱导型启动子p
aox1
发酵生产hlyz最适的温度为26℃,最适ph为6.0;组成型启动子p
gap
发酵生产hlyz的最适温度为28℃,最适ph 6.0。
19.作为本发明所述毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法中的一种优选方案,其中信号肽优化中,替换掉的信号肽为α信号肽,进行替换的信号肽种类包括hfbi signal sequence(hss)、inuia signal sequence(iss)、w1 signal sequence(wss)、killer signal sequence(kss)、invertase signal sequence(inss)、hlyz signal sequence(hss)、albumin signal sequence(alss)、lipase signal sequence(lss)、apre signal sequence(apss)、glucoamylase signal sequence(gss)中的一种。
20.作为本发明所述毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法中的一种优选方案,其中信号肽优化中,替换信号肽使用的引物为f、r,所述f1、r1包括iss
‑
f、iss
‑
r、hss
‑
f、hss
‑
r、inss
‑
f、inss
‑
r、kss
‑
f、kss
‑
r、lss
‑
f、lss
‑
r、alss
‑
f、alss
‑
r、gss
‑
f、gss
‑
r、hss
‑
f、hss
‑
r、wss
‑
f、wss
‑
r、apss
‑
f、apss
‑
r中的一种或一种以上。
21.作为本发明所述毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法中的一种优选方案,其中共表达伴侣蛋白中,共表达的伴侣蛋白为sso2、ero1、pdi1、kex2、aft1、hac1、hrd1、bmh2、ydj1、cne1中的一种或几种。
22.作为本发明所述毕赤酵母中提高人源溶菌酶分泌效率及酶活的方法中的一种优选方案,其中共表达伴侣蛋白中,使用的限制性核酸内切酶为ecor i和sal i或者xho i和not i。
23.本发明提供了一种使用插入含有基因偏好性编码的质粒,同时结合启动子、信号肽、伴侣蛋白的优化,得到了一种在分泌效率和酶活上有着突出的良好的效果的人源溶菌酶表达和分泌菌株。
附图说明
24.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本
领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
25.图1为实施例1中启动子为p
aox1
时hlyz表达的sds
‑
page和western blot图;
26.图2实施例1中启动子为p
aox1
不同温度、ph、发酵时间菌株的表达水平;
27.图3为实施例2中更换启动子为p
gap
之后的sds
‑
page图和western blot图;
28.图4为实施例2中更换启动子为p
gap
之后的不同温度、ph、发酵时间菌株的表达水平;
29.图5为实施例3中插入不同信号肽后菌株的sds
‑
page图;
30.图6为实施例3中插入不同信号肽后菌株的酶活水平;
31.图7为实施例4中单敲除或双敲除后菌株的sds
‑
page图,其中,四个泳道中分别为未敲除,敲除vps10
‑
1、敲除vps10
‑
2、vps10
‑
1/2双敲除;
32.图8为实施例4中单敲除或者双敲除菌株的酶活水平;
33.图9为实施例5中共表达不同伴侣蛋白之后菌株的sds
‑
page图;
34.图10为实施例5中共表达不同伴侣蛋白之后菌株酶活水平;
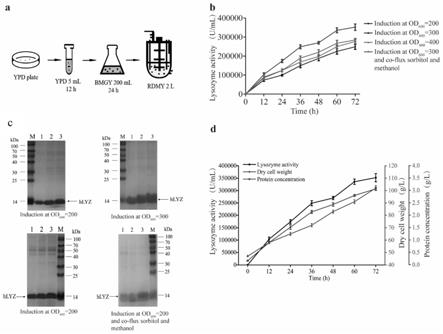
35.图11为实施例6中发酵过程的相关数据,其中,a为发酵过程示意图,b为在od
600
值分别在200、300、400时流加甲醇以及在od
600
值=300时共流加山梨醇和甲醇进行诱导表达的酶活,c为不同发酵过程或者不同od
600
值时蛋白表达情况,d为od
600
=300时的发酵图。
具体实施方式
36.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合说明书实施例对本发明的具体实施方式做详细的说明。
37.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
38.其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
39.实施例1
40.设计毕赤酵母密码子偏好性优化编码(hlyz)的碱基序列并进行人工合成,插入到毕赤酵母甲醇诱导分泌型质粒ppic9k中,使用双酶切技术实现hlyz插入到毕赤酵母甲醇诱导分泌型质粒ppic9k中,双酶切使用的内切酶为ecorⅰ和notⅰ,双酶切完成后,构建出质粒ppic9k
‑
hlyz。
41.将构建得到的质粒ppic9k
‑
hlyz进行如下操作,使用内切酶sac i和bamh i进行启动子的取代,使用组成型启动子p
gap
取代ppic9k
‑
hlyz中的诱导型启动子p
aox1
,其中p
aox1
的序列如seq id no.1所示,p
gap
的序列如seq id no.2所示,人源溶菌酶的序列如seq id no.3所示,得到重组质粒ppic9k
‑
p
gap
‑
hlyz。
42.利用sal i酶将上述质粒ppic9k
‑
p
gap
‑
hlyz线性化后,通过设置电压为1500v、电阻为200ω为参数的电转化将hlyz基因插入毕赤酵母gs115的基因组中,迅速加入1ml的1mol l
‑1的d
‑
山梨醇后置于30℃摇床中220rpm预培养2h后涂布于md平板上,利用3mg/ml高浓度
g418的ypd平板筛选出高拷贝菌株作为出发菌株gs115/hlyz。
43.质粒导入菌株实现菌株中包含目标质粒的具体操作为:使用限制性核酸内切酶blnⅰ将pgapza类型的质粒线性化,将纯化后的线性质粒与感受态毕赤酵母于电转杯中混合均匀,静置于冰上15min,通过电转化(1500v、250ω)将线性质粒插入毕赤酵母基因组,迅速加入1mol
·
l
‑1的d
‑
山梨醇(预冷),并在30℃预培养2h,涂布于含有100μg
·
ml
‑1博来霉素的ypd平板上生长3天。
44.使用sds
‑
page和western blot验证其在摇瓶水平下培养的产物,摇瓶培养的具体条件如下:将制得的基因敲除菌株与原始菌株进行培养,在ypd培养基中培养12h,转接至bmgy培养基中培养24h至od
600
为15,再重悬至bmgy中,每12h加入0.5%的甲醇。sds
‑
page和western blot的结果如图1和图3所示。
45.由图1和图3可得,我方发明中构建的菌株gs115/hlyz带有目标基因,即质粒能够正常导入到目标菌株中,同时目标基因也能够稳定存在,根据实施例2中方法测得菌株的最佳表达条件。
46.实施例2
47.使用溶壁微球菌作为指示菌对于摇瓶培养的产物进行活性的检测。
48.通过对于温度和ph进行调整,测得不同温度和ph条件下的蛋白表达水平,调整发酵温度、ph、时间,得到菌株在最适表达水平之下的表达条件。
49.由图2可得,诱导型启动子p
aox1
发酵生产hlyz的最适条件为26℃,ph 6.0,甲醇诱导后96h酶活达到最高,酶活可达16,400
±
700u
·
ml
‑1;组成型启动子p
gap
发酵生产hlyz的最适条件为28℃,ph 6.0,使用葡萄糖为碳源后48h酶活达到最高,但仅达到310
±
17.3u
·
ml
‑1,因此本研究选用诱导型启动子p
aox1
发酵生产hlyz。
50.由酶活表达水平可得,使用甲醇诱导启动子时,有着酶活大量增加的趋势,当使用组成型启动子时,酶活较低,但是不需要使用外来诱导物进行诱导,相较诱导启动子有着更加稳定、安全的效果。
51.实施例3
52.将构建的gs115/hlyz菌株进行信号肽的优化,分别使用十种信号肽分别替代ppic9k
‑
hlyz中的α信号肽,根据毕赤酵母密码子偏好性优化信号肽hfbi signal sequence(hss)、inuia signal sequence(iss)、w1 signal sequence(wss)、killer signal sequence(kss)、invertase signal sequence(inss)、hlyz signal sequence(hss)、albumin signal sequence(alss)、lipase signal sequence(lss)、apre signal sequence(apss)、glucoamylase signal sequence(gss)的基因序列,利用引物hss
‑
f/r、issf/r、wss
‑
f/r、kss
‑
f/r、inss
‑
f/r、hss
‑
f/r、alss
‑
f/r、lss
‑
f/r、apss
‑
f/r、gss
‑
f/r,以合成的信号肽基因序列为模板扩增出信号肽hss、iss、wss、kss、inss、hss、alss、lss、apss、gss的基因序列,经过bamh i、ecor i酶切后连接至ppic9k
‑
hlyz,替换该质粒中的α信号肽,构建构建出质粒ppic9k
‑
hss
‑
hlyz、ppic9k
‑
iss
‑
hlyz、ppic9k
‑
wss
‑
hlyz、ppic9k
‑
kss
‑
hlyz、ppic9k
‑
inss
‑
hlyz、ppic9k
‑
hss
‑
hlyz、ppic9k
‑
alss
‑
hlyz、ppic9k
‑
lss
‑
hlyz、ppic9k
‑
apss
‑
hlyz、ppic9k
‑
gss
‑
hlyz,信号肽及其对应的序列如表1所示。
53.表1信号肽及其对应的序列
[0054][0055][0056]
信号肽的优化为信号肽插入,其具体的操作方法如下:设计引物f1、r1将密码子优化的信号肽序列插入到毕赤酵母甲醇诱导分泌型质粒ppic9k的ecorⅰ和notⅰ酶切位点中,实现信号肽的插入,信号肽引物及其对应的序列如表2所示。
[0057]
表2信号肽及其对应的序列
[0058]
iss
‑
fgcgcggatccatgaagttggcttactccttiss
‑
rgcgcgaattcgtagttaataacggaagcahss
‑
fgcgcggatccatgaagttctttgctattgcthss
‑
rgcgcgaattcagcaacagcagcagcagcaainss
‑
fgcgcggatccatgttgttgcaagcttttttinss
‑
rgcgcggatccagcactaatcttagcagcaakss
‑
fgcgcggatccatgagtttgatggttgttagtkss
‑
rgcgcggatcctggccaagcaccttgcaaclss
‑
fgcgcggatccatgaagttgttgagtttgactlss
‑
rgcgcggatccagcaacacaagtagccaaaaalss
‑
fgcgcggatccatgaagtggacgacttttatalss
‑
rgcgcggatccactgtaagcactactaaacaagss
‑
fgcgcggatccatgagttttagatctttgttgggss
‑
rgcgcggatccggtttgtactggtttggcthss
‑
fgcgcggatccatgaaggctttgattgttttghss
‑
rgcgcggatccaccttgaacagtaacagacaa
wss
‑
fgcgcggatccatgagaagaagagctattccwss
‑
rgcgcgaattcagccaaagcagatgaacccaapss
‑
fgcgcggatccatgagatttccttctattttapss
‑
rgcgcgaattcagccaaagcggatgaagcagc
[0059]
将更换不同信号肽后的菌株进行摇瓶发酵,利用sds
‑
page检测hlyz的分泌表达情况,结果如图5所示。
[0060]
蛋白表达量的测定过程参照实施例3中最佳蛋白表达条件,即采用26℃,ph 6.0,甲醇诱导后96h。
[0061]
将更换不同信号肽之后的菌株的hlyz酶活水平如图6所示。
[0062]
由图5可得,我方发明可以实现有效、稳定的信号肽的插入。
[0063]
由图6可得,插入了hfbi信号肽之后蛋白的酶活水平最高,可将hlyz的分泌酶活提高至24,880
±
1034.6u
·
ml
‑1,为出发菌株的1.51倍。
[0064]
进一步可以得出,本实施例中设计的信号肽对于蛋白的表达水平能够起到一定程度的促进的效果,即实现了一定程度的对于蛋白表达的促进效果。
[0065]
实施例4
[0066]
以gs115/hss
‑
hlyz作为出发菌株,将1ng质粒和5ng donner dna与80μl感受态至于电转杯中静置5min,再通过通过设置参数为电压1500v、电阻200欧姆的电转化的方式转入感受态中。迅速加入1ml的1mol
·
l
‑1的d
‑
山梨醇后置于30℃摇床中220rpm预培养2h涂布于含有潮霉素的ypd平板上生长3天。
[0067]
于目的基因上下游1300bp处设计引物vps10
‑1‑
1300
‑
f/r、利用菌落pcr的方法初步筛选出阳性克隆子,筛选的标准为利用目的基因上下游1300bp处作为引物,如果pcr出来2600条带,就是阳性转化子,如果是2600加5400的目的基因则是失败案例。再提出该单克隆子的基因组,再次用上述引物pcr,之后将pcr产物送至测序公司测序。最终得到vps10
‑
1δ单敲除菌株。
[0068]
设计引物vps10
‑
2上f/r、vps10
‑2‑
下f/r将vps10基因上下游各1000bp融合在一起共2000bp作为基因敲除的donner dna。以gs115/hss
‑
hlyz作为出发菌株,将1ng质粒和5ng donner dna与80μl感受态至于电转杯中静置5min,再通过通过设置参数为电压1500v、电阻200ω的电转化的方式转入感受态中。迅速加入1ml的1mol
·
l
‑1的d
‑
山梨醇后置于30℃摇床中220rpm预培养2h涂布于含有潮霉素的ypd平板上生长2
‑
3天。
[0069]
于目的基因上下游1300bp处设计引物vps10
‑2‑
1300
‑
f/r利用菌落pcr的方法初步筛选出阳性克隆子,筛选的标准为利用目的基因上下游1300bp处作为引物,如果pcr出来2600bp条带,就是阳性转化子,如果是2600bp加5400bp的目的基因则是失败案例。再提出该单克隆子的基因组,再次用上述引物pcr,之后将pcr产物送至测序公司测序。最终得到vps10
‑
1δvps10
‑
2δ双敲除菌株。
[0070]
将得到的敲除菌株摇瓶发酵,将发酵上清液进行sds
‑
page检测,结果如图7所示。
[0071]
测定单敲除和双敲除之后菌株的酶活,测定的酶活水平为实施例3中表达的温度和ph,使用甲醇为碳源,测定时间为培养后96h,测得的酶活数据记录在图8中。
[0072]
由图7可得,我方发明中提供的方法实现了菌株中单敲除或者双敲除的有效实现。
[0073]
由图8可得,制得的单敲除和双敲除的酶活数据如下:vps10
‑
1δ单敲除菌株的酶
活为56,100
±
1876.67u/ml,vps10
‑
2δ单敲除菌株的酶活为59,080
±
3040u/ml,vps10
‑
1δvps10
‑
2δ双敲除菌株的酶活为6,050
±
630u
·
ml
‑1,可以得到vps10
‑
2δ单敲除菌株的酶活更高。
[0074]
实施例5
[0075]
将实施例4中经过敲除的菌株进行伴侣蛋白的优化,分别添加如下十种分子伴侣的基因到菌株的基因组上实现菌株对于伴侣蛋白的表达,十种伴侣蛋白分别以sso2
‑
f/r、ero1
‑
f/r、pdi1
‑
f/r、kex2
‑
f/r、aft1
‑
f/r、hac1
‑
f/r、hrd1
‑
f/r、bmh2
‑
f/r、ydj1
‑
f/r、cne1
‑
f/r为引物经过pcr扩增的分别得到sso2、ero1、pdi1、kex2、aft1、hac1、hrd1、bmh2、ydj1、cne1基因片段,伴侣蛋白具体的插入方法为:以毕赤酵母gs115基因组为模板,将伴侣蛋白基因片段经过限制性核酸内切酶ecor i和sal i(内部含有ecor i和sal i酶切位点的基因序列使用限制性核酸内切酶xho i和not i)酶切后连接至pgapza载体上,构建出对应的质粒pgapza
‑
sso2、pgapza
‑
ero1、pgapza
‑
pdi1、pgapza
‑
kex2、pgapza
‑
aft1、pgapza
‑
hac1、pgapza
‑
hrd1、pgapza
‑
bmh2、pgapza
‑
ydj1、pgapza
‑
cne1。然后将构建好的质粒,经过限制性核酸内切酶blnⅰ将pgapza类型的质粒线性化,将纯化后的线性质粒与毕赤酵母感受态于电转杯中混合均匀,静置于冰上15min,通过电转化(1500v、250ω)将线性质粒插入毕赤酵母基因组,迅速加入1mol
·
l
‑1的d
‑
山梨醇(预冷),并在30℃预培养2h,涂布于含有100μg
·
ml
‑1博来霉素的ypd平板上生长3天,将得到的菌株进行摇瓶发酵,并对发酵上清液进行sds
‑
page检测,得到的结果如图9所示。
[0076]
按照实施例3中测得的最佳温度和ph,测定插入信号肽之后的表达水平,碳源为甲醇,培养96h后测定酶活水平,测定的结果记录在图10中。
[0077]
由图9可得,我方发明中实现了伴侣蛋白的稳定表达。
[0078]
由图10可得,进行了信号肽优化之后的菌株含有插入的伴侣蛋白的基因,同时不同的伴侣蛋白对于目标蛋白的产生具有不同程度的效果,其中ero1和pdi1两种伴侣蛋白提高hlyz的分泌酶活,最终在摇瓶水平上最高可将hlyz的分泌酶活提高至81600
±
5230u
·
ml
‑1,为出发菌株的5.41倍,在摇瓶水平上为已报道最高。
[0079]
实施例6
[0080]
将制得的菌株检测hlyz的表达情况:挑选生长状况良好的单菌种接种至5ml ypd培养基、30℃培养16h作为一级种子液,将一级种子液转移至含有50ml的bmgy培养基的摇瓶中,30℃培养24h作为二级种子液。将二级种子液按照10%接种量接种至发酵罐中,发酵罐中培养液为rdmy培养液,其包含的原料为如表1所示:
[0081]
表1 rdmy培养基中含有的原料
[0082][0083]
发酵过程初始装液量2l,控制温度30℃、ph 6.0、通风比1.3vvm,使用40%氨水调节发酵液的ph,发酵过程中逐步提升搅拌从300上升到800rpm,使发酵罐中溶解氧(do)保持10%以上,必要时加入适量消泡剂控制发酵泡沫。甲醇型毕赤酵母的发酵工艺包括分批发酵阶段,补料发酵阶段和甲醇诱导阶段。在分批发酵阶段中,菌体消耗初始培养基中的碳源,当发酵罐中do上升,证明初始培养基中碳源耗尽,则进入补料发酵阶段,使用do
‑
star方式流加甘油,使培养基中的甘油处于极低的状态,有利于菌体生长。当培养基中的菌浓达到预期值时,停止甘油的流加,对细胞进行饥饿处理2h,此时发酵罐中的do维持在60%以上,最后进入甲醇诱导阶段,调节发酵液的ph、温度至实施例3中测定的最佳发酵条件,将甲醇缓慢流加至培养液中,通过甲醇检测器检测发酵液中的甲醇含量,并定时取样检测hlyz的表达情况。
[0084]
采取在摇瓶水平中优化的ph和温度,利用5l发酵罐发酵生产hlyz,使用甲醇检测器实时监测发酵液中的甲醇含量为5g
·
l
‑1,利用rdmy培养基发酵生产hlyz,在甘油生长期分别使发酵罐中的菌体od
600
=200、300、400时进行甲醇诱导hlyz的分泌表达。通过sds
‑
page检测hlyz蛋白分泌表达的情况,并测定其活性,结果如图11中a、b、c、d所示,在发酵罐中hlyz的分泌表达与摇瓶水平有所不同,在甲醇诱导后72h酶活达到最高。在od
600
=200、300、400时使用甲醇诱导表达hlyz,最高酶活分别为225,600
±
13665.4u
·
ml
‑1、352,000
±
16696.5u
·
ml
‑1、267,000
±
10405.8u
·
ml
‑1。其中,当发酵液中菌体od
600
达到300时流加甲醇诱导得到的hlyz的酶活最高,总蛋白浓度达到3.18mg
·
ml
‑1。将得到的数据记录在图11中
[0085]
由图11可得,在发酵过程中,hlyz的分泌表达量随时间的增加并不是线性关系,这可能是由于在甲醇诱导前期,发酵液中的溶解氧可控制到10%以上,但在诱导中后期,发酵液中溶氧过低,长时间处于0%,影响了hlyz的分泌表达,并且会产生一些有毒的副产物。
[0086]
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。