1.本发明涉及生物检测技术领域,尤其涉及基于微流控芯片的食源性致病菌的检测方法。
背景技术:
2.食源性致病菌是通过食品为媒介引起食物中毒的致病性细菌,通常包括:致病性大肠埃希菌、沙门氏菌、志贺氏菌、单核细胞增生李斯特氏菌、副溶血性弧菌、溶血性链球菌以及金黄色葡萄球菌等;食源性致病菌污染给公共安全带来了巨大的威胁,而早期诊断食源性致病菌有助于控制和预防感染的传播。因此,对食源性致病菌进行有效的鉴定至关重要。
3.目前,已报道的食源性细菌的检测方法包括:1、常规检测方法虽然操作简便、检测成本较低,但是具有检测周期长的弊端;2、免疫学检测方法,通过利用抗原抗体的特异性反应进行食源性细菌的检测,虽然检测速度较快,但是具有检测成本高的弊端;3、分子生物学检测方法如pcr技术,具有特异性强的特点,但是具有对检测设备操作技能要求较高的弊端;4、基于荧光或电化学的生物传感器检测方法,具有检测速度快,灵敏度高的特点,但存在检测设备昂贵且不利于大范围推广的弊端。
4.所以,亟需一种检测速度快、灵敏度高且检测成本低的食源性细菌的检测方法。
技术实现要素:
5.鉴于上述问题,本发明提供基于微流控芯片的食源性致病菌的检测方法,以解决现有技术中食源性细菌检测成本高、检测步骤繁琐的问题。
6.为实现上述目的,本发明提供了一种基于微流控芯片的食源性致病菌的检测方法,方法包括:
7.对微控流芯片进行改性,将树枝状大分子聚合物pamam共价连接在微控流芯片的通道表面;
8.将5’末端氨基化的引发链加入微控流芯片的通道中,引发链共价连接在树枝状大分子聚合物pamam的表面;
9.将含有与引发链互补的序列的核酸适配体加入微控流芯片的通道中,使核酸适配体与引发链通过碱基配对结合;
10.将待测的靶标细菌加入微控流芯片的通道中进行孵育,使靶标细菌与核酸适配体进行特异性结合,释放引发链;
11.将h1链、h2链和氯化血红素加入微控流芯片的通道中进行孵育,其中,h1链和h2链的末端修饰有g
‑
四联体亚基;被释放的引发链分别与h1链、h2链进行互补配对并打开h1链、h2链的发夹结构,进而引发杂交链扩增反应;其中,氯化血红素与g
‑
四联体亚基形成dna模拟酶;
12.将过氧化氢和atbs混合液加入微控流芯片的通道中进行孵育,dna模拟酶催化过
氧化氢和atbs氧化产生显色反应;根据显色反应判断待测靶标细菌的有无以及待测靶标细菌的浓度。
13.进一步,优选的,
14.引发链的序列如seq id no.1所示;
15.核酸适配体的序列如seq id no.2所示;
16.h1链的序列如seq id no.3所示;
17.h2链的序列如seq id no.4所示。
18.进一步,优选的,对微控流芯片进行改性,将树枝状大分子聚合物pamam共价连接在微控流芯片的通道表面的具体步骤包括:
19.将微控流芯片的玻璃底板放入体积比为3∶1的浓硫酸和双氧水的混合液中进行表面活化,浸泡1小时后,用超纯水清洗玻璃底板并烘干;
20.将玻璃底板浸入含有5%的aptes的乙醇溶液中,浸泡2小时后,用超纯水清洗玻璃底板并烘干;
21.将玻璃底板浸入含有4μm树枝状大分子聚合物pamam的甲醇溶液中,并加入20μm的nhs和edc进行活化,浸泡2小时后,用超纯水清洗芯片并烘干,完成对微控流芯片的改性,并实现树枝状大分子聚合物pamam共价连接在微控流芯片的通道表面。
22.本发明还提供一种上述基于微流控芯片的食源性致病菌的检测方法在食源性病菌检测中的应用。
23.本发明还提供一种用于食源性细菌检测的微流控芯片,包括玻璃底板以及键合在玻璃底板上的通道;通道包括待测样品进样口、待测样品进样通道、待测样品废液口以及待测样品废液通道;待测样品进样口与待测样品废液口分别设置在微控流芯片的两端;待测样品进样口与待测样品进样通道相连通,待测样品废液口与待测样品废液通道相连通;待测样品进样通道和待测样品废液通道之间并联设置有多个反应单元;
24.反应单元包括依次连通的包被液入口、反应腔室以及包被液出口,包被液入口通过表面张力细通道与待测样品进样通道相连通,包被液出口通过表面张力细通道与待测样品废液通道相连通。
25.进一步,优选的,所述表面张力细通道的宽度为90~150μm。
26.进一步,优选的,在每个微流控芯片上设置的所述反应单元的数量为3~9个。
27.本发明的有益效果如下:
28.本发明提供的基于微流控芯片的食源性细菌的检测方法,通过在微流控芯片上,待测细菌与核酸适配体结合,导致之前与所述核酸适配体相结合的引发链被释放;释放后的引发链与h1链以及h2链互补配对并打开其发夹结构,发生hcr反应;基于氯化血红素和g
‑
四联体生成dna模拟酶,通过dna模拟酶催化过氧化氢介导的abts产生显色反应,进而通过显色反应判断待测靶标细菌的有无以及待测靶标细菌的浓度;具有操作简单、灵敏度高、检测成本低,仅通过裸眼即可判断待测靶标细菌的有无的特点;而且,方便携带,适用于现场检测场景,因此在食源性细菌检测方面具有较好的应用前景。
附图说明
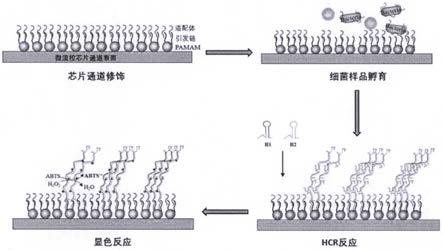
29.图1 显示基于微流控芯片的食源性细菌的检测方法的检测原理图。
30.图2 显示微流控芯片的结构示意图。
具体实施方式
31.本发明将根据下列实施例进行更具体的说明。然而,本发明的保护范围并不受限于下列的实施例。
32.主要试剂来源如下:引发链、适配体、h1链和h2链及其末端g
‑
四联体亚基均由上海生工生物工程股份有限公司合成,经过hplc方式纯化。氯化血红素、过氧化氢以及abts购自西格玛奥德里奇(上海)贸易有限公司。其他试剂均为进口和国产分析纯试剂。
33.实施例1
34.图1示出了基于微流控芯片的食源性细菌的检测方法的检测原理图,如图1所示,本发明以微流控芯片作为反应的载体,将树枝状大分子聚合物共价连接在微流控芯片底板的通道表面,以提高通道表面修饰位点的密度。将引发链共价连接在树枝状大分子聚合物的表面,并使含有一段与引发链互补的序列的细菌适配体与之结合。当靶标细菌与上述细菌适配体发生特异性结合之后,引发链被释放,引发h1链与其互补配对,同时打开h1链的发夹结构;并且再引发h2链与其互补配对,并打开h2链的发夹结构,从而发生杂交链扩增(hcr)反应。其中,h1链5’端和3’端分别修饰有四分之三和四分之一的g
‑
四联体亚基,而h2链的3’端和5’端分别修饰有四分之三和四分之一的g
‑
四联体亚基。当发生杂交链扩增反应时,在氯化血红素存在的情况下,g
‑
四联体亚基共定位形成具有过氧化氢酶作用的dna模拟酶;dna模拟酶催化过氧化氢介导的2,2
′‑
联氮
‑
双
‑3‑
乙基苯并噻唑啉
‑6‑
磺酸(atbs)的氧化,发生显色反应。进而根据显色反应的颜色的变化确定细菌的有无以及细菌的浓度。
35.具体地说,本发明提供了一种基于微流控芯片的食源性致病菌的检测方法,方法包括s1~s6。
36.s1、对微控流芯片进行改性,将树枝状大分子聚合物pamam共价连接在微控流芯片的通道表面。
37.在具体的实施过程中,对微控流芯片进行改性,其中,微控流芯片由玻璃底板以及聚二甲基硅氧烷(polydimethylsiloxane,pdms)制成。通过对玻璃底板进行表面改性,破坏掉其
‑
ch3基团,同时形成亲水性质的
‑
cooh极性基团,改善其亲水性以及表面兼容性,以满足生化分析的需要。
38.在具体的实施过程中,对改性后的微控流芯片的玻璃底板与pdms板键合。pdms板上开设有通道。玻璃底板与pdms板键合后,玻璃底板即为通道的底面。完成玻璃底板的改性,将树枝状大分子聚合物pamam共价连接玻璃底板上,即连接在pdms通道的底面。
39.s2、将5’末端氨基化的引发链加入微控流芯片的通道中,引发链共价连接在树枝状大分子聚合物pamam的表面;
40.在具体的实施过程中,引发链通过氨基与微流控芯片通道中的羧基共价连接。
41.s3、将含有与引发链互补序列的核酸适配体加入微控流芯片的通道中,使核酸适配体与引发链通过碱基配对结合;
42.需要说明的是,核酸适配体为包括一端与引发链互补的序列的细菌适配体。引入50μl的适配体(5μm)与引发链通过碱基配对结合在一起,将多余的适配体用缓冲液清洗除去。其中,缓冲液可以为pbs缓冲液(磷酸盐缓冲液,ph值为7.4,主要成分为磷酸氢钠、磷酸
二氢钠、氯化钠以及氯化钾),tris
‑
hcl缓冲液,hepes缓冲液以及生理盐水;其中,pbs缓冲液作为优选。
43.s4、将待测的靶标细菌加入微控流芯片的通道中进行孵育,使靶标细菌与核酸适配体进行特异性结合,释放引发链;
44.将待测样品加入微控流芯片的通道中,然后待测样品进入不同的反应单元里。需要说明的是,在将含有与引发链互补序列的核酸适配体加入微控流芯片的通道中,核酸适配体与引发链通过碱基配对结合后,需要利用缓冲液对通道进行冲洗。
45.s5、将h1链、h2链和氯化血红素加入微控流芯片的通道中进行孵育,其中,h1链和h2链的末端修饰有g
‑
四联体亚基;被释放的引发链分别与h1链、h2链进行互补配对并打开h1链、h2链的发夹结构,进而引发杂交链扩增反应;其中,氯化血红素与g
‑
四联体亚基形成dna模拟酶;其中,h1链的序列如seq id no.3所示;h2链的序列如seq id no.4所示。
46.在将h1链、h2链和氯化血红素加入微控流芯片的通道中进行孵育后,需要利用缓冲液对通道进行冲洗。
47.s6、将过氧化氢和atbs混合液加入微控流芯片的通道中进行孵育,dna模拟酶催化过氧化氢和atbs氧化产生显色反应;根据显色反应判断待测靶标细菌的有无以及待测靶标细菌的浓度。
48.在具体的实施过程中,根据abts发生的显色反应,利用标准品浓度及其产生的颜色变化程度制作标准曲线,然后根据标准曲线计算待测样品的浓度值。
49.本发明的基于微流控芯片的食源性致病菌的检测方法,利用适配特异性地与靶标细菌结合,从而释放引发链引发hcr反应,提高了对食源性细菌检测的速度以及灵敏度;基于氯化血红素和g
‑
四联体生成dna模拟酶,通过dna模拟酶催化过氧化氢介导的abts产生显色反应,进而通过显色反应判断待测靶标细菌的有无以及待测靶标细菌的浓度;有效简化了检测步骤,从而提高了检测效率;另外,将裸眼可见的abts的显色反应的颜色变化替代反应体系的检测信号,无需其他辅助仪器即可完成待测食源性细菌的有无以及浓度的检测,达到了降低检测成本的技术效果。
50.本发明还提供一种上述基于微流控芯片的食源性致病菌的检测方法在食源性病菌检测中的应用。上述基于微流控芯片的食源性致病菌的检测方法适用于各种场景的食源性致病菌的检测,尤其,适于对检测零度度以及时效性要求较高的现场快速检测。
51.图2示出了微流控芯片的结构示意图;如图2所示:本发明的一种用于食源性细菌检测的微流控芯片,包括玻璃底板以及键合在玻璃底板上的通道,通道包括待测样品进样口21、待测样品进样通道22、待测样品废液口24以及待测样品废液通道23;待测样品进样口21与待测样品废液口24分别设置在微控流芯片20的两端;待测样品进样口21与待测样品进样通道22相连通,待测样品废液口24与待测样品废液通道23相连通;待测样品进样通道22和待测样品废液通道23之间并联设置有多个反应单元25;需要说明的是,通道即为设置有通道的pdms板。
52.反应单元25包括依次连通的包被液入口251、反应腔室252以及包被液出口253,包被液入口251通过表面张力细通道254与待测样品进样通道22相连通,包被液出口253通过表面张力细通道254与待测样品废液通道23相连通。所述包被液入口251用于引入引发链和适配体等溶液。在具体的实施过程中,在每个微流控芯片上设置的所述反应单元25的数量
为3~9个,具体的反应单元的数量要根据实际应用场景的需要进行设定。
53.具体地说,待测样品进样口21、待测样品进样通道22、待测样品废液口24、待测样品废液通道23以及反应单元25均为微流控芯片的通道。其中,包被液入口251用于引入引发链和适配体等溶液;而待测样品进样通道22用于注入待测样品溶液、h1链、氯化血红素和h2链、过氧化氢和atbs混合液。而上述试剂均最终进入到中间的反应腔室252内进行孵育。其中,产生的废液自包被液出口253流经待测样品废液通道23到达待测样品废液口24排出。
54.以沙门氏菌为例,利用上述微流控芯片进行食源性细菌检测。其中,微流控芯片由5mm
×
75mm的玻璃底板和pdms盖板组成,玻璃底板和pdms盖板通过等离子键合在一起。微流控芯片20上有4个反应单元,因此,可以实现四种细菌的同时检测。
55.第一部分,对微控流芯片进行处理修饰
56.首先,将树枝状大分子聚合物pamam共价连接在微控流芯片的通道表面,具体步骤包括:
57.s11、将微控流芯片的玻璃底板放入体积比为3∶1的浓硫酸和双氧水的混合液中进行表面活化,浸泡1小时后,用超纯水清洗玻璃底板并烘干;以使得所述微控流芯片的表面暴露出羟基。
58.s12、将玻璃底板浸入含有5%的aptes的乙醇溶液中,浸泡2小时后,用超纯水清洗玻璃底板并烘干;以使得所述微控流芯片的表面氨基化。其中,aptes为3
‑
氨丙基三甲氧基硅氧烷((3
‑
aminopropyl)
‑
trimethoxysilane)。
59.s13、将玻璃底板浸入含有4μm树枝状大分子聚合物pamam的甲醇溶液中,并加入20μm的nhs和edc进行活化,浸泡2小时后,用超纯水清洗芯片并烘干,以使得所述微控流芯片的表面羧基化。完成对微控流芯片的改性,并实现树枝状大分子聚合物pamam共价连接在微控流芯片的通道表面。其中,pamam为羧基化的树枝状聚合物。
60.然后,将改性后的玻璃底板与设置有通道的pdms板通过等离子键合在一起。
61.第三,将引发链和适配体键合到微流控芯片的通道表面
62.通过在改性后的微流控芯片的通道中加入40μm的nhs和edc,通过酰胺键反应来活化通道表面的树枝状大分子聚合物pamam上的羧基。
63.引入50μl的5’末端修饰有氨基的引发链(2μm),使其共价结合到微流控芯片的通道表面。引入50μl的适配体(5μm)与引发链通过碱基配对结合在一起,将多余的适配体用缓冲液清洗除去。其中,引发链和适配体均通过包被液入口251注入。其中,引发链的序列如seq id no.1所示,核酸适配体的序列如seq id no.2所示。
64.在具体的实施过程中,将引发链和适配体加入到微流控芯片的包被液入口251处,对反应腔室252的底面进行修饰,以捕获细菌。待上述作为包被液的引发链,适配体等干燥后,利用pdms小柱将包被液入口和出口两端封闭;而且,所述表面张力细通道的宽度为90~150μm,其中,优选为100μm;待测样品进样通道22的宽度为1mm,利用表面张力原理,达到阻止包被液反流入待测样品进样通道22,使其停留在中间的圆形反应腔室252内。
65.第二部分,利用处理修饰后的微控流芯片进行靶标细菌测试
66.自待测样品进样口21引入50μl含有沙门氏菌的样品溶液并孵育15分钟,使适配体与沙门氏菌特异性结合,并释放出引发链。用缓冲液将适配体与沙门氏菌结合物冲洗干净。
67.将h1链、氯化血红素和h2链加入微控流芯片的待测样品进样口21,进行孵育15分
钟,其中,h1链5’端和3’端分别修饰有四分之三和四分之一的g
‑
四联体亚基,而h2链的3’端和5’端分别修饰有四分之三和四分之一的g
‑
四联体亚基。其中,h1链的序列如seq id no.3所示;h2链的序列如seq id no.4所示。引发链分别与h1链、h2链进行互补配对并打开h1链、h2链的发夹结构,即使h1链和h2链与暴露出来的引发链引发杂交链扩增反应;其中,氯化血红素与杂交链的g
‑
四联体亚基形成具有光氧化氢酶作用的dna模拟酶。
68.将过氧化氢和atbs混合液加入微控流芯片的待测样品进样口21进行孵育。dna模拟酶催化过氧化氢介导的atbs氧化产生显色反应;1分钟内,即可根据显色反应判断待测靶标细菌的有无以及待测靶标细菌的浓度。
69.通过上述实验可知,本发明的基于微流控芯片的食源性细菌的检测方法的lod(limit of detection)为10cfu/ml;检测的线性范围为102~107cfu/ml;完成一次食源性细菌检测的时间为30~35min。通过上述结果可知,本发明的基于微流控芯片的食源性细菌的检测方法具有检测成本低、检测效率高,检测范围广的特点。
70.本文中所涉及的各种实验用品(包括但不限于:化学试剂、生物制品、细胞、生物体、仪器等)之中,对于那些特殊的或不易获得的,文中均已注明了制造商、参考文献或详细的制备方法;未经特别说明的,均为常规实验用品,在本技术日之前,可以通过各种方式(例如购买、自行制备等)很方便地获得。
71.虽然,上文中已经用一般性说明、具体实施方式以及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改和改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。