1.本发明属于检测技术领域,具体涉及一种新型乙酰胆碱酯酶的催化光谱传感检测体系的建立及检测技术。
背景技术:
2.乙酰胆碱酯酶(ache)是生物神经传导过程中的一种重要天然酶,其普遍存在于周围神经系统中,可特异性地催化底物乙酰胆碱发生水解反应使其快速水解成胆碱和乙酸盐。这个酶促反应过程与一系列疾病的发生有关联,如阿尔兹海默症(ad)、炎症及神经毒剂中毒等。目前,已有研究表明通过引入ache抑制剂可以提高神经递质乙酰胆碱的水平,达到缓解ad发病和改善ad症状。因此,研发ache活性及其抑制剂筛选的分析检测方法对人类生命健康具有十分重要和现实的研究意义。
3.目前许多检测ache活性及筛选其抑制剂的方法已经被发展,其中最常用的是基于5,5'
‑
二硫代双(2
‑
硝基苯甲酸)(dntb)试剂的ellman方法。基于ellman方法,in k.rhee建立了一种在薄层色谱中确定乙酰胆碱酯酶抑制假阳性效应的方法。此方法主要是利用巯基分子与dntb的二硫键发生特异性的切割反应,产生的黄色产物在412nm处具有较强的紫外吸收,从而实现对ache的定量分析。
4.应用荧光“turn on”法检测ache的活性:qian用dna肽链模板化制备银纳米簇,并通过ag
‑
s能够选择性与巯基胆碱(tch)相结合从而提高ag ncs的荧光,快速、超灵敏地实现了ache活性的检测。该方法对tch的检出限达0.3nmol/l,其线性范围为2.0~16nmol/l而对ache活性的检出限低至0.5
×
10
‑4u/ml。该方法成功地被应用于人体红细胞的检测。
5.电化学检测技术检测ache的活性:王琴课题组基于乙酰化产物辅酶a(coa)的自身特性,原位合成了巯基
‑
cu(ii)配位聚合物,利用ache可以催化atch产生巯基胆碱tch,然后通过s
‑
cu键原位形成tch
‑
cu(ii)配位微球(cp);tch
‑
cu(ii)cp可以吸附到石墨烯修饰电极表面;tch
‑
cu(ii)cp具有独特的电催化活性。cp催化邻苯二胺产生的电化学信号与ache的量成正比,该方法能够用于灵敏检测ache的活性,检出限为0.03mu
·
ml
‑1(s/n=3),线性范围为0.05~100mu
·
ml
‑1,建立了一系列经济且免标记的荧光/电化学方法用于实现对组蛋白乙酰转移酶活性的检测。
6.在以上的ache活性检测技术中,ellman检测法具有背景干扰、过程繁琐和假阳性信高的缺点;荧光“turn on”法不仅耗时和成本高,且荧光法难以适宜实时、实地快速监控;电化学法检测仪器操作简单,测定速度快,易于携带等特点受到广泛关注,目前主要集中于电位型和电流型ache生物传感器,但氧化电位过高、干扰严重,导致准确度低和灵敏度差。因此,开发一种高灵敏且简单、准确的用于检测ache活性的技术,对于临床诊断和ad药物分析等方面是具有重要意义的。
技术实现要素:
7.本发明的目的在于克服现有技术的不足之处,提供了乙酰胆碱酯酶(ache)催化光
谱传感检测体系及检测方法,解决了上述背景技术中的问题。
8.本发明解决其技术问题所采用的技术方案之一是:
9.一种新型ache的催化光谱传感检测方法,包括如下步骤:
10.(1)原位制备au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂:将巯基分子hs
‑
c
16
‑
tacn依次与纳米au、zn
2
在室温下作用,原位形成au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂;
11.(2)检测:将含有ache的样品溶液加入到au nps
‑
(s
‑
c
16
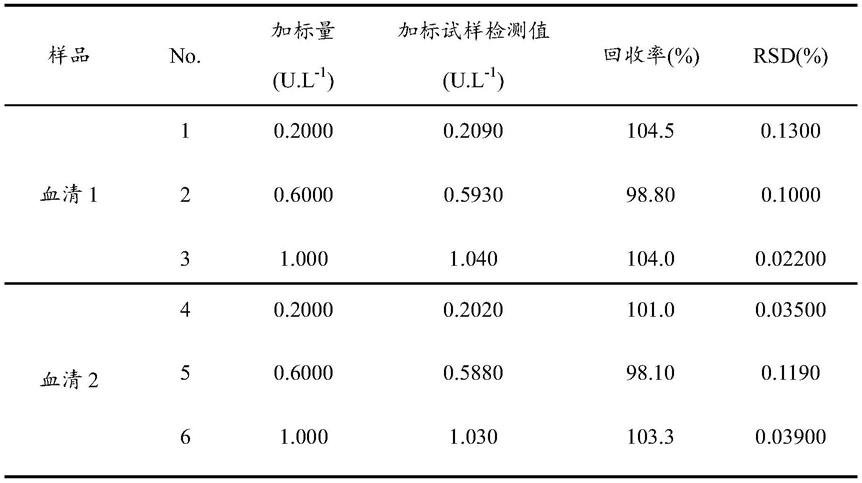
‑
tacn)
‑
zn
2
的纳米au型催化剂和有机磷hpnp的混合溶液体系中,在恒温水浴下反应若干分钟,立即扫描其uv
‑
vis吸收光谱,通过记录288~292nm和398~402nm处吸光度的变化,计算得到样品溶液中ache的含量。
12.在本发明一较佳实施例中,所述hs
‑
c
16
‑
tacn的制备方法包括:1,4,7
‑
三氮杂环壬烷(tacn)、三乙胺与二碳酸二叔丁酯在三氯甲烷中于室温下反应得到1,4,7
‑
三氮杂环壬烷
‑
1,4
‑
二羧酸二叔丁基酯;1,16二溴十六烷与硫代乙酸钾在丙酮中于室温下反应得到s
‑
代(16
‑
溴十六烷基)乙酸酯;s
‑
代(16
‑
溴十六烷基)乙酸酯、k2co3和nahco3在ch3cn中于30~40℃反应,随后向其中加入1,4,7
‑
三氮杂环壬烷
‑
1,4
‑
二羧酸二叔丁基酯,在55~65℃反应得到二叔丁基
‑7‑
(16
‑
(乙酰硫基)十六烷基)
‑
1,4,7,
‑
三氮杂环壬烷
‑
1,4
‑
二羧酸酯;二叔丁基
‑7‑
(16
‑
(乙酰硫基)十六烷基)
‑
1,4,7,
‑
三氮杂环壬烷
‑
1,4
‑
二羧酸酯与盐酸在甲醇中于55~65℃反应,除去溶剂,得到16
‑
(1,4,7
‑
三氮杂环壬烷
‑1‑
基)
‑
十六烷基
‑1‑
硫醇,即为所述hs
‑
c
16
‑
tacn。
13.在本发明一较佳实施例中,所述步骤(1)中,纳米au的粒径为2~4nm。
14.在本发明一较佳实施例中,所述uv
‑
vis吸收光谱的波长为398~402nm。
15.在本发明一较佳实施例中,所述步骤(2)中,反应体系的ph例如通过hepes缓冲溶液调节,ph为6.5~7.5;反应体系的温度例如通过恒温水浴提供,温度为25~35℃。
16.在本发明一较佳实施例中,所述步骤(2)中,au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
纳米au型催化剂浓度为1
×
10
‑5~20
×
10
‑5m。
17.在本发明一较佳实施例中,测定ache活度检出限的方法包括如下步骤:将不同活度的ache加入到au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂和hpnp混合溶液中,再加入到ph为6.5~7.5的1mm hepes缓冲溶液中,于25~35℃下反应28~32min,扫描其uv
‑
vis吸收光谱。
18.在本发明一较佳实施例中,求出398~402nm处吸光度与ache活度的对数值具有的两个线性关系曲线,相似地,求出288~292nm处吸光度与ache活度的对数值具有的两个线性关系曲线,最后根据398~402nm处吸光度与ache活度的对数值之间的线性关系曲线和288~292nm处吸光度与ache活度的对数值之间的线性关系曲线计算出ache活度检出限。本发明中,ache活度检出限可以达到0.012u.l
‑1(3σ/k,n=11,其中k为关系曲线的斜率)。
19.本方法所涉及的催化反应示意图如图1所示。
20.本发明解决其技术问题所采用的技术方案之二是:
21.一种ache的催化光谱传感检测体系,包括hpnp有机磷化合物、ache和au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂;所述au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂浓度为1
×
10
‑5~20
×
10
‑5m;所述体系的ph为6.5~7.5,温度为25~35℃,吸光度检测波长为288
~292nm和398~402nm。
22.本发明解决其技术问题所采用的技术方案之三是:
23.au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂在ache的检测中的应用。
24.本发明所涉及的设备、试剂、工艺、参数等,除有特别说明外,均为常规设备、试剂、工艺、参数等,不再作实施例。
25.本发明所列举的所有范围包括该范围内的所有点值。
26.本发明所述“大约”、“约”或“左右”等指的是所述范围或数值的
±
20%范围内。
27.本发明中,所述“室温”即常规环境温度,可以为10~30℃。
28.本技术方案与背景技术相比,具有如下优点:
29.有机磷化合物为ache抑制剂的一大类,本发明借助所设计的催化底物分子hpnp结构和传统有机磷农药分子的结构类似,在au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
纳米au型催化剂催化hpnp水解反应体系中加入ache后,ache通过磷酰化作用,使得hpnp脱离纳米au表面的催化基头tacn
‑
zn
2
,导致hpnp的水解反应受到抑制,最终可通过uv
‑
vis吸收光谱捕捉到催化信号的变化,实现对ache活度的检测,从而研发出一种新型的ache催化光谱传感技术。和前述背景技术中的ellman法、荧光法、电化学法相比较,本技术方案具有简便、灵敏、快速等方面的技术优点。
附图说明
30.图1为本方法所涉及的催化反应示意图。
31.图2为合成的3nm aunps的tem图。
32.图3为合成boc保护的tacn的路线图。
33.图4合成s
‑
代(16
‑
溴十六烷基)乙酸酯的路线图。
34.图5合成二叔丁基
‑7‑
(16
‑
(乙酰硫基)十六烷基)
‑
1,4,7
‑
三氮杂环壬烷
‑
1,4
‑
二羧酸酯的路线图。
35.图6合成16
‑
(1,4,7
‑
三氮杂环壬烷
‑1‑
基)
‑
十六烷基
‑1‑
硫醇(hs
‑
c
16
‑
tacn)的路线图。
36.图7为合成hs
‑
c
16
‑
tacn的表征结果图。
37.图8为400nm(a1)波长处、290nm(a2)波长处、a1/a2即两波波长处紫外吸收峰强度的比值和ache的活度的in值的关系曲线。
38.图9为ache与其他所考察的物质对au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂催化hpnp水解反应体系选择性的吸收光谱响应。
39.图10为ache与各种所考察的物质共存于au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂催化hpnp水解反应体系时,吸收光谱响应情况对比。
具体实施方式
40.下面结合附图和实施例具体说明本发明的内容:
41.实施例1:au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂的制备
42.制备au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂的方法,具体包括以下步骤:
43.1)合成粒径为3nm左右的au nps:参照还原氯金酸的方法,制备得到的3nm au nps
的tem如图2所示。
44.2)合成末端带有tacn环的巯基分子hs
‑
c
16
‑
tacn的步骤如下:
45.①
boc保护的tacn的合成步骤如下:
46.分析天平称取0.3204g 1,4,7
‑
三氮杂环壬烷(tacn)(2.48mmol),并将其溶于装有20ml三氯甲烷的烧瓶中,在通氮气的环境下加入230μl三乙胺。持续搅拌并排除烧瓶中的空气,分析天平称取1.082g二碳酸二叔丁酯(4.96mmol),并将其溶于装有20ml三氯甲烷的烧瓶中,缓慢逐滴加入到tacn的混合溶液中,该实验使用的仪器是微量进样器,设置其流速为350μl.min
‑1,待该三氯甲烷溶液加完后,该反应溶液在室温且氮气环境中搅拌10小时。反应结束后将反应液旋干后,采用过硅胶柱的方式分离纯化反应后的产物,洗脱剂:二氯甲烷与甲醇的体积比为20:1,可得0.205g淡黄色粘稠状产物,为含两个boc保护的tacn氮杂环,记为1,4,7
‑
三氮杂环壬烷
‑
1,4
‑
二羧酸二叔丁基酯,计算产率为25%(合成路线如图3所示)。
47.②
s
‑
代(16
‑
溴十六烷基)乙酸酯的合成步骤如下:
48.称取2.848g 1,16二溴十六烷(8.0mmol),并将其溶解装有20ml丙酮的烧瓶中,氮气环境下加入1.015g硫代乙酸钾(9.00mmol)加入到上述装有丙酮的烧瓶中,待烧瓶中的空气完全,排净后,该反应液在氮气环境且室温的条件下搅拌10小时,反应结束后过滤掉悬浮液,滤液再旋干,经硅胶柱(洗脱液:v
pe(石油醚)
/v
dcm(二氯甲烷)
=8/2)纯化后,获得0.82g的s
‑
代(16
‑
溴十六烷基)乙酸酯白色产物,通过称取产物的质量计算出产率为29.2%(合成路线如图4所示)。
49.③
二叔丁基
‑7‑
(16
‑
(乙酰硫基)十六烷基)
‑
1,4,7
‑
三氮杂环壬烷
‑
1,4
‑
二羧酸酯合成步骤如下:
50.将0.302g的化合物s
‑
代(16
‑
溴十六烷基)乙酸酯(0.86mmol)加入到含有0.279g的k2co3(2.02mmol)和0.1698g的nahco3(2.02mmol)的ch3cn中的悬浮液中,在温度为35℃下反应30分钟。然后再加入0.2369g 1,4,7
‑
三氮杂环壬烷
‑
1,4
‑
二羧酸二叔丁基酯(0.72mmol),在60℃下搅拌反应6h。反应结束后,过滤悬浮液,并旋蒸溶剂。粗产物经硅胶柱(洗脱液:v
pe(石油醚)
/v
ea(乙酸乙酯)
=7/3)得以纯化。最终获得0.23g纯的白色固体,为二叔丁基
‑7‑
(16
‑
(乙酰硫基)十六烷基)
‑
1,4,7,
‑
三氮杂环壬烷
‑
1,4
‑
二羧酸酯(产率计算为53%)(合成路线如图5所示)。
51.④
16
‑
(1,4,7
‑
三氮杂环壬烷
‑1‑
基)
‑
十六烷基
‑1‑
硫醇(hs
‑
c
16
‑
tacn)合成步骤如下:
52.将化合物二叔丁基
‑7‑
(16
‑
(乙酰硫基)十六烷基)
‑
1,4,7,
‑
三氮杂环壬烷
‑
1,4
‑
二羧酸酯溶解在5ml甲醇溶液中,再加入等体积的3m盐酸溶液,在60℃水浴下反应6h。反应结束后,多余的溶剂经旋蒸后即得所需的16
‑
(1,4,7
‑
三氮杂环壬烷
‑1‑
基)
‑
十六烷基
‑1‑
硫醇,无需进一步纯化(合成路线如图6所示)。所合成的hs
‑
c
16
‑
tacn表征结果如图7所示。
53.3)hs
‑
c
16
‑
tacn依次与au nps、zn
2
作用,在室温下制备au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
纳米au型催化剂的步骤如下:
54.以hs
‑
c
16
‑
tacn和3.07
±
0.53nm左右的au nps为例,将10mm hepes缓冲溶液(ph为8.0)、12μm hs
‑
c
16
‑
tacn和1.5μm au nps溶液混合,再加入12μm zn
2
离子即得au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂。
55.实施例2:au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂催化底物分子hpnp水解实
验
56.au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂催化底物分子hpnp水解反应的实验步骤如下:
57.将160μl 1mm hpnp溶液加入到1840μl含au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂的1mm hepes缓冲液(ph为7.24)中,hepes缓冲溶液由naoh溶液调节至所需ph,摇匀,混合液在30℃下加热0.5h,立即扫描其uv
‑
vis吸收光谱。
58.实施例3:利用aunps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂进行ache的检测
59.一种新型的ache催化光谱传感检测方法,包括如下步骤:
60.(1)样品制备:
61.1)参照实施例1的方法,原位形成aunps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂。
62.2)ache溶液配制:首先配制hepes缓冲溶液,用滤膜过滤后溶解ache(市售产品)并低温保存,使用时用牛血清蛋白溶液稀释至所需活度。
63.(2)检测:将不同活度的ache加入到au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂和hpnp混合溶液体系中,在一定的温度下反应若干分钟,立即扫描其uv
‑
vis吸收光谱,通过290nm和400nm处吸光度的变化,计算得到样品溶液中ache的含量,ache的检出限为0.012u.l
‑1(3σ/k,n=11,其中k为关系曲线的斜率),所有实验都平行三组,请参阅图8。
64.1)求出a
400nm
与ache活度的对数值具有两个线性关系曲线:a1(abs=400nm)=0.4627
‑
0.08ln(c
ache
)(loda1=0.097u.l
‑1),如图8所示。
65.2)求出a
290nm
与ache活度的对数值也具有两个线性关系曲线:a2(abs=290nm)=0.1172ln(c
ache
) 0.4616(loda2=0.066u.l
‑1),如图8所示。
66.3)最后通过a1/a2=0.9940
‑
0.6242ln(c
ache
)(loda1/a2=0.012u.l
‑1),计算出ache活度检出限为0.012u.l
‑1(3σ/k,n=11,其中k为关系曲线的斜率)。如图8所示。线性范围为0~6u.l
‑1。
67.实施例4:样品加标实验
68.(1)样品制备:
69.①
随机从医务室取出两份人血清样品,放置冰箱低温保存;
70.②
待血清自然析出后离心,且小份移置干净试管并低温保存。
71.(2)加标回收实验操作:
72.将160μl 1mm hpnp溶液加入到一定量的hepes缓冲溶液(ph为7.24)中,再加入配制好的au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂溶液,最后加入60μl人血清样品溶液,控制总体积为2ml。混匀后,混合液于30℃恒温水浴中反应30min,立即后用紫外可见吸收光谱仪测其吸光度光谱(波长=400nm),计算出回收率和rsd值,所有实验都平行三组。
73.结果如下表1所示,可以看出在相同的实验条件下,血清中ache的回收率法研究结果表明,血清1(医务室的血清样品)中ache的回收率为98.8%~104.5%,血清2中ache的回收率为98.1%~103.3%。rsd值则分别为0.022%~0.13%和0.035%~0.199%(表1)。由此可见,该催化传感体系具有较好的应用前景。
74.表1人血清中ache的回收率实验结果(n=3)
[0075][0076]
实施例5:传感体系对ache活性的选择性实验和抗干扰性实验
[0077]
(1)ache活性的选择性实验:实验条件与上述的ache相同,选择常见的酶、蛋白质和氨基酸等进行研究,所有实验都平行三组。
[0078]
请参阅图9,分别加入浓度和ache相同的酶(过氧化氢酶catalase、淀粉酶glucoamylase、木瓜蛋白酶papain、脂肪酶lipase、溶菌酶lysocyme、胰蛋白酶trypsin)、蛋白质(血红蛋白hemogtobin、牛血清蛋白bsa)和氨基酸(色氨酸tryptophan、甘氨酸glycine)到au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂和hpnp混合溶液体系中,实验条件与上述的ache相同,考察相应的吸收光谱响应。结果显示,只有加入一定数量的ache才会抑制au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂催化hpnp的水解反应,而其他所考察的相关物质对催化反应几乎没有影响。由此可以说明该催化传感体系对ache具有高选择性。
[0079]
(2)ache活性的抗干扰性实验:请参阅图10,当au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂催化hpnp的水解反应溶液体系中加入ache后,再分别加入高于ache活度10倍的其他考察物种后发现,所引起的uv
‑
vis吸收光谱变化与单独引入ache的几乎一样。这说明该催化传感体系具有强的抗干扰能力。
[0080]
实施例6:ache活度检出限的确定
[0081]
根据a400nm/a290nm与ln(c
ache
)作线性关系图,并根据公式a1/a2=0.9940
‑
0.6242ln(c
ache
)(loda1/a2=0.012u.l
‑
1)获得的ache活度检出限最低可达到0.012u.l
‑1(3σ/k,n=11,其中k为关系曲线的斜率)。
[0082]
实施例7:利用本发明的催化光谱传感检测体系对ache活度检测
[0083]
ache可以高选择性、高灵敏度地抑制au nps
‑
(s
‑
c
16
‑
tacn)
‑
zn
2
的纳米au型催化剂催化hpnp水解反应,从而发展出一种新型且高灵敏的ache催化传感体系。能够获得高灵敏度,这可能源自于催化反应的应用而获得信号放大的效果所致。
[0084]
以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。