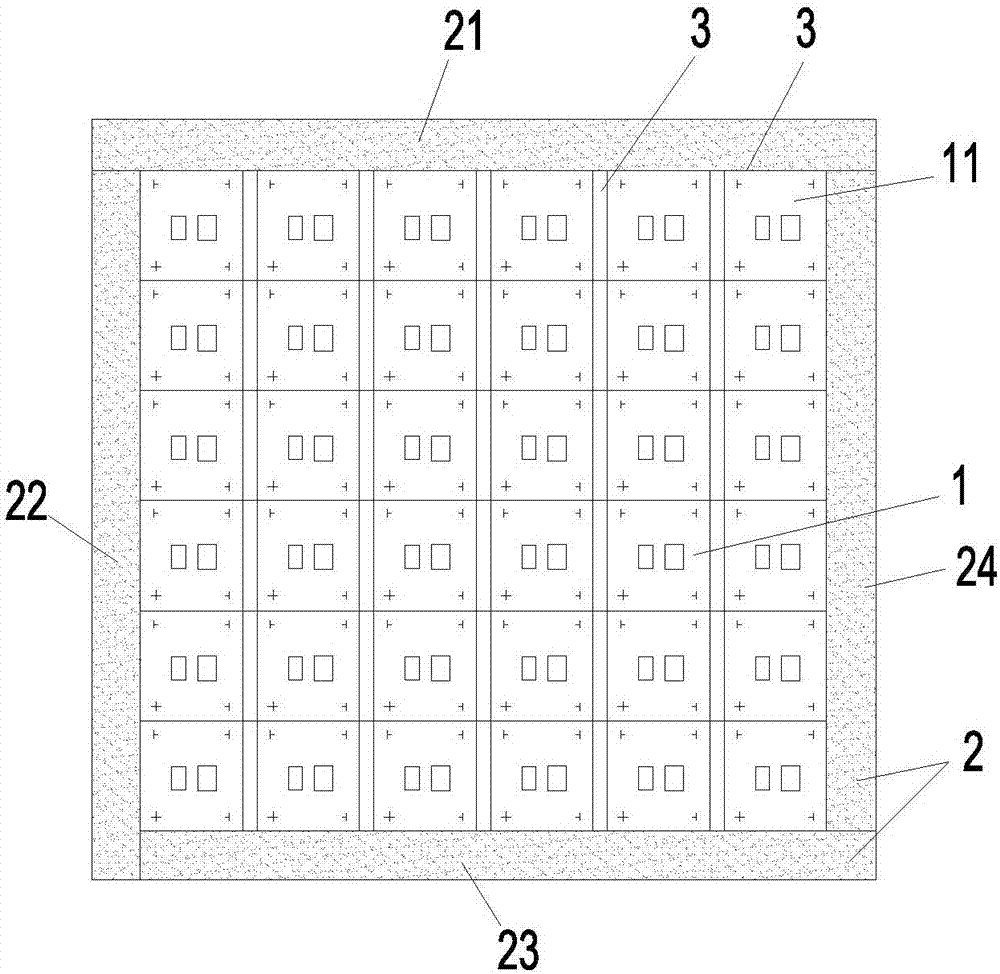
本发明涉及用于微流体设备。更具体地,本发明涉及用于检测靶分子的集成蛋白质微阵列的微流体系统。
背景技术:
::许多诊断或其他程序需要将样品从收集点运送到可以分析样品的设施的很远距离。提供可以更接近样品收集位置使用并且及时产生分析结果的分析设备将是有用的,例如对于在复杂基质内以微量存在的靶分子。对于改善的灵敏度、定量和产量,elisa是一种常用的形式,其基于将抗体包被在吸附剂96孔板的固相上,并将elisa测定限制为单一分析物。大部分诊断测试仍在手动或半自动elisa滴定板上进行。elisa是极其劳动密集型的,用户会欢迎使用简化的替代技术。目前,除了成本考虑之外,安排两个以上测定的测试结果以获得多个标记的测试结果,即使在来自相同测试实验室的请求时,也倾向于引起额外的延迟。同时安排两个检测可能意味着发送更多样本,并经常向不同的实验室发送。这也导致比安排一个测试和等待结果以评估是否需要进一步测试的标准做法更高的成本。多路复用是一种范式转换,可以使用产生更多诊断信息的测试来节省更多经济成本。多路复用测定也提高了疾病标志物的诊断能力。通常,单个标志物具有临床敏感性和/或特异性限制。与elisa表面相比,微阵列表面中使用的较小斑点导致用于微阵列测定的测试样品中分析物的可能性降低,在测定中耗尽或改变(ekins,1989)。这种差异还意味着微阵列分析具有更好的准确性和灵敏度,尤其是在低分析物样品中。随着扩散约束被最小化,微阵列测定也与更快的动力学相关联。因此,与传统方法相比,该技术平台在生物标志物组的通量和评估方面有效得多。最近,免疫测定已与微流体系统集成在一起。微流体系统通常被称为“芯片上实验室(loc)”或“生物芯片”。与传统的实验室系统相比,这些loc微流体系统使测定小型化。将免疫测定集成到loc中有几个优点,包括但不限于更少的样品/试剂消耗,增强的灵敏度,降低的污染风险,更低的单位成本,更低的功耗以及更高的可靠性和功能性(donganduede,2017;lin等,2010)。在实验室中进行的典型免疫测定花费大量时间,主要是由于温育时间长,这归因于试剂从溶液移动到发生免疫反应的表面的低效质量输送。微流体免疫测定期间的液体输送可以辅助试剂的质量输送并提高免疫反应的效率。免疫测定中使用的试剂可能非常昂贵。将免疫测定集成到微流体中可以大大减少由于小型化而导致的试剂消耗。技术实现要素:本发明部分地提供了一种用于从少量样品中平行地检测多重靶分子的微流体装置。靶分子包括多肽、抗体、小分子、代谢物、重金属等。微流体装置可以是集成蛋白质微阵列的微流体设备,其用于例如检测靶分子阵列。一方面,本发明提供了一种包含微流体盒的装置,所述微流体盒包含蛋白质微阵列和用于接受流体样品的托座(receptacle),其中流体样品配置为与蛋白质微阵列流体连通。微流体盒可以与仪器气动连接,以便例如控制流体的运动。仪器能够检测来自蛋白质微阵列的信号。另一方面,本发明提供了一种包含微流体盒的装置,所述微流体盒包含湿盒、干盒和蛋白质微阵列,其中所述湿盒包含多个试剂储罐;多个缓冲剂储罐;和多个废物储罐;所述干盒包含用于检测所述蛋白质微阵列的孔隙和多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:多个试剂通道;多个缓冲剂通道;将所述阵列室与所述缓冲剂储罐、试剂储罐和废物储罐连接的多个通道;其中所述通道配置为允许流体平稳流动且交叉污染最小化;并且其中所述干盒与所述湿盒对准,并与所述湿盒和所述蛋白质微阵列流体连通。另一方面,本发明提供一种微流体盒,其包含湿盒、干盒和蛋白质微阵列,其中所述湿盒可包含:i)多个试剂储罐,其容纳例如测定-特异性试剂;ii)多个缓冲剂储罐,其中缓冲剂储罐的数量等于试剂储罐的数量;iii)多个废物储罐;iv)对应于所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;v)用于接收流体样品的样品孔;和vi)对应于所述缓冲剂储罐、试剂储罐、废物储罐和样品孔中每一个的多个端口;并且所述干盒可包含用于检测来自蛋白质微阵列的信号的孔隙和设置在主结点周围的多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:vii)多个试剂通道,其中每个试剂通道对应于所述湿盒的所述试剂储罐中的一个;viii)多个缓冲剂通道,其中每个缓冲剂通道对应于所述湿盒的所述缓冲剂储罐中的一个;ix)从所述主结点通向每个缓冲剂通道的通道;x)将每个缓冲剂通道与各试剂通道连接的通道,从而形成缓冲剂通道/试剂通道对;xi)将所述阵列室与所述第一废物储罐连接的通道;xii)将所述阵列室与所述主结点连接的通道;xiii)将所述主结点与所述第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;xiv)对应于所述湿盒的所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和xv)对应于所述通气口中每一个的多个液体不可透的透气的阻隔物,以及将每个试剂/缓冲剂通道对从储罐连接至主通道的通道;其中所述干盒可与所述湿盒对准,并且与所述湿盒和所述蛋白质微阵列流体连通,所述通气口与仪器的歧管接合。另一方面,本发明提供一种其包含湿盒、干盒和蛋白质微阵列的微流体盒,其中所述湿盒包含:i)多个试剂储罐;ii)多个缓冲剂储罐,其中缓冲剂储罐的数量等于试剂储罐的数量;iii)第一和第二废物储罐;iv)对应于所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;v)用于接收流体样品的样品孔;和vi)对应于所述缓冲剂储罐、试剂储罐、废物储罐和样品孔中每一个的多个端口;并且所述干盒包含用于检测所述蛋白质微阵列的孔隙和设置在主结点周围的多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:多个试剂通道,其中每个试剂通道对应于所述湿盒的所述试剂储罐中的一个;多个缓冲剂通道,其中每个缓冲剂通道对应于所述湿盒的所述缓冲剂储罐中的一个,并且其中每个缓冲剂通道与各自对应的试剂通道连接,从而形成缓冲剂通道/试剂通道对;从所述主结点通向每个缓冲剂通道的通道;将所述阵列室与所述第一废物储罐连接的通道;将所述阵列室与所述主结点连接的通道;将所述主结点与所述第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;对应于所述湿盒的所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和对应于所述通气口中每一个的多个液体不可透的透气的阻隔物;其中所述干盒与所述湿盒对准,并且能够与所述湿盒和所述蛋白质微阵列流体连通,所述通气口能够与仪器的歧管接合。另一方面,本发明提供一种其包含湿盒、干盒和蛋白质微阵列的微流体盒,其中所述湿盒可包含:i)多个试剂储罐;ii)多个缓冲剂储罐,其中缓冲剂储罐的数量等于试剂储罐的数量;iii)第一和第二废物储罐;iv)对应于所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;v)用于接收流体样品的样品孔;和vi)对应于所述缓冲剂储罐、试剂储罐、废物储罐和样品孔中每一个的多个端口;并且所述干盒包含用于检测所述蛋白质微阵列的孔隙和多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:多个试剂通道,其中每个试剂通道对应于所述湿盒的所述试剂储罐中的一个;多个缓冲剂通道,其中每个缓冲剂通道对应于所述湿盒的所述缓冲剂储罐中的一个,并且其中每个缓冲剂通道与各自对应的试剂通道连接,从而形成缓冲剂通道/试剂通道对,并且其中每个缓冲剂通道与主通道连接;将所述阵列室与所述第一废物储罐连接的通道;将所述阵列室与所述主通道连接的通道;将所述主通道与所述第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;对应于所述湿盒的所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和对应于所述通气口中每一个的多个液体不可透的透气的阻隔物;其中所述干盒与所述湿盒对准,并且能够与所述湿盒和所述蛋白质微阵列流体连通,所述通气口能够与仪器的歧管接合。另一方面,本发明提供一种湿盒,其包含:i)多个试剂储罐;ii)多个缓冲剂储罐,其中缓冲剂储罐的数量等于试剂储罐的数量;iii)第一和第二废物储罐;iv)对应于所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;v)用于接收流体样品的样品孔;和vi)对应于所述缓冲剂储罐、试剂储罐、废物储罐和样品孔中每一个的多个端口;其中所述湿盒能够与干盒和蛋白质微阵列对准。另一方面,本发明提供一种干盒,其包含用于检测蛋白质微阵列的孔隙和设置在主结点周围的多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:多个试剂通道,其中每个试剂通道对应于所述湿盒的所述试剂储罐中的一个;多个缓冲剂通道,其中每个缓冲剂通道对应于所述湿盒的所述缓冲剂储罐中的一个,并且其中每个缓冲剂通道与各自对应的试剂通道连接,从而形成缓冲剂通道/试剂通道对;从所述主结点通向每个缓冲剂通道的通道;将所述阵列室与所述第一废物储罐连接的通道;将所述阵列室与所述主结点连接的通道;将所述主结点与所述第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;对应于所述湿盒的所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和对应于所述通气口中每一个的多个液体不可透的透气的阻隔物;其中所述干盒能够与湿盒和所述蛋白质微阵列对准,所述通气口能够与仪器的歧管接合。另一方面,本发明提供一种干盒,其包含用于检测所述蛋白质微阵列的孔隙和多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:多个试剂通道,其中每个试剂通道对应于所述湿盒的所述试剂储罐中的一个;多个缓冲剂通道,其中每个缓冲剂通道对应于所述湿盒的所述缓冲剂储罐中的一个,并且其中每个缓冲剂通道与各自对应的试剂通道连接,从而形成缓冲剂通道/试剂通道对,并且其中每个缓冲剂通道与主通道连接;将所述阵列室与所述第一废物储罐连接的通道;将所述阵列室与所述主通道连接的通道;将所述主通道与所述第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;对应于所述湿盒的所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和对应于所述通气口中每一个的多个液体不可透的透气的阻隔物;其中所述干盒能够与湿盒和所述蛋白质微阵列对准,所述通气口能够与仪器的歧管接合。所述蛋白质微阵列可以是抗体微阵列、蛋白质或肽微阵列。所述流体样品可以是生物样品或者含有待检测的靶分子的任意液体样品。所述仪器可包括泵、阀门和光学传感器以及集成微处理器以便控制上述部件。从所述光学传感器的读出可使用量化软件来解释。所述软件可以按照预先设定的脚本控制特定阀门的打开或关闭以及流速。其还可以控制光学传感器以进行图像捕获和图像分析,例如信号量化和背景扣除。所述缓冲剂储罐、试剂储罐和废物储罐可配置为允许预定体积。所述湿盒可包含层压底部,所述层压底部包含预切洞,其在所述缓冲剂储罐、试剂储罐和废物储罐下面以用于装载所述储罐。必要时,所述湿盒可以是可重复使用的。所述干盒可以是一次性的。包含蛋白质微阵列的组装的微流体盒可以是一次性的。本发明的概述不一定描述了本发明的所有特征。附图说明通过以下参考附图的描述,本发明的这些和其他特征将变得更加明显,其中:图1显示来自不含抗原的elisa的捕获和检测抗体之间的交叉反应性筛选结果。所有检测抗体都是生物素化的。使用链霉亲和素-hrp(sa-hrp)检测信号,并且嵌入的表中显示的数字是光密度读数(o.d.)。图2显示来自elisa的抗原和检测抗体之间的交叉反应性筛选结果。在孔中将对应于捕获抗体的抗原温育后,将所有检测抗体分别施用于不同的孔,以用于检测各抗原与其他3种检测抗体之间的交叉反应性。图3a-l显示用微阵列形式测试各种捕获抗体浓度及其响应的设置和结果,其中载玻片用genepix微阵列扫描仪扫描;a-c:从左上起顺时针点样四个斑点:bsa-生物素:13.2μg/ml,ca15-3cab1.25μg/ml,ca15-3cab125μg/ml,ca15-3cab12.5μg/ml;a:用3000u/ml的ca15-3抗原和1μg/ml的ca15-3dab探测;b:用300u/ml的ca15-3抗原和1μg/ml的ca15-3dab探测;c:用30u/ml的ca15-3抗原和1μg/ml的ca15-3dab探测;d-f:从左上起顺时针点样四个斑点:bsa-生物素:13.2μg/ml,ceacab20μg/ml,ceacab2000μg/ml,ceacabcab200μg/ml;d:用500ng/ml的cea抗原和10μg/ml的ceadab探测;e:用50ng/ml的cea抗原和10μg/ml的ceadab探测;f:5ng/ml的cea抗原和10μg/ml的ceadab探测;g-i:从左上起顺时针点样四个斑点:bsa-生物素:13.2μg/ml,5μg/ml的cyfra21-1cab,500μg/ml的cyfra21-1cab,50μg/ml的cyfra21-1cab;g:用200ng/ml的cyfra21-1抗原和10μg/ml的cyfra21-1dab探测;h:用20ng/ml的cyfra21-1抗原和10μg/ml的cyfra21-1dab探测;i:用2ng/ml的cyfra21-1抗原和10μg/ml的cyfra21-1dab探测;j-l:从左上起顺时针点样四个斑点:bsa-生物素:13.2μg/ml,5μg/ml的erbb2cab,500μg/ml的erbb2cab,50μg/ml的erbb2;j:用1500ng/ml的erbb2和4μg/ml的erbb2dab探测;k:用150ng/ml的erbb2和4μg/ml的erbb2dab探测;l:用15ng/ml的erbb2和4μg/ml的erbb2dab探测。图4显示了微阵列布局和结果,其说明了改变ca15-3捕获抗体浓度对信号的影响,信号用tmb-mx显影并用genepix微阵列扫描仪扫描;用隔离器在载玻片上点样;顶行(从左至右):bsa-生物素(8nm),500μg/ml的ca15-3cab,200μg/ml的ca15-3cab;中间行(从左至右):80μg/ml的ca15-3cab,32μg/ml的ca15-3cab,750u/ml的ca15-3抗原;底行(从左至右):375u/ml的ca15-3抗原,187.5u/ml的ca15-3抗原,93.75u/ml的ca15-3抗原;用30u/ml的ca15-3抗原和1μg/ml的ca15-3抗原探测。图5a-b显示erbb2的固定化抗原滴定(a)和来自微阵列测定的相应抗原滴定曲线(b);a:用隔离器在载玻片上点样;顶行(从左至右):500μg/ml的erbb2cab,250μg/ml的erbb2cab,125μg/ml的erbb2cab,62.5μg/ml的erbb2cab;第二行(从左至右):与顶行相同;第三行(从左至右):2812.5ng/ml的erbb2抗原,1875ng/ml的erbb2抗原,1406.25ng/ml的erbb2抗原,937.5ng/ml的erbb2抗原;底行(从左至右):703.13ng/ml的erbb2抗原,468.75ng/ml的erbb2抗原,351.56ng/ml的erbb2抗原,234.38ng/ml的erbb2抗原。图6a-d显示使用机器人微阵列打印机打印的微阵列载玻片的结果,其中捕获抗体是用单个检测抗体6次探测的复制品;亮角点是用于取向的bsa-生物素;第一行是500μg/ml的erbb2cab;第二行是500μg/ml的cyfra21-1cab;第三行是500μg/ml的ca15-3cab;第四行是2000μg/ml的ceacab1;第五行是2000μg/ml的ceacab2;a:用2μg/ml的ca15-3dab探测;b:用4μg/ml的erbb2dab探测;c:用20μg/ml的ceadab探测;d:用10μg/ml的cyfra21-1dab探测。图7显示用定制硅酮隔离器点样的微阵列载玻片上的捕获和检测抗体之间的交叉反应性;顶行(从左至右):8nm的bsa-生物素,25μg/ml的ca15-3cab,250μg/ml的erbb2cab;中间行(从左至右):50μg/ml的cyfra21-1cab,500μg/ml的ceacab,1500u/ml的ca15-3抗原;底行(从左至右):7.5μg/ml的erbb2抗原,100ng/ml的cyfra21-1抗原,15μg/ml的cea。其随后用2μg/ml的ca15-3dab、20μg/ml的ceadab、8μg/ml的erbb2dab、5μg/ml的cyfra21-1dab的dab混合物探测。图8显示用于检查新ca15-3抗原(fitzgerald:30c-cp9064u)中的潜在污染物的微阵列实验,其中用sa-hrp和enzmet银显影剂探测微阵列,用genepix微阵列扫描仪扫描显影的信号;用定制硅酮隔离器点样微阵列载玻片;顶行(从左至右):8nm的bsa-生物素,25μg/ml的ca15-3cab,1500u/ml的ca15-3抗原;中间行(从左至右):50μg/ml的cyfra21-1cab,650μg/ml的ceacab,250μg/m的erbb2cab;底行(从左至右):100ng/ml的cyfra21-1抗原,15μg/ml的cea抗原,7.5μg/ml的erbb2抗原;用30u/ml的新ca15-3抗原以及1μg/ml的ca15-3dab、20μg/ml的ceadab、8μg/ml的erbb2dab、5μg/ml的cyfra21-1dab的dab混合物探测。图9a-d显示检查抗原和检测抗体之间的交叉反应性的微阵列实验的结果;嵌图a-b:用定制硅酮隔离器打印;顶行(从左至右):8nm的bsa-生物素,25μg/ml的ca15-3cab,250μg/ml的erbb2cab;中间行(从左至右):50μg/ml的cyfra21-1cab,500μg/ml的ceacab,1500u/ml的ca15-3抗原;底行(从左至右):7.5μg/ml的erbb2抗原,100ng/ml的cyfra21-1抗原,15μg/ml的cea;嵌图c-d:用定制硅酮隔离器打印;顶行(从左至右):bsa-生物素4nm,50μg/ml的ca15-3cab,1500u/ml的ca15-3抗原;中间行(从左至右):200μg/ml的cyfra21-1cab,975μg/ml的ceacab,395μg/m的erbb2cab;底行(从左至右):100ng/ml的cyfra21-1抗原,15μg/ml的cea抗原,2.25μg/ml的erbb2抗原;a:用30u/ml的ca15-3抗原和2μg/ml的ca15-3dab探测;b:用8ng/ml的cyfra21-1抗原和5μg/ml的cyfra21-1dab探测;c:用200ng/ml的cea和20μg/ml的ceadab探测;d:用120ng/ml的erbb2抗原和8μg/ml的erbb2dab探测。图10a-d显示检查抗原和检测抗体之间的交叉反应性的微阵列实验的结果;嵌图a-c:用定制硅酮隔离器点样;顶行(从左至右):8nm的bsa-生物素,25μg/ml的ca15-3cab,250μg/ml的erbb2cab;中间行(从左至右):50μg/ml的cyfra21-1cab,500μg/ml的ceacab,1500u/ml的ca15-3抗原;底行(从左至右):7.5μg/ml的erbb2抗原,100ng/ml的cyfra21-1抗原,15μg/ml的cea;嵌图d:用定制硅酮隔离器点样;顶行(从左至右):bsa-生物素10nm,25μg/ml的ca15-3cab,200μg/ml的erbb2;中间行(从左至右):200μg/ml的cyfra21-1cab,125μg/ml的cyfra21-1cab,250μg/ml的cyfra21-1抗原;底行(从左至右):500μg/ml的ceacab,250μg/ml的ceacab,125μg/ml的ceacab;a:用30u/ml的ca15-3抗原和2μg/ml的ca15-3dab探测;b:用50ng/ml的cea抗原和20μg/ml的ceadab探测;c:用8ng/ml的cyfra21-1和5μg/ml的cyfra21-1dab探测;d:用30ng/ml的erbb2抗原和8μg/ml的erbb2dab探测。图11a-n显示通过预混合dab与链霉亲和素-辣根过氧化物酶(sa-hrp)或与sa-hrp/生物素-hrp进行信号放大;嵌图a-g显示用sa-hrp和生物素-hrp的各种组合探测的夹心抗体微阵列测定的结果,其中用genepix微阵列扫描仪扫描探测的载玻片;载玻片用定制硅酮隔离器点样;顶行(从左至右):8nm的bsa-生物素,25μg/ml的ca15-3cab,1500u/ml的ca15-3抗原;中间行(从左至右):50μg/ml的cyfra21-1cab,650μg/ml的ceacab,250μg/m的erbb2cab;底行(从左至右):100ng/ml的cyfra21-1抗原,15μg/ml的cea抗原,7.5μg/ml的erbb2;a-g都用由ca15-3、cea、erbb2和cyfra21-1组成的抗原混合物探测。a:用具有5x摩尔量的sa-hrp的dab混合物探测15分钟;b:用具有5x摩尔量的sa-hrp的dab混合物探测15分钟,并且添加4μg/ml的生物素-hrp,探测10分钟;c:用dab混合物探测15分钟,添加预混合有1μg/ml的生物素-hrp的4μg/ml的sa-hrp,探测10分钟;d:用dab混合物探测15分钟,添加预混合有2μg/ml的生物素-hrp的4μg/ml的sa-hrp,探测10分钟;e:用dab混合物探测15分钟,添加预混合有4μg/ml的生物素-hrp的4μg/ml的sa-hrp,探测10分钟;f:用dab混合物探测15分钟,添加预混合有5μg/ml的生物素-hrp的20μg/ml的sa-hrp,探测10分钟;g:用dab混合物探测15分钟,添加预混合有25μg/ml的生物素-hrp的100μg/ml的sa-hrp,探测10分钟;嵌图h-m:用不同浓度的bsa-生物素打印微阵列载玻片,重复四次;第1行:120nm的bsa-生物素和打印缓冲剂;第2行:60nm的bsa-生物素和打印缓冲剂;第3行:30nm的bsa-生物素和打印缓冲剂;第4行:20nm的bsa-生物素和打印缓冲剂;第5行:15nm的bsa-生物素和10nm的bsa-生物素;第6行:7.5nm的bsa-生物素和5nm的bsa-生物素;第7行:37.5nm的bsa-生物素和2.5nm的bsa-生物素;第8行:1.875nm的bsa-生物素和1.25nm的bsa-生物素;然后用各种浓度的sa-hrp和生物素-hrp探测载玻片;h:用4μg/ml的sa-hrp探测10分钟;i:用预混合的4μg/ml的sa-hrp和2μg/ml的生物素-hrp探测10分钟;j:用预混合的4μg/ml的sa-hrp和4μg/ml的生物素-hrp探测10分钟;k:用预混合的4μg/ml的sa-hrp和6μg/ml的生物素-hrp探测10分钟;l:用预混合的4μg/ml的sa-hrp和8μg/ml的生物素-hrp探测10分钟;m:用预混合的8μg/ml的sa-hrp和4μg/ml的生物素-hrp探测10分钟;嵌图n:h-m中的数据的图示;1:用4μg/ml的sa-hrp探测10分钟;2:用4μg/ml的sa-hrp和2μg/ml的生物素-hrp探测10分钟;3:用4μg/ml的sa-hrp和4μg/ml的生物素-hrp探测10分钟;4:用8μg/ml的sa-hrp和4μg/ml的生物素-hrp探测10分钟。图12a-b显示sa-hrp和生物素-hrp预混物的不同温育时间;对于两个嵌图,都用定制硅酮隔离器对载玻片点样;顶行(从左至右):4nm的bsa-生物素,50μg/ml的ca15-3cab,1500u/ml的ca15-3抗原;中间行(从左至右):200μg/ml的cyfra21-1cab,975μg/ml的cea,395μg/ml的erbb2cab;底行(从左至右):100ng/ml的cyfra21-1抗原,15μg/ml的cea抗原,2.25μg/ml的erbb2抗原;嵌图a显示sa-hrp和生物素-hrp混合物的10分钟温育时间的结果;嵌图b显示sa-hrp/生物素-hrp混合物的5分钟温育时间的结果;用bioradchemdoctmmp系统扫描载玻片。图13a-c显示用sa-hrp的稀释物打印并用tmb-mx探测的载玻片;载玻片用定制硅酮隔离器点样;顶行(从左至右):0.5μg/ml的sa-hrp,1μg/ml的sa-hrp,2μg/ml的sa-hrp;中间行(从左至右):4μg/ml的sa-hrp,缓冲剂,0.5μg/ml的sa-hrp;底行(从左至右):1μg/ml的sa-hrp,2μg/ml的sa-hrp,4μg/ml的sa-hrp;嵌图a显示用genepix微阵列扫描仪扫描的tmb-mx(moss基底)显影后的载玻片的图像;嵌图b显示用该仪器成像的tmb-mx显影后的载玻片的光学图像;嵌图c是嵌图b所示tmb-mx响应的剂量依赖性的图示。图14a-d显示测试不同tmb-mx温育时间的微阵列载玻片;信号用仪器成像;载玻片用定制硅酮隔离器打印;顶行(从左至右):20μg/ml的ca15-3cab,80μg/ml的ca15-3cab,750u/ml的ca15-3抗原;中间行(从左至右):100μg/ml的cyfra21-1cab,400μg/ml的cyfra21-1cab,125ng/ml的cyfra21-1抗原;底行(从左至右):125μg/ml的erbb2cab,500μg/ml的erbb2cab,1875ng/ml的erbb2抗原;嵌图a显示2分钟tmb-mx温育后的信号;嵌图b显示4分钟tmb-mx温育后的信号;嵌图c显示6分钟tmb-mx温育后的信号;嵌图d显示8分钟tmb-mx温育后的信号。图15a-b显示斑点布局以及测试不同打印缓冲剂的两个银染斑点的图像;25μg/ml的ca15-3cab用定制硅酮隔离器点样;a以1xpbs点样,b以1xpbs 20%甘油点样;用bioradchemdoctmmp系统成像。图16a-b显示打印缓冲剂对银显影微阵列载玻片的cea捕获抗体微阵列扫描的信号强度的作用;载玻片在定制硅酮隔离器上点样;a:用1xpbs、5%甘油和0.02%十二烷基肌氨酸钠打印抗体和抗原;顶行(从左至右):4nm的bsa-生物素,50μg/ml的ca15-3cab,1500u/ml的ca15-3抗原;中间行(从左至右):200μg/ml的cyfra21-1cab,975μg/ml的ceacab,395μg/ml的erbb2cab;底行(从左至右):100ng/ml的cyfra21-1抗原,15μg/ml的cea抗原,2.25μg/ml的erbb2抗原;b:用1xpbs打印的抗体和抗原;顶行(从左至右):4nm的bsa-生物素,pbs中的1000μg/ml的ceacab,pbs中的1000μg/ml的ceacab;中间行(从左至右):312.5ng/ml的cea抗原,625ng/ml的cea抗原,1250ng/ml的cea抗原;底行(从左至右):2500ng/ml的cea抗原,5000ng/ml的cea抗原,10000ng/ml的cea抗原;两个孔都用200ng/ml的cea抗原(c3100-14)和20μg/ml的c1299-87o-b检测抗体探测。在白色框中突出显示975μg/ml和100μg/ml的c1299-87w的cea捕获抗体斑点用于比较。图17a-b显示不同离子强度的探测缓冲剂的结果。利用定制硅酮隔离器将捕获抗体在载玻片上点样;顶行(从左至右):50μg/ml的ca15-3cab,25μg/ml的ca15-3cab;底行(从左至右):500μg/ml的erbb2cab,250μg/ml的erbb2cab;通过银显影获得结果,并用bioradchemdoctmmp系统成像。嵌图a示出当使用1xpbst 5%bsa的探测缓冲剂时的结果。嵌图b示出当使用低离子强度的探测缓冲剂0.25xpbst 5%bsa时的结果。图18a-l显示抗原和检测抗体混合物的不同温育时间。载玻片用微阵列打印机打印,重复6次,第一行为500μg/ml的erbb2cab,第二行为500μg/ml的ca15-3cab;银显影的捕获抗体斑点的微阵列扫描仪图像;嵌图a-f用30u/ml的ca15-3抗原和15ng/ml的erbb2抗原的抗原混合物以及dab混合物探测15分钟;a:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测15分钟的抗原混合物;b:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测30分钟的抗原混合物;c:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测60分钟的抗原混合物;d:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测15分钟的抗原混合物;e:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测30分钟的抗原混合物;f:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测60分钟的抗原混合物;嵌图g-l用30u/ml的ca15-3抗原和15ng/ml的erbb2抗原的抗原混合物以及dab混合物探测30分钟;g:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测15分钟的抗原混合物;h:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测30分钟的抗原混合物;i:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测60分钟的抗原混合物;j:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测15分钟的抗原混合物;k:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测30分钟的抗原混合物;l:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测60分钟的抗原混合物。图19显示用arrayit比色扫描仪扫描的充分显影的tmb-mx的微阵列扫描;载玻片用omnigrid微阵列打印机打印,斑点在12×12网格中一式三份打印;第1行(从左至右):30nm的bsa-生物素,40μg/ml的ca15-3cab,30μg/ml的ca15-3cab,20μg/ml的ca15-3cab;第2行(从左至右):1600u/ml的ca15-3抗原,800u/ml的ca15-3抗原,400u/ml的ca15-3抗原,200u/ml的ca15-3抗原;第3行(从左至右):600μg/ml的cyfra21-1cab,0.25μg/ml的cyfra21-1抗原,0.2μg/ml的cyfra21-1抗原,0.16μg/ml的cyfra21-1抗原;第4行(从左至右):580μg/ml的ceacab,5.4μg/ml的cea抗原,3.6μg/ml的cea抗原,2.4μg/ml的cea抗原;第5行(从左至右):100μg/ml的erbb2cab,1.35μg/ml的erbb2抗原,0.9μg/ml的erbb2抗原,0.6μg/ml的erbb2抗原;第6行(从左至右):100μg/ml的mmp-7cab,9μg/ml的mmp-7抗原,6μg/ml的mmp-7抗原,3μg/ml的mmp-7抗原;第7行(从左至右):40μg/ml的铁蛋白cab,20μg/ml的铁蛋白cab,10μg/ml的铁蛋白cab,5μg/ml的铁蛋白cab;第8行(从左至右):2.7μg/ml的铁蛋白抗原,1.8μg/ml的铁蛋白抗原,1.2μg/ml的铁蛋白抗原,0.8μg/ml的铁蛋白抗原;第9行(从左至右):400μg/ml的ca19-9cab,200μg/ml的ca19-9cab,100μg/ml的ca19-9cab,22.5ku/ml的ca19-9抗原;第10行(从左至右):15ku/ml的ca19-9抗原,10ku/ml的ca19-9抗原,570μg/ml的ca72-4cab,300μg/ml的ca72-4;第11行(从左至右):150μg/ml的ca72-4,4000u/ml的ca72-4抗原,2000u/ml的ca72-4抗原,1000u/ml的ca72-4抗原;第12行(从左至右):200μg/ml的d-二聚体cab,100μg/ml的d-二聚体抗原,20μg/ml的d-二聚体抗原,4μg/ml的d-二聚体抗原;用含有ca15-3(60u/ml)、cyfra21-1(8ng/ml)、cea(20ng/ml)、ca72-4(40u/ml)、ca19-9(148u/ml)、erbb2(60ng/ml)、铁蛋白(200ng/ml)、mmp-7(20ng/ml)的抗原混合物探测载玻片;然后用ca15-3dab(20ng/ml)、cyfra21-1dab(8μg/ml)、ceadab(2μg/ml)、ca72-4dab(5μg/ml)、ca19-9dab(150ng/ml)、erbb2dab(0.4μg/ml)、铁蛋白dab(5μg/ml)、mmp-7dab(400ng/ml)的dab混合物探测载玻片。图20是在微阵列载玻片上打印的抗原的平均cea抗原曲线的图示。图21示出用平均抗原曲线标准化的捕获抗体斑点上cea抗原响应的标准曲线。图22是比较如本文所述进行的微阵列实验和市售elisa试剂盒(fujierbioinc)的brand-altman图。图23示出用所述盒和仪器探测并成像的载玻片的结果;载玻片用omnigrid微阵列打印机打印,斑点在12×12网格中一式三份打印;第1行(从左至右):30nm的bsa-生物素,40μg/ml的ca15-3cab,30μg/ml的ca15-3cab,20μg/ml的ca15-3cab;第2行(从左至右):1600u/ml的ca15-3抗原,800u/ml的ca15-3抗原,400u/ml的ca15-3抗原,200u/ml的ca15-3抗原;第3行(从左至右):600μg/ml的cyfra21-1cab,0.25μg/ml的cyfra21-1抗原,0.2μg/ml的cyfra21-1抗原,0.16μg/ml的cyfra21-1抗原;第4行(从左至右):1000μg/ml的ceacab,5.4μg/ml的cea抗原,3.6μg/ml的cea抗原,2.4μg/ml的cea抗原;第5行(从左至右):100μg/ml的erbb2cab,1.35μg/ml的erbb2抗原,0.9μg/ml的erbb2抗原,0.6μg/ml的erbb2抗原;第6行(从左至右):100μg/ml的mmp-7cab,9μg/ml的mmp-7抗原,6μg/ml的mmp-7抗原,3μg/ml的mmp-7抗原;第7行(从左至右):40μg/ml的铁蛋白cab,20μg/ml的铁蛋白cab,10μg/ml的铁蛋白cab,5μg/ml的铁蛋白cab;第8行(从左至右):2.7μg/ml的铁蛋白抗原,1.8μg/ml的铁蛋白抗原,1.2μg/ml的铁蛋白抗原,0.8μg/ml的铁蛋白抗原;第9行(从左至右):400μg/ml的ca19-9cab,200μg/ml的ca19-9cab,100μg/ml的ca19-9cab,22.5ku/ml的ca19-9抗原;第10行(从左至右):15ku/ml的ca19-9抗原,10ku/ml的ca19-9抗原,600μg/ml的ca72-4cab,300μg/ml的ca72-4;第11行(从左至右):150μg/ml的ca72-4,4000u/ml的ca72-4抗原,2000u/ml的ca72-4抗原,1000u/ml的ca72-4抗原;第12行(从左至右):200μg/ml的d-二聚体cab,100μg/ml的d-二聚体抗原,20μg/ml的d-二聚体抗原,4μg/ml的d-二聚体抗原;用含有ca15-3(60u/ml)、cyfra21-1(8ng/ml)、cea(20ng/ml)、ca72-4(40u/ml)、ca19-9(148u/ml)、erbb2(60ng/ml)、铁蛋白(200ng/ml)、mmp-7(20ng/ml)的抗原混合物探测载玻片;然后用ca15-3dab(20ng/ml)、cyfra21-1dab(8μg/ml)、ceadab(2μg/ml)、ca72-4dab(5μg/ml)、ca19-9dab(150ng/ml)、erbb2dab(0.4μg/ml)、铁蛋白dab(5μg/ml)、mmp-7dab(400ng/ml)的dab混合物探测载玻片。图24a-b显示根据一个实施方式示出分离的干盒和湿盒以及它们如何能够与彼此和仪器歧管接合的示意图;嵌图a显示顶视图,嵌图b显示侧视图。图25a-c是干盒的不同实施方式的示意图。图26是湿盒的一个实施方式的示意图。图27是示例性湿盒和干盒的侧视图的示意图,其显示了两者对准。图28是用于仪器和盒的泵、阀门、储罐和流体路径的一个实施方式的示意图。图29是用于仪器的螺线管阀门的一个实施方式的示意图。图30是仪器、盒和计算机/软件连接的一个实施方式的示意图。图31是台式仪器的一个实施方式的图示。图32是注射泵的一个实施方式的图示。图33是歧管的一个实施方式的图示。图34a-b分别显示不同检测抗体浓度的ca15-3的标准曲线,0.2μg/ml(a)和0.4μg/ml(b)。图35a-b分别显示不同检测抗体浓度的肌红蛋白的标准曲线,1μg/ml(a)和4μg/ml(b)。图36显示来自无抗原的微阵列的捕获抗体和检测抗体之间的交叉反应性筛选结果。用来自arrayit比色扫描仪的图像检测信号,并用imagej量化;a行:400μg/ml的erbb2cab;b行:800μg/ml的ceacab;c行:160μg/ml的ca15-3cab;柱1:40ng/ml的ca15-3dab;柱2:25μg/ml的ceadab;柱3:4μg/ml的erbb2dab。图37显示乳腺癌组抗原与微阵列上的检测抗体之间的交叉反应性筛选结果。用来自arrayit比色扫描仪的图像检测信号,并用imagej量化;a行:400μg/ml的erbb2cab和erbb2抗原;b行:800μg/ml的ceacab和cea抗原;c行:160μg/ml的ca15-3cab和ca15-3抗原;柱1:40ng/ml的ca15-3dab;柱2:25μg/ml的ceadab;柱3:4μg/ml的erbb2dab。图38乳腺癌组抗原与微阵列上的捕获抗体之间的交叉反应性筛选结果。用来自arrayit比色扫描仪的图像检测信号,并用imagej量化;a行:400μg/ml的erbb2cab;b行:800μg/ml的ceacab;c行:160μg/ml的ca15-3cab;柱1:ca15-3抗原和40ng/ml的ca15-3dab;柱2:cea抗原和25μg/ml的ceadab;柱3:erbb2抗原和4μg/ml的erbb2dab。图39显示减去背景后各种sa-hrp/生物素-hrp条件的信号;1:用8μg/ml的sa-hrp和4μg/ml的生物素-hrp探测的bsa-生物素的数目;2:用16μg/ml的sa-hrp和8μg/ml的生物素-hrp探测的bsa-生物素的数目;3:用32μg/ml的sa-hrp和16μg/ml的生物素-hrp探测的bsa-生物素的数目;4:用64μg/ml的sa-hrp和32μg/ml的生物素-hrp探测的bsa-生物素的数目。图40a-c显示在三个载玻片类型上打印、探测和用tmb显影的erbb2cab;载玻片用arrayit比色扫描仪成像;bsa-生物素30nm在阵列的四个角中一式两份地打印;一式两份地打印一行erbb2cab和抗原,最大浓度的erbb2cab,1/2最大浓度的erbb2cab,1/4最大浓度的erbb2cab,4μg/ml的erbb2抗原,2μg/ml的erbb2抗原,1μg/ml的erbb2抗原;嵌图a显示氨基硅烷载玻片的结果;嵌图b显示醛载玻片的结果;嵌图c显示环氧载玻片的结果。图41a-c显示在使用具有0.01%十二烷基肌氨酸钠和0.25mg/mlbsa的打印缓冲剂时的改善的斑点形态和cv的降低;嵌图a显示对于在1xpbs中重复四次打印的样品的tmb显影和用比色扫描仪成像后的结果图像;顶行:30μg/ml的ca15-3cab,第二行:400u/ml的ca15-3抗原,第三行:200u/ml的ca15-3抗原,底行:100u/ml的ca15-3抗原;嵌图b显示对于在1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa中重复四次打印的样品的tmb显影和用比色扫描仪成像后的结果图像;顶行:20μg/ml的ca15-3cab,第二行:1600u/ml的ca15-3抗原,第三行:800u/ml的ca15-3抗原,第四行:400u/ml的ca15-3抗原,底行:200u/ml的ca15-3抗原;嵌图c是示出嵌图a和b所示的cab和抗原的平均%变异系数(cv)的图;1:用1xpbs打印的cab的%cv,2:用1xpbs打印的抗原的%cv,3:用1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa打印的cab的%cv,4:用1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa打印的抗原的%cv。图42显示在用22ng/ml的肌红蛋白探测后的肌红蛋白捕获抗体的结果。1:利用25μg/ml肌红蛋白cab和1μg/ml肌红蛋白dab的短测定时间(10分钟)的结果信号;2:利用40μg/ml肌红蛋白cab和50ng/mldab的长测定时间(27分钟)的结果信号。图43显示在使用盒运行自动心脏面板免疫测定后从仪器原型获取的图像;角斑点是bsa-生物素斑点;cabs和抗原重复五次打印;第1行:后一半,肌红蛋白cab浓度1,第2行:肌红蛋白cab浓度2,肌红蛋白cab浓度2,第3行:肌红蛋白抗原浓度1,肌红蛋白抗原浓度2,第4行:ck-mb抗原浓度1,ck-mb抗原浓度2,第5行:ck-mbcab浓度1,ck-mbcab浓度2,第6行:ck-mbcab浓度3,nt-probnpcab浓度1,第7行:nt-probnpcab浓度2,nt-probnpcab浓度3。图44a-c是湿盒的备选实施方式的图示;嵌图a是湿盒的备选实施方式的顶部的图示;嵌图b是湿盒的备选实施方式的底部的图示;嵌图c是湿盒的备选实施方式的示意图。图45a-c是如本文所述的仪器的一个实施方式的图示;嵌图a示出仪器的正视图;嵌图b示出仪器的后视图;嵌图c显示仪器主体的分解。图46a-b是歧管的示意图;嵌图a示出歧管的后视图;嵌图b示出歧管的侧视图。图47是歧管层压体的一个实施方式的示意图。具体实施方式本公开内容部分地提供了用于并行检测多种靶多肽或其他靶分子的微流体装置。所述微流体装置可以是集成蛋白质微阵列的微流体设备,用于例如检测疾病相关的蛋白质生物标志物的阵列。通常,本文所述的微阵列免疫测定使用与常规夹心elisa相同的基本方案,不同之处在于测定是多路复用的,并且测定的尺寸显著减少,这减少了试剂和样品的消耗。靶分子靶分子包括但不限于与人类疾病相关或相联系的生物标志物、小分子、药物代谢物、滥用物质、水或土壤样品中的污染物、食物污染物和环境中的过敏原。在一些实施方式中,靶分子是可公开获得的特异性检测和/或识别分子(如抗体)所针对的那那些。生物标志物生物标志物通常是指生物状态或条件的可测量指标。因此,如本文所用的生物标志物可以指在与之相关的生物样品中发现的或从其获得的任何可检测分子,并因此可用于确定致病条件、疾病或病症的存在;对致病条件、疾病或病症的易感性;对治疗干预的响应;等等。生物标志物的实例包括但不限于用于诸如癌症、心血管疾病、糖尿病、炎性疾病或神经病症等疾病或病症的生物标志物。术语“癌症”包括癌,其是主要的癌症并且是上皮细胞或覆盖器官、腺体或其他身体结构(例如皮肤、子宫、肺、乳腺、前列腺、胃、肠)的外部或内部表面的细胞的癌症,并且其倾向于转移;肉瘤,其来源于结缔组织或支持组织(例如骨骼、软骨、肌腱、韧带、脂肪、肌肉);和血液肿瘤,其来源于骨髓和淋巴组织。癌可以是腺癌(其通常发生在能够分泌的器官或腺体,例如乳腺癌、肺癌、结肠癌、前列腺癌或膀胱癌)或可以是鳞状细胞癌(其起源于鳞状上皮,通常在身体的大部分区域发育)。肉瘤可以是骨肉瘤或成骨肉瘤(骨),软骨肉瘤(软骨),平滑肌肉瘤(平滑肌),横纹肌肉瘤(骨骼肌),间皮肉瘤或间皮瘤(体腔膜质内膜),纤维肉瘤(纤维组织),血管肉瘤或血管内皮瘤(血管),脂肪肉瘤(脂肪组织),胶质瘤或星形细胞瘤(脑内发现的神经源性结缔组织),粘液肉瘤(原始胚胎结缔组织),或者间叶瘤(mesenchymous)或混合中胚层肿瘤(混合结缔组织类型)。血液肿瘤可能是骨髓瘤,其起源于骨髓浆细胞;白血病,其可以是“液体癌症”,是骨髓癌,并且可能是骨髓性或粒细胞白血病(骨髓和粒细胞白细胞),淋巴、淋巴细胞或成淋巴细胞白血病(淋巴和淋巴细胞血细胞)或真性红细胞增多症或红细胞增多症(各种血细胞产物,但以红细胞为主);或淋巴瘤,其可以是实体瘤并且在淋巴系统的腺体或淋巴结中发展,并且可以是霍奇金淋巴瘤或非霍奇金淋巴瘤。此外,还存在混合型癌症,例如腺鳞癌、混合中胚层肿瘤、癌肉瘤或畸胎癌。癌症也可以基于它们起源的器官(即“原发部位”)命名,例如乳腺癌、脑癌、肺癌、肝癌、皮肤癌、前列腺癌、睾丸癌、膀胱癌、结肠癌和直肠癌、宫颈癌、子宫癌等。即使癌症转移到与原发部位不同的身体的另一部分,这种命名仍然存在。基于原发部位命名的癌症可与组织学分类相关联。例如,肺癌通常是小细胞肺癌或非小细胞肺癌,其可以是鳞状细胞癌、腺癌或大细胞癌;皮肤癌通常是基底细胞癌、鳞状细胞癌或黑素瘤。淋巴瘤可能出现在与头部、颈部和胸部相关的淋巴结中,也可能出现在腹部淋巴结或腋窝或腹股沟淋巴结中。用于乳腺癌的生物标志物包括但不限于癌抗原15-3(ca15-3)、癌胚抗原(cea)、细胞角蛋白片段21-1(cyfra21-1)和可溶性人表皮生长因子受体2(her2/erbb2)。ca15-3是乳腺癌的常用肿瘤标志物(生物标志物)。其来源于muc1基因;因此,ca15-3也称为粘蛋白1(muc1)(grzywa等,2014)。其长度为1255个氨基酸,分子量为122kda(begum等,2012)。其是粘蛋白家族的成员,是一个大的跨膜糖基化分子,由三个主要结构域组成:大的胞外区域,跨膜序列和胞质结构域(ricci等,2009;lucarelli等,2014;grzywa等,2014)。已经发现健康个体中ca15-3的正常范围是0-28u/ml(begum等,2012)。当存在癌时,ca15-3的顶端取向及其糖基化被改变(grzywa等,2014)并且蛋白质过表达并分布在整个细胞表面,产生保护癌细胞免受宿主免疫系统和促进转移活性的环境(danysh等,2012)。在一些实施方式中,ca15-3可用于早期检测乳腺癌复发和/或用于评估乳腺癌治疗的效率,例如通过比较治疗前后血液中ca15-3的水平。癌胚抗原(cea)是一种180-kda的糖蛋白,它是由gold和freedman于1965年首次从结肠癌中发现和提取的(gold和freedman,1965)。其正常功能是细胞粘附和抑制细胞凋亡。结果,它在正常粘膜细胞中表达并在腺癌中过表达(beauchemin和arabzadeh,2013)。它存在于肿瘤细胞膜的外围,在那里其被释放到体液中。它经常在乳腺癌、结肠直肠癌和其他上皮癌患者中过表达并释放到循环血流中(goldenberg等,1981)。cea的水平通常较低,例如在健康成人中为0至2.5μg/l(微克/升),并且在吸烟者中往往略高,在0至5μg/l之间(alexander等,1976)。在癌症患者(例如乳腺癌患者)中,cea的水平可以高于10μg/l(romero等,1996)。在一些实施方式中,cea可用作诊断、预后或监测对癌症(例如乳腺癌和结肠直肠癌)的治疗响应的标志物。细胞角蛋白片段21-1(cyfra21-1)是细胞角蛋白19的可溶性片段,细胞角蛋白的酸性1型亚基,分子量为40kda(jose等,2013),并且在细胞凋亡过程中释放到血流中(oloomi等,2013)。健康个体没有表现出升高的血清cyfra21-1水平。在一些实施方式中,cyfra21-1的大于2.0ng/ml的截断值可用于检测测定(nakata等,2000)。已经制备了具有cyfra21-1的杆结构域的螺旋2b内的表位的单克隆抗体(jose等,2013)。在一些实施方式中,cyfra21-1可用于检测癌症复发和/或癌症治疗(例如乳腺癌治疗)的功效。人表皮生长因子受体2(her2)是受体酪氨酸激酶(rtk)家族中的受体之一。her2是一种185kda的跨膜蛋白,由3个结构域组成:细胞外结构域(ecd),跨膜结构域和细胞内激酶结构域(shao等,2014)。细胞外结构域(ecd)可以通过基质金属蛋白酶从乳腺癌细胞表面切割,在切割后将her2-ecd释放到血清中(arribase等,(2010)。在一些实施方式中,her2的大于15ng/ml的水平可用于检测测定(hyashi等,2012;fornier等,2005)。在一些实施方式中,her2可用作用于诊断、预后或监测对癌症(例如乳腺癌)治疗的响应的标志物。生物标志物能够诊断、复发或监测其他癌症类型。ca19-9是最初从结肠直肠癌细胞系的培养基中分离的唾液酸化的lewis血型抗原。它是最常用的肿瘤标志物,用于cea后消化道癌的诊断。80%的晚期胰腺癌患者中的ca19-9水平升高(高于37u/ml)(su等,2015)。美国临床肿瘤学会建议在整个胰腺癌治疗过程中使用ca19-9监测以确定疾病进展(locker等,2006)。ca-125,也称为muc-16,是糖蛋白的粘蛋白家族的另一种癌抗原。它由三个不同的结构域组成:n-末端,串联重复和c-末端,细胞外区域通过蛋白水解切割从细胞中释放。ca-125是卵巢癌最有用的临床生物标志物。ca-125水平的升高(高于35u/ml)与卵巢癌的进展相关,并且fda批准其用于监测卵巢癌和检测疾病复发(leung等,2014)。ca72-4,也称为肿瘤相关糖蛋白或tag-72,是用于胃肠癌的生物标志物。与其他癌症抗原类似,它是一种超过1000kda的粘蛋白样分子。这种生物标志物对胃癌是最有用的。高水平的ca72-4(高于5u/ml)表明晚期胃癌或肿瘤复发的预后(mattar等,2002;yang等,2014)。铁蛋白是一种主要的胞质蛋白,其在细胞内铁的储存中起作用。当过表达时,其可以分泌到血清中,并且可以在多种癌症中以升高的水平发现。铁蛋白水平升高可能是霍奇金淋巴瘤、肝细胞癌、非小细胞肺癌或胰腺癌患者预后较差的指标(hann等,1990;melia等,1982;maxim等,1986;kalousova等,2012)。然而,铁蛋白的截断值随癌症类型而变化(范围92-400ng/ml)。铁蛋白水平升高也可能是乳腺癌复发的指征,而具有较高铁蛋白水平的胰腺癌患者存活率降低(robertson等,1991;kalousova等,2012)。mmp-7(基质金属蛋白酶-7)是锌依赖性内肽酶,其切割细胞外基质的蛋白质。其可以通过基底膜蛋白的蛋白水解切割促进癌症侵袭。发现mmp-7在许多癌症中过表达,包括卵巢癌、肾癌和急性髓性白血病(yokohoma等,2008)。血清中升高的mmp-7水平可用于癌症预后。卵巢癌患者显示血清mmp-7水平高于7.4ng/ml(shafdan等,2015)。此外,在胃癌患者中,mmp-7水平升高与预后较差和生存率降低有关(yeh等,2010)。心血管疾病是循环系统(包括心脏和血管)的疾病。心血管疾病包括但不限于冠状动脉疾病(例如心绞痛或心肌梗塞)、充血性心力衰竭、中风、高血压性心脏病、风湿性心脏病、心肌病、心律失常、心动过速、狭窄、先天性心脏病、心脏瓣膜病、心脏炎、主动脉瘤、外周动脉疾病、静脉血栓形成、动脉粥样硬化等。心血管疾病的生物标志物包括但不限于b型利尿钠肽、心肌肌钙蛋白、肌红蛋白和d-二聚体。b型利尿钠肽或bnp是心脏标志物,其作为激素起作用以诱导尿钠排泄、利尿和血管舒张。它最初表达为probnp激素原,然后被切割并分泌为bnp和nt-probnp(n-末端probnp)。nt-probnp具有比bnp更长的半衰期(2小时vs.20分钟)。大多数健康人的bnp约为10pg/ml。平均心力衰竭患者的bnp水平为675pg/ml,nt-probnp水平为4639pg/ml。bnp和nt-probnp在老年患者、女性和患有肾衰竭的患者中均升高。相反,肥胖人群的bnp和nt-probnp水平降低。bnp或nt-probnp水平的增加与疾病严重程度和死亡率的增加相关。在一些实施方式中,bnp或nt-probnp水平可用于预测心脏病风险的增加或减少(例如患有慢性心力衰竭的患者),或用于建立和/或监测预后、疾病严重性或指导治疗。在一些实施方式中,bnp的约80pg/ml的水平可用于检测实验。心肌肌钙蛋白是由肌钙蛋白t、肌钙蛋白i和肌钙蛋白c组成的心脏特异性复合物。尽管肌钙蛋白i更普遍,但肌钙蛋白t(37kda)和肌钙蛋白i(22kda)已被常规用作心脏标志物。肌钙蛋白i是100%心脏特异性的,与肌钙蛋白t不同,肌钙蛋白i不会因肾脏疾病或骨骼损伤而升高。肌钙蛋白水平的增加(高于160pg/ml)表明病况恶化(xue等,tonkin等)。在一些实施方式中,肌钙蛋白水平可用于预测、检测和/或确定心血管事件(例如心肌梗塞(mi)或心肌损伤)的风险、治疗的优化、预后、疾病严重性、临床结果和/或死亡率。肌钙蛋白水平的降低与更好的预后相关。肌红蛋白(17kda)是与血红蛋白相似的血红素结合蛋白,除了它存在于肌肉组织中。由于它在所有肌肉组织中,因此不是心肌特异性的。已显示在急性心肌梗塞后1-4小时,心脏组织迅速分泌。在一些实施方式中,高于88ng/ml的肌红蛋白水平可用于预测和/或检测死亡率、心肌坏死或心肌梗塞。d-二聚体是纤维蛋白降解的独特心脏标志物。它通过3种酶的连续作用形成:凝血酶,因子xiiia和纤溶酶。市售d-二聚体测定检测存在于纤维蛋白的因子xiiia-交联的片段d结构域但不存在于纤维蛋白原降解产物或非交联的纤维蛋白中的表位(adam等,2009)。在一些实施方式中,d-二聚体测量可临床应用以排除静脉血栓栓塞(vte,其包括深静脉血栓形成(dvt)和肺栓塞(pe))或用于诊断或监测弥散性血管内凝血(dic)中的凝血激活。在一些实施方式中,d-二聚体水平可用于检测启动血管内纤维蛋白形成但不是必需的血栓形成的疾病过程,例如但不限于血液凝固的激活、衰老、妊娠、癌症或癌症相关的vte(ay等,2009)。在一些实施方式中,约500ng/ml的水平可用于检测测定。其他生物标志物可包括但不限于:钙调理蛋白-h2、岩藻糖基转移酶iv(fut4)、agr3(前梯度-3)、agr2(前梯度-2)、dj-1、胸苷激酶1(tk1)、α-甲胎蛋白、psa(前列腺特异性抗原)、绒毛膜促性腺激素(hcg)、pro-grp(胃泌素释放肽前体)、nse(神经元特异性烯醇化酶)、scc-ag(鳞状细胞癌抗原)/ta-4、ca-242、ca-50、pepi/ii(胃蛋白酶原i/ii比率)、afu(α-l-岩藻糖苷酶)、alp(碱性磷酸酶)、he-4(人附睾蛋白4/wfdc2)、β2m(β-2-微球蛋白)、vma(香草扁桃酸,3-甲氧基-4-羟基扁桃酸)、tpa(组织多肽抗原)、半乳糖凝集素-3、髓过氧化物酶和hs-crp。生物标志物还可用于诊断和监测各种其他医学病况。炎症是先天免疫反应的标志,涉及病原性感染和组织损伤。此外,人们可能患有慢性炎症性疾病,例如类风湿性关节炎、哮喘和肠易激综合症。炎症生物标志物评估炎性状态下的疾病活动并诊断和控制感染。标志性炎症生物标志物是c-反应蛋白或crp。crp是蛋白质的正五聚蛋白家族(110-144kda),其在被细胞因子激活时由肝细胞分泌(algarra等,2013)。然后crp循环到感染或组织损伤部位,以帮助将补体蛋白质补充到炎症部位。在健康个体中,crp的中位数浓度为0.8μg/ml。在炎症刺激后,其增加至超过500μg/ml。血清浓度在前6小时升至超过5μg/ml,在48小时达到峰值(pepys和hirschfield,2003)。由于炎症可能是心血管损伤的指征,crp也被用作心脏病风险的生物标志物。另外的炎症生物标志物包括上述铁蛋白和mmp-7。血清铁蛋白被认为是急性和慢性炎症的急性期反应物和标志物。发现它在广泛的炎症条件下升高。据认为铁蛋白的增加反映了铁储存的增加,而铁储存则远离病原体的使用(wang等,2010)。mmp-7除了用作癌症的标志物之外,还是炎症的生物标志物。mmp-7因炎性细胞因子以及病原性细菌的存在而上调(burke,2004)。对于铁蛋白和mmp-7潜在抗体,参见段落[0073]和[0074]。已经进行了许多工作来开发神经病症如神经退行性疾病和脑损伤的生物标志物。诸如阿尔茨海默氏病、帕金森病和朊病毒病等神经退行性疾病的特征在于蛋白质聚集体或斑块的形成。识别血浆或脑脊液(csf)中的特定生物标志物将为医生提供相对非侵入性的诊断这些疾病的方法。阿尔茨海默病是一种进行性神经退行性疾病,其损害认知功能,影响80%的80岁以上人群(nayak等,2015)。其特征在于由淀粉状蛋白β肽42和tau蛋白质组成的淀粉样斑块的形成。有趣的是,已发现阿尔茨海默病患者的csf中淀粉样蛋白β-42水平较低,这可能是由于其在大脑中的积累。相反,csf中的tau升高(nayak等,2015)。利用在阿尔茨海默氏症的患者血浆中发现的生物标志物将是一种侵入性甚至更少的诊断技术。阿尔茨海默氏症患者血液中的蛋白质补体因子h(cfh)增加。cfh是补体途径的负调节因子,血液中的水平升高与疾病的后期相关。cfh也是一种特别有用的生物标志物,因为它在其他神经退行性疾病中没有出现,因此是阿尔茨海默氏症特异性的(nayak等,2015)。帕金森氏病是阿尔茨海默病后最常见的神经退行性疾病。其特征在于由脑干和大脑中的进行性神经变性引起的严重运动损伤。许多神经元显示出包含最显著由α-突触核蛋白组成的包涵体。此外,在帕金森患者的csf中发现了许多蛋白质,这些生物标志物的临床有用性仍有待确定。然而,在帕金森病患者的血清中发现了补体相关蛋白的增加。具体而言,上述cfh以及c3c、c3dg和因子b的增加(nayak等,2015)。朊病毒病,也称为传染性海绵状脑病,是一组独特的可以影响人类和动物的疾病。在人类中,传播通常是遗传的,导致33-35kda朊病毒蛋白的异常积累。在其疾病状态中,朊病毒蛋白呈现β-折叠构象而不是其典型的α-螺旋构象,导致蛋白质积聚和聚集(nayak等,2015)。目前的诊断方法无法识别朊病毒疾病,因此为这种疾病设置生物标志物将是非常有益的。csf中的一些生物标志物已在朊病毒病患者中被鉴定出来。具体而言,14-3-3、β-淀粉样蛋白、tau、s100b和神经元特异性烯醇化酶(nse)(rubenstein,2015)。一个缺点是这些标志物不是朊病毒疾病特异性的并且也可以存在于其他神经退行性疾病中。因此,需要进行大量研究以鉴定在csf或血浆中易于获得的朊病毒疾病特异性生物标志物。应理解可以使用生物标志物的任意组合。在一些实施方式中,例如,cyfra21-1可与其他乳腺或其他癌症生物标志物(例如ca15-3)一起用于确定癌症的复发和/或癌症治疗的功效,例如乳腺癌治疗;肌钙蛋白可与肌红蛋白或肌酸激酶mb(ck-mb)一起用于心肌梗塞(mi)的早期检测;肌钙蛋白可与crp或nt-probnp一起用于患有与急性冠状动脉综合征(acs)一致的临床综合征的患者的风险评估;等等。流体样品“流体样品”可以是含有或疑似含有靶分子的任何流体,例如生物样品、环境样品、法医样品等。“生物样品”可以是直接或间接从受试者分离或获得的任何器官、组织、细胞或细胞提取物。例如,生物样品可以包括但不限于获自患者受试者(人或动物)、实验受试者或实验动物受试者的来自骨、脑、乳腺、结肠、肌肉、神经、卵巢、前列腺、视网膜、皮肤、骨骼肌、肠、睾丸、心脏、肝脏、肺、肾、胃、胰腺、子宫、肾上腺、扁桃体、脾脏的细胞或组织(例如来自活组织检查或尸检),软组织,外周血,全血,红细胞浓缩物,血小板浓缩物,白血球浓缩物,血细胞蛋白,血浆,富含血小板的血浆,血浆浓缩物,来自任何血浆分馏的沉淀物,来自任何血浆分馏的上清液,血浆蛋白馏分,纯化或部分纯化的血液蛋白或其他成分,血清,精液,哺乳动物初乳,乳汁,尿液,粪便,唾液,胎盘提取物,羊水,冷沉淀物,冷冻上清液,细胞裂解液,哺乳动物细胞培养物或培养基,发酵产物,腹水,血细胞中存在的蛋白质,实体瘤或任何其他标本,或其任意提取物。在一些实施方式中,可能需要将癌细胞与样品中的非癌细胞分开。样品还可以包括但不限于通过正常细胞或转化细胞在细胞培养物中产生的产物(例如,通过重组dna或单克隆抗体技术)。样品还可以包括但不限于从非哺乳动物受试者(例如昆虫或蠕虫)分离的任何器官、组织、细胞或细胞提取物。样品还可以包括但不限于植物、细菌、霉菌、孢子或病毒。“样品”也可以是在实验条件下产生的细胞或细胞系,其不直接与受试者分离。样品也可以是无细胞的、人工衍生的或合成的。样品可以来自已知癌性、疑似癌性或被认为不是癌性的细胞或组织(例如,正常或对照)。在一些实施方式中,如本文所用的样品基本上是纯化的,例如不含细胞和/或细胞提取物。因此,在一些实施方式中,样品可包括基本上不含细胞的体液或提取物,例如血浆、血清或尿液。应当明白这种样品可含有少量细胞,例如5%以下,即0%至5%之间的任意值,例如小于1%、2%、3%、4%或5%。作为另一选择,样品可含有细胞,例如全血。“对照”包括获得用于确定基线表达或活性的样品。因此,对照样品可以通过许多方法获得,包括来自非癌细胞或组织,例如来自受试者的肿瘤周围的细胞或癌细胞;来自未患癌症的受试者;来自未疑似患有癌症风险的受试者;或来自此类受试者的细胞或细胞系。对照还包括先前建立的标准。因此,可以将根据本发明进行的任何测试或测定与建立的标准进行比较,并且可能不必每次都获得用于比较的对照样品。可以分析样品以检测关注的靶分子的存在或量。蛋白质微阵列可以使用特异性结合靶分子的合适的结合伴侣或其片段来检测靶分子。例如,在一些实施方式中,生物标志物可以使用特异性结合生物标志物的合适抗体或其片段来检测。在备选实施方式中,例如,可以使用蛋白质或肽来检测自身抗体。如本文所述或本领域已知的,可以使用任何合适的检测方法。抗体在识别生物标志物时“特异性结合”生物标志物,但基本上不识别并结合样品中的其他分子。这种抗体具有例如对生物标志物的亲和力,其比样品中抗体对另一参照分子的亲和力大至少10、100、1000或10000倍。在一些实施方式中,可特异性结合生物标志物的抗体或其片段以微阵列存在(“抗体微阵列”)。“抗体微阵列”是指在合适的基底上提供的能够结合多个生物标志物的多个抗体或其片段,所述基底例如为化学官能化或涂布聚合物的玻璃或类似材料。可以使用标准技术将抗体附着或沉积在基底上,例如使用微阵列点样机器人。通常,抗体可以设置在基底的区域中,使得它们可以检测生物标志物。该区域可以是任何合适的尺寸,这取决于所用抗体的数量和打印的密度以及化学官能化或聚合物涂布的区域的大小。通常,抗体微阵列会包含能够特异性结合多个生物标志物的多个抗体。例如,在一些实施方式中,在抗体微阵列中,每个不同的抗体可以特异性结合不同的生物标志物。在备选实施方式中,抗体微阵列可包含能够特异性结合具体生物标志物的多个抗体。因此,每个抗体可以与微阵列中存在的其他抗体不同,这样它们可以特异性地结合不同的生物标志物,或者特异性地结合相同生物标志物的不同区域。抗体微阵列可以包含适当数量的抗体,例如约2个至约10,000个抗体,或者约100、200、300、500、1000、1500、2000、3000、4000、5000、6000、7000、8000、9000或10000个抗体中的任意值。在一些实施方式中,受制于例如微阵列基底的尺寸、设备可检测区域的大小、光学检测系统提供的图像分辨率以及抗体的斑点尺寸,可以使用更大的数量,例如15000、20000或30000以上。应当明白可以在基底上点样的抗体数量取决于基底的尺寸、斑点的密度、交叉反应性相互作用、斑点尺寸等。例如,随着能够检测生物标志物的区域的大小增加,或斑点密度的增加,或斑点尺寸的减小,可以点样更多数量的抗体。抗体可以在基底上设置为直径可以为约50微米至约500微米的斑点,或者例如60微米、100微米、200微米或250微米中的任意值。在一些实施方式中,受制于例如微阵列基底的尺寸、可由生物标志物检测的区域的大小和抗体的密度,斑点可以更大。斑点可具有任意形状,无论是规则的还是不规则的。抗体斑点通常在空间上彼此离散。通常,斑点彼此分开至少100微米,例如彼此分开至少100、200或400微米。斑点可以以任何合适的方式排列,无论是有序的还是随机的。通常,斑点以有序的方式排列,使得斑点的分离是规则的和预定的。斑点可以排列成一维、二维或三维。例如,斑点可以按行和列排列,数量为约10至约1,000。微流体盒可提供包含微流体环路、反应室或“阵列室”、含有诸如试剂、缓冲剂或样品的储罐的盒(“微流体盒”)。在一些实施方式中,微流体盒可包括但不限于多个试剂储罐和通道,多个缓冲剂储罐和通道,多个废物储罐和通道,多个通气口,多个端口,用于检测蛋白质微阵列的孔,以及连接储罐的通道,例如从主结点引出的通道或通向缓冲剂通道的通道、将缓冲剂通道与试剂通道连接的通道、将阵列室与废物储罐连接的通道、将阵列室与主结点或通道连接的通道、将主结点或通道连接至废物储罐的通道,和/或用于接收流体样品的托座或孔。在一些实施方式中,样品托座或孔可不存在,并且样品可装载到所述储罐中的一个内。在一些实施方式中,一些通道可设置在主结点的周围。在一些实施方式中,一些通道可与主通道连接。通道可以配置成通过例如减少或防止气泡而允许流体平稳流动,并且通过例如减少或防止试剂和/或缓冲溢出而使交叉污染最小化。在一些实施方式中,微流体盒可包含多个液体不可透的透气的阻隔物,例如液体不可透的透气的膜。在一些实施方式中,液体不可透的透气的阻隔物可以是水性液体不可透的。在一些实施方式中,液体不可透的透气的阻隔物可以是高表面张力液体不可透的。微流体盒可以包含用于接收蛋白质微阵列的托座。在一些实施方式中,微流体盒可包含蛋白质微阵列。微流体盒可以与蛋白质微阵列流体连通。在一些实施方式中,微流体盒可包含:包含含有诸如试剂或缓冲剂等流体的储罐的“湿”部(“湿盒”);和包含微流体环路和反应室的“干”部(“干盒”)。湿盒可配置成与干盒对准。样品托座可位于湿盒中或干盒中。微流体盒可与仪器气动连接以便例如控制流体的运动。所述仪器能够检测蛋白质微阵列。通气口可与仪器的歧管相接。湿盒湿盒可包含多个试剂储罐和通道、多个缓冲剂储罐和通道、多个废物储罐、多个通气口、多个端口、以及可选的用于接收流体样品的样品托座或孔。在一些实施方式中,缓冲剂储罐的数目可与试剂储罐的数目相同。在一些实施方式中,湿盒可包含两个废物储罐,称为第一废物储罐和第二废物储罐。在一些实施方式中,通气口的数目对应于缓冲剂储罐、试剂储罐和废物储罐中的每一个。在一些实施方式中,端口的数目可对应于缓冲剂储罐、试剂储罐、废物储罐和如果存在时的样品托座或孔中的每一个。在一些实施方式中,湿盒可包含多个试剂储罐,其中缓冲剂储罐的数目与试剂储罐的数目相同;多个废物储罐;多个通气口,其对应于缓冲剂储罐、试剂储罐和废物储罐中的每一个;可选的用于接收流体样品的样品托座或孔;和对应于缓冲剂储罐、试剂储罐、废物储罐和如果存在时的样品托座或孔中的每一个的多个端口。在一些实施方式中,湿盒可包含:多个试剂储罐(本文中称为“r#”);与试剂储罐相同数目的缓冲剂储罐(本文中称为“b#”);多个废物储罐(本文中称为“w#”),使得缓冲剂储罐、试剂储罐和废物储罐配置为允许指定的体积;多个通气口,其对应于缓冲剂储罐、试剂储罐和废物储罐中的每一个;用于接收流体样品的样品托座或孔;对应于缓冲剂储罐、试剂储罐、废物储罐和样品托座或孔中的每一个的多个端口;和可选的,层压底部,其含有在每个储罐下面的预切洞以用于装载所述储罐。在一些实施方式中,湿盒组件可具有以下尺寸。缓冲剂储罐b1和/或试剂储罐r2可以是大致椭圆形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。b1和/或r2可以长约3mm至约40mm,例如约9mm;宽约2mm至约50mm,例如约3mm,深2mm至约7mm,例如约7mm,并且体积为约10μl至约2000μl,例如约160μl。在一些实施方式中,b1可以是大致椭圆形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。b1可以长约2mm至约40mm,例如约9mm;宽约2mm至约50mm,例如约7mm,深2mm至约7mm,例如约7mm,并且体积为约10μl至约2000μl,例如约200μl。在一些实施方式中,r2可以是大致椭圆形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。r2可以长约2mm至约40mm,例如约9mm;宽约2mm至约50mm,例如约4mm,深2mm至约7mm,例如约7mm,并且体积为约10μl至约2000μl,例如约160μl。试剂储罐r3可以是大致椭圆形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。r3可以长约3mm至约40mm或其间的任意值,例如约9mm;宽约2mm至约50mm或其间的任意值,例如约4mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约200μl。缓冲剂储罐b4可以通常是弯曲形状的,角度为约90度至约179度,例如150度,以便例如允许指定的体积和正确的端口对准,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。b4可以长约3mm至约40mm或其间的任意值,例如约13mm;宽约2mm至约50mm或其间的任意值,例如约8mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约420μl。缓冲剂储罐b5可以大致椭圆形的,在一侧具有附加区域以容纳额外的体积,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。在一些实施方式中,b5可以在该侧包含额外的三角形区域,以容纳额外的体积。b4可以长约3mm至约40mm或其间的任意值,例如约13mm;宽约2mm至约50mm或其间的任意值,例如约7mm或约8mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约420μl。试剂储罐r6可以是大致椭圆形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。r6可以长约3mm至约40mm或其间的任意值,例如约11mm;宽约2mm至约50mm或其间的任意值,例如约3mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约226μl。试剂储罐r7可以大致椭圆形的,在一侧具有附加区域以容纳额外的体积,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。r7可以包含在基座上的轻微凸起,以容纳额外的体积。r7可以长约3mm至约40mm或其间的任意值,例如约11mm;宽约2mm至约50mm或其间的任意值,例如约4mm或约5mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约260μl。缓冲剂储罐b8可以是大致弯曲形状的,角度为约90度至约179度,例如150度,以允许与干盒接合,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。在一些实施方式中,b8的形状可构造成在湿盒末端的凹口或梢周围造型,以便与干盒接合。b8可以长约3mm至约40mm或其间的任意值,例如约15mm或约16mm;宽约2mm至约50mm或其间的任意值,例如约6mm或约10mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约420μl。废物储罐w1可以是大致u形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形,并具有允许进入的流体汇集的附加区域。在一些实施方式中,w1可具有方形凸起,其在靠近右边缘的储罐底部附近。w1的体积可以为约100μl至约20000μl或其间的任意值,例如约3130μl或约4000μl。在w1中,进入入口的流体可沿着盒的右边缘行进经过储罐,沿着盒的底边行进,然后沿盒的左边缘向上行进,直至其到达通气口54。这可以防止进入的流体射到储罐的末端并堵塞通气口。在一些实施方式中,w1可以在入口附近膨胀以形成初始的大储罐区域,以便例如允许流体容易地汇集到储罐中。废物储罐w2可以是大致u形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形,并且体积为约100μl至约20000μl或其间的任意值,例如约2100μl或约2500μl。不受任何具体理论的束缚,w2的形状可允许进入w2储罐的流体尽可能远离通气口,从而防止通气口的无意堵塞。在一些实施方式中,w2可以在入口附近膨胀以形成初始的大储罐区域,以例如降低流体阻力。在一些实施方式中,例如包括初始大储罐区域的那些,w1和/或w2中的任一个或两者可以变窄以连接到w1或w2对应的端口。可以在w1和w2中添加压痕以减少或防止流体立即到达w1或w2的窄区域,这可能导致阻力和流动停止。如果存在时的样品托座或孔可以长约1mm至约20mmlong或其间的任意值,例如约1.25mm、1.5mm或3mm;宽约1mm至约10mm或其间的任意值,例如约1.25mm、2mm或5mm;深2mm至约7mm或其间的任意值,例如约7mm,并且样品的容量为约4μl至约500μl,例如约25μl。湿盒的底部可以由任何合适的材料制成。在一些实施方式中,湿盒可具有层压底部。层压底部可包含与储罐对准并在储罐下方的预切洞,以例如有助于储罐装载。在一些实施方式中,湿盒可包括在湿盒侧面的试剂或缓冲剂储罐装载口。在装载后,侧端口或预切洞可以用例如透明胶带或任何其他合适的密封剂密封。在一些实施方式中,湿盒可以包含在盒前面的手柄。在备选实施方式中,湿盒可包含在湿盒侧面的把手。在一些实施方式中,湿盒可包括对准特征(alignmentfeatures),例如半圆形切口,以帮助将湿盒与干盒对准。湿盒可由具有低蛋白质粘合性质的任何合适材料制成,例如但不限于聚甲基丙烯酸甲酯(pmma)、聚苯乙烯(ps)、聚对苯二甲酸乙二醇酯(pet)和聚氯乙烯(pvc)。在一些实施方式中,湿盒可由聚碳酸酯制成。在一些实施方式中,湿盒可以是可重复使用的。在备选实施方式中,湿盒可以是一次性的。干盒干盒可包含用于检测蛋白质微阵列的孔隙;多个微流体通道,其包含多个试剂通道、多个缓冲剂通道以及连接通道,例如从主结点或主通道通向缓冲剂通道的通道、将缓冲剂通道与试剂通道连接的通道、通向废物储罐或主结点或主通道的通道等;多个通气口;可选的,对应于通气口的多个液体不可透的透气的阻隔物;和可选的用于接收流体样品的样品托座。在一些实施方式中,通道可设置在主结点或主通道周围。在一些实施方式中,干盒可包含用于检测蛋白质微阵列的孔隙和设置在主结点或主通道周围的多个微流体通道,其中在与湿盒对准时所述孔隙限定阵列室,并且在干盒和湿盒之间接收蛋白质微阵列的托座限定阵列室的底部,所述微流体通道包含多个试剂通道,其中每个试剂通道对应于湿盒中的一个试剂储罐;多个缓冲剂通道,其中每个缓冲剂通道对应于湿盒的一个缓冲剂储罐;从主结点通向每个缓冲剂通道的通道;将每个缓冲剂通道与每个试剂通道连接的通道,以形成缓冲剂通道/试剂通道对;将阵列室与第一废物储罐连接的通道;将阵列室与主结点连接的通道;将主结点与第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;对应于所述湿盒的缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和对应于每个通气口的多个液体不可透的透气的阻隔物。在一些实施方式中,干盒可包含用于接收蛋白质微阵列的托座。在一些实施方式中,干盒可包含蛋白质微阵列。在一些实施方式中,孔隙可限定阵列室,并且蛋白质微阵列限定阵列室的底部。在一些实施方式中,在与湿盒对准时,孔隙可限定阵列室,并且在干盒和湿盒之间接收蛋白质微阵列的托座限定阵列室的底部。在一些实施方式中,液体不可透的透气的阻隔物可叠加在通气口上。在一些实施方式中,所述通道可配置为允许流体平稳流动且交叉污染最小化。在一些实施方式中,干盒可包括:设置在主结点周围的多个微流体通道,其包含:-多个试剂通道(本文中称为“r#c”),使得每个试剂通道对应于湿盒的一个试剂储罐;-多个缓冲剂通道(本文中称为“b#c”),使得每个缓冲剂通道对应于湿盒的一个缓冲剂储罐;ii)-从主结点通向每个缓冲剂通道的通道(本文中称为“c#/#”);-将每个缓冲剂通道与每个试剂通道连接的通道,以形成缓冲剂通道/试剂通道对;-将主结点与第二废物储罐(w2)连接的通道;-将阵列室与主结点连接的通道(本文中称为“prec”);和-将阵列室与第一废物储罐(w1)连接的通道(本文中称为“postc”);使得所述通道配置为允许流体平稳流动且交叉污染最小化。在一些实施方式中,干盒可包含:设置在主结点周围的多个微流体通道,其包含:-多个试剂通道(本文中称为“r#c”),使得每个试剂通道对应于湿盒的一个试剂储罐;-多个缓冲剂通道(本文中称为“b#c”),使得每个缓冲剂通道对应于湿盒的一个缓冲剂储罐;-在缓冲剂通道上方的聚四氟乙烯(ptfe)膜,其暴露于大气;-将每个缓冲剂通道与每个试剂通道连接的通道,以形成缓冲剂通道/试剂通道对;-将主结点与废物储罐连接的通道(本文中称为“cw2”);-将所有缓冲剂和储罐通道与主通道(本文中称为“mainc”)连接的通道;-将阵列室与主通道连接的通道(本文中称为“prec”);和-将阵列室与废物储罐连接的通道(本文中称为“postc”);使得所述通道配置为允许流体平稳流动且交叉污染最小化。在一些实施方式中,干盒可包含:设置在主结点周围的多个微流体通道,其包含:-多个试剂通道(本文中称为“r#c”),使得每个试剂通道对应于湿盒的一个试剂储罐;-多个缓冲剂通道(本文中称为“b#c”),使得每个缓冲剂通道对应于湿盒的一个缓冲剂储罐;-在缓冲剂通道和试剂通道口下面的聚丙烯膜(本文中称为“密封膜”);-将每个缓冲剂通道与每个试剂通道连接的通道,以形成缓冲剂通道/试剂通道对;-将所有缓冲剂和储罐通道与主通道(本文中称为“mainc”)连接的通道;-将主通道(称为“mainc”)与第一废物储罐连接的通道(本文中称为“cw2”);-将阵列室与主通道连接的通道(本文中称为“prec”);和-将阵列室与废物储罐连接的通道(本文中称为“postc”);使得所述通道配置为允许流体平稳流动且交叉污染最小化。在干盒和湿盒接口处包含密封膜并且不受任何特定假设的约束的实施方式中,密封膜可以减少或消除气泡和/或减少或防止试剂或缓冲剂的交叉污染。在一些实施方式中,可防止试剂或缓冲剂过早进入干盒。密封膜可由聚丙烯制成。密封膜的孔径可为约10μm,并且可厚约51μm。在加入来自泵的压力后,试剂流体能够穿过密封膜并通过试剂通道进入干盒,所述试剂通道与配对的缓冲剂通道连接,最终连接主通道,其将试剂带到阵列室。密封膜可位于阀门/干盒接口,其被称为透气膜(gpm)或流体阻隔膜,在这个位置,其可以通过将流体限制在盒内来保护仪器免受流体入口的影响。密封膜还可以或另选地位于缓冲剂和储罐通道(例如b1c或r2c)的入口,以便例如减少或防止流体过早地进入干盒,并有助于减少或防止交叉污染,例如试剂交叉污染。在一些实施方式中,缓冲剂和试剂通道的配对允许在试剂步骤后用缓冲剂冲洗试剂通道,这可以帮助减少或防止交叉污染,例如试剂交叉污染。在一些实施方式中,试剂/缓冲剂通道对可与主通道而不是主结点连接。这种构型可以在干盒的构造中允许更少的层压层,其不受任何特定假设的约束,可以减少或防止气泡被困在接合处并减少或阻止流动。在一些实施方式中,通向废物储罐的通道(例如w2c)可减少或防止气泡。例如,在流向阵列室之前,试剂首先灌注到相应的废物储罐(例如w2)。这样在试剂进入之前去除通道中可能存在的气泡和空气。在试剂进入阵列室之前首先将这些气泡推送到w2,可以减少或防止气泡干扰位于阵列室中的抗体和抗原斑点。例如,在一些实施方式中,储罐2的试剂通道(r2c)可与储罐1的缓冲剂通道(b1c)连接;储罐3的试剂通道(r3c)可与储罐4的缓冲剂通道(b4c)连接;储罐6的试剂通道(r6c)可与储罐5的缓冲剂通道(b5c)连接;并且储罐7的试剂通道(r7c)可与储罐8的缓冲剂通道(b8c)连接(例如图25a)。在一些实施方式中,试剂/缓冲剂通道对可直接连接到主结点或通道。干盒可包含用于检测来自抗体微阵列的信号的孔隙(本文称为“阵列室”)。应当明白,取决于通道和储罐的特定几何形状,孔隙的位置和尺寸可以改变,因此阵列室可以改变。可以将样品托座引入干盒中,以允许样品装载到该储罐中。样品装载后,样品托座可以密封,例如用透明胶带密封,以减少或防止泄漏。在一些实施方式中,干盒组件可具有以下尺寸。缓冲剂通道b1c、b4c、b5c和/或b8c可以长约3mm至约36mm或其间的任意值,例如长约14mm、16mm或25mm,并且宽约0.5mm至约3mm或其间的任意值,例如约2mm。试剂通道r2c、r3c、r6c和/或r7c可以长约约3mm至约20mm或其间的任意值,例如长约11mm,并且宽约0.5mm至约3mm或其间的任意值,例如约2mm。受任何特定理论的束缚,缓冲剂和/或试剂通道的宽度和深度可允许在储罐和通道之间形成空气袋,从而在通道中提供足够的容量,使得试剂不会偶然离开储罐。c1/2和/或c5/6可以长约3mm至约35mm,例如约16mm,并且宽约0.5mm至约3mm,例如约1mm。c3/4可以长约3mm至约35mm,例如约8mm,并且宽约0.5mm至约3mm,例如约1mm。c7/8可以长约3mm至约50mm,例如约32mm,并且宽约0.5mm至约3mm,例如约1mm。prec可以长约3mm至约44mm或其间的任意值,例如约17mm、22mm或30mm,并且宽约0.5mm至约3mm,例如约1mm。postc可以长约12mm至约300mm或其间的任意值,例如约70mm或122mm,并且宽约0.5mm至约3mm或其间的任意值,例如约1mm至约1.5mm。当存在时,mainc可以长约20mm至约80mm或其间的任意值,例如约53mm或65mm,并且宽约0.5mm至约3mm或其间的任意值,例如约1mm。当存在时,ptfe膜可以长约5mm至约27mm,例如约7mm,并且宽约2.5mm至约6mm,例如4mm。阵列室的面积可以为约4mm2至约500mm2或其间的任意值,例如面积为约100mm2,并且深约100μm至300μm或其间的任意值,例如深250μm。当存在时,“密封膜”可以长约5mm至约80mm,例如约3mm,并且宽约2.5mm至约7mm,例如3mm。干盒可由具有低蛋白质粘合性质的任何合适材料制成,例如但不限于聚甲基丙烯酸甲酯(pmma)、聚碳酸酯、聚苯乙烯或环状烯烃聚合物。在一些实施方式中,干盒可由聚对苯二甲酸乙二醇酯制成。干燥盒中的通道可以使用激光或任何合适的方式形成,例如复制成型,感染成型或压花。在一些实施方式中,干盒可以是一次性的。湿盒中的通气口可配置为与干盒中的通道的通气口对准。在一些实施方式中,湿盒中的通气口可与干盒的通气口和透气或流体阻隔膜对准,使得空气能够自由流动(图27)。在一些实施方式中,湿盒中的通气口可与干盒的通气口和透气或流体阻隔膜对准,使得仪器中的泵产生的压力能够自由地通过,而不允许液体通过(图27)。在一些实施方式中,湿盒中的储罐位置可配置为与干盒中的通道的端口对准(图27)。应当明白,干盒的尺寸足够容纳微流体通道和用于检测来自蛋白质微阵列(例如抗体微阵列)的信号的孔隙的几何形状。湿盒的尺寸可以由干盒的尺寸确定。在一些实施方式中,组装的微流体盒的尺寸可以为约8cm×5.5cm×1cm。“约”是指5%以下的值或范围的方差(正或负),例如0.5%、1%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%等。流体(例如试剂和/或缓冲剂)可装载到湿盒或微流体盒的适当储罐中。在一些实施方式中,试剂和/或缓冲剂可通过层压底部中的孔装载,其可在装载后密封。在一些实施方式中,试剂和/或缓冲剂可在使用前装载和密封到湿盒或微流体盒的适当储罐中,并在例如4℃储存。在备选实施方式中,试剂和/或缓冲剂可以在即将使用前装载和密封到湿盒或微流体盒的适当储罐中。在一些实施方式中,试剂和/或缓冲剂可分别由湿盒和/或干盒或微流体盒提供。样品可以同时装载到样品托座或孔中,或者随后装载到试剂和缓冲剂中。湿盒或微流体盒可包括用于纯化流体样品的系统。例如,过滤器或膜可用于例如血液样品。应当明白的是纯化程度将取决于所用流体样品的类型,在许多情况下,部分纯化可能就足够了。在一些实施方式中,样品可以装入血液过滤元件中。这可能包含一个血浆过滤器,以便过滤全血中的血浆和去除血细胞。可以将蛋白质微阵列(例如抗体微阵列)载玻片附接到干盒上,使得微阵列上的蛋白质或抗体斑点在干盒的孔隙(阵列室)内对准,并且可以在分析开始时暴露于来自湿盒的流体(例如样品、缓冲剂、试剂)。干盒和湿盒可对准,使得蛋白质或抗体微阵列中的蛋白质或抗体可进入阵列室,干盒中的微流体通道、端口和/或通气口与湿盒中相应的储罐、端口和/或通气口对准。在一些实施方式中,湿盒和/或干盒中的凹口或导向装置可允许轻易对准。在一些实施方式中,湿盒和干盒可以可逆地连接以形成组装的微流体盒,使得湿盒可以重复使用。在一些实施方式中,湿盒和干盒可分别提供。在备选实施方式中,湿盒和干盒可以永久地连接以形成组装的微流体盒,其可以在使用后丢弃。在一些实施方式中,湿盒和干盒可与蛋白质微阵列一起提供。在一些实施方式中,蛋白质微阵列可与湿盒和/或干盒或微流体盒分开提供。仪器和操作微流体盒可以插入设计用于保持微流体盒的仪器的盒托座中。仪器可包括用于微流体盒的对准/弹出机构。例如,仪器可以包括夹紧特征,该夹紧特征可以夹入微流体盒中的相应特征,例如半圆形特征,以帮助盒的正确对准。微流体盒可以与仪器气动连接,以例如控制流体的运动。仪器可能能够使用光学传感器或其他检测系统(例如,比色系统)检测蛋白质微阵列。仪器可包括用于纯化流体样品的系统。除了盒托座和对准/弹出机构之外,仪器还可以包括但不限于泵、阀门系统、歧管、led激发源、检测系统、cpu、蓝牙连接、lcd触摸屏、可充电电池、电路板、hdmi适配器、usb连接器、以太网连接适配器、串口、通气扇、电源开关和/或防护罩中的一个或多个。一旦插入,干盒中的通气口可与将阀门与储罐口连接的仪器的歧管接合。在一些实施方式中,泵、阀门和检测系统可以与打印电路板集成,该打印电路板能够将来自软件的电输入传递到各种组件。泵可用于产生压力驱动的流体流动。合适的泵可以能够相继输送例如试剂、缓冲剂和/或样品。在一些实施方式中,所述泵可以是真空泵。应当明白,可以使用任何合适的泵,只要其能够在仪器的背景下根据需要操作即可。可设计仪器,使得泵能够从试剂储罐推动,由此使流体朝废物储罐流动。图32示出了示例性注射泵。泵通常可以是在其侧面转动的u形。底部的泵可以插入仪器的歧管中。o形环可以安装在泵的端部周围以密封歧管内的泵,并密封用于驱动流动的空气压力。泵的上部可以具有齿。具有互补齿的环可以将泵连接到电机,使得当电机移动时,泵将移入或移出歧管。泵可通过电机(例如,vex:rb-inn-11)操作。盒读取器可包括用于推动或拉动指定体积空气的容积式空气泵。可例如通过接地不锈钢销针轴向移动到泵腔中而使空气移位。销针可通过固定径向密封件在腔体入口处密封。销针可由步进电机驱动(haydonkerklc1574w-05)线性致动器直接移动。可用接近传感器光学测量泵位置。可以自动校准泵以检测和校正跳过的步骤并考虑结构的变化。阀门可允许自动控制泵、通气口和喷嘴之间的气动连接。阀门可使用螺钉和面密封安装到歧管组件。歧管组件可包括多个阀门,一级两个额外阀门的空插座。系统中可包括压力传感器,以便测量泵内的压力。应尽量减少压力传感器和传感器连接内的空气量,以改善系统响应。阀门可以是螺线管阀门(例如,parker:x-705l-f或lee:lhdx0532300b)。阀门可以置于每个储罐上方,包括废物储罐(图29),还有一个额外的阀门用于通气,或者允许泵归零而不连接到盒中。打开与特定储罐相关联的螺线管阀门,导致储罐中的流体从储罐移向废物储罐。仪器可装配有包含通道的歧管,用于在泵、阀门和盒之间通过空气,使得空气可以从泵通过歧管行进到阀门。如果阀门打开,则空气可行进经过特定阀门,返回歧管并进入盒的相应储罐。图33和图47示出了示例性歧管,其用于将来自泵的控制连接至通向盒的阀门。空气通过端口88离开泵,行进到阀门入口85,并通过打开的阀门。然后空气通过端口86离开阀门,重新进入歧管并行进到歧管与盒87连接的端口。在泵的归零期间,或行进到w1(1)或w2(2)空气通过端口排出至大气63。java应用程序允许图像捕获,分析脚本和信号量化,并使用公开可用的相机通信库,实现公共可用的控制器协议,并使用标准的java图形用户界面库。可以使用软件来控制仪器中阀门的开放,从而控制流体的运动,例如如下:-缓冲剂可以从缓冲剂储罐推动通过主结点,然后到达第二废物储罐(w2),以大幅减少或净化空气通道;-样品可从样品孔推动经过例如试剂储罐r7,通过主结点,并经由prec通过阵列室,经由postc到达第一废物储罐(w1)上;-试剂可从试剂储罐推动通过主结点并通过阵列室(经由prec),经由postc到达第一废物储罐(w1)上。光学传感器可以用于获取样品测定结果的读数,并且可以使用量化软件来解释读数的结果。光学传感器可以用于获取样品测定结果的读数,并且可以使用量化软件来解释读数的结果。可以使用任何合适的光学传感系统。在一些实施方式中,仪器包括相机,例如usb相机(例如,leopardimaging:li-ov7725)和照明系统,使得软件能够获得斑点的图像。然后,软件可以基于相机拍摄的图像计算光密度。led阵列(例如,life-oninc.)可以放置在斑点的场下方,使得照明允许斑点的图像。仪器成像系统可包括一个光源,光源包括4个白色led,它们透过半透明的丙烯酸扩散器,然后穿过湿卡的背面。湿盒可由半透明聚碳酸酯制成,从而增加了照明的均匀性。led的闪烁可以允许合适的软件计算所得图像的增益和偏移。led可以三角形的时变信号照亮载玻片的背面。该调制可发生在大约2.6hz。调制可由控制器电路产生,该控制器电路也可用于控制阀门和泵电机。控制器电路可产生方波信号,该信号被积分然后用于调制到led的电流,从而产生三角形的时变光输出,以便减少杂散光引起的误差以及像素增益和偏移的变化。光路长度可以设计得尽可能短,以减小仪器的尺寸。光学系统可允许tad系统对由测定产生的阵列室中的斑点成像,以确定插入的微流体盒的类型、相容性、取向和成功插入,并且对微流体盒中的流体流动进行成像。相机可发挥多种功能,其包括但不限于以足够的分辨率对测定产生的斑点进行成像,以量化光密度;将从仪器中输入空白和点图像作为输入;将基于所选择的卡类型配置的点阵列尺寸来定位基准点并输出二维点阵列;对微流体盒上的特征进行成像,其允许确定盒类型、相容性和取向,并允许tad确定成功插入;对微流体盒内的所有微流体进行成像,以记录流体或空气位置;协助诊断或提供测试记录;和/或对盒标签进行成像以进行条形码扫描。led阵列可照亮微流体盒的顶面。光输入可由控制电子设备调制,并且可以由软件控制以支持例如上述的相机功能。这些灯可用于条形码扫描,并可在测定期间进行视频记录以进行故障排除和诊断。成像led可为阵列室的基座提供光。光输入可由控制电子设备调制,并且可以根据量化阵列室中斑点的需要由软件控制。对于阵列室中的成像点,来自led的光必须进入阵列室的底部,通过观察窗口,并进入相机而不会反射或漫射通过任何其他表面。来自成像led的光不得反射或漫射通过tad设备的任何元件,然后从顶部照射阵列室。在阵列成像led和微流体盒测定室之间可包括漫射元件,以在led进入测定室之前均匀地分布来自led的光。为了获得斑点的图像,可以首先获得空白图像,以允许软件通过忽略斑点形成之前存在的任何背景来检测斑点。在斑点形成时,可以获得斑点图像。在图像捕获开始时,两个640×480像素阵列归零:一个将累积每个单独像素的平均黑色和白色强度,另一个将累积强度乘以整体像素平均值。空间像素平均值也可与捕获帧的时间一起存储。在以下分析中,空间像素平均值可用作调制信号的代理。这是基于2.6hz周期的唯一来源必须归因于调制的假设。一旦捕获了所需的总帧数,就将平均像素强度的时间记录可与正弦波的频率范围相关联,以便识别正确的调制频率、相位和幅度。该估算的结果是与调制幅度成比例的值。接下来,可对每个像素计算最小二乘线性回归,以确定每个像素相对于提取的调制信号的增益和偏移。此时,可假设单个像素增益表示与led输出相关的比例因子。像素偏移不被认为是有用的并且被丢弃。为了阻挡由卡到卡的变化,由于腔室中的流体引起的光密度变化以及精确的调制幅度引起的影响,可首先在斑点形成之前然后在之后捕获图像。这些被称为“空白”图像和“斑点”图像。可通过计算斑点图像的每个像素增益与空白图像的每个像素增益的比率来创建最终处理图像。可通过所计算的斑点图像与空白图像的调制幅度的比率来进一步缩放该图像。用于量化的斑点可以由软件用户手动标记。每个斑点包含一个中心点区域。用户可以使用软件更改斑点的大小。为了量化斑点,可以计算新图像,其中每个像素等于斑点和无斑点图像的每个像素的比率。这消除了由于背光和固有的空间卡密度以及像素增益和偏移引起的变化。计算中心点圆内的平均像素值。泵、阀门和光学相机可集成到仪器中。在仪器内,这些部件可与打印电路板集成在一起,该电路板可将来自软件的所有电输入传递到各种组件。仪器可容纳微控制器、泵、阀门和光学系统。可将盒(湿盒和干盒一起)插入仪器中并通过与歧管的弹簧机构接合,该歧管可将阀门连接到储罐端口。软件可以加载到连接到仪器的计算机上。tad系统可以包括读取器,其控制和量化由盒而得的结果。该仪器可包括塑料和金属外壳组成,其包括但不限于触摸屏显示器、主cpupcb、包括泵的盒接口、多个阀门、用于量化的相机、各种led光源和带有mcu的pcb、阀门驱动器、电机驱动器和传感器,以确保正确进行实验。读取器的基本形式可包括用于用户界面的图形触摸屏显示器,其具有用于盒插入的抽屉。外壳可以使用ots防振脚。tad软件可在基于arm的cpu上运行。主要的软件功能(包括所有gui)可以是用java编写的软件应用程序(app)的结果。该app可依赖于各种其他软件库和软件包的支持,这些软件库和软件包属于未知来源(soup)软件类别。tad可以包括公共可用的电子子组件。用户与应用程序的交互可以通过触摸屏完成。可以通过屏幕键盘完成数据输入。在一些实施方式中,可以包括用于患者id进入的外部条形码扫描仪的添加。将以下述实施例进一步阐述本发明实施例1:生物标志物分析开发和验证(elisa)1a:针对同源抗原的抗体反应性验证(elisa)最初根据制造商的推荐选择每种生物标志物的夹心免疫测定抗体对。这些包括四种生物标志物:ca15-3、cea、erbb2和cyfra21.1。在夹心免疫测定中测试抗体对以确定该对的质量(如本文1b部分所述)。更具体而言,将cea(fitzgerald:30-ac25p)和cyfra21.1(cedarlane:clpro350)抗原在涂布缓冲剂(0.2mnahco3/na2co3ph9.4)中稀释。通过在室温下培养2小时,将50μl抗原的三种不同浓度(200ng/ml,20ng/ml,2ng/ml)的涂布缓冲剂溶液涂布在96孔maxisorpelisa板(thermofisher)的孔上,并将板在4℃储存过夜。第二天,用200μl封闭缓冲剂(1xpbst 2%bsa)封闭elisa板1小时。然后用50μl各自的一抗(1°抗体,表1)探测孔1小时,接着用50μl二抗(2°抗体)(来自与hrp缀合的各种物质的抗-igg)探测,或者将50μlsa-hrp施加到孔中30分钟。随后,用1xpbst洗涤孔6次,每次洗涤5分钟。使用50μltmb(vwr)将信号显影30分钟,然后用50μl2m硫酸终止反应。将板用versamax微孔板读取器(分子设备)在450nm下进行扫描。表1示出了测试针对其抗原的抗体反应性的样品结果。在间接elisa实验中,orb48781(biorbyt)未能识别出cyfra21.1抗原,在所有抗原浓度下都给出低o.d.值(表1)。然而,cyfra21.1的两种其他抗体af3506和mab3506(r&dsystems)能够以剂量依赖性的方式识别抗原。cea的两种抗体10-1134b和10-1131(fitzgerald)即使在高抗体浓度下也在夹心测定中给出低信号。有趣的是,它们能够识别cea抗原(表1)。两种抗体很可能在与cea抗原的结合中相互干扰。其它cea抗体,包括10-c10d、10-c10e和mab41281(r&dsystems)可以剂量依赖性的方式识别cea抗原。因此,在夹心测定中进一步测试这些抗体(1b部分)。表1:抗体反应性筛选设置和结果(o.d.)1b:用于夹心测定的抗体对的相容性(elisa)测试ca15-3和erbb2的第一个夹心抗体对是成功的。这些抗体的优化可以在1c部分中找到。在鉴定出能够识别同源抗原的cea和cyfra21.1的抗体后(1a部分),抗体在夹心测定中针对其相容性进行了进一步的测试。cea抗体对于cea,在范围从1μg/ml至10μg/ml的各种浓度下测试三种不同的抗体10-c10d、10-c10e和10-1134作为捕获抗体(cabs)。将在涂布缓冲剂(0.2mnahco3/na2co3ph9.4)中稀释的50μl抗体涂布在96孔maxisorpelisa板(thermofisher)的孔上。并将板在室温下温育2小时,然后保持在4℃过夜。第二天,用200μl封闭缓冲剂(1xpbst 2%bsa)封闭elisa板1小时。将孔用200μl的1xpbst洗涤三次,用20ng/ml、2ng/ml和0ng/ml的cea抗原温育1小时,然后用1xpbst洗涤三次。用1小时添加50μl不同的生物素化检测抗体(表2)。用另外两种抗体作为检测抗体(dabs)测试每个捕获抗体。在1xpbst洗涤后,将孔用50μl的sa-hrp探测30分钟,然后用1xpbst洗涤6次,每次5分钟。使用50μltmb(vwr)将信号显影30分钟,然后用50μl2m硫酸终止反应。将板用versamax微孔板读取器(分子设备)在450nm下进行扫描。样品结果示于表2。在该研究中具有最佳信噪比并说明对cea抗原的剂量依赖性响应的抗体对是10-c10d捕获抗体和10-1134b检测抗体。抗体mab41281在这些测试中表现出高背景。表2:cea抗体对相容性测试cyfra21.1抗体针对cyfra21.1的初始抗体检测鉴定出两种识别同源抗原的抗体,mab3506和af3506。这些抗体在夹心测定中以两种组合进行测试,一种用mab3506作为捕获抗体,af3506作为检测抗体,反之亦然。如先前描述的进行elisa测定,其中捕获抗体以各种浓度(表3)涂布,然后分别用20ng/ml、2ng/ml和0ng/ml(表3)的cyfra21.1抗原探测。将孔用各种浓度(表3)的生物素化检测抗体探测,然后用sa-hrp探测。将信号用tmb显影。然后将板用versamax(分子设备)板读取器在450nm下进行扫描。o.d.结果如表3所示。用mab3506作为捕获抗体,af3506-b作为检测抗体进行的夹心测定工作良好,以剂量依赖性方式检测cyfra21.1抗原。然而,用af3506作为捕获抗体,mab3506作为检测抗体的相反夹心测定在这些实验中未能产生强的cyfra21.1信号。表3:cyfra21.1抗体对相容性测试1c:抗体滴定(elisa)测试了捕获抗体和检测抗体的最佳浓度。这些实验通常称为棋盘滴定。对于用于每种生物标志物,制备2倍系列稀释液用于捕获和检测抗体。除了空白对照之外,制备两个浓度的抗原,其中一个高于其生理截断值,一个低于其生理截断值。为了确定每个抗体对的最佳浓度,通过将来自抗原孔的读数除以来自没有抗原的孔的读数来计算信噪比。用最高的信噪比和最低的背景读数确定捕获和检测抗体的最佳浓度。生物标志物:erbb2如先前所述进行夹心测定elisa。捕获抗体mab1129(r&dsystems)以4种不同浓度测试:8μg/ml、4μg/ml、2μg/ml和1μg/ml。类似地,检测抗体baf1129(r&dsystems)以160ng/ml、80ng/ml、32ng/ml和16ng/ml进行测试。由于erbb2截断值为15ng/ml,erbb2抗原(r&dsystems:1129-er-050)以25ng/ml、5ng/ml和0ng/ml。每种组合一式两份地进行。结果和实验装置如表4所示。计算信噪比,并且分别对4μg/mlcab和80ng/mldab观察到最高的信噪比。因此,这两种最佳浓度可用于之后的实验。表4:erbb2抗体滴定生物标志物:ca15-3如先前所述进行夹心测定elisa实验。捕获抗体10-ca153a(fitzgerald)以4种不同浓度测试:5μg/ml、2.5μg/ml、1.25μg/ml和0.625μg/ml。类似地,检测抗体10-ca153b-b以200ng/ml、100ng/ml、50ng/ml和25ng/ml进行测试。由于ca15-3截断值为30u/ml,ca15-3抗原30c-cp9064(fitzgerald)以100u/ml、10u/ml和0u/ml。每种组合一式两份地进行。结果和实验装置如表5所示。计算信噪比,对于ca15-3,cab和dab的最佳浓度分别测定为1.25μg/ml和100ng/ml。表5:ca15-3的抗体滴定生物标志物:cyfra21.1如先前所述的进行夹心测定elisa实验。捕获抗体mab3506(r&dsystems)以4种不同浓度测试:6.4μg/ml、3.2μg/ml、1.6μg/ml和0.8μg/ml。类似地,检测抗体af3506-b(r&dsystems)以10μg/ml和5μg/ml进行测试。由于cyfra21.1截断值为2ng/ml,cyfra21.1抗原(cedarlane:clpro350)以20ng/ml、2ng/ml和0ng/ml。每种组合一式两份地进行。结果和实验装置如表6所示。计算信噪比,对于cyfra21.1,cab和dab的最佳浓度分别测定为6.25μg/ml和5μg/ml。表6:cyfra21.1抗体滴定生物标志物:cea如先前所述进行夹心测定elisa实验。捕获抗体10-c10d(fitzgerald)以4种不同浓度测试:20μg/ml、10μg/ml、5μg/ml和2.5μg/ml。与其他生物标志物不同,对cea测试两种检测抗体:10-1134b(fitzgerald)和10-1134b(fitzgerald)。这两种检测抗体都以4种不同浓度测试:10μg/ml、5μg/ml、2.5μg/ml和1.25μg/ml。由于cea截断值为5ng/ml,cea抗原(fitzgerald:30-ac25p)以20ng/ml、2ng/ml和0ng/ml。每种组合一式两份地进行。结果和实验装置如表7所示。计算信噪比,对于cea,cab和dab的最佳浓度分别测定为10μg/ml和1.25μg/ml。两种检测抗体的表现同样出色。表7:cea滴定1d:抗体交叉反应性(elisa)进行elisa测试以确定抗体和生物标志物之间是否发生交叉反应。交叉反应性:捕获抗体和检测抗体之间(不使用抗原的实验)如先前所述进行elisa实验。代替抗原,将孔用封闭缓冲剂(1xpbst 2%bsa)温育1小时。针对ca15-3的生物素化检测抗体10-ca153b-b显示出与10-c10d的一些交叉反应性,针对cea的捕获抗体具有0.20605的o.d读数(图1)。针对cyfra21.1的生物素化检测抗体af3506b显示了与包含其配对捕获抗体mab3506的所有捕获抗体的交叉反应性。针对cea和erbb2的生物素化检测抗体(10-1131b和baf1129)与任何捕获抗体均未显示出显著水平的交叉反应性。检测抗体和抗原之间的交叉反应性为了确定抗原和检测抗体之间的非特异性相互作用,如前所述进行elisa实验。每个孔用捕获抗体涂布,封闭并与其相应的抗原一起温育。然而,代替用其配对的检测抗体进行探测的是,用与抗原无关的检测抗体进行探测。如图2所示,抗原与其他检测抗体之间未发现交叉反应性。使用cyfra21.1检测抗体的孔的相对较高的读数可能源于此检测抗体和所有捕获抗体之前观察到的交叉反应性(图1)。捕获抗体和抗原之间的交叉反应性所有捕获抗体用降低ca15-3浓度(其他3种抗原的浓度保持不变)的抗原混合物探测,并用所有检测抗体的混合物检测。正如预期的那样,对于ca15-3捕获抗体10-ca15-3a所看到的信号减少。出乎意料地,cea捕获抗体10-c10d和cyfra21.1捕获抗体mab3506的信号也有所减少(表8)。发现了ca15-3抗原30c-cp9064(fitzgerald)含有cea和cyfra21.1污染物。因此,cea和cyfra21.1捕获抗体不是非特异性结合的ca15-3抗原,而是存在于ca15-3抗原溶液中的其同源抗原。与mab1129、erbb2捕获抗体和ca15-3抗原没有相互作用。对剩余的三种生物标志物进行了类似的实验。对于erbb2,通过erbb2捕获抗体mab1129仅看出剂量依赖性响应(表8)。由于cea和cyfra21.1作为ca15-3中的污染物存在,因此从用于测试cea和cyfra21.1的抗原混合物中省略了ca15-3。在抗原混合物中没有ca15-3的情况下,cea和cyfra21.1捕获抗体只识别它们各自的抗原(表8)。表8:交叉反应性实验总结:捕获抗体与抗原之间的相互作用1e:抗体亲和性为了确定捕获抗体和检测抗体识别它们各自抗原的程度,我们用elisa进行了抗体亲和性实验。我们将抗原和检测抗体温育了不同的时间,以了解温育时间如何影响信号读数。这种实验的实例在表9中示出:左侧。将孔用针对ca15-3的捕获抗体(10-ca153a)以1.25μg/ml涂布。在封闭之后,将孔用ca15-3抗原温育,截断水平为30u/ml,温育时间为5分钟至60分钟。每个时间点都包括无抗原对照。随后将孔用100ng/mlca15-3检测抗体(10-ca153b-b)以5分钟至60分钟内的不同时间量进行探测。结果示于左下部。正如预期的那样,抗原或检测抗体的温育时间越长,产生的信号越强。检测抗体温育时间的增加似乎不影响背景信号。对于60分钟的检测抗体温育时间,信号在抗原温育时间15分钟时饱和,抗原温育时间越长,不产生较高的信号。发现了10分钟的抗原温育时间足以获得可靠的信号。对检测抗体温育时间进行了类似的实验,并观察了检测抗体浓度的效果。对于ca15-3以30u/ml的截断水平探测抗原,温育时间保持固定在10分钟(表9:右侧)。检测抗体10-ca153b-b以4种不同浓度测试:100ng/ml、200ng/ml、400ng/ml和800ng/ml,温育时间在5分钟至1小时内变化。对于100ng/ml和200ng/ml的浓度,信号随预温育时间的增加而增加。对于400ng/ml和800ng/ml,信号在仅5或10分钟的温育时间后变得饱和,并且更多的温育时间不会产生更强的信号。因此,对于检测抗体而言100ng/ml的浓度足以获得可靠的信号。对剩余的生物标志物进行了类似的实验以改进抗原和检测抗体温育时间以及检测抗体浓度。表9:ca15-3的抗体亲和性elisa测试的设置和结果2:抗体微阵列测定开发2a:抗体滴定测试每个捕获抗体的各种浓度以确定微阵列的最佳浓度。所有四种生物标志物的捕获抗体均以10倍连续稀释在环氧硅烷载玻片上点样。每孔点样单个捕获抗体的三种浓度,以及取向用的13.2μg/ml的bsa-生物素斑点。三个孔用各个捕获抗体组点样(图3a-l)。每个孔随后用各抗原的三个10倍浓度探测:30u/ml、300u/ml和3000u/ml的ca15-3;5ng/ml、50ng/ml和500ng/ml的cea;2ng/ml、20ng/ml和200ng/ml的cyfra21.1;和15ng/ml、150ng/ml和1500ng/ml的erbb2。每个孔用其相应的检测抗体探测:1μg/ml的10-ca153b-b,10μg/ml的10-1131b,10μg/ml的af3506b,和4μg/ml的baf1129。所有孔用链霉亲和素(sa)-alexa546(thermofisher)探测,并用genepix微阵列扫描仪在532nm进行扫描。对于10-ca153b-b,捕获抗体浓度都不能检测30u/ml的截断水平的ca15-3(图3a-l)。对于10-c10d,2000μg/ml能够检测5ng/ml的截断水平的cea,但信号弱。对于mab3506和mab1129,500μg/ml的捕获抗体能够检测2ng/ml的cyfra21.1和15ng/ml的erbb2的截断水平。ca15-3捕获抗体10-ca153a的多种浓度。使用定制硅酮隔离器将500μg/ml、200μg/ml、80μg/ml和32μg/ml四种浓度的0.4μl的该捕获抗体点样在环氧硅烷载玻片上(参见:第3部分-抗体微阵列构造)。还将ca15-3抗原斑点点样以用于不同的实验。封闭载玻片并用30u/ml的ca15-3抗原以及1μg/ml的检测抗体10-ca153b-b进行探测。结果利用tmb-mx(moss)显影,并且用genepix微阵列扫描仪扫描。当我们测试探测条件的体积极限时,这种探测以最小的体积进行。如图4所示,当10-ca153a为80μg/ml时,检测到良好的信号。在较高的捕获抗体浓度200μg/ml和500μg/ml时,信号较低。这表明捕获抗体的这些较高浓度可能会干扰抗原结合。对于32μg/ml的捕获抗体,信号也很低;然而,这可能归因于该实验中使用的最小体积及其在孔中部的位置,其导致在温育步骤期间抗原溶液的覆盖率差。对其他生物标志物捕获抗体进行了类似的实验,以确定引起抗原捕获的最佳密度的最佳捕获抗体浓度。检测抗体浓度凭经验确定。通过微阵列打印机(例如genemachinesomnigrid300)用针对ca15-3和cea的捕获抗体的稀释物打印化学改性微阵列载玻片。出于数据标准化目的,也打印了ca15-3和cea的抗原的稀释物。将抗体和抗原在1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa打印缓冲剂中稀释。在载玻片打印和固定后,用封闭缓冲剂封装载玻片。采用不同量的ca15-3和cea抗原,然后使用ca15-3和cea检测抗体的稀释物,探测16个微阵列网格。ca15-3和cea检测抗体的两种不同稀释物探测7种不同的抗原浓度,以产生检测抗体稀释物的标准曲线。对于ca15-3,检测抗体以0.2μg/ml和0.4μg/ml进行测试。cea检测抗体以20μg/ml和25μg/ml进行测试。在利用sa-hrp/生物素-hrp和tmb信号显影后,载玻片利用arrayit比色扫描仪成像,并通过imagej量化。从捕获抗体计数中减去背景(零抗原时的cab计数值)。然后用抗原斑点(cab计数/ag计数)标准化捕获抗体斑点。随后绘制标准化的计数(对应探测的抗原浓度),产生标准曲线。图34a-b中示出了0.2μg/ml和0.4μg/ml检测抗体处的80μg/ml的ca15-3捕获抗体的标准曲线。使用0.2μg/ml的检测抗体产生线性标准曲线,而0.4μg/ml的检测抗体在较高抗原浓度下引起计数饱和。基于这些研究,选择0.2μg/ml作为ca15-3的检测抗体浓度。还用cea进行了类似的实验,并导致选择20μg/ml作为检测抗体浓度。对心血管生物标志物进行了类似的实验。检测抗体浓度凭经验确定。用针对肌红蛋白的捕获抗体的稀释物打印环氧涂布的载玻片。出于数据标准化目的,也打印了肌红蛋白的稀释物。将抗体和抗原在1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa打印缓冲剂中稀释。在载玻片打印和固定后,用封闭缓冲剂封装载玻片。采用不同量的肌红蛋白抗原,然后使用肌红蛋白检测抗体的稀释物,探测16个微阵列网格。对于肌红蛋白,检测抗体以0.5μg/ml、1μg/ml、2μg/ml和4μg/ml进行测试。图35a-b中示出了1μg/ml和4μg/ml检测抗体处的100μg/ml的肌红蛋白捕获抗体的标准曲线。使用1μg/ml的检测抗体产生线性标准曲线,而4μg/ml的检测抗体在较高抗原浓度下引起计数饱和。基于这些研究,选择1μg/ml作为肌红蛋白的检测抗体浓度。还用其他心血管生物标志物ck-mb、nt-probnp和肌钙蛋白i进行了类似的实验,并导致分别选择5μg/ml、10μg/ml和100μg/ml作为这些生物标志物的检测抗体浓度。2b:抗原滴定为了确定用于潜在信号量化目的的最佳抗原浓度,在微阵列载玻片上进行抗原标准曲线。除了4种复制捕获抗体浓度之外,将8种不同的抗原浓度点样在载玻片上。对erbb2的此实验的实例在图5a-b中示出。每个孔用不同浓度的erbb2抗原探测以获得不同实验的标准曲线。然后将孔用20μg/ml的erbb2检测抗体baf1129探测,然后用sa-hrp/生物素-hrp探测,用tmb-mx将信号显影。用仪器相机量化斑点。由于夹心测定中用于温育的抗原量不应影响点样的抗原,因此每个孔被认为是每个抗原斑点的复制品。对各抗原浓度获得平均值,在信号vs.浓度图表中绘制,得到抗原滴定的标准曲线(图5a-b)。对其他生物标志物进行类似实验以得到抗原滴定的标准曲线。2c:抗体缀合用生物素修饰检测抗体,允许使用携带链霉亲和素(sa)的常见二级检测试剂进行信号检测。生物素具有非常小的尺寸(244da)并且可以与抗体和蛋白质缀合而不影响它们的活性。生物素分子将通过sa与sa-hrp紧密结合,使得hrp将催化其比色基底显影成可见信号。缀合通常允许一个以上的生物素分子缀合到抗体上,从而通过增加能够结合一种抗体的hrp分子的数量来扩增信号。为了将生物素与检测抗体缀合,我们使用n-羟基琥珀酰亚胺(nhs)酯活化的生物素(thermofisher)。nhs酯与抗体上的伯胺以及赖氨酸残基的侧链反应形成酰胺键。对于生物素化反应,制备10mmnhs酯活化的生物素溶液。对于每20μg检测抗体,使用0.5μl的10mmnhs-酯活化的生物素。将检测抗体-生物素溶液在室温下于旋转器上温育1小时。温育后,将溶液置于10,000mw的截断透析管中(thermofisher)。将具有溶液的透析管置于冷的1xpbs中并在4℃下放置过夜。这允许除去任何未缀合的生物素,同时将检测抗体保持在透析管中。这也允许缀合缓冲剂对于1xpbs的交换。第二天,从透析管中取出溶液,用bradford方法量化所得检测抗体的最终浓度。2d:微阵列上的抗体交叉反应性捕获抗体和检测抗体之间的交叉反应性用微阵列格式进一步验证用elisa进行的交叉反应性实验。用打印机器人打印微阵列载玻片。这些载玻片的所有捕获抗体均以六个复制品打印。将含有所有捕获抗体的孔用封闭缓冲剂封闭,并用单一检测抗体探测,以确定捕获抗体和检测抗体之间是否存在交叉反应性。结果在图6a-d中示出。发现了针对ca15-3的检测抗体10-ca153b-b与mab3506、mab1129及其自身的捕获抗体10-ca153a轻度交叉反应。针对cyfra21.1和erbb2的检测抗体af3506和baf1129也与这些相同捕获抗体轻微交叉反应。也通过用定制硅酮隔离器(gracebiolabs)点样的载玻片检查捕获抗体和检测抗体之间的交叉反应性。对于所有四种生物标志物,载玻片都点样有捕获抗体和抗原。代替抗原,用封闭缓冲剂温育孔。用含有所有四种生物标志物的检测抗体的检测抗体混合物(2μg/ml的ca15-3b-b,20μg/ml的c1299-87o-b,8μg/ml的baf1129和5μg/ml的af3506)探测孔。在探测之前将检测抗体与sa-hrp(dab:5xsa-hrp)预混1小时。将斑点用来自nanoprobes的enzmet银显影剂显影,并用genepix微阵列扫描仪扫描。结果在图7中示出。正如预期的那样,除erbb2外,点样的抗原都显影。对于25μg/ml的捕获抗体ca15-3a、250μg/ml的mab1129和500μg/ml的c1299-87w没有观察到信号。对于50μg/ml的mab3506观察到低水平的交叉反应性。对于乳腺癌组检查捕获抗体和检测抗体之间的交叉反应性。用genemachinesomnigrid300将ca15-3、cea和erbb2的捕获抗体和抗原打印到环氧涂布的载玻片上。随后将载玻片用没有任何抗原的检测抗体探测,用arrayit比色扫描仪成像。除非存在交叉反应性,否则在没有抗原的情况下,当用检测抗体探测时,应该没有捕获抗体信号。图36图示了实验结果。每个柱表示不同的捕获抗体/检测抗体组合。对于任何捕获抗体/检测抗体组合,没有高于背景的信号,表明在测试条件下,乳腺癌组捕获抗体和检测抗体之间没有交叉反应性。抗原和检测抗体之间的交叉反应性通过我们利用elisa的交叉反应性实验,我们发现了原始ca15-3抗原也含有cea和cyfra21.1抗原的杂质。捕获新ca15-3抗原(fitzgerald:30c-cp9064u)并在微阵列上测试,以确保不再有任何污染。使用硅酮隔离器将捕获抗体和抗原点样在微阵列载玻片上。将孔用30u/ml的ca15-3抗原(新)探测,并用针对所有生物标志物的检测抗体混合物探测。将孔用sa-hrp和enzmet银显影剂探测。将所得载玻片用genepix微阵列扫描仪在532nm进行扫描。然后,在cyfra21.1和cea捕获抗体(mab3506和c1299-87w)处没有发现信号(图8)。因此,我们推断出是这种新的ca15-3不具有会干扰我们的多路复用免疫测定的污染物。为了检查抗原和检测抗体之间的潜在交叉反应,将抗原点样到微阵列载玻片上。将载玻片用封闭缓冲剂(1xpbst 5%bsa)封闭,并用抗原及其相应的检测抗体探测。将孔用抗原探测,这是由于载玻片也被用于其他实验的捕获抗体点样。将孔用sa-hrp和生物素-hrp预混物(分别为4μg/ml和2μg/ml)探测,并用enzmet银显影剂显影。结果在图9a-d中示出。用2μg/ml的ca15-3b-b探测点样有所有四种抗原的孔。正如预期的那样,显影的唯一抗原信号是ca15-3的信号。ca15-3b-b检测抗体未能与其他三种生物标志物发生交叉反应。所有四种抗原斑点也在三个单独的孔中用剩余的三种检测抗体(5μg/ml的af3506b,20μg/ml的c1299-87o-b和8μg/ml的baf1129)探测。用无关抗原没有任何信号。这证实了检测抗体和非同源抗原之间没有交叉反应性相互作用。检查乳腺癌组的抗原和检测抗体之间的潜在交叉反应性。如上所述,用genemachinesomnigrid300将ca15-3、cea和erbb2捕获抗体点样在环氧涂布的载玻片上。用ca15-3、cea和erbb2抗原探测各个微阵列网格。随后将孔用其他生物标志物的检测抗体探测,即随后将用ca15-3抗原探测的孔用cea和erbb2检测抗体探测。在信号显影之后,将载玻片用arrayit比色扫描仪进行扫描。抗原应该结合其各自的捕获抗体,但由于抗原不具有其同源检测抗体,因此在捕获抗体斑点处应该没有信号。捕获抗体/抗原斑点未显示用相应的检测抗体探测出的信号(图37)。这表明在乳腺癌组中抗原和检测抗体之间没有交叉反应性。抗原和捕获抗体之间的交叉反应性为了检查抗原和捕获抗体之间的相互作用,利用定制硅酮隔离器将微阵列载玻片用捕获抗体和抗原点样。将载玻片温育过夜并用封闭缓冲剂(1xpbst 5%bsa)封闭1小时。然后将孔用单个抗原及其相应的检测抗体探测。结果在图10a-d中示出。正如预期的那样,用30u/ml的ca15-3和2μg/ml的ca15-3b-b检测抗体探测的孔仅在10-ca15-3a捕获抗体和ca15-3点样的抗原处显示出信号。用50ng/ml的cea和c1299-87o-b检测抗体(20μg/ml)探测的孔仅在cea捕获抗体(c1299-87w)和cea点样的抗原处具有信号。类似地,用8ng/ml的cyfra21-1和其5μg/ml的检测抗体(af3506b)探测的孔仅对cyfra21-1捕获抗体mab3506和cyfra21-1点样的抗原显示出信号。在单独的实验中,仅用捕获抗体点样用30ng/ml的erbb2及其检测抗体和8μg/ml的baf1129探测的孔。正如预期的那样,其仅在erbb2捕获抗体(mab1129)处显示出信号。这些结果表明,该组内的抗原和其他捕获抗体之间没有可能干扰我们的多路复用免疫测定的任何强烈的交叉反应相互作用。为了检查抗原和捕获抗体之间的相互作用,用genemachinesomnigrid300将捕获抗体点样在环氧涂布的载玻片上。然后用ca15-3、cea或erbb2探测微阵列网格,然后用其同源检测抗体探测。在信号显影后,将载玻片用arrayit比色扫描仪进行扫苗。如果抗原和捕获抗体之间具有相互作用,则应当在该捕获抗体处有信号。在没有交叉反应性的情况下,抗原应仅在其相应的捕获抗体处显示出信号。在任何非特异性捕获抗体处都没有看到信号,表明在测试条件下抗原和捕获抗体之间没有交叉反应性(图38)。2d:信号放大测试了不同量的链霉亲和素-辣根过氧化物酶(sa-hrp),将检测抗体和sa-hrp步骤合并为一个。检测抗体是生物素化的,使得它们可以被sa-hrp识别。用检测抗体和sa-hrp的预混物缩短测定时间我们最初试图通过将生物素化检测抗体和sa-hrp培养物这两种组分预混合而将其合并成一种而增加信号并缩短测定时间。检测抗体与5倍摩尔浓度的sa-hrp预混合,在探测前旋转1小时。将针对ca15-3(10-ca15-3a)、cyfra21-1(mab3506)、cea(c1299-87w)和erbb2(mab1129)的捕获抗体手动点样到微阵列载玻片上。所有四种生物标志物的抗原也手动点样。随后将斑点用ca15-3、cyfra21-1、cea和erbb2抗原分别探测30分钟,1x截断值分别为:30u/ml,5ng/ml,2.5ng/ml和15ng/ml。然后将不同的孔用混合了dab的5xsa-hrp温育(图11a-g)。用检测抗体混合物探测15分钟,然后用sa-hrp探测15分钟。结果表明,用检测抗体和5倍sa-hrp的混合物探测15分钟足以获得良好的信号。一些孔也用检测抗体混合物探测15分钟,然后用各种组合的sa-hrp和生物素-hrp的混合物探测(图11h-m)。发现了与检测抗体sa-hrp预混物相比,将sa-hrp和生物素-hrp预混合并将其与检测抗体混合物分开探测增加了信号。生物素-hrp和sa-hrp的组合使用探索了生物素-hrp与sa-hrp组合使用的目的是提高信号检测对微阵列的灵敏度。我们首先尝试将不同比例的sa-hrp与生物素-hrp预混合30分钟,然后用于探测。将捕获抗体和抗原点样到微阵列载玻片上,如图11a-g所示。不同的sa-hrp/生物素-hrp组合在图11h-m中示出。将孔封闭,然后用由30u/ml的ca15-3、2ng/ml的cyfra21.1、15ng/ml的erbb2和50ng/ml的cea组成的抗原混合物探测。将孔用由1μg/ml的ca15-3b-b、20μg/ml的c1299-87o-b、8μg/ml的baf1129和5μg/ml的af3506b组成的检测抗体混合物探测。检测混合物分别探测或在探测之前与sa-hrp预混。用2分钟/2分钟/8分钟的enzmet银显影方案将载玻片显影。结果表明,用sa-hrp/生物素-hrp预混物探测的孔的信号高于仅用sa-hrp探测或dab混合物/5xsa-hrp预混物探测的孔的信号。另外,sa-hrp/生物素-hrp预混物的最佳浓度分别为4μg/ml和2μg/ml。任何试剂的更高浓度都没有达到更高的信号。也通过利用omingrid300微阵列打印机打印的载玻片(在其上采用tmb-mx检测方法)探索了sa-hrp/生物素-hrp预混物的组合使用。如图11n所示,将与生物素缀合的各种浓度的bsa点样在微阵列载玻片上。将孔封闭,然后用各种sa-hrp/生物素-hrp组合探测10分钟。载玻片用tmb-mx显影4分钟。将斑点信号量化,结果表明,用sa-hrp/生物素-hrp预混物探测的孔比单独的sa-hrp具有更高的信号。另外,sa-hrp/生物素-hrp预混物的最佳浓度分别为4μg/ml和4μg/ml。sa-hrp/生物素-hrp预混物在8μg/ml和4μg/ml时具有更高的信号但也具有更高的背景。一旦确定了适当浓度的sa-hrp和生物素-hrp,我们还测试了我们是否可以缩短sa-hrp/生物素-hrp混合物的温育时间,如图12a-b所示。用捕获抗体及其相应的抗原并列点样载玻片(图12a)。将孔用由60u/ml的ca15-3、4ng/ml的cyfra21.1、50ng/ml的cea和30ng/ml的erbb2组成的抗原混合物探测30分钟。将孔用pbst洗涤,然后用由1μg/ml的10-ca15-3b-b、5μg/ml的af3506b、20μg/ml的c1299-87o-b和8μg/ml的baf1129组成的检测抗体混合物探测15分钟。在pbst洗涤后,将孔随后用4μg/ml的sa-hrp/2μg/ml的生物素-hrp探测10分钟或5分钟。然后用2分钟/2分钟/8分钟的enzmet银显影方案将载玻片显影。结果在图12b中示出。我们发现,在用sa-hrp/生物素-hrp仅探测5分钟后,信号减少。由此,我们使用10分钟的sa-hrp/生物素-hrp温育时间用于后续的实验。为了减少sa-hrp/b-hrp温育时间,将两种试剂的浓度增加至更高。将不同浓度的bsa-生物素打印到环氧涂布的载玻片上,如图11a-g所示。将载玻片用浓度分别为64μg/ml/32μg/ml、32μg/ml/16μg/ml、16μg/ml/8μg/ml、8μg/ml/4μg/ml的sa-hrp/b-hrp探测2分钟。将斑点用tmb显影2分钟,并在arrayit比色扫描仪上成像。结果可见于图39。从平均计数中减去背景后,64μg/ml/32μg/ml的sa-hrp/b-hrp在bsa-生物素的所有浓度下具有最高信号。结果是,64μg/ml的sa-hrp和32μg/ml的b-hrp的混合物用于全部2分钟sa-hrp/b-hrp温育时间的后续测定。2e:信号显影比色检测使用银色显影进行最初的工作,这是一种比色检测方法,其中hrp在还原剂和过氧化氢存在下催化银离子的还原。该方法称为enzmet,需要依次以严格的摩尔比添加三种溶液,硝酸银、氢醌和过氧化氢。当我们使用仪器原型测试我们的微流体盒中的测定时,实施银显影被证明是困难的。首先,银显影需要三个单独的试剂,这些试剂需要按顺序和以确定的体积释放到测定室中。此外,试剂之间的任何污染都会导致储罐和通道中的过早的银沉积。试剂对离子也非常敏感,因为任何与离子的接触也可能导致过早的非特异性银沉积。考虑到所有其他试剂都含有离子,这可能会导致问题。因此,我们探索了其他比色检测方法,例如tmb-mx。用于信号显影的tmb-mxtmb(3,3',5,5'-四甲基联苯胺)是辣根过氧化物酶(hrp)的基底,并且非常普遍地用于elisa。我们通过使用tmb-mx使这种基底适用于微阵列,tmb-mx是一种过氧化物酶基底,它在反应部位产生不溶的蓝色沉淀,且几乎没有背景(moss基底)。我们的tmb-mx初始测试涉及微阵列,其中sa-hrp以各种浓度(0.5μg/ml、1μg/ml、2μg/ml和4μg/ml)点样到微阵列载玻片上,一式两份(图13a)。在封闭和洗涤之后,将阵列用tmb-mx温育8分钟,然后用蒸馏水漂洗以停止反应。将载玻片在genepix微阵列扫描仪中扫描,将图像量化。tmb-mx产生强烈且剂量依赖性的信号(图13b和13c)。这种剂量依赖性在图13c中图示出;然而,信号似乎在2μg/mlsa-hrp时变得饱和。将捕获抗体和抗原手动点样到微阵列载玻片上,以观察我们是否可以减少tmb-mx暴露的时间(图14a-d)。将所有四个孔用由ca15-3(30u/ml)、cyfra21.1(2ng/ml)和erbb2(15ng/ml)组成的抗原混合物探测30分钟。在pbst漂洗后,将所有四个孔用由1μg/ml的10-ca15-3b-b、5μg/ml的af3506b和8μg/ml的af1129b组成的检测抗体混合物探测15分钟。在pbst漂洗后,将所有四个孔分别用4μg/ml和2μg/ml的sa-hrp/生物素-hrp混合物探测10分钟。在pbst漂洗后,将孔随后用tmb-mx探测2分钟、4分钟、6分钟或8分钟。结果在图14a、b、c和d中示出。定性地来看,2分钟的tmb-mx暴露不足以获得高信号,但是4分钟、6分钟或8分钟的tmb-mx暴露给出了等价的信号。3:抗体微阵列构造3a:微阵列基底抗体微阵列需要将抗体固定在表面上。这可以通过吸附或共价固定发生。这些表面的功能不仅是提供可以固定抗体的支持物,而且还应该表现出最大的结合特性并保持抗体天然构象和活性。还需要显示最小的非特异性结合,以最小化检测系统中的背景噪声。通过分子吸附进行的固定化通过分子间力发生,主要是离子键和疏水和极性相互作用。这导致抗体层是异质的并且随机取向,因为每个分子可以在不同方向上形成任何接触,以最小化与基底和先前吸附的蛋白质的排斥相互作用。因此,吸附受到固定化蛋白质的几何尺寸的限制,高密度填充物可以空间封闭抗体的活性位点,从而干扰它们的结合能力。抗体和蛋白质也可以吸附在涂有硝酸纤维素或凝胶的载玻片上。水凝胶是三维载体,其中捕获分子扩散到多孔结构中。这导致改善的吸附能力,但抗体仍然是随机取向和弱附着的。此外,与质量传递效应有关的问题和来自非特异性相互作用的高背景信号可能干扰测定准确度和灵敏度(nimse等,2014)。在共价固定化期间,抗体或蛋白质通过可接触的暴露氨基酸官能团与固定载体共价结合。这导致不可逆的结合并产生高表面覆盖。通过氨基酸侧链的化学结合通常是随机的,因为其基于通常存在于蛋白质外部的残基。附着可以通过许多残基同时发生,增强固定化蛋白质群体的异质性。可以靶向许多不同的官能团,包括胺、硫醇、羧基和羟基。胺基团可以通过nhs、醛或环氧树脂涂布的载玻片共价附接到载体上。载体与nh2基团反应形成强酰胺键。通常,赖氨酸侧链反应,但反应也可以与n-末端发生。位于外部暴露的半胱氨酸中的硫醇基团可与马来酰亚胺涂布的载玻片反应。马来酰亚胺双键与硫醇基团进行加成反应,形成稳定的硫醚键。然而,通过暴露于还原试剂,这种连接是可逆的。位于外部暴露的谷氨酸和天冬氨酸的羧基可以使用碳二亚胺与胺涂布的载玻片反应。丝氨酸和苏氨酸侧链上的羟基可与环氧树脂涂布的载玻片反应,因此使环氧树脂涂布的载玻片不仅能与胺反应,还能与羟基反应(zhuandsnyder,2003)。为了确定哪种是用于抗原斑点的最佳载玻片表面,我们测试了3种不同生理化学性质的微阵列表面。测试了环氧硅烷载玻片(例如来自schott的载玻片e和来自arrayit的superepoxy载玻片)以及涂布有用n-羟基琥珀酰亚胺(nhs)酯官能化的聚合物薄膜或3-d聚合物的载玻片。将各种量的四种抗原(ca15-3、cyfra21.1、erbb2和cea)点样在每种类型的表面上。尽管三种载玻片中信号强度和斑点形态有相似之处,但由于其与聚合物涂布表面在室温下具有优异的稳定性,因此选择了来自信誉良好的供应商的环氧硅烷涂层载玻片作为阵列基底。进行另外的测试以确认环氧涂布的载玻片适合于我们的微阵列测定。测试了以氨基硅烷和醛涂布的备选载玻片。氨基硅烷涂布的载玻片显示与抗体上的羧基共价结合的胺基。醛涂布的载玻片显示出与抗体上的胺基共价结合的醛基。将erbb2捕获抗体和抗原打印到全部三种载玻片类型上。在封闭后,将载玻片用15ng/ml的erbb2抗原和erbb2检测抗体(4μg/ml)探测。在利用sa-hrp/b-hrp和tmb信号显影后,通过arrayit比色扫描仪将载玻片成像。打印布局和得到的图像显示在图40a-c中。当在环氧涂布的载玻片上打印时,erbb2cab显示出最高的信号。erbb2cab在氨基硅烷载玻片上没有信号,在醛涂布的载玻片上只有弱信号。erbb2抗原斑点在所有载玻片类型上都有信号,但环氧涂布的载玻片具有最高信号。这证实环氧涂布的载玻片适用于高测定信号。3b:点样缓冲剂最初,我们通过在1x磷酸盐缓冲剂盐水(pbs)中稀释抗体和抗原来进行微阵列载玻片的点样。我们测试了其他点样缓冲剂以确定抗体和抗原的扩散,以获得更好的斑点均匀性。甘油已显示出有助于保持之前的斑点大小和形态(olle等,2005;richens等,2015)。我们点样了在1xpbs或1xpbs 20%甘油中的25μg/ml的捕获抗体10-ca15-3a,然后将点样的阵列用30u/ml的ca15-3抗原探测1小时,并用20μg/ml的其生物素化检测抗体10-ca15-3b-b探测30分钟。用sa-hrp检测信号30分钟,并用enzmet银显影剂(2分钟/2分钟/8分钟)显影。结果在图15a-b中示出。向点样缓冲剂中加入20%甘油可使抗体更均匀地扩散。其还导致更圆形的斑点形状。我们还研究了对于点样缓冲剂的备选添加剂,例如洗涤剂和2’3’-丁二醇。添加1%吐温-20或30%2’3-丁二醇改善了信号强度、抗体扩散或斑点形态。对于大多数捕获抗体,我们使用含有1xpbs,5%甘油和0.02%十二烷基肌氨酸(tad打印缓冲剂)的点样缓冲剂,除了cea,c1299-87w,其在1xpbs中打印时提供改善的信号。如图16a-b所示,c1299-87w打印在1xtad打印缓冲剂中(图16a)或1xpbs中(图16b)。在两个实验中,c1299-87w以大约1000μg/ml的浓度打印,用200ng/ml的cea抗原(c3100-14)探测,用20μg/ml的cea生物素化检测抗体(c1299-87o-b)检测,进行sa-hrp/生物素-hrp(分别为4μg/ml和2μg/ml)和enzmet银检测(2分钟/2分钟/8分钟)。突出显示c1299-87w斑点。与左侧的斑点相比(图16a),在1xpbs中点样c1299-87w显著增加了信号(图16b)。我们发现一些抗体在某些条件下使用甘油或tad打印缓冲剂不能很好地打印,例如,当与omnigrid300微阵列一起使用时。大多数抗体和抗原在pbs中打印良好。然而,低浓度的一些抗体和抗原未能在pbs中打印,因为蛋白质的总浓度非常低。结果,我们在1xpbs 0.25mg/mlbsa中打印抗体和抗原。对于低浓度抗体和抗原这增加了蛋白质总浓度,并改善了打印。因此,将1xpbs 0.25mg/mlbsa用作我们的打印缓冲剂,以用于利用omnigrid300打印的微阵列实验。最初,用genemachinesomnigrid300将捕获抗体和抗原点样在1xpbs中。测试了其它点样缓冲剂,包括牛血清白蛋白(bsa)和/或十二烷基肌氨酸钠,一种离子型表面活性剂。结果在图41a-b中示出。用1xpbs或1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa作为打印缓冲剂将ca15-3捕获抗体和抗原打印在环氧涂布的载玻片上。然后将载玻片用30u/mlca15-3抗原和ca15-3检测抗体探测。在信号显影后,用arrayit比色扫描仪将载玻片成像。添加十二烷基肌氨酸钠和bsa提高了捕获抗体和抗原的信号强度(图41a)。这些打印缓冲剂添加剂还分别增加了斑点直径,并减少了捕获抗体和抗原复制斑点中的变化(图41b)。图41c显示了嵌图a和b中所示结果的cab和抗原的平均%变异系数(cv)。3c:打印方法对于微阵列打印,已经采用了多种策略,这取决于测定开发的不同阶段所需的阵列的配置和大小。当测试各种条件或当打印参数已经最终确定需要高的点密度和均匀形态时,机器人系统如arrayitspotbot3(arrayit)和microgridiimicroarrayer(biorobotics)已成功用于打印微阵列。为了减少阵列打印成本并缩短周转时间,使用定制的硅酮隔离器手动点样用于初步微阵列实验的阵列,特征是尺寸分别为约7mm×7mm的16(8×2)个孔。它们可以通过表面张力粘附在阵列基底的表面上,因此可以容易地除去。每个孔含有9(3×3)或16(4×4)个斑点。9斑点隔离器的斑点直径为1mm,而16斑点隔离器的斑点直径为0.75mm。由于在手动点样的载玻片上产生的相对较大的液滴和打印缓冲剂中存在甘油,在环境胺反应发生所需的室温下于湿度室中过夜温育后,没有发生斑点的彻底干燥,因此,液滴中的一些蛋白质不能与基底的表面直接接触,导致信号损失。结果,在室温下在湿度室中过夜温育后,取出载玻片并在4℃下干燥24小时,然后在1xpbst中多次漂洗。然后将载玻片在封闭缓冲剂中封闭1小时。为了比较在硅酮隔离器和微阵列打印机之间打印的载玻片产生的信号,将不同的样品送到位于亚利桑那的appliedmicroarrayinc.和蒙特利尔的nrc-bri的不同微阵列打印机上以打印多批载玻片。最后,genemachinesomnigrid300微阵列打印机在内部设置,可在控制良好的gui软件中提供高容量(高达308个载玻片)和强大性能,便于实验设计。与arrayit提供的smp3b销针一起,能够在单个孔中打印144个斑点(每个斑点直径约220微米)。在16孔板式中,在单个载玻片中打印了总共2304个斑点。用不同的生物标志物样品打印多批载玻片。从打印的载玻片产生的信号是令人满意的。需要进一步优化打印参数(加载参数、清洁程序和接触时间)。尽管使用隔离器的手动点样对于初步实验是有用的,但它们在重复之间具有太多的可变性。因此,genemachinesomnigrid300是一种机器人微阵列打印机,能够一次打印多达300个载玻片,其用于自动地打印载玻片。omnigrid300还允许在每个载玻片上打印8×2阵列以用于台式处理,或者用于微流体盒中的单场载玻片。用微阵列套管针smb3b(telechem)打印载玻片,得到直径约150-400um的斑点。使用omnigrid300在约50%湿度下打印载玻片。打印后,载玻片在70%湿度下保持在打印机中过夜,以允许抗体/抗原固定化。然后在第二天将载玻片干燥,然后用1xpbst多次漂洗。将载玻片在封闭缓冲剂中封闭1小时。3d:封闭和温育缓冲剂用1xpbs 0.05%tween(pbst) 2%bsa封闭初步微阵列,该缓冲剂与我们的elisa测定中使用的缓冲剂相同。在室温下伴随振荡封闭1小时后,观察到高的非特异性背景。正如之前曾尝试过的那样(richensetal.,2009),bsa浓度从2%增加到5%,改善了背景噪音。首先,在含有1xpbst和5%bsa的封闭缓冲剂中进行封闭后续的温育步骤。为了促进抗原-抗体相互作用,我们尝试在具有较低离子强度的温育缓冲剂中进行测定(reverberiandreverberi,2007)。点样两种捕获抗体,50μg/ml和25μg/ml的10-ca15-3a以及500μg/ml和250μg/ml的mab1129。随后将孔用在1xpbst 5%bsa或0.25xpbst 5%bsa中稀释的30u/ml的ca15-3和15ng/ml的erbb2探测30分钟。随后将孔用在探测缓冲剂中稀释的检测抗体/5xsa-hrp混合物探测15分钟。包含的检测抗体是1μg/ml的10-ca15-3b-b和4μg/ml的baf1129。然后利用enzmet银显影剂(2分钟/2分钟/8分钟)将信号显影。结果可见于图17a-b。当使用较低离子强度缓冲剂时,对ca15-3和erbb2都获得更高的信号。因此,我们得出结论,降低离子强度可以帮助抗体-抗原相互作用,因此用于后续的实验中。3d:微阵列温育时间我们最初开始的温育试剂的微阵列实验的时间与elisa实验中使用的时间相似,每个温育步骤通常为1小时。然而,由于最终产品将是在尽可能短的时间内进行的测定,我们开始尝试更短的温育时间。在此示出的这种实验的一个实例是在机器人打印的捕获抗体载玻片(appliedmicroarrays)上进行的。捕获抗体10-ca15-3a和mab1129分别以500μg/ml点样。将30u/ml的ca15-3和15ng/ml的erbb2的抗原混合物温育15分钟、30分钟或60分钟(图18a-f)。随后,将1μg/ml的10-ca15-3b-b和4μg/ml的baf1129的检测抗体混合物施加在载玻片上15分钟、30分钟或60分钟(图18g-l)。在这些步骤之后,将孔用4μg/ml的sa-hrp探测30分钟。然后用enzmet银显影剂(2分钟/2分钟/8分钟)将斑点显影。如ca15-3斑点所示,产生足够量化的信号的抗原混合物的最短温育时间各自为30分钟(图18a-f)。对于检测抗体,可检测信号需要15分钟的温育(图18g-l)。3e:所得微阵列测定图19中示出了优化的微阵列测定实例孔。使用omnigrid300将144个捕获抗体和抗原打印到环氧涂布的载玻片上并使其固定过夜。第二天,将载玻片在1xpbs 5%bsa中封闭1小时。随后将孔用含有8种癌症生物标志物的抗原混合物探测30分钟:ca15-3(60u/ml)、cyfra21-1(8ng/ml)、cea(20ng/ml)、ca72-4(40u/ml)、ca19-9(148u/ml)、erbb2(60ng/ml)、铁蛋白(200ng/ml)和mmp7-4(20ng/ml)。在用pbst简单洗涤后,将孔用检测抗体混合物探测15分钟。所有检测抗体均为生物素化的以允许sa-hrp识别。将孔再次用pbst简单洗涤,并用4μg/mlsa-hrp和4μg/ml生物素-hrp的混合物探测10分钟。在用1xpbst洗涤5分钟后,反应斑点用tmb-mx显影4分钟。将载玻片用arrayit比色扫描仪扫描,并通过imagej量化。除捕获抗体的打印外,还打印抗原以标准化检测抗体量的差异。抗原以至少三种不同的浓度打印,以产生抗原标准曲线。在探测多个孔的实验中,使用每个抗原斑点的平均值来产生平均标准曲线(图20)。这些检测抗体浓度和所得信号的标准化小变化可以反过来用于标准化捕获的抗体信号。为了生成每种生物标志物的标准曲线,用已知浓度的抗原探测每个孔。得到的捕获抗体信号(图19)用给定生物标志物的平均抗原曲线标准化。通过使用平均抗原曲线的斜率,将信号转换为相对浓度(图20)。然后将该相对浓度相对于已知的抗原浓度作图,如图21所示。这些曲线针对所有8种生物标志物生成。即使用相同的抗原浓度探测,两个孔之间也会发生变异。变异水平可以用变异系数(cv)量化。为了确定变异系数,捕获抗体的重复品信号的标准偏差除以捕获抗体的复制品信号的平均值并乘以100,得到%cv。对于免疫测定,低于20%的变异系数被认为是可接受的变异水平。孔内变异(intra-variation)是在相同载玻片上以相同浓度探测的多个孔的平均%cv。孔间变异(inter-variation)是于可能的不同日期在不同的载玻片上以相同浓度探测的多个孔的平均%cv。计算所有生物标志物的孔内变异。ca12-3和ca19-9的孔内变异如表12所示。在可接受的变化范围内,ca15-3和ca19-9的孔内变异均低于20%。表12:ca15-3和ca19-9的孔内变异还对生物标志物检查了孔间变异。在三个单独的实验中,在三个不同的日期用相同浓度的抗原探测孔。cv%由指定的捕获抗体的复制斑点计算(表13)。然后将来自这三个实验的cv%平均以产生各生物标志物的孔间变异。结果在表13中示出。各生物标志物的孔间变异低于15%,表明测定是精确的。表13:生物标志物的孔间变异我们的测定还与每种生物标志物的fda批准或ce标记的elisa试剂盒进行了比较,以确定我们的测定与fda批准的测定相比如何。使用elisa试剂盒和我们的微阵列产生标准曲线。还用elisa试剂盒和微阵列测定了用于每种生物标志物的三种已知浓度。这些浓度跨越了低、中、高范围的标准曲线。使用每个测定产生的标准曲线,确定并比较这三种“未知数”的浓度。使用cyfra21-1的实例在图22中示出。对于cyfra2-1,我们将我们的测定与fda批准的来自fujierbioinc.的elisa试剂盒进行了比较。使用配对t检验比较两种检测方法,并在bland-altman图中视觉表示。通过我们的测定确定的浓度与fujierbio的elisa测定具有95%的可接受性。时间是诊断心脏病发作的关键。任何延迟治疗都会降低患者获得良好结果的机会。由此,我们希望减少总测定时间,特别是对于心血管生物标志物组。最初,心血管组的总测定时间为27分钟:10分钟抗原温育,10分钟检测抗体温育,5分钟sa-hrp/生物素-hrp温育和2分钟tmb温育。我们将总测定时间减少至10分钟:4分钟样品温育,2分钟检测抗体温育,2分钟sa-hrp/生物素-hrp温育和2分钟tmb温育。即使总测定时间缩短,我们也可以保持高水平的信号和灵敏度。为了减少总测定时间,必须改变测定的一些变量。具体来说,我们提高了捕获抗体和检测抗体的浓度。例如,对于肌红蛋白的检测,在较长的测定中,捕获抗体(cab)浓度范围为80μg/ml至10μg/ml。在将测定时间减少至10分钟后,肌红蛋白捕获抗体浓度提高至800μg/ml至12.5μg/ml的跨度。类似地,在27分钟的较长肌红蛋白测定中,50ng/ml的检测抗体(dab)浓度足以检测肌红蛋白抗原。在测定时间减少后,肌红蛋白检测抗体浓度升至1μg/ml。然而,在这些条件改变时,我们保持了肌红蛋白信号。图42示出了当用22ng/ml肌红蛋白和不同的检测抗体浓度探测时的捕获抗体的平均信号。尽管该测定法比较长的测定法短得多,但较短的测定法在改变的条件下显示出更高的信号。因此,我们得出结论,10分钟的测定时间足以检测测试的心血管生物标志物。3f:用微流体盒和仪器进行的免疫测定我们将抗体微阵列测定实施到我们的微流体盒和仪器中。在用于与微流体盒正确对准的载玻片中心处用omnigrid300打印环氧涂布的载玻片。在固定化之后,将载玻片封闭并附接至微流体盒。湿盒在分开的储罐中装载有用于免疫测定的试剂;由ca15-3校准剂(40u/ml)组成的抗原混合物,由ca15-3检测抗体(10-ca153b-b:0.5μg/ml)组成的检测抗体混合物,sa-hrp/生物素-hrp(4μg/ml/4μg/ml)。装载到湿盒中的其它试剂包括:1xpbs、蒸馏水和tmb-mx。将干盒和湿盒组装并插入仪器中。运行脚本以自动执行测定以及获取最终图像,如图23所示。该测定能够使ca15-3捕获抗体斑点和抗原斑点的结果显影。由于使用检测抗体的高浓度,存在额外的交叉反应性斑点。一旦在实验室中优化了测定,我们便将微阵列测定整合到微流体盒中。将诸如抗原、检测抗体混合物、sa-hrp/生物素-hrp、tmb等试剂和诸如pbst和dh20等缓冲剂预先装载到湿盒中(图44c)。将用心脏标志物捕获抗体和抗原点样的载玻片附接于干盒。湿盒预先装载有试剂。r1装载有tmb,r2装载有dh2o,r3装载有sa-hrp/生物素-hrp,r4装载有pbst,r5装载有pbst,r6装载有抗原样品,r7装载有检测抗体混合物,r8装载有pbst。然后将盒放入一种我们的初始仪器原型,并通过仪器软件运行脚本。仪器自动获取空白和斑点图像(图43)。然后可以用仪器将这些斑点量化为光密度。结果表明该机器能够自动处理微阵列测定并显影出比色可量化的结果。4:微阵列测定的微流体盒的开发4a:分开的湿盒和干盒的设计将湿组分和干组分分到两个分开的盒中(图24a-b),其中图24a显示了干盒15和湿盒16的俯视图,其中玻璃载玻片11介于两盒之间。图24b示出了干盒15和湿盒16的侧视叠放图。干盒含有限定阵列室12以及微流体通道17的孔隙和仪器歧管口14,所述微流体通道17将试剂和/或缓冲剂从湿盒中的储罐经阵列室12带到同样在湿盒中的废物储罐。流体阻隔膜22可介于通道和仪器歧管口之间。弹性密封件20可利用压敏粘合剂21在仪器歧管口周围粘附于干盒顶部。含有捕获抗体的玻璃微阵列载玻片11可通过压敏粘合剂21粘附于干盒,其也可粘附于干盒的底部以使其附接于湿盒。湿盒16含有用于通过阵列室后的所用试剂的储罐18(用于试剂和缓冲剂的个体储罐3至10以及废物储罐1和2),以及标签13,以便于处理。干盒15和湿盒16可由相同或不同类型的材料制成。在一些实施方式中,干盒的一部分可以由聚对苯二甲酸乙二醇酯23激光切割而成,具有聚碳酸酯19部分,而湿盒可以由聚碳酸酯19制成。干盒15的分离允许在即将组装之前插入微阵列玻璃载玻片,以及根据特定生物化学测定和关于测定时机的灵活性而对盒进行定制。类似地,湿盒16的分离允许试剂装载的简单性和灵活性。对于干盒,每个试剂通道与缓冲剂通道连接,以冲洗掉使用期间留在通道中的任何残留试剂。干盒的一个实施方式在图25a中示出。在图25a中,附图标记在本文中的指代如下:i)11:玻璃载玻片;ii)12:阵列室;iii)22:透气膜;iv)25:从废物储罐2(w2)至干盒中通道(cw2)的端口v)26:废物储罐1(w1)的通气口vi)27:废物储罐2(w2)的通气口vii)28:缓冲剂储罐1的通气口(b1v)viii)29:试剂储罐2的通气口(r2v)ix)30:试剂储罐3的通气口(r3v)x)31:缓冲剂储罐4的通气口(b4v)xi)32:缓冲剂储罐5的通气口(b5v)xii)33:试剂储罐6的通气口(r6v)xiii)34:试剂储罐7的通气口(r7v)xiv)35:缓冲剂储罐8的通气口(b8v)xv)36:缓冲剂储罐1的通道(b1c)xvi)37:试剂储罐2的通道(r2c)xvii)38:试剂储罐3的通道(r3c)xviii)39:缓冲剂储罐4的通道(b4c)xix)40:缓冲剂储罐5的通道(b5c)xx)41:试剂储罐6的通道(r6c)xxi)42:试剂储罐7的通道(r7c)xxii)43:缓冲剂储罐8的通道(b8c)xxiii)45:w1至干盒中通道(postc)的端口xxiv)46:至废物储罐2的通道(cw2)xxv)47:从b1c和r2c至主结点的通道(c1/2)xxvi)48:从b4c和r3c至主结点的通道(c3/4)xxvii)49:从b5c和r6c至主结点的通道(c5/6)xxviii)50:从b8c和r7c至主结点的通道(c7/8)xxix)51:阵列室前通道(prec)xxx)52:阵列室后通道(postc)xxxi)56:样品托座;xxxii)104:孔隙xxxiii)106:主结点xxxiv)107:用于与湿盒对准的凹口;xxxv)108:用于与湿盒对准的防错装置(pokeyoke)图25a所示的干盒中的通道和孔隙的位置和尺寸如下:i)b1c,b4c,b5c,b8c:长14mm,宽2mm;ii)r2c,r3c,r6c,r7c:长11mm,宽2mm;iii)c1/2:长16mm,宽1mm;iv)c3/4:长8mm,宽1mm;v)c5/6:长16mm,宽1mm;vi)c7/8:长32mm,宽1mm;vii)prec:长17mm,宽1mm;viii)postc:长122mm,宽1-1.5mm;ix)孔隙:面积为100mm2;x)具有载玻片的阵列室:体积25mm2。在操作中,储罐2的试剂通道r2c(37)与储罐1的缓冲剂通道b1c(36)连接;储罐3的试剂通道r3c(38)与储罐4的缓冲剂通道b4c(39)连接;储罐6的试剂通道r6c(41)与储罐5的缓冲剂通道b5c(40)连接,并且储罐7的试剂通道r7c(42)与储罐8的缓冲剂通道b8c(43)连接(图25a)。一旦试剂从指定的储罐中推出,则从其缓冲剂储罐对推送缓冲剂就可以冲洗通道中剩余的试剂(例如c1/2(47))。这些构造可减少或防止试剂之间的交叉污染。我们也将所有试剂/缓冲剂通道对与主结点连接以减少或防止试剂之间的交叉污染。一旦试剂或缓冲剂通过其通道从其储罐中推出,则流体经过其通道(例如r2c(37)或b1c(36)和c1/2(47))到达主结点106。从这里,流体可以被推到第一或第二废物储罐w2(27)或w1(26)。首先将所有试剂推至w2,以“灌注”储罐并将任何气泡清除到w2(26)中。一旦试剂“灌注”,则从储罐到主结点的整个通道都填充了指定的液体。然后推动w1(27),其允许流体以指定的溶液填充阵列室。这允许在试剂和打印在载玻片上的抗体之间进行任何相互作用,或者在缓冲剂的情况下允许任何非特异性相互作用从阵列室清除并进入w1(27)。图25b示出了干盒的备选实施方式。在图25b中,附图标记在本文中的指代如下:i)11:玻璃载玻片;ii)12:阵列室;iii)25:从废物储罐2(w2)至干盒中通道(cw2)的端口iv)36:缓冲剂储罐1的通道(b1c)v)37:试剂储罐2的通道(r2c)vi)38:试剂储罐3的通道(r3c)vii)39:缓冲剂储罐4的通道(b4c)viii)40:缓冲剂储罐5的通道(b5c)ix)41:试剂储罐6的通道(r6c)x)42:试剂储罐7的通道(r7c)xi)43:缓冲剂储罐8的通道(b8c)xii)45:w1至postc的端口xiii)46:至废物储罐2的通道(cw2)xiv)51:阵列室前通道(prec)xv)52:阵列室后通道(postc)xvi)80:主通道(mainc)xvii)81:聚四氟乙烯膜m1/2xviii)82:聚四氟乙烯膜m3/4xix)83:聚四氟乙烯膜m5/6xx)84:聚四氟乙烯膜m7/8xxi)104:孔隙xxii)107:用于与湿盒对准的凹口xxiii)108:用于与湿盒对准的防错装置图25b所示的干盒中的通道和孔隙的位置和尺寸如下:i)25:w2的端口,0.79mm2ii)36:b1c,15mmiii)37:r2c,11mmiv)38:r3c,21mmv)39:b4c,15mmvi)40:b5c,15mmvii)41:r6c,12mmviii)42;r7c,11mmix)43:b8c,15mmx)45:w1至干盒中postc通道的端口,0.79mm2xi)46:cw2,11mmxii)51:prec,20mmxiii)52:postc,37mmxiv)80mainc,52mmxv)81:m1/228m,mm2xvi)82:m3/4,28mm2xvii)83:m5/6,28mm2xviii)84:m7/8,28mm2xix)104:孔隙,100mm2在操作中,试剂将从湿盒中的试剂储罐4、5、8或9经其各自的通道37、38、41或42推送至主通道80。当试剂通过通道时,它将在膜81、82、83或84下面通过。膜将试剂暴露在空气中,允许试剂内的任何气泡进入大气。一旦在主通道80中,则试剂将首先经cw2(46)推送至w2(25)的端口。这允许废物试剂进入w2(2)。当试剂通过通道时,它将在膜81、82、83或84下面通过。膜将试剂暴露在空气中,允许试剂内的任何气泡进入大气。一旦在主通道80中,则试剂将首先经cw2(46)推送至w2(2)。这将确保从试剂中除去所有空气。随后试剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。试剂将在postc(52)中继续至w1(45)的端口并进入w1(1)。这将确保从试剂中除去所有空气。随后试剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。试剂将在postc(52)中继续至w1(1)。在阵列室中试剂温育后,用配对的缓冲剂冲掉剩余的试剂。缓冲剂将从湿盒中的缓冲剂储罐3、6、7或10经其各自的通道36、39、40或43推送。当缓冲剂通过通道时,它将在膜81、82、83或84下面通过。膜将试剂暴露在空气中,允许缓冲剂内的任何气泡进入大气。一旦在主通道80中,则缓冲剂将首先经cw2(46)推送至w2(25)的端口并进入w2(2)。这将确保从缓冲剂中除去所有空气。随后缓冲剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。缓冲剂将在postc(52)中继续至w1(45)的端口并进入w1(1)。图25c示出了干盒的备选实施方式。在图2cb中,附图标记在本文中的指代如下:i)11:玻璃载玻片;ii)12:阵列室;iii)25:从废物储罐2(w2)至干盒中cw2通道的端口iv)26:废物储罐1(w1)的通气口v)27:废物储罐2(w2)的通气口vi)28:缓冲剂储罐1的通气口(b1v)vii)29:试剂储罐2的通气口(r2v)viii)30:试剂储罐3的通气口(r3v)ix)31:缓冲剂储罐4的通气口(b4v)x)32:缓冲剂储罐5的通气口(b5v)xi)33:试剂储罐6的通气口(r6v)xii)34:试剂储罐7的通气口(r7v)xiii)35:缓冲剂储罐8的通气口(b8v)xiv)36:缓冲剂储罐1的通道(b1c)xv)37:试剂储罐2的通道(r2c)xvi)38:试剂储罐3的通道(r3c)xvii)39:缓冲剂储罐4的通道(b4c)xviii)40:缓冲剂储罐5的通道(b5c)xix)41:试剂储罐6的通道(r6c)xx)42:试剂储罐7的通道(r7c)xxi)43:缓冲剂储罐8的通道(b8c)xxii)45:w1至干盒中postc通道的端口xxiii)46:至废物储罐2的通道(cw2)xxiv)47:从b1c和r2c至主结点的通道(c1/2)xxv)48:从b4c和r3c至主结点的通道(c3/4)xxvi)49:从b5c和r6c至主结点的通道(c5/6)xxvii)50:从b8c和r7c至主结点的通道(c7/8)xxviii)51:阵列室前通道(prec)xxix)52:阵列室后通道(postc)xxx)56:样品托座;xxxi)66:密封膜xxxii)80:主通道(mainc)xxxiii)104:孔隙,100mm2xxxiv)107:用于与湿盒对准的凹口在此实施方式中,图25c所示的干盒组件可具有下述尺寸:i)25:从废物储罐2(w2)至干盒中cw2通道的端口,0.79mm2ii)26:废物储罐1(w1)的通气口,1.13mm2iii)27:废物储罐1(w2)的通气口,1.13mm2iv)28:缓冲剂储罐1的通气口(b1v),1.13mm2v)29:试剂储罐2的通气口(r2v),1.13mm2vi)30:试剂储罐3的通气口(r3v),1.13mm2vii)31:缓冲剂储罐4的通气口(r4v),1.13mm2viii)32:缓冲剂储罐8的通气口(b8v),1.13mm2ix)33:试剂储罐6的通气口(r6v),1.13mm2x)34:试剂储罐7的通气口(r7v),1.13mm2xi)35:缓冲剂储罐8的通气口(r8v),1.13mm2xii)36:缓冲剂储罐1的通道(b1c),5mmxiii)37:试剂储罐2的通道(r2c),10mmxiv)38:试剂储罐3的通道(r3c),18mmxv)39:缓冲剂储罐4的通道(b4c),5mmxvi)40:缓冲剂储罐5的通道(b5c),5mmxvii)41:试剂储罐6的通道(r6c),10mmxviii)42;试剂储罐7的通道(r7c),9mmxix)43:缓冲剂储罐8的通道(b8c),5mmxx)45:w1至干盒中postc通道的端口,0.79mm2xxi)46:至废物储罐2的通道(cw2),15mmxxii)47:b1c和r2c至主结点(c1/2)的通道,10mmxxiii)48:b4c和r3c至主结点(c3/4)的通道,10mmxxiv)49:b5c和r6c至主结点(c5/6)的通道,10mmxxv)50:b8c和r7c至主结点(c7/8)的通道,10mmxxvi)51:阵列室前通道(prec),18mmxxvii)52:阵列室后通道(postc),27mmxxviii)56:样品口,0.79mm2xxix)66:密封膜,9.62mm2xxx)80:主通道(mainc),51mmxxxi)104:孔隙,100mm2在操作中,样品将首先经样品口(56)装载到试剂储罐中。试剂将从湿盒中的试剂储罐4、5、8或9经其各自的密封膜(66)推送入其各自的通道37、38、41或42中。试剂将进入其各自的缓冲剂/试剂通道47、48、49或50至主通道80。一旦在主通道80中,则试剂将首先经cw2(46)推送至w2(25)的端口。这允许废物试剂进入w2(2)。这将确保从试剂中除去所有空气。随后试剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。试剂将在postc(52)中继续至w1(45)的端口并进入w1(1)。这将确保从试剂中除去所有空气。随后试剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。试剂将在postc(52)中继续至w1(1)。在阵列室中试剂温育后,用配对的缓冲剂冲掉剩余的试剂。缓冲剂将从湿盒中的试剂储罐3、6、7或10经其各自的密封膜(66)推送入其各自的通道36、39、40或43中。试剂将进入其各自的缓冲剂/试剂通道47、48、49或50至主通道80。一旦在主通道80中,则缓冲剂将首先经cw2(46)推送至w2(25)的端口并进入w2(2)。这将确保从缓冲剂中除去所有空气。随后缓冲剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。缓冲剂将在postc(52)中继续至w1(45)的端口并进入w1(1)。湿盒中储罐的位置和尺寸经过优化,使得其可允许指定的体积。在示出湿盒的实施方式的图26和48c中,存在的附图标记在本文中的指代如下:i)1:废物储罐1(w1)ii)2:废物储罐2(w2)iii)3:缓冲剂储罐1(b1)iv)4:试剂储罐2(r2)v)5:试剂储罐3(r3)vi)6:缓冲剂储罐4(b4)vii)7:缓冲剂储罐5(b5)viii)8:试剂储罐6(r6)ix)9:试剂储罐7(r7)x)10:缓冲剂储罐8(b8)xi)13:操作标签xii)24:用于对准干盒的凹口107xiii)24:用于对准干盒的防错装置108xiv)25:w2至干盒的端口xv)44:样品孔xvi)45:w1至干盒的端口xvii)54:至阀门的端口xviii)55:至干盒的端口在图26中,储罐的尺寸如下:b8(10):储罐的体积为420μl。b8具有弯曲形状,用于在湿盒末端的凹口周围进行造型,以便与干盒接合。该储罐覆盖长15mm、宽10mm、深7mm的区域。r7(9):储罐的体积为260μl。r7为大致椭圆形,在基座上具有轻微凸起,以容纳额外的体积。该储罐覆盖长11mm、宽4mm、深7mm的区域。样品托座(44):宽5mm,长1.5mm,深7mm。其保持大约25μl的样品。r6(8):储罐的体积为226μl。r6为大致椭圆形。该储罐覆盖长11mm、宽3mm、深7mm的区域。b5(7):储罐的体积为420μl。该储罐为大致椭圆形,在侧面具有额外的三角形区域,以便容纳额外的体积。该储罐覆盖长约13mm、宽7mm、深7mm的区域。b4(6):储罐的体积为420μl。该储罐具有大致弯曲的形状以允许指定的体积,并且具有正确的端口对准。该储罐覆盖长约13mm、宽8mm、深7mm的区域。r3(5):储罐的体积为200μl。该储罐为大致椭圆形。该储罐覆盖长9mm、宽4mm、深7mm的区域。r2(4):储罐的体积为160μl。该储罐为大致椭圆形。该储罐覆盖长9mm、宽3mm、深7mm的区域。b1(3):储罐的体积为160μl。该储罐为大致椭圆形。该储罐覆盖长9mm、宽3mm、深7mm的区域。w2(2):储罐的体积为2100μl。该储罐具有u形。这种设计允许进入w2储罐的流体尽可能地远离通气口。这防止通气口的任何意外堵塞。w1(1):储罐的体积为大约3129μl。该储罐具有u形。进入入口的流体沿着盒的右边缘行进经过储罐,沿着盒的底边(靠近手柄)行进,然后沿盒的左边缘向上行进,直至其到达通气口。此外,在靠近右边缘的储罐底部附近增加了一个方形凸起。其被添加用于允许汇集进入流体。这防止进入的流体射到储罐的末端并堵塞通气口。在图48c中,储罐的尺寸如下:b8(10):储罐的体积为475μl。b8具有弯曲形状,以在湿盒末端的凹口周围进行造型,以便与干盒接合。该储罐覆盖长约19mm、宽约6mm、深约9mm的区域。r7(9):储罐的体积为300μl。r7为大致椭圆形,在基座上具有轻微凸起,以容纳额外的体积。该储罐覆盖长11mm、宽约4mm、深约9mm的区域。r6(8):储罐的体积为275μl。r6为大致椭圆形。该储罐覆盖长约11mm、宽约3mm、深约9mm的区域。b5(7):储罐的体积为450μl。该储罐为大致椭圆形,在侧面具有额外的三角形区域,以便容纳额外的体积。该储罐覆盖长约13mm、宽约6mm、深约9mm的区域。b4(6):储罐的体积为450μl。该储罐具有大致弯曲的形状以允许指定的体积,并且具有正确的端口对准。该储罐覆盖长约15mm、宽约4.5mm、深约9mm的区域。r3(5):储罐的体积为250μl。该储罐为大致椭圆形。该储罐覆盖长约9mm、宽约3mm、深约9mm的区域。r2(4):储罐的体积为300μl。该储罐为大致椭圆形。该储罐覆盖长约10mm、宽约4mm、深约9mm的区域。b1(3):储罐的体积为175μl。该储罐为大致椭圆形。该储罐覆盖长约9mm、宽约3mm、深约9mm的区域。w2(2):储罐的体积为2000μl。该储罐具有u形。该设计允许进入w2储罐的流体尽可能地远离通气口。这减少或防止通气口的任何意外堵塞。w1(1):储罐的体积为大约2000μl。该储罐具有u形。进入入口的流体沿着盒的右边缘行进经过储罐,沿着盒的底边(靠近手柄)行进,然后沿盒的左边缘向上行进,直至其到达通气口。此外,在靠近右边缘的储罐底部附近增加了一个方形凸起。其被添加用于允许汇集进入流体。这减少或防止进入的流体射到储罐的末端并堵塞通气口。底部层压体:图26和48c示出的湿盒具有层压底部。该层压体含有在储罐下方的预切洞,用于储罐装载。微阵列抗体载玻片将抗体打印到玻璃载玻片上,使得打印的斑点与阵列室对准。阵列室的位置和打印的斑点可以改变,只要它们彼此对准即可。抗体可以以50μm至300μm的斑点尺寸打印。5:仪器设计5a:泵和螺线管阀门系统压力驱动的流动由泵(68)产生。通过打开需要流体运动的选定储罐上方的阀门,并通过将废物储罐对大气打开,所述泵在所需方向上移动,使得所选储罐中的流体被推向大气,并允许相继的试剂递送。我们的仪器设计成使泵从试剂储罐中推出。通过在我们想要移动的试剂储罐(例如3)处打开螺线管阀门(65),流体将从储罐移向废物1或废物2(图28)。流体捕集器(64)确保来自储罐的液体不能进入歧管或阀门。密封膜(66)防止液体过早地离开储罐进入阵列室或干盒通道。然而,通过泵(68)的压力和特定阀门(65)的开放,液体可以穿过密封膜朝向w1(1)或w2(2)。如果我们希望灌注储罐,我们将溶液移至废物2(2)。这将减少或消除储罐中存在的任何气泡并将试剂带到主结点。接下来是推动废物1(1),其将使试剂穿过阵列室(12)并进入废物1储罐(1)。通过电机(vex:rb-inn-11)操作泵。废物1(1)和废物(2)的阀门都对大气打开,使空气可以逸出盒。作为另一选择,鲁尔端口(67)密封歧管,使得空气仅在歧管和盒内行进。电动机的旋转使泵移入和移出,从而导致流体的运动。盒式读取器包括用于推动或拉动指定体积空气的容积式空气泵。通过接地不锈钢销针轴向移动到泵腔中而使空气移位。销针通过固定径向密封件在腔体入口处密封。销针由步进电机驱动(haydonkerklc1574w-05)线性致动器直接移动。用接近传感器光学测量泵位置。可以自动校准泵以检测和校正跳过的步骤并考虑结构的变化。阀门允许自动控制泵、通气口和喷嘴之间的气动连接。阀门使用螺钉和面密封安装到歧管组件。歧管组件包括十一个阀门,并包括两个额外阀门的空插座,以利于将来的盒迭代。系统中包括压力传感器,以测量泵内的压力。应尽量减少压力传感器和传感器连接内的空气量,以改善系统响应。为了控制在给定时间打开哪个储罐,我们使用了螺线管阀门(parker:x-705l-f)。电磁阀门由机电致动以由软件打开。没有任何致动,则阀门关闭。如果泵将流体从试剂储罐推向废物储罐,打开到大气压,则阀门的开口允许空气进入储罐。图29示出了阀门的示意图,其显示了封闭端口69、公共端口70和常闭端口71。当阀门致动时,端口70和71打开,允许空气通过阀门。当阀门不再致动或关闭时,这些端口关闭。阀门放置在每个储罐上方,包括废物储罐(图28)。还放置了另外的阀门以用于通气,或允许泵在没有连接到盒中的情况下重新归零。5b:光学传感可以使用任何合适的光学传感系统。在一些实施方式中,仪器包括相机,例如usb相机(例如,leopardimaging:li-ov7725)和照明系统,使得软件能够获得斑点的图像。然后,软件可以基于相机拍摄的图像计算光密度。led阵列可以放置在斑点的场下方,使得照明允许斑点的图像(例如,life-oninc.)。仪器成像系统由光源组成,光源由4个白色led组成,它们透过半透明的丙烯酸扩散器,然后穿过湿卡的背面。湿盒由半透明聚碳酸酯制成,从而增加了照明的均匀性。led的闪烁可以允许合适的软件计算所得图像的增益和偏移。led以三角形的时变信号照亮载玻片的背面。该调制发生在大约2.6hz。调制由控制器电路产生,该控制器电路也用于控制阀门和泵电机。控制器电路产生方波信号,该信号被积分然后用于调制到led的电流,从而产生三角形的时变光输出。光路长度可以设计得尽可能短,以减小仪器的尺寸。光学系统允许tad系统对由测定产生的阵列室中的斑点成像,以确定插入的微流体盒的类型、相容性、取向和成功插入,并且对微流体盒中的流体流动进行成像。相机发挥多种功能。其以足够的分辨率对测定产生的斑点进行成像,以量化光密度。其将从仪器中输入空白和点图像作为输入。其还将基于所选择的卡类型配置的点阵列尺寸来定位基准点并输出二维点阵列。其对微流体盒上的特征进行成像,允许确定盒类型、相容性和方向,并允许tad确定成功插入。其可以对微流体盒内的所有微流体进行成像,以记录流体或空气位置,并协助诊断或提供测试记录。相机还可以对盒标签进行成像以进行条形码扫描。led阵列照亮微流体盒的顶面。光输入由控制电子设备调制,并且可以由软件控制以支持上述相机功能。这些灯用于条形码扫描和潜在的视频记录,用于故障排除和诊断。成像led为阵列室的基座提供光。光输入由控制电子设备调制,并且可以根据量化阵列室中斑点的需要由软件控制。对于阵列室中的成像点,来自led的光必须进入阵列室的底部,通过观察窗口,并进入相机而不会反射或漫射通过任何其他表面。来自成像led的光不得反射或漫射通过tad设备的任何元件,然后从顶部照射阵列室。在阵列成像led和微流体盒测定室之间包括漫射元件,以在led进入测定室之前均匀地分布来自led的光。为了获得斑点的图像,可以首先获得空白图像,以允许软件通过忽略斑点形成之前存在的任何背景来检测斑点。在斑点显影时,可以获得斑点图像。在图像捕获开始时,两个640×480像素阵列归零:一个将累积每个单独像素的平均黑色和白色强度,另一个将累积强度乘以整体像素平均值。空间像素平均值也与捕获帧的时间一起存储。在以下分析中,空间像素平均值用作调制信号的代理。这是基于2.6hz周期的唯一来源必须归因于调制的假设。一旦捕获了所需的总帧数,就将平均像素强度的时间记录与正弦波的频率范围相关联,以便识别正确的调制频率、相位和幅度。该计算的结果是与调制幅度成比例的值。接下来,对每个像素计算最小二乘线性回归,以确定每个像素相对于提取的调制信号的增益和偏移。此时,假设单个像素增益表示与led输出相关的比例因子。像素偏移不被认为是有用的并且被丢弃。为了阻挡由卡到卡的变化,由于腔室中的流体引起的光密度变化以及精确的调制幅度引起的影响,首先在斑点形成之前然后在之后捕获图像。这些被称为“空白”图像和“斑点”图像。通过计算斑点图像的每个像素增益与空白图像的每个像素增益的比率来创建最终处理图像。通过所计算的斑点图像与空白图像的调制幅度的比率来进一步缩放该图像。用于量化的斑点可以由软件用户手动标记。每个斑点包含一个中心点区域。用户可以使用软件更改斑点的大小。为了量化斑点,可以计算新图像,其中每个像素等于斑点和无斑点图像的每个像素的比率。这消除了由于背光和固有的空间卡密度以及像素增益和偏移引起的变化。计算中心斑点圆内的平均像素值。该仪器设计用于包含摄像机和照明系统,使得该软件能够拍摄从tmb-mx显影的斑点的图像。然后,软件将能够基于相机拍摄的图像计算光密度。相机是usb相机(leopard成像:li-ov7725)。led灯阵列位于斑点区域下方,其照明允许斑点图像(life-oninc.)。led指示灯闪烁,这允许软件计算得到的图像的增益和偏移。光路长度设计得尽可能短,以使装置尽可能紧凑。5c:仪器集成泵、阀门和光学相机都将集成到仪器中。在仪器内,这些部件与打印电路板集成在一起。该电路板将来自软件的所有电输入传递到各种组件。仪器将容纳微控制器、泵、阀门和光学系统。将盒(湿盒和干盒一起)插入仪器中并通过与歧管的弹簧机构接合。歧管是将阀门连接到储罐端口的装置。当前装载在pc笔记本电脑上的软件通过两根usb电缆连接仪器,一根控制仪器,另一根控制相机。图30示出了仪器、盒和软件如何组合在一起的示意图。tad系统可以包括读取器,其控制和量化由盒而得的结果。该仪器由塑料和金属外壳组成,其容纳触摸屏显示器、主cpupcb、包括泵的盒接口、多个阀门、用于量化的相机、各种led光源和带有mcu的pcb、阀门驱动器、电机驱动器和传感器,以确保正确进行实验。读取器的基本形式将包括用于用户界面的图形触摸屏显示器,其具有用于盒插入的抽屉。外壳可以使用ots防振脚。假设读取器将用在足够平坦的表面上,不需要进行调整。读取器可以向用户指示它是否不够平坦。tad软件将在基于arm的cpu上运行。主要的软件功能(包括所有gui)可以是用java编写的软件应用程序(app)的结果。该应用程序将依赖于各种其他软件库和软件包的支持,这些软件库和软件包属于未知来源(soup)软件类别。在tad中的微控制器中运行的软件将被称为tad固件。这意味着该软件在运行时无法显着重新配置,并且它将在加电时开始执行。tad的固件将在盒接口的微控制器上运行。该固件将使用由两个线程组成的实时架构实现:连续的无限主循环和恒定间隔定时器中断。中断可以被称为快速代码,主循环将被称为慢速代码。根据经验,预计mcu将花费近一半的时间执行快速代码,而一半花在慢速代码上。tad可以包括许多定制和现成的电子组件。tad的主ui可以基于7”触摸屏lcd。这可能是具有并行接口的ots组件和基于ft5x06控制器的i2c触摸屏控制器。所有用户与应用程序的交互都将通过触摸屏完成。任何数据输入都将通过屏幕键盘完成。在一些实施方式中,可以包括用于患者id输入的外部条形码扫描仪的添加。gui可以包括主屏幕,以允许用户启动向导式引导过程,用于运行分析和访问仪器设置,这取决于用户授权级别。tad可能包含用于备用蓄电池的nimh蓄电池。四块大约4a*h的mimh电池可以提供足够的能量以在8w下运行设备大约2小时。读取器可以使用四到六块电池。cpupcb包含tad的所有gui和通信。歧管pcb包含顶部led、阀门和泵电机的驱动组件。它还包含压力传感器的adc。盒接口pcv管理盒式接口的所有功能。该板为照明led提供安装,用于照亮阵列室。其还包含所有输入功率转换,包括蓄电池充电和监控。蓄电池pcb机械安装蓄电池、蓄电池热敏电阻和蓄电池监控电路。歧管组件(图46a-b,概念性渲染)可包括盒接口pcb;光学传感系统中描述的相机(109)和盒成像led;微流体盒接口中描述的歧管端口(14)、光学窗口和对准特征;和泵(68)、阀门(65)、压力传感器和叠层堆(110)。泵(68)、阀门(65)和组装的盒(79)必须全部与歧管的层压堆叠体(110)接合。另外,必须定位相机(109)以正确地对阵列室(12)的结果进行成像。图33和47示出了歧管的两个示例性详述的层压堆叠体,其用于将来自泵的空气连接到通向盒的阀门。空气通过端口88离开泵,行进到阀门入口85,并通过打开的阀门。然后空气通过端口86离开阀门,重新进入歧管并行进到歧管与盒87连接的端口。在泵的归零期间,或行进到w1(1)或w2(2)空气通过端口排出至大气63。盒接口包含预期仪器与盒正确耦合的连接功能。该接口旨在为盒设计和构造提供足够的灵活性,以便盒设计可以独立于仪器进行迭代。盒读取器包括10个喷嘴,每个喷嘴高0.9mm,内径3mm,外径3.5mm,倒角60°。3mm内径为0.9mm深,以接受喷嘴垫圈的弯曲,然后其过渡到0.5mm直径的洞,以最小化内部空气量。喷嘴间隔5.8mm。读取器包括用于添加两个额外喷嘴的空间,具有最小修改以支持将来的盒迭代。喷嘴和盒对准特征由单个铝坯加工而成,并拧到歧管组件上。喷嘴与微流体盒上的10个端口接合。端口间隔5.8mm,以盒中线为中心,距盒前缘2.72mm。每个喷嘴/端口对在盒式读取器和微流体盒之间提供独立的气动连接。0.03英寸厚的硅橡胶垫圈粘合在气动端口上方。垫圈包含与每个气动端口对准的1.5mm洞。当夹紧时,垫圈在气动端口和喷嘴之间提供密封。微流体盒接口的喷嘴和喷嘴垫圈用弹簧或致动器驱动机构夹紧在一起。夹紧将在没有来自用户的输入力的情况下完成。该机构为所有喷嘴提供均匀的夹紧力,总夹紧力为30 /-5n。该机构可以保持12mm至17mm高的盒的可接受的夹紧力。这将确保在盒的弹性体表面和读取器的喷嘴之间施加足够的局部压力,以提供足够的密封而无需施加会使垫圈变形并干扰密封的过大压力。在喷嘴两侧的盒式读取器上会有对准特征,其将与湿盒顶部两侧的特征相接合。这些用于精确的盒对准。它们可以由矩形突出物组成,在端部的3个边缘上具有倒角。这些特征将在水平面上占据1mm至2mm的未对准。层压堆叠体(laminatestack)提供微流体空气通道以连接通气口/进气口、泵、阀门和喷嘴。可以容易地移除和更换堆叠体以翻新仪器或重新配置微流体连接。堆叠体通过圆形通道与其他组件连接,从通道堆栈的顶部或底部离开,并密封到其他组件,其中有暴露的粘合剂岛,每个通道周围提供2mm至4mm的密封。堆叠体通过歧管组件上的特征(销针等)对准,并且包含特征,因此其只能以正确的取向安装。该系统包括用于潜在潮湿空气移动通过微流体盒并安全地排放到环境中的路径。该路径兼作泵的进气口。通气口开口指向下方以防止灰尘聚集在端口中。通气口上盖有gpm,以防止灰尘进入空气系统。通气口排入盒式读取器的主体。必须允许少量空气自由地流入和流出盒式读取器,以防止在盒式读取器内部产生压力/真空。盒可以放入从盒式读取器(89)延伸的抽屉中(图45a)。在插入过程中应该容易水平地握住盒。希望在没有正确插入盒的情况下不能关闭抽屉(例如盒与读取器碰撞)。如果在未正确插入盒的情况下关闭抽屉,抽屉关闭机构可以受力限制以防止损坏盒。抽屉设计可以最小化夹点并且可以包括力层压以防止对使用者的伤害。当盒式读取器接受时,微流体盒被保持在可移动的承滴盘(driptray)内,该承滴盘可具有容纳保持在微流体盒内的整个流体体积的能力。移动抽屉元件可以是托盘。托盘可移除以便清洁。托盘可接受宽达80mm、长达70mm的盒,并且可替换为接受宽度可达95mm,长度可达85mm的盒的托盘,以便将来进行盒迭代。目的是为两个额外的气动端口提供空间。托盘可包括手指间隙袋,以允许容易地安装和移除微流体盒。托盘可以包括使得盒不能倒置或以不正确的方向插入的特征。最终仪器的图示在图45a-c中示出,其中包括泵、cpu、电机和歧管组件的内部元件由塑料壳体(96)和金属部件(94)包围。仪器的前部由7英寸的lcd屏幕(90)和用于容纳插入的盒的可弹出托盘(89)组成。散热金属板位于仪器背面,以协助冷却仪器(95)。各种usb和电气连接位于仪器(91,93)的前部和后部。仪器由位于仪器92后部的on按钮供电。5d:操作脚本软件中的脚本用于命令仪器从哪个储存器进行推送。该脚本可以用文本文件编写并加载到仪器中,专门为在我们的系统中使用而开发了用户友好的基于java的脚本。一些简单的命令用于将盒(全部通气(ventall))和泵(向内通气(ventin),向外通气(ventout),中度通气(ventmid))中的压力归零。脚本控制的另一个简单命令是“暂停(break)”,其简单地中断脚本直到用户希望继续。最后,图像控制“抓空白”抓取用于背景的空白图像,并且“抓点”在斑点完成显影时抓取图像。为了控制机器的流体,一个命令行包含将流体移动到所需位置所需的所有信息。示例性泵命令包括“全部通气”,其打开和关闭所有阀门以使盒中的压力归零;“向内通气”,其一直向外移动泵使其可推动;“向外通气”,其一直向内移动泵使其可拉动;“中度通气”,使泵移动至半程;示例性流体命令包括“抽”,泵朝试剂储罐拉动流体;“推”,泵从试剂储罐推动流体;示例性成像命令包括“抓空白”,其抓取空白图像;“抓点”,其抓取斑点图像;示例性其它脚本命令包括“暂停”,其使脚本和仪器中断;和“//”,其后面的任何文本都是注释而不是命令。泵命令是脚本线的开始,无论是将流体从储罐推至废物的“推”还是将流体在相反方向上推动的“抽”。在抽或推之后是你想要推动的体积,例如100μl。命令的下一部分是你想要从其推出液体的储罐,例如“r1”(可以从任意缓冲剂或试剂储罐中选择)。在此之后是你想要推进的储罐,例如“w1”(选取w1或w2)。命令的最后一部分是流体被推动的所用时间量,即100s。体积量和时间量决定了流速,即流体移动的多快。该脚本存储在具有.txt文件扩展名的纯文本文件中。所有文件内容都不区分大小写。假定脚本的每一行都包含注释和/或单个命令。如果一行包含一个命令,那么命令名将从该行的第一个非空白字符开始。一行开头的空白字符(空格和制表符)将被忽略。注释是脚本解析器不处理的文本。这些可用于传达人类可读的信息,以帮助人们理解脚本。注释以//开头。脚本解析器将忽略注释分隔符后面的任何文本。如果一行的第一个非空白字符是注释分隔符,则整行将被忽略。除非明确用单位表示,否则参数必须以命令定义中的指定的顺序出现。参数与命令分开,并以空格分隔。许多命令需要规定一个或多个阀门。有效的阀门描述符是:r1、r2、r3、r4、r5、r6、r7、r8、w1、w2、all、vent、none。所有数值参数都可以用科学记数法指定,例如1.4e-9,并且假定为正,除非指定的带有负号。为方便起见,数字参数可以跟随有单位,例如:s、μl、g/ml。如果存在,指定的单位将覆盖该命令的已定义参数顺序,除非还需要无单位参数。假设时间值以秒为单位。体积值假定为微升。假设浓度值以克/毫升为单位。某些命令需要指定名称,例如,以指示参数指的是特定蛋白质。对该名称的所有引用必须键入相同的名称。名称以脚本编写,以双引号开头和结尾。盒和仪器的操作组装干盒湿盒和干盒是单独提供的,但这不是必需的。将载有抗体的载玻片面朝下置于干盒中的粘合剂层上。将载玻片夹在一起,以确保通道对载玻片的良好密封。组装湿盒试剂可以通过底部层压体中的预切洞装载到储罐中。为确保试剂不会从通道口或通气口溢出,将一条胶带放在湿盒顶部密封这些端口。一旦加入试剂,将一片胶带置于层压体的预切洞上以密封储罐。在最终产品中,试剂将在制造期间装载,并且密封将通过更合适的机构发生。此时样品可通过湿盒顶部添加到样品口。作为另一选择,可以安装样品机构,使得可以在组装整个盒之后添加样品。组装湿盒和干盒从干盒的背面移除粘合剂覆盖物,露出粘合剂。干盒和湿盒使用防错装置和凹口对准。将干盒压在湿盒上。干燥和湿盒用夹具密封。盒/仪器接口组装的盒滑入盒入口。施加一些力以覆盖盒平台上的弹簧机构。一旦盒完全插入仪器中,平台上的压力释放允许盒的通气口弹起并与歧管端口正确接合。软件和测定方案台式仪器的实施方式(图31)通过两根usb电缆连接到个人计算机。最终产品可能将软件、仪器和成像屏幕都集成到一个产品中。对于台式仪器,该软件加载在个人计算机上。将包含测定方案的脚本加载到app中。脚本可以首先转到脚本的第一行并按下播放。将组装好的微流体盒(79)装入仪器的前部。利用该脚本,夹紧电机(72)被接合并且通过盒夹紧cam(76),盒可以被夹紧以与歧管(73)接合。仪器可以通过仪器中的阀门pcb(74)自动控制(通过脚本)阀门(65)的开口。同时,脚本激活泵电机(75)移动泵(68)。这导致流体从指定的试剂或缓冲剂储罐移动到指定的废物储罐。将试剂顺序地推过阵列室直到整个测定完成。在使用tmb进行现场开发之前,该软件可以通过下部pcb(78)和位于相机护罩(77)中的相机激活led。这为测定创建了空白图像。在tmb之后,相机拍摄了一个斑点图像。相机抓取也通过脚本控制。可以通过加载特定的设置文件来量化斑点。斑点将自动量化,并可保存结果文件。最终产品可以用户友好的格式说明结果,并指出结果是否表明生物标志物水平高于截断值。参考文献adam,s.s.,key,n.s.,andgreenberg,c.s.(2009).d-dimerantigen:currentconceptsandfutureprospects.blood,113.13,2878-2887.[00340]alexander,j.c.,silverman,n.a.andchretien,p.b.(1976).effectofageandcigarettesmokingoncarcinoembryonicantigenlevels.journaloftheamericanmedicalassociation,235(18),1975-1979.algarra,m.,gomes,d.,&dasilva,j.c.e.(2013).currentanalyticalstrategiesforc-reactiveproteinquantificationinblood.clinicachimicaacta,415,1-9.arribasj.,parra-palauj.l.,andpedersenk.(2010).her2fragmentationandbreastcancerstratification.clincancerres;16(16);4071-4073.ay,c.,vormittag,r.,dunkler,d.,simanek,r.,chiriac,a.l.,drach,j.,...andpabinger,i.(2009).d-dimerandprothrombinfragment1 2predictvenousthromboembolisminpatientswithcancer:resultsfromtheviennacancerandthrombosisstudy.journalofclinicaloncology,27(25),4124-4129.beauchemin,n.andarabzadeh,a.(2013).carcinoembryonicantigen-relatedcelladhesionmolecules(ceacams)incancerprogressionandmetastasis.cancermetastasisreviews,32:643-671.begum,m.,karim,s.,malik,a.,khurshid,r.,asif,m.,salim,a.,...andalqahtani,m.h.(2012).ca15-3(mucin-1)andphysiologicalcharacteristicsofbreastcancerfromlahore,pakistan.asianpacificjournalofcancerprevention,13(10),5257-5261.burke,b.(2004).theroleofmatrixmetalloproteinase7ininnateimmunity.immunobiology,209:51-56.danysh,b.p.,constantinou,p.e.,lukianova-hleb,e.y.,lapotko,d.o.,andcarson,d.d.(2012).themuc1ectodomain:anovelandefficienttargetforgoldnanoparticleclusteringandvapornanobubblegeneration.theranostics,2(8),777.dong,j.andueda,h.(2017).elisa-typeassaysoftracebiomarkersusingmicrofluidicmethods.wiresnanomedicineandnanobiotechnology,e1457.ekins.r.p(1989).multi-analyteimmunoassay.jpharmbiomedanal.1989;7(2):155-68.fornier,m.n.,seidman,a.d.,schwartz,m.k.,ghani,f.,thiel,r.,norton,l.,andhudis,c.(2005).serumher2extracellulardomaininmetastaticbreastcancerpatientstreatedwithweeklytrastuzumabandpaclitaxel:associationwithher2statusbyimmunohistochemistryandfluorescenceinsituhybridizationandwithresponserate.annalsofoncology;16;234-239goldenberg,d.m.,neville,a.m.,carter,a.c.,go,v.l.w.,holyoke,e.d.,isselbacher,k.j.,...andschwartz,m.(1981).cea(carcinoembryonicantigen):itsroleasamarkerinthemanagementofcancer.journalofcancerresearchandclinicaloncology,101(3),239-242.grzywar,lupicka-slowika,walczak,m,etal.(2014).highlysensitivedetectionofcancerantigen15-3usingnovelavianigyantibodies.altex;31(1);43-52hann,h.l.,etal.(1990).prognosticimportanceofserumtransferrinandferritininchildhoodhodgkin’sdisease,66.2:313-316.jose,j.,sunil,p.m.,madhavannirmal,r.,andvarghese,s.s.(2013).cyfra21-1:anoverview.oral&maxillofacialpathologyjournal,4(2).kalousová,m.,krechler,t.,jáchymová,m.,kuběna,a.a.,a.,&zima,t.(2012).ferritinisanindependentmortalitypredictorinpatientswithpancreascancer.resultsofapilotstudy.tumorbiology,33.5:1695-1700.leung,f.,diamanis,e.p.andkulasingam,v.(2014).ovariancancerbiomarkers:currentstateandfutureimplicationsfromhigh-throughputtechnologies.advancesinclinicalchemistry,66,25-77.lin,c.etal.(2010).microfluidicimmunoassays.journalforlaboratoryautomation.15(3).253-274.locker,g.y.,hamilton,s.,harris,j.,jessup,j.m.,kemeny,n.,macdonald,j.s.,...andbast,r.c.(2006).asco2006updateofrecommendationsfortheuseoftumormarkersingastrointestinalcancer.journalofclinicaloncology,24(33),5313-5327.lucarelli,g.,ditonno,p.,bettocchi,c.,vavallo,a.,rutigliano,m.,galleggiante,v.,...andselvaggi,f.p.(2014).diagnosticandprognosticroleofpreoperativecirculatingca15-3,ca125,andbeta-2microglobulininrenalcellcarcinoma.diseasemarkers,689795.mattar,r.,andrade,c.r.a.d.,difavero,g.m.,gama-rodrigues,j.j.,&laudanna,a.a.(2002).preoperativeserumlevelsofca72-4,cea,ca19-9andalpha-fetoproteininpatientswithgastriccancer.revistadohospitaldasclinicas57.3:89-92.maxim,petere.androbertw.veltri.(1986).serumferritinasatumormarkerinpatientswithsquamouscellcarcinomaoftheheadandneck.cancer,57.2:305-311.melia,w.m.,bullock,s.,johnson,p.j.,&williams,r.(1983).serumferritininhepatocellularcarcinoma.acomparisonwithalphafetoprotein.cancer,51.11:2112-2115.nakata,b.,ogawa,y.,ishikawa,t.,ikeda,k.,kato,y.,nishino,h.,andhirakawa,k.(2000).serumcyfra21-1isoneofthemostreliabletumormarkersforbreastcarcinoma.cancer,89(6),1285-1290.nayak,a.,salt,g.,verma,s.k.,andkishore,u.(2015).proteomicsapproachtoidentifybiomarkersofneurodegenerativediseases.intrevneurobiol.121:59-86.olle,e.w.,messamore,j.,deogracias,m.p.,mcclintock,s.d.,anderson,t.d.,&johnson,k.j.(2005).comparisonofantibodyarraysubstratesandtheuseofglyceroltonormalizespotmorphology.experimentalandmolecularpathology.79(3):206-209pepys,m.b.andhirschfield,g.m.(2003).c-reactiveprotein:acriticalupdate.journalforclinicalinvestigation.111:1805-1812.reverberi,randreverberi,l.(2007).factorsaffectingtheantigen-antibodyreaction.bloodtransfusion.5:227-240.ricci,a.,mariotta,s.,andbronzetti,e.(2009).serumca15-3isincreasedinpulmonaryfibrosis.sarcoidosisvasculitisanddiffuselungdisease,26(1),54-63.richens,j.l.,lunt,e.a.,ando'shea,p.(2015).optimisationofproteinmicroarraytechniquesforanalysisoftheplasmaproteome:minimisationofnon-specificbindinginteractions.internationalimmunopharmacology,24(2),166-168.howell,a.(1991).prospectiveassessmentoftheroleoffivetumourmarkersinbreastcancer.cancerimmunology,immunotherapy.33.6:403-410.romero,s.,fernandez,c.,arriero,j.m.,espasa,a.,candela,a.,martin,c.andsanchez-paya,j.(1996).cea,ca15-3andcyfra21-1inserumandpleuralfluidofpatientswithpleuraleffusions.eurorespirj,9,17-23.rubenstein,r.(2015).proteomicanalysisofpriondiseases:creatingclarityorcausingconfusion.electrophoresis,33:3631-3643.shao,x.,wang,x.,xu,x.,feng,j.,han,m.,zhang,h.,...andjin,h.(2014).outcomepredictionvaluesofsolublehumanepidermalgrowthfactorreceptor-2extracellulardomaininmetastaticbreastcancer.intjclinexppathol;7(3);1108-1113su,s.b.,qin,s.y.,chen,w.,luo,w.,andjiang,h.x.(2015).carbohydrateantigen19-9fordifferentialdiagnosisofpancreaticcarcinomaandchronicpancreatitis.worldj.gastroenterol.21(14):4323-4333.tonkin,a.(2015).biomarkersinstablecoronaryheartdisease,theirmodulationandcardiovascularrisk:thelipidbiomarkerstudy.internationaljournalofcardiology.201:499-507.xue,y.,clopton,p.,peacock,w.f.,&maisel,a.s.(2011).serialchangesinhigh-sensitivetroponinipredictoutcomeinpatientswithdecompensatedheartfailure.europeanjournalofheartfailure.13:37-42.yang,a.p.,liu,j.,lei,h.y.,zhang,q.w.,zhao,l.,andyang,g.h.(2014).ca72-4combinedwithcea,ca15andca19-9improvesthesensitivityfortheearlydiagnosisofgastriccancer.clinicachimicaacta,437:183-186.yeh,y.c.,sheu,b.s.,cheng,h.c.,wang,y.l.,yang,h.b.,andwu,j.j.(2010).elevatedserummatrixmetalloproteinase-3and-7inh.pylori-relatedgastriccancercanbebiomarkerscorrelatingwithapoorsurvival.digestivediseasesandsciences,55.6:1649-1657.zhu,h.andsnyder,m.(2003).proteinchiptechnology.currentopinioninchemicalbiology.7:55-63.所有引用文献均在此通过引用并入。已经针对一个或多个实施方式描述了本发明。然而,对于本领域技术人员显而易见的是,在不脱离权利要求所限定的本发明的范围的情况下,可以进行许多变化和修改。当前第1页12当前第1页12
背景技术:
::许多诊断或其他程序需要将样品从收集点运送到可以分析样品的设施的很远距离。提供可以更接近样品收集位置使用并且及时产生分析结果的分析设备将是有用的,例如对于在复杂基质内以微量存在的靶分子。对于改善的灵敏度、定量和产量,elisa是一种常用的形式,其基于将抗体包被在吸附剂96孔板的固相上,并将elisa测定限制为单一分析物。大部分诊断测试仍在手动或半自动elisa滴定板上进行。elisa是极其劳动密集型的,用户会欢迎使用简化的替代技术。目前,除了成本考虑之外,安排两个以上测定的测试结果以获得多个标记的测试结果,即使在来自相同测试实验室的请求时,也倾向于引起额外的延迟。同时安排两个检测可能意味着发送更多样本,并经常向不同的实验室发送。这也导致比安排一个测试和等待结果以评估是否需要进一步测试的标准做法更高的成本。多路复用是一种范式转换,可以使用产生更多诊断信息的测试来节省更多经济成本。多路复用测定也提高了疾病标志物的诊断能力。通常,单个标志物具有临床敏感性和/或特异性限制。与elisa表面相比,微阵列表面中使用的较小斑点导致用于微阵列测定的测试样品中分析物的可能性降低,在测定中耗尽或改变(ekins,1989)。这种差异还意味着微阵列分析具有更好的准确性和灵敏度,尤其是在低分析物样品中。随着扩散约束被最小化,微阵列测定也与更快的动力学相关联。因此,与传统方法相比,该技术平台在生物标志物组的通量和评估方面有效得多。最近,免疫测定已与微流体系统集成在一起。微流体系统通常被称为“芯片上实验室(loc)”或“生物芯片”。与传统的实验室系统相比,这些loc微流体系统使测定小型化。将免疫测定集成到loc中有几个优点,包括但不限于更少的样品/试剂消耗,增强的灵敏度,降低的污染风险,更低的单位成本,更低的功耗以及更高的可靠性和功能性(donganduede,2017;lin等,2010)。在实验室中进行的典型免疫测定花费大量时间,主要是由于温育时间长,这归因于试剂从溶液移动到发生免疫反应的表面的低效质量输送。微流体免疫测定期间的液体输送可以辅助试剂的质量输送并提高免疫反应的效率。免疫测定中使用的试剂可能非常昂贵。将免疫测定集成到微流体中可以大大减少由于小型化而导致的试剂消耗。技术实现要素:本发明部分地提供了一种用于从少量样品中平行地检测多重靶分子的微流体装置。靶分子包括多肽、抗体、小分子、代谢物、重金属等。微流体装置可以是集成蛋白质微阵列的微流体设备,其用于例如检测靶分子阵列。一方面,本发明提供了一种包含微流体盒的装置,所述微流体盒包含蛋白质微阵列和用于接受流体样品的托座(receptacle),其中流体样品配置为与蛋白质微阵列流体连通。微流体盒可以与仪器气动连接,以便例如控制流体的运动。仪器能够检测来自蛋白质微阵列的信号。另一方面,本发明提供了一种包含微流体盒的装置,所述微流体盒包含湿盒、干盒和蛋白质微阵列,其中所述湿盒包含多个试剂储罐;多个缓冲剂储罐;和多个废物储罐;所述干盒包含用于检测所述蛋白质微阵列的孔隙和多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:多个试剂通道;多个缓冲剂通道;将所述阵列室与所述缓冲剂储罐、试剂储罐和废物储罐连接的多个通道;其中所述通道配置为允许流体平稳流动且交叉污染最小化;并且其中所述干盒与所述湿盒对准,并与所述湿盒和所述蛋白质微阵列流体连通。另一方面,本发明提供一种微流体盒,其包含湿盒、干盒和蛋白质微阵列,其中所述湿盒可包含:i)多个试剂储罐,其容纳例如测定-特异性试剂;ii)多个缓冲剂储罐,其中缓冲剂储罐的数量等于试剂储罐的数量;iii)多个废物储罐;iv)对应于所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;v)用于接收流体样品的样品孔;和vi)对应于所述缓冲剂储罐、试剂储罐、废物储罐和样品孔中每一个的多个端口;并且所述干盒可包含用于检测来自蛋白质微阵列的信号的孔隙和设置在主结点周围的多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:vii)多个试剂通道,其中每个试剂通道对应于所述湿盒的所述试剂储罐中的一个;viii)多个缓冲剂通道,其中每个缓冲剂通道对应于所述湿盒的所述缓冲剂储罐中的一个;ix)从所述主结点通向每个缓冲剂通道的通道;x)将每个缓冲剂通道与各试剂通道连接的通道,从而形成缓冲剂通道/试剂通道对;xi)将所述阵列室与所述第一废物储罐连接的通道;xii)将所述阵列室与所述主结点连接的通道;xiii)将所述主结点与所述第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;xiv)对应于所述湿盒的所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和xv)对应于所述通气口中每一个的多个液体不可透的透气的阻隔物,以及将每个试剂/缓冲剂通道对从储罐连接至主通道的通道;其中所述干盒可与所述湿盒对准,并且与所述湿盒和所述蛋白质微阵列流体连通,所述通气口与仪器的歧管接合。另一方面,本发明提供一种其包含湿盒、干盒和蛋白质微阵列的微流体盒,其中所述湿盒包含:i)多个试剂储罐;ii)多个缓冲剂储罐,其中缓冲剂储罐的数量等于试剂储罐的数量;iii)第一和第二废物储罐;iv)对应于所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;v)用于接收流体样品的样品孔;和vi)对应于所述缓冲剂储罐、试剂储罐、废物储罐和样品孔中每一个的多个端口;并且所述干盒包含用于检测所述蛋白质微阵列的孔隙和设置在主结点周围的多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:多个试剂通道,其中每个试剂通道对应于所述湿盒的所述试剂储罐中的一个;多个缓冲剂通道,其中每个缓冲剂通道对应于所述湿盒的所述缓冲剂储罐中的一个,并且其中每个缓冲剂通道与各自对应的试剂通道连接,从而形成缓冲剂通道/试剂通道对;从所述主结点通向每个缓冲剂通道的通道;将所述阵列室与所述第一废物储罐连接的通道;将所述阵列室与所述主结点连接的通道;将所述主结点与所述第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;对应于所述湿盒的所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和对应于所述通气口中每一个的多个液体不可透的透气的阻隔物;其中所述干盒与所述湿盒对准,并且能够与所述湿盒和所述蛋白质微阵列流体连通,所述通气口能够与仪器的歧管接合。另一方面,本发明提供一种其包含湿盒、干盒和蛋白质微阵列的微流体盒,其中所述湿盒可包含:i)多个试剂储罐;ii)多个缓冲剂储罐,其中缓冲剂储罐的数量等于试剂储罐的数量;iii)第一和第二废物储罐;iv)对应于所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;v)用于接收流体样品的样品孔;和vi)对应于所述缓冲剂储罐、试剂储罐、废物储罐和样品孔中每一个的多个端口;并且所述干盒包含用于检测所述蛋白质微阵列的孔隙和多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:多个试剂通道,其中每个试剂通道对应于所述湿盒的所述试剂储罐中的一个;多个缓冲剂通道,其中每个缓冲剂通道对应于所述湿盒的所述缓冲剂储罐中的一个,并且其中每个缓冲剂通道与各自对应的试剂通道连接,从而形成缓冲剂通道/试剂通道对,并且其中每个缓冲剂通道与主通道连接;将所述阵列室与所述第一废物储罐连接的通道;将所述阵列室与所述主通道连接的通道;将所述主通道与所述第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;对应于所述湿盒的所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和对应于所述通气口中每一个的多个液体不可透的透气的阻隔物;其中所述干盒与所述湿盒对准,并且能够与所述湿盒和所述蛋白质微阵列流体连通,所述通气口能够与仪器的歧管接合。另一方面,本发明提供一种湿盒,其包含:i)多个试剂储罐;ii)多个缓冲剂储罐,其中缓冲剂储罐的数量等于试剂储罐的数量;iii)第一和第二废物储罐;iv)对应于所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;v)用于接收流体样品的样品孔;和vi)对应于所述缓冲剂储罐、试剂储罐、废物储罐和样品孔中每一个的多个端口;其中所述湿盒能够与干盒和蛋白质微阵列对准。另一方面,本发明提供一种干盒,其包含用于检测蛋白质微阵列的孔隙和设置在主结点周围的多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:多个试剂通道,其中每个试剂通道对应于所述湿盒的所述试剂储罐中的一个;多个缓冲剂通道,其中每个缓冲剂通道对应于所述湿盒的所述缓冲剂储罐中的一个,并且其中每个缓冲剂通道与各自对应的试剂通道连接,从而形成缓冲剂通道/试剂通道对;从所述主结点通向每个缓冲剂通道的通道;将所述阵列室与所述第一废物储罐连接的通道;将所述阵列室与所述主结点连接的通道;将所述主结点与所述第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;对应于所述湿盒的所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和对应于所述通气口中每一个的多个液体不可透的透气的阻隔物;其中所述干盒能够与湿盒和所述蛋白质微阵列对准,所述通气口能够与仪器的歧管接合。另一方面,本发明提供一种干盒,其包含用于检测所述蛋白质微阵列的孔隙和多个微流体通道,所述孔隙限定与所述蛋白质微阵列结合的阵列室,所述微流体通道包含:多个试剂通道,其中每个试剂通道对应于所述湿盒的所述试剂储罐中的一个;多个缓冲剂通道,其中每个缓冲剂通道对应于所述湿盒的所述缓冲剂储罐中的一个,并且其中每个缓冲剂通道与各自对应的试剂通道连接,从而形成缓冲剂通道/试剂通道对,并且其中每个缓冲剂通道与主通道连接;将所述阵列室与所述第一废物储罐连接的通道;将所述阵列室与所述主通道连接的通道;将所述主通道与所述第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;对应于所述湿盒的所述缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和对应于所述通气口中每一个的多个液体不可透的透气的阻隔物;其中所述干盒能够与湿盒和所述蛋白质微阵列对准,所述通气口能够与仪器的歧管接合。所述蛋白质微阵列可以是抗体微阵列、蛋白质或肽微阵列。所述流体样品可以是生物样品或者含有待检测的靶分子的任意液体样品。所述仪器可包括泵、阀门和光学传感器以及集成微处理器以便控制上述部件。从所述光学传感器的读出可使用量化软件来解释。所述软件可以按照预先设定的脚本控制特定阀门的打开或关闭以及流速。其还可以控制光学传感器以进行图像捕获和图像分析,例如信号量化和背景扣除。所述缓冲剂储罐、试剂储罐和废物储罐可配置为允许预定体积。所述湿盒可包含层压底部,所述层压底部包含预切洞,其在所述缓冲剂储罐、试剂储罐和废物储罐下面以用于装载所述储罐。必要时,所述湿盒可以是可重复使用的。所述干盒可以是一次性的。包含蛋白质微阵列的组装的微流体盒可以是一次性的。本发明的概述不一定描述了本发明的所有特征。附图说明通过以下参考附图的描述,本发明的这些和其他特征将变得更加明显,其中:图1显示来自不含抗原的elisa的捕获和检测抗体之间的交叉反应性筛选结果。所有检测抗体都是生物素化的。使用链霉亲和素-hrp(sa-hrp)检测信号,并且嵌入的表中显示的数字是光密度读数(o.d.)。图2显示来自elisa的抗原和检测抗体之间的交叉反应性筛选结果。在孔中将对应于捕获抗体的抗原温育后,将所有检测抗体分别施用于不同的孔,以用于检测各抗原与其他3种检测抗体之间的交叉反应性。图3a-l显示用微阵列形式测试各种捕获抗体浓度及其响应的设置和结果,其中载玻片用genepix微阵列扫描仪扫描;a-c:从左上起顺时针点样四个斑点:bsa-生物素:13.2μg/ml,ca15-3cab1.25μg/ml,ca15-3cab125μg/ml,ca15-3cab12.5μg/ml;a:用3000u/ml的ca15-3抗原和1μg/ml的ca15-3dab探测;b:用300u/ml的ca15-3抗原和1μg/ml的ca15-3dab探测;c:用30u/ml的ca15-3抗原和1μg/ml的ca15-3dab探测;d-f:从左上起顺时针点样四个斑点:bsa-生物素:13.2μg/ml,ceacab20μg/ml,ceacab2000μg/ml,ceacabcab200μg/ml;d:用500ng/ml的cea抗原和10μg/ml的ceadab探测;e:用50ng/ml的cea抗原和10μg/ml的ceadab探测;f:5ng/ml的cea抗原和10μg/ml的ceadab探测;g-i:从左上起顺时针点样四个斑点:bsa-生物素:13.2μg/ml,5μg/ml的cyfra21-1cab,500μg/ml的cyfra21-1cab,50μg/ml的cyfra21-1cab;g:用200ng/ml的cyfra21-1抗原和10μg/ml的cyfra21-1dab探测;h:用20ng/ml的cyfra21-1抗原和10μg/ml的cyfra21-1dab探测;i:用2ng/ml的cyfra21-1抗原和10μg/ml的cyfra21-1dab探测;j-l:从左上起顺时针点样四个斑点:bsa-生物素:13.2μg/ml,5μg/ml的erbb2cab,500μg/ml的erbb2cab,50μg/ml的erbb2;j:用1500ng/ml的erbb2和4μg/ml的erbb2dab探测;k:用150ng/ml的erbb2和4μg/ml的erbb2dab探测;l:用15ng/ml的erbb2和4μg/ml的erbb2dab探测。图4显示了微阵列布局和结果,其说明了改变ca15-3捕获抗体浓度对信号的影响,信号用tmb-mx显影并用genepix微阵列扫描仪扫描;用隔离器在载玻片上点样;顶行(从左至右):bsa-生物素(8nm),500μg/ml的ca15-3cab,200μg/ml的ca15-3cab;中间行(从左至右):80μg/ml的ca15-3cab,32μg/ml的ca15-3cab,750u/ml的ca15-3抗原;底行(从左至右):375u/ml的ca15-3抗原,187.5u/ml的ca15-3抗原,93.75u/ml的ca15-3抗原;用30u/ml的ca15-3抗原和1μg/ml的ca15-3抗原探测。图5a-b显示erbb2的固定化抗原滴定(a)和来自微阵列测定的相应抗原滴定曲线(b);a:用隔离器在载玻片上点样;顶行(从左至右):500μg/ml的erbb2cab,250μg/ml的erbb2cab,125μg/ml的erbb2cab,62.5μg/ml的erbb2cab;第二行(从左至右):与顶行相同;第三行(从左至右):2812.5ng/ml的erbb2抗原,1875ng/ml的erbb2抗原,1406.25ng/ml的erbb2抗原,937.5ng/ml的erbb2抗原;底行(从左至右):703.13ng/ml的erbb2抗原,468.75ng/ml的erbb2抗原,351.56ng/ml的erbb2抗原,234.38ng/ml的erbb2抗原。图6a-d显示使用机器人微阵列打印机打印的微阵列载玻片的结果,其中捕获抗体是用单个检测抗体6次探测的复制品;亮角点是用于取向的bsa-生物素;第一行是500μg/ml的erbb2cab;第二行是500μg/ml的cyfra21-1cab;第三行是500μg/ml的ca15-3cab;第四行是2000μg/ml的ceacab1;第五行是2000μg/ml的ceacab2;a:用2μg/ml的ca15-3dab探测;b:用4μg/ml的erbb2dab探测;c:用20μg/ml的ceadab探测;d:用10μg/ml的cyfra21-1dab探测。图7显示用定制硅酮隔离器点样的微阵列载玻片上的捕获和检测抗体之间的交叉反应性;顶行(从左至右):8nm的bsa-生物素,25μg/ml的ca15-3cab,250μg/ml的erbb2cab;中间行(从左至右):50μg/ml的cyfra21-1cab,500μg/ml的ceacab,1500u/ml的ca15-3抗原;底行(从左至右):7.5μg/ml的erbb2抗原,100ng/ml的cyfra21-1抗原,15μg/ml的cea。其随后用2μg/ml的ca15-3dab、20μg/ml的ceadab、8μg/ml的erbb2dab、5μg/ml的cyfra21-1dab的dab混合物探测。图8显示用于检查新ca15-3抗原(fitzgerald:30c-cp9064u)中的潜在污染物的微阵列实验,其中用sa-hrp和enzmet银显影剂探测微阵列,用genepix微阵列扫描仪扫描显影的信号;用定制硅酮隔离器点样微阵列载玻片;顶行(从左至右):8nm的bsa-生物素,25μg/ml的ca15-3cab,1500u/ml的ca15-3抗原;中间行(从左至右):50μg/ml的cyfra21-1cab,650μg/ml的ceacab,250μg/m的erbb2cab;底行(从左至右):100ng/ml的cyfra21-1抗原,15μg/ml的cea抗原,7.5μg/ml的erbb2抗原;用30u/ml的新ca15-3抗原以及1μg/ml的ca15-3dab、20μg/ml的ceadab、8μg/ml的erbb2dab、5μg/ml的cyfra21-1dab的dab混合物探测。图9a-d显示检查抗原和检测抗体之间的交叉反应性的微阵列实验的结果;嵌图a-b:用定制硅酮隔离器打印;顶行(从左至右):8nm的bsa-生物素,25μg/ml的ca15-3cab,250μg/ml的erbb2cab;中间行(从左至右):50μg/ml的cyfra21-1cab,500μg/ml的ceacab,1500u/ml的ca15-3抗原;底行(从左至右):7.5μg/ml的erbb2抗原,100ng/ml的cyfra21-1抗原,15μg/ml的cea;嵌图c-d:用定制硅酮隔离器打印;顶行(从左至右):bsa-生物素4nm,50μg/ml的ca15-3cab,1500u/ml的ca15-3抗原;中间行(从左至右):200μg/ml的cyfra21-1cab,975μg/ml的ceacab,395μg/m的erbb2cab;底行(从左至右):100ng/ml的cyfra21-1抗原,15μg/ml的cea抗原,2.25μg/ml的erbb2抗原;a:用30u/ml的ca15-3抗原和2μg/ml的ca15-3dab探测;b:用8ng/ml的cyfra21-1抗原和5μg/ml的cyfra21-1dab探测;c:用200ng/ml的cea和20μg/ml的ceadab探测;d:用120ng/ml的erbb2抗原和8μg/ml的erbb2dab探测。图10a-d显示检查抗原和检测抗体之间的交叉反应性的微阵列实验的结果;嵌图a-c:用定制硅酮隔离器点样;顶行(从左至右):8nm的bsa-生物素,25μg/ml的ca15-3cab,250μg/ml的erbb2cab;中间行(从左至右):50μg/ml的cyfra21-1cab,500μg/ml的ceacab,1500u/ml的ca15-3抗原;底行(从左至右):7.5μg/ml的erbb2抗原,100ng/ml的cyfra21-1抗原,15μg/ml的cea;嵌图d:用定制硅酮隔离器点样;顶行(从左至右):bsa-生物素10nm,25μg/ml的ca15-3cab,200μg/ml的erbb2;中间行(从左至右):200μg/ml的cyfra21-1cab,125μg/ml的cyfra21-1cab,250μg/ml的cyfra21-1抗原;底行(从左至右):500μg/ml的ceacab,250μg/ml的ceacab,125μg/ml的ceacab;a:用30u/ml的ca15-3抗原和2μg/ml的ca15-3dab探测;b:用50ng/ml的cea抗原和20μg/ml的ceadab探测;c:用8ng/ml的cyfra21-1和5μg/ml的cyfra21-1dab探测;d:用30ng/ml的erbb2抗原和8μg/ml的erbb2dab探测。图11a-n显示通过预混合dab与链霉亲和素-辣根过氧化物酶(sa-hrp)或与sa-hrp/生物素-hrp进行信号放大;嵌图a-g显示用sa-hrp和生物素-hrp的各种组合探测的夹心抗体微阵列测定的结果,其中用genepix微阵列扫描仪扫描探测的载玻片;载玻片用定制硅酮隔离器点样;顶行(从左至右):8nm的bsa-生物素,25μg/ml的ca15-3cab,1500u/ml的ca15-3抗原;中间行(从左至右):50μg/ml的cyfra21-1cab,650μg/ml的ceacab,250μg/m的erbb2cab;底行(从左至右):100ng/ml的cyfra21-1抗原,15μg/ml的cea抗原,7.5μg/ml的erbb2;a-g都用由ca15-3、cea、erbb2和cyfra21-1组成的抗原混合物探测。a:用具有5x摩尔量的sa-hrp的dab混合物探测15分钟;b:用具有5x摩尔量的sa-hrp的dab混合物探测15分钟,并且添加4μg/ml的生物素-hrp,探测10分钟;c:用dab混合物探测15分钟,添加预混合有1μg/ml的生物素-hrp的4μg/ml的sa-hrp,探测10分钟;d:用dab混合物探测15分钟,添加预混合有2μg/ml的生物素-hrp的4μg/ml的sa-hrp,探测10分钟;e:用dab混合物探测15分钟,添加预混合有4μg/ml的生物素-hrp的4μg/ml的sa-hrp,探测10分钟;f:用dab混合物探测15分钟,添加预混合有5μg/ml的生物素-hrp的20μg/ml的sa-hrp,探测10分钟;g:用dab混合物探测15分钟,添加预混合有25μg/ml的生物素-hrp的100μg/ml的sa-hrp,探测10分钟;嵌图h-m:用不同浓度的bsa-生物素打印微阵列载玻片,重复四次;第1行:120nm的bsa-生物素和打印缓冲剂;第2行:60nm的bsa-生物素和打印缓冲剂;第3行:30nm的bsa-生物素和打印缓冲剂;第4行:20nm的bsa-生物素和打印缓冲剂;第5行:15nm的bsa-生物素和10nm的bsa-生物素;第6行:7.5nm的bsa-生物素和5nm的bsa-生物素;第7行:37.5nm的bsa-生物素和2.5nm的bsa-生物素;第8行:1.875nm的bsa-生物素和1.25nm的bsa-生物素;然后用各种浓度的sa-hrp和生物素-hrp探测载玻片;h:用4μg/ml的sa-hrp探测10分钟;i:用预混合的4μg/ml的sa-hrp和2μg/ml的生物素-hrp探测10分钟;j:用预混合的4μg/ml的sa-hrp和4μg/ml的生物素-hrp探测10分钟;k:用预混合的4μg/ml的sa-hrp和6μg/ml的生物素-hrp探测10分钟;l:用预混合的4μg/ml的sa-hrp和8μg/ml的生物素-hrp探测10分钟;m:用预混合的8μg/ml的sa-hrp和4μg/ml的生物素-hrp探测10分钟;嵌图n:h-m中的数据的图示;1:用4μg/ml的sa-hrp探测10分钟;2:用4μg/ml的sa-hrp和2μg/ml的生物素-hrp探测10分钟;3:用4μg/ml的sa-hrp和4μg/ml的生物素-hrp探测10分钟;4:用8μg/ml的sa-hrp和4μg/ml的生物素-hrp探测10分钟。图12a-b显示sa-hrp和生物素-hrp预混物的不同温育时间;对于两个嵌图,都用定制硅酮隔离器对载玻片点样;顶行(从左至右):4nm的bsa-生物素,50μg/ml的ca15-3cab,1500u/ml的ca15-3抗原;中间行(从左至右):200μg/ml的cyfra21-1cab,975μg/ml的cea,395μg/ml的erbb2cab;底行(从左至右):100ng/ml的cyfra21-1抗原,15μg/ml的cea抗原,2.25μg/ml的erbb2抗原;嵌图a显示sa-hrp和生物素-hrp混合物的10分钟温育时间的结果;嵌图b显示sa-hrp/生物素-hrp混合物的5分钟温育时间的结果;用bioradchemdoctmmp系统扫描载玻片。图13a-c显示用sa-hrp的稀释物打印并用tmb-mx探测的载玻片;载玻片用定制硅酮隔离器点样;顶行(从左至右):0.5μg/ml的sa-hrp,1μg/ml的sa-hrp,2μg/ml的sa-hrp;中间行(从左至右):4μg/ml的sa-hrp,缓冲剂,0.5μg/ml的sa-hrp;底行(从左至右):1μg/ml的sa-hrp,2μg/ml的sa-hrp,4μg/ml的sa-hrp;嵌图a显示用genepix微阵列扫描仪扫描的tmb-mx(moss基底)显影后的载玻片的图像;嵌图b显示用该仪器成像的tmb-mx显影后的载玻片的光学图像;嵌图c是嵌图b所示tmb-mx响应的剂量依赖性的图示。图14a-d显示测试不同tmb-mx温育时间的微阵列载玻片;信号用仪器成像;载玻片用定制硅酮隔离器打印;顶行(从左至右):20μg/ml的ca15-3cab,80μg/ml的ca15-3cab,750u/ml的ca15-3抗原;中间行(从左至右):100μg/ml的cyfra21-1cab,400μg/ml的cyfra21-1cab,125ng/ml的cyfra21-1抗原;底行(从左至右):125μg/ml的erbb2cab,500μg/ml的erbb2cab,1875ng/ml的erbb2抗原;嵌图a显示2分钟tmb-mx温育后的信号;嵌图b显示4分钟tmb-mx温育后的信号;嵌图c显示6分钟tmb-mx温育后的信号;嵌图d显示8分钟tmb-mx温育后的信号。图15a-b显示斑点布局以及测试不同打印缓冲剂的两个银染斑点的图像;25μg/ml的ca15-3cab用定制硅酮隔离器点样;a以1xpbs点样,b以1xpbs 20%甘油点样;用bioradchemdoctmmp系统成像。图16a-b显示打印缓冲剂对银显影微阵列载玻片的cea捕获抗体微阵列扫描的信号强度的作用;载玻片在定制硅酮隔离器上点样;a:用1xpbs、5%甘油和0.02%十二烷基肌氨酸钠打印抗体和抗原;顶行(从左至右):4nm的bsa-生物素,50μg/ml的ca15-3cab,1500u/ml的ca15-3抗原;中间行(从左至右):200μg/ml的cyfra21-1cab,975μg/ml的ceacab,395μg/ml的erbb2cab;底行(从左至右):100ng/ml的cyfra21-1抗原,15μg/ml的cea抗原,2.25μg/ml的erbb2抗原;b:用1xpbs打印的抗体和抗原;顶行(从左至右):4nm的bsa-生物素,pbs中的1000μg/ml的ceacab,pbs中的1000μg/ml的ceacab;中间行(从左至右):312.5ng/ml的cea抗原,625ng/ml的cea抗原,1250ng/ml的cea抗原;底行(从左至右):2500ng/ml的cea抗原,5000ng/ml的cea抗原,10000ng/ml的cea抗原;两个孔都用200ng/ml的cea抗原(c3100-14)和20μg/ml的c1299-87o-b检测抗体探测。在白色框中突出显示975μg/ml和100μg/ml的c1299-87w的cea捕获抗体斑点用于比较。图17a-b显示不同离子强度的探测缓冲剂的结果。利用定制硅酮隔离器将捕获抗体在载玻片上点样;顶行(从左至右):50μg/ml的ca15-3cab,25μg/ml的ca15-3cab;底行(从左至右):500μg/ml的erbb2cab,250μg/ml的erbb2cab;通过银显影获得结果,并用bioradchemdoctmmp系统成像。嵌图a示出当使用1xpbst 5%bsa的探测缓冲剂时的结果。嵌图b示出当使用低离子强度的探测缓冲剂0.25xpbst 5%bsa时的结果。图18a-l显示抗原和检测抗体混合物的不同温育时间。载玻片用微阵列打印机打印,重复6次,第一行为500μg/ml的erbb2cab,第二行为500μg/ml的ca15-3cab;银显影的捕获抗体斑点的微阵列扫描仪图像;嵌图a-f用30u/ml的ca15-3抗原和15ng/ml的erbb2抗原的抗原混合物以及dab混合物探测15分钟;a:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测15分钟的抗原混合物;b:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测30分钟的抗原混合物;c:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测60分钟的抗原混合物;d:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测15分钟的抗原混合物;e:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测30分钟的抗原混合物;f:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测60分钟的抗原混合物;嵌图g-l用30u/ml的ca15-3抗原和15ng/ml的erbb2抗原的抗原混合物以及dab混合物探测30分钟;g:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测15分钟的抗原混合物;h:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测30分钟的抗原混合物;i:用1μg/ml的ca15-3dab和2μg/ml的erbb2dab的dab混合物探测60分钟的抗原混合物;j:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测15分钟的抗原混合物;k:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测30分钟的抗原混合物;l:用4μg/ml的ca15-3dab和8μg/ml的erbb2dab的dab混合物探测60分钟的抗原混合物。图19显示用arrayit比色扫描仪扫描的充分显影的tmb-mx的微阵列扫描;载玻片用omnigrid微阵列打印机打印,斑点在12×12网格中一式三份打印;第1行(从左至右):30nm的bsa-生物素,40μg/ml的ca15-3cab,30μg/ml的ca15-3cab,20μg/ml的ca15-3cab;第2行(从左至右):1600u/ml的ca15-3抗原,800u/ml的ca15-3抗原,400u/ml的ca15-3抗原,200u/ml的ca15-3抗原;第3行(从左至右):600μg/ml的cyfra21-1cab,0.25μg/ml的cyfra21-1抗原,0.2μg/ml的cyfra21-1抗原,0.16μg/ml的cyfra21-1抗原;第4行(从左至右):580μg/ml的ceacab,5.4μg/ml的cea抗原,3.6μg/ml的cea抗原,2.4μg/ml的cea抗原;第5行(从左至右):100μg/ml的erbb2cab,1.35μg/ml的erbb2抗原,0.9μg/ml的erbb2抗原,0.6μg/ml的erbb2抗原;第6行(从左至右):100μg/ml的mmp-7cab,9μg/ml的mmp-7抗原,6μg/ml的mmp-7抗原,3μg/ml的mmp-7抗原;第7行(从左至右):40μg/ml的铁蛋白cab,20μg/ml的铁蛋白cab,10μg/ml的铁蛋白cab,5μg/ml的铁蛋白cab;第8行(从左至右):2.7μg/ml的铁蛋白抗原,1.8μg/ml的铁蛋白抗原,1.2μg/ml的铁蛋白抗原,0.8μg/ml的铁蛋白抗原;第9行(从左至右):400μg/ml的ca19-9cab,200μg/ml的ca19-9cab,100μg/ml的ca19-9cab,22.5ku/ml的ca19-9抗原;第10行(从左至右):15ku/ml的ca19-9抗原,10ku/ml的ca19-9抗原,570μg/ml的ca72-4cab,300μg/ml的ca72-4;第11行(从左至右):150μg/ml的ca72-4,4000u/ml的ca72-4抗原,2000u/ml的ca72-4抗原,1000u/ml的ca72-4抗原;第12行(从左至右):200μg/ml的d-二聚体cab,100μg/ml的d-二聚体抗原,20μg/ml的d-二聚体抗原,4μg/ml的d-二聚体抗原;用含有ca15-3(60u/ml)、cyfra21-1(8ng/ml)、cea(20ng/ml)、ca72-4(40u/ml)、ca19-9(148u/ml)、erbb2(60ng/ml)、铁蛋白(200ng/ml)、mmp-7(20ng/ml)的抗原混合物探测载玻片;然后用ca15-3dab(20ng/ml)、cyfra21-1dab(8μg/ml)、ceadab(2μg/ml)、ca72-4dab(5μg/ml)、ca19-9dab(150ng/ml)、erbb2dab(0.4μg/ml)、铁蛋白dab(5μg/ml)、mmp-7dab(400ng/ml)的dab混合物探测载玻片。图20是在微阵列载玻片上打印的抗原的平均cea抗原曲线的图示。图21示出用平均抗原曲线标准化的捕获抗体斑点上cea抗原响应的标准曲线。图22是比较如本文所述进行的微阵列实验和市售elisa试剂盒(fujierbioinc)的brand-altman图。图23示出用所述盒和仪器探测并成像的载玻片的结果;载玻片用omnigrid微阵列打印机打印,斑点在12×12网格中一式三份打印;第1行(从左至右):30nm的bsa-生物素,40μg/ml的ca15-3cab,30μg/ml的ca15-3cab,20μg/ml的ca15-3cab;第2行(从左至右):1600u/ml的ca15-3抗原,800u/ml的ca15-3抗原,400u/ml的ca15-3抗原,200u/ml的ca15-3抗原;第3行(从左至右):600μg/ml的cyfra21-1cab,0.25μg/ml的cyfra21-1抗原,0.2μg/ml的cyfra21-1抗原,0.16μg/ml的cyfra21-1抗原;第4行(从左至右):1000μg/ml的ceacab,5.4μg/ml的cea抗原,3.6μg/ml的cea抗原,2.4μg/ml的cea抗原;第5行(从左至右):100μg/ml的erbb2cab,1.35μg/ml的erbb2抗原,0.9μg/ml的erbb2抗原,0.6μg/ml的erbb2抗原;第6行(从左至右):100μg/ml的mmp-7cab,9μg/ml的mmp-7抗原,6μg/ml的mmp-7抗原,3μg/ml的mmp-7抗原;第7行(从左至右):40μg/ml的铁蛋白cab,20μg/ml的铁蛋白cab,10μg/ml的铁蛋白cab,5μg/ml的铁蛋白cab;第8行(从左至右):2.7μg/ml的铁蛋白抗原,1.8μg/ml的铁蛋白抗原,1.2μg/ml的铁蛋白抗原,0.8μg/ml的铁蛋白抗原;第9行(从左至右):400μg/ml的ca19-9cab,200μg/ml的ca19-9cab,100μg/ml的ca19-9cab,22.5ku/ml的ca19-9抗原;第10行(从左至右):15ku/ml的ca19-9抗原,10ku/ml的ca19-9抗原,600μg/ml的ca72-4cab,300μg/ml的ca72-4;第11行(从左至右):150μg/ml的ca72-4,4000u/ml的ca72-4抗原,2000u/ml的ca72-4抗原,1000u/ml的ca72-4抗原;第12行(从左至右):200μg/ml的d-二聚体cab,100μg/ml的d-二聚体抗原,20μg/ml的d-二聚体抗原,4μg/ml的d-二聚体抗原;用含有ca15-3(60u/ml)、cyfra21-1(8ng/ml)、cea(20ng/ml)、ca72-4(40u/ml)、ca19-9(148u/ml)、erbb2(60ng/ml)、铁蛋白(200ng/ml)、mmp-7(20ng/ml)的抗原混合物探测载玻片;然后用ca15-3dab(20ng/ml)、cyfra21-1dab(8μg/ml)、ceadab(2μg/ml)、ca72-4dab(5μg/ml)、ca19-9dab(150ng/ml)、erbb2dab(0.4μg/ml)、铁蛋白dab(5μg/ml)、mmp-7dab(400ng/ml)的dab混合物探测载玻片。图24a-b显示根据一个实施方式示出分离的干盒和湿盒以及它们如何能够与彼此和仪器歧管接合的示意图;嵌图a显示顶视图,嵌图b显示侧视图。图25a-c是干盒的不同实施方式的示意图。图26是湿盒的一个实施方式的示意图。图27是示例性湿盒和干盒的侧视图的示意图,其显示了两者对准。图28是用于仪器和盒的泵、阀门、储罐和流体路径的一个实施方式的示意图。图29是用于仪器的螺线管阀门的一个实施方式的示意图。图30是仪器、盒和计算机/软件连接的一个实施方式的示意图。图31是台式仪器的一个实施方式的图示。图32是注射泵的一个实施方式的图示。图33是歧管的一个实施方式的图示。图34a-b分别显示不同检测抗体浓度的ca15-3的标准曲线,0.2μg/ml(a)和0.4μg/ml(b)。图35a-b分别显示不同检测抗体浓度的肌红蛋白的标准曲线,1μg/ml(a)和4μg/ml(b)。图36显示来自无抗原的微阵列的捕获抗体和检测抗体之间的交叉反应性筛选结果。用来自arrayit比色扫描仪的图像检测信号,并用imagej量化;a行:400μg/ml的erbb2cab;b行:800μg/ml的ceacab;c行:160μg/ml的ca15-3cab;柱1:40ng/ml的ca15-3dab;柱2:25μg/ml的ceadab;柱3:4μg/ml的erbb2dab。图37显示乳腺癌组抗原与微阵列上的检测抗体之间的交叉反应性筛选结果。用来自arrayit比色扫描仪的图像检测信号,并用imagej量化;a行:400μg/ml的erbb2cab和erbb2抗原;b行:800μg/ml的ceacab和cea抗原;c行:160μg/ml的ca15-3cab和ca15-3抗原;柱1:40ng/ml的ca15-3dab;柱2:25μg/ml的ceadab;柱3:4μg/ml的erbb2dab。图38乳腺癌组抗原与微阵列上的捕获抗体之间的交叉反应性筛选结果。用来自arrayit比色扫描仪的图像检测信号,并用imagej量化;a行:400μg/ml的erbb2cab;b行:800μg/ml的ceacab;c行:160μg/ml的ca15-3cab;柱1:ca15-3抗原和40ng/ml的ca15-3dab;柱2:cea抗原和25μg/ml的ceadab;柱3:erbb2抗原和4μg/ml的erbb2dab。图39显示减去背景后各种sa-hrp/生物素-hrp条件的信号;1:用8μg/ml的sa-hrp和4μg/ml的生物素-hrp探测的bsa-生物素的数目;2:用16μg/ml的sa-hrp和8μg/ml的生物素-hrp探测的bsa-生物素的数目;3:用32μg/ml的sa-hrp和16μg/ml的生物素-hrp探测的bsa-生物素的数目;4:用64μg/ml的sa-hrp和32μg/ml的生物素-hrp探测的bsa-生物素的数目。图40a-c显示在三个载玻片类型上打印、探测和用tmb显影的erbb2cab;载玻片用arrayit比色扫描仪成像;bsa-生物素30nm在阵列的四个角中一式两份地打印;一式两份地打印一行erbb2cab和抗原,最大浓度的erbb2cab,1/2最大浓度的erbb2cab,1/4最大浓度的erbb2cab,4μg/ml的erbb2抗原,2μg/ml的erbb2抗原,1μg/ml的erbb2抗原;嵌图a显示氨基硅烷载玻片的结果;嵌图b显示醛载玻片的结果;嵌图c显示环氧载玻片的结果。图41a-c显示在使用具有0.01%十二烷基肌氨酸钠和0.25mg/mlbsa的打印缓冲剂时的改善的斑点形态和cv的降低;嵌图a显示对于在1xpbs中重复四次打印的样品的tmb显影和用比色扫描仪成像后的结果图像;顶行:30μg/ml的ca15-3cab,第二行:400u/ml的ca15-3抗原,第三行:200u/ml的ca15-3抗原,底行:100u/ml的ca15-3抗原;嵌图b显示对于在1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa中重复四次打印的样品的tmb显影和用比色扫描仪成像后的结果图像;顶行:20μg/ml的ca15-3cab,第二行:1600u/ml的ca15-3抗原,第三行:800u/ml的ca15-3抗原,第四行:400u/ml的ca15-3抗原,底行:200u/ml的ca15-3抗原;嵌图c是示出嵌图a和b所示的cab和抗原的平均%变异系数(cv)的图;1:用1xpbs打印的cab的%cv,2:用1xpbs打印的抗原的%cv,3:用1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa打印的cab的%cv,4:用1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa打印的抗原的%cv。图42显示在用22ng/ml的肌红蛋白探测后的肌红蛋白捕获抗体的结果。1:利用25μg/ml肌红蛋白cab和1μg/ml肌红蛋白dab的短测定时间(10分钟)的结果信号;2:利用40μg/ml肌红蛋白cab和50ng/mldab的长测定时间(27分钟)的结果信号。图43显示在使用盒运行自动心脏面板免疫测定后从仪器原型获取的图像;角斑点是bsa-生物素斑点;cabs和抗原重复五次打印;第1行:后一半,肌红蛋白cab浓度1,第2行:肌红蛋白cab浓度2,肌红蛋白cab浓度2,第3行:肌红蛋白抗原浓度1,肌红蛋白抗原浓度2,第4行:ck-mb抗原浓度1,ck-mb抗原浓度2,第5行:ck-mbcab浓度1,ck-mbcab浓度2,第6行:ck-mbcab浓度3,nt-probnpcab浓度1,第7行:nt-probnpcab浓度2,nt-probnpcab浓度3。图44a-c是湿盒的备选实施方式的图示;嵌图a是湿盒的备选实施方式的顶部的图示;嵌图b是湿盒的备选实施方式的底部的图示;嵌图c是湿盒的备选实施方式的示意图。图45a-c是如本文所述的仪器的一个实施方式的图示;嵌图a示出仪器的正视图;嵌图b示出仪器的后视图;嵌图c显示仪器主体的分解。图46a-b是歧管的示意图;嵌图a示出歧管的后视图;嵌图b示出歧管的侧视图。图47是歧管层压体的一个实施方式的示意图。具体实施方式本公开内容部分地提供了用于并行检测多种靶多肽或其他靶分子的微流体装置。所述微流体装置可以是集成蛋白质微阵列的微流体设备,用于例如检测疾病相关的蛋白质生物标志物的阵列。通常,本文所述的微阵列免疫测定使用与常规夹心elisa相同的基本方案,不同之处在于测定是多路复用的,并且测定的尺寸显著减少,这减少了试剂和样品的消耗。靶分子靶分子包括但不限于与人类疾病相关或相联系的生物标志物、小分子、药物代谢物、滥用物质、水或土壤样品中的污染物、食物污染物和环境中的过敏原。在一些实施方式中,靶分子是可公开获得的特异性检测和/或识别分子(如抗体)所针对的那那些。生物标志物生物标志物通常是指生物状态或条件的可测量指标。因此,如本文所用的生物标志物可以指在与之相关的生物样品中发现的或从其获得的任何可检测分子,并因此可用于确定致病条件、疾病或病症的存在;对致病条件、疾病或病症的易感性;对治疗干预的响应;等等。生物标志物的实例包括但不限于用于诸如癌症、心血管疾病、糖尿病、炎性疾病或神经病症等疾病或病症的生物标志物。术语“癌症”包括癌,其是主要的癌症并且是上皮细胞或覆盖器官、腺体或其他身体结构(例如皮肤、子宫、肺、乳腺、前列腺、胃、肠)的外部或内部表面的细胞的癌症,并且其倾向于转移;肉瘤,其来源于结缔组织或支持组织(例如骨骼、软骨、肌腱、韧带、脂肪、肌肉);和血液肿瘤,其来源于骨髓和淋巴组织。癌可以是腺癌(其通常发生在能够分泌的器官或腺体,例如乳腺癌、肺癌、结肠癌、前列腺癌或膀胱癌)或可以是鳞状细胞癌(其起源于鳞状上皮,通常在身体的大部分区域发育)。肉瘤可以是骨肉瘤或成骨肉瘤(骨),软骨肉瘤(软骨),平滑肌肉瘤(平滑肌),横纹肌肉瘤(骨骼肌),间皮肉瘤或间皮瘤(体腔膜质内膜),纤维肉瘤(纤维组织),血管肉瘤或血管内皮瘤(血管),脂肪肉瘤(脂肪组织),胶质瘤或星形细胞瘤(脑内发现的神经源性结缔组织),粘液肉瘤(原始胚胎结缔组织),或者间叶瘤(mesenchymous)或混合中胚层肿瘤(混合结缔组织类型)。血液肿瘤可能是骨髓瘤,其起源于骨髓浆细胞;白血病,其可以是“液体癌症”,是骨髓癌,并且可能是骨髓性或粒细胞白血病(骨髓和粒细胞白细胞),淋巴、淋巴细胞或成淋巴细胞白血病(淋巴和淋巴细胞血细胞)或真性红细胞增多症或红细胞增多症(各种血细胞产物,但以红细胞为主);或淋巴瘤,其可以是实体瘤并且在淋巴系统的腺体或淋巴结中发展,并且可以是霍奇金淋巴瘤或非霍奇金淋巴瘤。此外,还存在混合型癌症,例如腺鳞癌、混合中胚层肿瘤、癌肉瘤或畸胎癌。癌症也可以基于它们起源的器官(即“原发部位”)命名,例如乳腺癌、脑癌、肺癌、肝癌、皮肤癌、前列腺癌、睾丸癌、膀胱癌、结肠癌和直肠癌、宫颈癌、子宫癌等。即使癌症转移到与原发部位不同的身体的另一部分,这种命名仍然存在。基于原发部位命名的癌症可与组织学分类相关联。例如,肺癌通常是小细胞肺癌或非小细胞肺癌,其可以是鳞状细胞癌、腺癌或大细胞癌;皮肤癌通常是基底细胞癌、鳞状细胞癌或黑素瘤。淋巴瘤可能出现在与头部、颈部和胸部相关的淋巴结中,也可能出现在腹部淋巴结或腋窝或腹股沟淋巴结中。用于乳腺癌的生物标志物包括但不限于癌抗原15-3(ca15-3)、癌胚抗原(cea)、细胞角蛋白片段21-1(cyfra21-1)和可溶性人表皮生长因子受体2(her2/erbb2)。ca15-3是乳腺癌的常用肿瘤标志物(生物标志物)。其来源于muc1基因;因此,ca15-3也称为粘蛋白1(muc1)(grzywa等,2014)。其长度为1255个氨基酸,分子量为122kda(begum等,2012)。其是粘蛋白家族的成员,是一个大的跨膜糖基化分子,由三个主要结构域组成:大的胞外区域,跨膜序列和胞质结构域(ricci等,2009;lucarelli等,2014;grzywa等,2014)。已经发现健康个体中ca15-3的正常范围是0-28u/ml(begum等,2012)。当存在癌时,ca15-3的顶端取向及其糖基化被改变(grzywa等,2014)并且蛋白质过表达并分布在整个细胞表面,产生保护癌细胞免受宿主免疫系统和促进转移活性的环境(danysh等,2012)。在一些实施方式中,ca15-3可用于早期检测乳腺癌复发和/或用于评估乳腺癌治疗的效率,例如通过比较治疗前后血液中ca15-3的水平。癌胚抗原(cea)是一种180-kda的糖蛋白,它是由gold和freedman于1965年首次从结肠癌中发现和提取的(gold和freedman,1965)。其正常功能是细胞粘附和抑制细胞凋亡。结果,它在正常粘膜细胞中表达并在腺癌中过表达(beauchemin和arabzadeh,2013)。它存在于肿瘤细胞膜的外围,在那里其被释放到体液中。它经常在乳腺癌、结肠直肠癌和其他上皮癌患者中过表达并释放到循环血流中(goldenberg等,1981)。cea的水平通常较低,例如在健康成人中为0至2.5μg/l(微克/升),并且在吸烟者中往往略高,在0至5μg/l之间(alexander等,1976)。在癌症患者(例如乳腺癌患者)中,cea的水平可以高于10μg/l(romero等,1996)。在一些实施方式中,cea可用作诊断、预后或监测对癌症(例如乳腺癌和结肠直肠癌)的治疗响应的标志物。细胞角蛋白片段21-1(cyfra21-1)是细胞角蛋白19的可溶性片段,细胞角蛋白的酸性1型亚基,分子量为40kda(jose等,2013),并且在细胞凋亡过程中释放到血流中(oloomi等,2013)。健康个体没有表现出升高的血清cyfra21-1水平。在一些实施方式中,cyfra21-1的大于2.0ng/ml的截断值可用于检测测定(nakata等,2000)。已经制备了具有cyfra21-1的杆结构域的螺旋2b内的表位的单克隆抗体(jose等,2013)。在一些实施方式中,cyfra21-1可用于检测癌症复发和/或癌症治疗(例如乳腺癌治疗)的功效。人表皮生长因子受体2(her2)是受体酪氨酸激酶(rtk)家族中的受体之一。her2是一种185kda的跨膜蛋白,由3个结构域组成:细胞外结构域(ecd),跨膜结构域和细胞内激酶结构域(shao等,2014)。细胞外结构域(ecd)可以通过基质金属蛋白酶从乳腺癌细胞表面切割,在切割后将her2-ecd释放到血清中(arribase等,(2010)。在一些实施方式中,her2的大于15ng/ml的水平可用于检测测定(hyashi等,2012;fornier等,2005)。在一些实施方式中,her2可用作用于诊断、预后或监测对癌症(例如乳腺癌)治疗的响应的标志物。生物标志物能够诊断、复发或监测其他癌症类型。ca19-9是最初从结肠直肠癌细胞系的培养基中分离的唾液酸化的lewis血型抗原。它是最常用的肿瘤标志物,用于cea后消化道癌的诊断。80%的晚期胰腺癌患者中的ca19-9水平升高(高于37u/ml)(su等,2015)。美国临床肿瘤学会建议在整个胰腺癌治疗过程中使用ca19-9监测以确定疾病进展(locker等,2006)。ca-125,也称为muc-16,是糖蛋白的粘蛋白家族的另一种癌抗原。它由三个不同的结构域组成:n-末端,串联重复和c-末端,细胞外区域通过蛋白水解切割从细胞中释放。ca-125是卵巢癌最有用的临床生物标志物。ca-125水平的升高(高于35u/ml)与卵巢癌的进展相关,并且fda批准其用于监测卵巢癌和检测疾病复发(leung等,2014)。ca72-4,也称为肿瘤相关糖蛋白或tag-72,是用于胃肠癌的生物标志物。与其他癌症抗原类似,它是一种超过1000kda的粘蛋白样分子。这种生物标志物对胃癌是最有用的。高水平的ca72-4(高于5u/ml)表明晚期胃癌或肿瘤复发的预后(mattar等,2002;yang等,2014)。铁蛋白是一种主要的胞质蛋白,其在细胞内铁的储存中起作用。当过表达时,其可以分泌到血清中,并且可以在多种癌症中以升高的水平发现。铁蛋白水平升高可能是霍奇金淋巴瘤、肝细胞癌、非小细胞肺癌或胰腺癌患者预后较差的指标(hann等,1990;melia等,1982;maxim等,1986;kalousova等,2012)。然而,铁蛋白的截断值随癌症类型而变化(范围92-400ng/ml)。铁蛋白水平升高也可能是乳腺癌复发的指征,而具有较高铁蛋白水平的胰腺癌患者存活率降低(robertson等,1991;kalousova等,2012)。mmp-7(基质金属蛋白酶-7)是锌依赖性内肽酶,其切割细胞外基质的蛋白质。其可以通过基底膜蛋白的蛋白水解切割促进癌症侵袭。发现mmp-7在许多癌症中过表达,包括卵巢癌、肾癌和急性髓性白血病(yokohoma等,2008)。血清中升高的mmp-7水平可用于癌症预后。卵巢癌患者显示血清mmp-7水平高于7.4ng/ml(shafdan等,2015)。此外,在胃癌患者中,mmp-7水平升高与预后较差和生存率降低有关(yeh等,2010)。心血管疾病是循环系统(包括心脏和血管)的疾病。心血管疾病包括但不限于冠状动脉疾病(例如心绞痛或心肌梗塞)、充血性心力衰竭、中风、高血压性心脏病、风湿性心脏病、心肌病、心律失常、心动过速、狭窄、先天性心脏病、心脏瓣膜病、心脏炎、主动脉瘤、外周动脉疾病、静脉血栓形成、动脉粥样硬化等。心血管疾病的生物标志物包括但不限于b型利尿钠肽、心肌肌钙蛋白、肌红蛋白和d-二聚体。b型利尿钠肽或bnp是心脏标志物,其作为激素起作用以诱导尿钠排泄、利尿和血管舒张。它最初表达为probnp激素原,然后被切割并分泌为bnp和nt-probnp(n-末端probnp)。nt-probnp具有比bnp更长的半衰期(2小时vs.20分钟)。大多数健康人的bnp约为10pg/ml。平均心力衰竭患者的bnp水平为675pg/ml,nt-probnp水平为4639pg/ml。bnp和nt-probnp在老年患者、女性和患有肾衰竭的患者中均升高。相反,肥胖人群的bnp和nt-probnp水平降低。bnp或nt-probnp水平的增加与疾病严重程度和死亡率的增加相关。在一些实施方式中,bnp或nt-probnp水平可用于预测心脏病风险的增加或减少(例如患有慢性心力衰竭的患者),或用于建立和/或监测预后、疾病严重性或指导治疗。在一些实施方式中,bnp的约80pg/ml的水平可用于检测实验。心肌肌钙蛋白是由肌钙蛋白t、肌钙蛋白i和肌钙蛋白c组成的心脏特异性复合物。尽管肌钙蛋白i更普遍,但肌钙蛋白t(37kda)和肌钙蛋白i(22kda)已被常规用作心脏标志物。肌钙蛋白i是100%心脏特异性的,与肌钙蛋白t不同,肌钙蛋白i不会因肾脏疾病或骨骼损伤而升高。肌钙蛋白水平的增加(高于160pg/ml)表明病况恶化(xue等,tonkin等)。在一些实施方式中,肌钙蛋白水平可用于预测、检测和/或确定心血管事件(例如心肌梗塞(mi)或心肌损伤)的风险、治疗的优化、预后、疾病严重性、临床结果和/或死亡率。肌钙蛋白水平的降低与更好的预后相关。肌红蛋白(17kda)是与血红蛋白相似的血红素结合蛋白,除了它存在于肌肉组织中。由于它在所有肌肉组织中,因此不是心肌特异性的。已显示在急性心肌梗塞后1-4小时,心脏组织迅速分泌。在一些实施方式中,高于88ng/ml的肌红蛋白水平可用于预测和/或检测死亡率、心肌坏死或心肌梗塞。d-二聚体是纤维蛋白降解的独特心脏标志物。它通过3种酶的连续作用形成:凝血酶,因子xiiia和纤溶酶。市售d-二聚体测定检测存在于纤维蛋白的因子xiiia-交联的片段d结构域但不存在于纤维蛋白原降解产物或非交联的纤维蛋白中的表位(adam等,2009)。在一些实施方式中,d-二聚体测量可临床应用以排除静脉血栓栓塞(vte,其包括深静脉血栓形成(dvt)和肺栓塞(pe))或用于诊断或监测弥散性血管内凝血(dic)中的凝血激活。在一些实施方式中,d-二聚体水平可用于检测启动血管内纤维蛋白形成但不是必需的血栓形成的疾病过程,例如但不限于血液凝固的激活、衰老、妊娠、癌症或癌症相关的vte(ay等,2009)。在一些实施方式中,约500ng/ml的水平可用于检测测定。其他生物标志物可包括但不限于:钙调理蛋白-h2、岩藻糖基转移酶iv(fut4)、agr3(前梯度-3)、agr2(前梯度-2)、dj-1、胸苷激酶1(tk1)、α-甲胎蛋白、psa(前列腺特异性抗原)、绒毛膜促性腺激素(hcg)、pro-grp(胃泌素释放肽前体)、nse(神经元特异性烯醇化酶)、scc-ag(鳞状细胞癌抗原)/ta-4、ca-242、ca-50、pepi/ii(胃蛋白酶原i/ii比率)、afu(α-l-岩藻糖苷酶)、alp(碱性磷酸酶)、he-4(人附睾蛋白4/wfdc2)、β2m(β-2-微球蛋白)、vma(香草扁桃酸,3-甲氧基-4-羟基扁桃酸)、tpa(组织多肽抗原)、半乳糖凝集素-3、髓过氧化物酶和hs-crp。生物标志物还可用于诊断和监测各种其他医学病况。炎症是先天免疫反应的标志,涉及病原性感染和组织损伤。此外,人们可能患有慢性炎症性疾病,例如类风湿性关节炎、哮喘和肠易激综合症。炎症生物标志物评估炎性状态下的疾病活动并诊断和控制感染。标志性炎症生物标志物是c-反应蛋白或crp。crp是蛋白质的正五聚蛋白家族(110-144kda),其在被细胞因子激活时由肝细胞分泌(algarra等,2013)。然后crp循环到感染或组织损伤部位,以帮助将补体蛋白质补充到炎症部位。在健康个体中,crp的中位数浓度为0.8μg/ml。在炎症刺激后,其增加至超过500μg/ml。血清浓度在前6小时升至超过5μg/ml,在48小时达到峰值(pepys和hirschfield,2003)。由于炎症可能是心血管损伤的指征,crp也被用作心脏病风险的生物标志物。另外的炎症生物标志物包括上述铁蛋白和mmp-7。血清铁蛋白被认为是急性和慢性炎症的急性期反应物和标志物。发现它在广泛的炎症条件下升高。据认为铁蛋白的增加反映了铁储存的增加,而铁储存则远离病原体的使用(wang等,2010)。mmp-7除了用作癌症的标志物之外,还是炎症的生物标志物。mmp-7因炎性细胞因子以及病原性细菌的存在而上调(burke,2004)。对于铁蛋白和mmp-7潜在抗体,参见段落[0073]和[0074]。已经进行了许多工作来开发神经病症如神经退行性疾病和脑损伤的生物标志物。诸如阿尔茨海默氏病、帕金森病和朊病毒病等神经退行性疾病的特征在于蛋白质聚集体或斑块的形成。识别血浆或脑脊液(csf)中的特定生物标志物将为医生提供相对非侵入性的诊断这些疾病的方法。阿尔茨海默病是一种进行性神经退行性疾病,其损害认知功能,影响80%的80岁以上人群(nayak等,2015)。其特征在于由淀粉状蛋白β肽42和tau蛋白质组成的淀粉样斑块的形成。有趣的是,已发现阿尔茨海默病患者的csf中淀粉样蛋白β-42水平较低,这可能是由于其在大脑中的积累。相反,csf中的tau升高(nayak等,2015)。利用在阿尔茨海默氏症的患者血浆中发现的生物标志物将是一种侵入性甚至更少的诊断技术。阿尔茨海默氏症患者血液中的蛋白质补体因子h(cfh)增加。cfh是补体途径的负调节因子,血液中的水平升高与疾病的后期相关。cfh也是一种特别有用的生物标志物,因为它在其他神经退行性疾病中没有出现,因此是阿尔茨海默氏症特异性的(nayak等,2015)。帕金森氏病是阿尔茨海默病后最常见的神经退行性疾病。其特征在于由脑干和大脑中的进行性神经变性引起的严重运动损伤。许多神经元显示出包含最显著由α-突触核蛋白组成的包涵体。此外,在帕金森患者的csf中发现了许多蛋白质,这些生物标志物的临床有用性仍有待确定。然而,在帕金森病患者的血清中发现了补体相关蛋白的增加。具体而言,上述cfh以及c3c、c3dg和因子b的增加(nayak等,2015)。朊病毒病,也称为传染性海绵状脑病,是一组独特的可以影响人类和动物的疾病。在人类中,传播通常是遗传的,导致33-35kda朊病毒蛋白的异常积累。在其疾病状态中,朊病毒蛋白呈现β-折叠构象而不是其典型的α-螺旋构象,导致蛋白质积聚和聚集(nayak等,2015)。目前的诊断方法无法识别朊病毒疾病,因此为这种疾病设置生物标志物将是非常有益的。csf中的一些生物标志物已在朊病毒病患者中被鉴定出来。具体而言,14-3-3、β-淀粉样蛋白、tau、s100b和神经元特异性烯醇化酶(nse)(rubenstein,2015)。一个缺点是这些标志物不是朊病毒疾病特异性的并且也可以存在于其他神经退行性疾病中。因此,需要进行大量研究以鉴定在csf或血浆中易于获得的朊病毒疾病特异性生物标志物。应理解可以使用生物标志物的任意组合。在一些实施方式中,例如,cyfra21-1可与其他乳腺或其他癌症生物标志物(例如ca15-3)一起用于确定癌症的复发和/或癌症治疗的功效,例如乳腺癌治疗;肌钙蛋白可与肌红蛋白或肌酸激酶mb(ck-mb)一起用于心肌梗塞(mi)的早期检测;肌钙蛋白可与crp或nt-probnp一起用于患有与急性冠状动脉综合征(acs)一致的临床综合征的患者的风险评估;等等。流体样品“流体样品”可以是含有或疑似含有靶分子的任何流体,例如生物样品、环境样品、法医样品等。“生物样品”可以是直接或间接从受试者分离或获得的任何器官、组织、细胞或细胞提取物。例如,生物样品可以包括但不限于获自患者受试者(人或动物)、实验受试者或实验动物受试者的来自骨、脑、乳腺、结肠、肌肉、神经、卵巢、前列腺、视网膜、皮肤、骨骼肌、肠、睾丸、心脏、肝脏、肺、肾、胃、胰腺、子宫、肾上腺、扁桃体、脾脏的细胞或组织(例如来自活组织检查或尸检),软组织,外周血,全血,红细胞浓缩物,血小板浓缩物,白血球浓缩物,血细胞蛋白,血浆,富含血小板的血浆,血浆浓缩物,来自任何血浆分馏的沉淀物,来自任何血浆分馏的上清液,血浆蛋白馏分,纯化或部分纯化的血液蛋白或其他成分,血清,精液,哺乳动物初乳,乳汁,尿液,粪便,唾液,胎盘提取物,羊水,冷沉淀物,冷冻上清液,细胞裂解液,哺乳动物细胞培养物或培养基,发酵产物,腹水,血细胞中存在的蛋白质,实体瘤或任何其他标本,或其任意提取物。在一些实施方式中,可能需要将癌细胞与样品中的非癌细胞分开。样品还可以包括但不限于通过正常细胞或转化细胞在细胞培养物中产生的产物(例如,通过重组dna或单克隆抗体技术)。样品还可以包括但不限于从非哺乳动物受试者(例如昆虫或蠕虫)分离的任何器官、组织、细胞或细胞提取物。样品还可以包括但不限于植物、细菌、霉菌、孢子或病毒。“样品”也可以是在实验条件下产生的细胞或细胞系,其不直接与受试者分离。样品也可以是无细胞的、人工衍生的或合成的。样品可以来自已知癌性、疑似癌性或被认为不是癌性的细胞或组织(例如,正常或对照)。在一些实施方式中,如本文所用的样品基本上是纯化的,例如不含细胞和/或细胞提取物。因此,在一些实施方式中,样品可包括基本上不含细胞的体液或提取物,例如血浆、血清或尿液。应当明白这种样品可含有少量细胞,例如5%以下,即0%至5%之间的任意值,例如小于1%、2%、3%、4%或5%。作为另一选择,样品可含有细胞,例如全血。“对照”包括获得用于确定基线表达或活性的样品。因此,对照样品可以通过许多方法获得,包括来自非癌细胞或组织,例如来自受试者的肿瘤周围的细胞或癌细胞;来自未患癌症的受试者;来自未疑似患有癌症风险的受试者;或来自此类受试者的细胞或细胞系。对照还包括先前建立的标准。因此,可以将根据本发明进行的任何测试或测定与建立的标准进行比较,并且可能不必每次都获得用于比较的对照样品。可以分析样品以检测关注的靶分子的存在或量。蛋白质微阵列可以使用特异性结合靶分子的合适的结合伴侣或其片段来检测靶分子。例如,在一些实施方式中,生物标志物可以使用特异性结合生物标志物的合适抗体或其片段来检测。在备选实施方式中,例如,可以使用蛋白质或肽来检测自身抗体。如本文所述或本领域已知的,可以使用任何合适的检测方法。抗体在识别生物标志物时“特异性结合”生物标志物,但基本上不识别并结合样品中的其他分子。这种抗体具有例如对生物标志物的亲和力,其比样品中抗体对另一参照分子的亲和力大至少10、100、1000或10000倍。在一些实施方式中,可特异性结合生物标志物的抗体或其片段以微阵列存在(“抗体微阵列”)。“抗体微阵列”是指在合适的基底上提供的能够结合多个生物标志物的多个抗体或其片段,所述基底例如为化学官能化或涂布聚合物的玻璃或类似材料。可以使用标准技术将抗体附着或沉积在基底上,例如使用微阵列点样机器人。通常,抗体可以设置在基底的区域中,使得它们可以检测生物标志物。该区域可以是任何合适的尺寸,这取决于所用抗体的数量和打印的密度以及化学官能化或聚合物涂布的区域的大小。通常,抗体微阵列会包含能够特异性结合多个生物标志物的多个抗体。例如,在一些实施方式中,在抗体微阵列中,每个不同的抗体可以特异性结合不同的生物标志物。在备选实施方式中,抗体微阵列可包含能够特异性结合具体生物标志物的多个抗体。因此,每个抗体可以与微阵列中存在的其他抗体不同,这样它们可以特异性地结合不同的生物标志物,或者特异性地结合相同生物标志物的不同区域。抗体微阵列可以包含适当数量的抗体,例如约2个至约10,000个抗体,或者约100、200、300、500、1000、1500、2000、3000、4000、5000、6000、7000、8000、9000或10000个抗体中的任意值。在一些实施方式中,受制于例如微阵列基底的尺寸、设备可检测区域的大小、光学检测系统提供的图像分辨率以及抗体的斑点尺寸,可以使用更大的数量,例如15000、20000或30000以上。应当明白可以在基底上点样的抗体数量取决于基底的尺寸、斑点的密度、交叉反应性相互作用、斑点尺寸等。例如,随着能够检测生物标志物的区域的大小增加,或斑点密度的增加,或斑点尺寸的减小,可以点样更多数量的抗体。抗体可以在基底上设置为直径可以为约50微米至约500微米的斑点,或者例如60微米、100微米、200微米或250微米中的任意值。在一些实施方式中,受制于例如微阵列基底的尺寸、可由生物标志物检测的区域的大小和抗体的密度,斑点可以更大。斑点可具有任意形状,无论是规则的还是不规则的。抗体斑点通常在空间上彼此离散。通常,斑点彼此分开至少100微米,例如彼此分开至少100、200或400微米。斑点可以以任何合适的方式排列,无论是有序的还是随机的。通常,斑点以有序的方式排列,使得斑点的分离是规则的和预定的。斑点可以排列成一维、二维或三维。例如,斑点可以按行和列排列,数量为约10至约1,000。微流体盒可提供包含微流体环路、反应室或“阵列室”、含有诸如试剂、缓冲剂或样品的储罐的盒(“微流体盒”)。在一些实施方式中,微流体盒可包括但不限于多个试剂储罐和通道,多个缓冲剂储罐和通道,多个废物储罐和通道,多个通气口,多个端口,用于检测蛋白质微阵列的孔,以及连接储罐的通道,例如从主结点引出的通道或通向缓冲剂通道的通道、将缓冲剂通道与试剂通道连接的通道、将阵列室与废物储罐连接的通道、将阵列室与主结点或通道连接的通道、将主结点或通道连接至废物储罐的通道,和/或用于接收流体样品的托座或孔。在一些实施方式中,样品托座或孔可不存在,并且样品可装载到所述储罐中的一个内。在一些实施方式中,一些通道可设置在主结点的周围。在一些实施方式中,一些通道可与主通道连接。通道可以配置成通过例如减少或防止气泡而允许流体平稳流动,并且通过例如减少或防止试剂和/或缓冲溢出而使交叉污染最小化。在一些实施方式中,微流体盒可包含多个液体不可透的透气的阻隔物,例如液体不可透的透气的膜。在一些实施方式中,液体不可透的透气的阻隔物可以是水性液体不可透的。在一些实施方式中,液体不可透的透气的阻隔物可以是高表面张力液体不可透的。微流体盒可以包含用于接收蛋白质微阵列的托座。在一些实施方式中,微流体盒可包含蛋白质微阵列。微流体盒可以与蛋白质微阵列流体连通。在一些实施方式中,微流体盒可包含:包含含有诸如试剂或缓冲剂等流体的储罐的“湿”部(“湿盒”);和包含微流体环路和反应室的“干”部(“干盒”)。湿盒可配置成与干盒对准。样品托座可位于湿盒中或干盒中。微流体盒可与仪器气动连接以便例如控制流体的运动。所述仪器能够检测蛋白质微阵列。通气口可与仪器的歧管相接。湿盒湿盒可包含多个试剂储罐和通道、多个缓冲剂储罐和通道、多个废物储罐、多个通气口、多个端口、以及可选的用于接收流体样品的样品托座或孔。在一些实施方式中,缓冲剂储罐的数目可与试剂储罐的数目相同。在一些实施方式中,湿盒可包含两个废物储罐,称为第一废物储罐和第二废物储罐。在一些实施方式中,通气口的数目对应于缓冲剂储罐、试剂储罐和废物储罐中的每一个。在一些实施方式中,端口的数目可对应于缓冲剂储罐、试剂储罐、废物储罐和如果存在时的样品托座或孔中的每一个。在一些实施方式中,湿盒可包含多个试剂储罐,其中缓冲剂储罐的数目与试剂储罐的数目相同;多个废物储罐;多个通气口,其对应于缓冲剂储罐、试剂储罐和废物储罐中的每一个;可选的用于接收流体样品的样品托座或孔;和对应于缓冲剂储罐、试剂储罐、废物储罐和如果存在时的样品托座或孔中的每一个的多个端口。在一些实施方式中,湿盒可包含:多个试剂储罐(本文中称为“r#”);与试剂储罐相同数目的缓冲剂储罐(本文中称为“b#”);多个废物储罐(本文中称为“w#”),使得缓冲剂储罐、试剂储罐和废物储罐配置为允许指定的体积;多个通气口,其对应于缓冲剂储罐、试剂储罐和废物储罐中的每一个;用于接收流体样品的样品托座或孔;对应于缓冲剂储罐、试剂储罐、废物储罐和样品托座或孔中的每一个的多个端口;和可选的,层压底部,其含有在每个储罐下面的预切洞以用于装载所述储罐。在一些实施方式中,湿盒组件可具有以下尺寸。缓冲剂储罐b1和/或试剂储罐r2可以是大致椭圆形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。b1和/或r2可以长约3mm至约40mm,例如约9mm;宽约2mm至约50mm,例如约3mm,深2mm至约7mm,例如约7mm,并且体积为约10μl至约2000μl,例如约160μl。在一些实施方式中,b1可以是大致椭圆形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。b1可以长约2mm至约40mm,例如约9mm;宽约2mm至约50mm,例如约7mm,深2mm至约7mm,例如约7mm,并且体积为约10μl至约2000μl,例如约200μl。在一些实施方式中,r2可以是大致椭圆形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。r2可以长约2mm至约40mm,例如约9mm;宽约2mm至约50mm,例如约4mm,深2mm至约7mm,例如约7mm,并且体积为约10μl至约2000μl,例如约160μl。试剂储罐r3可以是大致椭圆形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。r3可以长约3mm至约40mm或其间的任意值,例如约9mm;宽约2mm至约50mm或其间的任意值,例如约4mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约200μl。缓冲剂储罐b4可以通常是弯曲形状的,角度为约90度至约179度,例如150度,以便例如允许指定的体积和正确的端口对准,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。b4可以长约3mm至约40mm或其间的任意值,例如约13mm;宽约2mm至约50mm或其间的任意值,例如约8mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约420μl。缓冲剂储罐b5可以大致椭圆形的,在一侧具有附加区域以容纳额外的体积,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。在一些实施方式中,b5可以在该侧包含额外的三角形区域,以容纳额外的体积。b4可以长约3mm至约40mm或其间的任意值,例如约13mm;宽约2mm至约50mm或其间的任意值,例如约7mm或约8mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约420μl。试剂储罐r6可以是大致椭圆形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。r6可以长约3mm至约40mm或其间的任意值,例如约11mm;宽约2mm至约50mm或其间的任意值,例如约3mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约226μl。试剂储罐r7可以大致椭圆形的,在一侧具有附加区域以容纳额外的体积,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。r7可以包含在基座上的轻微凸起,以容纳额外的体积。r7可以长约3mm至约40mm或其间的任意值,例如约11mm;宽约2mm至约50mm或其间的任意值,例如约4mm或约5mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约260μl。缓冲剂储罐b8可以是大致弯曲形状的,角度为约90度至约179度,例如150度,以允许与干盒接合,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形。在一些实施方式中,b8的形状可构造成在湿盒末端的凹口或梢周围造型,以便与干盒接合。b8可以长约3mm至约40mm或其间的任意值,例如约15mm或约16mm;宽约2mm至约50mm或其间的任意值,例如约6mm或约10mm,深2mm至约7mm或其间的任意值,例如约7mm,并且体积为约10μl至约2000μl,例如约420μl。废物储罐w1可以是大致u形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形,并具有允许进入的流体汇集的附加区域。在一些实施方式中,w1可具有方形凸起,其在靠近右边缘的储罐底部附近。w1的体积可以为约100μl至约20000μl或其间的任意值,例如约3130μl或约4000μl。在w1中,进入入口的流体可沿着盒的右边缘行进经过储罐,沿着盒的底边行进,然后沿盒的左边缘向上行进,直至其到达通气口54。这可以防止进入的流体射到储罐的末端并堵塞通气口。在一些实施方式中,w1可以在入口附近膨胀以形成初始的大储罐区域,以便例如允许流体容易地汇集到储罐中。废物储罐w2可以是大致u形的,但是也可以考虑其他形状,例如圆形、椭圆形、矩形和正方形,并且体积为约100μl至约20000μl或其间的任意值,例如约2100μl或约2500μl。不受任何具体理论的束缚,w2的形状可允许进入w2储罐的流体尽可能远离通气口,从而防止通气口的无意堵塞。在一些实施方式中,w2可以在入口附近膨胀以形成初始的大储罐区域,以例如降低流体阻力。在一些实施方式中,例如包括初始大储罐区域的那些,w1和/或w2中的任一个或两者可以变窄以连接到w1或w2对应的端口。可以在w1和w2中添加压痕以减少或防止流体立即到达w1或w2的窄区域,这可能导致阻力和流动停止。如果存在时的样品托座或孔可以长约1mm至约20mmlong或其间的任意值,例如约1.25mm、1.5mm或3mm;宽约1mm至约10mm或其间的任意值,例如约1.25mm、2mm或5mm;深2mm至约7mm或其间的任意值,例如约7mm,并且样品的容量为约4μl至约500μl,例如约25μl。湿盒的底部可以由任何合适的材料制成。在一些实施方式中,湿盒可具有层压底部。层压底部可包含与储罐对准并在储罐下方的预切洞,以例如有助于储罐装载。在一些实施方式中,湿盒可包括在湿盒侧面的试剂或缓冲剂储罐装载口。在装载后,侧端口或预切洞可以用例如透明胶带或任何其他合适的密封剂密封。在一些实施方式中,湿盒可以包含在盒前面的手柄。在备选实施方式中,湿盒可包含在湿盒侧面的把手。在一些实施方式中,湿盒可包括对准特征(alignmentfeatures),例如半圆形切口,以帮助将湿盒与干盒对准。湿盒可由具有低蛋白质粘合性质的任何合适材料制成,例如但不限于聚甲基丙烯酸甲酯(pmma)、聚苯乙烯(ps)、聚对苯二甲酸乙二醇酯(pet)和聚氯乙烯(pvc)。在一些实施方式中,湿盒可由聚碳酸酯制成。在一些实施方式中,湿盒可以是可重复使用的。在备选实施方式中,湿盒可以是一次性的。干盒干盒可包含用于检测蛋白质微阵列的孔隙;多个微流体通道,其包含多个试剂通道、多个缓冲剂通道以及连接通道,例如从主结点或主通道通向缓冲剂通道的通道、将缓冲剂通道与试剂通道连接的通道、通向废物储罐或主结点或主通道的通道等;多个通气口;可选的,对应于通气口的多个液体不可透的透气的阻隔物;和可选的用于接收流体样品的样品托座。在一些实施方式中,通道可设置在主结点或主通道周围。在一些实施方式中,干盒可包含用于检测蛋白质微阵列的孔隙和设置在主结点或主通道周围的多个微流体通道,其中在与湿盒对准时所述孔隙限定阵列室,并且在干盒和湿盒之间接收蛋白质微阵列的托座限定阵列室的底部,所述微流体通道包含多个试剂通道,其中每个试剂通道对应于湿盒中的一个试剂储罐;多个缓冲剂通道,其中每个缓冲剂通道对应于湿盒的一个缓冲剂储罐;从主结点通向每个缓冲剂通道的通道;将每个缓冲剂通道与每个试剂通道连接的通道,以形成缓冲剂通道/试剂通道对;将阵列室与第一废物储罐连接的通道;将阵列室与主结点连接的通道;将主结点与第二废物储罐连接的通道;其中所述通道配置为允许流体平稳流动和交叉污染最小化;对应于所述湿盒的缓冲剂储罐、试剂储罐和废物储罐中每一个的多个通气口;和对应于每个通气口的多个液体不可透的透气的阻隔物。在一些实施方式中,干盒可包含用于接收蛋白质微阵列的托座。在一些实施方式中,干盒可包含蛋白质微阵列。在一些实施方式中,孔隙可限定阵列室,并且蛋白质微阵列限定阵列室的底部。在一些实施方式中,在与湿盒对准时,孔隙可限定阵列室,并且在干盒和湿盒之间接收蛋白质微阵列的托座限定阵列室的底部。在一些实施方式中,液体不可透的透气的阻隔物可叠加在通气口上。在一些实施方式中,所述通道可配置为允许流体平稳流动且交叉污染最小化。在一些实施方式中,干盒可包括:设置在主结点周围的多个微流体通道,其包含:-多个试剂通道(本文中称为“r#c”),使得每个试剂通道对应于湿盒的一个试剂储罐;-多个缓冲剂通道(本文中称为“b#c”),使得每个缓冲剂通道对应于湿盒的一个缓冲剂储罐;ii)-从主结点通向每个缓冲剂通道的通道(本文中称为“c#/#”);-将每个缓冲剂通道与每个试剂通道连接的通道,以形成缓冲剂通道/试剂通道对;-将主结点与第二废物储罐(w2)连接的通道;-将阵列室与主结点连接的通道(本文中称为“prec”);和-将阵列室与第一废物储罐(w1)连接的通道(本文中称为“postc”);使得所述通道配置为允许流体平稳流动且交叉污染最小化。在一些实施方式中,干盒可包含:设置在主结点周围的多个微流体通道,其包含:-多个试剂通道(本文中称为“r#c”),使得每个试剂通道对应于湿盒的一个试剂储罐;-多个缓冲剂通道(本文中称为“b#c”),使得每个缓冲剂通道对应于湿盒的一个缓冲剂储罐;-在缓冲剂通道上方的聚四氟乙烯(ptfe)膜,其暴露于大气;-将每个缓冲剂通道与每个试剂通道连接的通道,以形成缓冲剂通道/试剂通道对;-将主结点与废物储罐连接的通道(本文中称为“cw2”);-将所有缓冲剂和储罐通道与主通道(本文中称为“mainc”)连接的通道;-将阵列室与主通道连接的通道(本文中称为“prec”);和-将阵列室与废物储罐连接的通道(本文中称为“postc”);使得所述通道配置为允许流体平稳流动且交叉污染最小化。在一些实施方式中,干盒可包含:设置在主结点周围的多个微流体通道,其包含:-多个试剂通道(本文中称为“r#c”),使得每个试剂通道对应于湿盒的一个试剂储罐;-多个缓冲剂通道(本文中称为“b#c”),使得每个缓冲剂通道对应于湿盒的一个缓冲剂储罐;-在缓冲剂通道和试剂通道口下面的聚丙烯膜(本文中称为“密封膜”);-将每个缓冲剂通道与每个试剂通道连接的通道,以形成缓冲剂通道/试剂通道对;-将所有缓冲剂和储罐通道与主通道(本文中称为“mainc”)连接的通道;-将主通道(称为“mainc”)与第一废物储罐连接的通道(本文中称为“cw2”);-将阵列室与主通道连接的通道(本文中称为“prec”);和-将阵列室与废物储罐连接的通道(本文中称为“postc”);使得所述通道配置为允许流体平稳流动且交叉污染最小化。在干盒和湿盒接口处包含密封膜并且不受任何特定假设的约束的实施方式中,密封膜可以减少或消除气泡和/或减少或防止试剂或缓冲剂的交叉污染。在一些实施方式中,可防止试剂或缓冲剂过早进入干盒。密封膜可由聚丙烯制成。密封膜的孔径可为约10μm,并且可厚约51μm。在加入来自泵的压力后,试剂流体能够穿过密封膜并通过试剂通道进入干盒,所述试剂通道与配对的缓冲剂通道连接,最终连接主通道,其将试剂带到阵列室。密封膜可位于阀门/干盒接口,其被称为透气膜(gpm)或流体阻隔膜,在这个位置,其可以通过将流体限制在盒内来保护仪器免受流体入口的影响。密封膜还可以或另选地位于缓冲剂和储罐通道(例如b1c或r2c)的入口,以便例如减少或防止流体过早地进入干盒,并有助于减少或防止交叉污染,例如试剂交叉污染。在一些实施方式中,缓冲剂和试剂通道的配对允许在试剂步骤后用缓冲剂冲洗试剂通道,这可以帮助减少或防止交叉污染,例如试剂交叉污染。在一些实施方式中,试剂/缓冲剂通道对可与主通道而不是主结点连接。这种构型可以在干盒的构造中允许更少的层压层,其不受任何特定假设的约束,可以减少或防止气泡被困在接合处并减少或阻止流动。在一些实施方式中,通向废物储罐的通道(例如w2c)可减少或防止气泡。例如,在流向阵列室之前,试剂首先灌注到相应的废物储罐(例如w2)。这样在试剂进入之前去除通道中可能存在的气泡和空气。在试剂进入阵列室之前首先将这些气泡推送到w2,可以减少或防止气泡干扰位于阵列室中的抗体和抗原斑点。例如,在一些实施方式中,储罐2的试剂通道(r2c)可与储罐1的缓冲剂通道(b1c)连接;储罐3的试剂通道(r3c)可与储罐4的缓冲剂通道(b4c)连接;储罐6的试剂通道(r6c)可与储罐5的缓冲剂通道(b5c)连接;并且储罐7的试剂通道(r7c)可与储罐8的缓冲剂通道(b8c)连接(例如图25a)。在一些实施方式中,试剂/缓冲剂通道对可直接连接到主结点或通道。干盒可包含用于检测来自抗体微阵列的信号的孔隙(本文称为“阵列室”)。应当明白,取决于通道和储罐的特定几何形状,孔隙的位置和尺寸可以改变,因此阵列室可以改变。可以将样品托座引入干盒中,以允许样品装载到该储罐中。样品装载后,样品托座可以密封,例如用透明胶带密封,以减少或防止泄漏。在一些实施方式中,干盒组件可具有以下尺寸。缓冲剂通道b1c、b4c、b5c和/或b8c可以长约3mm至约36mm或其间的任意值,例如长约14mm、16mm或25mm,并且宽约0.5mm至约3mm或其间的任意值,例如约2mm。试剂通道r2c、r3c、r6c和/或r7c可以长约约3mm至约20mm或其间的任意值,例如长约11mm,并且宽约0.5mm至约3mm或其间的任意值,例如约2mm。受任何特定理论的束缚,缓冲剂和/或试剂通道的宽度和深度可允许在储罐和通道之间形成空气袋,从而在通道中提供足够的容量,使得试剂不会偶然离开储罐。c1/2和/或c5/6可以长约3mm至约35mm,例如约16mm,并且宽约0.5mm至约3mm,例如约1mm。c3/4可以长约3mm至约35mm,例如约8mm,并且宽约0.5mm至约3mm,例如约1mm。c7/8可以长约3mm至约50mm,例如约32mm,并且宽约0.5mm至约3mm,例如约1mm。prec可以长约3mm至约44mm或其间的任意值,例如约17mm、22mm或30mm,并且宽约0.5mm至约3mm,例如约1mm。postc可以长约12mm至约300mm或其间的任意值,例如约70mm或122mm,并且宽约0.5mm至约3mm或其间的任意值,例如约1mm至约1.5mm。当存在时,mainc可以长约20mm至约80mm或其间的任意值,例如约53mm或65mm,并且宽约0.5mm至约3mm或其间的任意值,例如约1mm。当存在时,ptfe膜可以长约5mm至约27mm,例如约7mm,并且宽约2.5mm至约6mm,例如4mm。阵列室的面积可以为约4mm2至约500mm2或其间的任意值,例如面积为约100mm2,并且深约100μm至300μm或其间的任意值,例如深250μm。当存在时,“密封膜”可以长约5mm至约80mm,例如约3mm,并且宽约2.5mm至约7mm,例如3mm。干盒可由具有低蛋白质粘合性质的任何合适材料制成,例如但不限于聚甲基丙烯酸甲酯(pmma)、聚碳酸酯、聚苯乙烯或环状烯烃聚合物。在一些实施方式中,干盒可由聚对苯二甲酸乙二醇酯制成。干燥盒中的通道可以使用激光或任何合适的方式形成,例如复制成型,感染成型或压花。在一些实施方式中,干盒可以是一次性的。湿盒中的通气口可配置为与干盒中的通道的通气口对准。在一些实施方式中,湿盒中的通气口可与干盒的通气口和透气或流体阻隔膜对准,使得空气能够自由流动(图27)。在一些实施方式中,湿盒中的通气口可与干盒的通气口和透气或流体阻隔膜对准,使得仪器中的泵产生的压力能够自由地通过,而不允许液体通过(图27)。在一些实施方式中,湿盒中的储罐位置可配置为与干盒中的通道的端口对准(图27)。应当明白,干盒的尺寸足够容纳微流体通道和用于检测来自蛋白质微阵列(例如抗体微阵列)的信号的孔隙的几何形状。湿盒的尺寸可以由干盒的尺寸确定。在一些实施方式中,组装的微流体盒的尺寸可以为约8cm×5.5cm×1cm。“约”是指5%以下的值或范围的方差(正或负),例如0.5%、1%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%等。流体(例如试剂和/或缓冲剂)可装载到湿盒或微流体盒的适当储罐中。在一些实施方式中,试剂和/或缓冲剂可通过层压底部中的孔装载,其可在装载后密封。在一些实施方式中,试剂和/或缓冲剂可在使用前装载和密封到湿盒或微流体盒的适当储罐中,并在例如4℃储存。在备选实施方式中,试剂和/或缓冲剂可以在即将使用前装载和密封到湿盒或微流体盒的适当储罐中。在一些实施方式中,试剂和/或缓冲剂可分别由湿盒和/或干盒或微流体盒提供。样品可以同时装载到样品托座或孔中,或者随后装载到试剂和缓冲剂中。湿盒或微流体盒可包括用于纯化流体样品的系统。例如,过滤器或膜可用于例如血液样品。应当明白的是纯化程度将取决于所用流体样品的类型,在许多情况下,部分纯化可能就足够了。在一些实施方式中,样品可以装入血液过滤元件中。这可能包含一个血浆过滤器,以便过滤全血中的血浆和去除血细胞。可以将蛋白质微阵列(例如抗体微阵列)载玻片附接到干盒上,使得微阵列上的蛋白质或抗体斑点在干盒的孔隙(阵列室)内对准,并且可以在分析开始时暴露于来自湿盒的流体(例如样品、缓冲剂、试剂)。干盒和湿盒可对准,使得蛋白质或抗体微阵列中的蛋白质或抗体可进入阵列室,干盒中的微流体通道、端口和/或通气口与湿盒中相应的储罐、端口和/或通气口对准。在一些实施方式中,湿盒和/或干盒中的凹口或导向装置可允许轻易对准。在一些实施方式中,湿盒和干盒可以可逆地连接以形成组装的微流体盒,使得湿盒可以重复使用。在一些实施方式中,湿盒和干盒可分别提供。在备选实施方式中,湿盒和干盒可以永久地连接以形成组装的微流体盒,其可以在使用后丢弃。在一些实施方式中,湿盒和干盒可与蛋白质微阵列一起提供。在一些实施方式中,蛋白质微阵列可与湿盒和/或干盒或微流体盒分开提供。仪器和操作微流体盒可以插入设计用于保持微流体盒的仪器的盒托座中。仪器可包括用于微流体盒的对准/弹出机构。例如,仪器可以包括夹紧特征,该夹紧特征可以夹入微流体盒中的相应特征,例如半圆形特征,以帮助盒的正确对准。微流体盒可以与仪器气动连接,以例如控制流体的运动。仪器可能能够使用光学传感器或其他检测系统(例如,比色系统)检测蛋白质微阵列。仪器可包括用于纯化流体样品的系统。除了盒托座和对准/弹出机构之外,仪器还可以包括但不限于泵、阀门系统、歧管、led激发源、检测系统、cpu、蓝牙连接、lcd触摸屏、可充电电池、电路板、hdmi适配器、usb连接器、以太网连接适配器、串口、通气扇、电源开关和/或防护罩中的一个或多个。一旦插入,干盒中的通气口可与将阀门与储罐口连接的仪器的歧管接合。在一些实施方式中,泵、阀门和检测系统可以与打印电路板集成,该打印电路板能够将来自软件的电输入传递到各种组件。泵可用于产生压力驱动的流体流动。合适的泵可以能够相继输送例如试剂、缓冲剂和/或样品。在一些实施方式中,所述泵可以是真空泵。应当明白,可以使用任何合适的泵,只要其能够在仪器的背景下根据需要操作即可。可设计仪器,使得泵能够从试剂储罐推动,由此使流体朝废物储罐流动。图32示出了示例性注射泵。泵通常可以是在其侧面转动的u形。底部的泵可以插入仪器的歧管中。o形环可以安装在泵的端部周围以密封歧管内的泵,并密封用于驱动流动的空气压力。泵的上部可以具有齿。具有互补齿的环可以将泵连接到电机,使得当电机移动时,泵将移入或移出歧管。泵可通过电机(例如,vex:rb-inn-11)操作。盒读取器可包括用于推动或拉动指定体积空气的容积式空气泵。可例如通过接地不锈钢销针轴向移动到泵腔中而使空气移位。销针可通过固定径向密封件在腔体入口处密封。销针可由步进电机驱动(haydonkerklc1574w-05)线性致动器直接移动。可用接近传感器光学测量泵位置。可以自动校准泵以检测和校正跳过的步骤并考虑结构的变化。阀门可允许自动控制泵、通气口和喷嘴之间的气动连接。阀门可使用螺钉和面密封安装到歧管组件。歧管组件可包括多个阀门,一级两个额外阀门的空插座。系统中可包括压力传感器,以便测量泵内的压力。应尽量减少压力传感器和传感器连接内的空气量,以改善系统响应。阀门可以是螺线管阀门(例如,parker:x-705l-f或lee:lhdx0532300b)。阀门可以置于每个储罐上方,包括废物储罐(图29),还有一个额外的阀门用于通气,或者允许泵归零而不连接到盒中。打开与特定储罐相关联的螺线管阀门,导致储罐中的流体从储罐移向废物储罐。仪器可装配有包含通道的歧管,用于在泵、阀门和盒之间通过空气,使得空气可以从泵通过歧管行进到阀门。如果阀门打开,则空气可行进经过特定阀门,返回歧管并进入盒的相应储罐。图33和图47示出了示例性歧管,其用于将来自泵的控制连接至通向盒的阀门。空气通过端口88离开泵,行进到阀门入口85,并通过打开的阀门。然后空气通过端口86离开阀门,重新进入歧管并行进到歧管与盒87连接的端口。在泵的归零期间,或行进到w1(1)或w2(2)空气通过端口排出至大气63。java应用程序允许图像捕获,分析脚本和信号量化,并使用公开可用的相机通信库,实现公共可用的控制器协议,并使用标准的java图形用户界面库。可以使用软件来控制仪器中阀门的开放,从而控制流体的运动,例如如下:-缓冲剂可以从缓冲剂储罐推动通过主结点,然后到达第二废物储罐(w2),以大幅减少或净化空气通道;-样品可从样品孔推动经过例如试剂储罐r7,通过主结点,并经由prec通过阵列室,经由postc到达第一废物储罐(w1)上;-试剂可从试剂储罐推动通过主结点并通过阵列室(经由prec),经由postc到达第一废物储罐(w1)上。光学传感器可以用于获取样品测定结果的读数,并且可以使用量化软件来解释读数的结果。光学传感器可以用于获取样品测定结果的读数,并且可以使用量化软件来解释读数的结果。可以使用任何合适的光学传感系统。在一些实施方式中,仪器包括相机,例如usb相机(例如,leopardimaging:li-ov7725)和照明系统,使得软件能够获得斑点的图像。然后,软件可以基于相机拍摄的图像计算光密度。led阵列(例如,life-oninc.)可以放置在斑点的场下方,使得照明允许斑点的图像。仪器成像系统可包括一个光源,光源包括4个白色led,它们透过半透明的丙烯酸扩散器,然后穿过湿卡的背面。湿盒可由半透明聚碳酸酯制成,从而增加了照明的均匀性。led的闪烁可以允许合适的软件计算所得图像的增益和偏移。led可以三角形的时变信号照亮载玻片的背面。该调制可发生在大约2.6hz。调制可由控制器电路产生,该控制器电路也可用于控制阀门和泵电机。控制器电路可产生方波信号,该信号被积分然后用于调制到led的电流,从而产生三角形的时变光输出,以便减少杂散光引起的误差以及像素增益和偏移的变化。光路长度可以设计得尽可能短,以减小仪器的尺寸。光学系统可允许tad系统对由测定产生的阵列室中的斑点成像,以确定插入的微流体盒的类型、相容性、取向和成功插入,并且对微流体盒中的流体流动进行成像。相机可发挥多种功能,其包括但不限于以足够的分辨率对测定产生的斑点进行成像,以量化光密度;将从仪器中输入空白和点图像作为输入;将基于所选择的卡类型配置的点阵列尺寸来定位基准点并输出二维点阵列;对微流体盒上的特征进行成像,其允许确定盒类型、相容性和取向,并允许tad确定成功插入;对微流体盒内的所有微流体进行成像,以记录流体或空气位置;协助诊断或提供测试记录;和/或对盒标签进行成像以进行条形码扫描。led阵列可照亮微流体盒的顶面。光输入可由控制电子设备调制,并且可以由软件控制以支持例如上述的相机功能。这些灯可用于条形码扫描,并可在测定期间进行视频记录以进行故障排除和诊断。成像led可为阵列室的基座提供光。光输入可由控制电子设备调制,并且可以根据量化阵列室中斑点的需要由软件控制。对于阵列室中的成像点,来自led的光必须进入阵列室的底部,通过观察窗口,并进入相机而不会反射或漫射通过任何其他表面。来自成像led的光不得反射或漫射通过tad设备的任何元件,然后从顶部照射阵列室。在阵列成像led和微流体盒测定室之间可包括漫射元件,以在led进入测定室之前均匀地分布来自led的光。为了获得斑点的图像,可以首先获得空白图像,以允许软件通过忽略斑点形成之前存在的任何背景来检测斑点。在斑点形成时,可以获得斑点图像。在图像捕获开始时,两个640×480像素阵列归零:一个将累积每个单独像素的平均黑色和白色强度,另一个将累积强度乘以整体像素平均值。空间像素平均值也可与捕获帧的时间一起存储。在以下分析中,空间像素平均值可用作调制信号的代理。这是基于2.6hz周期的唯一来源必须归因于调制的假设。一旦捕获了所需的总帧数,就将平均像素强度的时间记录可与正弦波的频率范围相关联,以便识别正确的调制频率、相位和幅度。该估算的结果是与调制幅度成比例的值。接下来,可对每个像素计算最小二乘线性回归,以确定每个像素相对于提取的调制信号的增益和偏移。此时,可假设单个像素增益表示与led输出相关的比例因子。像素偏移不被认为是有用的并且被丢弃。为了阻挡由卡到卡的变化,由于腔室中的流体引起的光密度变化以及精确的调制幅度引起的影响,可首先在斑点形成之前然后在之后捕获图像。这些被称为“空白”图像和“斑点”图像。可通过计算斑点图像的每个像素增益与空白图像的每个像素增益的比率来创建最终处理图像。可通过所计算的斑点图像与空白图像的调制幅度的比率来进一步缩放该图像。用于量化的斑点可以由软件用户手动标记。每个斑点包含一个中心点区域。用户可以使用软件更改斑点的大小。为了量化斑点,可以计算新图像,其中每个像素等于斑点和无斑点图像的每个像素的比率。这消除了由于背光和固有的空间卡密度以及像素增益和偏移引起的变化。计算中心点圆内的平均像素值。泵、阀门和光学相机可集成到仪器中。在仪器内,这些部件可与打印电路板集成在一起,该电路板可将来自软件的所有电输入传递到各种组件。仪器可容纳微控制器、泵、阀门和光学系统。可将盒(湿盒和干盒一起)插入仪器中并通过与歧管的弹簧机构接合,该歧管可将阀门连接到储罐端口。软件可以加载到连接到仪器的计算机上。tad系统可以包括读取器,其控制和量化由盒而得的结果。该仪器可包括塑料和金属外壳组成,其包括但不限于触摸屏显示器、主cpupcb、包括泵的盒接口、多个阀门、用于量化的相机、各种led光源和带有mcu的pcb、阀门驱动器、电机驱动器和传感器,以确保正确进行实验。读取器的基本形式可包括用于用户界面的图形触摸屏显示器,其具有用于盒插入的抽屉。外壳可以使用ots防振脚。tad软件可在基于arm的cpu上运行。主要的软件功能(包括所有gui)可以是用java编写的软件应用程序(app)的结果。该app可依赖于各种其他软件库和软件包的支持,这些软件库和软件包属于未知来源(soup)软件类别。tad可以包括公共可用的电子子组件。用户与应用程序的交互可以通过触摸屏完成。可以通过屏幕键盘完成数据输入。在一些实施方式中,可以包括用于患者id进入的外部条形码扫描仪的添加。将以下述实施例进一步阐述本发明实施例1:生物标志物分析开发和验证(elisa)1a:针对同源抗原的抗体反应性验证(elisa)最初根据制造商的推荐选择每种生物标志物的夹心免疫测定抗体对。这些包括四种生物标志物:ca15-3、cea、erbb2和cyfra21.1。在夹心免疫测定中测试抗体对以确定该对的质量(如本文1b部分所述)。更具体而言,将cea(fitzgerald:30-ac25p)和cyfra21.1(cedarlane:clpro350)抗原在涂布缓冲剂(0.2mnahco3/na2co3ph9.4)中稀释。通过在室温下培养2小时,将50μl抗原的三种不同浓度(200ng/ml,20ng/ml,2ng/ml)的涂布缓冲剂溶液涂布在96孔maxisorpelisa板(thermofisher)的孔上,并将板在4℃储存过夜。第二天,用200μl封闭缓冲剂(1xpbst 2%bsa)封闭elisa板1小时。然后用50μl各自的一抗(1°抗体,表1)探测孔1小时,接着用50μl二抗(2°抗体)(来自与hrp缀合的各种物质的抗-igg)探测,或者将50μlsa-hrp施加到孔中30分钟。随后,用1xpbst洗涤孔6次,每次洗涤5分钟。使用50μltmb(vwr)将信号显影30分钟,然后用50μl2m硫酸终止反应。将板用versamax微孔板读取器(分子设备)在450nm下进行扫描。表1示出了测试针对其抗原的抗体反应性的样品结果。在间接elisa实验中,orb48781(biorbyt)未能识别出cyfra21.1抗原,在所有抗原浓度下都给出低o.d.值(表1)。然而,cyfra21.1的两种其他抗体af3506和mab3506(r&dsystems)能够以剂量依赖性的方式识别抗原。cea的两种抗体10-1134b和10-1131(fitzgerald)即使在高抗体浓度下也在夹心测定中给出低信号。有趣的是,它们能够识别cea抗原(表1)。两种抗体很可能在与cea抗原的结合中相互干扰。其它cea抗体,包括10-c10d、10-c10e和mab41281(r&dsystems)可以剂量依赖性的方式识别cea抗原。因此,在夹心测定中进一步测试这些抗体(1b部分)。表1:抗体反应性筛选设置和结果(o.d.)1b:用于夹心测定的抗体对的相容性(elisa)测试ca15-3和erbb2的第一个夹心抗体对是成功的。这些抗体的优化可以在1c部分中找到。在鉴定出能够识别同源抗原的cea和cyfra21.1的抗体后(1a部分),抗体在夹心测定中针对其相容性进行了进一步的测试。cea抗体对于cea,在范围从1μg/ml至10μg/ml的各种浓度下测试三种不同的抗体10-c10d、10-c10e和10-1134作为捕获抗体(cabs)。将在涂布缓冲剂(0.2mnahco3/na2co3ph9.4)中稀释的50μl抗体涂布在96孔maxisorpelisa板(thermofisher)的孔上。并将板在室温下温育2小时,然后保持在4℃过夜。第二天,用200μl封闭缓冲剂(1xpbst 2%bsa)封闭elisa板1小时。将孔用200μl的1xpbst洗涤三次,用20ng/ml、2ng/ml和0ng/ml的cea抗原温育1小时,然后用1xpbst洗涤三次。用1小时添加50μl不同的生物素化检测抗体(表2)。用另外两种抗体作为检测抗体(dabs)测试每个捕获抗体。在1xpbst洗涤后,将孔用50μl的sa-hrp探测30分钟,然后用1xpbst洗涤6次,每次5分钟。使用50μltmb(vwr)将信号显影30分钟,然后用50μl2m硫酸终止反应。将板用versamax微孔板读取器(分子设备)在450nm下进行扫描。样品结果示于表2。在该研究中具有最佳信噪比并说明对cea抗原的剂量依赖性响应的抗体对是10-c10d捕获抗体和10-1134b检测抗体。抗体mab41281在这些测试中表现出高背景。表2:cea抗体对相容性测试cyfra21.1抗体针对cyfra21.1的初始抗体检测鉴定出两种识别同源抗原的抗体,mab3506和af3506。这些抗体在夹心测定中以两种组合进行测试,一种用mab3506作为捕获抗体,af3506作为检测抗体,反之亦然。如先前描述的进行elisa测定,其中捕获抗体以各种浓度(表3)涂布,然后分别用20ng/ml、2ng/ml和0ng/ml(表3)的cyfra21.1抗原探测。将孔用各种浓度(表3)的生物素化检测抗体探测,然后用sa-hrp探测。将信号用tmb显影。然后将板用versamax(分子设备)板读取器在450nm下进行扫描。o.d.结果如表3所示。用mab3506作为捕获抗体,af3506-b作为检测抗体进行的夹心测定工作良好,以剂量依赖性方式检测cyfra21.1抗原。然而,用af3506作为捕获抗体,mab3506作为检测抗体的相反夹心测定在这些实验中未能产生强的cyfra21.1信号。表3:cyfra21.1抗体对相容性测试1c:抗体滴定(elisa)测试了捕获抗体和检测抗体的最佳浓度。这些实验通常称为棋盘滴定。对于用于每种生物标志物,制备2倍系列稀释液用于捕获和检测抗体。除了空白对照之外,制备两个浓度的抗原,其中一个高于其生理截断值,一个低于其生理截断值。为了确定每个抗体对的最佳浓度,通过将来自抗原孔的读数除以来自没有抗原的孔的读数来计算信噪比。用最高的信噪比和最低的背景读数确定捕获和检测抗体的最佳浓度。生物标志物:erbb2如先前所述进行夹心测定elisa。捕获抗体mab1129(r&dsystems)以4种不同浓度测试:8μg/ml、4μg/ml、2μg/ml和1μg/ml。类似地,检测抗体baf1129(r&dsystems)以160ng/ml、80ng/ml、32ng/ml和16ng/ml进行测试。由于erbb2截断值为15ng/ml,erbb2抗原(r&dsystems:1129-er-050)以25ng/ml、5ng/ml和0ng/ml。每种组合一式两份地进行。结果和实验装置如表4所示。计算信噪比,并且分别对4μg/mlcab和80ng/mldab观察到最高的信噪比。因此,这两种最佳浓度可用于之后的实验。表4:erbb2抗体滴定生物标志物:ca15-3如先前所述进行夹心测定elisa实验。捕获抗体10-ca153a(fitzgerald)以4种不同浓度测试:5μg/ml、2.5μg/ml、1.25μg/ml和0.625μg/ml。类似地,检测抗体10-ca153b-b以200ng/ml、100ng/ml、50ng/ml和25ng/ml进行测试。由于ca15-3截断值为30u/ml,ca15-3抗原30c-cp9064(fitzgerald)以100u/ml、10u/ml和0u/ml。每种组合一式两份地进行。结果和实验装置如表5所示。计算信噪比,对于ca15-3,cab和dab的最佳浓度分别测定为1.25μg/ml和100ng/ml。表5:ca15-3的抗体滴定生物标志物:cyfra21.1如先前所述的进行夹心测定elisa实验。捕获抗体mab3506(r&dsystems)以4种不同浓度测试:6.4μg/ml、3.2μg/ml、1.6μg/ml和0.8μg/ml。类似地,检测抗体af3506-b(r&dsystems)以10μg/ml和5μg/ml进行测试。由于cyfra21.1截断值为2ng/ml,cyfra21.1抗原(cedarlane:clpro350)以20ng/ml、2ng/ml和0ng/ml。每种组合一式两份地进行。结果和实验装置如表6所示。计算信噪比,对于cyfra21.1,cab和dab的最佳浓度分别测定为6.25μg/ml和5μg/ml。表6:cyfra21.1抗体滴定生物标志物:cea如先前所述进行夹心测定elisa实验。捕获抗体10-c10d(fitzgerald)以4种不同浓度测试:20μg/ml、10μg/ml、5μg/ml和2.5μg/ml。与其他生物标志物不同,对cea测试两种检测抗体:10-1134b(fitzgerald)和10-1134b(fitzgerald)。这两种检测抗体都以4种不同浓度测试:10μg/ml、5μg/ml、2.5μg/ml和1.25μg/ml。由于cea截断值为5ng/ml,cea抗原(fitzgerald:30-ac25p)以20ng/ml、2ng/ml和0ng/ml。每种组合一式两份地进行。结果和实验装置如表7所示。计算信噪比,对于cea,cab和dab的最佳浓度分别测定为10μg/ml和1.25μg/ml。两种检测抗体的表现同样出色。表7:cea滴定1d:抗体交叉反应性(elisa)进行elisa测试以确定抗体和生物标志物之间是否发生交叉反应。交叉反应性:捕获抗体和检测抗体之间(不使用抗原的实验)如先前所述进行elisa实验。代替抗原,将孔用封闭缓冲剂(1xpbst 2%bsa)温育1小时。针对ca15-3的生物素化检测抗体10-ca153b-b显示出与10-c10d的一些交叉反应性,针对cea的捕获抗体具有0.20605的o.d读数(图1)。针对cyfra21.1的生物素化检测抗体af3506b显示了与包含其配对捕获抗体mab3506的所有捕获抗体的交叉反应性。针对cea和erbb2的生物素化检测抗体(10-1131b和baf1129)与任何捕获抗体均未显示出显著水平的交叉反应性。检测抗体和抗原之间的交叉反应性为了确定抗原和检测抗体之间的非特异性相互作用,如前所述进行elisa实验。每个孔用捕获抗体涂布,封闭并与其相应的抗原一起温育。然而,代替用其配对的检测抗体进行探测的是,用与抗原无关的检测抗体进行探测。如图2所示,抗原与其他检测抗体之间未发现交叉反应性。使用cyfra21.1检测抗体的孔的相对较高的读数可能源于此检测抗体和所有捕获抗体之前观察到的交叉反应性(图1)。捕获抗体和抗原之间的交叉反应性所有捕获抗体用降低ca15-3浓度(其他3种抗原的浓度保持不变)的抗原混合物探测,并用所有检测抗体的混合物检测。正如预期的那样,对于ca15-3捕获抗体10-ca15-3a所看到的信号减少。出乎意料地,cea捕获抗体10-c10d和cyfra21.1捕获抗体mab3506的信号也有所减少(表8)。发现了ca15-3抗原30c-cp9064(fitzgerald)含有cea和cyfra21.1污染物。因此,cea和cyfra21.1捕获抗体不是非特异性结合的ca15-3抗原,而是存在于ca15-3抗原溶液中的其同源抗原。与mab1129、erbb2捕获抗体和ca15-3抗原没有相互作用。对剩余的三种生物标志物进行了类似的实验。对于erbb2,通过erbb2捕获抗体mab1129仅看出剂量依赖性响应(表8)。由于cea和cyfra21.1作为ca15-3中的污染物存在,因此从用于测试cea和cyfra21.1的抗原混合物中省略了ca15-3。在抗原混合物中没有ca15-3的情况下,cea和cyfra21.1捕获抗体只识别它们各自的抗原(表8)。表8:交叉反应性实验总结:捕获抗体与抗原之间的相互作用1e:抗体亲和性为了确定捕获抗体和检测抗体识别它们各自抗原的程度,我们用elisa进行了抗体亲和性实验。我们将抗原和检测抗体温育了不同的时间,以了解温育时间如何影响信号读数。这种实验的实例在表9中示出:左侧。将孔用针对ca15-3的捕获抗体(10-ca153a)以1.25μg/ml涂布。在封闭之后,将孔用ca15-3抗原温育,截断水平为30u/ml,温育时间为5分钟至60分钟。每个时间点都包括无抗原对照。随后将孔用100ng/mlca15-3检测抗体(10-ca153b-b)以5分钟至60分钟内的不同时间量进行探测。结果示于左下部。正如预期的那样,抗原或检测抗体的温育时间越长,产生的信号越强。检测抗体温育时间的增加似乎不影响背景信号。对于60分钟的检测抗体温育时间,信号在抗原温育时间15分钟时饱和,抗原温育时间越长,不产生较高的信号。发现了10分钟的抗原温育时间足以获得可靠的信号。对检测抗体温育时间进行了类似的实验,并观察了检测抗体浓度的效果。对于ca15-3以30u/ml的截断水平探测抗原,温育时间保持固定在10分钟(表9:右侧)。检测抗体10-ca153b-b以4种不同浓度测试:100ng/ml、200ng/ml、400ng/ml和800ng/ml,温育时间在5分钟至1小时内变化。对于100ng/ml和200ng/ml的浓度,信号随预温育时间的增加而增加。对于400ng/ml和800ng/ml,信号在仅5或10分钟的温育时间后变得饱和,并且更多的温育时间不会产生更强的信号。因此,对于检测抗体而言100ng/ml的浓度足以获得可靠的信号。对剩余的生物标志物进行了类似的实验以改进抗原和检测抗体温育时间以及检测抗体浓度。表9:ca15-3的抗体亲和性elisa测试的设置和结果2:抗体微阵列测定开发2a:抗体滴定测试每个捕获抗体的各种浓度以确定微阵列的最佳浓度。所有四种生物标志物的捕获抗体均以10倍连续稀释在环氧硅烷载玻片上点样。每孔点样单个捕获抗体的三种浓度,以及取向用的13.2μg/ml的bsa-生物素斑点。三个孔用各个捕获抗体组点样(图3a-l)。每个孔随后用各抗原的三个10倍浓度探测:30u/ml、300u/ml和3000u/ml的ca15-3;5ng/ml、50ng/ml和500ng/ml的cea;2ng/ml、20ng/ml和200ng/ml的cyfra21.1;和15ng/ml、150ng/ml和1500ng/ml的erbb2。每个孔用其相应的检测抗体探测:1μg/ml的10-ca153b-b,10μg/ml的10-1131b,10μg/ml的af3506b,和4μg/ml的baf1129。所有孔用链霉亲和素(sa)-alexa546(thermofisher)探测,并用genepix微阵列扫描仪在532nm进行扫描。对于10-ca153b-b,捕获抗体浓度都不能检测30u/ml的截断水平的ca15-3(图3a-l)。对于10-c10d,2000μg/ml能够检测5ng/ml的截断水平的cea,但信号弱。对于mab3506和mab1129,500μg/ml的捕获抗体能够检测2ng/ml的cyfra21.1和15ng/ml的erbb2的截断水平。ca15-3捕获抗体10-ca153a的多种浓度。使用定制硅酮隔离器将500μg/ml、200μg/ml、80μg/ml和32μg/ml四种浓度的0.4μl的该捕获抗体点样在环氧硅烷载玻片上(参见:第3部分-抗体微阵列构造)。还将ca15-3抗原斑点点样以用于不同的实验。封闭载玻片并用30u/ml的ca15-3抗原以及1μg/ml的检测抗体10-ca153b-b进行探测。结果利用tmb-mx(moss)显影,并且用genepix微阵列扫描仪扫描。当我们测试探测条件的体积极限时,这种探测以最小的体积进行。如图4所示,当10-ca153a为80μg/ml时,检测到良好的信号。在较高的捕获抗体浓度200μg/ml和500μg/ml时,信号较低。这表明捕获抗体的这些较高浓度可能会干扰抗原结合。对于32μg/ml的捕获抗体,信号也很低;然而,这可能归因于该实验中使用的最小体积及其在孔中部的位置,其导致在温育步骤期间抗原溶液的覆盖率差。对其他生物标志物捕获抗体进行了类似的实验,以确定引起抗原捕获的最佳密度的最佳捕获抗体浓度。检测抗体浓度凭经验确定。通过微阵列打印机(例如genemachinesomnigrid300)用针对ca15-3和cea的捕获抗体的稀释物打印化学改性微阵列载玻片。出于数据标准化目的,也打印了ca15-3和cea的抗原的稀释物。将抗体和抗原在1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa打印缓冲剂中稀释。在载玻片打印和固定后,用封闭缓冲剂封装载玻片。采用不同量的ca15-3和cea抗原,然后使用ca15-3和cea检测抗体的稀释物,探测16个微阵列网格。ca15-3和cea检测抗体的两种不同稀释物探测7种不同的抗原浓度,以产生检测抗体稀释物的标准曲线。对于ca15-3,检测抗体以0.2μg/ml和0.4μg/ml进行测试。cea检测抗体以20μg/ml和25μg/ml进行测试。在利用sa-hrp/生物素-hrp和tmb信号显影后,载玻片利用arrayit比色扫描仪成像,并通过imagej量化。从捕获抗体计数中减去背景(零抗原时的cab计数值)。然后用抗原斑点(cab计数/ag计数)标准化捕获抗体斑点。随后绘制标准化的计数(对应探测的抗原浓度),产生标准曲线。图34a-b中示出了0.2μg/ml和0.4μg/ml检测抗体处的80μg/ml的ca15-3捕获抗体的标准曲线。使用0.2μg/ml的检测抗体产生线性标准曲线,而0.4μg/ml的检测抗体在较高抗原浓度下引起计数饱和。基于这些研究,选择0.2μg/ml作为ca15-3的检测抗体浓度。还用cea进行了类似的实验,并导致选择20μg/ml作为检测抗体浓度。对心血管生物标志物进行了类似的实验。检测抗体浓度凭经验确定。用针对肌红蛋白的捕获抗体的稀释物打印环氧涂布的载玻片。出于数据标准化目的,也打印了肌红蛋白的稀释物。将抗体和抗原在1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa打印缓冲剂中稀释。在载玻片打印和固定后,用封闭缓冲剂封装载玻片。采用不同量的肌红蛋白抗原,然后使用肌红蛋白检测抗体的稀释物,探测16个微阵列网格。对于肌红蛋白,检测抗体以0.5μg/ml、1μg/ml、2μg/ml和4μg/ml进行测试。图35a-b中示出了1μg/ml和4μg/ml检测抗体处的100μg/ml的肌红蛋白捕获抗体的标准曲线。使用1μg/ml的检测抗体产生线性标准曲线,而4μg/ml的检测抗体在较高抗原浓度下引起计数饱和。基于这些研究,选择1μg/ml作为肌红蛋白的检测抗体浓度。还用其他心血管生物标志物ck-mb、nt-probnp和肌钙蛋白i进行了类似的实验,并导致分别选择5μg/ml、10μg/ml和100μg/ml作为这些生物标志物的检测抗体浓度。2b:抗原滴定为了确定用于潜在信号量化目的的最佳抗原浓度,在微阵列载玻片上进行抗原标准曲线。除了4种复制捕获抗体浓度之外,将8种不同的抗原浓度点样在载玻片上。对erbb2的此实验的实例在图5a-b中示出。每个孔用不同浓度的erbb2抗原探测以获得不同实验的标准曲线。然后将孔用20μg/ml的erbb2检测抗体baf1129探测,然后用sa-hrp/生物素-hrp探测,用tmb-mx将信号显影。用仪器相机量化斑点。由于夹心测定中用于温育的抗原量不应影响点样的抗原,因此每个孔被认为是每个抗原斑点的复制品。对各抗原浓度获得平均值,在信号vs.浓度图表中绘制,得到抗原滴定的标准曲线(图5a-b)。对其他生物标志物进行类似实验以得到抗原滴定的标准曲线。2c:抗体缀合用生物素修饰检测抗体,允许使用携带链霉亲和素(sa)的常见二级检测试剂进行信号检测。生物素具有非常小的尺寸(244da)并且可以与抗体和蛋白质缀合而不影响它们的活性。生物素分子将通过sa与sa-hrp紧密结合,使得hrp将催化其比色基底显影成可见信号。缀合通常允许一个以上的生物素分子缀合到抗体上,从而通过增加能够结合一种抗体的hrp分子的数量来扩增信号。为了将生物素与检测抗体缀合,我们使用n-羟基琥珀酰亚胺(nhs)酯活化的生物素(thermofisher)。nhs酯与抗体上的伯胺以及赖氨酸残基的侧链反应形成酰胺键。对于生物素化反应,制备10mmnhs酯活化的生物素溶液。对于每20μg检测抗体,使用0.5μl的10mmnhs-酯活化的生物素。将检测抗体-生物素溶液在室温下于旋转器上温育1小时。温育后,将溶液置于10,000mw的截断透析管中(thermofisher)。将具有溶液的透析管置于冷的1xpbs中并在4℃下放置过夜。这允许除去任何未缀合的生物素,同时将检测抗体保持在透析管中。这也允许缀合缓冲剂对于1xpbs的交换。第二天,从透析管中取出溶液,用bradford方法量化所得检测抗体的最终浓度。2d:微阵列上的抗体交叉反应性捕获抗体和检测抗体之间的交叉反应性用微阵列格式进一步验证用elisa进行的交叉反应性实验。用打印机器人打印微阵列载玻片。这些载玻片的所有捕获抗体均以六个复制品打印。将含有所有捕获抗体的孔用封闭缓冲剂封闭,并用单一检测抗体探测,以确定捕获抗体和检测抗体之间是否存在交叉反应性。结果在图6a-d中示出。发现了针对ca15-3的检测抗体10-ca153b-b与mab3506、mab1129及其自身的捕获抗体10-ca153a轻度交叉反应。针对cyfra21.1和erbb2的检测抗体af3506和baf1129也与这些相同捕获抗体轻微交叉反应。也通过用定制硅酮隔离器(gracebiolabs)点样的载玻片检查捕获抗体和检测抗体之间的交叉反应性。对于所有四种生物标志物,载玻片都点样有捕获抗体和抗原。代替抗原,用封闭缓冲剂温育孔。用含有所有四种生物标志物的检测抗体的检测抗体混合物(2μg/ml的ca15-3b-b,20μg/ml的c1299-87o-b,8μg/ml的baf1129和5μg/ml的af3506)探测孔。在探测之前将检测抗体与sa-hrp(dab:5xsa-hrp)预混1小时。将斑点用来自nanoprobes的enzmet银显影剂显影,并用genepix微阵列扫描仪扫描。结果在图7中示出。正如预期的那样,除erbb2外,点样的抗原都显影。对于25μg/ml的捕获抗体ca15-3a、250μg/ml的mab1129和500μg/ml的c1299-87w没有观察到信号。对于50μg/ml的mab3506观察到低水平的交叉反应性。对于乳腺癌组检查捕获抗体和检测抗体之间的交叉反应性。用genemachinesomnigrid300将ca15-3、cea和erbb2的捕获抗体和抗原打印到环氧涂布的载玻片上。随后将载玻片用没有任何抗原的检测抗体探测,用arrayit比色扫描仪成像。除非存在交叉反应性,否则在没有抗原的情况下,当用检测抗体探测时,应该没有捕获抗体信号。图36图示了实验结果。每个柱表示不同的捕获抗体/检测抗体组合。对于任何捕获抗体/检测抗体组合,没有高于背景的信号,表明在测试条件下,乳腺癌组捕获抗体和检测抗体之间没有交叉反应性。抗原和检测抗体之间的交叉反应性通过我们利用elisa的交叉反应性实验,我们发现了原始ca15-3抗原也含有cea和cyfra21.1抗原的杂质。捕获新ca15-3抗原(fitzgerald:30c-cp9064u)并在微阵列上测试,以确保不再有任何污染。使用硅酮隔离器将捕获抗体和抗原点样在微阵列载玻片上。将孔用30u/ml的ca15-3抗原(新)探测,并用针对所有生物标志物的检测抗体混合物探测。将孔用sa-hrp和enzmet银显影剂探测。将所得载玻片用genepix微阵列扫描仪在532nm进行扫描。然后,在cyfra21.1和cea捕获抗体(mab3506和c1299-87w)处没有发现信号(图8)。因此,我们推断出是这种新的ca15-3不具有会干扰我们的多路复用免疫测定的污染物。为了检查抗原和检测抗体之间的潜在交叉反应,将抗原点样到微阵列载玻片上。将载玻片用封闭缓冲剂(1xpbst 5%bsa)封闭,并用抗原及其相应的检测抗体探测。将孔用抗原探测,这是由于载玻片也被用于其他实验的捕获抗体点样。将孔用sa-hrp和生物素-hrp预混物(分别为4μg/ml和2μg/ml)探测,并用enzmet银显影剂显影。结果在图9a-d中示出。用2μg/ml的ca15-3b-b探测点样有所有四种抗原的孔。正如预期的那样,显影的唯一抗原信号是ca15-3的信号。ca15-3b-b检测抗体未能与其他三种生物标志物发生交叉反应。所有四种抗原斑点也在三个单独的孔中用剩余的三种检测抗体(5μg/ml的af3506b,20μg/ml的c1299-87o-b和8μg/ml的baf1129)探测。用无关抗原没有任何信号。这证实了检测抗体和非同源抗原之间没有交叉反应性相互作用。检查乳腺癌组的抗原和检测抗体之间的潜在交叉反应性。如上所述,用genemachinesomnigrid300将ca15-3、cea和erbb2捕获抗体点样在环氧涂布的载玻片上。用ca15-3、cea和erbb2抗原探测各个微阵列网格。随后将孔用其他生物标志物的检测抗体探测,即随后将用ca15-3抗原探测的孔用cea和erbb2检测抗体探测。在信号显影之后,将载玻片用arrayit比色扫描仪进行扫描。抗原应该结合其各自的捕获抗体,但由于抗原不具有其同源检测抗体,因此在捕获抗体斑点处应该没有信号。捕获抗体/抗原斑点未显示用相应的检测抗体探测出的信号(图37)。这表明在乳腺癌组中抗原和检测抗体之间没有交叉反应性。抗原和捕获抗体之间的交叉反应性为了检查抗原和捕获抗体之间的相互作用,利用定制硅酮隔离器将微阵列载玻片用捕获抗体和抗原点样。将载玻片温育过夜并用封闭缓冲剂(1xpbst 5%bsa)封闭1小时。然后将孔用单个抗原及其相应的检测抗体探测。结果在图10a-d中示出。正如预期的那样,用30u/ml的ca15-3和2μg/ml的ca15-3b-b检测抗体探测的孔仅在10-ca15-3a捕获抗体和ca15-3点样的抗原处显示出信号。用50ng/ml的cea和c1299-87o-b检测抗体(20μg/ml)探测的孔仅在cea捕获抗体(c1299-87w)和cea点样的抗原处具有信号。类似地,用8ng/ml的cyfra21-1和其5μg/ml的检测抗体(af3506b)探测的孔仅对cyfra21-1捕获抗体mab3506和cyfra21-1点样的抗原显示出信号。在单独的实验中,仅用捕获抗体点样用30ng/ml的erbb2及其检测抗体和8μg/ml的baf1129探测的孔。正如预期的那样,其仅在erbb2捕获抗体(mab1129)处显示出信号。这些结果表明,该组内的抗原和其他捕获抗体之间没有可能干扰我们的多路复用免疫测定的任何强烈的交叉反应相互作用。为了检查抗原和捕获抗体之间的相互作用,用genemachinesomnigrid300将捕获抗体点样在环氧涂布的载玻片上。然后用ca15-3、cea或erbb2探测微阵列网格,然后用其同源检测抗体探测。在信号显影后,将载玻片用arrayit比色扫描仪进行扫苗。如果抗原和捕获抗体之间具有相互作用,则应当在该捕获抗体处有信号。在没有交叉反应性的情况下,抗原应仅在其相应的捕获抗体处显示出信号。在任何非特异性捕获抗体处都没有看到信号,表明在测试条件下抗原和捕获抗体之间没有交叉反应性(图38)。2d:信号放大测试了不同量的链霉亲和素-辣根过氧化物酶(sa-hrp),将检测抗体和sa-hrp步骤合并为一个。检测抗体是生物素化的,使得它们可以被sa-hrp识别。用检测抗体和sa-hrp的预混物缩短测定时间我们最初试图通过将生物素化检测抗体和sa-hrp培养物这两种组分预混合而将其合并成一种而增加信号并缩短测定时间。检测抗体与5倍摩尔浓度的sa-hrp预混合,在探测前旋转1小时。将针对ca15-3(10-ca15-3a)、cyfra21-1(mab3506)、cea(c1299-87w)和erbb2(mab1129)的捕获抗体手动点样到微阵列载玻片上。所有四种生物标志物的抗原也手动点样。随后将斑点用ca15-3、cyfra21-1、cea和erbb2抗原分别探测30分钟,1x截断值分别为:30u/ml,5ng/ml,2.5ng/ml和15ng/ml。然后将不同的孔用混合了dab的5xsa-hrp温育(图11a-g)。用检测抗体混合物探测15分钟,然后用sa-hrp探测15分钟。结果表明,用检测抗体和5倍sa-hrp的混合物探测15分钟足以获得良好的信号。一些孔也用检测抗体混合物探测15分钟,然后用各种组合的sa-hrp和生物素-hrp的混合物探测(图11h-m)。发现了与检测抗体sa-hrp预混物相比,将sa-hrp和生物素-hrp预混合并将其与检测抗体混合物分开探测增加了信号。生物素-hrp和sa-hrp的组合使用探索了生物素-hrp与sa-hrp组合使用的目的是提高信号检测对微阵列的灵敏度。我们首先尝试将不同比例的sa-hrp与生物素-hrp预混合30分钟,然后用于探测。将捕获抗体和抗原点样到微阵列载玻片上,如图11a-g所示。不同的sa-hrp/生物素-hrp组合在图11h-m中示出。将孔封闭,然后用由30u/ml的ca15-3、2ng/ml的cyfra21.1、15ng/ml的erbb2和50ng/ml的cea组成的抗原混合物探测。将孔用由1μg/ml的ca15-3b-b、20μg/ml的c1299-87o-b、8μg/ml的baf1129和5μg/ml的af3506b组成的检测抗体混合物探测。检测混合物分别探测或在探测之前与sa-hrp预混。用2分钟/2分钟/8分钟的enzmet银显影方案将载玻片显影。结果表明,用sa-hrp/生物素-hrp预混物探测的孔的信号高于仅用sa-hrp探测或dab混合物/5xsa-hrp预混物探测的孔的信号。另外,sa-hrp/生物素-hrp预混物的最佳浓度分别为4μg/ml和2μg/ml。任何试剂的更高浓度都没有达到更高的信号。也通过利用omingrid300微阵列打印机打印的载玻片(在其上采用tmb-mx检测方法)探索了sa-hrp/生物素-hrp预混物的组合使用。如图11n所示,将与生物素缀合的各种浓度的bsa点样在微阵列载玻片上。将孔封闭,然后用各种sa-hrp/生物素-hrp组合探测10分钟。载玻片用tmb-mx显影4分钟。将斑点信号量化,结果表明,用sa-hrp/生物素-hrp预混物探测的孔比单独的sa-hrp具有更高的信号。另外,sa-hrp/生物素-hrp预混物的最佳浓度分别为4μg/ml和4μg/ml。sa-hrp/生物素-hrp预混物在8μg/ml和4μg/ml时具有更高的信号但也具有更高的背景。一旦确定了适当浓度的sa-hrp和生物素-hrp,我们还测试了我们是否可以缩短sa-hrp/生物素-hrp混合物的温育时间,如图12a-b所示。用捕获抗体及其相应的抗原并列点样载玻片(图12a)。将孔用由60u/ml的ca15-3、4ng/ml的cyfra21.1、50ng/ml的cea和30ng/ml的erbb2组成的抗原混合物探测30分钟。将孔用pbst洗涤,然后用由1μg/ml的10-ca15-3b-b、5μg/ml的af3506b、20μg/ml的c1299-87o-b和8μg/ml的baf1129组成的检测抗体混合物探测15分钟。在pbst洗涤后,将孔随后用4μg/ml的sa-hrp/2μg/ml的生物素-hrp探测10分钟或5分钟。然后用2分钟/2分钟/8分钟的enzmet银显影方案将载玻片显影。结果在图12b中示出。我们发现,在用sa-hrp/生物素-hrp仅探测5分钟后,信号减少。由此,我们使用10分钟的sa-hrp/生物素-hrp温育时间用于后续的实验。为了减少sa-hrp/b-hrp温育时间,将两种试剂的浓度增加至更高。将不同浓度的bsa-生物素打印到环氧涂布的载玻片上,如图11a-g所示。将载玻片用浓度分别为64μg/ml/32μg/ml、32μg/ml/16μg/ml、16μg/ml/8μg/ml、8μg/ml/4μg/ml的sa-hrp/b-hrp探测2分钟。将斑点用tmb显影2分钟,并在arrayit比色扫描仪上成像。结果可见于图39。从平均计数中减去背景后,64μg/ml/32μg/ml的sa-hrp/b-hrp在bsa-生物素的所有浓度下具有最高信号。结果是,64μg/ml的sa-hrp和32μg/ml的b-hrp的混合物用于全部2分钟sa-hrp/b-hrp温育时间的后续测定。2e:信号显影比色检测使用银色显影进行最初的工作,这是一种比色检测方法,其中hrp在还原剂和过氧化氢存在下催化银离子的还原。该方法称为enzmet,需要依次以严格的摩尔比添加三种溶液,硝酸银、氢醌和过氧化氢。当我们使用仪器原型测试我们的微流体盒中的测定时,实施银显影被证明是困难的。首先,银显影需要三个单独的试剂,这些试剂需要按顺序和以确定的体积释放到测定室中。此外,试剂之间的任何污染都会导致储罐和通道中的过早的银沉积。试剂对离子也非常敏感,因为任何与离子的接触也可能导致过早的非特异性银沉积。考虑到所有其他试剂都含有离子,这可能会导致问题。因此,我们探索了其他比色检测方法,例如tmb-mx。用于信号显影的tmb-mxtmb(3,3',5,5'-四甲基联苯胺)是辣根过氧化物酶(hrp)的基底,并且非常普遍地用于elisa。我们通过使用tmb-mx使这种基底适用于微阵列,tmb-mx是一种过氧化物酶基底,它在反应部位产生不溶的蓝色沉淀,且几乎没有背景(moss基底)。我们的tmb-mx初始测试涉及微阵列,其中sa-hrp以各种浓度(0.5μg/ml、1μg/ml、2μg/ml和4μg/ml)点样到微阵列载玻片上,一式两份(图13a)。在封闭和洗涤之后,将阵列用tmb-mx温育8分钟,然后用蒸馏水漂洗以停止反应。将载玻片在genepix微阵列扫描仪中扫描,将图像量化。tmb-mx产生强烈且剂量依赖性的信号(图13b和13c)。这种剂量依赖性在图13c中图示出;然而,信号似乎在2μg/mlsa-hrp时变得饱和。将捕获抗体和抗原手动点样到微阵列载玻片上,以观察我们是否可以减少tmb-mx暴露的时间(图14a-d)。将所有四个孔用由ca15-3(30u/ml)、cyfra21.1(2ng/ml)和erbb2(15ng/ml)组成的抗原混合物探测30分钟。在pbst漂洗后,将所有四个孔用由1μg/ml的10-ca15-3b-b、5μg/ml的af3506b和8μg/ml的af1129b组成的检测抗体混合物探测15分钟。在pbst漂洗后,将所有四个孔分别用4μg/ml和2μg/ml的sa-hrp/生物素-hrp混合物探测10分钟。在pbst漂洗后,将孔随后用tmb-mx探测2分钟、4分钟、6分钟或8分钟。结果在图14a、b、c和d中示出。定性地来看,2分钟的tmb-mx暴露不足以获得高信号,但是4分钟、6分钟或8分钟的tmb-mx暴露给出了等价的信号。3:抗体微阵列构造3a:微阵列基底抗体微阵列需要将抗体固定在表面上。这可以通过吸附或共价固定发生。这些表面的功能不仅是提供可以固定抗体的支持物,而且还应该表现出最大的结合特性并保持抗体天然构象和活性。还需要显示最小的非特异性结合,以最小化检测系统中的背景噪声。通过分子吸附进行的固定化通过分子间力发生,主要是离子键和疏水和极性相互作用。这导致抗体层是异质的并且随机取向,因为每个分子可以在不同方向上形成任何接触,以最小化与基底和先前吸附的蛋白质的排斥相互作用。因此,吸附受到固定化蛋白质的几何尺寸的限制,高密度填充物可以空间封闭抗体的活性位点,从而干扰它们的结合能力。抗体和蛋白质也可以吸附在涂有硝酸纤维素或凝胶的载玻片上。水凝胶是三维载体,其中捕获分子扩散到多孔结构中。这导致改善的吸附能力,但抗体仍然是随机取向和弱附着的。此外,与质量传递效应有关的问题和来自非特异性相互作用的高背景信号可能干扰测定准确度和灵敏度(nimse等,2014)。在共价固定化期间,抗体或蛋白质通过可接触的暴露氨基酸官能团与固定载体共价结合。这导致不可逆的结合并产生高表面覆盖。通过氨基酸侧链的化学结合通常是随机的,因为其基于通常存在于蛋白质外部的残基。附着可以通过许多残基同时发生,增强固定化蛋白质群体的异质性。可以靶向许多不同的官能团,包括胺、硫醇、羧基和羟基。胺基团可以通过nhs、醛或环氧树脂涂布的载玻片共价附接到载体上。载体与nh2基团反应形成强酰胺键。通常,赖氨酸侧链反应,但反应也可以与n-末端发生。位于外部暴露的半胱氨酸中的硫醇基团可与马来酰亚胺涂布的载玻片反应。马来酰亚胺双键与硫醇基团进行加成反应,形成稳定的硫醚键。然而,通过暴露于还原试剂,这种连接是可逆的。位于外部暴露的谷氨酸和天冬氨酸的羧基可以使用碳二亚胺与胺涂布的载玻片反应。丝氨酸和苏氨酸侧链上的羟基可与环氧树脂涂布的载玻片反应,因此使环氧树脂涂布的载玻片不仅能与胺反应,还能与羟基反应(zhuandsnyder,2003)。为了确定哪种是用于抗原斑点的最佳载玻片表面,我们测试了3种不同生理化学性质的微阵列表面。测试了环氧硅烷载玻片(例如来自schott的载玻片e和来自arrayit的superepoxy载玻片)以及涂布有用n-羟基琥珀酰亚胺(nhs)酯官能化的聚合物薄膜或3-d聚合物的载玻片。将各种量的四种抗原(ca15-3、cyfra21.1、erbb2和cea)点样在每种类型的表面上。尽管三种载玻片中信号强度和斑点形态有相似之处,但由于其与聚合物涂布表面在室温下具有优异的稳定性,因此选择了来自信誉良好的供应商的环氧硅烷涂层载玻片作为阵列基底。进行另外的测试以确认环氧涂布的载玻片适合于我们的微阵列测定。测试了以氨基硅烷和醛涂布的备选载玻片。氨基硅烷涂布的载玻片显示与抗体上的羧基共价结合的胺基。醛涂布的载玻片显示出与抗体上的胺基共价结合的醛基。将erbb2捕获抗体和抗原打印到全部三种载玻片类型上。在封闭后,将载玻片用15ng/ml的erbb2抗原和erbb2检测抗体(4μg/ml)探测。在利用sa-hrp/b-hrp和tmb信号显影后,通过arrayit比色扫描仪将载玻片成像。打印布局和得到的图像显示在图40a-c中。当在环氧涂布的载玻片上打印时,erbb2cab显示出最高的信号。erbb2cab在氨基硅烷载玻片上没有信号,在醛涂布的载玻片上只有弱信号。erbb2抗原斑点在所有载玻片类型上都有信号,但环氧涂布的载玻片具有最高信号。这证实环氧涂布的载玻片适用于高测定信号。3b:点样缓冲剂最初,我们通过在1x磷酸盐缓冲剂盐水(pbs)中稀释抗体和抗原来进行微阵列载玻片的点样。我们测试了其他点样缓冲剂以确定抗体和抗原的扩散,以获得更好的斑点均匀性。甘油已显示出有助于保持之前的斑点大小和形态(olle等,2005;richens等,2015)。我们点样了在1xpbs或1xpbs 20%甘油中的25μg/ml的捕获抗体10-ca15-3a,然后将点样的阵列用30u/ml的ca15-3抗原探测1小时,并用20μg/ml的其生物素化检测抗体10-ca15-3b-b探测30分钟。用sa-hrp检测信号30分钟,并用enzmet银显影剂(2分钟/2分钟/8分钟)显影。结果在图15a-b中示出。向点样缓冲剂中加入20%甘油可使抗体更均匀地扩散。其还导致更圆形的斑点形状。我们还研究了对于点样缓冲剂的备选添加剂,例如洗涤剂和2’3’-丁二醇。添加1%吐温-20或30%2’3-丁二醇改善了信号强度、抗体扩散或斑点形态。对于大多数捕获抗体,我们使用含有1xpbs,5%甘油和0.02%十二烷基肌氨酸(tad打印缓冲剂)的点样缓冲剂,除了cea,c1299-87w,其在1xpbs中打印时提供改善的信号。如图16a-b所示,c1299-87w打印在1xtad打印缓冲剂中(图16a)或1xpbs中(图16b)。在两个实验中,c1299-87w以大约1000μg/ml的浓度打印,用200ng/ml的cea抗原(c3100-14)探测,用20μg/ml的cea生物素化检测抗体(c1299-87o-b)检测,进行sa-hrp/生物素-hrp(分别为4μg/ml和2μg/ml)和enzmet银检测(2分钟/2分钟/8分钟)。突出显示c1299-87w斑点。与左侧的斑点相比(图16a),在1xpbs中点样c1299-87w显著增加了信号(图16b)。我们发现一些抗体在某些条件下使用甘油或tad打印缓冲剂不能很好地打印,例如,当与omnigrid300微阵列一起使用时。大多数抗体和抗原在pbs中打印良好。然而,低浓度的一些抗体和抗原未能在pbs中打印,因为蛋白质的总浓度非常低。结果,我们在1xpbs 0.25mg/mlbsa中打印抗体和抗原。对于低浓度抗体和抗原这增加了蛋白质总浓度,并改善了打印。因此,将1xpbs 0.25mg/mlbsa用作我们的打印缓冲剂,以用于利用omnigrid300打印的微阵列实验。最初,用genemachinesomnigrid300将捕获抗体和抗原点样在1xpbs中。测试了其它点样缓冲剂,包括牛血清白蛋白(bsa)和/或十二烷基肌氨酸钠,一种离子型表面活性剂。结果在图41a-b中示出。用1xpbs或1xpbs 0.01%十二烷基肌氨酸钠 0.25mg/mlbsa作为打印缓冲剂将ca15-3捕获抗体和抗原打印在环氧涂布的载玻片上。然后将载玻片用30u/mlca15-3抗原和ca15-3检测抗体探测。在信号显影后,用arrayit比色扫描仪将载玻片成像。添加十二烷基肌氨酸钠和bsa提高了捕获抗体和抗原的信号强度(图41a)。这些打印缓冲剂添加剂还分别增加了斑点直径,并减少了捕获抗体和抗原复制斑点中的变化(图41b)。图41c显示了嵌图a和b中所示结果的cab和抗原的平均%变异系数(cv)。3c:打印方法对于微阵列打印,已经采用了多种策略,这取决于测定开发的不同阶段所需的阵列的配置和大小。当测试各种条件或当打印参数已经最终确定需要高的点密度和均匀形态时,机器人系统如arrayitspotbot3(arrayit)和microgridiimicroarrayer(biorobotics)已成功用于打印微阵列。为了减少阵列打印成本并缩短周转时间,使用定制的硅酮隔离器手动点样用于初步微阵列实验的阵列,特征是尺寸分别为约7mm×7mm的16(8×2)个孔。它们可以通过表面张力粘附在阵列基底的表面上,因此可以容易地除去。每个孔含有9(3×3)或16(4×4)个斑点。9斑点隔离器的斑点直径为1mm,而16斑点隔离器的斑点直径为0.75mm。由于在手动点样的载玻片上产生的相对较大的液滴和打印缓冲剂中存在甘油,在环境胺反应发生所需的室温下于湿度室中过夜温育后,没有发生斑点的彻底干燥,因此,液滴中的一些蛋白质不能与基底的表面直接接触,导致信号损失。结果,在室温下在湿度室中过夜温育后,取出载玻片并在4℃下干燥24小时,然后在1xpbst中多次漂洗。然后将载玻片在封闭缓冲剂中封闭1小时。为了比较在硅酮隔离器和微阵列打印机之间打印的载玻片产生的信号,将不同的样品送到位于亚利桑那的appliedmicroarrayinc.和蒙特利尔的nrc-bri的不同微阵列打印机上以打印多批载玻片。最后,genemachinesomnigrid300微阵列打印机在内部设置,可在控制良好的gui软件中提供高容量(高达308个载玻片)和强大性能,便于实验设计。与arrayit提供的smp3b销针一起,能够在单个孔中打印144个斑点(每个斑点直径约220微米)。在16孔板式中,在单个载玻片中打印了总共2304个斑点。用不同的生物标志物样品打印多批载玻片。从打印的载玻片产生的信号是令人满意的。需要进一步优化打印参数(加载参数、清洁程序和接触时间)。尽管使用隔离器的手动点样对于初步实验是有用的,但它们在重复之间具有太多的可变性。因此,genemachinesomnigrid300是一种机器人微阵列打印机,能够一次打印多达300个载玻片,其用于自动地打印载玻片。omnigrid300还允许在每个载玻片上打印8×2阵列以用于台式处理,或者用于微流体盒中的单场载玻片。用微阵列套管针smb3b(telechem)打印载玻片,得到直径约150-400um的斑点。使用omnigrid300在约50%湿度下打印载玻片。打印后,载玻片在70%湿度下保持在打印机中过夜,以允许抗体/抗原固定化。然后在第二天将载玻片干燥,然后用1xpbst多次漂洗。将载玻片在封闭缓冲剂中封闭1小时。3d:封闭和温育缓冲剂用1xpbs 0.05%tween(pbst) 2%bsa封闭初步微阵列,该缓冲剂与我们的elisa测定中使用的缓冲剂相同。在室温下伴随振荡封闭1小时后,观察到高的非特异性背景。正如之前曾尝试过的那样(richensetal.,2009),bsa浓度从2%增加到5%,改善了背景噪音。首先,在含有1xpbst和5%bsa的封闭缓冲剂中进行封闭后续的温育步骤。为了促进抗原-抗体相互作用,我们尝试在具有较低离子强度的温育缓冲剂中进行测定(reverberiandreverberi,2007)。点样两种捕获抗体,50μg/ml和25μg/ml的10-ca15-3a以及500μg/ml和250μg/ml的mab1129。随后将孔用在1xpbst 5%bsa或0.25xpbst 5%bsa中稀释的30u/ml的ca15-3和15ng/ml的erbb2探测30分钟。随后将孔用在探测缓冲剂中稀释的检测抗体/5xsa-hrp混合物探测15分钟。包含的检测抗体是1μg/ml的10-ca15-3b-b和4μg/ml的baf1129。然后利用enzmet银显影剂(2分钟/2分钟/8分钟)将信号显影。结果可见于图17a-b。当使用较低离子强度缓冲剂时,对ca15-3和erbb2都获得更高的信号。因此,我们得出结论,降低离子强度可以帮助抗体-抗原相互作用,因此用于后续的实验中。3d:微阵列温育时间我们最初开始的温育试剂的微阵列实验的时间与elisa实验中使用的时间相似,每个温育步骤通常为1小时。然而,由于最终产品将是在尽可能短的时间内进行的测定,我们开始尝试更短的温育时间。在此示出的这种实验的一个实例是在机器人打印的捕获抗体载玻片(appliedmicroarrays)上进行的。捕获抗体10-ca15-3a和mab1129分别以500μg/ml点样。将30u/ml的ca15-3和15ng/ml的erbb2的抗原混合物温育15分钟、30分钟或60分钟(图18a-f)。随后,将1μg/ml的10-ca15-3b-b和4μg/ml的baf1129的检测抗体混合物施加在载玻片上15分钟、30分钟或60分钟(图18g-l)。在这些步骤之后,将孔用4μg/ml的sa-hrp探测30分钟。然后用enzmet银显影剂(2分钟/2分钟/8分钟)将斑点显影。如ca15-3斑点所示,产生足够量化的信号的抗原混合物的最短温育时间各自为30分钟(图18a-f)。对于检测抗体,可检测信号需要15分钟的温育(图18g-l)。3e:所得微阵列测定图19中示出了优化的微阵列测定实例孔。使用omnigrid300将144个捕获抗体和抗原打印到环氧涂布的载玻片上并使其固定过夜。第二天,将载玻片在1xpbs 5%bsa中封闭1小时。随后将孔用含有8种癌症生物标志物的抗原混合物探测30分钟:ca15-3(60u/ml)、cyfra21-1(8ng/ml)、cea(20ng/ml)、ca72-4(40u/ml)、ca19-9(148u/ml)、erbb2(60ng/ml)、铁蛋白(200ng/ml)和mmp7-4(20ng/ml)。在用pbst简单洗涤后,将孔用检测抗体混合物探测15分钟。所有检测抗体均为生物素化的以允许sa-hrp识别。将孔再次用pbst简单洗涤,并用4μg/mlsa-hrp和4μg/ml生物素-hrp的混合物探测10分钟。在用1xpbst洗涤5分钟后,反应斑点用tmb-mx显影4分钟。将载玻片用arrayit比色扫描仪扫描,并通过imagej量化。除捕获抗体的打印外,还打印抗原以标准化检测抗体量的差异。抗原以至少三种不同的浓度打印,以产生抗原标准曲线。在探测多个孔的实验中,使用每个抗原斑点的平均值来产生平均标准曲线(图20)。这些检测抗体浓度和所得信号的标准化小变化可以反过来用于标准化捕获的抗体信号。为了生成每种生物标志物的标准曲线,用已知浓度的抗原探测每个孔。得到的捕获抗体信号(图19)用给定生物标志物的平均抗原曲线标准化。通过使用平均抗原曲线的斜率,将信号转换为相对浓度(图20)。然后将该相对浓度相对于已知的抗原浓度作图,如图21所示。这些曲线针对所有8种生物标志物生成。即使用相同的抗原浓度探测,两个孔之间也会发生变异。变异水平可以用变异系数(cv)量化。为了确定变异系数,捕获抗体的重复品信号的标准偏差除以捕获抗体的复制品信号的平均值并乘以100,得到%cv。对于免疫测定,低于20%的变异系数被认为是可接受的变异水平。孔内变异(intra-variation)是在相同载玻片上以相同浓度探测的多个孔的平均%cv。孔间变异(inter-variation)是于可能的不同日期在不同的载玻片上以相同浓度探测的多个孔的平均%cv。计算所有生物标志物的孔内变异。ca12-3和ca19-9的孔内变异如表12所示。在可接受的变化范围内,ca15-3和ca19-9的孔内变异均低于20%。表12:ca15-3和ca19-9的孔内变异还对生物标志物检查了孔间变异。在三个单独的实验中,在三个不同的日期用相同浓度的抗原探测孔。cv%由指定的捕获抗体的复制斑点计算(表13)。然后将来自这三个实验的cv%平均以产生各生物标志物的孔间变异。结果在表13中示出。各生物标志物的孔间变异低于15%,表明测定是精确的。表13:生物标志物的孔间变异我们的测定还与每种生物标志物的fda批准或ce标记的elisa试剂盒进行了比较,以确定我们的测定与fda批准的测定相比如何。使用elisa试剂盒和我们的微阵列产生标准曲线。还用elisa试剂盒和微阵列测定了用于每种生物标志物的三种已知浓度。这些浓度跨越了低、中、高范围的标准曲线。使用每个测定产生的标准曲线,确定并比较这三种“未知数”的浓度。使用cyfra21-1的实例在图22中示出。对于cyfra2-1,我们将我们的测定与fda批准的来自fujierbioinc.的elisa试剂盒进行了比较。使用配对t检验比较两种检测方法,并在bland-altman图中视觉表示。通过我们的测定确定的浓度与fujierbio的elisa测定具有95%的可接受性。时间是诊断心脏病发作的关键。任何延迟治疗都会降低患者获得良好结果的机会。由此,我们希望减少总测定时间,特别是对于心血管生物标志物组。最初,心血管组的总测定时间为27分钟:10分钟抗原温育,10分钟检测抗体温育,5分钟sa-hrp/生物素-hrp温育和2分钟tmb温育。我们将总测定时间减少至10分钟:4分钟样品温育,2分钟检测抗体温育,2分钟sa-hrp/生物素-hrp温育和2分钟tmb温育。即使总测定时间缩短,我们也可以保持高水平的信号和灵敏度。为了减少总测定时间,必须改变测定的一些变量。具体来说,我们提高了捕获抗体和检测抗体的浓度。例如,对于肌红蛋白的检测,在较长的测定中,捕获抗体(cab)浓度范围为80μg/ml至10μg/ml。在将测定时间减少至10分钟后,肌红蛋白捕获抗体浓度提高至800μg/ml至12.5μg/ml的跨度。类似地,在27分钟的较长肌红蛋白测定中,50ng/ml的检测抗体(dab)浓度足以检测肌红蛋白抗原。在测定时间减少后,肌红蛋白检测抗体浓度升至1μg/ml。然而,在这些条件改变时,我们保持了肌红蛋白信号。图42示出了当用22ng/ml肌红蛋白和不同的检测抗体浓度探测时的捕获抗体的平均信号。尽管该测定法比较长的测定法短得多,但较短的测定法在改变的条件下显示出更高的信号。因此,我们得出结论,10分钟的测定时间足以检测测试的心血管生物标志物。3f:用微流体盒和仪器进行的免疫测定我们将抗体微阵列测定实施到我们的微流体盒和仪器中。在用于与微流体盒正确对准的载玻片中心处用omnigrid300打印环氧涂布的载玻片。在固定化之后,将载玻片封闭并附接至微流体盒。湿盒在分开的储罐中装载有用于免疫测定的试剂;由ca15-3校准剂(40u/ml)组成的抗原混合物,由ca15-3检测抗体(10-ca153b-b:0.5μg/ml)组成的检测抗体混合物,sa-hrp/生物素-hrp(4μg/ml/4μg/ml)。装载到湿盒中的其它试剂包括:1xpbs、蒸馏水和tmb-mx。将干盒和湿盒组装并插入仪器中。运行脚本以自动执行测定以及获取最终图像,如图23所示。该测定能够使ca15-3捕获抗体斑点和抗原斑点的结果显影。由于使用检测抗体的高浓度,存在额外的交叉反应性斑点。一旦在实验室中优化了测定,我们便将微阵列测定整合到微流体盒中。将诸如抗原、检测抗体混合物、sa-hrp/生物素-hrp、tmb等试剂和诸如pbst和dh20等缓冲剂预先装载到湿盒中(图44c)。将用心脏标志物捕获抗体和抗原点样的载玻片附接于干盒。湿盒预先装载有试剂。r1装载有tmb,r2装载有dh2o,r3装载有sa-hrp/生物素-hrp,r4装载有pbst,r5装载有pbst,r6装载有抗原样品,r7装载有检测抗体混合物,r8装载有pbst。然后将盒放入一种我们的初始仪器原型,并通过仪器软件运行脚本。仪器自动获取空白和斑点图像(图43)。然后可以用仪器将这些斑点量化为光密度。结果表明该机器能够自动处理微阵列测定并显影出比色可量化的结果。4:微阵列测定的微流体盒的开发4a:分开的湿盒和干盒的设计将湿组分和干组分分到两个分开的盒中(图24a-b),其中图24a显示了干盒15和湿盒16的俯视图,其中玻璃载玻片11介于两盒之间。图24b示出了干盒15和湿盒16的侧视叠放图。干盒含有限定阵列室12以及微流体通道17的孔隙和仪器歧管口14,所述微流体通道17将试剂和/或缓冲剂从湿盒中的储罐经阵列室12带到同样在湿盒中的废物储罐。流体阻隔膜22可介于通道和仪器歧管口之间。弹性密封件20可利用压敏粘合剂21在仪器歧管口周围粘附于干盒顶部。含有捕获抗体的玻璃微阵列载玻片11可通过压敏粘合剂21粘附于干盒,其也可粘附于干盒的底部以使其附接于湿盒。湿盒16含有用于通过阵列室后的所用试剂的储罐18(用于试剂和缓冲剂的个体储罐3至10以及废物储罐1和2),以及标签13,以便于处理。干盒15和湿盒16可由相同或不同类型的材料制成。在一些实施方式中,干盒的一部分可以由聚对苯二甲酸乙二醇酯23激光切割而成,具有聚碳酸酯19部分,而湿盒可以由聚碳酸酯19制成。干盒15的分离允许在即将组装之前插入微阵列玻璃载玻片,以及根据特定生物化学测定和关于测定时机的灵活性而对盒进行定制。类似地,湿盒16的分离允许试剂装载的简单性和灵活性。对于干盒,每个试剂通道与缓冲剂通道连接,以冲洗掉使用期间留在通道中的任何残留试剂。干盒的一个实施方式在图25a中示出。在图25a中,附图标记在本文中的指代如下:i)11:玻璃载玻片;ii)12:阵列室;iii)22:透气膜;iv)25:从废物储罐2(w2)至干盒中通道(cw2)的端口v)26:废物储罐1(w1)的通气口vi)27:废物储罐2(w2)的通气口vii)28:缓冲剂储罐1的通气口(b1v)viii)29:试剂储罐2的通气口(r2v)ix)30:试剂储罐3的通气口(r3v)x)31:缓冲剂储罐4的通气口(b4v)xi)32:缓冲剂储罐5的通气口(b5v)xii)33:试剂储罐6的通气口(r6v)xiii)34:试剂储罐7的通气口(r7v)xiv)35:缓冲剂储罐8的通气口(b8v)xv)36:缓冲剂储罐1的通道(b1c)xvi)37:试剂储罐2的通道(r2c)xvii)38:试剂储罐3的通道(r3c)xviii)39:缓冲剂储罐4的通道(b4c)xix)40:缓冲剂储罐5的通道(b5c)xx)41:试剂储罐6的通道(r6c)xxi)42:试剂储罐7的通道(r7c)xxii)43:缓冲剂储罐8的通道(b8c)xxiii)45:w1至干盒中通道(postc)的端口xxiv)46:至废物储罐2的通道(cw2)xxv)47:从b1c和r2c至主结点的通道(c1/2)xxvi)48:从b4c和r3c至主结点的通道(c3/4)xxvii)49:从b5c和r6c至主结点的通道(c5/6)xxviii)50:从b8c和r7c至主结点的通道(c7/8)xxix)51:阵列室前通道(prec)xxx)52:阵列室后通道(postc)xxxi)56:样品托座;xxxii)104:孔隙xxxiii)106:主结点xxxiv)107:用于与湿盒对准的凹口;xxxv)108:用于与湿盒对准的防错装置(pokeyoke)图25a所示的干盒中的通道和孔隙的位置和尺寸如下:i)b1c,b4c,b5c,b8c:长14mm,宽2mm;ii)r2c,r3c,r6c,r7c:长11mm,宽2mm;iii)c1/2:长16mm,宽1mm;iv)c3/4:长8mm,宽1mm;v)c5/6:长16mm,宽1mm;vi)c7/8:长32mm,宽1mm;vii)prec:长17mm,宽1mm;viii)postc:长122mm,宽1-1.5mm;ix)孔隙:面积为100mm2;x)具有载玻片的阵列室:体积25mm2。在操作中,储罐2的试剂通道r2c(37)与储罐1的缓冲剂通道b1c(36)连接;储罐3的试剂通道r3c(38)与储罐4的缓冲剂通道b4c(39)连接;储罐6的试剂通道r6c(41)与储罐5的缓冲剂通道b5c(40)连接,并且储罐7的试剂通道r7c(42)与储罐8的缓冲剂通道b8c(43)连接(图25a)。一旦试剂从指定的储罐中推出,则从其缓冲剂储罐对推送缓冲剂就可以冲洗通道中剩余的试剂(例如c1/2(47))。这些构造可减少或防止试剂之间的交叉污染。我们也将所有试剂/缓冲剂通道对与主结点连接以减少或防止试剂之间的交叉污染。一旦试剂或缓冲剂通过其通道从其储罐中推出,则流体经过其通道(例如r2c(37)或b1c(36)和c1/2(47))到达主结点106。从这里,流体可以被推到第一或第二废物储罐w2(27)或w1(26)。首先将所有试剂推至w2,以“灌注”储罐并将任何气泡清除到w2(26)中。一旦试剂“灌注”,则从储罐到主结点的整个通道都填充了指定的液体。然后推动w1(27),其允许流体以指定的溶液填充阵列室。这允许在试剂和打印在载玻片上的抗体之间进行任何相互作用,或者在缓冲剂的情况下允许任何非特异性相互作用从阵列室清除并进入w1(27)。图25b示出了干盒的备选实施方式。在图25b中,附图标记在本文中的指代如下:i)11:玻璃载玻片;ii)12:阵列室;iii)25:从废物储罐2(w2)至干盒中通道(cw2)的端口iv)36:缓冲剂储罐1的通道(b1c)v)37:试剂储罐2的通道(r2c)vi)38:试剂储罐3的通道(r3c)vii)39:缓冲剂储罐4的通道(b4c)viii)40:缓冲剂储罐5的通道(b5c)ix)41:试剂储罐6的通道(r6c)x)42:试剂储罐7的通道(r7c)xi)43:缓冲剂储罐8的通道(b8c)xii)45:w1至postc的端口xiii)46:至废物储罐2的通道(cw2)xiv)51:阵列室前通道(prec)xv)52:阵列室后通道(postc)xvi)80:主通道(mainc)xvii)81:聚四氟乙烯膜m1/2xviii)82:聚四氟乙烯膜m3/4xix)83:聚四氟乙烯膜m5/6xx)84:聚四氟乙烯膜m7/8xxi)104:孔隙xxii)107:用于与湿盒对准的凹口xxiii)108:用于与湿盒对准的防错装置图25b所示的干盒中的通道和孔隙的位置和尺寸如下:i)25:w2的端口,0.79mm2ii)36:b1c,15mmiii)37:r2c,11mmiv)38:r3c,21mmv)39:b4c,15mmvi)40:b5c,15mmvii)41:r6c,12mmviii)42;r7c,11mmix)43:b8c,15mmx)45:w1至干盒中postc通道的端口,0.79mm2xi)46:cw2,11mmxii)51:prec,20mmxiii)52:postc,37mmxiv)80mainc,52mmxv)81:m1/228m,mm2xvi)82:m3/4,28mm2xvii)83:m5/6,28mm2xviii)84:m7/8,28mm2xix)104:孔隙,100mm2在操作中,试剂将从湿盒中的试剂储罐4、5、8或9经其各自的通道37、38、41或42推送至主通道80。当试剂通过通道时,它将在膜81、82、83或84下面通过。膜将试剂暴露在空气中,允许试剂内的任何气泡进入大气。一旦在主通道80中,则试剂将首先经cw2(46)推送至w2(25)的端口。这允许废物试剂进入w2(2)。当试剂通过通道时,它将在膜81、82、83或84下面通过。膜将试剂暴露在空气中,允许试剂内的任何气泡进入大气。一旦在主通道80中,则试剂将首先经cw2(46)推送至w2(2)。这将确保从试剂中除去所有空气。随后试剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。试剂将在postc(52)中继续至w1(45)的端口并进入w1(1)。这将确保从试剂中除去所有空气。随后试剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。试剂将在postc(52)中继续至w1(1)。在阵列室中试剂温育后,用配对的缓冲剂冲掉剩余的试剂。缓冲剂将从湿盒中的缓冲剂储罐3、6、7或10经其各自的通道36、39、40或43推送。当缓冲剂通过通道时,它将在膜81、82、83或84下面通过。膜将试剂暴露在空气中,允许缓冲剂内的任何气泡进入大气。一旦在主通道80中,则缓冲剂将首先经cw2(46)推送至w2(25)的端口并进入w2(2)。这将确保从缓冲剂中除去所有空气。随后缓冲剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。缓冲剂将在postc(52)中继续至w1(45)的端口并进入w1(1)。图25c示出了干盒的备选实施方式。在图2cb中,附图标记在本文中的指代如下:i)11:玻璃载玻片;ii)12:阵列室;iii)25:从废物储罐2(w2)至干盒中cw2通道的端口iv)26:废物储罐1(w1)的通气口v)27:废物储罐2(w2)的通气口vi)28:缓冲剂储罐1的通气口(b1v)vii)29:试剂储罐2的通气口(r2v)viii)30:试剂储罐3的通气口(r3v)ix)31:缓冲剂储罐4的通气口(b4v)x)32:缓冲剂储罐5的通气口(b5v)xi)33:试剂储罐6的通气口(r6v)xii)34:试剂储罐7的通气口(r7v)xiii)35:缓冲剂储罐8的通气口(b8v)xiv)36:缓冲剂储罐1的通道(b1c)xv)37:试剂储罐2的通道(r2c)xvi)38:试剂储罐3的通道(r3c)xvii)39:缓冲剂储罐4的通道(b4c)xviii)40:缓冲剂储罐5的通道(b5c)xix)41:试剂储罐6的通道(r6c)xx)42:试剂储罐7的通道(r7c)xxi)43:缓冲剂储罐8的通道(b8c)xxii)45:w1至干盒中postc通道的端口xxiii)46:至废物储罐2的通道(cw2)xxiv)47:从b1c和r2c至主结点的通道(c1/2)xxv)48:从b4c和r3c至主结点的通道(c3/4)xxvi)49:从b5c和r6c至主结点的通道(c5/6)xxvii)50:从b8c和r7c至主结点的通道(c7/8)xxviii)51:阵列室前通道(prec)xxix)52:阵列室后通道(postc)xxx)56:样品托座;xxxi)66:密封膜xxxii)80:主通道(mainc)xxxiii)104:孔隙,100mm2xxxiv)107:用于与湿盒对准的凹口在此实施方式中,图25c所示的干盒组件可具有下述尺寸:i)25:从废物储罐2(w2)至干盒中cw2通道的端口,0.79mm2ii)26:废物储罐1(w1)的通气口,1.13mm2iii)27:废物储罐1(w2)的通气口,1.13mm2iv)28:缓冲剂储罐1的通气口(b1v),1.13mm2v)29:试剂储罐2的通气口(r2v),1.13mm2vi)30:试剂储罐3的通气口(r3v),1.13mm2vii)31:缓冲剂储罐4的通气口(r4v),1.13mm2viii)32:缓冲剂储罐8的通气口(b8v),1.13mm2ix)33:试剂储罐6的通气口(r6v),1.13mm2x)34:试剂储罐7的通气口(r7v),1.13mm2xi)35:缓冲剂储罐8的通气口(r8v),1.13mm2xii)36:缓冲剂储罐1的通道(b1c),5mmxiii)37:试剂储罐2的通道(r2c),10mmxiv)38:试剂储罐3的通道(r3c),18mmxv)39:缓冲剂储罐4的通道(b4c),5mmxvi)40:缓冲剂储罐5的通道(b5c),5mmxvii)41:试剂储罐6的通道(r6c),10mmxviii)42;试剂储罐7的通道(r7c),9mmxix)43:缓冲剂储罐8的通道(b8c),5mmxx)45:w1至干盒中postc通道的端口,0.79mm2xxi)46:至废物储罐2的通道(cw2),15mmxxii)47:b1c和r2c至主结点(c1/2)的通道,10mmxxiii)48:b4c和r3c至主结点(c3/4)的通道,10mmxxiv)49:b5c和r6c至主结点(c5/6)的通道,10mmxxv)50:b8c和r7c至主结点(c7/8)的通道,10mmxxvi)51:阵列室前通道(prec),18mmxxvii)52:阵列室后通道(postc),27mmxxviii)56:样品口,0.79mm2xxix)66:密封膜,9.62mm2xxx)80:主通道(mainc),51mmxxxi)104:孔隙,100mm2在操作中,样品将首先经样品口(56)装载到试剂储罐中。试剂将从湿盒中的试剂储罐4、5、8或9经其各自的密封膜(66)推送入其各自的通道37、38、41或42中。试剂将进入其各自的缓冲剂/试剂通道47、48、49或50至主通道80。一旦在主通道80中,则试剂将首先经cw2(46)推送至w2(25)的端口。这允许废物试剂进入w2(2)。这将确保从试剂中除去所有空气。随后试剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。试剂将在postc(52)中继续至w1(45)的端口并进入w1(1)。这将确保从试剂中除去所有空气。随后试剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。试剂将在postc(52)中继续至w1(1)。在阵列室中试剂温育后,用配对的缓冲剂冲掉剩余的试剂。缓冲剂将从湿盒中的试剂储罐3、6、7或10经其各自的密封膜(66)推送入其各自的通道36、39、40或43中。试剂将进入其各自的缓冲剂/试剂通道47、48、49或50至主通道80。一旦在主通道80中,则缓冲剂将首先经cw2(46)推送至w2(25)的端口并进入w2(2)。这将确保从缓冲剂中除去所有空气。随后缓冲剂将经prec(51)推送至孔隙(104),孔隙(104)在与玻璃载玻片(11)接合时将形成阵列室(12)。缓冲剂将在postc(52)中继续至w1(45)的端口并进入w1(1)。湿盒中储罐的位置和尺寸经过优化,使得其可允许指定的体积。在示出湿盒的实施方式的图26和48c中,存在的附图标记在本文中的指代如下:i)1:废物储罐1(w1)ii)2:废物储罐2(w2)iii)3:缓冲剂储罐1(b1)iv)4:试剂储罐2(r2)v)5:试剂储罐3(r3)vi)6:缓冲剂储罐4(b4)vii)7:缓冲剂储罐5(b5)viii)8:试剂储罐6(r6)ix)9:试剂储罐7(r7)x)10:缓冲剂储罐8(b8)xi)13:操作标签xii)24:用于对准干盒的凹口107xiii)24:用于对准干盒的防错装置108xiv)25:w2至干盒的端口xv)44:样品孔xvi)45:w1至干盒的端口xvii)54:至阀门的端口xviii)55:至干盒的端口在图26中,储罐的尺寸如下:b8(10):储罐的体积为420μl。b8具有弯曲形状,用于在湿盒末端的凹口周围进行造型,以便与干盒接合。该储罐覆盖长15mm、宽10mm、深7mm的区域。r7(9):储罐的体积为260μl。r7为大致椭圆形,在基座上具有轻微凸起,以容纳额外的体积。该储罐覆盖长11mm、宽4mm、深7mm的区域。样品托座(44):宽5mm,长1.5mm,深7mm。其保持大约25μl的样品。r6(8):储罐的体积为226μl。r6为大致椭圆形。该储罐覆盖长11mm、宽3mm、深7mm的区域。b5(7):储罐的体积为420μl。该储罐为大致椭圆形,在侧面具有额外的三角形区域,以便容纳额外的体积。该储罐覆盖长约13mm、宽7mm、深7mm的区域。b4(6):储罐的体积为420μl。该储罐具有大致弯曲的形状以允许指定的体积,并且具有正确的端口对准。该储罐覆盖长约13mm、宽8mm、深7mm的区域。r3(5):储罐的体积为200μl。该储罐为大致椭圆形。该储罐覆盖长9mm、宽4mm、深7mm的区域。r2(4):储罐的体积为160μl。该储罐为大致椭圆形。该储罐覆盖长9mm、宽3mm、深7mm的区域。b1(3):储罐的体积为160μl。该储罐为大致椭圆形。该储罐覆盖长9mm、宽3mm、深7mm的区域。w2(2):储罐的体积为2100μl。该储罐具有u形。这种设计允许进入w2储罐的流体尽可能地远离通气口。这防止通气口的任何意外堵塞。w1(1):储罐的体积为大约3129μl。该储罐具有u形。进入入口的流体沿着盒的右边缘行进经过储罐,沿着盒的底边(靠近手柄)行进,然后沿盒的左边缘向上行进,直至其到达通气口。此外,在靠近右边缘的储罐底部附近增加了一个方形凸起。其被添加用于允许汇集进入流体。这防止进入的流体射到储罐的末端并堵塞通气口。在图48c中,储罐的尺寸如下:b8(10):储罐的体积为475μl。b8具有弯曲形状,以在湿盒末端的凹口周围进行造型,以便与干盒接合。该储罐覆盖长约19mm、宽约6mm、深约9mm的区域。r7(9):储罐的体积为300μl。r7为大致椭圆形,在基座上具有轻微凸起,以容纳额外的体积。该储罐覆盖长11mm、宽约4mm、深约9mm的区域。r6(8):储罐的体积为275μl。r6为大致椭圆形。该储罐覆盖长约11mm、宽约3mm、深约9mm的区域。b5(7):储罐的体积为450μl。该储罐为大致椭圆形,在侧面具有额外的三角形区域,以便容纳额外的体积。该储罐覆盖长约13mm、宽约6mm、深约9mm的区域。b4(6):储罐的体积为450μl。该储罐具有大致弯曲的形状以允许指定的体积,并且具有正确的端口对准。该储罐覆盖长约15mm、宽约4.5mm、深约9mm的区域。r3(5):储罐的体积为250μl。该储罐为大致椭圆形。该储罐覆盖长约9mm、宽约3mm、深约9mm的区域。r2(4):储罐的体积为300μl。该储罐为大致椭圆形。该储罐覆盖长约10mm、宽约4mm、深约9mm的区域。b1(3):储罐的体积为175μl。该储罐为大致椭圆形。该储罐覆盖长约9mm、宽约3mm、深约9mm的区域。w2(2):储罐的体积为2000μl。该储罐具有u形。该设计允许进入w2储罐的流体尽可能地远离通气口。这减少或防止通气口的任何意外堵塞。w1(1):储罐的体积为大约2000μl。该储罐具有u形。进入入口的流体沿着盒的右边缘行进经过储罐,沿着盒的底边(靠近手柄)行进,然后沿盒的左边缘向上行进,直至其到达通气口。此外,在靠近右边缘的储罐底部附近增加了一个方形凸起。其被添加用于允许汇集进入流体。这减少或防止进入的流体射到储罐的末端并堵塞通气口。底部层压体:图26和48c示出的湿盒具有层压底部。该层压体含有在储罐下方的预切洞,用于储罐装载。微阵列抗体载玻片将抗体打印到玻璃载玻片上,使得打印的斑点与阵列室对准。阵列室的位置和打印的斑点可以改变,只要它们彼此对准即可。抗体可以以50μm至300μm的斑点尺寸打印。5:仪器设计5a:泵和螺线管阀门系统压力驱动的流动由泵(68)产生。通过打开需要流体运动的选定储罐上方的阀门,并通过将废物储罐对大气打开,所述泵在所需方向上移动,使得所选储罐中的流体被推向大气,并允许相继的试剂递送。我们的仪器设计成使泵从试剂储罐中推出。通过在我们想要移动的试剂储罐(例如3)处打开螺线管阀门(65),流体将从储罐移向废物1或废物2(图28)。流体捕集器(64)确保来自储罐的液体不能进入歧管或阀门。密封膜(66)防止液体过早地离开储罐进入阵列室或干盒通道。然而,通过泵(68)的压力和特定阀门(65)的开放,液体可以穿过密封膜朝向w1(1)或w2(2)。如果我们希望灌注储罐,我们将溶液移至废物2(2)。这将减少或消除储罐中存在的任何气泡并将试剂带到主结点。接下来是推动废物1(1),其将使试剂穿过阵列室(12)并进入废物1储罐(1)。通过电机(vex:rb-inn-11)操作泵。废物1(1)和废物(2)的阀门都对大气打开,使空气可以逸出盒。作为另一选择,鲁尔端口(67)密封歧管,使得空气仅在歧管和盒内行进。电动机的旋转使泵移入和移出,从而导致流体的运动。盒式读取器包括用于推动或拉动指定体积空气的容积式空气泵。通过接地不锈钢销针轴向移动到泵腔中而使空气移位。销针通过固定径向密封件在腔体入口处密封。销针由步进电机驱动(haydonkerklc1574w-05)线性致动器直接移动。用接近传感器光学测量泵位置。可以自动校准泵以检测和校正跳过的步骤并考虑结构的变化。阀门允许自动控制泵、通气口和喷嘴之间的气动连接。阀门使用螺钉和面密封安装到歧管组件。歧管组件包括十一个阀门,并包括两个额外阀门的空插座,以利于将来的盒迭代。系统中包括压力传感器,以测量泵内的压力。应尽量减少压力传感器和传感器连接内的空气量,以改善系统响应。为了控制在给定时间打开哪个储罐,我们使用了螺线管阀门(parker:x-705l-f)。电磁阀门由机电致动以由软件打开。没有任何致动,则阀门关闭。如果泵将流体从试剂储罐推向废物储罐,打开到大气压,则阀门的开口允许空气进入储罐。图29示出了阀门的示意图,其显示了封闭端口69、公共端口70和常闭端口71。当阀门致动时,端口70和71打开,允许空气通过阀门。当阀门不再致动或关闭时,这些端口关闭。阀门放置在每个储罐上方,包括废物储罐(图28)。还放置了另外的阀门以用于通气,或允许泵在没有连接到盒中的情况下重新归零。5b:光学传感可以使用任何合适的光学传感系统。在一些实施方式中,仪器包括相机,例如usb相机(例如,leopardimaging:li-ov7725)和照明系统,使得软件能够获得斑点的图像。然后,软件可以基于相机拍摄的图像计算光密度。led阵列可以放置在斑点的场下方,使得照明允许斑点的图像(例如,life-oninc.)。仪器成像系统由光源组成,光源由4个白色led组成,它们透过半透明的丙烯酸扩散器,然后穿过湿卡的背面。湿盒由半透明聚碳酸酯制成,从而增加了照明的均匀性。led的闪烁可以允许合适的软件计算所得图像的增益和偏移。led以三角形的时变信号照亮载玻片的背面。该调制发生在大约2.6hz。调制由控制器电路产生,该控制器电路也用于控制阀门和泵电机。控制器电路产生方波信号,该信号被积分然后用于调制到led的电流,从而产生三角形的时变光输出。光路长度可以设计得尽可能短,以减小仪器的尺寸。光学系统允许tad系统对由测定产生的阵列室中的斑点成像,以确定插入的微流体盒的类型、相容性、取向和成功插入,并且对微流体盒中的流体流动进行成像。相机发挥多种功能。其以足够的分辨率对测定产生的斑点进行成像,以量化光密度。其将从仪器中输入空白和点图像作为输入。其还将基于所选择的卡类型配置的点阵列尺寸来定位基准点并输出二维点阵列。其对微流体盒上的特征进行成像,允许确定盒类型、相容性和方向,并允许tad确定成功插入。其可以对微流体盒内的所有微流体进行成像,以记录流体或空气位置,并协助诊断或提供测试记录。相机还可以对盒标签进行成像以进行条形码扫描。led阵列照亮微流体盒的顶面。光输入由控制电子设备调制,并且可以由软件控制以支持上述相机功能。这些灯用于条形码扫描和潜在的视频记录,用于故障排除和诊断。成像led为阵列室的基座提供光。光输入由控制电子设备调制,并且可以根据量化阵列室中斑点的需要由软件控制。对于阵列室中的成像点,来自led的光必须进入阵列室的底部,通过观察窗口,并进入相机而不会反射或漫射通过任何其他表面。来自成像led的光不得反射或漫射通过tad设备的任何元件,然后从顶部照射阵列室。在阵列成像led和微流体盒测定室之间包括漫射元件,以在led进入测定室之前均匀地分布来自led的光。为了获得斑点的图像,可以首先获得空白图像,以允许软件通过忽略斑点形成之前存在的任何背景来检测斑点。在斑点显影时,可以获得斑点图像。在图像捕获开始时,两个640×480像素阵列归零:一个将累积每个单独像素的平均黑色和白色强度,另一个将累积强度乘以整体像素平均值。空间像素平均值也与捕获帧的时间一起存储。在以下分析中,空间像素平均值用作调制信号的代理。这是基于2.6hz周期的唯一来源必须归因于调制的假设。一旦捕获了所需的总帧数,就将平均像素强度的时间记录与正弦波的频率范围相关联,以便识别正确的调制频率、相位和幅度。该计算的结果是与调制幅度成比例的值。接下来,对每个像素计算最小二乘线性回归,以确定每个像素相对于提取的调制信号的增益和偏移。此时,假设单个像素增益表示与led输出相关的比例因子。像素偏移不被认为是有用的并且被丢弃。为了阻挡由卡到卡的变化,由于腔室中的流体引起的光密度变化以及精确的调制幅度引起的影响,首先在斑点形成之前然后在之后捕获图像。这些被称为“空白”图像和“斑点”图像。通过计算斑点图像的每个像素增益与空白图像的每个像素增益的比率来创建最终处理图像。通过所计算的斑点图像与空白图像的调制幅度的比率来进一步缩放该图像。用于量化的斑点可以由软件用户手动标记。每个斑点包含一个中心点区域。用户可以使用软件更改斑点的大小。为了量化斑点,可以计算新图像,其中每个像素等于斑点和无斑点图像的每个像素的比率。这消除了由于背光和固有的空间卡密度以及像素增益和偏移引起的变化。计算中心斑点圆内的平均像素值。该仪器设计用于包含摄像机和照明系统,使得该软件能够拍摄从tmb-mx显影的斑点的图像。然后,软件将能够基于相机拍摄的图像计算光密度。相机是usb相机(leopard成像:li-ov7725)。led灯阵列位于斑点区域下方,其照明允许斑点图像(life-oninc.)。led指示灯闪烁,这允许软件计算得到的图像的增益和偏移。光路长度设计得尽可能短,以使装置尽可能紧凑。5c:仪器集成泵、阀门和光学相机都将集成到仪器中。在仪器内,这些部件与打印电路板集成在一起。该电路板将来自软件的所有电输入传递到各种组件。仪器将容纳微控制器、泵、阀门和光学系统。将盒(湿盒和干盒一起)插入仪器中并通过与歧管的弹簧机构接合。歧管是将阀门连接到储罐端口的装置。当前装载在pc笔记本电脑上的软件通过两根usb电缆连接仪器,一根控制仪器,另一根控制相机。图30示出了仪器、盒和软件如何组合在一起的示意图。tad系统可以包括读取器,其控制和量化由盒而得的结果。该仪器由塑料和金属外壳组成,其容纳触摸屏显示器、主cpupcb、包括泵的盒接口、多个阀门、用于量化的相机、各种led光源和带有mcu的pcb、阀门驱动器、电机驱动器和传感器,以确保正确进行实验。读取器的基本形式将包括用于用户界面的图形触摸屏显示器,其具有用于盒插入的抽屉。外壳可以使用ots防振脚。假设读取器将用在足够平坦的表面上,不需要进行调整。读取器可以向用户指示它是否不够平坦。tad软件将在基于arm的cpu上运行。主要的软件功能(包括所有gui)可以是用java编写的软件应用程序(app)的结果。该应用程序将依赖于各种其他软件库和软件包的支持,这些软件库和软件包属于未知来源(soup)软件类别。在tad中的微控制器中运行的软件将被称为tad固件。这意味着该软件在运行时无法显着重新配置,并且它将在加电时开始执行。tad的固件将在盒接口的微控制器上运行。该固件将使用由两个线程组成的实时架构实现:连续的无限主循环和恒定间隔定时器中断。中断可以被称为快速代码,主循环将被称为慢速代码。根据经验,预计mcu将花费近一半的时间执行快速代码,而一半花在慢速代码上。tad可以包括许多定制和现成的电子组件。tad的主ui可以基于7”触摸屏lcd。这可能是具有并行接口的ots组件和基于ft5x06控制器的i2c触摸屏控制器。所有用户与应用程序的交互都将通过触摸屏完成。任何数据输入都将通过屏幕键盘完成。在一些实施方式中,可以包括用于患者id输入的外部条形码扫描仪的添加。gui可以包括主屏幕,以允许用户启动向导式引导过程,用于运行分析和访问仪器设置,这取决于用户授权级别。tad可能包含用于备用蓄电池的nimh蓄电池。四块大约4a*h的mimh电池可以提供足够的能量以在8w下运行设备大约2小时。读取器可以使用四到六块电池。cpupcb包含tad的所有gui和通信。歧管pcb包含顶部led、阀门和泵电机的驱动组件。它还包含压力传感器的adc。盒接口pcv管理盒式接口的所有功能。该板为照明led提供安装,用于照亮阵列室。其还包含所有输入功率转换,包括蓄电池充电和监控。蓄电池pcb机械安装蓄电池、蓄电池热敏电阻和蓄电池监控电路。歧管组件(图46a-b,概念性渲染)可包括盒接口pcb;光学传感系统中描述的相机(109)和盒成像led;微流体盒接口中描述的歧管端口(14)、光学窗口和对准特征;和泵(68)、阀门(65)、压力传感器和叠层堆(110)。泵(68)、阀门(65)和组装的盒(79)必须全部与歧管的层压堆叠体(110)接合。另外,必须定位相机(109)以正确地对阵列室(12)的结果进行成像。图33和47示出了歧管的两个示例性详述的层压堆叠体,其用于将来自泵的空气连接到通向盒的阀门。空气通过端口88离开泵,行进到阀门入口85,并通过打开的阀门。然后空气通过端口86离开阀门,重新进入歧管并行进到歧管与盒87连接的端口。在泵的归零期间,或行进到w1(1)或w2(2)空气通过端口排出至大气63。盒接口包含预期仪器与盒正确耦合的连接功能。该接口旨在为盒设计和构造提供足够的灵活性,以便盒设计可以独立于仪器进行迭代。盒读取器包括10个喷嘴,每个喷嘴高0.9mm,内径3mm,外径3.5mm,倒角60°。3mm内径为0.9mm深,以接受喷嘴垫圈的弯曲,然后其过渡到0.5mm直径的洞,以最小化内部空气量。喷嘴间隔5.8mm。读取器包括用于添加两个额外喷嘴的空间,具有最小修改以支持将来的盒迭代。喷嘴和盒对准特征由单个铝坯加工而成,并拧到歧管组件上。喷嘴与微流体盒上的10个端口接合。端口间隔5.8mm,以盒中线为中心,距盒前缘2.72mm。每个喷嘴/端口对在盒式读取器和微流体盒之间提供独立的气动连接。0.03英寸厚的硅橡胶垫圈粘合在气动端口上方。垫圈包含与每个气动端口对准的1.5mm洞。当夹紧时,垫圈在气动端口和喷嘴之间提供密封。微流体盒接口的喷嘴和喷嘴垫圈用弹簧或致动器驱动机构夹紧在一起。夹紧将在没有来自用户的输入力的情况下完成。该机构为所有喷嘴提供均匀的夹紧力,总夹紧力为30 /-5n。该机构可以保持12mm至17mm高的盒的可接受的夹紧力。这将确保在盒的弹性体表面和读取器的喷嘴之间施加足够的局部压力,以提供足够的密封而无需施加会使垫圈变形并干扰密封的过大压力。在喷嘴两侧的盒式读取器上会有对准特征,其将与湿盒顶部两侧的特征相接合。这些用于精确的盒对准。它们可以由矩形突出物组成,在端部的3个边缘上具有倒角。这些特征将在水平面上占据1mm至2mm的未对准。层压堆叠体(laminatestack)提供微流体空气通道以连接通气口/进气口、泵、阀门和喷嘴。可以容易地移除和更换堆叠体以翻新仪器或重新配置微流体连接。堆叠体通过圆形通道与其他组件连接,从通道堆栈的顶部或底部离开,并密封到其他组件,其中有暴露的粘合剂岛,每个通道周围提供2mm至4mm的密封。堆叠体通过歧管组件上的特征(销针等)对准,并且包含特征,因此其只能以正确的取向安装。该系统包括用于潜在潮湿空气移动通过微流体盒并安全地排放到环境中的路径。该路径兼作泵的进气口。通气口开口指向下方以防止灰尘聚集在端口中。通气口上盖有gpm,以防止灰尘进入空气系统。通气口排入盒式读取器的主体。必须允许少量空气自由地流入和流出盒式读取器,以防止在盒式读取器内部产生压力/真空。盒可以放入从盒式读取器(89)延伸的抽屉中(图45a)。在插入过程中应该容易水平地握住盒。希望在没有正确插入盒的情况下不能关闭抽屉(例如盒与读取器碰撞)。如果在未正确插入盒的情况下关闭抽屉,抽屉关闭机构可以受力限制以防止损坏盒。抽屉设计可以最小化夹点并且可以包括力层压以防止对使用者的伤害。当盒式读取器接受时,微流体盒被保持在可移动的承滴盘(driptray)内,该承滴盘可具有容纳保持在微流体盒内的整个流体体积的能力。移动抽屉元件可以是托盘。托盘可移除以便清洁。托盘可接受宽达80mm、长达70mm的盒,并且可替换为接受宽度可达95mm,长度可达85mm的盒的托盘,以便将来进行盒迭代。目的是为两个额外的气动端口提供空间。托盘可包括手指间隙袋,以允许容易地安装和移除微流体盒。托盘可以包括使得盒不能倒置或以不正确的方向插入的特征。最终仪器的图示在图45a-c中示出,其中包括泵、cpu、电机和歧管组件的内部元件由塑料壳体(96)和金属部件(94)包围。仪器的前部由7英寸的lcd屏幕(90)和用于容纳插入的盒的可弹出托盘(89)组成。散热金属板位于仪器背面,以协助冷却仪器(95)。各种usb和电气连接位于仪器(91,93)的前部和后部。仪器由位于仪器92后部的on按钮供电。5d:操作脚本软件中的脚本用于命令仪器从哪个储存器进行推送。该脚本可以用文本文件编写并加载到仪器中,专门为在我们的系统中使用而开发了用户友好的基于java的脚本。一些简单的命令用于将盒(全部通气(ventall))和泵(向内通气(ventin),向外通气(ventout),中度通气(ventmid))中的压力归零。脚本控制的另一个简单命令是“暂停(break)”,其简单地中断脚本直到用户希望继续。最后,图像控制“抓空白”抓取用于背景的空白图像,并且“抓点”在斑点完成显影时抓取图像。为了控制机器的流体,一个命令行包含将流体移动到所需位置所需的所有信息。示例性泵命令包括“全部通气”,其打开和关闭所有阀门以使盒中的压力归零;“向内通气”,其一直向外移动泵使其可推动;“向外通气”,其一直向内移动泵使其可拉动;“中度通气”,使泵移动至半程;示例性流体命令包括“抽”,泵朝试剂储罐拉动流体;“推”,泵从试剂储罐推动流体;示例性成像命令包括“抓空白”,其抓取空白图像;“抓点”,其抓取斑点图像;示例性其它脚本命令包括“暂停”,其使脚本和仪器中断;和“//”,其后面的任何文本都是注释而不是命令。泵命令是脚本线的开始,无论是将流体从储罐推至废物的“推”还是将流体在相反方向上推动的“抽”。在抽或推之后是你想要推动的体积,例如100μl。命令的下一部分是你想要从其推出液体的储罐,例如“r1”(可以从任意缓冲剂或试剂储罐中选择)。在此之后是你想要推进的储罐,例如“w1”(选取w1或w2)。命令的最后一部分是流体被推动的所用时间量,即100s。体积量和时间量决定了流速,即流体移动的多快。该脚本存储在具有.txt文件扩展名的纯文本文件中。所有文件内容都不区分大小写。假定脚本的每一行都包含注释和/或单个命令。如果一行包含一个命令,那么命令名将从该行的第一个非空白字符开始。一行开头的空白字符(空格和制表符)将被忽略。注释是脚本解析器不处理的文本。这些可用于传达人类可读的信息,以帮助人们理解脚本。注释以//开头。脚本解析器将忽略注释分隔符后面的任何文本。如果一行的第一个非空白字符是注释分隔符,则整行将被忽略。除非明确用单位表示,否则参数必须以命令定义中的指定的顺序出现。参数与命令分开,并以空格分隔。许多命令需要规定一个或多个阀门。有效的阀门描述符是:r1、r2、r3、r4、r5、r6、r7、r8、w1、w2、all、vent、none。所有数值参数都可以用科学记数法指定,例如1.4e-9,并且假定为正,除非指定的带有负号。为方便起见,数字参数可以跟随有单位,例如:s、μl、g/ml。如果存在,指定的单位将覆盖该命令的已定义参数顺序,除非还需要无单位参数。假设时间值以秒为单位。体积值假定为微升。假设浓度值以克/毫升为单位。某些命令需要指定名称,例如,以指示参数指的是特定蛋白质。对该名称的所有引用必须键入相同的名称。名称以脚本编写,以双引号开头和结尾。盒和仪器的操作组装干盒湿盒和干盒是单独提供的,但这不是必需的。将载有抗体的载玻片面朝下置于干盒中的粘合剂层上。将载玻片夹在一起,以确保通道对载玻片的良好密封。组装湿盒试剂可以通过底部层压体中的预切洞装载到储罐中。为确保试剂不会从通道口或通气口溢出,将一条胶带放在湿盒顶部密封这些端口。一旦加入试剂,将一片胶带置于层压体的预切洞上以密封储罐。在最终产品中,试剂将在制造期间装载,并且密封将通过更合适的机构发生。此时样品可通过湿盒顶部添加到样品口。作为另一选择,可以安装样品机构,使得可以在组装整个盒之后添加样品。组装湿盒和干盒从干盒的背面移除粘合剂覆盖物,露出粘合剂。干盒和湿盒使用防错装置和凹口对准。将干盒压在湿盒上。干燥和湿盒用夹具密封。盒/仪器接口组装的盒滑入盒入口。施加一些力以覆盖盒平台上的弹簧机构。一旦盒完全插入仪器中,平台上的压力释放允许盒的通气口弹起并与歧管端口正确接合。软件和测定方案台式仪器的实施方式(图31)通过两根usb电缆连接到个人计算机。最终产品可能将软件、仪器和成像屏幕都集成到一个产品中。对于台式仪器,该软件加载在个人计算机上。将包含测定方案的脚本加载到app中。脚本可以首先转到脚本的第一行并按下播放。将组装好的微流体盒(79)装入仪器的前部。利用该脚本,夹紧电机(72)被接合并且通过盒夹紧cam(76),盒可以被夹紧以与歧管(73)接合。仪器可以通过仪器中的阀门pcb(74)自动控制(通过脚本)阀门(65)的开口。同时,脚本激活泵电机(75)移动泵(68)。这导致流体从指定的试剂或缓冲剂储罐移动到指定的废物储罐。将试剂顺序地推过阵列室直到整个测定完成。在使用tmb进行现场开发之前,该软件可以通过下部pcb(78)和位于相机护罩(77)中的相机激活led。这为测定创建了空白图像。在tmb之后,相机拍摄了一个斑点图像。相机抓取也通过脚本控制。可以通过加载特定的设置文件来量化斑点。斑点将自动量化,并可保存结果文件。最终产品可以用户友好的格式说明结果,并指出结果是否表明生物标志物水平高于截断值。参考文献adam,s.s.,key,n.s.,andgreenberg,c.s.(2009).d-dimerantigen:currentconceptsandfutureprospects.blood,113.13,2878-2887.[00340]alexander,j.c.,silverman,n.a.andchretien,p.b.(1976).effectofageandcigarettesmokingoncarcinoembryonicantigenlevels.journaloftheamericanmedicalassociation,235(18),1975-1979.algarra,m.,gomes,d.,&dasilva,j.c.e.(2013).currentanalyticalstrategiesforc-reactiveproteinquantificationinblood.clinicachimicaacta,415,1-9.arribasj.,parra-palauj.l.,andpedersenk.(2010).her2fragmentationandbreastcancerstratification.clincancerres;16(16);4071-4073.ay,c.,vormittag,r.,dunkler,d.,simanek,r.,chiriac,a.l.,drach,j.,...andpabinger,i.(2009).d-dimerandprothrombinfragment1 2predictvenousthromboembolisminpatientswithcancer:resultsfromtheviennacancerandthrombosisstudy.journalofclinicaloncology,27(25),4124-4129.beauchemin,n.andarabzadeh,a.(2013).carcinoembryonicantigen-relatedcelladhesionmolecules(ceacams)incancerprogressionandmetastasis.cancermetastasisreviews,32:643-671.begum,m.,karim,s.,malik,a.,khurshid,r.,asif,m.,salim,a.,...andalqahtani,m.h.(2012).ca15-3(mucin-1)andphysiologicalcharacteristicsofbreastcancerfromlahore,pakistan.asianpacificjournalofcancerprevention,13(10),5257-5261.burke,b.(2004).theroleofmatrixmetalloproteinase7ininnateimmunity.immunobiology,209:51-56.danysh,b.p.,constantinou,p.e.,lukianova-hleb,e.y.,lapotko,d.o.,andcarson,d.d.(2012).themuc1ectodomain:anovelandefficienttargetforgoldnanoparticleclusteringandvapornanobubblegeneration.theranostics,2(8),777.dong,j.andueda,h.(2017).elisa-typeassaysoftracebiomarkersusingmicrofluidicmethods.wiresnanomedicineandnanobiotechnology,e1457.ekins.r.p(1989).multi-analyteimmunoassay.jpharmbiomedanal.1989;7(2):155-68.fornier,m.n.,seidman,a.d.,schwartz,m.k.,ghani,f.,thiel,r.,norton,l.,andhudis,c.(2005).serumher2extracellulardomaininmetastaticbreastcancerpatientstreatedwithweeklytrastuzumabandpaclitaxel:associationwithher2statusbyimmunohistochemistryandfluorescenceinsituhybridizationandwithresponserate.annalsofoncology;16;234-239goldenberg,d.m.,neville,a.m.,carter,a.c.,go,v.l.w.,holyoke,e.d.,isselbacher,k.j.,...andschwartz,m.(1981).cea(carcinoembryonicantigen):itsroleasamarkerinthemanagementofcancer.journalofcancerresearchandclinicaloncology,101(3),239-242.grzywar,lupicka-slowika,walczak,m,etal.(2014).highlysensitivedetectionofcancerantigen15-3usingnovelavianigyantibodies.altex;31(1);43-52hann,h.l.,etal.(1990).prognosticimportanceofserumtransferrinandferritininchildhoodhodgkin’sdisease,66.2:313-316.jose,j.,sunil,p.m.,madhavannirmal,r.,andvarghese,s.s.(2013).cyfra21-1:anoverview.oral&maxillofacialpathologyjournal,4(2).kalousová,m.,krechler,t.,jáchymová,m.,kuběna,a.a.,a.,&zima,t.(2012).ferritinisanindependentmortalitypredictorinpatientswithpancreascancer.resultsofapilotstudy.tumorbiology,33.5:1695-1700.leung,f.,diamanis,e.p.andkulasingam,v.(2014).ovariancancerbiomarkers:currentstateandfutureimplicationsfromhigh-throughputtechnologies.advancesinclinicalchemistry,66,25-77.lin,c.etal.(2010).microfluidicimmunoassays.journalforlaboratoryautomation.15(3).253-274.locker,g.y.,hamilton,s.,harris,j.,jessup,j.m.,kemeny,n.,macdonald,j.s.,...andbast,r.c.(2006).asco2006updateofrecommendationsfortheuseoftumormarkersingastrointestinalcancer.journalofclinicaloncology,24(33),5313-5327.lucarelli,g.,ditonno,p.,bettocchi,c.,vavallo,a.,rutigliano,m.,galleggiante,v.,...andselvaggi,f.p.(2014).diagnosticandprognosticroleofpreoperativecirculatingca15-3,ca125,andbeta-2microglobulininrenalcellcarcinoma.diseasemarkers,689795.mattar,r.,andrade,c.r.a.d.,difavero,g.m.,gama-rodrigues,j.j.,&laudanna,a.a.(2002).preoperativeserumlevelsofca72-4,cea,ca19-9andalpha-fetoproteininpatientswithgastriccancer.revistadohospitaldasclinicas57.3:89-92.maxim,petere.androbertw.veltri.(1986).serumferritinasatumormarkerinpatientswithsquamouscellcarcinomaoftheheadandneck.cancer,57.2:305-311.melia,w.m.,bullock,s.,johnson,p.j.,&williams,r.(1983).serumferritininhepatocellularcarcinoma.acomparisonwithalphafetoprotein.cancer,51.11:2112-2115.nakata,b.,ogawa,y.,ishikawa,t.,ikeda,k.,kato,y.,nishino,h.,andhirakawa,k.(2000).serumcyfra21-1isoneofthemostreliabletumormarkersforbreastcarcinoma.cancer,89(6),1285-1290.nayak,a.,salt,g.,verma,s.k.,andkishore,u.(2015).proteomicsapproachtoidentifybiomarkersofneurodegenerativediseases.intrevneurobiol.121:59-86.olle,e.w.,messamore,j.,deogracias,m.p.,mcclintock,s.d.,anderson,t.d.,&johnson,k.j.(2005).comparisonofantibodyarraysubstratesandtheuseofglyceroltonormalizespotmorphology.experimentalandmolecularpathology.79(3):206-209pepys,m.b.andhirschfield,g.m.(2003).c-reactiveprotein:acriticalupdate.journalforclinicalinvestigation.111:1805-1812.reverberi,randreverberi,l.(2007).factorsaffectingtheantigen-antibodyreaction.bloodtransfusion.5:227-240.ricci,a.,mariotta,s.,andbronzetti,e.(2009).serumca15-3isincreasedinpulmonaryfibrosis.sarcoidosisvasculitisanddiffuselungdisease,26(1),54-63.richens,j.l.,lunt,e.a.,ando'shea,p.(2015).optimisationofproteinmicroarraytechniquesforanalysisoftheplasmaproteome:minimisationofnon-specificbindinginteractions.internationalimmunopharmacology,24(2),166-168.howell,a.(1991).prospectiveassessmentoftheroleoffivetumourmarkersinbreastcancer.cancerimmunology,immunotherapy.33.6:403-410.romero,s.,fernandez,c.,arriero,j.m.,espasa,a.,candela,a.,martin,c.andsanchez-paya,j.(1996).cea,ca15-3andcyfra21-1inserumandpleuralfluidofpatientswithpleuraleffusions.eurorespirj,9,17-23.rubenstein,r.(2015).proteomicanalysisofpriondiseases:creatingclarityorcausingconfusion.electrophoresis,33:3631-3643.shao,x.,wang,x.,xu,x.,feng,j.,han,m.,zhang,h.,...andjin,h.(2014).outcomepredictionvaluesofsolublehumanepidermalgrowthfactorreceptor-2extracellulardomaininmetastaticbreastcancer.intjclinexppathol;7(3);1108-1113su,s.b.,qin,s.y.,chen,w.,luo,w.,andjiang,h.x.(2015).carbohydrateantigen19-9fordifferentialdiagnosisofpancreaticcarcinomaandchronicpancreatitis.worldj.gastroenterol.21(14):4323-4333.tonkin,a.(2015).biomarkersinstablecoronaryheartdisease,theirmodulationandcardiovascularrisk:thelipidbiomarkerstudy.internationaljournalofcardiology.201:499-507.xue,y.,clopton,p.,peacock,w.f.,&maisel,a.s.(2011).serialchangesinhigh-sensitivetroponinipredictoutcomeinpatientswithdecompensatedheartfailure.europeanjournalofheartfailure.13:37-42.yang,a.p.,liu,j.,lei,h.y.,zhang,q.w.,zhao,l.,andyang,g.h.(2014).ca72-4combinedwithcea,ca15andca19-9improvesthesensitivityfortheearlydiagnosisofgastriccancer.clinicachimicaacta,437:183-186.yeh,y.c.,sheu,b.s.,cheng,h.c.,wang,y.l.,yang,h.b.,andwu,j.j.(2010).elevatedserummatrixmetalloproteinase-3and-7inh.pylori-relatedgastriccancercanbebiomarkerscorrelatingwithapoorsurvival.digestivediseasesandsciences,55.6:1649-1657.zhu,h.andsnyder,m.(2003).proteinchiptechnology.currentopinioninchemicalbiology.7:55-63.所有引用文献均在此通过引用并入。已经针对一个或多个实施方式描述了本发明。然而,对于本领域技术人员显而易见的是,在不脱离权利要求所限定的本发明的范围的情况下,可以进行许多变化和修改。当前第1页12当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。