亚胺还原酶突变体及其在合成(r)-2-(2,5-二氟苯基)吡咯烷中的应用
[技术领域]
[0001]
本发明涉及医药化工领域,具体涉及一种亚胺还原酶突变体,以及这种亚胺还原酶突变体的应用,还涉及这种亚胺还原酶突变体与葡萄糖脱氢酶的共表达酶以及这种共表达酶的应用。
[
背景技术:
]
[0002]
拉罗替尼(larotrectinib),商品名是美国bayer开发的抗肿瘤药物,用于成人和小儿具有神经营养受体酪氨酸激酶(ntrk)基因融合的实体瘤治疗,于2018年11月26日经fda批准在美国上市。其特点在于:
①
不限癌种,只要存在ntrk融合,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等17种癌症类型,同时对成人和儿童都是可以使用的;
②
总缓解率高,在trk融合癌患者的三项大型临床试验汇总数据显示,拉罗替尼的总缓解率orr为75%,其中22%的患者完全缓解;
③
快速持久的响应,这款药物的神奇之处在于,起效非常快,并且一旦有效,带来的缓解往往是出乎意料的。数据显示,平均的起效时间仅为1.84个月,73%的患者响应的持续时间超过6个月。
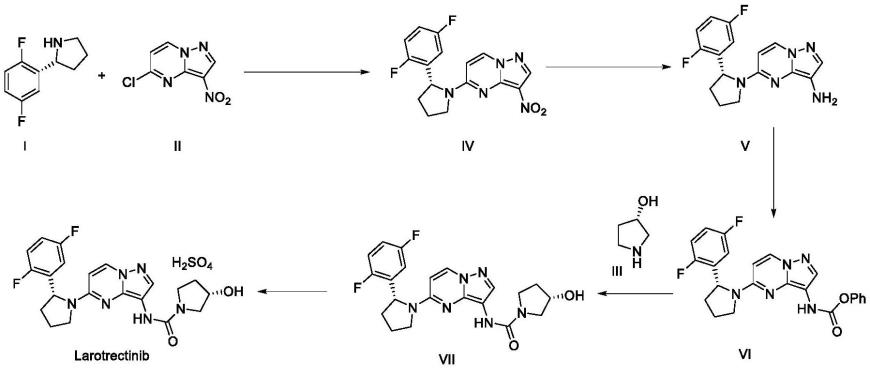
[0003]
拉罗替尼的合成线路如式1所示,其合成需要用到三个关键中间体,即化合物ⅰ、化合物ⅱ、化合物ⅲ。
[0004][0005]
式1:拉罗替尼的合成线路
[0006]
合成拉罗替尼的中间体中,化合物ⅰ的制备难度较大也尤为重要,从文献报道看,化合物ⅰ的合成方法主要有手性诱导法、手性辅助试剂法、手性拆分等方法。
[0007]
在专利cn111057729、cn109593803、cn109593802、cn110283858都使用了亚胺还原酶制备化合物i,其中cn110283858仅能制备出s构型,cn109593803、cn109593802公开了使用亚胺还原酶突变体制备r构型,但是没有公开ee值,cn111057729公开了野生型的亚胺还原酶制备r构型化合物i,虽然转化率>99%,但载量仅为50g/l,且用酶量超过底物量20%不利于后处理,最终产物的ee值97.6%也未达到99%以上。
[0008]
针对现有技术的不足,需要一种新的亚胺还原酶制备高ee值的r构型化合物i。
[
技术实现要素:
]
[0009]
本发明提供一种亚胺还原酶突变体,催化化合物ix为化合物i,提高了转化率,并取得高的ee值,本发明还提供亚胺还原酶突变体与葡萄糖脱氢酶的共表达酶,降低了制备化合物i的成本。
[0010]
为了达到发明目的,本发明的技术方案如下:
[0011]
亚胺还原酶突变体,与氨基酸序列seq id no:1相比,存在残基差异包括a92、d112、q189、q137、y220、v248、m253、f295中的一个或多个。
[0012]
进一步,残基差异包括a92w、d112v\s、q189m、q137r\a、y220q、v248n、m253a\s、f295w中的一个或多个。
[0013]
进一步,残基差异还包括s227q、g252c中的一个或多个。
[0014]
进一步,残基差异还包括p179c、i222c\n中的一个或多个。
[0015]
进一步,氨基酸序列选自seq id no:3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97或99。
[0016]
一种制备(r)-2-(2,5-二氟苯基)吡咯烷酮的方法,使用本发明的亚胺还原酶突变体催化底物ix为化合物i
[0017][0018]
进一步,将化合物ix、辅酶、葡萄糖、葡萄糖脱氢酶、亚胺还原酶突变体混合进行反应得到化合物i;
[0019]
进一步,所述辅酶为nadp;
[0020]
进一步,所述化合物ix与亚胺还原酶突变体的质量比为1~10:1;
[0021]
进一步,所述辅酶与亚胺还原酶突变体的质量比为0.01~0.1:1;
[0022]
进一步,所述葡萄糖与亚胺还原酶突变体的质量比为2~20:1;
[0023]
进一步,所述葡萄糖脱氢酶与亚胺还原酶突变体的质量比为0.1~0.5:1;
[0024]
进一步,反应条件为磷酸盐调节ph6~7,反应温度为20~30℃,搅拌速度为250~350。
[0025]
一种核酸,编码权利本发明的亚胺还原酶突变体。
[0026]
一种表达载体,包括本发明公开的亚胺还原酶突变体的核酸。
[0027]
一种细胞,包括本发明公开的亚胺还原酶突变体的核酸或载体。
[0028]
一种生产亚胺还原酶突变体的方法,培养包括本发明公开的细胞得到所述的亚胺还原酶突变体。
[0029]
进一步,本发明公开的亚胺还原酶突变体和葡萄糖脱氢酶共表达。
[0030]
进一步,用同时含有亚胺还原酶突变体与葡萄糖脱氢酶基因的细胞生产共表达酶。
[0031]
进一步,共表达酶的制备,通过带有限制性内切酶位点的引物将葡萄糖脱氢酶基
因从pet30a-gdh载体上扩增下来。分别用限制性内切酶bamhi和xhoi对带有权利要求1-5所述的亚胺还原酶突变体基因片段的pet30a-ired载体和扩增获得的带有rbs位点的葡萄糖脱氢酶基因片段进行双酶切,胶回收酶切片段,并用t4 dna连接酶连接后转化大肠杆菌bl21(de3)感受态细胞,获得同时含有亚胺还原酶基因和葡萄糖脱氢酶基因的重组菌。
[0032]
进一步,生产方法制备得到的亚胺还原酶突变体或者亚胺还原酶突变体与葡萄糖脱氢酶的共表达酶。
[0033]
使用共表达酶催化底物ix为化合物i
[0034][0035]
进一步,将化合物ix、辅酶、葡萄糖、共表达酶混合进行反应得到化合物i;
[0036]
进一步,所述辅酶为nadp;
[0037]
进一步,所述化合物ix与共表达酶的质量比为10:1;
[0038]
进一步,所述辅酶与共表达酶的质量比为1:10;
[0039]
进一步,所述葡萄糖与共表达酶的质量比为20:1;
[0040]
进一步,反应条件为磷酸盐调节ph6~7,反应温度为20~30℃,搅拌速度为250~350。
[0041]
相对于现有技术,本发明取得的有益效果:
[0042]
1、使用本发明亚胺还原酶突变体催化制备化合物i(r)-2-(2,5-二氟苯基)吡咯烷,转化率为99.9%,ee值为100%,底物载量为150g/l。
[0043]
2、本发明的亚胺还原酶突变体和葡萄糖脱氢酶共表达酶,在同一个工程菌中表达,在使用亚胺还原酶制备化合物i实现辅酶循环再生,减少再次制备葡萄糖脱氢酶的步骤,降低成本。
[附图说明]
[0044]
图1为化合物i(r)-2-(2,5-二氟苯基)吡咯烷的合成路线图;
[0045]
图2为化合物i(r)-2-(2,5-二氟苯基)吡咯烷标准品的反相非手性hplc图谱;
[0046]
图3为化合物ix底物5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯标准品的反相非手性hplc图谱;
[0047]
图4为实施例5反应中控的反相非手性hplc图谱(seq id no:1样品);
[0048]
图5为化合物i(r,s)-2-(2,5-二氟苯基)吡咯烷的正相手性hplc图谱;
[0049]
图6为化合物i(r)-2-(2,5-二氟苯基)吡咯烷标准品的正相手性hplc图谱;
[0050]
图7为实施例5合成的化合物i(r)-2-(2,5-二氟苯基)吡咯烷的正相手性hplc图谱(seq id no:1样品);
[0051]
图8为亚胺还原酶和葡萄糖脱氢酶共表达质粒图谱。
[0052]
图9为亚胺还原酶的三维结构模拟图及突变位点。
[具体实施例]
[0053]
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
[0054]
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
[0055]
实施例1亚胺还原酶的表达及酶粉制备
[0056]
(1)将来源于乳类芽孢杆菌(paenibacillus lactis)的野生型亚胺还原酶的编码基因seq id no:1送至南京金斯瑞公司进行密码子优化和全基因合成,连接入质粒pet-30a( )中;将重组质粒转入大肠杆菌bl21(de3)中,将菌液涂布于含50μg/ml卡那霉素的lb琼脂平板上,置于37℃下培养过夜;挑取转化子进行测序验证,将验证正确的转化子命名为e.coli bl21/pet30a-no.1。
[0057]
(2)将上述重组菌e.coli bl21/pet30a-no.1接种于5ml含有50μg/ml卡那霉素的lb液体培养基中,置于37℃下培养过夜;取1ml菌液接种于100ml含有50μg/ml卡那霉素的lb液体培养基中,置于37℃下培养3h,然后加入50μl 1m iptg,25℃下诱导16小时;离心(4000rpm,4℃,10min)收集菌体,加入4倍体积的pbs缓冲液(ph=7.0)重悬,重悬后对细胞进行超声破碎,再将溶液进行冷冻干燥,获得亚胺还原酶酶粉,野生型亚胺还原酶的氨基酸序列如seq id no:1所示。
[0058]
实施例2亚胺还原酶突变体文库的构建
[0059]
将亚胺还原酶的氨基酸序列在discovery studio模拟软件上进行蛋白质的三维结构建模,然后通过docking进行底物与蛋白质的结合模拟,最后通过discovery studio软件分析结合位点及相互作用力,选择有可能与底物和nadp结合相关、与nadp质子传递相关的氨基酸作为突变氨基酸。
[0060]
根据突变氨基酸及其两侧的碱基序列(突变氨基酸请见表1中的突变位点),设计相应的突变引物(表1)。以含亚胺还原酶基因的pet30a( )表达载体为模版,通过全质粒pcr获得完整的线性片段,将上述pcr产物经dpnⅰ消化除去母本模版后,转化到大肠杆菌bl21(de3)中,涂布于含有50μg/ml卡那霉素的lb固体培养基中,37℃培养过夜,即获得单点饱和突变文库。
[0061]
表1点饱和突变引物序列
[0062]
[0063]
[0064]
[0065]
[0066][0067]
突变文库经过筛选后,将获得的有益单点突变进行组合,构建组合突变库并筛选。
[0068]
实施例3亚胺还原酶突变体的初筛
[0069]
(1)挑取文库中的菌落至96孔微量培养板上,培养板的每孔含有150μllb液体培养基和50μg/ml卡那霉素,将菌体置于37℃、220rpm摇床中培养过夜;将20μl菌液转接至含有380μl lb液体培养基和50μg/ml卡那霉素的96孔板中,继续在37℃、220rpm的摇床中培养2~3h,添加iptg至终浓度为0.4mm进行诱导,然后降温至25℃培养过夜(至少16小时)。
[0070]
(2)将96孔板离心(10min,4000rpm,25℃)收集菌体,用200μl裂解液(含1g/l溶菌酶和0.5g/l硫酸多粘菌素b)重悬菌体,于25℃、600rpm下振荡2h进行裂解,裂解后的细胞碎片通过离心(4000rpm,4℃,10min)进行沉淀,获得上清液即粗酶液,用于酶标仪进行活性初筛。
[0071]
(3)反应混合液的配制:取1ml 5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯溶液,1.5ml dmso,0.25ml nadph溶液(20mm),12.75ml磷酸盐缓冲液(ph6.50.1m)置于加样槽中,混匀即得反应混合液。用液体工作站进行液体分装,取酶标板每孔分装150μl反应混合液,然后加入上述粗酶液50μl,并立即于25℃检测340nm处吸光光度值的变化。
[0072]
酶活性定义:单位时间内生成1μmol产物所需要的酶的用量为一个酶活单位。
[0073]
酶液活性
[0074]
其中:
[0075]
δa340:吸光值变化值;
[0076]
v0:反应总体积;
[0077]
n:酶液稀释倍数;
[0078]
t:反应时间;
[0079]
v1:加酶量;
[0080]
6.22为nadph斜率常数
[0081]
实施例4亚胺还原酶突变体的复筛
[0082]
(1)将实施例3中酶活性高于母本的突变体接种于100ml含50μg/ml卡那霉素的lb液体培养基中,37℃振荡培养至od600=0.6时,加入iptg至终浓度为0.5mm,在25℃下进行诱导表达。诱导16h后,离心(10min,4000rpm,25℃)收集菌体。菌体用超声破碎仪(jy92-2d,宁波新芝生物科技股份有限公司)破碎细胞,离心(4℃,10000rpm,20min)获得上清液,部分用于活性检测,剩余上清液进行冷冻干燥,制备酶粉。
[0083]
(2)取5ml离心管,加入50mg底物5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯,0.2ml dmso,再加入1.8ml磷酸盐缓冲液(ph6.5 0.1m)。再向反应瓶中加入0.5mg nadp和90mg葡萄糖,搅拌至完全溶解,再向其中分别加入葡萄糖脱氢酶5mg和待筛选粗酶液0.2ml,混匀并升温至25℃,以300r/min搅拌反应24h。反应结束后,分别取反应液100μl加入到900μl乙腈中充分振荡,使用0.22μm过滤膜过滤,进行hplc分析。
[0084]
选取催化活性优于母本的突变体进行测序,分析突变位点,获得亚胺还原酶突变体的编码基因seq id no:4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98或100,相应的亚胺还原酶突变体的氨基酸序列分别如seq id no:3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97或99所示。
[0085]
不同亚胺还原酶突变体的活性检测结果见表2。
[0086]
表2亚胺还原酶突变体的突变位点与活性检测
[0087]
[0088]
[0089]
[0090][0091]
注: 表示酶活性是seq id no:1的1.2至2.5倍; 表示酶活性是seq id no:1的3至5倍; 表示酶活性是seq id no:1的6至10倍; 表示酶活性是seq id no:1的11至20倍;
[0092]
实施例5表2中标为“ ”的亚胺还原酶突变体在制备(r)-2-(2,5-二氟苯基)吡咯烷中的应用
[0093]
取10ml反应瓶,加入250mg底物5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯,加入0.5ml dmso,加入4ml磷酸盐缓冲液(ph6.5 0.1m),调节ph至6.5。再向反应瓶中加入2.5mg nadp和500mg葡萄糖,搅拌至完全溶解,再向其中分别加入25mg葡萄糖脱氢酶和250mg亚胺还原酶突变体酶粉,混匀并升温至25℃,以300r/min搅拌反应24h。反应结束后,分别取反应液100μl加入到900μl乙腈中充分振荡,使用0.22μm过滤膜过滤,进行hplc分析。取反应液500μl,调ph11以上,加1000μl正己烷萃取,取正己烷层过膜后供正相hplc分析手性。seq id no:1转化率图谱见图4,seq id no:1手性检测图谱见图7,seq id no:23手性检测图谱见图8.
[0094]
seq id no:1及活性最高的三个突变体转化率及手性结果如表3所示。
[0095]
表3
[0096]
酶转化率%ee%seq id no:130.699.2seq id no:1156.999.4seq id no:1761.199.6seq id no:2368.399.9
[0097]
实施例6表2中标为“ ”的亚胺还原酶突变体在制备(r)-2-(2,5-二氟苯基)吡咯烷中的应用
[0098]
取10ml反应瓶,加入500mg底物5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯,加入0.5ml dmso,加入4ml磷酸盐缓冲液(ph6.5 0.1m),调节ph至6.5。再向反应瓶中加入5mg nadp和1000mg葡萄糖,搅拌至完全溶解,再向其中分别加入25mg葡萄糖脱氢酶和250mg亚胺还原酶突变体酶粉,混匀并升温至25℃,以300r/min搅拌反应24h。反应结束后,分别取反应液100μl加入到900μl乙腈中充分振荡,使用0.22μm过滤膜过滤,进行hplc分析。取反应液500μl,调ph11以上,加1000μl正己烷萃取,取正己烷层过膜后供正相hplc分析手性。
[0099]
seq id no:1及活性最高的三个突变体转化率及手性结果如表4所示。
[0100]
表4
[0101][0102][0103]
实施例7表2中标为“ ”的亚胺还原酶突变体在制备(r)-2-(2,5-二氟苯基)吡咯烷中的应用
[0104]
取10ml反应瓶,加入500mg底物5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯,加入0.5ml dmso,加入4ml磷酸盐缓冲液(ph6.5 0.1m),调节ph至6.5。再向反应瓶中加入5mg nadp和1000mg葡萄糖,搅拌至完全溶解,再向其中分别加入25mg葡萄糖脱氢酶和100mg亚胺还原酶突变体酶粉,混匀并升温至25℃,以300r/min搅拌反应24h。反应结束后,分别取反应液100μl加入到900μl乙腈中充分振荡,使用0.22μm过滤膜过滤,进行hplc分析。取反应液500μl,调ph11以上,加1000μl正己烷萃取,取正己烷层过膜后供正相hplc分析手性。
[0105]
seq id no:37及活性最高的三个突变体转化率及手性结果如表5所示。
[0106]
表5
[0107]
酶转化率%ee%seq id no:3730.999.6seq id no:4778.999.6seq id no:5181.899.7seq id no:5785.599.7
[0108]
实施例8表2中标为“ ”的亚胺还原酶突变体在制备(r)-2-(2,5-二氟苯基)吡咯烷中的应用
[0109]
取10ml反应瓶,加入500mg底物5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯,加入0.5ml dmso,加入4ml磷酸盐缓冲液(ph6.5 0.1m),调节ph至6.5。再向反应瓶中加入5mg nadp和1000mg葡萄糖,搅拌至完全溶解,再向其中分别加入25mg葡萄糖脱氢酶和50mg亚胺还原酶突变体酶粉,混匀并升温至25℃,以300r/min搅拌反应16h。反应结束后,分别取反应液100μl加入到900μl乙腈中充分振荡,使用0.22μm过滤膜过滤,进行hplc分析。取反应液500μl,调ph11以上,加1000μl正己烷萃取,取正己烷层过膜后供正相hplc分析手性。
[0110]
seq id no:37及活性最高的三个突变体转化率及手性结果如表6所示。
[0111]
表6
[0112]
酶转化率%ee%seq id no:3716.899.7seq id no:8199.3100
seq id no:8799.599.7seq id no:9399.999.6
[0113]
实施例9亚胺还原酶与葡萄糖脱氢酶的共表达酶粉制备
[0114]
通过带有限制性内切酶位点的引物(见下表)将葡萄糖脱氢酶基因从pet30a-gdh载体上扩增下来。分别用限制性内切酶bamhi和xhoi对带有亚胺还原酶基因片段的pet30a-ired载体和扩增获得的带有rbs位点的葡萄糖脱氢酶基因片段进行双酶切。胶回收酶切片段,并用t4 dna连接酶连接后转化大肠杆菌bl21(de3)感受态细胞,获得同时含有亚胺还原酶基因和葡萄糖脱氢酶基因的重组菌(共表达酶基因序列见seq id no:143,共表达质粒示意图见图9)。
[0115]
表葡萄糖脱氢酶扩增引物
[0116][0117][0118]
将上述重组菌接种于5ml含有50μg/ml卡那霉素的lb液体培养基中,置于37℃下培养过夜;取1ml菌液接种于100ml含有50μg/ml卡那霉素的lb液体培养基中,置于37℃下培养3h,然后加入50μl 1m iptg,25℃下诱导16小时;离心(4000rpm,4℃,10min)收集菌体,加入4倍体积的pbs缓冲液(ph=7.0)重悬,重悬后对细胞进行超声破碎,再将溶液进行冷冻干燥,获得亚胺还原酶和葡萄糖脱氢酶共表达酶粉。
[0119]
实施例10亚胺还原酶与葡萄糖脱氢酶的共表达酶粉在(r)-2-(2,5-二氟苯基)吡咯烷制备中的应用
[0120]
取10ml反应瓶,加入500mg底物5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯,加入0.5ml dmso,加入4ml磷酸盐缓冲液(ph6.5 0.1m),调节ph至6.5。再向反应瓶中加入5mg nadp和1000mg葡萄糖,搅拌至完全溶解,再向其中加入50mg共表达酶粉(此处亚胺还原酶为seq id no:81所示突变酶),混匀并升温至25℃,以300r/min搅拌反应16h。反应结束后,分别取反应液100μl加入到900μl乙腈中充分振荡,使用0.22μm过滤膜过滤,进行hplc分析。取反应液500μl,调ph11以上,加1000μl正己烷萃取,取正己烷层过膜后供正相hplc分析手性。转化率99.6%,ee值99.8%。
[0121]
实施例11亚胺还原酶与葡萄糖脱氢酶的共表达酶粉在(r)-2-(2,5-二氟苯基)吡咯烷制备中的应用
[0122]
取500ml反应瓶,加入30g底物5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯,加入20ml dmso,加入150ml磷酸盐缓冲液(ph6.5 0.1m),调节ph至6.5。再向反应瓶中加入300mg nadp和60g葡萄糖,搅拌至完全溶解,再向其中加入3g共表达酶粉(此处亚胺还原酶为seq id no:81所示突变酶),混匀并升温至25℃,以300r/min搅拌反应,取反应液100μl加入到900μl乙腈中充分振荡,使用0.22μm过滤膜过滤,进行hplc分析。反应16h,转化率99.6%,停止反应,取反应液500μl,调ph11以上,加1000μl正己烷萃取,取正己烷层过膜后供正相hplc分析手性,ee值99.9%。
[0123]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
