1.本发明涉及高通量测序技术领域,具体而言,涉及一种融合蛋白、其相关核酸分子以及其在高通量测序中的应用。
背景技术:
2.荧光素酶(luciferase)是生物体内能够产生生物发光的酶的总称。由于其自发光效应而被广泛应用作为报告基因。在检测等方面的应用也越来越广泛。荧光素酶的种类包括:细菌荧光素酶(bacterial luciferase,bluc)、萤火虫荧光素酶(firefly luciferase,fluc)、海肾荧光素酶(renilla luciferase,rluc)和高斯荧光素酶(gaussia luciferase,gluc)。
[0003]“边合成边测序技术”(sbs)是目前世界范围内广泛使用的新一代测序技术,它是通过在dntp上引入可逆阻断基团以及可切割的荧光标记,来实现dntp掺入时的荧光信号的采集的。最常见的sbs测序方法是:将模板和测序引物固定在固体支撑物上,并将该支撑物暴露于四种含有可逆阻断基团和可切割荧光标记的dntp类似物中。退火时,在dna聚合酶的作用下,只有正确的互补碱基可以掺入3’末端,洗掉未掺入的核苷酸并将固体支撑物成像即完成了一个碱基的测序。接着在体系中加入切除试剂以裂解接头释放荧光团,并去除3’端阻断基团,从而使3
’‑
o h再生。而后可以重复该循环。每一种碱基使用不同的荧光颜色进行标记,使得在每个测序循环中,可以通过其颜色鉴定掺入的dntp类似物,判断被测序的碱基。然而,目前的sbs方法需要昂贵的可逆终止的dntp,且这种将荧光标记修饰在dntp上的测序方法,相比未带荧光标记的dntp而言,在一定程度上对dna聚合酶的聚合效率影响更大。另外,由于这种荧光标记在前一轮pcr信号采集完成后需要切掉,以便引入下一个dntp,由于切割荧光标记后的dna链上会留有“疤痕”(即残留的修饰),一方面影响后续dna聚合酶的识别和结合效率,另一方面还可能对后一个dntp所携带的荧光产生干扰,甚至导致荧光淬灭。
[0004]
为此,华大智造开发出一种新的基于抗体识别碱基的抗体测序技术。抗体测序技术是利用抗体识别未进行染料标记的脱氧核糖核苷酸进而完成测序的技术。其具体原理如图1所示,通过脱氧核糖核苷酸抗体识别待测序碱基,抗体上标有不同荧光染料进而可以识别不同碱基。在测序过程中,可逆阻断的dntp(简称cold-dntp)首先被聚合到与待测dna分子反向互补的分子锚上,带有不同荧光标记的抗体分别与cold-dntp特异结合。通过信号采集和脱氧核糖核苷酸识别算法获得待测dna分子的脱氧核糖核苷酸序列信息。
[0005]
但是,抗体测序技术需要开发4种荧光染料,且4种荧光染料需要修饰到抗体上。同时由于使用荧光染料,后续测序仪必需用到贵重的光学仪器,因而在一定程度上限制了其在测序方面的广泛应用。因此,仍需要对现有技术中的高通量测序技术进行改进。
技术实现要素:
[0006]
本发明的主要目的在于提供一种融合蛋白、其相关核酸分子以及其在高通量测序
中的应用,为研究和开发新的测序技术提供基础。
[0007]
为了实现上述目的,根据本发明的一个方面,提供了一种融合蛋白,该融合蛋白包括脱氧核糖核苷酸抗体以及与脱氧核糖核苷酸抗体融合表达的荧光素酶,融合蛋白能够与脱氧核糖核苷酸抗体对应的脱氧核糖核苷酸结合,且在催化荧光素酶底物后发光。
[0008]
进一步地,脱氧核糖核苷酸抗体选自datp、dttp、dctp及dgtp中任意一种脱氧核糖核苷酸的抗体;优选地,荧光素酶选自细菌荧光素酶、萤火虫荧光素酶、海萤荧光素酶、海肾荧光素酶、高斯荧光素酶、nanoluc萤光素酶和刺虾荧光素酶中的任意一种;优选地,脱氧核糖核苷酸抗体采用igg、fab、scfv、及vhh中的任意一种抗体的结构。
[0009]
进一步地,脱氧核糖核苷酸抗体包括轻链和重链,并且重链与荧光素酶融合表达;优选地,重链与荧光素酶之间通过柔性肽连接;优选地,柔性肽为(ggggs)n或a(eaaak)na,n选自1、2、3或4;优选地,重链与荧光素酶之间通过柔性肽连接形成h-luc重组重链,其中,h-luc重组重链选自seq id no:1、seq id no:3、seq id no:5或seq id no:7;优选地,融合蛋白为anti-a-luc融合蛋白、anti-t-luc融合蛋白、anti-c-luc融合蛋白或anti-g-luc融合蛋白,其中,anti-a-luc融合蛋白的h-luc重组重链的氨基酸序列为seq id no:1,轻链的氨基酸序列为seq id no:2;anti-t-luc融合蛋白的h-luc重组重链的氨基酸序列为seq id no:3,轻链的氨基酸序列为seq id no:4;anti-c-luc融合蛋白的h-luc重组重链的氨基酸序列为seq id no:5,轻链的氨基酸序列为seq id no:6;anti-g-luc融合蛋白的h-luc重组重链的氨基酸序列为seq id no:7,轻链的氨基酸序列为seq id no:8。
[0010]
为了实现上述目的,根据本发明的第二个方面,提供了编码上述任一种融合蛋白的融合片段的核酸分子,融合片段为脱氧核糖核苷酸抗体与荧光素酶融合表达的片段。
[0011]
进一步地,融合片段为脱氧核糖核苷酸抗体的重链与荧光素酶融合而成的h-luc重组重链,其中,编码h-luc重组重链的核酸分子的核酸序列选自seq id no:9、seq id no:11、seq id no:13或seq id no:15;优选地,编码融合蛋白的核酸分子还包括编码脱氧核糖核苷酸抗体的轻链的核酸分子,其中,当编码h-luc重组重链的核酸分子的核酸序列为seq id no:9时,编码轻链的核酸分子的核酸序列为seq id no:10;当编码h-luc重组重链的核酸分子的核酸序列为seq id no:11时,编码轻链的核酸分子的核酸序列为seq id no:12;当编码h-luc重组重链的核酸分子的核酸序列为seq id no:13时,编码轻链的核酸分子的核酸序列为seq id no:14;当编码h-luc重组重链的核酸分子的核酸序列为seq id no:15时,编码轻链的核酸分子的核酸序列为seq id no:16。
[0012]
根据本技术的第三个方面,提供了一种重组载体,重组载体上连接有上述任一种核酸分子。
[0013]
根据本技术的第四个方面,提供了一种宿主细胞,该宿主细胞中转染有上述任一种重组载体。
[0014]
根据本技术的第五个方面,提供了一种高通量测序方法,该高通量测序方法包括:将带有可逆阻断基团的脱氧核糖核苷酸加入到待测序的核酸分子上,再加入上述任一种融合蛋白,通过检测融合蛋白自发光所产生的信号来确定掺入的脱氧核糖核苷酸的类型,从而确定待测序的核酸分子的序列。
[0015]
进一步地,通过检测在每一轮反应中掺入带有可逆阻断基团的脱氧核糖核苷酸时,融合蛋白自发光所产生的信号,来获得待测序的核酸分子的碱基序列;其中,每一轮反
应的反应体系包括带有可逆阻断基团的脱氧核糖核苷酸、待测序的核酸分子、dna聚合酶、融合蛋白以及融合蛋白的荧光素酶活性相对应的底物荧光素,且每一轮反应掺入的带有可逆阻断基团的脱氧核糖核苷酸为可逆阻断datp、可逆阻断dttp、可逆阻断dctp及可逆阻断dgtp中的一种;优选地,荧光素选自萤火虫荧光素、海萤荧光素、腔肠素、氟代腔肠素和腔肠素类似物中的任意一种;优选地,通过自发光测序平台检测融合蛋白自发光所产生的信号,更优选自发光测序平台包括dnbseq-e5测序仪。
[0016]
根据本技术的第六个方面,提供了上述任一种融合蛋白在高通量测序中的应用。
[0017]
应用本发明的技术方案,提供了一种脱氧核糖核苷酸抗体与荧光素酶的融合蛋白,该融合蛋白兼具两种活性,一方面能够识别阻断的脱氧核氧核苷酸上的碱基,直接靶向测序碱基,另一方面能够催化荧光素酶底物自发光。因而应用于测序时,不需要化学修饰制备试剂原料,同时拥有自发光测序平台仪器简单、无需荧光光源等优势,为开发新型测序技术提供了新的思路和基础。
附图说明
[0018]
构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
[0019]
图1示出了现有技术中基于脱氧核糖核苷酸抗体测序的原理示意图;
[0020]
图2示出了本技术优选实施例中融合蛋白的结构示意图;
[0021]
图3a至图3c示出了本技术优选实施例中融合蛋白的表达载体构建过程示意图;
[0022]
图4示出了本技术优选实施例中表达的融合蛋白的sds-page检测图;
[0023]
图5示出了本技术优选实施例中所构建表达的融合蛋白的抗体部分elisa检测图;
[0024]
图6示出了本技术优选实施例中所构建表达的融合蛋白生物发光检测实验结果;
[0025]
图7示出了本技术优选实施例中所构建表达的融合蛋白双功能活性检测图;
[0026]
图8示出了本技术优选实施例中所构建表达的融合蛋白在自发光测序仪上活性检测图;
[0027]
图9示出了本技术另一种优选实施例中融合蛋白的结构示意图。
具体实施方式
[0028]
需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
[0029]
术语解释:
[0030]
柔性肽:也可以叫做接头序列(linker),本技术中指通过适当的核苷酸序列将不同的目的基因连接起来,使其在适当的生物体内表达为一条单一的肽链,其中,起到连接作用的氨基酸序列即被称为柔性肽。
[0031]
vhh:variable domain of heavy chain of heavy chain antibody,只有重链可变区组成的单域抗体,也称为纳米抗体(nanobody,a single domain antibody),是最小的功能性抗原结合片段,具有分子量小、结构简单、易于进行基因改造、稳定性好、可溶性强、抗原结合性能好以及体积小、免疫原性低、组织穿透力强等特点。
[0032]
如背景技术所提到的,现有的大多高通量测序技术都基于识别碱基,使得特定的
荧光基团或荧光染料在特定波长的激光激发下产生特定的荧光信号来确定碱基顺序,这不仅需要测序仪器配备贵重的光学仪器来实现荧光信号的产生和采集,而且需要复杂的化学修饰工艺来制备相应的试剂。为改善这一现状,本技术开发出一种融合蛋白,并且基于该融合蛋白改进了测序方案。该融合蛋白是一种脱氧核糖核苷酸抗体与荧光素酶融合蛋白,该融合蛋白使得抗体测序技术的优势得以在自发光测序平台上使用。本技术开发出的融合蛋白一方面能够识别阻断的脱氧核氧核苷酸上的碱基,直接靶向测序碱基,另一方面能够催化荧光素酶底物自发光。因而应用于测序时,不需要化学修饰制备试剂原料,同时拥有自发光测序平台仪器简单,无需荧光光源等优势,为开发新型测序技术提供了新的思路和基础。
[0033]
基于上述研究结果,申请人提出了本技术的技术方案。在一种典型的实施方式中,提供了一种融合蛋白,该融合蛋白包括脱氧核糖核苷酸抗体以及与脱氧核糖核苷酸抗体融合表达的荧光素酶,融合蛋白能够与脱氧核糖核苷酸抗体对应的脱氧核糖核苷酸结合,且在催化荧光素酶底物后发光。
[0034]
本发明提供的融合蛋白同时保留了两部分蛋白的活性,一方面能够特异性地与dntp结合,另一方面能够发挥荧光素酶催化底物后发光的优势,有助于降低测序平台对荧光光源及昂贵光学采集设备的依赖,可应用于临床检测或相关科学研究。
[0035]
上述脱氧核糖核苷酸抗体选自datp、dttp、dctp及dgtp中任意一种脱氧核糖核苷酸的抗体。优选地,荧光素酶选自细菌荧光素酶、萤火虫荧光素酶、海萤荧光素酶、海肾荧光素酶、高斯荧光素酶(gaussia luciferase,一种20kd的蛋白,来源于海洋桡足类生物长腹水蚤,可通过催化腔肠素氧化发光)、nanoluc荧光素酶和刺虾荧光素酶(即刺虾来源的荧光素酶)中的任意一种。
[0036]
上述脱氧核糖核苷酸抗体的结构可以采用现有抗体结构中的任意一种,优选采用igg、fab、scfv、vhh中的任意一种抗体的结构,本技术中优选实施例中,采用图2所示的抗体结构。为进一步提高荧光素酶的自发光性能,也可以在图2所示基础上增加所融合的荧光素酶的数量,比如如图9所示的抗体结构。
[0037]
通常,融合蛋白的构建需要满足融合分子间以富含疏水性氨基酸的接头序列连接。相应地,上述融合蛋白中脱氧核糖核苷酸抗体与荧光素酶之间也通过接头序列连接,使两部分活性分子之间保持足够的空间距离以使得融合的两部分活性分子的生物学活性能够正常发挥。能够起到此类作用的接头序列可以是螺旋状的连接肽[a(eaaak)na](能够增加蛋白结构域之间的距离)和低疏水性、低电荷的氨基酸组成的柔性肽。
[0038]
采用低疏水性、低电荷小的氨基酸组成的多肽接头具有较大的柔性,能够充分伸展以分开两种融合的组合分子,使之能在互不干扰的情况下充分折叠成各自的天然构象。最常用的是(ggggs)n,n≥2。
[0039]
柔性肽的长度若过长,容易使融合蛋白对蛋白酶比较敏感,导致活性融合蛋白在生产过程中的产量下降。若过短,能避免融合蛋白被分解,但两个融合分子相距太近,不利于蛋白功能的发挥。通常连接肽至少应包含10个氨基酸。目前最为常用的是huston设计合成的(ggggs)3序列。
[0040]
在本技术一些优选的实施例中,融合蛋白中脱氧核糖核苷酸抗体与荧光素酶之间通过柔性肽连接,优选地,柔性肽为(ggggs)n或a(eaaak)na,n选自1、2、3或4;具体柔性链的类型和长度可以根据实际效果进行合理选择确定。更优选地,柔性肽为(ggggs)2。n选自2时
柔性肽序列为ggggsggggs(seq id no:17)或aeaaakeaaaka(seq id no:20);n选自3时柔性肽序列为ggggsggggsggggs(seq id no:18)或aeaaakeaaakeaaaka(seq id no:21);n选自4时柔性肽序列为ggggsggggsggggsggggs(seq id no:19)或aeaaakeaaakeaaakeaaaka(seq id no:22)。
[0041]
脱氧核糖核苷酸抗体的结构包括重链和轻链,荧光素酶融合时,根据需要可以与轻链融合,也可以与重链融合,具体与轻链或重链融合的位置,可以根据需要合理选择。本技术优选的实施例中,荧光素酶通过与重链融合形成的上述融合蛋白。优选地,荧光素酶在重链的c端融合。即通过上述柔性链与重链的c末端连接。
[0042]
在本技术中,将重链与荧光素酶之间通过柔性肽连接形成的片段记作h-luc重组重链,根据脱氧核糖核苷酸抗体种类的不同,该h-luc重组重链的序列也不同。优选地,h-luc重组重链选自seq id no:1(即为datp抗体的重组重链序列)、seq id no:3(即为dttp抗体的重组重链序列)、seq id no:5(即为dctp抗体的重组重链序列)或seq id no:7(即为dgtp抗体的重组重链序列)。
[0043]
将四种脱氧核糖核苷酸抗体的融合蛋白分别记作anti-a-luc融合蛋白、anti-t-luc融合蛋白、anti-c-luc融合蛋白或anti-g-luc融合蛋白,在一优选的实施例中,anti-a-luc融合蛋白的h-luc重组重链的氨基酸序列为seq id no:1,轻链的氨基酸序列为seq id no:2;anti-t-luc融合蛋白的h-luc重组重链的氨基酸序列为seq id no:3,轻链的氨基酸序列为seq id no:4;anti-c-luc融合蛋白的h-luc重组重链的氨基酸序列为seq id no:5,轻链的氨基酸序列为seq id no:6;anti-g-luc融合蛋白的h-luc重组重链的氨基酸序列为seq id no:7,轻链的氨基酸序列为seq id no:8。
[0044]
在本技术第二种典型的实施方式中,还提供了一种核酸分子,该核酸分子编码上述任一种融合蛋白的融合片段,融合片段为脱氧核糖核苷酸抗体与荧光素酶融合表达的片段。
[0045]
核酸分子的序列结构根据脱氧核糖核苷酸抗体与荧光素酶融合的具体方式的不同而有所不同。在本技术一种优选的实施例中,融合片段为脱氧核糖核苷酸抗体的重链与荧光素酶融合而成的上述h-luc重组重链,其中,编码h-luc重组重链的核酸分子的核酸序列选自seq id no:9(即为datp抗体的重组重链的重组dna序列)、seq id no:11(即为dttp抗体的重组重链的重组dna序列)、seq id no:13(即为dctp抗体的重组重链的重组dna序列)或seq id no:15(即为dgtp抗体的重组重链的重组dna序列)。
[0046]
上述融合蛋白是通过将编码抗体轻链和重组重链的基因置于同一细胞中表达后结合而成。即编码融合蛋白的核酸分子还包括编码轻链的核酸分子,分别选自seq id no:10、seq id no:12、seq id no:14或seq id no:16,其中seq id no:9编码的h-luc重组重链与seq id no:10编码的轻链结合形成上述anti-a-luc融合蛋白;seq id no:11编码的h-luc重组重链与seq id no:12编码的轻链结合形成上述anti-t-luc融合蛋白;seq id no:13编码的h-luc重组重链与seq id no:14编码的轻链结合形成上述anti-c-luc融合蛋白;seq id no:15编码的h-luc重组重链与seq id no:16编码的轻链结合形成上述anti-g-luc融合蛋白。
[0047]
在本技术第三种典型的实施方式中,提供了一种重组载体,该重组载体上连接有编码上述融合蛋白的融合片段的核酸分子。
[0048]
在本技术第四种典型的实施方式中,提供了一种宿主细胞,该宿主细胞中转染有上述重组载体。
[0049]
在上述基础上,本技术还提供了一种融合蛋白的纯化方法,该纯化方法包括但不局限于:离子交换层析(q柱、sp柱)、疏水层析、肝素柱层析或硫酸铵沉淀法。
[0050]
在本技术第五种典型的实施方式中,提供了一种高通量测序方法,该高通量测序方法包括:将带有可逆阻断基团的脱氧核糖核苷酸加入到待测序的核酸分子上,再加入上述任一种的融合蛋白,通过检测该融合蛋白自发光产生的信号来确定掺入的脱氧核糖核苷酸的类型,从而确定该待测序核酸分子的序列。
[0051]
在一种优选的实施例中,上述高通量测序的方法包括:通过检测在每一轮反应中掺入带有可逆阻断基团的脱氧核糖核苷酸时融合蛋白自发光所产生的信号,来获得待测序核酸分子的碱基序列;其中,每一轮反应的反应体系包括带有可逆阻断基团的脱氧核糖核苷酸、待测核酸分子、dna聚合酶、融合蛋白以及融合蛋白的荧光素酶活性相对应的底物荧光素,且每一轮反应掺入的带有可逆阻断基团的脱氧核糖核苷酸为可逆阻断datp、可逆阻断dttp、可逆阻断dctp及可逆阻断dgtp中的一种。
[0052]
本技术提供的上述融合蛋白是一种脱氧核糖核苷酸抗体与荧光素酶融合蛋白,该融合蛋白兼具两个分子的生物学活性,一方面能够通过脱氧核糖核苷酸抗体特异性识别阻断的脱氧核糖核苷酸,直接靶向测序碱基,另一方面能够催化荧光素酶底物自发光。因而应用于测序时,可以简化底物制备流程,无需荧光标记,同时拥有自发光测序平台仪器简单,无需荧光光源等优势。
[0053]
现有技术中基于抗体的测序原理是:每一种抗体特异性识别一种具有可逆阻断基团的脱氧核糖核苷酸,然后通过识别每一种抗体所携带的荧光标记的颜色来判断相应的碱基。
[0054]
在本技术改进的融合蛋白方案中,将常规抗体上的荧光标记改为荧光素酶,则上述改进的测序反应的原理为:若添加的一个dntp(如dctp),通过碱基互补配对原则,能够与待测核酸分子配对,则在聚合酶的作用下被添加到引物的3’末端,通过向反应体系中加入融合蛋白,融合蛋白中的抗体部分可以特异性的识别添加的脱氧核糖核苷酸(如dctp),向体系中通入对应底物时,融合蛋白中的荧光素酶可以催化底物发光,发光信号可被检测系统识别而完成测序的技术。
[0055]
在本技术中,荧光素可以根据对应的荧光素酶进行选择,在一种优选的实施例中,上述荧光素选自萤火虫荧光素、海萤荧光素、腔肠素、氟代腔肠素和腔肠素类似物中的任意一种。其中,萤火虫荧光素是萤火虫荧光素酶的底物,海萤荧光素是海萤荧光素酶的底物,腔肠素、氟代腔肠素和腔肠素类似物是海肾荧光素酶、高斯荧光素酶等的底物。
[0056]
在本技术中,融合蛋白中的荧光素酶催化底物发光的颜色理论上可以相同也可以不同。在一种实施方式中,每一轮反应仅加入一种融合蛋白及其对应的底物荧光素,因而,只需通过检测是否发光即可判断该轮反应加入的脱氧核糖核苷酸中碱基的类型是否与待测序核酸分子的模板序列匹配,进而可以判断相应位置的脱氧核糖核苷酸中碱基的类型,此种情形下,荧光素酶催化底物后发光的颜色无特殊要求,可以相同或不同。
[0057]
在另一种实施方式中,每一轮反应同时加入四种融合蛋白及其对应的四种底物荧光素,需要检测四种颜色不同的荧光来实现四种不同的脱氧核糖核苷酸类型的区分,此时
荧光素酶催化底物后发光的颜色互不相同。
[0058]
在又一种实施方式中,每一轮反应同时加入三种融合蛋白和一种未与荧光素酶融合的脱氧核糖核苷酸抗体,三种融合蛋白中的第一种融合蛋白含有第一种荧光素酶,第二种融合蛋白含有第二种荧光素酶,第三种融合蛋白同时含有第一种和第二种荧光素酶(结构如图9所示),因此,在通入第一种荧光素酶对应的底物时,检测到发光信号则是对应第一融合蛋白和第三融合蛋白结合的脱氧核糖核苷酸,在通入第二种荧光素酶对应的底物时,检测到发光信号则是对应第二融合蛋白和第三融合蛋白结合的脱氧核糖核苷酸,而两次检测后都不发光则是对应未与荧光素酶融合的脱氧核糖核苷酸抗体所对应的脱氧核糖核苷酸,此种情形下,荧光素酶催化底物后发光的颜色是相同的,不需要进行特殊区分。具体地,例如使用anti-a-gluc、anti-t-nluc、anti-c-nluc-gluc三种融合蛋白和未与荧光素酶融合的anti-g抗体,在通入gluc的底物腔肠素时,第一次检测到发光信号则对应脱氧核糖核苷酸a和c,在通入nluc的底物氟代腔肠素时,第二次检测到发光信号则对应脱氧核糖核苷酸t和c,即两次检测都发光则对应脱氧核糖核苷酸c,只有第一次检测发光则对应脱氧核糖核苷酸a,只有第二次检测发光则对应脱氧核糖核苷酸t,两次检测后都没有发光则对应脱氧核糖核苷酸g,从而实现四种脱氧核糖核苷酸的区分。
[0059]
由于本技术的融合蛋白能够在催化底物荧光素后自发光产生信号,因而本技术的高通量测序步骤中,对测序平台的设备要求较低,在发光步骤不需要高昂的激发光光源设备,在信号采集步骤中也不需要采用高昂的光学设备,只需采用普通的自发光测序平台进行发光信号的采集即可。优选可采用的自发光测序平台包括dnbseq-e5测序仪。
[0060]
此外,在其他实施方式中,本技术的上述融合蛋白还可以在高通量测序中有其他的应用形式,比如作为对照,用于开发其他新的测序用试剂等。
[0061]
下面将结合具体的实施例来进一步说明本技术的有益效果。需要说明的是,以下实施例主要包括如下内容:
[0062]
1)将基因合成获得的融合蛋白重组表达质粒pcdna3.1-h-luc和pcdna3.1-l电转入cho细胞中,两种质粒的表达产物——抗体重链荧光素酶融合蛋白和抗体轻链,在细胞内组装成本发明的融合蛋白,利用遗传霉素g418进行筛选高表达融合抗体的稳定细胞株;
[0063]
2)对稳定细胞株扩大培养,低温离心取上清,将上清过protein a柱进行分离纯化;
[0064]
3)sds-page鉴定分离纯化得到的融合蛋白;
[0065]
4)elisa实验鉴定融合蛋白抗体部分的亲和活性;
[0066]
5)酶活实验鉴定荧光素酶部分的自发光活性。
[0067]
6)在4)和5)证明融合蛋白均良好地保留了两部分蛋白的活性基础上,将融合蛋白在自发光测序仪上进行信号测试,能很好地接收信号,表明本发明的融合蛋白可用于新型测序技术。
[0068]
实施例1融合蛋白重组表达载体pcdna3.1-h-luc和pcdna3.1-l的构建
[0069]
设计含有碱基抗体重链与荧光素酶的融合基因的质粒pcdna3.1-h-luc(seq id no:9、seq id no:11、seq id no:13、seq id no:15),设计含有碱基抗体轻链基因的质粒pcdna3.1-l(seq id no:10、seq id no:12、seq id no:14、seq id no:16),委托华大吉比爱合成以上质粒。
[0070]
seq id no:9中第1位至第1341位为datp抗体重链基因序列,第1342位至第1386位为linker基因序列,第1387位至第1905位为荧光素酶基因序列;
[0071]
seq id no:11中第1位至第1347位为dttp抗体重链基因序列,第1348位至第1392位为linker基因序列,第1393位至第1911位为荧光素酶基因序列;
[0072]
seq id no:13中第1位至第1338位为dctp抗体重链基因序列,第1339位至第1383位为linker基因序列,第1384位至第1905位为荧光素酶基因序列;
[0073]
seq id no:15中第1位至第1326位为dgtp抗体重链基因序列,第1327位至第1371位为linker基因序列,第1372位至第1890位为荧光素酶基因序列;
[0074]
各序列中加粗及加下划线部分为柔性肽(或者叫linker,连接序列),linker前的序列为抗体重链序列,linker后的序列为荧光素酶序列。以pcdna3.1-a-h-luc和pcdna3.1-a-l为例,质粒图谱设计思路及构建过程如图3a、3b及3c所示。
[0075]
实施例2融合表达载体的转染、表达和纯化
[0076]
准备1ml浓度为1
×
107个/ml的cho细胞,取100μl,加入10μg构建好的pcdna3.1-h-luc和pcdna3.1-l融合蛋白表达质粒,混合均匀。将混好的融合蛋白表达质粒细胞混合物加入电击杯中,通过电转仪(125v 50ms)电转细胞。将细胞取出放入37℃预热的新鲜培养基中。37℃,8%co2条件下培养。
[0077]
待细胞扩大培养收集细胞培养液8000rpm/min离心10min,收集上清。将上清过滤后进行protein a柱上样,pbs洗涤10ml。用ph3.0 100mm甘氨酸20mm精氨酸洗脱。10%sds-page检测洗脱得到的蛋白。将最终纯化后的样品透析或超滤至pbs中,液氮速冻,-70℃保存。
[0078]
sds-page检测结果见图4。其中泳道1:anti-a-luc融合蛋白;泳道2:anti-t-luc融合蛋白;泳道3:anti-c-luc融合;泳道4:anti-g-luc融合蛋白;泳道m:分子marker。上述结果显示,各融合蛋白符合预期大小。
[0079]
实施例3融合蛋白抗体部分elisa测试亲和实验
[0080]
bsa-a/t/c/g蛋白的制备:用水稀释dntp mix至终浓度为1mm。加0.4mg edc(1-乙基-3-[3-二甲氨基丙基]碳化二亚胺盐酸盐)和0.6mg nhs(n-羟基琥珀酰亚胺)到0.5ml活化缓冲液(0.1m mes,0.5m nacl,ph 6.0)中,再加入等体积的1mm cold dntp溶液,混合均匀,在室温下反应20min。用1ml pbs溶解bsa至终浓度为1mm,加入到上述体系中,在室温下反应2小时。(上述所涉及试剂均为市售商品,且不限品牌。)
[0081]
将制备好的抗原100μl bsa-a/t/c/g蛋白(浓度1μg/ml)过夜包被于酶条上。加200μlpbst震荡洗涤10min 3次,pbs震荡洗涤3次。
[0082]
加入1%bsa-pbs 200μl,37℃封闭2h。pbst 200μl,10min,洗涤3次,pbs200μl,10min,洗涤3次。
[0083]
加入浓度梯度稀释的蛋白溶液100μl,37℃孵育2h。pbst 200μl,10min,洗涤3次,pbs200μl,10min,洗涤3次。
[0084]
加入稀释的商品辣根过氧化物酶标记的羊抗兔抗体100μl,37℃孵育1h。pbst 200μl,10min,洗涤3次,pbs200μl,10min,洗涤3次。
[0085]
使用四甲基联苯胺微孔过氧化物酶底物(tmb)作为底物进行显色10min;
[0086]
加入50μl浓度为0.1mol/l的硫酸终止反应后,测量450nm的吸光度。
[0087]
分析吸光度与浓度,做出效果分析图。结果如图5所示。其中,a:anti-a-luc融合蛋白实验结果分析;b:anti-t-luc融合蛋白实验结果分析;c:anti-c-luc融合蛋白实验结果分析;d:anti-g-luc融合蛋白实验结果分析。从图5可以看出,各融合蛋白对相应碱基的结合力与作为阳性对照的针对各碱基的抗体的结合力相当。即该结果显示各融合蛋白保留了抗体对碱基的亲和活性。
[0088]
实施例4融合蛋白荧光素酶部分活性检测
[0089]
将各融合蛋白用底物稀释液(50mm tris,ph 8.0,100mm nacl)稀释至3nm,取10μl加入96孔酶标板。再加入用相同溶液稀释至10μm的底物腔肠素90μl,用酶标仪自发光模块读取发光强度,具体结果见图6。
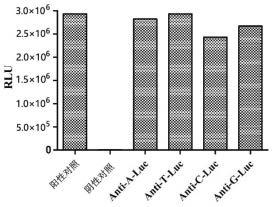
[0090]
图6中,a:anti-a-luc融合蛋白实验结果分析;b:anti-t-luc融合蛋白实验结果分析;c:anti-c-luc融合蛋白实验结果分析;d:anti-g-luc融合蛋白实验结果分析。从图6所示结果可以看出,融合蛋白荧光素酶部分催化底物腔肠素自发光活性与各自对应的非融合的荧光素酶的发光强度相当,即结果显示融合蛋白保留了荧光素酶催化底物发光的活性。
[0091]
实施例5融合蛋白双功能活性检测
[0092]
通过elisa检测结合力与生物发光实验。
[0093]
(1)将抗原100μl抗原蛋白浓度1μg/ml过夜包被于酶条上。加200μl pbst震荡洗涤10min3次,pbs震荡洗涤3次。
[0094]
(2)加入1%bsa-pbs 200μl,37℃封闭2h。pbst 200μl,10min,洗涤3次,pbs200μl,10min,洗涤3次。
[0095]
(3)加入1μg/ml融合蛋白溶液100μl,37℃孵育2h。pbst 200μl,10min,洗涤3次,pbs200μl,10min,洗涤3次。
[0096]
(4)加入用溶液稀释至10μm的底物腔肠素100μl,用酶标仪自发光模块读取发光强度。
[0097]
(5)分析发光值,做出效果分析图,结果见图7(其中,阳性对照为高斯荧光素酶,阴性对照为pbs buffer)。
[0098]
从图7可以看出,各融合蛋白双功能活性与阳性对照相当。该结果表明,各融合蛋白均能够结合各靶点碱基后催化底物发光,因而同时具有抗体及荧光素酶双功能活性。
[0099]
实施例6融合蛋白在测序仪上检测信号
[0100]
在自发光测序仪dnbseqe5上使用融合蛋白进行发光信号验证,检测融合蛋白测序信号值,具体步骤为:
[0101]
(1)提供连接于支持物上的待测序的核酸分子,或者将待测序的核酸分子连接于支持物上;
[0102]
(2)添加用于起始核苷酸聚合反应的引物,使引物退火至待测序的核酸分子上,引物作为起始的生长的核酸链,与待测序的核酸分子一起形成连接于支持物上的双链体;
[0103]
(3)添加用于进行核苷酸聚合反应的聚合酶,以及四种dntp,从而形成含有溶液相和固相的反应体系;
[0104]
(4)在允许聚合酶进行核苷酸聚合反应的条件下,使用聚合酶进行核苷酸聚合反应,从而将所述四种dntp中的一种聚合在生长的核酸链的3'端;
[0105]
(5)移除前一步骤的反应体系的溶液相,保留连接于支持物上的双链体,并加入5μ
g/ml抗体荧光素酶融合蛋白;
[0106]
(6)用洗脱缓冲液充分去除未结合的融合蛋白;
[0107]
(7)加入荧光素酶底物,通入底物的同时检测荧光信号;
[0108]
(8)通入洗脱反应液,移除上一步反应的溶液;
[0109]
(9)酶失活,通入使荧光素酶变性的反应试剂
[0110]
(10)移除上一步反应的溶液;
[0111]
(11)重复步骤(3)-(11)分析对照与融合蛋白信号值,做出效果分析图,结果见图8(其中对照为e5系列测序使用的用于检测a碱基的gluc luciferase通道蛋白)。
[0112]
从图8中可以看出,各融合蛋白在测序时能够检测掺入dntp上的相应碱基产生的荧光信号,可以应用于新型测序技术。
[0113]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。