1.本发明属于兽用微生物添加剂技术领域,与抗生素添加剂领域有关,本发明具体涉及一株具有呕吐毒素脱毒功能的产酶抑菌型枯草芽孢杆菌的筛选及应用。
背景技术:
2.呕吐毒素(deoxynivalenol,简称don),主要由多种镰刀菌(fusarium)产生,因其普遍存在于饲料中,严重影响动物生产性能,受到世界各国的普遍重视(cui et al2013)。因此有效控制和解决饲料中霉菌毒素污染,对改善动物生产性能具有重要意义。且随着抗生素在动物生产中长期大量使用,其弊端日益突出,导致动物免疫机能低下、肠道菌群失衡,耐药菌株增加及药物残留等问题,严重危害养殖业健康发展,影响人类食品安全。因此研发新型抗生素替代品已是当务之急。
3.益生菌具有天然、安全、无残留、无污染等优点,具有防止动物疾病,增强动物免疫力,提高饲料利用率及动物生产性能的作用,已成为抗生素最佳替代品之一被广泛研究开发。同时研究表明益生菌及其代谢产物具有较好的脱毒效果,且具有生长迅速、繁殖快和易于培养的特点,非常易于大规模生产和推广使用,已成为极具发展潜力的霉菌毒素脱毒剂。
4.本发明通过筛选具有高效脱除呕吐毒素且高效抑菌、产酶的益生菌,并对其进行鉴定、生物学特性分析、脱毒效果验证,开发具有呕吐毒素脱毒功能的产酶抑菌型饲用微生物添加剂。
技术实现要素:
5.为克服现有技术存在的缺陷,本发明提供了一种具有呕吐毒素脱毒功能的产酶抑菌型枯草芽孢杆菌(bacillus subtilis),以及该菌株在呕吐毒素脱毒中的应用。
6.为了实现上述目的,本发明是通过以下技术方案实现的:
7.本发明首先在实验室现有的从动物肠道中分离、纯化、保存的212株益生菌菌库中,选用don类似物环氧乙烷作为唯一碳源初筛培养,筛选获得8株优势菌株。然后再对初筛获得的8株菌株用don纯品作为唯一碳源进行脱毒复筛试验,结合抑菌试验及产酶试验综合评价,筛选具有筛选出具有高效脱除呕吐毒素且高效抑菌、产酶的益生菌菌株grh
‑
bs007。通过形态学特征、生理生化指标、16s rrna gene扩增测序比对,确定菌株grh
‑
bs007为枯草芽胞杆菌(bacillus subtilis),其16s rrna基因的核苷酸序列如seq id no.1所示,该枯草芽孢杆菌在2021年8月10日保藏于中国典型培养物保藏中心(简称cctcc,地址为:湖北省武汉市武汉大学内),其提议的分类命名为枯草芽孢杆菌(bacillus subtilis)grh
‑
bs007,保藏编号为cctcc no:m20211008。
8.经测定,具有呕吐毒素脱毒功能的产酶抑菌型枯草芽孢杆菌grh
‑
bs007对呕吐毒素有很好的脱毒能力,脱毒24小时,可脱除84.45%的呕吐毒素;对大肠杆菌k88、o157、 o139、o157、沙门氏菌金黄色葡萄球菌均有良好的抑菌活性;具有良好的产淀粉酶的能力
(酶活64.6u/ml),且生长速度稳定,2h左右进入对数生长期,对数期为4h左右,芽胞体对温度、胃酸、胆盐有着较高的耐受性。
9.本发明通过对don较为敏感的动物模型验证枯草芽胞杆菌grh
‑
bs007对灌胃 don的balb/c小鼠的具有良好的解毒作用。
10.本发明通过体内、体外试验分别验证了枯草芽孢杆菌grh
‑
bs007对don的优良脱毒效果,且本发明的枯草芽孢杆菌菌具有良好的抑菌效果、产淀粉酶活性及抗逆性,可以作为饲料添加剂使用。
11.本发明的有益效果:
12.(1)本发明所述的枯草芽孢杆菌grh
‑
bs007对呕吐毒素脱毒能力强;
13.(2)本发明所述的枯草芽孢杆菌grh
‑
bs007对常见肠道致病菌(大肠杆菌、沙门氏菌、金黄色葡萄球菌)具有良好的抑菌效果;
14.(3)本发明所述的枯草芽孢杆菌grh
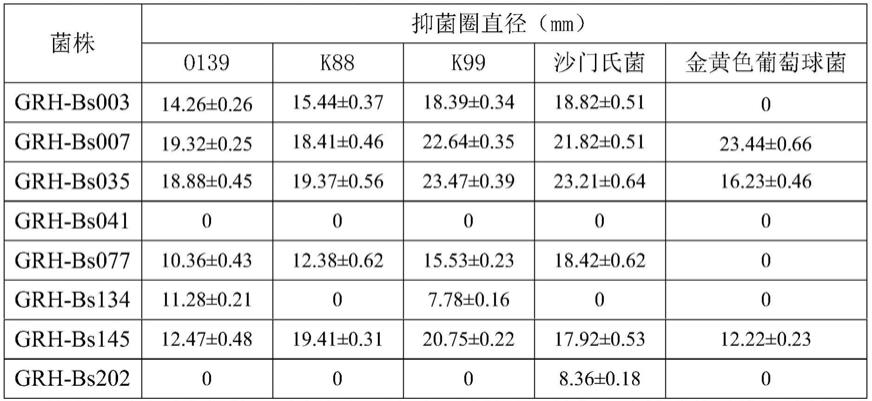
‑
bs007具有良好的产淀粉酶的能力;
15.(4)本发明所述的枯草芽孢杆菌grh
‑
bs007生长速度快,体对温度、胃酸、胆盐有着较高的耐受性。
16.(5)本发明所述的枯草芽孢杆菌grh
‑
bs007在动物体内对呕吐毒素具有较好脱毒作用,且益生效果良好。
17.更详细的技术方案见《具体实施方式》的内容。
附图说明
18.图1:本发明菌株的生长曲线图。
具体实施方式
19.实施例1:菌株的筛选
20.(1)脱毒初筛
21.以苯基环氧乙烷为唯一碳元素来源初筛益生菌菌株。将分离保存的益生菌株菌株划线接种于混有苯基环氧乙烷的固体初筛培养基中,保证苯基环氧乙烷成为唯一碳元素来源,将其置于37℃培养箱中培养1周,观察菌株的生长情况。为避免细菌在原环境中的碳源干扰,挑取生长出来的单菌落,连续3次纯培养,最后保存能在培养基上生长的菌株,记录分析菌株的生长状况。筛选获得8株优势菌株。菌株编号分别为grh
‑
bs003、 grh
‑
bs007、grh
‑
bs035、grh
‑
bs041、grh
‑
bs077、grh
‑
bs134、grh
‑
bs145、grh
‑
bs202。
22.(2)脱毒复筛
23.以don纯品做底物进行菌株脱毒能力的复筛,分别挑取初筛菌株于50ml的lb液体培养基中,37℃、200r/min条件下培养24h后作为种子液;将种子液以1%的接种量接种到100ml的lb液体培养基中,37℃、200r/min条件下培养24h作为发酵液;分别取初筛菌株的发酵液990μl,各加入10μl的don标准工作液(初始浓度100mg/l),在 37℃、200r/min条件下反应24h,以等量的lb液体培养基加等量的don标准工作液为对照组,每个样品做3个重复。将待检液混合均匀,10000r/min条件下离心5min,取离心后的上清液用0.22μm无菌过滤器过滤后用于don含量测定。采用呕吐毒素(don) 酶联免疫定量测试盒对待检液中don剩余含量进行测定,检测时做复孔。结果如表1。
24.表1 don纯品脱毒复筛结果
25.菌株grh
‑
bs003grh
‑
bs007grh
‑
bs035grh
‑
bs041grh
‑
bs077grh
‑
bs134grh
‑
bs145grh
‑
bs202脱毒率27.31%84.45%45.38%55.72%88.68%33.32%76.78%44.61%
26.(3)产酶试验筛选
27.接种初筛菌株至50ml的lb液体培养基中,37℃、200r/min培养24h后作为种子液。取5.00ml种子液12000r/min离心2min,弃上清,将沉淀用无菌水调节od值至 0.5左右(约5
×
107cfu/ml),接种到产酶培养基(胰蛋白胨10g/l,酵母浸粉5g/l,可溶性淀粉5g/l,kh2po
4 2g/l,mgso4·
7h2o 0.5g/l,cacl2·
2h2o 0.2g/l,以水配制), 37℃、200r/min培养24h后,离心除菌体后获得上清液,采用yoo改良法测定淀粉酶活力,取0.5%可溶性淀粉溶液5ml,在37℃水浴中预热10min,加入适当稀释的上清液 0.5ml,37℃水浴震荡,反应5min后,加入5ml0.lmol/l h2s04终止反应。取0.5ml反应液与5ml稀碘液显色,于620nm处测定光密度值。以0.5ml水代替0.5ml反应液作为空白对照,以不加发酵液(加入同体积的缓冲液)作为对照管,计算酶活力,结果见表2。
28.酶活力根据以下公式计算:酶活力(u)=(r0‑
r)
×
50
×
d/r029.式中:r0、r分别表示对照和反应液的光密度值,d为酶的稀释倍数。调整d使(r0‑
r)/r0在0.2
‑
0.7。酶活定义为:37℃,ph6.0条件下,5min内水解1mg淀粉的酶量为1个活力单位。
30.表2 酶活力测定结果
31.菌株grh
‑
bs003grh
‑
bs007grh
‑
bs035grh
‑
bs041grh
‑
bs077grh
‑
bs134grh
‑
bs145grh
‑
bs202酶活力8.3u/ml64.6u/ml22.3u/ml18.7u/ml54.2u/ml15.9u/ml45.4u/ml23.7u/ml
32.(4)抑菌试验筛选
33.将指示菌(沙门氏菌、金黄色葡萄球菌、大肠杆菌k88、k99、o139)接种于5ml lb 培养基中,于37℃摇床培养12h,通过比浊法,将指示菌稀释到106cfu/ml备用。初筛菌株经过活化培养后,菌液按2%接种量分别接种于装有lb的50ml ep管中,于37℃摇床培养,分别在培养至24h和48h后取出,4℃,8000r/min离心15min,去除菌体保留发酵上清液。用棉签蘸取指示菌均匀涂布于整个平皿上,至少四次。每个平板放置3个牛津杯,稍稍按压一下,取200μl初筛菌株发酵上清液加入牛津杯中,4℃放置 8h,37℃培养箱10h后观察抑菌效果并用直尺测量抑菌圈直径,结果见表3。
34.表3 初筛菌株发酵上清液体外抑菌试验
35.36.结论:通过脱毒初筛、脱毒复杂、产酶试验筛选、抑菌试验筛选结果综合分析,菌株grh
‑
bs007具有高效脱除呕吐毒素且高效抑菌、产酶的特性。
37.实施例2:菌株的鉴定
38.(1)形态学鉴定及理化特征鉴定
39.上述grh
‑
bs007菌株的细胞形态和理化特征见表4。
40.表4 grh
‑
bs007菌株的细胞形态和理化特征
41.鉴定指标结果鉴定指标结果菌落颜色白色或微黄葡萄糖产酸 革兰氏染色阳性木糖产酸 细胞形态杆状阿拉伯糖产酸 芽孢 甘露醇产酸 接触酶 利用丙酸盐
‑
水解明胶 硝酸盐还原 形成吲哚
‑
水解淀粉 厌氧生长
‑
7%氯化钠生长
42.注:
“‑”
表示阴性;“ ”表示阳性。
43.(2)分子鉴定
44.通过菌株16srrna序列对菌株grh
‑
bs007进行种属鉴定。芽孢杆菌16srrna基因组 pcr扩增所用引物为f1和r1(序列如下)。pcr扩增反应程序为:95℃预变性10min,1 个循环;95℃变性1min,56℃退火30s,72℃延伸1.5min,共30个循环;72℃最后延伸10min。扩增后,产物送至上海生工生物工程有限公司测序,菌株grh
‑
bs007的16s rrna 测序结果如seq id no.1所示。
45.f1:5
’‑
agagtttgatcctggctcag
‑3’
46.r1:5
’‑
aaggaggtgatccaccc
‑3’
47.grh
‑
bs007的16srrna序列在ncbi进行blastn比较,检索发现,grh
‑
bs007与 genebank中枯草芽孢杆菌序列同源性较高,相似性为100% (https://www.ncbi.nlm.nih.gov/),证明菌株grh
‑
bs007为枯草芽孢杆菌,正式命名为枯草芽孢杆菌(bacillus subtilis)grh
‑
bs007。
48.该枯草芽孢杆菌2021年8月10日送交湖北省武汉市武汉大学内中国典型培养物保藏中心(cctcc)保藏,其保藏号为:cctcc no:m20211008。
49.实施例3:枯草芽孢杆菌grh
‑
bs007生物学特性的测定
50.(1)生长曲线测定
51.挑取枯草芽孢杆菌grh
‑
bs007于50ml的lb液体培养基中,37℃、200r/min条件下培养24h后作为种子液,将种子液以1%的接种量接种到100ml的lb液体培养基中,37℃、 200r/min条件下培养24h作为发酵液。将发酵液以1%的接种量接种到5ml的lb液体培养基中,分别在0h、2h、4h、6h、8h、10h、12h、14h、16h、18h、20h、22h 时将培养液取出,将培养液10倍梯度稀释后用倾注法测各菌株的生长曲线,每个实验组做三个平行。以培养时间为横坐标,log(cfu/ml)值为纵坐标,绘制菌株的生长曲线。生长曲线结果见图1,grh
‑
bs007在2h左右进入对数生长期,对数期为4h左右,而后进入稳定期、衰退期。
52.(2)高温耐受性试验
53.取grh
‑
bs007芽胞悬液注入到离心管中,采用10倍梯度稀释,用倾注法测剩余活菌数。再将装有剩余芽孢悬液的离心管分别置于75℃、80℃、85℃、90℃水浴锅中热处理5min,取热处理后的菌液进行逐级10倍梯度稀释,用倾注法测剩余活菌数。以等量的芽孢悬液加等量的生理盐水为对照,每组试验做三个重复,grh
‑
bs007芽孢高温耐受性结果见表6。
54.表5 枯草芽孢杆菌grh
‑
bs007的高温耐受性
55.处理温度75℃80℃85℃90℃存活率100%96.2
±
2.7%92.6
±
3.2%61.5
±
2.8%
56.(3)胆盐耐受性的试验
57.取0.5ml的grh
‑
bs007芽孢悬液加入到4.5ml的0.3%模拟胆盐中(ph值为8.0),并迅速在振荡器上充分混和,然后置于37℃培养箱静置培养。分别在0h、24h的时候取出培养液并立即进行逐级10倍梯度稀释,用倾注法测剩余活菌数。以等量的芽孢悬液加等量的生理盐水为对照,每组试验做三个重复。grh
‑
bs007芽孢在模拟胆盐中反应24 小时后有91.6
±
6.3%的存活率。
58.(4)胃液耐受性的试验
59.取0.5ml的grh
‑
bs007芽孢悬液加入到4.5ml的模拟胃液中(ph值为2.0),并迅速在振荡器上充分混和,然后置于37℃培养箱静置培养。分别在0h、2h和4h的时候取出培养液并立即进行逐级10倍梯度稀释,用倾注法测剩余活菌数。以等量的芽孢悬液加等量的生理盐水为对照,每组试验做三个重复,枯草芽孢杆菌grh
‑
bs007芽孢高温耐受性结果见表7。
60.表6 枯草芽孢杆菌grh
‑
bs007芽孢模拟胃液耐受性
61.处理时间2小时4小时存活率97.1
±
1.3%93.2
±
4.6%
62.结论:试验表明,菌株grh
‑
bs007具有繁殖速度快、耐受力强的优点。
63.实施例4:枯草芽孢杆菌grh
‑
bs007在动物饲养中的应用
64.50只3周龄balb/c雄鼠预饲3d后,随机分为5组,每组2个重复,每个重复5 只/笼,分组和试验方案见表7,饲养环境温度为23
±
2℃,每天照明12h,自由饮水与采食。分别在试验第14d和第28d分析各组balb/c小鼠的生产性能,分析grh
‑
bs007 在小鼠体内脱毒的效果及其益生的作用。
65.表7 动物试验分组
66.组别1
‑
14d15
‑
28d对照组pbspbs益生菌组grh
‑
bs007grh
‑
bs007攻毒组dondon预防组grh
‑
bs007grh
‑
bs007 don治疗组dongrh
‑
bs007
67.注:n/a表示无处理;所有试验组均饲喂标准小鼠饲料,其中don的剂量2mg/kg
·
bw、grh
‑
bs007为活菌悬液(108cfu/ml,pbs洗涤后重悬);给药方式为口服灌胃(0.2ml/只);分别在攻毒开始)后第14d和第28d,对试验动物禁食过夜(自由饮水),次日进行检测样品采
集。
68.各处理组balb/c小鼠生长性能结果见表8。平均日增重方面,益生菌组(饲喂枯草芽孢杆菌grh
‑
bs007)显著高于其他各组(p<0.05),而攻毒组显著低于其他各组(p<0.05);平均日采食上,各处理组小鼠虽有不同的趋势,但差异不显著(p>0.05),表明枯草芽孢杆菌grh
‑
bs007具有促进小鼠增长的作用,且能够缓解don中毒对balb/c 小鼠平均日增重的影响。
69.表8 枯草芽孢杆菌grh
‑
bs007对小鼠生长性能的影响
70.组别平均日增重(g)平均日采食(g)对照组0.302
±
0.04
b
3.31
±
0.02益生菌组0.332
±
0.05
c
3.55
±
0.02攻毒组0.197
±
0.03
a
3.02
±
0.04预防组0.283
±
0.04
b
3.21
±
0.03治疗组0.276
±
0.03
b
3.27
±
0.04
71.注:表中数据以m
±
sd表示;同列数据之间,未标肩标者或肩标有相同字母表示差异不显著(p>0.05),肩标无相同字母表示差异显著(p<0.05)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。