1.本发明属于酶工程技术领域,涉及一种海洋来源的内切型硫酸软骨素硫酸酯酶及其编码基因与应用。
背景技术:
2.硫酸软骨素(cs)/硫酸皮肤素(ds)是一类天然聚阴离子线性糖胺聚糖,广泛分布于动物细胞表面与细胞外基质中。其主链由β1-3糖苷键连接的d-葡萄糖醛酸/l-艾杜糖醛酸(glcua/idoua)和n-乙酰半乳糖胺(galnac)二糖单元,通过β1-4糖苷键重复连接而成。cs/ds通过与特殊的核心蛋白相连形成蛋白聚糖,与一系列生长因子、细胞因子或其他胞外基质组分相互作用,参与各种生理学病理学过程,例如细胞增殖、神经再生、免疫反应、肿瘤发生及病原微生物感染等(jiang,xu,li,chen,hong&chen,2019;monneau,arenzana-seisdedos&lortat-jacob,2016;sugiura,clausen,shioiri,gustavsson,watanabe&salanti,2016;tighe&garantziotis,2019)。硫酸软骨素的合成过程中伴随着差向异构化和一系列的硫酸化修饰,在c5差向异构酶的作用下,硫酸软骨素二糖单元中的glcua残基异构化成为idoua,因此cs和ds通常以杂合链的形式存在;在各种的硫酸基转移酶的作用下,cs/ds己糖醛酸(glcua/idoua)的c2及c3位和galnac的c4和c6位可发生不同程度、不同位置的硫酸化修饰(kusche-gullberg&kjellen,2003),其中常见的二糖单元有galnac的c4位硫酸化修饰的a unit(glcuaβ1
–
3galnac(4s))、galnac的c6位硫酸化修饰的c unit(glcuaβ1
–
3galnac(6s))、和glcua的c2位和galnac的c6位双硫酸化修饰的d unit(glcua(2s)β1
–
3galnac(6s))、galnac的c4位和c6位双硫酸化修饰的e unit(glcuaβ1
–
3galnac(4,6s))、非硫酸化修饰的o unit(glcuaβ1
–
3galnac)和它们在ds中对应的含有艾杜糖醛酸的二糖单元的不同硫酸化形式(kusche-gullberg&kjellen,2003;vessella,traboni,cimini,iadonisi,schiraldi&bedini,2019)。这些多样化的修饰使cs/ds具有高度的结构复杂性和聚阴离子特性,为其结构与功能的研究带来了极大的困难。
3.cs/ds硫酸酯酶归属于芳基硫酸酯酶家族,它们能够特异性的水解cs/ds糖链中的硫酸基团,结构和催化机制相对保守,且在许多关键的生物学过程,例如轴突生长、细胞老化、炎症反应肿瘤发生及动脉粥样硬化过程中,均发挥重要作用。迄今为止,越来越多的研究证明,生物体cs/ds硫酸化程度及模式具有时空特异性,与各种生理和病理过程相关,而硫酸酯酶作为一种能够特异性水解特异位点硫酸根的水解酶,有潜力成为硫酸化cs/ds结构功能研究及特定硫酸化模式相关cs/ds寡糖制备的重要工具。
4.近年来,细菌来源的cs/ds硫酸酯酶因其多样的底物选择性和优良的酶学特性,受到了高度的重视,有潜力成为cs/ds结构功能研究、糖链硫酸化模式编辑及相关疾病治疗的重要工具酶。根据底物特异性的不同,cs/ds硫酸酯酶可分为糖醛酸2-o-硫酸酯酶、galnac-4-o-硫酸酯酶和galnac-6-o-硫酸酯酶三大类。而根据其底物降解模式的不同,cs/ds硫酸酯酶又可分为可以水解糖链内部硫酸根的内切型cs/ds硫酸酯酶和仅水解糖链端基硫酸根
的外切型cs/ds硫酸酯酶(wang,sugahara&li,2016)。可是,相对于cs/ds结构的高度复杂性,目前已鉴定并进行深入酶学性质分析的细菌来源cs/ds硫酸酯酶的种类和数量依然极为有限,且多为用途相对受限外切酶。已鉴定的内切酶仅有bacteroides thetaiotaomicron及vibrio sp.fc509来源的两种galnac-4-o-硫酸酯酶(ulmer et al.,2014;wang,han,cai,zheng,sugahara&li,2015);来源于proteus vulgaris的商品化的cs/ds硫酸酯酶为外切型galnac-4-o-硫酸酯酶(yamagata,saito,habuchi&suzuki,1968),由原始菌体发酵生产制备,分离纯化过程复杂,难以获得高纯的单一酶。因此,发现更多特性新颖的硫酸酯酶,研究其作用模式和底物降解特性,对cs/ds结构功能研究及特定硫酸化模式的cs/ds寡糖制备具有重要意义。而海洋微生物具有丰富的且特性新颖的糖胺聚糖降解酶,是新型cs/ds硫酸酯酶的重要来源。
技术实现要素:
5.针对现有技术的不足,本发明提供一种海洋来源的内切型硫酸软骨素galnac-4-o-硫酸酯酶及其编码基因与应用。
6.本发明的技术方案是:
7.一种海洋来源的内切型硫酸软骨素硫酸酯酶pb_3262,氨基酸序列如seq id no.2所示。
8.本发明的硫酸软骨素硫酸酯酶pb_3262是内切型的galnac-4-o-硫酸酯酶,能够特异性降解含有单硫酸化a unit的cs-a多糖内部的4-o-硫酸基团,生成含有非硫酸化o unit的cs多糖。
9.上述内切型硫酸软骨素硫酸酯酶pb_3262的编码基因,核苷酸序列如seq id no.1所示。
10.本发明中所述内切型硫酸软骨素硫酸酯酶pb_3262的编码基因来源于发光杆菌(photobacterium sp.)qa16,所述内切型硫酸软骨素硫酸酯酶pb_3262分离自发光杆菌(photobacterium sp.)qa16,发光杆菌qa16于2020年8月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号cgmcc no.20556。
11.一种重组表达载体,在表达载体中插入了上述内切型硫酸软骨素硫酸酯酶pb_3262的编码基因。
12.根据本发明优选的,所述表达载体为大肠杆菌表达载体、酵母表达载体、枯草杆菌表达载体、乳酸菌表达载体、链霉菌表达载体、噬菌体载体、丝状真菌表达载体、植物表达载体、昆虫表达载体或哺乳动物细胞表达载体。
13.一种重组细胞,在宿主细胞中插入了上述内切型硫酸软骨素硫酸酯酶pb_3262的编码基因。
14.根据本发明优选的,所述宿主细胞为大肠杆菌宿主细胞、酵母菌宿主细胞、枯草杆菌宿主细胞、乳酸菌宿主细胞、放线菌宿主细胞、丝状真菌宿主细胞、昆虫细胞或哺乳动物细胞。
15.进一步优选的,所述的大肠杆菌宿主细胞为escherichia coli bl21、escherichia coli jm 109或escherichia coli dh 5α;所述酵母菌宿主细胞为
saccharomyces cerevisiae、pichia pastoris或kluyveromyces iactis;所述枯草杆菌宿主细胞为bacillus subtilis 168、bacillus subtilis r25或bacillus subtilis 9920;所述乳酸菌宿主细胞为lactic acid bacteria c0cc101;所述放线菌宿主细胞为streptomyces sp.;所述丝状真菌宿主细胞为trichoderma viride,trichoderma reesei,aspergillus niger或aspergillus nidulans;所述昆虫细胞为bombyxmori或antharaea eucalypti;所述哺乳动物细胞为人肾上皮细胞293t、中国仓鼠卵巢细胞cho、幼小仓鼠肾脏细胞bhk或中国仓鼠肺细胞chl。
16.上述重组细胞在重组表达内切型硫酸软骨素硫酸酯酶pb_3262中的应用。
17.上述内切型硫酸软骨素硫酸酯酶pb_3262在制备cs二糖、寡糖及多糖中的应用。
18.上述内切型硫酸软骨素硫酸酯酶pb_3262在研究特殊硫酸化结构的糖胺聚糖结构功能关系中应用。
19.有益效果:
20.1、本发明中的硫酸软骨素硫酸酯酶pb_3262,分离自发光杆菌(photobacterium sp.)qa16,易于异源表达及纯化,且表达产量高,降解活性高,特异性强,兼具备科学研究及工业应用潜力,对cs/ds相关领域研究及发展具有重要意义。
21.2、本发明中的硫酸软骨素硫酸酯酶pb_3262对富含单硫酸化a unit的底物具有高度选择性,特别是对4-o-单硫酸化的a unit二糖和富含a unit的cs-a多糖表现出高度特异性、选择性和降解活性,对多糖的酶活为146.71mu/mg,尤其是对a unit二糖降解活力极高,酶活力达到了165.75u/mg。
22.3、本发明中的硫酸软骨素硫酸酯酶pb_3262降解富含a unit的cs-a底物时表现为内切酶降解模式,其独特的酶学特性可应用于特殊硫酸化程度的硫酸软骨素的定向修饰,亦可制备不同的硫酸化程度的硫酸软骨素寡糖,不仅有潜力应用于相关硫酸化的硫酸软骨素的结构功能研究,在食品药品及医疗领域具有十分广阔的应用前景。
附图说明
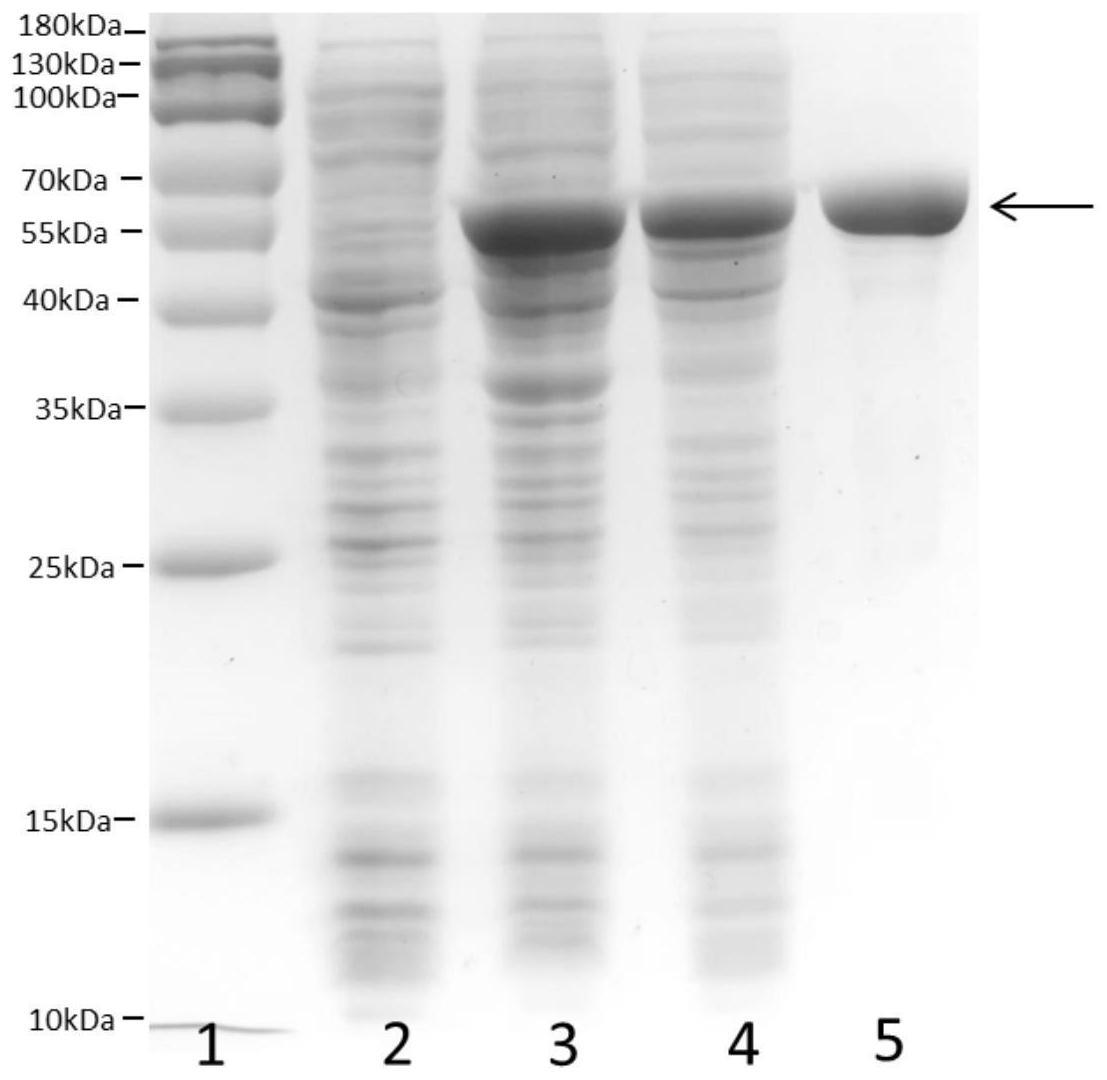
23.图1为内切型galnac-4-o-硫酸酯酶pb_3262表达及纯化情况的sds-page凝胶电泳图谱;
24.其中:泳道1、蛋白质分子量标准,条带自上至下大小为180kda,130kda,100kda,70kda,55kda,40kda,35kda,25kda,15kda,10kda;泳道2、未转化大肠杆菌破壁后上清,上样量10μl;泳道3、重组菌破壁后菌液,上样量10μl;泳道4、重组菌破壁后上清,上样量10μl;泳道5、经镍柱纯化的pb_3262样品,上样量10μl;
25.图2为温度、ph、金属离子及其浓度、酶孵育时间对内切型硫酸软骨素galnac-4-o-硫酸酯酶pb_3262的活性影响曲线;
26.图中:a是不同温度下pb_3262对a unit二糖的降解速率图,b是不同ph及缓冲溶液中pb_3262对a unit二糖的降解速率图,c是体系中含不同金属离子时pb_3262对a unit二糖的降解速率图,d是pb_3262在不同温度下孵育不同时间时酶对a unit二糖的降解速率图,e是在不同na
浓度下pb_3262对a unit二糖的降解速率图,f是在不同ca
2
浓度下pb_3262对a unit二糖的降解速率图;
27.图3为硫酸酯酶pb_3262降解不同硫酸化模式的不饱和cs二糖的降解产物的高效
液相色谱(hplc)分析图;
28.图中:a是以不饱和a unit二糖为底物时pb_3262的降解分析图,b是以不饱和c unit二糖为底物时pb_3262的降解分析图,c是以不饱和d unit二糖为底物时pb_3262的降解分析图,d是以不饱和e unit二糖为底物时pb_3262的降解分析图;
29.图4为硫酸酯酶pb_3262降解富含4-o-硫酸根的cs-a、cs-e和ds多糖的降解产物的高效液相色谱(hplc)分析图;
30.图中:a是pb_3262降解cs-a多糖的降解产物分析图,b是pb_3262降解cs-e多糖的降解产物分析图,c是pb_3262降解ds多糖的降解产物分析图;
31.图5为硫酸酯酶pb_3262的三维结构模拟示意图,及其活性中心关键位点氨基酸突变体酶活力分析的降解终产物的高效液相色谱(hplc)分析图;
32.图中:a为pb_3262三维结构模拟及活性中心参与催化反应位点示意图,b为pb_3262标签序列位点突变活性检测的高效液相色谱(hplc)分析图。
具体实施方式
33.以下实施例的阐述,是为了全面公开本发明如何实施的一些常用技术,而不是为了限制本发明的应用范围。发明人已经尽最大努力确保实施例中各个参数的准确性(例如量,温度,等等),但是一些实验误差和偏差也应该予以考虑。除非另有说明,本发明中分子量是指平均分子量,温度是指摄氏度。
34.生物材料来源:
35.以下实施例中的发光杆菌(photobacterium sp.)qa16在2020年8月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号cgmcc no.20556,相关保藏工作已经在申请中国专利cn112126606a时完成和公开。
36.实施例1、内切型硫酸软骨素硫酸酯酶pb_3262基因序列分析
37.内切型硫酸软骨素硫酸酯酶pb_3262来源于海洋细菌发光杆菌(photobacterium sp.)qa16。是将发光杆菌(photobacterium sp.)qa16先进行基因组测序,再通过open reading frame finder(orf finder,http://www.ncbi.nlm.nih.gov/gorf/gorf.html)和basic local alignment search tool(blast,http://blast.ncbi.nlm.nih.gov/blast.cgi)对基因组序列进行分析得到的。
38.内切型硫酸软骨素硫酸酯酶pb_3262基因编码区长1,488bp,其核苷酸序列如seq id no.1所示,信号肽分析显示其不含有n-末端信号肽。内切型硫酸软骨素硫酸酯酶pb_3262基因编码的蛋白质由495个氨基酸组成,理论分子量为56.7kda,其氨基酸序列如seq id no.2所示。用blast软件在线分析,blast多序列比对结果显示,其与已鉴定的来源于发光杆菌(photobacterium sp.)fc615的外切型galnac-4-o-硫酸酯酶exopb4sf具有最高的序列相似性,相似度达85.51%(wang et al.,2019),但是内外切性质完全不同。
39.实施例2、内切型硫酸软骨素硫酸酯酶pb_3262表达载体的构建
40.将发光杆菌(photobacterium sp.)qa16接种至液体培养基中,在30℃、200rpm的条件下,振荡培养至od
600
约为0.8;取培养菌液40ml,在12,000rpm条件下离心25min,收集菌体沉淀,用20ml的溶菌缓冲液(10mm tris-hcl ph 8.0)洗涤,在12,000rpm条件下离心
25min,收集菌体沉淀;
41.上述菌体沉淀中,每管加入溶菌缓冲液(10mm tris-hcl ph 8.0)12.0ml,得到约14.0ml的菌液,分别加入浓度为20mg/ml的溶菌酶各560μl,其终浓度约800μg/ml;冰浴1h后,37℃温浴2h,至溶液粘稠;加入10%(w/v)十二烷基磺酸钠(sds)0.82ml,100mg/ml的蛋白酶k溶液60μl,52℃水浴1h;加入tris-hcl平衡过的酚/氯仿/异戊醇(体积比25:24:1)15ml,轻轻颠倒混匀,至充分乳化;10,000g、4℃条件下离心10min,转移上清,加入2.0ml的naac-hac(ph 5.2,3.0m)缓冲液,以及17.0ml的无水乙醇,混匀;用1ml的枪头挑出丝状dna,转移至1.5ml的离心管中,以70%(v/v)的乙醇(贮于-20℃)洗涤2次,离心后弃上清;10,000g、4℃条件下离心3min,彻底弃掉上清;样品于无菌工作台中,酒精灯下风吹干燥;用无菌去离子水重悬溶解dna样品,4℃过夜,得到大分子量基因组dna。
42.以发光杆菌(photobacterium sp.)qa16的基因组dna为模板,进行pcr扩增,引物序列如下:
43.正向引物pb_3262-f:5
′‑
catatgatgccagcttgtagcgctgcctcatc-3
′
,
44.反向引物pb_3262-r:5
′‑
ctcgagagtgtaggcattcagaacactgg-3
′
。
45.在正向和反向引物中,标注有下划线的碱基序列分别为限制性内切酶ndei和xhoi的酶切位点。primerstar
tm hs dna聚合酶购自宝生物公司,pcr反应体系按照公司提供的产品说明操作。
46.pcr反应条件:95℃预变性5min;95℃变性40s,60℃退火30s,72℃延伸1min 30s,35个循环;72℃延伸15min,4℃稳定15min。
47.pcr产物经琼脂糖凝胶电泳胶回收得到带有酶切位点的内切型硫酸软骨素galnac-4-o-硫酸酯酶pb_3262目的基因的片段,并将其通过粘性末端连接连至使用同样限制性内切酶酶切后的pet-30a表达载体中,用于粘性末端连接的t4 dna ligase购自宝生物公司,连接酶与底物反应的体系、片段与载体的比例、反应温度以及反应时间均遵循使用说明书。
48.连接体系转化到大肠杆菌dh5α菌株,涂布到含50μg/ml卡那霉素的luria-bertani培养基固体平板上,37℃倒置培养14h,挑取单克隆到卡那抗性的lb液体培养基中,37℃、200rpm培养12-14h后,提取质粒;将含有目标质粒的菌体收集进行氯仿抽提验证阳性克隆,结果得到大小正确的目标质粒,初步证明重组质粒构建正确。阳性菌株由生工生物公司进行dna测序,测序结果表明插入表达载体pet-30a的pb_3262序列正确,且在其5’端和3’端分别含有ndei和xhoi酶切位点。
49.实施例3、重组内切型硫酸软骨素硫酸酯酶pb_3262的大肠杆菌中的重组表达及分离纯化
50.将测序正确的内切型硫酸软骨素硫酸酯酶pet-30a-pb_3262重组质粒分别转化到大肠杆菌bl21(de3)(购于南京诺唯赞生物科技有限公司),涂布到含50μg/ml卡那霉素的luria-bertani培养基固体平板上,37℃倒置培养14h,挑取单克隆到卡那抗性的lb液体培养基中,37℃、200rpm培养12-14h后进一步扩大培养,加入iptg至终浓度为0.05mm,16℃诱导表达24h。表达结束后收集菌体,菌体破碎后离心分离得到破碎菌体的上清,利用ni sepharose 6fast flow(ge)亲和层析凝胶对目的蛋白进行层析纯化,并通过聚丙烯酰胺凝胶电泳(sds-page)对纯化的目的蛋白进行检测,以未转化重组质粒的大肠杆菌裂解上清为
对照,检测结果如图1所示。纯化后的重组galnac-4-o-硫酸酯酶pb_3262(图1)在电泳胶上基本均呈单一条带,且位置与他们的理论分子量相吻合,纯度达到95%。
51.实施例4、重组内切型硫酸软骨素硫酸酯酶pb_3262的酶学性质分析
52.1、温度对酶活性的影响
53.将10mg/ml的不饱和硫酸软骨素a unit二糖、150mm的tris-hcl缓冲液(ph 7.0)、pb_3262粗酶液以及去离子水按照3:10:3:14(体积比)的比例混合后,分别在0℃、10℃、20℃、30℃、40℃、50℃、60℃、70℃条件下反应5min,反应结束后,沸水浴处理使酶失活,加沸水浴灭活的酶反应作为阴性对照,反应产物稀释后上样superdex
tm peptide 10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶pb_3262水解产生的非硫酸化的峰的比率来表示酶反应速率,将此读数比率最大的条件定义为100%相对酶活力(relativie activity),检测结果如图2a所示。
54.由图2a可知,内切型硫酸软骨素硫酸酯酶pb_3262水解不饱和a unit的最适反应温度为50℃,同时在30-40℃时也保有较好的酶活力,当温度高达70℃时酶几近失活。
55.2、ph对酶活性的影响
56.将10mg/ml的不饱和硫酸软骨素a unit二糖、含有不同缓冲离子对的150mm反应缓冲液、pb_3262粗酶液以及去离子水按照3:10:3:14(体积比)的比例混合,反应缓冲液包括150mm的naac-hac溶液(ph 5.0-6.0)、150mm的nah2po
4-na2hpo4溶液(ph 6.0-8.0)和150mm的tris-hcl溶液(ph 7.0-10.0),在50℃下反应5min,反应结束后,沸水浴处理使酶失活,加沸水浴灭活的酶反应作为阴性对照,反应产物稀释后上样superdex peptide
tm
10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶pb_3262水解产生的非硫酸化的峰的比率来表示酶反应速率,将此读数比率最大的条件定义为100%相对酶活力(relativie activity),检测结果如图2b所示。
57.由图2b可知,内切型硫酸软骨素硫酸酯酶pb_3262水解不饱和a unit的最适ph为ph7.0,最适缓冲条件均是tris-hcl缓冲溶液,且在ph 6.0的naac-hac缓冲溶液中也具有较好的酶活性,溶液ph值低于5或高于9时均表现出极低的酶活力,且pbs缓冲液下酶活力明显低于tris-hcl缓冲液。
58.3、金属离子及二价金属离子螯合剂对酶活性的影响
59.将10mg/ml的不饱和硫酸软骨素a unit二糖、150mm的tris-hcl缓冲液(ph 7.0)、100mm金属离子及金属离子螯合剂、pb_3262粗酶液以及去离子水按照3:10:1.5:3:12.5(体积比)的比例混合,在50℃下反应5min,反应结束后,沸水浴处理使酶失活,加沸水浴灭活的酶和相应的金属离子的反应作为阴性对照,反应产物稀释后上样superdex peptide 10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶pb_3262水解产生的非硫酸化的峰的比率来表示酶反应速率(扣除相应位置阴性对照峰面积),将不加金属离子及螯合剂的反应定义为100%相对活力(relativie activity),检测结果如图2c所示。
60.由图2c可知,对于内切型硫酸软骨素硫酸酯酶pb_3262,一价金属离子中,li
、k
均对酶有一定的促进作用;二价金属离子中,除ca
2
对酶活力有促进作用外,ba
2
对酶也有一定的促进作用;此外,很多金属离子如ag
、hg
2
、pb
2
、cu
2
、zn
2
、fe
3
和cr
3
均对酶有很强的
抑制作用。
61.4、温度对酶稳定性的影响
62.将10mg/ml的不饱和硫酸软骨素a unit二糖、150mm的tris-hcl缓冲液(ph 7.0)、在不同温度(0℃-70℃)下热处理1、2、4、8、12、24h后的pb_3262粗酶液以及去离子水按照3:10:3:14(体积比)的比例混合,在50℃下反应5min,反应结束后,沸水浴处理使酶失活,加沸水浴灭活的酶反应作为阴性对照。反应产物稀释后上样superdex peptide
tm
10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶pb_3262水解产生的非硫酸化峰的比率来表示酶反应速率,将不做时间梯度热处理的反应非硫酸化的峰比率读数定义为100%相对酶活力(relativie activity),检测结果如图2d所示。
63.由图2d可知,内切型硫酸软骨素硫酸酯酶pb_3262在30℃以上的高温放置均会在1h之内迅速失活,表明内切型硫酸软骨素硫酸酯酶pb_3262是温度敏感型酶且不能长时间耐受高温环境。孵育24h后,内切型硫酸软骨素硫酸酯酶pb_3262在10℃和20℃的酶活会降低将近四分之三。
64.5、na
对酶活性的影响
65.将10mg/ml的不饱和硫酸软骨素a unit二糖、150mm的tris-hcl缓冲液(ph 7.0)、pb_3262粗酶液以及去离子水按照3:10:3:14(体积比)的比例混合,加入nacl至终浓度达0-1m,在50℃下反应5min,反应结束后,沸水浴处理使酶失活,加沸水浴灭活的酶反应作为阴性对照。反应产物稀释后上样superdex peptide
tm 10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶pb_3262水解产生的非硫酸化峰的比率来表示酶反应速率,将不加nacl的反应非硫酸化的峰比率读数定义为100%相对酶活力(relativie activity),检测结果如图2e所示。
66.由图2e可知,随着溶液中na
浓度的升高,酶活性稍微增强然后减弱并抑制酶活性,50mmol/l的na
对酶活力促进作用最强。
67.6、ca
2
对酶活性的影响
68.将10mg/ml的不饱和硫酸软骨素a unit二糖、150mm的tris-hcl缓冲液(ph 7.0)、pb_3262粗酶液以及去离子水按照3:10:3:14(体积比)的比例混合,加入cacl2至终浓度达0-0.5m,在50℃下反应5min,反应结束后,沸水浴处理使酶失活,加沸水浴灭活的酶反应作为阴性对照。反应产物稀释后上样superdex peptidetm 10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶pb_3262水解产生的非硫酸化峰的比率来表示酶反应速率,将不加cacl2的反应非硫酸化的峰比率读数定义为100%相对酶活力(relativie activity),检测结果如图2f所示。
69.由图2f可知,随着溶液中ca
2
浓度的升高,酶活性稍微增强然后减弱,150mmol/l以上的cacl2浓度反而对酶活性有抑制作用,50mmol/l的ca
2
对酶活力促进作用最强。
70.实施例5、重组内切型硫酸软骨素硫酸酯酶pb_3262对不同硫酸化模式的不饱和硫酸软骨素二糖的降解产物分析
71.将不同硫酸化模式的不饱和硫酸软骨素二糖(a unit、c unit、d unit和e unit)、150mm的tris-hcl缓冲液(ph 7.0)、纯化后的重组硫酸酯酶pb_3262酶液以及去离子水按照3:10:3:14(体积比)的比例混合,25℃反应12h,以加灭活酶的反应体系作为阴性对照,反应
结束后沸水浴处理使酶失活,取上清2μl(约1μg糖)进行2-ab荧光标记并进行hplc分析,检测结果如图3所示。
72.hplc分析条件为凝胶柱:superdex peptide
tm 10/300gl(ge);流动相:0.2m碳酸氢铵;流速:0.4ml/min;检测条件:荧光检测器,激发光330nm,发射光420nm,室温检测。
73.由图3可知,内切型硫酸软骨素硫酸酯酶pb_3262能够水解4-o-单硫酸化的不饱和a unit二糖中的硫酸集团生成非硫酸化的o unit,无法降解其他位置硫酸化的二糖,如6-o-硫酸化的c unit二糖和c2,c6位双硫酸化的d unit二糖。除此之外,使用相同的酶量,pb_3262也无法有效水解c4,c6位双硫酸化的e unit二糖,说明额外的6-o-硫酸化在一定程度上抑制了酶对4-o-硫酸基的水解活性。
74.实施例6、重组内切型硫酸软骨素硫酸酯酶pb_3262对不同硫酸化模式cs多糖的降解产物分析
75.以不同的、富含4-o-硫酸根的cs/ds多糖(cs-a、cs-e和ds)为底物,加入pb_3262酶液,分析多糖降解产物的二糖组成。
76.具体步骤如下:将10mg/ml的各种不同类型的富含4-o-硫酸基团的cs多糖溶液(cs-a、cs-e和ds)、150mm的tris-hcl缓冲液(ph 7.0)、纯化后的10mg/ml的pb_3262酶液以及去离子水按照1:10:1:18(体积比)的比例混合,在25℃下反应过夜。取降解产物2μg沸水浴灭活,加入硫酸软骨素裂解酶(csase abc)将其完全降解为二糖后,进行2-ab荧光标记并进行hplc分析,检测结果如图4所示。
77.hplc分析条件为凝胶柱:superdex peptide 10/300gl(ge);流动相:0.2m碳酸氢铵;流速:0.4ml/min;检测条件:荧光检测器,激发光330nm,发射光420nm,室温检测。
78.由图4可知,经过过夜反应,富含4-o-单硫酸化二糖的cs-a多糖中的4-o-硫酸根被完全降解,说明pb_3262是一个内切型的galnac-4-o-硫酸酯酶。而pb_3262对富含c4,c6双硫酸化e unit的cs-e多糖及富含idoua的ds多糖中的4-o-硫酸基团的降解却非常有限,说明pb_3262具有一定的单硫酸化a unit降解倾向性,双硫酸化二糖及差向异构化二糖对酶活性均有不同程度的抑制作用。
79.实施例7、重组内切型硫酸软骨素硫酸酯酶pb_3262的酶活力测定
80.将10mg/ml的不饱和硫酸软骨素a unit二糖及cs-a多糖、150mm的tris-hcl缓冲液(ph 7.0)、纯化后的pb_3262酶液以及去离子水按照3:10:3:14(体积比)的比例混合,分别在50℃反应30s、1min、2min、5min,沸水浴灭活反应,降解多糖的反应加csase abc酶将其完全降解为二糖。反应产物上样superdex peptide
tm 10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶pb_3262水解产生的非硫酸化的峰的峰面积,根据标准曲线计算生成非硫酸化产物的摩尔量,从而计算产生硫酸基团的摩尔量。酶活力单位(u)定义为单位时间(1min)内产生1μmol硫酸基团所需的酶量。
81.经计算,内切型硫酸软骨素硫酸酯酶pb_3262降解a unit的酶活为165.75u/mg,降解cs-a多糖的酶活为146.71mu/mg。
82.实施例8、重组内切型硫酸软骨素硫酸酯酶pb_3262的三维结构预测及关键位点突变体活性检测
83.根据已鉴定的、结构已知的cs/ds硫酸酯酶序列,通过swiss-model同源建模构建
内切型硫酸软骨素硫酸酯酶pb_3262的三维结构模型,具体如图5a所示。
84.内切型硫酸软骨素硫酸酯酶pb_3262的活性中心关键位点氨基酸突变体酶活力分析的降解终产物的高效液相色谱(hplc)分析图如图5b所示,其酶活性中心关键位点的失活突变显示,pb_3262-c70a(第70位的半胱氨酸突变为丙氨酸)和pb_3262-r74a(第74位的精氨酸突变为丙氨酸)均使酶失去原有的活性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
