1.本技术涉及基因测序技术领域,具体涉及一种可以使宏基因组文库片段大小集中的建库方法及其应用。
背景技术:
2.高通量测序(ngs)的数据产出和数据质量跟多个因素息息相关,其中主要影响因素是文库质量、测序试剂和仪器状况,由于测序试剂和仪器状况不易控制,因此,为了保证测序质量,需要严格把控文库质量。文库的质量对于高通量测序(ngs)产出的数据质量至关重要。
3.评价文库质量,通常可从三方面衡量:文库片段、文库碱基复杂度和文库浓度。完整的文库除了目的片段,还可能存在二聚体、小片段、大片段等非目的片段的存在,这些非目的片段会导致文库定量不准确,同时还可能影响后续的上机测序,降低测序数据的产出和测序的质量。因此文库片段指标是浓度定量准确性的前提,是测序数据量产出均一性的根本。
4.文库片段分析通常都使用微流控芯片技术的仪器进行检测,一般有以下3种情况:1.大片段拖尾现象:
①
片段化过程中打断的条件不合适,残留部分较长的片段;
②
文库分选过程磁珠比例不当导致;
③
文库的扩增循环数太高,文库过度扩增自我互联形成多聚体。大片段在上机测序时,可能会跨孔长簇,测序仪会过滤掉这部分的数据,降低产出。2.宽峰现象:
①
打断条件不合适,
②
文库没有进行分选或分选条件不合适。宽峰的文库由于片段分布广,难以进行文库浓度的准确定量,因此文库的数据产出不好控制。3.片段过大现象:
①
插入片段过长,打断条件不合适,
②
文库没有进行分选或分选条件不合适。测序的文库长度太长,一方面会影响文库浓度的荧光定量,另一方面,在上机测序时可能会跨孔长簇,产生index hopping,降低测序数据的产出和质量,还有长的文库片段也会形成较大的簇,导致荧光信号减弱,机器在碱基识别时,准确率降低,q30降低,同时也会影响数据量。
5.宏基因组测序能够对样本中的所有核酸进行无偏向测序,包括人源和微生物的核酸。因此文库质量对于宏基因组测序来说影响极大,文库质量直接关系到目标病原数据产出的占比与整个测序质量进而影响微生物含量分析,影响病原微生物的检出。鉴于此,特提出本技术。
技术实现要素:
6.本技术针对宏基因组样本,使用酶切消化法搭配低浓度反应增强液来构建文库体系,通过对时间、温度、核酸洗脱液(ph)、样本类型、input量、循环数等影响文库片段大小的多种因素进行优化探索,保证了在相对较高的扩增循环数下宏基因组文库片段大小集中不拖尾,低起始量的样本能达到出库标准,体现了样本兼容性高和体系稳定性好等优势。
7.因此本技术的核心目的是寻求一种针对宏基因组样本的、具有样本兼容性高和体系稳定性的新型建库方法及体系。
8.为实现上述目的,本技术具体采用的技术方案如下:
9.本技术首先提供一种使宏基因组文库片段大小集中的文库构建方法,其特征在于,所述方法包括:
10.1)核酸提取:取感染宏基因组样本进行核酸提取;
11.2)文库构建:a、核酸片段化;b、接头连接;c、接头产物纯化;d、纯化产物扩增。
12.进一步的,所述核酸提取可采用金匙1901r核酸提取和纯化试剂盒进行。
13.进一步的,所述a、核酸片段化步骤具体为:取一定起始量的核酸提取样本,加入片段化酶、eb洗脱液和反应增强液进行酶切反应。
14.进一步的,所述反应增强液终浓度为1-50nmol,所述反应增强液中包括tris-hcl、c6h5o7na3、bsa、mg(ch3coo)2.4h2o、mgcl2、cacl2、bacl2、mncl2、nacl、kcl、na2hpo4、kh2po4和nh4h2po4。
15.预测该反应增强液能够使dna构象发生变化,形成网状结构,增加与片段化酶有效碰撞的机会和让片段化打断酶保持高活性的反应环境。
16.进一步的,所述反应增强液中部分组分的浓度如下:
[0017][0018][0019]
进一步的,所述一定起始量的核酸提取样本为1-60ng的核酸提取样本;所述反应增强液终浓度为1-50nmol;所述酶切反应的温度为35-37℃,反应时间为15-20min。
[0020]
更进一步的,所述一定起始量的核酸提取样本为1-30ng的核酸提取样本;所述反应增强液终浓度为30nmol;所述酶切反应的温度为37℃,反应时间为20min。
[0021]
在一些具体的实施方式中,所述片段化步骤具体为:
[0022]
将片段化酶(fea enzyme mix-c2)使用时从冰箱取出轻弹混匀离心,于灭菌pc r管中配制如下反应:
[0023][0024]
备注:1ng≤input dna≤60ng。
[0025]
使用移液器轻轻吹打混匀,短暂离心将反应液收集至管底。
[0026]
将pcr管暂时置于冰上,在pcr仪上设置下述程序,将pcr管放入pcr仪,然后继续运行程序:
[0027][0028]
反应结束后,立即进行接头连接步骤。
[0029]
在一些具体的实施方式中,所述接头连接步骤具体为:
[0030]
将连接酶buffer解冻后混匀离心,置于冰上备用。连接酶使用时从冰箱取出轻弹混匀离心,在末端修复产物的pcr管中配制如下反应:
[0031][0032]
使用移液器轻轻吹打10次混匀(请勿振荡混匀),并短暂离心将反应液收集至管底。
[0033]
将pcr管置于pcr仪中,进行下述反应:
[0034]
热盖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
off
[0035]
20℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
15min
[0036]
4℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
hold
[0037]
反应结束后,立即进行后续步骤。
[0038]
进一步的,所述纯化产物扩增中扩增循环数为6-12个,优选10-12个;更优选的,所述扩增反应如下:
[0039][0040]
在一些具体的实施方式中,纯化产物的扩增具体为:
[0041]
配制pcr反应混合液:
[0042][0043]
按下表条件进行pcr反应:
[0044][0045][0046]
反应结束后瞬时离心将反应液收集至管底。
[0047]
进一步的,所述文库构建以金匙2102/2037病原微生物核酸检测试剂盒为基础。
[0048]
进一步的,所述文库构建方法使片段大小保持在300-400bp范围内,文库峰形稳定。
[0049]
进一步的,所述文库构建是针对二代mgi测序平台的文库构建。
[0050]
进一步的,所述感染宏基因组样本选自肺泡灌洗液、血液、痰液和脑脊液。
[0051]
本技术还提供一种宏基因组测序分析方法,包括上述任一所述的文库构建方法,并进一步包括测序和生信分析步骤。
[0052]
本技术有益的技术效果:
[0053]
1)本技术在常规酶切法文库构建的组分中加入反应增强液nb,同时通过优化建库体系中的时间、温度、ph、样本类型、核酸洗脱液、input量等,获得一种使宏基因组文库片段大小集中的文库构建方法,该方法至少具有体系兼容性高优势,同时稳定性好,无论什么样本类型或核酸类型的文库都能使文库片段稳定在200-400bp的范围内,另外还具有操作简单、成本低等优势。
[0054]
2)本技术能够提高产出数据质量:本技术构建的可以使宏基因组文库片段大小集中的方法,使文库片段大小稳定在200-400bp的范围之内,能提高文库定量的准确性,提高混样均一性、产出数据量更均一,有利于测序检出结果的解读。
附图说明
[0055]
为了更清楚地说明本技术具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本技术的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0056]
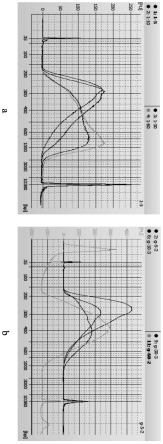
图1、不同酶切温度的文库峰形图,其中,a为对照组30℃文库峰形图,b为实验组37℃的文库峰形图;
[0057]
图2、不同样本类型、不同酶切时间的文库峰形图,其中,a为临床样本15min文库峰形,b为临床样本20min文库峰形,c为临床样本25和30min文库峰形,d为gdna 15min文库峰形,e为gdna 20min文库峰形,f为gdna 25min文库峰形;
[0058]
图3、1-60ng input量文库峰形图;
[0059]
图4、不同ph值洗液文库峰形图;
[0060]
图5、相同起始量不同溶液的文库峰形图;
[0061]
图6、不同eb量的文库峰形图;
[0062]
图7、不同含量反应增强液的文库峰形图,其中,a为1ng起始量不同增强液量的文库峰形,b为10ng起始量不同增强液量的文库峰形,c为30ng起始量不同增强液量的文库峰形,d为60ng起始量不同增强液量的文库峰形;
[0063]
图8、不同循环数的文库峰形图,其中,a为6cycles文库峰形,b为9cycles文库峰形,c为10cycles文库峰形,d为12cycles文库峰形,e为14cycles文库峰形,f为16cycles文库峰形;
[0064]
图9、原流程和新流程产出数据偏差比较。
具体实施方式
[0065]
下面将结合实施例对本技术的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本技术,而不应视为限制本技术的范围,并且所述实施例是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
[0066]
部分术语定义
[0067]
除非在下文中另有定义,本技术具体实施方式中所用的所有技术术语和科学术语的含义意图与本领域技术人员通常所理解的相同。虽然相信以下术语对于本领域技术人员
很好理解,但仍然阐述以下定义以更好地解释本技术。
[0068]
如本技术中所使用,术语“包括”、“包含”、“具有”、“含有”或“涉及”为包含性的(inclusive)或开放式的,且不排除其它未列举的元素或方法步骤。术语“由
…
组成”被认为是术语“包含”的优选实施方案。如果在下文中某一组被定义为包含至少一定数目的实施方案,这也应被理解为揭示了一个优选地仅由这些实施方案组成的组。
[0069]
本技术中的术语“大约”、“大体”表示本领域技术人员能够理解的仍可保证论及特征的技术效果的准确度区间。该术语通常表示偏离指示数值的
±
10%,优选
±
5%。在提及单数形式名词时使用的不定冠词或定冠词例如“一个”或“一种”,“所述”,包括该名词的复数形式。
[0070]
此外,说明书和权利要求书中的术语第一、第二、第三、(a)、(b)、(c)以及诸如此类,是用于区分相似的元素,不是描述顺序或时间次序必须的。应理解,如此应用的术语在适当的环境下可互换,并且本技术描述的实施方案能以不同于本技术描述或举例说明的其它顺序实施。
[0071]
本技术的方法,从影响文库片段大小的因素入手进行筛选:1.从酶学特性角度出发选择酶适宜的反应温度,来选择对应温度下的反应时间;2.从酶活性角度出发研究建库流程中可能影响酶活性的因素:反应环境ph、温度,根据核酸稳定性、试剂背景及稳定来源,选择合适的核酸洗脱液;3.研究选择的洗脱液在反应体系中的含量变化对文库片段大小的影响;4.解决洗脱液对片段化反应的影响,筛选反应增强液并确立其在反应体系中的最适浓度。
[0072]
以下结合具体的实施例来证明本技术所产生的技术效果。
[0073]
实施例1本技术体系优化
[0074]
宏基因组检测过程中,文库片段大小会影响文库定量结果的准确性;华大测序平台文库的dnb制备所需的体积是根据文库片段的大小来计算的,v=80*n*2*327/c*10^6(n表示文库总片段长度,单个脱氧核糖核苷酸的平均分子量为327,c表示混合文库浓度ng/μl,dsdna文库投入量为80fmol),若临床文库片段大小有较大差异,则导致dnb体积有偏差,有效的dnb的量也会出现偏差,数据产出不均一,可能会有漏检的风险。鉴于此,本实施例从影响文库片段大小的因素,包括时间、温度、核酸洗脱液(ph)、样本类型、input量、反应增强液、循环数等出发,以每一个条件作为单因素可变量进行文库峰形稳定性的优化。
[0075]
具体的,以文库构建体系条件不改变作为阴性对照,通过建立包括如下6方面的体系优化,以期使宏基因组文库片段大小集中。
[0076]
1)不同片段化温度对文库峰形的影响;
[0077]
2)不同酶切时间对文库峰形的影响;
[0078]
3)不同的建库起始量对文库峰形的影响;
[0079]
4)不同ph值的核酸洗脱液(nfw、eb、tb)对文库峰形的影响;
[0080]
4.1eb对峰形的影响;
[0081]
4.2eb含量对文库峰形的影响;
[0082]
5)反应增强液的选择和优化;
[0083]
6)循环数的调整优化。
[0084]
一、详细实验方法和步骤
[0085]
1.样本制备
[0086]
1)配置临床样本,为探索各种类型样本环境下的宏基因组建库,本技术将不同类型临床样本制成1个混合样本(血浆、脑脊液、肺泡灌洗液、痰液各1ml混成1个样本),其中除血浆外,其它3种类型的样本均使用破壁仪进行样本处理后吸取相应的体积进行混合;作为补充,本技术同时采购商品化gdna核酸样本用于部分实验的平行对照。
[0087]
2)混合后的样本按照核酸提取和纯化试剂盒说明书进行核酸提取3份,提取过程中分别用eb(elution buffer)、tb(tris盐酸buffer)、nfw(无核酸酶水)来洗脱核酸。
[0088]
表1制备的样本的核酸信息
[0089][0090]
2、建库处理
[0091]
根据设计的变量参数进行文库构建。
[0092]
3、文库片段分析
[0093]
采用agilent 2100bioanalyzer进行文库片段分析
[0094]
制胶:试剂室温平衡30min,15μl高灵敏度dna染色溶液加到高灵敏度dna胶混合物中,涡旋混匀,胶、染色液混合物全部转移至过滤管中,室温2240g(6000rpm)离心15min,弃过滤管,留胶备用。
[0095]
装胶:按照说明书,往芯片的相应位置加9μl胶,注意不要产生气泡;压胶、继续向芯片对应位置加入胶。
[0096]
加样:除了胶孔外的其它12个孔中加入5μl高灵敏度dna markers,每个样品孔不能空置,ladder的孔加入1μl dna ladder,其它11个孔中加入1μl样品,样品加到底,以防涡旋混合的时候飞溅出来。
[0097]
打开仪器,安装芯片进行检测。
[0098]
4、结果分析
[0099]
1)根据文库主峰的位置及片段大小,判断文库峰形是否一致。
[0100]
2)计算改变文库构建条件后整run产出的cv值与未变条件时整run产出的cv值比较,查看文库产出均一性。
[0101]
3)扩增循环数与文库片段大小的关系。
[0102]
二、实验结果:
[0103]
1.以温度为变量进行研究
[0104]
实验设计如下:
[0105][0106]
用2100片段分析仪进行对照组与实验组文库片段大小的分析,回收后的高浓度文库都统一稀释到3ng/μl左右,制胶、灌胶、点样1μl、仪器运行分析。
[0107]
酶切温度变化对文库峰形的影响如图1所示,a为对照组30℃文库峰形图,b为实验组37℃的文库峰形图。根据酶学特性选择酶适宜的反应温度,可见,同样建库起始量,37℃左右温度(比如35-37℃),片段化的文库片段大小主峰300-400bp之间,文库峰形更集中,而较低温度表现较差。
[0108]
2.以不同酶切时间为变量进行研究
[0109]
实验设计如下:
[0110][0111][0112]
酶切时间变化对文库峰形的影响如图2所示,a-c分别代表临床样本在15min、20min、25和30min酶切条件下的文库峰形(图c中同时包含25min和30min下的峰形),d-e代表gdna样本在15min、20min和25min酶切条件下的文库峰形。图2可见,无论是临床样本还是商品化的gdna核酸样本,在37℃条件下片段化,随着反应时间的增加,文库片段都变小,但之后文库会出现过度扩增的大片段,整体而言15-20min(最优选20min)时文库主峰片段大小在300-400bp之间,文库峰形更集中。
[0113]
3.以不同dna起始量为变量研究
[0114]
实验设计如下:
[0115][0116]
针对临床样本的不同建库起始量对文库峰形的影响结果如图3所示。可见,建库起始量在1-60ng之间,随着起始量的增加,文库片段主峰逐渐右移(文库片段增大),但文库主峰在300-400bp之间,文库峰形集中,超60ng后不利于峰形(60ng刚出现拖尾,箭头处),因此dna样本起始量为1-60ng,优选为1-30ng。
[0117]
4.添加不同核酸洗脱液为变量研究
[0118]
实验设计如下:
[0119][0120][0121]
体系中添加不同洗脱液对文库峰形影响如图4所示(图中仅体现eb和nfw)。不同洗脱液对应不同的ph值,可见缓冲体系中ph值对片段化酶有影响,同样量的核酸,溶解在不同ph值溶液中,不同洗脱液文库片段都分布在300-400bp之间,但eb文库片段较大,峰形分布比较宽,tb和nfw对文库峰形影响较小。
[0122]
此外,关于洗脱液的选择:首先,核酸在碱性的环境中能稳定贮存,eb相对更适合;其次,eb的洗脱效率通常是优于nfw;另外,tb通常是提取试剂盒中的洗脱组分,为不受限于提取试剂盒的选取,本技术综合选择eb溶液作为片段化过程的缓冲体系。
[0123]
4.1进一步研究eb对文库片段的影响(dna起始量为变量)
[0124]
实验设计如下:
[0125][0126]
在不同核酸起始量下,eb缓冲液对文库峰形的影响如图5所示:1ng起始量的核酸,eb影响文库的片段大小,文库峰形比较宽;30ng起始量的核酸,eb影响文库的片段大小,主峰在500bp。
[0127]
4.2进一步研究eb对文库峰形的影响(eb含量为变量)
[0128]
实验设计如下:
[0129][0130][0131]
不同eb含量对文库峰形的影响如图6所示。看得出,相同起始量的核酸,用不同体积的eb溶液稀释,在50ul的反应体系中eb含量越高,文库的峰形越宽,当反应体系中eb含量≤10ul时,文库的片段大小趋于稳定,峰形保持一致。
[0132]
综合4.1和4.2可见,eb的相对含量对文库的峰形影响非常大,这在实践中非常不利,需要进一步优化。
[0133]
5.1片段化过程中,探寻反应增强液以及以不同添加量的为变量的研究
[0134]
实验设计如下:
[0135]
本技术通过预实验筛选到一种反应增强液nb,其组分包括:tris-hcl和mg
(ch3coo)2.4h2o、mgcl2、cacl2、bacl2、mncl2、nacl、kcl、na2hpo4、kh2po4、nh4h2po4、bsa、c6h5o7na3(柠檬酸三钠)等。
[0136]
各组分的主要成分浓度见下表:
[0137]
离子名称离子终浓度c6h5o7na30.25-0.1mg/mlmg
2
10-30mmca
2
5-15mmba
2
0.05-1.5mmmn
2
0.05-1.5mmna
15-40mmk
0.1-0.5mmnh
4
0.3-0.6mmbsa0.075-0.15mg/ml
[0138]
不同添加量的为变量实验设计如下:
[0139][0140]
片段化过程中,反应增强液含量对文库峰形的影响如图7所示,其中,a为1ng起始量不同nb量的文库峰形,b为10ng起始量不同nb量的文库峰形,c为30ng起始量不同nb量的文库峰形,d为60ng起始量不同nb量的文库峰形。
[0141]
较令人惊奇的是,在建库起始量为1-60ng时,当加了一系列低浓度的反应增强液后体系不再受eb用量影响,即低浓度反应增强液加入,能够显著降低了eb对峰形的影响;尤其在体系中加入1-5ul(1-50nmol)时,最优3ul(30nmol终浓度)反应增强液时,能促进片段化的反应,使文库峰形都维持在300bp-400bp左右的一个稳定范围内。
[0142]
6.以循环数为变量研究
[0143]
实验设计如下:
[0144][0145]
扩增循环数对文库峰形的影响如图8所示,其中,a为6cycles文库峰形,b为
9cycles文库峰形,c为10cycles文库峰形,d为12cycles文库峰形,e为14cycles文库峰形,f为16cycles文库峰形。可见,随着扩增循环数的增加,文库出现过度扩增的大片段拖尾现象。在起始量1-60ng的范围内,扩增循环数为6-12cycles时(最优选10和12cycles),文库峰形稳定,片段在200-400bp之间。
[0146]
综上所述,在样本起始量为1-60ng,片段化体系中加入1-50nmol的反应增强液,酶切35-37℃左右,15-20min左右,扩增循环数为6-12cycles时文库的片段大小保持在300-400bp的范围之内,文库峰形保持稳定。
[0147]
最优选的方案为:样本起始量为1-30ng,片段化体系中加入30nmol的反应增强液,酶切37℃20min,扩增10-12cycles时,既能保证文库出库量达到华大平台上机要求,同时文库的片段大小保持在300-400bp的范围之内,文库峰形保持稳定,据此建立本技术的文库构建方法体系。
[0148]
实施例2本技术方法步骤建立
[0149]
基于上述确立最优化参数,建立本技术的文库构建和测序方法,具体如下:
[0150]
1.核酸提取纯化
[0151]
取临床样本,采用诸如商品化的金匙1901r核酸提取和纯化试剂盒进行核酸提取和纯化,获得纯化后的核酸溶液
[0152]
2.文库构建
[0153]
文库构建的基础步骤不作限制,以商品化的金匙2102/2037病原微生物核酸检测试剂盒(mgi-dna)为例。
[0154]
1)片段化&末端修复
[0155]
将片段化酶(fea enzyme mix-c2)使用时从冰箱取出轻弹混匀离心,于灭菌pc r管中配制如下反应:
[0156][0157]
备注:1ng≤input dna≤60ng;
[0158]
使用移液器轻轻吹打10次混匀,并短暂离心将反应液收集至管底。
[0159]
将pcr管暂时置于冰上,在pcr仪上设置下述程序,将pcr管放入pcr仪,然后继续运行程序:
[0160][0161]
待pcr仪反应结束后,立即进行步骤(2)。
[0162]
2)接头连接
[0163]
将连接酶buffer解冻后混匀离心,置于冰上备用。连接酶使用时从冰箱取出轻弹混匀离心,在末端修复产物的pcr管中配制如下反应:
[0164][0165]
使用移液器轻轻吹打10次混匀(请勿振荡混匀),并短暂离心将反应液收集至管底。
[0166]
将pcr管置于pcr仪中,进行下述反应:
[0167]
热盖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
off
[0168]
20℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
15min
[0169]
4℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
hold
[0170]
反应结束后,立即进行步骤(3)。
[0171]
3)接头连接产物纯化
[0172]
注:dna clean beads提前拿出涡旋震荡混匀,平衡至室温。
[0173]
吸取60μl即0.6
×
dna clean beads至100μl接头连接反应产物中,涡旋振荡或使用移液器吹打10次充分混匀。室温孵育5min。
[0174]
将pcr管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约5min),小心移除上清。
[0175]
加入200μl新鲜配制的80%乙醇漂洗磁珠,转动pcr管使磁珠穿过乙醇漂洗液3-4次,待磁珠完全吸附后小心移除上清。
[0176]
保持pcr管置于磁力架中,加入200μl新鲜配制的80%乙醇漂洗磁珠,再次转动pcr管使磁珠穿过漂洗液3-4次,待磁珠完全贴近磁条的管壁后小心移除上清。尽量吸干管内液体,有少量残留在管壁时可将离心管瞬时离心,在磁力架上分离后,用小量程的移液器将管底液体吸干。
[0177]
保持pcr管始终置于磁力架中,开盖干燥磁珠至刚刚出现龟裂。
[0178]
将pcr管从磁力架中取出,加入23μl eb洗脱,涡旋振荡或使用移液器吹打充分混匀,于室温静置5min,将pcr管短暂离心并置于磁力架上静置,待溶液澄清后吸取20μl上清至新的pcr管中,切勿触碰磁珠。停止点:连接产物纯化后可置-20℃冰箱储存。
[0179]
4)纯化产物的扩增(25min)
[0180]
在冰上配制pcr反应混合液:
[0181][0182]
注:udb-xx*:双端index文库扩增引物,xx为index序号,每个样品对应一个的index prime编号。
[0183]
移液器吹打混匀或涡旋震荡3次,每次3s,瞬时离心将反应液收集至管底。
[0184]
将步骤4.2所述pcr管置于pcr仪上,按下表的条件进行pcr反应。
[0185][0186]
反应结束后瞬时离心将反应液收集至管底。
[0187]
5)pcr产物纯化
[0188]
提前30min取出beads置于室温,使用前充分震荡混匀。
[0189]
吸取45μl即0.9x beads至50μl pcr产物中,用移液器轻轻吹打至少10次至完全混匀,最后一次应确保将吸头中所有液体及磁珠都打入离心管中。
[0190]
室温孵育5min。
[0191]
将离心管瞬时离心后置于磁力架,静置2-5min至液体澄清,用移液器小心吸取上清并丢弃。
[0192]
保持离心管置于磁力架上,加入200μl新鲜配制的80%乙醇漂洗磁珠及管壁,转动pcr管使磁珠穿过乙醇漂洗液3-4次待磁珠完全吸附后小心吸取并丢弃上清。
[0193]
重复上步,尽量吸干管内液体,有少量残留在管壁时可将离心管瞬时离心,在磁力架上分离后,用小量程的移液器将管底液体吸干。
[0194]
保持离心管置于磁力架上,打开离心管管盖,室温干燥,直至磁珠表面无反光、无开裂。
[0195]
将离心管从磁力架上取下,加入35μl eb进行dna洗脱,用移液器轻轻吹打至少10次至完全混匀。
[0196]
室温下孵育5min。
[0197]
将离心管瞬时离心后置于磁力架上,静置5min至液体澄清,将30μl上清液转移到
新的1.5ml离心管中。停止点:pcr纯化后产物,可置-20℃冰箱储存。
[0198]
3.测序和生信分析。
[0199]
mgi平台上机测序和下机数据生信分析。
[0200]
实施例3临床样本检测
[0201]
采用上述实施例确定的步骤,挑选不同类型临床研本样本进行检测,分别采用传统未优化的基础流程和本技术优化后流程体系分别建库,在mgi平台上机测序,分析整张芯片的产出和产出均一性。
[0202]
原流程结果如下表:
[0203][0204][0205]
本技术流程结果如下表和图9:
[0206][0207]
结合上表和图9可知,相同样本相同上机流程,在不同建库流程中,整张芯片的产出均一性,本技术优化后流程结果具有极其显著优势,产出偏差呈正态分布,无论是针对何种感染宏基因组样本,本技术的实际产出/理论产出值都优于未优化流程,cv值10%远小于传统流程33%,具有深远意义。
[0208]
最后应说明的是:以上各实施例仅用以说明本技术的技术方案,而非对其限制;尽管参照前述各实施例对本技术进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本技术各实施例技术方案的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。