具有glp-1诱导活性的蛋白质变体及其用途
技术领域
1.本公开内容涉及具有改善的glp-1诱导性和/或热稳定性和酶抗性的蛋白质变体,以及包含其的用于降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病的药物组合物。
背景技术:
2.食欲调节激素胰高血糖素样肽-1(glucagon-like peptide,glp-1)是由于食物摄取而从小肠分泌的激素,并且通过提高饱腹感来调节食欲,并通过诱导从胰腺分泌胰岛素来调节血糖。glp-1由l细胞分泌,所述l细胞是存在于回肠和结肠中的一种类型的肠内分泌细胞。
3.已知glp-1可用于治疗多种代谢疾病,例如糖尿病、肥胖、心脏病、脑血管疾病和动脉硬化。另外,glp-1涉及通过刺激胰腺中的葡萄糖依赖性胰岛素分泌、增强胰岛素基因表达、增强胰腺β细胞增殖、增强胰腺β细胞存活、抑制胰高血糖素分泌以及降低血糖而表现出治疗糖尿病的作用,并且涉及通过减慢胃的排空、抑制食欲、增强饱腹感以及抑制食物摄入而表现出治疗肥胖的作用。另外,据报道,其通过保护心肌细胞免受缺血的作用以及在处于心脏病发作风险中的患者中增强心脏功能的作用而表现出对心脏病的治疗作用(sokos,g.g.et al.,glucagon-like peptide-1infusion improves left ventricular ejection fraction and functional status in patients with chronic heart failure.,j.card.fail.(2006)12:694-699.;ban,k.,et al.,cardioprotective and vasodilatory actions of glucagon-like peptide-1receptor are mediated through both glucagon-like peptide-1receptor-dependent and-independent pathways,circulation(2008)117:2340-2350)。
4.同时,已知肠微生物与代谢疾病(例如,肥胖和糖尿病)深度相关,并且特别是嗜黏蛋白阿克曼氏菌(akkermansia muciniphila)菌株作为用于代谢病症(包括肥胖)的治疗剂而引起关注,因为其表现出以下作用:例如,其当施用于高脂饮食下的小鼠时降低血浆胆固醇、提高对象的能量消耗、以及引发提高的饱腹感和体重减轻(韩国专利公开no.2015-0133646、韩国专利申请公开no.2018-0053336、韩国专利no.1809172等)。
5.因此,本发明人已确定,嗜黏蛋白阿克曼氏菌提高了ucp-1因子影响褐色脂肪活性以用于产热目的,并且使用嗜黏蛋白阿克曼氏菌的参考菌株(akk;美国典型培养物保藏中心,保藏号:atcc baa-835)和从健康韩国人粪便中分离的嗜黏蛋白阿克曼氏菌snug-61027菌株(保藏号:kctc13530)诱导了小肠中食欲调节激素glp-1的表达。另外,本发明人已发现,来源于嗜黏蛋白阿克曼氏菌菌株snug-61027的b2um07蛋白(基因:amuc_1631,羧基末端蛋白酶)促进了glp-1分泌的诱导(韩国专利申请no.2019-0125670)。
6.此外,本发明人继续进行研究以改善b2um07蛋白的glp-1诱导性、热稳定性和酶抗性。作为结果,本发明人构建了b2um07蛋白的多种变体,并且确定了它们基于它们优异的glp-1诱导性、热稳定性和酶抗性而可用于降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病,并且因此完成了本发明。
技术实现要素:
7.技术目标
8.因此,本公开内容的一个目的是提供表现出优异的glp-1诱导性、热稳定性和酶抗性中的至少一种或更多种的包含seq id no:2或seq id no:4的氨基酸序列的蛋白质,以及在其氨基酸序列中包含一个或更多个氨基酸替换的蛋白质变体。
9.本公开内容的另一个目的是提供编码蛋白质变体的多核苷酸。
10.本公开内容的另一个目的是提供包含多核苷酸的载体。
11.本公开内容的另一个目的是提供包含载体的宿主细胞。
12.本公开内容的另一个目的是提供用于降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病的药物组合物,其包含蛋白质变体和可药用载体。
13.本公开内容的另一个目的是提供用于降低体重和/或体脂、抑制食欲或者改善或预防代谢疾病的食品组合物,其包含蛋白质变体。
14.技术方案
15.本发明人通过构建蛋白质变体完成了本发明,所述蛋白质变体通过将多种突变引入到b2um07蛋白中以改善glp-1诱导性、热稳定性和酶抗性而在降低体重和/或体脂、抑制食欲以及治疗、预防或改善多种代谢疾病方面表现出优异的作用。
16.本文中使用的术语“蛋白质变体”是指包含其中在野生型全长b2um07蛋白的氨基酸序列(下文seq id no:1)中一个或更多个氨基酸被替换、添加或缺失的变化的变体。在本说明书中,蛋白质变体的氨基酸编号是基于野生型全长b2um07蛋白的氨基酸序列(下文seq id no:1)的氨基酸编号来表示的。
17.[seq id no:1]
[0018]
《嗜黏蛋白阿克曼氏菌snug-61027(kbl983)b2umo7>
[0019][0020]
根据本公开内容的一个优选实施方案,本公开内容涉及包含下文seq id no:2的
氨基酸序列的蛋白质变体,其中n端的9个氨基酸被从野生型全长b2um07蛋白的氨基酸序列(seq id no:1)截短,并且六-组氨酸标签与c端连接。更优选地,本公开内容的蛋白质变体由seq id no:2的氨基酸序列组成。seq id no:2的蛋白质变体基于野生型全长b2um07蛋白的氨基酸序列(seq id no:1)的氨基酸编号以10-748-his表示。
[0021]
[seq id no:2]
[0022][0023]
作为本公开内容的一个实施方案,包含seq id no:2的氨基酸序列的蛋白质变体可通过以下构建:在amuc_1631基因中通过pcr用合适的引物对扩增编码b2um07蛋白的第10至748位氨基酸的seq id no:3的dna,随后进行本领域常规的克隆、蛋白质表达和纯化过程。
[0024]
[seq id no:3]
[0025]
[0026][0027]
另外,作为本公开内容的另一个方面,本公开内容涉及包含seq id no:4的氨基酸序列的蛋白质变体,特征在于,将seq id no:2的氨基酸序列中c端的六-组氨酸标签插入在第37与38位氨基酸之间。seq id no:4的蛋白质变体基于野生型全长b2um07蛋白的氨基酸序列(seq id no:1)的氨基酸编号以(10-37)-his-(38-748)表示。
[0028]
[seq id no:4]
[0029][0030]
另外,作为本公开内容的另一个方面,本公开内容涉及在seq id no:4的氨基酸序列中包含下表1的至少一个或更多个氨基酸替换的蛋白质变体。下表1至4中所述的氨基酸编号基于野生型全长b2um07蛋白的氨基酸序列(seq id no:1)的氨基酸编号来表示。
[0031]
[表1]
[0032][0033]
优选地,氨基酸替换可包含下表2中的至少一个或更多个氨基酸替换。
[0034]
[表2]
[0035]-c34a,c34s-c403a,c403t-s36h-m414f,m414i-a37h-v423i-g45a,g45l,g45v-r438v-k46a-t445i-r59a-g446r-k60a-a465d-v78l-n467d-k82a-k482a-k94a-s486a-r95a-a492l,a492v-k96a-a495i-m213q-r500a-a231f-a501i,a501v-a251p-k512a-t263i,t263l,t263v-r531a-d307a-a534f,a534v-k324d,k324n-k555r,-k368a-y583f,-g369a-c589a,c589s,c589t-r402s-g733a,g733v
[0036]
优选地,本公开内容的蛋白质变体包含seq id no:4的氨基酸序列,并且可包含表2的氨基酸替换中的一个氨基酸替换。另外,本公开内容的蛋白质变体包含seq id no:4的氨基酸序列,并且可包含表2的氨基酸替换中的2至5个氨基酸替换。在这种情况下,2至5个氨基酸替换可优选地包含k368a、c403a和c589a中的一个或更多个氨基酸替换。
[0037]
更优选地,本公开内容的蛋白质变体可包含下表3的氨基酸替换中的任一个。
[0038]
[表3]
[0039][0040]
更优选地,本公开内容的蛋白质变体包含seq id no:4的氨基酸序列,并且可包含c403a/c589a氨基酸替换,并且可进一步包含下表4的氨基酸替换中的至少一个或更多个。
[0041]
[表4]
[0042]-q43c-e379c-r59c-k409c-r95c-k416c-k99c-s464c-s107c-r468c-a119c-q523c-k138c-a530c-t142c-q562c-a158c-d575c-k161c-q585c-a164c-t590c-a189c-s596c-k193c-a610c-n203c-a627c-r220c-k634c-k258c-a651c-s311c-s658c-a332c-k700c-s358c-e710c-k363c-s745c
[0043]
包含seq id no:4的氨基酸序列且包含表1至3中所述的氨基酸替换以及包含表4中所述的氨基酸替换和c403a/c589a氨基酸替换的本公开内容的蛋白质变体与包含seq id no:2的氨基酸序列的蛋白质变体相比,glp-1诱导性、热稳定性和酶抗性中的一种或更多种可提高。包含表1至3中所述的氨基酸替换以及包含表4中所述的氨基酸替换和c403a/c589a氨基酸替换的本公开内容的蛋白质变体还在本公开内容范围内包括与其具有功能基本上等同的活性的功能等同物或功能衍生物。特别地,包含表1至3中所述的氨基酸替换以及包含表4中所述的氨基酸替换和c403a/c589a氨基酸替换的本公开内容的蛋白质变体与包含seq id no:2的氨基酸序列的蛋白质相比glp-1诱导性可提高约10%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、或者约70%或更多。
[0044]
另外,包含表1至3中所述的氨基酸替换以及包含表4中所述的氨基酸替换和c403a/c589a氨基酸替换的本公开内容的蛋白质变体与包含seq id no:2的氨基酸序列的蛋白质相比可表现出解链温度(tm)提高约0.2℃或更多、约0.5℃或更多、约0.8℃或更多、约1℃或更多或者约1.5℃的改善的热稳定性。
[0045]
另外,包含表1至3中所述的氨基酸替换以及包含表4中所述的氨基酸替换和c403a/c589a氨基酸替换的本公开内容的蛋白质变体可表现出改善的稳定性,即针对消化酶(例如,胰蛋白酶和糜蛋白酶)降解的酶抗性。
[0046]
本文中使用的术语“酶抗性”可表示针对体外或体内消化酶降解的稳定性。根据本公开内容的消化酶抗性可通过本领域已知的常规手段和方法来测量。
[0047]
在本公开内容的一个实施方案中,本公开内容涉及多核苷酸,其编码包含seq id no:2或seq id no:4的氨基酸序列的蛋白质变体,或者编码在seq id no:4的氨基酸序列中包含表1至3中所述的氨基酸替换的蛋白质变体以及包含表4中所述的氨基酸替换和c403a/c589a氨基酸替换的蛋白质变体。
[0048]
由于密码子的简并性或考虑到在旨在表达本公开内容的蛋白质变体的生物体中优选的密码子,编码本公开内容的蛋白质变体的多核苷酸可在不改变根据本公开内容的蛋白质变体的氨基酸序列的范围内在编码区进行多种修饰,并且可在不影响蛋白质表达的范围内在除了编码区以外的部分中进行多种改变或修饰。并且,这样的经修饰多核苷酸包括在本公开内容的范围内。编码本公开内容的蛋白质变体的多核苷酸可通过表达其的载体来提供。
[0049]
在本公开内容的一个实施方案中,本公开内容涉及载体,其包含编码本公开内容的蛋白质变体的多核苷酸。
[0050]
本文中使用的“载体”是指用于通过将编码本公开内容的蛋白质变体的多核苷酸引入到宿主细胞中来表达蛋白质变体的手段。本公开内容的载体包括所有常规载体,包括质粒、黏粒和病毒(例如,噬菌体),并且优选为质粒载体。本领域的技术人员可通过标准重组技术来构建载体。
[0051]
本公开内容的载体可包含多种调节序列。载体和表达载体还可包含提供其他功能的核酸序列以及调节转录和翻译的调节序列。
[0052]
在本公开内容的一个实施方案中,本公开内容涉及包含载体的宿主细胞。
[0053]
本文中使用的术语“宿主细胞”包括真核生物和原核生物,并且是指能够复制载体或表达由该载体编码的基因的任何可转化生物体。宿主细胞可通过载体来转染或转化,这是指其中将外源核酸分子递送或引入到宿主细胞中的过程。
[0054]
根据本公开内容的一个优选实施方案,本公开内容的宿主细胞是细菌细胞,更优选地是革兰氏阴性细菌细胞,还更优选地是大肠杆菌(e.coli)。
[0055]
在本公开内容的另一个方面中,本公开内容涉及药物组合物,其包含:含有seq id no:2或seq id no:4的氨基酸序列的蛋白质变体,或者在seq id no:4的氨基酸序列中含有表1至3中所述的氨基酸替换的蛋白质变体、以及含有表4中所述的氨基酸替换和c403a/c589a氨基酸替换的蛋白质变体;以及可药用载体。
[0056]
优选地,本公开内容的药物组合物可用于降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病。
[0057]
在本公开内容中,代谢疾病包括但不限于代谢综合征、肥胖、胰岛素抵抗、葡萄糖耐受、糖尿病、动脉硬化、血脂异常、高脂血症、高胆固醇血症、脂肪肝、心血管疾病、高血压和骨质疏松症。
[0058]
在本公开内容中,“治疗”意指预防(预防发生)、降低或减轻疾病、障碍或病症的至少一种症状或不良作用。本文中使用的“治疗”是指治疗性治疗和防止性或预防性措施二者,并且旨在预防或减慢(改善)所靶向病理病症或障碍。在本公开内容的一个实施方案中,需要治疗的对象不仅包括已经患有疾病或病症的对象,而且还包括最可能患有疾病或病症或者待预防疾病或病症的对象。
[0059]
本公开内容的药物组合物可以通过使用可药用载体和/或赋形剂根据本领域普通技术人员可容易进行的方法配制以单位剂型来制备,或者可通过并入到多剂量容器中来制备。在这种情况下,制剂可以是在油或水性介质中的溶液剂、混悬剂或乳剂,或者可以是提取物、散剂、颗粒剂、片剂或胶囊剂的形式,并且可另外包含分散剂或稳定剂。可对用于肠胃外使用的制剂进行灭菌,并且灭菌技术的一些非限制性实例包括通过抑制细菌的过滤器的
过滤、最终灭菌、无菌剂的并入、辐照、加热、真空干燥和冷冻干燥。
[0060]
本公开内容的药物组合物中包含的可药用载体通常用于制剂中,并且包括但不限于乳糖、右旋糖、蔗糖、山梨醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁和矿物油。除了上述组分之外,本公开内容的药物组合物还可包含润滑剂、润湿剂、甜味剂、矫味剂、乳化剂、助悬剂、防腐剂、杀菌剂、缓冲剂(例如,盐形式的乙酸、柠檬酸、磷酸等)。另外,本公开内容的药物组合物可被配制成冻干制剂。
[0061]
本公开内容的药物组合物可经口或肠胃外施用于对象,例如,可通过经口施用、静脉内注射、局部注射、腹膜内注射等来施用。
[0062]
本公开内容的药物组合物的合适剂量根据因素例如配制方法、施用模式、患者的年龄、体重、性别、病理状况、食物、施用时间、施用途径、排出速率和响应敏感性而变化,并且技术医师可针对所期望的治疗或预防容易地确定和开出有效剂量。根据本公开内容的一个优选实施方案,本公开内容的药物组合物的每日剂量为0.0001至100mg/kg。
[0063]
本公开内容的药物组合物可与通常用于降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病目的的另外的药剂组合施用。
[0064]
在本公开内容的另一个方面中,本公开内容涉及食品组合物,其包含含有seq id no:2或seq id no:4的氨基酸序列的蛋白质变体,或者在seq id no:4的氨基酸序列中含有表1至3中所述的氨基酸替换的蛋白质变体以及含有表4中所述的氨基酸替换和c403a/c589a氨基酸替换的蛋白质变体。
[0065]
本公开内容的食品组合物可用于降低体重和/或体脂、抑制食欲或者改善或预防代谢疾病。
[0066]
本公开内容的食品组合物可容易地用作有效用于降低体重和/或体脂、抑制食欲或者改善或预防代谢疾病的食品,例如,主要原料、辅助原料、食品添加剂、健康功能性食品或功能性食品饮料,但不限于此。
[0067]
食品组合物意指包含一种或更多种营养物的天然产品或加工产品,并且优选地意指通过一定量的加工可直接食用的状态。
[0068]
当以食品组合物的形式提供本公开内容的组合物时,本公开内容的组合物除了活性成分之外还可包含通常在食品产生期间添加的成分,例如蛋白质、碳水化合物、脂肪、营养物、调味剂和矫味剂。
[0069]
根据本公开内容的食品组合物可使用本领域中已知的方法产生,并且可与本公开内容的药物组合物包含相同重量的蛋白质变体。例如,根据本公开内容的食品组合物可包含以下量的本公开内容的蛋白质变体:总食品重量的按重量计0.001%至100%,优选按重量计1%至99%,并且在饮料的情况下,蛋白质变体可以以每100ml为0.001g至10g,优选0.01g至1g的比例被包含在内。食品中蛋白质变体的量可取决于多种因素,包括食品的容量、食品的消耗频率、食品中包含的菌株类型、食品中水分的量和/或用于食品中菌株存活的另外条件。
[0070]
在本公开内容的另一个方面中,提供了降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病的方法,并且所述方法包括向需要降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病的对象施用药学上有效量的根据本公开内容的蛋白质变体。
[0071]
预防或治疗疾病的对象包括所有动物,包括人。例如,其可以是动物例如狗、猫或小鼠,优选人。
[0072]
在本公开内容的另一个方面中,提供了本公开内容的蛋白质变体或组合物用于降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病的用途,以及本公开内容的蛋白质变体或组合物用于制备用于降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病的药物的用途。
[0073]
由于在用于预防或治疗疾病的方法中使用的药物组合物和施用方法与上述的那些相同,因此将省略对两者之间共同内容的描述。
[0074]
本公开内容在其应用中不限于在以下描述中阐述或在附图中举例说明的组分的构建和布置的细节。本公开内容能够具有其他实施方案以及能够以多种方式实践或进行。此外,本文中使用的措词和术语是出于描述的目的,而不应被认为是限制性的。本文中“包括”、“包含”或“具有”、“含有”、“构成”及其变化形式的使用意在涵盖其后列出的项目及其等同物以及另外的项目。
[0075]
除非本文中另有定义,否则与本公开内容结合使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。本公开内容的方法和技术通常是根据本领域公知的常规方法进行的。一般而言,本文中所述的与生物化学、酶学、分子和细胞生物学、微生物学、病毒学、细胞或组织培养、遗传学以及蛋白质与核化学结合使用的命名和技术是本领域公知的并且通常使用。除非另外指出,否则本公开内容的方法和技术通常根据本领域公知的常规方法进行,并如在本说明书通篇所引用和讨论的多种通用方法或者参考指南或方案中所述的进行。
[0076]
效果
[0077]
本公开内容的蛋白质变体表现出优异的glp-1诱导性、改善的热稳定性和酶抗性,并且因此可有效应用于降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病。
附图说明
[0078]
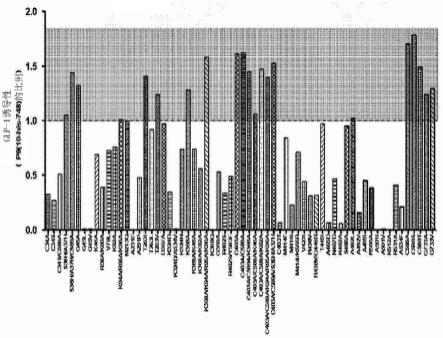
图1示出了测量蛋白质变体p9-00(1-748-his)、p9-01(10-748-his)和p9-02((10-37)-his-(38-748))的glp-1诱导性的结果。
[0079]
图2示出了通过elisa观察基于p9-02的变体的glp-1表达水平的作为与p9-02的glp-1表达水平的相对比例的结果。
[0080]
图3是与p9-02的蛋白质解链温度相比通过实时pcr观察基于p9-02的变体的蛋白质解链温度(tm)的提高和降低的结果。
[0081]
图4示出了聚乙二醇化变体p9-2ca(p9-02((10-37)-his-(38-748))c403a/c589a)以及40种基于p9-2ca的变体的sds-page结果。
[0082]
图5示出了测量基于聚乙二醇化p9-2ca的变体的glp-1诱导性的结果。
具体实施方式
[0083]
在下文中,将通过实施例更详细地描述本公开内容。这些实施例仅用于举例说明本发明,并且对于本领域普通技术人员将明显的是,本发明的范围不应被解释为受这些实施例限制。
[0084]
实施例1:基于全长p9的变体的构建以及效力的比较
[0085]
1-1:在c端用6个组氨酸标记的全长b2um07蛋白(p9-00(1-748-his)(seq id no:113))的克隆
[0086]
为了构建pet26b::p9-00(1-748-his),分别使用dna聚合酶(pfu,spd16-r250,solgent)扩增以下:使用seq id no:5和seq id no:6的引物从实施例1至2中构建的pet26b::p9-01(10-748-his)获得的第一中间体(5kb),以及使用seq id no:7和seq id no:8的引物从嗜黏蛋白阿克曼氏菌基因组dna(使用wizard基因组dna纯化试剂盒,promega)获得的第二中间体(2kb)。将扩增的第一和第二产物用dpni酶(fastdigest dpni,thermofisher scientific)处理,并随后使用gibson assembly master mix(e2611s,new england biolab)作为单个质粒合成。在合成之后,将质粒转化到dh5α感受态细胞中并平板接种在lb板上。从单个菌落中提取质粒,并通过测序确定突变,并在-20℃下储存直至使用。
[0087]
下表5示出了seq id no:5至8的引物序列。
[0088]
[表5]
[0089][0090]
1-2:p9-01(10-748-his)(seq id no:2)的克隆
[0091]
将编码b2um07蛋白的第10至748位氨基酸的dna(seq id no:3)通过pcr用包含ndei和xhoi限制酶位点序列的引物对在amuc_1631基因中进行扩增。将pet26b( )载体(novogene,usa)用作表达载体,并将扩增的pcr产物用ndei和xhoi限制酶进行处理并进行纯化。在将它们连接之后,将它们转化到dh5α感受态细胞中并平板接种在lb板上。从单个菌落中提取质粒,并通过测序确定突变,并在-20℃下储存直至使用。
[0092]
1-3:p9-02((10-37)-his-(38-748))(seq id no:4)的克隆
[0093]
为了构建pet26b::p9-02((10-37)-his-(38-748)),分别使用dna聚合酶(pfu,spd16-r250,solgent)扩增以下:使用seq id no:9和seq id no:12的引物从实施例1至2中构建的pet26b::p9-01(10-748-his)获得的第一中间体(5kb),以及使用seq id no:10和seq id no:11的引物从嗜黏蛋白阿克曼氏菌基因组dna(使用wizard基因组dna纯化试剂盒,promega)获得的第二中间体(2kb)。将扩增的第一和第二产物用dpni酶(fastdigest dpni,thermofisher scientific)处理,并随后使用gibson assembly master mix(e2611s,new england biolab)作为单个质粒合成。在合成之后,将质粒转化到dh5α感受态细胞中并平板接种在lb板上。从单个菌落中提取质粒,并通过测序确定突变,并在-20℃下储存直至使用。
[0094]
下表6示出了seq id no:9至12的引物序列。
[0095]
[表6]
[0096][0097]
实施例2:基于全长p9的变体的表达和纯化
[0098]
为了制备lb培养基,将约400ml dw和磁棒放置在干净的烧杯中。将12.5g的lb肉汤(bd difco
tm lb肉汤,miller)放置在烧杯中并在搅拌的同时使其溶解。将溶液转移至量筒,并使用dw调节体积至500ml。将500ml的溶液转移至1l烧瓶,将烧瓶的顶部用铝箔覆盖,并通过高压灭菌(121℃,15分钟)对烧瓶进行灭菌。在使用之前冷却至低于40℃并添加500μl的40mg/ml卡那霉素储备液。
[0099]
将实施例1中获得的适合于表达p9-00、p9-01和p9-02的各表达质粒转化到大肠杆菌中,并将携带各表达质粒的经转化大肠杆菌的单个或多个菌落接种到25ml lb培养基中(补充有40μg/ml卡那霉素)。将其在30℃下在以200rpm摇动的情况下进行孵育,直至od
600
达到约1.0。
[0100]
将接种有细菌的25ml lb培养基转移至包含500ml lb培养基的1l烧瓶中。将其在30℃下在以200rpm摇动的情况下进行孵育,直至od
600
达到0.7至0.8。为了诱导蛋白质表达,添加250μl的1m异丙基β-d-1-硫代半乳糖吡喃糖苷(iptg)储备液,并将其在30℃下在以200rpm摇动的情况下孵育4小时。在此之后,通过离心(6000g,20分钟)收获细胞。将细胞沉淀在-80℃下储存直至使用。
[0101]
为了制备大肠杆菌的细胞裂解物以用于ni-nta色谱,将收获的细胞沉淀重悬于40ml的裂解缓冲液中(补充有2mm 2-巯基乙醇的1
×
pbs(20
×
pbs稀释液,biosesang)),并转移至100ml玻璃烧杯中。将声波仪的探头置于烧杯的底部上方1cm处。将细胞悬液在冰上通过20khz/1秒的短脉冲(脉冲开,45μm振幅)和1秒间隔(脉冲关)的240次重复进行声处理8分钟(即,脉冲开:关=1秒:1秒,45μm振幅,8分钟处理;悬液始终保持在冰上)。然后,将其在冰上冷却8分钟,并重复声处理。然后,通过在4℃下在36,000g下离心20分钟来除去细胞碎片。
[0102]
为了进行ni-nta色谱,将0.5ml的沉降ni-nta树脂(hispur ni-nta树脂,thermofisher)添加至60ml的开放柱(由bio-rad制造)。将树脂用1柱体积(cv)的dw洗涤,并用2cv的1
×
pbs平衡。将柱用制备的细胞裂解物进行装载,并将柱在4℃下旋转30分钟。将树脂用包含20mm tris-hcl(ph 8.0)、150mm nacl、20mm咪唑和2mm 2-巯基乙醇的200ml的洗涤缓冲液洗涤。然后将经his标记的蛋白质用包含20mm tris-hcl(ph 8.0)、150mm nacl、
200mm咪唑和2mm 2-巯基乙醇的1ml的洗脱缓冲液洗脱。重复该操作10次,并将各级分收集在单独的管中。通过sds-page分析级分。
[0103]
对于蛋白质样品的透析,收集1至5个包含靶蛋白质的级分。将透析盒(thermofisher scientific slide-a-lyzer透析盒(10k mwco))用1
×
pbs水合5至10分钟。使用10ml注射器将收集的蛋白质注射到经水合的透析盒中。将烧杯用冷的1
×
pbs缓冲液填充至样品体积的至少100倍,并放置用于搅拌的磁棒。将包含蛋白质样品的透析盒添加至该烧杯中,并随后在4℃下搅拌2小时。将烧杯用新鲜的1
×
pbs缓冲液重新填充,并在4℃下搅拌过夜。使用10ml注射器获得样品。将经透析的蛋白质样品以100μl的等分试样在-80℃下保持冷冻。
[0104]
实施例3:基于全长p9的变体的glp-1表达测定
[0105]
3-1:用于体外测定和elisa测试的nci-h716细胞培养
[0106]
人肠中的人l细胞(细胞系)nci-h716(ccl-251
tm
)从atcc获取并用于本实验。作为培养基,混合rpmi1640(welgene;lm 011-51)、10% fbs和1%青霉素-链霉素并使用。在培养基中亚培养nci-h716细胞(细胞传代数小于30)之后,将其以2
×
104至6
×
104个细胞/200μl接种在经胶原蛋白包被的96孔板中,并在培养1天之后使用。
[0107]
在从板中除去培养基之后,将在实施例1和2中克隆、表达并纯化的200μl的蛋白质变体p9-00、p9-01和p9-02以0.05至0.1mg/ml的浓度在每个孔中处理3次,并在孵育2小时之后,将上清液分离并通过elisa分析以确定glp-1诱导性。针对elisa分析,使用人/小鼠/大鼠glp-1酶免疫测定试剂盒,并根据试剂盒的推荐方案进行实验。
[0108]
3-2:基于全长p9的变体的glp-1诱导性的比较
[0109]
作为根据实施例3-1测量蛋白质变体p9-00、p9-01和p9-02的glp-1诱导性的结果,p9-01与p9-00相比表现出glp-1诱导性提高了约3.5倍,并且p9-02与p9-01相比表现出glp-1诱导性提高了20%或更多(参见图1)。
[0110]
实施例4:另外的基于p9-02((10-37)-his-(38-748))的变体的制备
[0111]
基于在实施例3-2中显示出最佳glp-1诱导性的p9-02,使用全质粒定点诱变方法构建了另外的变体。将在实施例1-3中构建的编码p9-02蛋白的完整pet26b::p9-02((10-37)-his-(38-748))质粒通过pcr使用表6中示出的针对各变体的互补诱变引物对进行扩增。使用了高保真pfudna聚合酶(npfu-forte,enzynomics)。将扩增的pcr产物用dpni酶(fastdigest dpni,thermofisher scientific)处理,然后转化到dh5α感受态细胞中并平板接种在lb板上。从单个菌落中提取质粒,并通过测序确定突变,并在-20℃下储存直至使用。
[0112]
下表7示出了seq id no:13至112的用于定点诱变的引物序列。
[0113]
[表7]
[0114]
[0115]
[0116]
[0117][0118]
作为确定突变的结果,确定构建了针对表8中所述的63种另外的基于p9-02的变体的质粒。
[0119]
[表8]
[0120][0121]
在上表中,由于pcr误差,获得了k324d/a534v、m414i/k555r和r438v/g446r。此外,在多种变体中,使用用于构建各相应单变体的引物通过顺序诱变构建了k368a/k46a,k368a/k82a,k368a/k94a/r95a/k96a,c403a/c589a,c403a/c589a/s36h/a37h,c403a/c589a/k46a,c403a/c589a/k82a,c403a/c589a/k94a/r95a/k96a,c403a/c589a/k368a,c589a/c34s,和c589a/s36h/a37h。
[0122]
将适合于表达各变体的质粒以与实施例2中相同的方式转化到大肠杆菌中以表达各变体,并将各变体以与实施例2中相同的方式进行纯化。
[0123]
实施例5:另外的基于p9-02((10-37)-his-(38-748))的变体的glp-1诱导性的确定
[0124]
以与实施例3-1中相同的方式测量变体的glp-1诱导性,并且另外的基于p9-02的变体各自与p9-02相比glp-1的提高或降低在下表9中示出。
[0125]
[表9]
[0126]
[0127]
[0128][0129]
如上表9和图2中所示,在另外的基于p9-02的变体中,进一步包含以下突变的变体与p9-02相比具有显著改善的glp-1诱导性:
[0130]
g733a,g45a,t263i,t263v,k368a,k368a/k94a/r95a/k96a,c403a,c403a/c589a,c403a/c589a/s36h/a37h,c403a/c589a/k82a,c403a/c589a/k94a/r95a/k96a,c403a/c589a/k368a,c589a,c589a/s36h/a37h,c589s,c589t和g733v。
[0131]
实施例6:另外的基于p9-02((10-37)-his-(38-748))的变体的温度稳定性的确定
[0132]
为了确定实施例4中制备的各变体的温度稳定性,使用protein thermal shift
tm
染料试剂盒(thermofisher scientific,目录号4461146)根据制造商的方案测量各蛋白质的tm。
[0133]
为了启动蛋白质的解链反应,将protein thermal shift
tm
染料(1000
×
)通过稀释8
×
进行制备,并将反应板置于冰上。将5μl protein thermal shift
tm
缓冲液和12.5μl蛋白质样品添加至反应板中。添加2.5μl的经稀释的8
×
protein thermal shift染料,并通过上下吸移10次进行混合。将板用光黏合剂膜密封,并在1000rpm下旋转1分钟,并随后将板置于冰上。
[0134]
为了进行分析,装载上述板并使用以下设置运行实时pcr机器:每孔反应体积:20μl,模式斜坡模式:连续,谱热谱(操作1,温度14℃,2分钟,1.6℃/秒;操作2,以0.05℃/秒升高温度至温度为99℃),激发滤光片:x4(580nm),发射滤光片:m4(623nm)滤光片。
[0135]
作为实验的结果,p9-01(10-748-his)和p9-02((10-37)-his-(38-748))的tm分别在47.6℃和47.2℃下进行类似测量。
[0136]
同时,观察到在另外的基于p9-02的变体中,与p9-02相比包含g733a、s36h/a37h、k94a/r95a/k96a、m213q、m414f、t445i、s486a和a492l突变的p9变体的tm改善(图3)。
[0137]
另外的基于p9-02的变体各自相对于p9-02的tm提高在下表10中示出。
[0138]
[表10]
[0139]
[0140][0141]
通过以上实验结果,发现在p9-02中进一步包含g733a、s36h/a37h、k94a/r95a/k96a、m213q、m414f、t445i、s486a和a492l突变的变体与p9-02相比显示出改善的温度稳定性。特别是,已确定了,在p9-02中进一步包含g733a突变的p9蛋白质变体的glp-1诱导性和温度稳定性二者均改善。
[0142]
实施例7:另外的基于p9-2ca(p9-02((10-37)-his-(38-748))c403a/c589a)的变体的制备
[0143]
使用在实施例4中构建的pet26b::p9-02((10-37)-his-(38-748))c403a/c589a作为模板,使用与实施例4相同的方法构建另外的变体。
[0144]
下表11示出了seq id no:114至193的用于定点诱变的引物序列(以5
’‑
》3’方向)。
[0145]
[表11]
[0146]
[0147]
[0148][0149]
作为结果,确定构建了针对表12中所述的40种另外的基于p9-2ca的变体的质粒。
[0150]
[表12]
[0151][0152]
如下用适合于表达各变体的质粒转化大肠杆菌,以表达和纯化各变体。将菌落接种到补充有34μg/ml氯霉素和50μg/ml卡那霉素的10ml的tb培养基中,以制备携带用于表达另外的基于p9-2ca的变体的质粒的大肠杆菌bl21(de3)新鲜培养物。将10ml的培养物接种到补充有0.5%(w/v)甘油、0.05%(w/v)葡萄糖、0.4%(w/v)乳糖、34μg/ml氯霉素和50μg/ml卡那霉素的500ml的tb培养基中。将细胞在25℃下在以200rpm摇动的情况下孵育16至18小时,直至od
600
值达到4.0。在此之后,通过离心(6000g,20分钟)收获细胞,并将细胞沉淀在《-60℃下冷冻直至使用。
[0153]
将细胞重悬于经冷却的包含1
×
pbs(20
×
pbs稀释液,biosesang)和2mm 2-巯基乙醇的50ml裂解缓冲液中,并以与实施例2中相同的方式进行声处理(扩增40%)。在此之后,将样品冷却5分钟,重复声处理操作。然后,通过在4℃下在20,000g下离心20分钟来除去细胞碎片。
[0154]
将41种p9变体(p9-2ca变体和40种另外的基于p9-2ca的变体)通过ni-nta和阴离子交换色谱进行纯化。
[0155]
首先,为了进行ni-nta色谱,制备了用裂解缓冲液平衡的包含2ml ni-nta sepharose树脂的开放柱。将制备的柱用细胞裂解物进行装载,并旋转30至60分钟。将树脂用200ml洗涤缓冲液1[补充有150mm nacl、15mm咪唑(ph 8.0)和2mm 2-巯基乙醇的20mm tris-hcl(ph 8.0)缓冲液]洗涤。在此之后,将树脂用50ml洗涤缓冲液2[补充有15mm咪唑(ph 8.0)和2mm 2-巯基乙醇的20mm tris-hcl(ph 8.0)缓冲液]洗涤。然后将经his标记的
蛋白质用25ml洗脱缓冲液(补充有200mm咪唑和2mm 2-巯基乙醇的20mm tris-hcl缓冲液,ph 7.0)洗脱。
[0156]
然后,收集洗脱的经his标记的蛋白质,并在以下条件下进行阴离子交换色谱(hitrap q hp 5ml)。
[0157]
q-a缓冲液:20mm tris-hcl、1mm cacl2和2mm tcep(tris(2-羧乙基)膦),ph 7。
[0158]
q-b缓冲液:20mm tris-hcl、1m nacl、1mm cacl2和2mm tcep(tris(2-羧乙基)膦),ph 7。
[0159]
流速:5ml/分钟。
[0160]
制备了用q-a缓冲液平衡的hitrap q hp(5ml)柱(由cytiva制造)。将经his标记的蛋白质样品用25ml q-a缓冲液稀释2倍,并将样品用泵装载在平衡柱上。洗脱是通过将离子强度逐渐提高至0.4m nacl(40% q-b缓冲液)开始的。收集包含纯的基于2ca的变体的级分。通过sds-page分析级分。
[0161]
在存在还原剂tcep的情况下,在以下缓冲液中使经纯化的蛋白质变体cys特异性聚乙二醇化。
[0162]
缓冲液:20mm tris-hcl、150mm nacl和2mm tcep,ph 7。
[0163]
将基于2ca的变体的浓度调节至2.4μm,并制备了包含100% dmso中5mm聚(乙二醇)甲基醚马来酰亚胺(分子量2000)(10mg/ml)的100
×
聚乙二醇化试剂。在将2.4μm变体和50μm聚乙二醇化试剂在室温下反应2小时之后,通过透析将聚乙二醇化变体的缓冲液与pbs缓冲液进行交换。
[0164]
与其他还原剂(例如dtt和2-巯基乙醇)不同,tcep是不具有硫醇基的还原剂,并且因此不与聚乙二醇化试剂的马来酰亚胺基反应。因此,通过cys-马来酰亚胺反应稳定地进行cys特异性聚乙二醇化,同时使p9变体的半胱氨酸保持在还原状态。
[0165]
聚乙二醇化的p9-2ca变体和40种基于p9-2ca的变体的sds-page结果在图4中示出。将各样品稀释至0.05mg/ml并用于细胞实验。
[0166]
实施例8:另外的聚乙二醇化的基于p9-2ca(p9-02((10-37)-his-(38-748))c403a/c589a)的变体的glp-1诱导性的测量(l-细胞)
[0167]
通过以与实施例3-1中相同的方式测量实施例7中制备的41种聚乙二醇化变体的glp-1诱导性,下表13中示出了另外的基于p9-2ca的变体各自与p9-2ca相比glp-1的提高或降低。
[0168]
[表13]
[0169]
[0170]
[0171][0172]
除了p9-01以外,所有p9变体(2ca,no.1至40)都是cys特异性聚乙二醇化的。图5中图表的x轴上的编号1至40是任意分配给p9变体的编号,并且与表13中指示的变体相同。2ca是对照蛋白质,其是用于各p9变体(no.1至40)的模板。如表13和图5中所示,作为比较聚乙二醇化p9的glp-1诱导性的结果,全部glp-1诱导性均提高。在另外的基于2ca的变体中,当将包含q43c、r59c、a189c、r220c、k258c、k363c和k700c突变的p9变体(no.1、2、12、15、16、20和38变体)聚乙二醇化时,确定了与2ca相比glp-1诱导性降低(尽管与野生型相比glp-1诱导性提高)。此外,确定了在基于2ca的另外的变体中,在包含k99c、a119c、k138c、t142c、a158c、k161c、a164c、k193c、n203c、s311c、a332c、s358c、e379c、k416c、r468c、a530c、q562c、d575c、q585c、s596c、a610c、a651c、s658c和e710c的p9变体(no.4、6、7、8、9、10、11、13、14、17、18、19、21、23、25、27、28、29、30、32、33、36、37和39变体)中效力提高,其中p值《0.01。
[0173]
工业适用性
[0174]
本公开内容涉及具有改善的glp-1诱导性和/或热稳定性和酶抗性的蛋白质变体,以及包含其的用于降低体重和/或体脂、抑制食欲或者治疗或预防代谢疾病的药物组合物。
[0175]
序列表自由文本(free text)
[0176]
附有电子文件。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
