用于检测4种鲍特菌和特异性检测百日咳鲍特菌的dna片段、引物、探针和试剂盒及应用
技术领域
1.本发明涉及微生物检测技术领域,具体涉及用于检测4种鲍特菌和特异性检测百日咳鲍特菌的dna片段、引物、探针和试剂盒及其应用。
背景技术:
2.百日咳鲍特菌(bordetella pertussis,bp)为鲍特菌属(bordetella)细菌,是一种革兰氏阴性小杆菌,是人类百日咳的病原菌,该细菌主要通过空气传播,具有高度传染性且人为唯一的宿主,能够引起急性呼吸道传染病,人群普遍易感,其中多见于婴幼儿和年龄小的儿童,是严重威胁人类健康的主要传染病之一。该细菌感染的临床表现为阵发性痉挛咳嗽、呕吐、病程通常持续数周,婴儿易并发肺炎、癫痫,从而导致死亡。百日咳鲍特菌感染的及时确诊,做到早发现早治疗对于病情控制和愈后十分重要,若要实现早发现早治疗,百日咳鲍特菌感染的早期诊断极为重要。
3.目前,百日咳鲍特菌的检测方法主要分为以下3种:
4.1、细菌分离培养法:主要分为两种,一种是咳碟法,另一种是鼻咽拭子培养法。咳碟法在病程早期,无剧烈咳嗽或年龄较小的婴儿不易获得成功。目前认为鼻咽拭培养法优于咳碟法,培养越早阳性率越高,在卡他期培养可达90%,发病第3~4周阳性率仅有50%,在阵咳时或阵咳后采样阳性率较高。该方法虽然特异性好,但敏感性受取标本前应用抗生素、取标本时发病时间长、疫苗接种等影响,培养需3~7天才能出结果,耗费周期比较长,不利于疑似患者的快速诊断和治疗,因此不利于临床的早期诊断。
5.2.血清学检测:血清学检测方法较多,分为以下几种:
6.(1)elisa:目前多采用百日咳鲍特菌毒素和丝状血凝素作为抗原来检测百日咳特异性igm抗体,阳性率达70%。该方法特异性高、快速经济,是目前诊断百日咳鲍特菌感染的可靠方法之一,但灵敏度低,且百日咳鲍特菌培养难度高,容易出现假阴性。
7.(2)蛋白印迹法:采用抗百日咳毒素单克隆抗体进行酶联斑点蛋白印迹法检测百日咳患者鼻咽分泌物中百日咳毒素,特异性高,但操作步骤复杂繁琐。
8.(3)单克隆抗体菌落印迹法:采用抗百日咳鲍特菌脂多糖和丝状血凝素单克隆抗体菌落印记elisa来检测百日咳鲍特菌,48h可在硝化纤维膜上出现清晰蓝色斑点阳性印迹反应,此方法试验周期长,检测费力耗时,不便于大规模检测和推广。
9.(4)荧光抗体法:应用鼻咽拭分泌物涂片,加上吸附荧光的高价百日咳抗血清,30min后在荧光显微镜下观察病原菌,适用于快速诊断,早期患者75%~80%阳性。但检测结果存在假阳性,所以不能代替培养法。
10.总体而言,血清学检测对病程10天左右的人群检测阳性率高,但取样周期比较长,因此应用于早期诊断相对来说比较困难,且一些具有免疫缺陷、免疫系统尚未发育完善的患儿不能对病原体产生正常的免疫应答。百日咳的免疫学检测方法常取疑似急性期与恢复期2份血清标本进行检测,取样周期比较长,且灵敏度和特异性都不高,不适用百日咳的快
速诊断。
11.3、分子生物学检测:pcr是目前直接病原体检测的首选方法,这些技术包括实时pcr、巢式pcr、多重pcr等。此外,还有等温扩增技术,包括sat、lamp等。pcr方法具有快速、灵敏、特异性强等特点,大大地提高了检测效率。
12.目前报道的能够感染人类的鲍特菌主要有4种,分别是百日咳鲍特菌、副百日咳鲍特菌、霍氏鲍特菌和支气管败血鲍特菌。如果仅基于临床症候学来进行诊断是非常困难的,无法准确判断出致病菌。现有技术针对百日咳鲍特菌鉴定的基因片段的选择主要包括is481,ptxp,is1001,reca基因等,如专利申请cn110468223a主要针对上述4种基因进行检测,以所有基因的综合检测结果来确定不同的鲍特菌;该方法的实验过程过于繁琐,且对结果判断不够明确:如样本中所有基因仅检测is481为阳性,只能判断样本为鲍特菌,不能进一步明确具体的鲍特菌。专利申请cn101875974a则是基于is481进行百日咳鲍特菌的检测。但是,is481基因对于百日咳鲍特菌检测不特异,除能够检测出百日咳鲍特菌外,与其他鲍特菌检测存在交叉,造成霍氏鲍特菌、支气管鲍特菌检测也为阳性。目前还没有针对4种不同鲍特菌的测序分型方法。
技术实现要素:
13.本发明的第一目的在于提供用于检测4种鲍特菌的dna片段和特异性引物。
14.本发明的第二目的是提供用于特异性检测百日咳鲍特菌的dna片段和特异性引物探针组。
15.本发明的第三目的是提供用于检测4种鲍特菌和特异性检测百日咳鲍特菌的试剂盒。
16.本发明的第四目的是提供上述dna片段、特异性引物、探针、试剂盒的应用。
17.具体地,本发明提供以下技术方案:
18.第一方面,本发明提供用于检测鲍特菌的dna片段,其核苷酸序列如鲍特菌基因组第2574316位至2576520位所示,基因组的参考序列号为genbank:cp011447.1。
19.本发明所述的鲍特菌为百日咳鲍特菌(bordetella pertussis)、副百日咳鲍特菌(bordetella parapertussis)、霍氏鲍特菌(bordetella holmesii)和支气管败血鲍特菌(bordetella bronchiseptica)。
20.本发明通过将ncbi数据库中大量的百日咳鲍特菌、副百日咳鲍特菌、霍氏鲍特菌和支气管败血鲍特菌的基因组进行下载并分别切割,并通过序列多重比对,找出不同鲍特菌基因组的差异区域,经反复比对,确定bp2463基因的上述区域为最佳测序分型的靶标,利用上述区域作为靶标可以实现仅利用一个靶标即可准确地区分百日咳鲍特菌、副百日咳鲍特菌、霍氏鲍特菌和支气管败血鲍特菌。
21.具体地,上述用于检测鲍特菌的dna片段为以鲍特菌的基因组dna为模板、由核苷酸序列如seq id no.1
‑
2所示的引物扩增得到。
22.第二方面,本发明提供用于检测鲍特菌的特异性引物,其核苷酸序列如seq id no.1
‑
2所示。
23.bpcx
‑
f1:seq id no 1:gatggccgctatctcatgaaac;
24.bpcx
‑
r1:seq id no 2:cagtcgaagaagctgccgatg。
25.本发明针对bp2463基因的靶标区域设计一对通用型测序引物,该测序引物具有以下优点:(1)扩增靶标长度仅260bp,属于短序列,便于扩增;(2)该测序引物设置在4种鲍特菌保守区域,属于引物序列保守,但扩增片段差异较大的区域,因此能够同时扩增4种鲍特菌的基因组,通过产物测序即可同时完成对4种鲍特菌的鉴别分型。
26.经验证,本发明提供的上述测序引物对鲍特菌标准菌株,包括百日咳鲍特菌(菌株编号:ccug48528)、副百日咳鲍特菌(菌株编号:ccug62178)、霍氏鲍特菌(菌株编号:ccug59194)和支气管败血鲍特菌(菌株编号:ccug60853)经扩增后测序,测序结果均能与对应菌株匹配,表明测序引物能够对百日咳鲍特菌、副百日咳鲍特菌、霍氏鲍特菌和支气管败血鲍特菌准确分型。
27.而且,上述测序引物经临床样本的验证,与副百日咳鲍特菌、支气管败血鲍特菌、霍氏鲍特菌、甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、eb病毒、肺炎支原体、肺炎衣原体、鼻病毒、肺炎克雷伯氏菌、流感嗜血杆菌、肺炎链球菌、人偏肺病毒、腺病毒、金黄色葡萄球菌、嗜肺军团菌、ⅰ型流感病毒、ⅱ型流感病毒、ⅲ型流感病毒,均无交叉反应,特异性良好。
28.进一步地,为能够直接特异性检测百日咳鲍特菌,而不与其他鲍特菌产生交叉,本发明利用多重荧光pcr法,通过2个百日咳鲍特菌特异性靶标实现特异性检测百日咳鲍特菌。首先,本发明通过对多重比对结果进行分析,确定以ptxa基因(单拷贝序列)和插入序列is1663基因(多拷贝序列)的特定区域作为检测靶标。针对上述检测靶标经筛选和优化最终得到检测百日咳鲍特菌为阳性,其他鲍特菌均为阴性的特异性引物探针。该特异性引物是针对百日咳鲍特菌高度保守的序列,确保不会由于百日咳鲍特菌序列型别差异导致漏检或检测灵敏度低,亦不会对其他类型的鲍特菌出现交叉反应。
29.基于上述发现,第三方面,本发明提供用于检测百日咳鲍特菌的dna片段,其包含以下dna片段中的一种或两种的组合:
30.(1)核苷酸序列如百日咳鲍特菌基因组第108157位至108357位所示,基因组的参考序列号为genbank:alh71980.1;
31.(2)核苷酸序列如百日咳鲍特菌基因组第114845位至115961位所示,基因组的参考序列号为:genbank:alh71987.1。
32.具体地,上述(1)中的dna片段为以百日咳鲍特菌的基因组dna为模板、由核苷酸序列如seq id no.3
‑
4所示的引物扩增得到。
33.上述(2)中的dna片段为以百日咳鲍特菌的基因组dna为模板、由核苷酸序列如seq id no.6
‑
7所示的引物扩增得到。
34.优选将(1)和(2)中的靶标同时进行检测,双靶标的检测进一步提高了百日咳鲍特菌检测的准确性。
35.第四方面,本发明提供用于检测百日咳鲍特菌的特异性引物探针组,其包含以下引物探针组中的一种或两种的组合:
36.(1)特异性引物的核苷酸序列如seq id no.3
‑
4所示,探针序列如seq id no.5所示;
37.(2)特异性引物的核苷酸序列如seq id no.6
‑
7所示,探针序列如seq id no.8所示。
38.上述(1)中的特异性引物探针组针对ptxa基因的靶标区域,上述(2)中的特异性引物探针组针对插入序列is1663基因的靶标区域。
39.优选将(1)和(2)中的引物探针组联合使用,双靶标的检测进一步提高了百日咳鲍特菌检测的准确性。
40.进一步地,本发明对上述特异性引物探针组进行优化,以进一步提高其检测效果。具体地,在探针中设计2个淬灭基团,与常规的仅含1个淬灭基团的taqman探针相比,本发明的含有2个淬灭基团的探针在探针完整时,荧光基团的淬灭效果更好,背景值更低,探针被水解后,产生的信号值更高,有利于提高检测的灵敏度。在此基础上,对淬灭基团的标记位置进行特异的选择,进一步提高了淬灭效果,降低了背景值。
41.优选地,上述引物探针组中,所述探针含有2个淬灭基团,其中,序列如seq id no.5所示的探针的2个淬灭基团分别位于3’末端和5’端第10位碱基。序列如seq id no.8所示的探针的2个淬灭基团分别位于3’末端和5’端第7位碱基。
42.优选地,同一探针中的2个淬灭基团为相同的淬灭基团。淬灭基团可选自bhq1、bhq2、bhq3、tamra、dabcyl、nfq中的一种。
43.所述探针中还含有1个荧光基团,所述荧光基团位于探针的5’末端。
44.以上所述的荧光基团可为选自fam、vic、rox、cy5、tet、joe、cy3、hex中的一种。
45.其中,seq id no.8序列的5’末端标记的荧光基团与seq id no.5序列的5’末端标记的荧光基团不同。
46.此外,本发明还在特异性引物序列中引入了锁核酸修饰,以增强引物对靶序列的结合强度,进一步提高了检测特异性。
47.优选地,上述特异性引物探针组中,所述特异性引物中含有锁核酸修饰,其中,序列如seq id no.3所示的引物的锁核酸修饰位于5’端第13位碱基,序列如seq id no.4所示的引物的锁核酸修饰位于5’端第17位碱基。序列如seq id no.6所示的引物的锁核酸修饰位于5’端第15位碱基,序列如seq id no.7所示的引物的锁核酸修饰位于5’端第16位碱基。
48.上述特异性引物探针组经临床样本的验证,与副百日咳鲍特菌、支气管败血鲍特菌、霍氏鲍特菌、甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、eb病毒、肺炎支原体、肺炎衣原体、鼻病毒、肺炎克雷伯氏菌、流感嗜血杆菌、肺炎链球菌、人偏肺病毒、腺病毒、金黄色葡萄球菌、嗜肺军团菌、ⅰ型流感病毒、ⅱ型流感病毒、ⅲ型流感病毒,均无交叉反应,特异性良好,且具有较高的灵敏度。
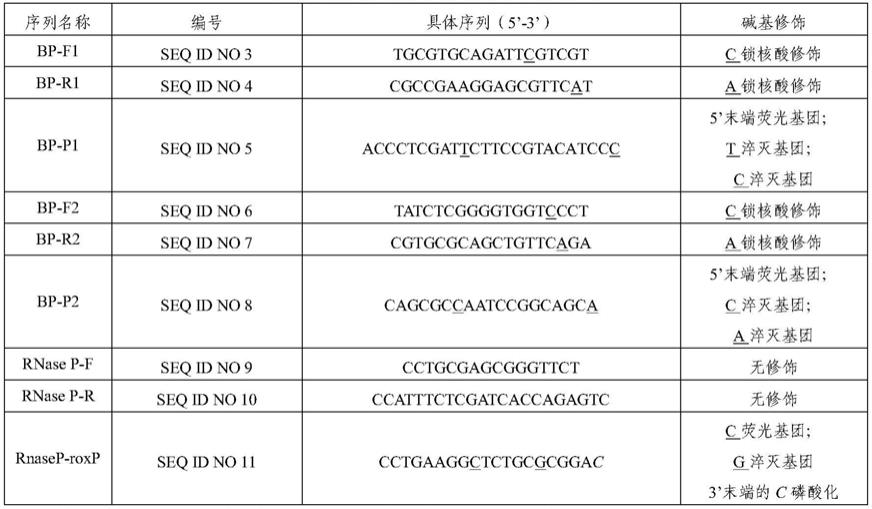
49.以上所述的特异性引物探针组的序列和修饰如表1所示。
50.表1特异性引物和探针的序列和修饰
[0051][0052]
第五方面,本发明提供所述用于检测鲍特菌的dna片段或所述特异性引物或所述用于检测百日咳鲍特菌的dna片段或所述特异性引物探针组的如下任一种应用:
[0053]
(1)在制备用于检测百日咳鲍特菌、副百日咳鲍特菌、霍氏鲍特菌和支气管败血鲍特菌的试剂盒中的应用;
[0054]
(2)在制备用于特异性检测百日咳鲍特菌的试剂盒中的应用;
[0055]
(3)在制备用于诊断百日咳的试剂盒中的应用;
[0056]
(4)在检测百日咳鲍特菌、副百日咳鲍特菌、霍氏鲍特菌和支气管败血鲍特菌中的应用;
[0057]
(5)在检测百日咳鲍特菌中的应用。
[0058]
第六方面,本发明提供用于检测鲍特菌的试剂盒,其包含用于检测鲍特菌的特异性引物,或者,其包含与用于检测百日咳鲍特菌的特异性引物探针组,或者其包含用于检测鲍特菌的特异性引物以及用于检测百日咳鲍特菌的特异性引物探针组。
[0059]
作为本发明的优选方案,所述试剂盒包含用于检测鲍特菌的特异性引物以及用于检测百日咳鲍特菌的特异性引物探针组。该试剂盒同时包含测序法的检测引物和多重荧光pcr法的检测引物和探针,在检测样本时,测序引物主要用于对疑似鲍特菌感染的测序分型,该测序引物可同时扩增百日咳鲍特菌、副百日咳鲍特菌、霍氏鲍特菌和支气管败血鲍特菌4种鲍特菌,将扩增产物测序,根据产物序列差异即可完成鲍特菌的分型;针对百日咳鲍特菌的特异性引物和探针则能够根据多重荧光pcr检测结果,对样本中的百日咳鲍特菌进行特异检测。
[0060]
优选地,所述试剂盒在进行百日咳鲍特菌的检测时,多重荧光pcr的反应体系中,seq id no.3、4、6、7所示的引物的浓度比为1:1:1:1,seq id no.3所示的引物与seq id no.5所示的探针的浓度比为2:1;seq id no.6所示的引物与seq id no.8所示的探针的浓度比为2:1。
[0061]
优选地,所述试剂盒还包含用于扩增内参基因的引物探针组,所述引物探针组中引物的序列如seq id no.9
‑
10所示,探针的序列如seq id no.11所示。
[0062]
上述内参基因为人基因组内源性内参基因。
[0063]
上述内参基因的引物探针组中,探针中含有荧光基团和淬灭基团,其中,序列如seq id no.11所示的探针的荧光基团位于5’端第9位,淬灭基团位于5’端第15位,且探针的3’末端的被磷酸化修饰。
[0064]
以上所述的荧光基团可选自fam、vic、rox、cy5、tet、joe、cy3、hex中的一种;淬灭基团可选自是bhq1、bhq2、bhq3、tamra、dabcyl、nfq中的一种。应当注意的是,多重pcr检测体系中,seq id no.11、seq id no.5、seq id no.8所示的探针的荧光基团应互不相同。
[0065]
上述探针的tm值为68.0℃
‑
70.0℃,gc值40.0%
‑
70.0%。
[0066]
上述试剂盒中,用于检测百日咳鲍特菌的两对特异性引物和两条探针以及用于扩增内参基因的一对特异性引物和一条探针可以混合液的形式存在,作为百日咳鲍特菌反应液。
[0067]
优选地,所述试剂盒还包含核酸扩增反应液,所述核酸扩增反应液包含pcr增强剂,所述pcr增强剂包含如下组分:氯化锰1
‑
3g/l,ssb单链结合蛋白0.5
‑
1.0g/l,叠氮钠0.05
‑
0.1g/l,氯化铵1
‑
2g/l。
[0068]
上述pcr增强剂能够显著提高多重荧光pcr扩增的效率。
[0069]
具体地,所述核酸扩增反应液包括如下组分:5
‑
10倍浓缩的pcr缓冲液,dn(u)tp混合液10
‑
30mm,udg酶1
‑
5u/μl,mgcl
2 150
‑
250mm,dna聚合酶3
‑
15u/μl和pcr增强剂25
‑
35%。
[0070]
上述核酸扩增反应液与用于检测鲍特菌的特异性引物(seq id no.1
‑
2)、百日咳反应液分别配合使用,用于pcr扩增。
[0071]
作为本发明的优选方案,所述试剂盒包含核酸扩增反应液、百日咳鲍特菌反应液、用于检测鲍特菌的特异性引物(seq id no.1
‑
2)、阳性对照、阴性对照。
[0072]
其中,阳性对照包括百日咳鲍特菌阳性质粒、rnase p阳性质粒和te buffer,阴性对照为0.9%的氯化钠溶液。
[0073]
以上所述的试剂盒在进行4种鲍特菌的分型检测(测序法)时,20μl的pcr反应体系包括如下组分:待测样本的核酸5μl,核酸扩增反应液16μl,seq id no.1
‑
2所示的引物4μl。
[0074]
pcr的反应程序包括如下步骤:94℃、2min;94℃、15s,55℃、15s,72℃、15s,35个循环;72℃、2min。
[0075]
以上所述的试剂盒在进行百日咳鲍特菌的特异性检测(荧光pcr法)时,20μl的pcr反应体系包括如下组分:待测样本的核酸5μl,核酸扩增反应液16μl,百日咳反应液4μl。
[0076]
多重荧光pcr的反应程序包括如下步骤:95℃、1min;95℃、1s,55℃、10s,40个循环。
[0077]
第七方面,本发明提供一种pcr增强剂,包含如下组分:氯化锰1
‑
3g/l,ssb单链结合蛋白0.5
‑
1.0g/l,叠氮钠0.05
‑
0.1g/l,氯化铵1
‑
2g/l。
[0078]
上述pcr增强剂能够显著提高多重荧光pcr扩增的效率。
[0079]
第八方面,本发明提供一种检测鲍特菌的方法,其包括如下步骤:
[0080]
(1)提取待测样本的核酸;
[0081]
(2)以待测样本的核酸为模板,采用seq id no.1
‑
2所示的引物进行pcr扩增,将得到的pcr扩增产物进行测序,根据pcr扩增产物的序列确定待测样本中是否含有鲍特菌以及含有的鲍特菌的种类;
[0082]
以待测样本的核酸为模板,采用seq id no.3
‑
4所示的引物、seq id no.5所示的探针以及seq id no.6
‑
7所示的引物、seq id no.8所示的探针进行多重荧光pcr,根据pcr产物的荧光检测结果判断待测样本中是否含有百日咳鲍特菌。
[0083]
上述步骤(2)中,20μl的测序pcr反应体系包括如下组分:待测样本的核酸5μl,核酸扩增反应液16μl,seq id no.1
‑
2所示的引物4μl。pcr的反应程序包括如下步骤:94℃、2min;94℃、15s,55℃、15s,72℃、15s,35个循环;72℃、2min。
[0084]
20μl的多重荧光pcr反应体系包括如下组分:待测样本的核酸5μl,核酸扩增反应液16μl,百日咳反应液4μl。多重荧光pcr的反应程序包括如下步骤:95℃、1min;95℃、1s,55℃、10s,40个循环。
[0085]
本发明的有益效果在于:
[0086]
本发明提供的特异性引物、探针和试剂盒不仅能够采用荧光pcr法特异性检测百日咳鲍特菌,同时能够实现对4种鲍特菌的测序分型检测。其中,用于特异性检测百日咳鲍特菌的引物探针与副百日咳鲍特菌、支气管败血鲍特菌、霍氏鲍特菌、甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、eb病毒、肺炎支原体、肺炎衣原体、鼻病毒、肺炎克雷伯氏菌、流感嗜血杆菌、肺炎链球菌、人偏肺病毒、呼吸道腺病毒、金黄色葡萄球菌、嗜肺军团菌、ⅰ型副流感病毒、ⅱ型副流感病毒、ⅲ型副流感病毒均无交叉反应,特异性强,且具有较高的灵敏度,检测限为100copies/ml;用于测序分型的靶标和引物可通过1次pcr扩增对百日咳鲍特菌、副百日咳鲍特菌、支气管败血鲍特菌和霍氏鲍特菌进行准确的分型,与甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、eb病毒、肺炎支原体、肺炎衣原体、鼻病毒、肺炎克雷伯氏菌、流感嗜血杆菌、肺炎链球菌、人偏肺病毒、呼吸道腺病毒、金黄色葡萄球菌、嗜肺军团菌、ⅰ型副流感病毒、ⅱ型副流感病毒、ⅲ型副流感病毒均无交叉反应,特异性强。
附图说明
[0087]
图1为本发明实施例1中不同靶基因上设计的引物探针的检测效果对比,其中a为bp2463靶标的筛选结果,mark代表dna marker,泳道1、2、3、4分别为百日咳鲍特菌、副百日咳鲍特菌、支气管败血鲍特菌和霍氏鲍特菌;b为ptxa基因和is1663基因的扩增曲线。
[0088]
图2为本发明实施例1中同一引物探针不同修饰方式的检测效果对比。
[0089]
图3为本发明实施例4中采用实施例2的试剂盒检测百日咳鲍特菌核酸不同浓度样本is1663基因扩增曲线图。
[0090]
图4为本发明实施例4中采用实施例2的试剂盒检测百日咳鲍特菌核酸不同浓度样本ptxa基因扩增曲线图。
[0091]
图5为本发明实施例4中采用实施例2的试剂盒检测百日咳鲍特菌核酸检测限浓度样本(100copies/ml)is1663基因扩增曲线图。
[0092]
图6为本发明实施例4中采用实施例2的试剂盒检测百日咳鲍特菌核酸检测限浓度样本(100copies/ml)ptxa基因扩增曲线图。
[0093]
图7为本发明实施例4中采用用于4种鲍特菌的测序分型检测的灵敏度电泳图。
[0094]
图8为本发明实施例4中采用用于4种鲍特菌的测序分型检测的检测限浓度样本(2
×
104copies/ml)电泳图。
[0095]
图9为本发明实施例5中采用实施例2的试剂盒检测百日咳鲍特菌的特异性评价中
is1663基因检测结果图。
[0096]
图10为本发明实施例5中采用实施例2的试剂盒检测检测百日咳鲍特菌的特异性评价中ptxa基因检测结果图。
[0097]
图11为本发明实施例5中采用用于4种鲍特菌的测序分型检测的特异性检测电泳图,其中,泳道1
‑
21依次为:百日咳鲍特菌、副百日咳鲍特菌、支气管败血鲍特菌、霍氏鲍特菌、甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、eb病毒、肺炎支原体、肺炎衣原体、鼻病毒、肺炎克雷伯氏菌、流感嗜血杆菌、肺炎链球菌、人偏肺病毒、呼吸道腺病毒、金黄色葡萄球菌、嗜肺军团菌、i型副流感病毒、ii型副流感病毒、iii型副流感病毒。
[0098]
图12为本发明实施例6中采用实施例2的试剂盒检测弱阳性样本(200copies/ml)is1663基因重复性扩增曲线图。
[0099]
图13为本发明实施例6中采用实施例2的试剂盒检测弱阳性样本(200copies/ml)ptxa基因重复性扩增曲线图。
[0100]
图14为本发明实施例7中,添加和未添加pcr增强剂的扩增曲线对比结果图。
[0101]
图15为本发明实施例8中采用实施例2的试剂盒对2例百日咳鲍特菌阳性样本(阳性样本和弱阳性样本)进行检测的结果图。
[0102]
以上图1的b、图2、图3、图4、图5、图6、图9、图10、图15的纵坐标均为
△
rn。
[0103]
图16为本发明实施例8中采用实施例2的试剂盒检测霍氏鲍特菌样本的测序结果图。
[0104]
图17为本发明实施例8中采用实施例2的试剂盒检测霍氏鲍特菌样本的测序比对结果图。
[0105]
图18为本发明实施例8中采用实施例2的试剂盒检测百日咳鲍特菌样本的测序结果图。
[0106]
图19为本发明实施例8中采用实施例2的试剂盒检测百日咳鲍特菌样本的测序比对结果图。
[0107]
图20为本发明实施例8中采用实施例2的试剂盒检测副百日咳鲍特菌样本的测序结果图。
[0108]
图21为本发明实施例8中采用实施例2的试剂盒检测副百日咳菌样本的测序比对结果图。
[0109]
图22为本发明实施例8中采用实施例2的试剂盒检测支气管败血特菌样本的测序结果图。
[0110]
图23为本发明实施例8中采用实施例2的试剂盒检测支气管败血样本的测序比对结果图。
具体实施方式
[0111]
以下实施例用于说明本发明,但不用来限制本发明的范围。
[0112]
以下实施例中,霍氏鲍特菌(菌株编号:ccug59194)、百日咳鲍特菌(菌株编号:ccug48528)、副百日咳鲍特菌(菌株编号:ccug62178)和支气管败血鲍特菌(菌株编号:ccug60853)购自瑞典的culture collection university of gothenburg(简称:ccug)。
[0113]
实施例1 检测靶标的选择和引物、探针的设计
[0114]
1、4种鲍特菌测序靶标的选择及引物设计
[0115]
从genebank下载百日咳鲍特菌、副百日咳鲍特菌、霍氏鲍特菌和支气管鲍特菌的所有基因组序列,通过多重比对和分析,找出这4种病原体基因组的差异区域,对不同差异区域进行筛选和验证,最终确定bp2463基因位于基因组第2574316位至2576520位的区域为最佳检测区域,在上述区域中存在4种鲍特菌的保守区域,也存在每种鲍特菌各自特异性的区域。
[0116]
以下列举几种筛选的靶标基因,包括最终确定的最佳的靶标基因bp2463区域以及bp3771基因,针对这些靶标基因序列设计引物和探针,并进行荧光定量pcr扩增和pcr产物电泳,结果如图1的a所示。结果显示,与bp3771基因相比,以bp2463基因区域为检测靶标具有明显更优的扩增效果。
[0117]
针对bp2463基因的靶标区域设计不同的扩增引物,经不断的筛选、优化和验证,获得了特异性和灵敏度均较高的扩增引物,其序列如seq id no.1
‑
2所示。
[0118]
2、百日咳鲍特菌特异性靶序列的选择及引物探针的设计
[0119]
从genebank下载百日咳鲍特菌、副百日咳鲍特菌、霍氏鲍特菌和支气管鲍特菌的所有基因组序列,通过多重比对和分析,找出百日咳鲍特菌与其他病原体的差异区域,对不同差异区域进行筛选和验证,最终确定以ptxa基因区域(位于基因组的第108157位至108357位)和插入序列is1663基因区域(位于基因组的第114945位至115961位)为检测靶标,ptxa基因和is1663基因均有较好的扩增曲线(图1的b)。
[0120]
针对上述靶序列设计多套引物和探针,经不断的筛选、优化和验证其对多种病原体的阴性和阳性样本核酸的检测结果,反复实验后,确定灵敏度、特异性和重复性最佳的引物和探针组合。其中,针对ptxa基因靶标区域的引物序列如seq id no.3
‑
4所示,探针序列如seq id no.5所示,针对is1663基因靶标区域的引物序列如seq id no.6
‑
7所示,探针序列如seq id no.8所示。
[0121]
对上述引物和探针的修饰进行优化,设计多种不同的修饰方式,其中部分修饰如表2所示。经不断筛选,确定了最优的修饰方式(表2中的组2):在探针中设计2个淬灭基团,在此基础上,对淬灭基团的标记位置进行特异的选择,其中,序列如seq id no.5所示的探针的2个淬灭基团分别位于3’末端和5’端第10位碱基。序列如seq id no.8所示的探针的2个淬灭基团分别位于3’末端和5’端第7位碱基。上述探针的5’末端标记有荧光基团。进一步地,在特异性引物中引入了锁核酸修饰并对锁核酸修饰的位置进行特异的选择,其中,序列如seq id no.3所示的引物的锁核酸修饰位于5’端第13位碱基,序列如seq id no.4所示的引物的锁核酸修饰位于5’端第17位碱基。序列如seq id no.6所示的引物的锁核酸修饰位于5’端第15位碱基,序列如seq id no.7所示的引物的锁核酸修饰位于5’端第16位碱基。
[0122]
利用表2中的引物和探针进行荧光pcr的检测结果如图2所示。结果表明,与组1、组3和组4相比,组2具有高灵敏度和较为规整的s型扩增曲线。
[0123]
表2特异性引物和探针的序列和修饰
[0124]
[0125][0126]
3、内参基因的选择及引物探针的设计
[0127]
选择人基因组内源性rnase p作为内参基因,针对该基因设计引物探针,其中,引物的序列如seq id no.9
‑
10所示,探针的序列如seq id no.11所示,探针的荧光基团位于5’端第9位,淬灭基团位于5’端第15位,3’末端的被磷酸化修饰(表2)。
[0128]
以上所述的引物和探针均由上海百力格生物技术有限公司合成。
[0129]
实施例2 用于鲍特菌检测的试剂盒
[0130]
本实施例提供一种用于鲍特菌检测的试剂盒,该试剂盒中包含如下组分:核酸扩增反应液、用于检测鲍特菌的特异性引物(seq id no.1
‑
2)、百日咳鲍特菌反应液、阳性对照、阴性对照。
[0131]
其中,核酸扩增反应液中组分和浓度如表3所示。
[0132]
表3核酸扩增反应液的组成
[0133]
试剂名称浓度缓冲液buffer5
×
dn(u)tp mix20mmudg2u/μlmgcl2溶液200mmdna聚合酶5u/μlpcr增强剂30%
[0134]
其中,pcr增强剂的组分和浓度如表4所示。
[0135]
表4 pcr增强剂的组成
[0136]
试剂名称浓度(g/l)氯化锰2.0ssb单链结合蛋白0.8叠氮钠0.08氯化铵1.2
[0137]
其中,百日咳鲍特菌反应液的组成如下:seq id no.3
‑
4所示的特异性引物,浓度
为400nm;seq id no.5所示的探针,浓度为100nm;seq id no.6
‑
7所示的特异性引物,浓度为300nmm;seq id no.8所示的探针,浓度为100nm。
[0138]
用于检测鲍特菌的特异性引物(seq id no.1
‑
2)的浓度为200nm。
[0139]
阳性对照为百日咳鲍特菌阳性质粒、rnase p阳性质粒和te buffer,阴性对照为0.9%的氯化钠溶液。
[0140]
实施例3 特异性检测百日咳鲍特菌和同时检测4种不同鲍特菌的方法
[0141]
本实施例提供利用实施例2的试剂盒进行百日咳鲍特菌特异性检测和4种不同鲍特菌同时检测的方法,包括如下步骤:
[0142]
(1)试剂预处理:分别取出核酸扩增反应液、百日咳反应液、测序引物(seq id no.1
‑
2)、阳性对照和阴性对照,平衡至室温,充分振荡混匀后瞬间离心;
[0143]
(2)用于鲍特菌测序分型的pcr反应液配制:将核酸扩增反应液和测序引物按比例进行配制,每个pcr反应管中20μl,其中,核酸扩增反应液16μl/人份、测序引物4μl/人份;
[0144]
(3)用于百日咳鲍特菌特异性检测的荧光pcr反应液配制:将核酸扩增反应液和百日咳反应液按比例进行配制,每个pcr反应管中20μl,其中,核酸扩增反应液16μl/人份、百日咳反应液4μl/人份;
[0145]
(4)提取待测样本的核酸;
[0146]
(5)加样:在步骤(2)配制的反应液中分别加入待测样本的核酸、阳性对照和阴性对照核酸各5μl,盖紧管盖,瞬时离心;
[0147]
(6)加样:在步骤(3)配制的反应液中分别加入待测样本的核酸、阳性对照和阴性对照核酸各5μl,盖紧管盖,瞬时离心;
[0148]
(7)扩增:将步骤(5)得到的pcr反应管放置在pcr仪中进行扩增,pcr仪的扩增检测循环参数如表5所示;扩增后,电泳检测,在260bp出有明显条带后,送去测序,根据测序结果即可完成鲍特菌的分型研究。
[0149]
表5 pcr的反应程序
[0150][0151]
(8)扩增检测:将步骤(6)得到的pcr反应管放置在荧光定量pcr仪中进行扩增检测,荧光定量pcr仪的扩增检测循环参数如表6所示,根据结果进行判读,is1663基因和ptxa基因任意1个基因检测为阳性,即可判读为百日咳鲍特菌阳性,通过内参检测判断结果的准确性。
[0152]
表6多重荧光pcr的反应程序
[0153]
[0154]
实施例4 试剂盒的灵敏度测试
[0155]
对实施例2的试剂盒用于荧光pcr法特异性检测百日咳鲍特菌的灵敏度进行分析,具体如下:
[0156]
取已知浓度的百日咳鲍特菌阳性样本的核酸,以百日咳阴性拭子样本为对照,采用数字pcr进行定量,根据定量结果,以10倍梯度稀释方式,依次稀释成106、105、104、103、102、101copies/ml,将上述样本提取核酸后加入到实施例3中所述的荧光pcr反应体系中,利用实施例3所述的方法进行检测。结果如图3和图4所示,结果表明,实施例2的试剂盒对于百日咳鲍特菌可检出浓度为102copies/ml。对于检测限浓度样本(100copies/ml)的扩增曲线如图5和图6所示。
[0157]
对实施例2的用于4种鲍特菌的测序分型检测的灵敏度进行分析,具体如下:
[0158]
取已知浓度的百日咳鲍特菌阳性样本的核酸,以百日咳阴性拭子样本为对照,采用数字pcr进行定量,根据定量结果,以10倍梯度稀释方式,依次稀释成108、107、106、105、104copies/ml,将上述样本提取核酸后加入到实施例3中所述的pcr反应体系中,利用实施例3所述的方法进行检测。4种鲍特菌的测序分型检测的灵敏度结果如图7所示。对于检测限浓度样本(2
×
104copies/ml)的扩增曲线如图8所示,结果显示,4种鲍特菌的测序分型的检测限为2
×
104copies/ml。
[0159]
实施例5 试剂盒的特异性评价
[0160]
对实施例2的试剂盒用于荧光pcr法特异性检测百日咳鲍特菌的特异性进行分析,具体如下:
[0161]
将副百日咳鲍特菌、支气管败血鲍特菌、霍氏鲍特菌、甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、eb病毒、肺炎支原体、肺炎衣原体、鼻病毒、肺炎克雷伯氏菌、流感嗜血杆菌、肺炎链球菌、人偏肺病毒、呼吸道腺病毒、金黄色葡萄球菌、嗜肺军团菌、ⅰ型副流感病毒、ⅱ型副流感病毒、ⅲ型副流感病毒进行数字pcr定量后,根据定量结果,均分别稀释至107copies/ml后分别加入到实施例3中所述的两种反应体系中,利用实施例3所述的方法进行检测。
[0162]
实施例2的试剂盒检测百日咳鲍特菌的特异性评价中is1663基因检测结果如图9所示,实施例2的试剂盒检测检测百日咳鲍特菌的特异性评价中ptxa基因检测结果如图10所示,结果表明,该试剂盒检测107copies/ml浓度的上述常见呼吸道病原体均无交叉。4种鲍特菌的测序分型试剂的特异性检测结果如图11所示,结果表明,4种鲍特菌的测序分型试剂与上述呼吸道病原体均无交叉。
[0163]
实施例6 试剂盒的重复性评价
[0164]
根据实施例4确定的检测限,将检测限附近浓度的样本(200copies/ml)加入到实施例3的荧光pcr反应体系中,利用实施例3所述的方法进行20次重复检测。
[0165]
表7重复性评价结果
[0166]
[0167]
结果如表7、图12和图13所示,重复性的cv值分别为0.22%和0.26%。结果表明,不同批次的检测结果差异很小,重复性很好。
[0168]
实施例7 pcr增强剂的作用检测
[0169]
为检测实施例2的试剂盒中pcr增强剂的作用,将正常的通用反应体系(以depc水替代pcr增强剂)和实施例3中加入了pcr增强剂的反应体系同时利用实施例3中所述的荧光pcr方法进行扩增检测和对比。
[0170]
结果如图14所示,结果表明,反应体系中加入pcr增强剂后,能够显著提高检测灵敏度及信号值。
[0171]
实施例8 试剂盒的应用
[0172]
利用实施例2的试剂盒和实施例3的检测方法对2例百日咳鲍特菌阳性样本(分别为阳性样本和弱阳性样本)进行检测,结果如图15所示,2例样本在多重荧光pcr反应体系中is1663和ptxa基因均能够实现扩增。
[0173]
利用实施例2的试剂盒和实施例3的检测方法对一批百日咳鲍特菌样本进行检测,在多重荧光pcr反应体系中is1663和ptxa基因检测准确性较好,扩增结果如表8。
[0174]
表8试剂盒检测一批百日咳样本的结果(ct值)
[0175][0176][0177]
利用实施例2的试剂盒和实施例3的检测方法对培养的霍氏鲍特菌(菌株编号:ccug59194)、百日咳鲍特菌(菌株编号:ccug48528)、副百日咳鲍特菌(菌株编号:ccug62178)和支气管败血鲍特菌(菌株编号:ccug60853)进行检测,多重荧光pcr检测的
is1663和ptxa基因除百日咳鲍特菌外均为阴性;对seq id no.1
‑
2所示引物进行pcr扩增得到的pcr产物进行测序,测序结果如图16、图18、图20、图22所示,在ncbi上进行测序结果比对,比对结果为霍氏鲍特菌、百日咳鲍特菌、副百日咳鲍特菌、支气管败血鲍特菌。(图17、图19、图21、图23)。
[0178]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。