1.本发明涉及精细化工与应用领域,特别是涉及一种槲皮素包合物共晶、中药组合物及其制备方法与应用。
背景技术:
2.槲皮素是一种常见的多功能的天然多酚黄酮类化合物,分子式为c
15h10
o7,分子量为302.25,自然界中分布广泛,普遍存在于槐米、槐花、车前子等植物的花、叶及果实中。槲皮素已经被证明具有抗菌、抗炎、抗癌、抗氧化、神经保护、肝脏保护、抗过敏等多种特性,对线粒体功能障碍方面的疾病也有一定的治疗作用,并且有研究表明,槲皮素的副作用小,对机体不会产生致癌或致死反应。槲皮素为黄色针状结晶,味苦,在水、苯、乙醚、氯仿、石油醚等溶剂中的溶解性较差,几乎不溶。槲皮素水溶性差、亲水性差且胃肠道中稳定性低,导致其口服生物利用率低,从而限制了其在医药和食品行业的应用。限于食品工业对食品配料低生产成本与高安全性的要求,通常对槲皮素采用化学和酶法修饰,合成新型的槲皮素衍生物的方法并不适用于目前的食品工业。
3.环糊精(cd)是一类环状低聚糖,是淀粉在葡萄糖基转移酶的作用下生成的,葡萄糖基转移酶通常是由芽孢杆菌属的某些种产生的。环糊精具有内疏水、外亲水的立体手性空腔。环糊精结构的空腔内侧由两圈氢原子及一圈糖苷键的氧原子组成,处于c-h键的屏蔽之下,所以环糊精内腔是疏水的,而环糊精分子的外侧由于羟基的聚集而呈亲水性。环糊精是由葡萄糖组成的,所以具有无毒、无害、无副作用,并且能被人体吸收等特性,具有淀粉的通用性质,可被用作药物的填料及粘结剂,在医药、食品、化工、材料、环保和分析化学等领域应用广泛。
技术实现要素:
4.基于此,本发明提供了一种槲皮素包合物共晶,其具有更好的水溶性与更高的溶出速率,能提高生物利用度,同时还具有明确的晶体结构和更好的稳定性。
5.本发明通过如下技术方案实现。
6.一种槲皮素包合物共晶,包括共晶配体,以及被所述共晶配体包合的药物活性成分;所述药物活性成分为槲皮素,所述共晶配体为环糊精。
7.在其中一个实施例中,所述环糊精为γ-环糊精。
8.在其中一个实施例中,槲皮素/γ环糊精包合物共晶的x射线粉末衍射图谱在下列2θ(
°
)角处具有特征衍射峰:
9.9.3
°±
0.2
°
、10.1
°±
0.2
°
、11.6
°±
0.2
°
、11.9
°±
0.2
°
、12.4
°±
0.2
°
、12.8
°±
0.2
°
、14.1
°±
0.2
°
、16.9
°±
0.2
°
、17.2
°±
0.2
°
、17.9
°±
0.2
°
、22.1
°±
0.2
°
、23.8
°±
0.2
°
与26.4
°±
0.2
°
。
10.在其中一个实施例中,槲皮素/γ环糊精包合物共晶的x射线粉末衍射图谱基本如图5所示。
11.在其中一个实施例中,槲皮素/γ环糊精包合物共晶的熔点为295℃
±
5℃。
12.在其中一个实施例中,所述槲皮素包合物共晶中,所述槲皮素的质量百分比为10.5%~11.5%。
13.本发明还提供一种如上所述的槲皮素包合物共晶的制备方法,包括如下步骤:
14.将槲皮素与第一溶剂混合,制备槲皮素溶液;
15.将环糊精与水混合,制备环糊精水溶液;
16.将所述环糊精水溶液加热至30℃~60℃,然后加入所述槲皮素溶液,制备混合液;
17.将所述混合液冷却,静置,收集析出的固体;
18.其中,所述第一溶剂为可与水混溶的有机溶剂。
19.在其中一个实施例中,所述第一溶剂选自甲醇、乙醇、乙腈、丙酮、四氢呋喃、异丙醇与乙二醇中的一种或多种。
20.在其中一个实施例中,所述混合液中,所述第一溶剂与水的体积比为3:(7~60)。
21.在其中一个实施例中,所述混合液中,所述槲皮素与所述环糊精的摩尔比为1:(1~20)。
22.在其中一个实施例中,加入所述槲皮素溶液的过程满足如下条件中的一个或多个:
23.(1)以1ml~3ml所述槲皮素溶液计,控制加入的时间为0.5min~30min;
24.(2)以100rpm~1000rpm的转速搅拌所述环糊精水溶液。
25.本发明还提供一种中药组合物,所述组合物包括如上所述的槲皮素包合物共晶,以及载体或辅料。
26.本发明还提供如上所述的槲皮素包合物共晶,或如上所述的中药组合物在制备化学制剂、药物或食品中的应用。
27.与现有技术相比较,本发明的槲皮素包合物共晶具有如下有益效果:
28.本发明通过研究并制备得到槲皮素与环糊精形成的包合物共晶。与传统的包合物相比,槲皮素与环糊精形成的包合物共晶具有更好的水溶性,以及更高的溶出速率,体现为30分钟内可完成溶出;与常规共晶制备中利用药物活性成分与共晶配体之间的氢键、静电作用等形成晶体的方式不同,本发明的包合物共晶利用了环糊精与槲皮素可形成包合物的特点,二者以主客体组装形成了包合物共晶,以增加槲皮素的水溶性。
29.进一步地,本发明融合溶剂注入法制备纳米粒和反溶剂法结晶,结合合适的加热温度,能够实现槲皮素与环糊精形成的包合物共晶的制备,且制备方法简单易行,便于推广应用。
附图说明
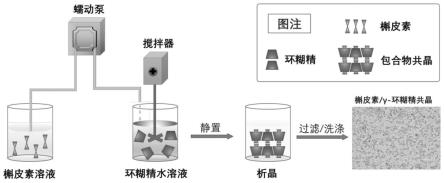
30.图1为本发明提供的槲皮素包合物共晶的制备工艺示意图;
31.图2为本发明提供的槲皮素与槲皮素包合物共晶的光学显微镜照片(标尺:50μm);
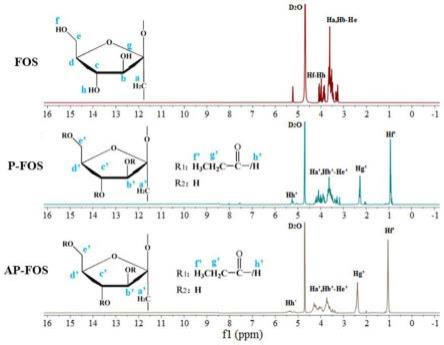
32.图3为本发明提供的槲皮素、γ-环糊精以及槲皮素/γ环糊精包合物共晶的h-nmr谱图;
33.图4为本发明提供的槲皮素、γ-环糊精以及槲皮素/γ环糊精包合物共晶的红外光谱图;其中,qt-原料药代表槲皮素,γcd-原料药代表γ-环糊精,γcd-qt代表槲皮素/γ
环糊精包合物共晶;
34.图5为本发明提供的槲皮素、γ-环糊精以及槲皮素/γ环糊精包合物共晶的xprd谱图(横坐标为角度2θ(
°
),纵坐标为强度);
35.图6为本发明提供的槲皮素、γ-环糊精以及槲皮素/γ环糊精包合物共晶的dsc图谱(横坐标为温度(℃),纵坐标为热流率(w/g));
36.图7为本发明提供槲皮素、槲皮素包合物以及槲皮素/γ环糊精包合物共晶的累积溶出曲线;其中,qt free代表槲皮素,qt包合物代表槲皮素包合物,qt共晶代表槲皮素/γ环糊精包合物共晶。
具体实施方式
37.为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施方式。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明的公开内容的理解更加透彻全面。
38.此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在发明的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。在本发明的描述中,“若干”的含义是至少一个,例如一个,两个等,除非另有明确具体的限定。
39.本发明中的词语“优选地”、“更优选地”等是指,在某些情况下可提供某些有益效果的本发明实施方案。然而,在相同的情况下或其他情况下,其他实施方案也可能是优选的。此外,对一个或多个优选实施方案的表述并不暗示其他实施方案不可用,也并非旨在将其他实施方案排除在本发明的范围之外。
40.当本文中公开一个数值范围时,上述范围视为连续,且包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值。进一步地,当范围是指整数时,包括该范围的最小值与最大值之间的每一个整数。此外,当提供多个范围描述特征或特性时,可以合并该范围。换言之,除非另有指明,否则本文中所公开之所有范围应理解为包括其中所归入的任何及所有的子范围。
41.除非另外指明,所有百分比、分数和比率都是按本发明组合物的总质量计算的。除非另外指明,有关所列成分的所有质量均给予活性物质的含量,因此它们不包括在可商购获得的材料中可能包含的溶剂或副产物。本文术语“质量百分比含量”可用符号“%”表示。除非另外指明,在本文中所有的分子量都是以道尔顿为单位表示的重均分子量。除非另外指明,在本文中所有配制和测试发生在25℃的环境。本文中“包括”、“包含”、“含”、“含有”、“具有”或其它变体意在涵盖非封闭式包括,这些术语之间不作区分。术语“包含”是指可加入不影响最终结果的其它步骤和成分。本发明的组合物和方法/工艺包含、由其组成和基本上由本文描述的必要元素和限制项以及本文描述的任一的附加的或任选的成分、组份、步骤或限制项组成。本文中术语“效能”、“性能”、“效果”、“功效”之间不作区分。
[0042]“药学上可接受的”指在合理医学判断范围内适于施用患者且与合理益处/风险比相称的那些配体、材料、组合物和/或剂型。
[0043]“药学上可接受的载体”指药学上可接受的材料、组合物或媒剂,例如液体或固体填充剂、稀释剂、赋形剂、溶剂或囊封材料。如本文所用,语言“药学上可接受的载体”包括与药物施用相容的缓冲剂、注射用无菌水、溶剂、分散介质、包衣、抗细菌剂及抗真菌剂、等渗剂及吸收延迟剂及诸如此类。在与配制物中其他成分兼容且对患者无害的意义上,每种载体必须为“药学上可接受的”。合适的实例包括但不限于:(1)糖,例如乳糖、葡萄糖及蔗糖;(2)淀粉,例如玉米淀粉、马铃薯淀粉;(3)纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素及乙酸纤维素;(4)粉状黄蓍胶;(5)麦芽;(6)明胶;(7)滑石;(8)赋形剂,例如可可脂及栓剂蜡;(9)油类,例如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油及大豆油;(10)二醇,例如丙二醇;(11)多元醇,例如甘油、山梨醇、甘露醇及聚乙二醇;(12)酯类,例如油酸乙酯及月桂酸乙酯;(13)琼脂;(14)缓冲剂,例如氢氧化镁及氢氧化铝;(15)海藻酸;(16)无热原水;(17)等渗盐水;(18)林格氏溶液;(19)乙醇;(20)磷酸盐缓冲液;及(21)药物配制物中所采用的其他无毒兼容物质。
[0044]
如本文所用,“药物”包括在在体内或体外提供生理和/或药理作用的任何药剂、化合物、组合物或混合物,且往往提供的是有益效果。所述“药物”在体内产生生理和/或药理作用的范围没有特别限制,可以为全身效果,也可以只在局部产生效果。所述“药物”的活性没有特别限制,可以为能与其它物质发生相互作用的活性物质,也可以为不发生相互作用的惰性物质。
[0045]
本发明的化合物或其药物组合物的剂型和施用方式没有特别限制。
[0046]
代表性的施用方式包括但并不限于:口服、瘤内、直肠、肠胃外(静脉内、肌肉内或皮下)注射、和局部给药。
[0047]
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性化合物与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增溶剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如,甘油;(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;(e)缓溶剂,例如石蜡;(f)吸收加速剂,例如,季胺化合物;(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,例如,高岭土;和(i)润滑剂,例如,滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种组合物中活性化合物或化合物的释放可以延迟的方式在消化道内的某一部分中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性化合物也可与上述赋形剂中的一种或多种形成微胶囊形式。
[0048]
用于口服给药的液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,具体例如,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物。除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、矫味剂和香料。如悬浮液可包含悬浮剂,具体例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物。
[0049]
用于肠胃外注射的组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,以及用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水或非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。
[0050]
用于局部给药的剂型包括软膏剂、散剂、贴剂、喷射剂和吸入剂。由活性成分在无菌条件下与药学上可接受的载体及任何防腐剂、缓冲剂,或必要时可能需要的推进剂一起混合而成。
[0051]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0052]
本发明提供了一种槲皮素包合物共晶,包括共晶配体,以及被共晶配体包合的药物活性成分;药物活性成分为槲皮素,共晶配体为环糊精。
[0053]
在一个具体的示例中,环糊精为γ-环糊精。
[0054]
在一个具体的示例中,槲皮素/γ环糊精包合物共晶的x射线粉末衍射图谱在下列2θ(
°
)角处具有特征衍射峰:
[0055]
9.3
°±
0.2
°
、10.1
°±
0.2
°
、11.6
°±
0.2
°
、11.9
°±
0.2
°
、12.4
°±
0.2
°
、12.8
°±
0.2
°
、14.1
°±
0.2
°
、16.9
°±
0.2
°
、17.2
°±
0.2
°
、17.9
°±
0.2
°
、22.1
°±
0.2
°
、23.8
°±
0.2
°
与26.4
°±
0.2
°
。
[0056]
在一个具体的示例中,槲皮素/γ环糊精包合物共晶的x射线粉末衍射图谱基本如图5所示。
[0057]
在一个具体的示例中,槲皮素/γ环糊精包合物共晶的差示扫描量热曲线基本如图6所示。
[0058]
在一个具体的示例中,槲皮素-γ环糊精包合物共晶的熔点为295℃
±
5℃。
[0059]
可以理解地,槲皮素/γ环糊精包合物共晶的熔点为290℃、291℃、292℃、293℃、294℃、295℃、296℃、297℃、298℃、299℃、300℃。
[0060]
在一个具体的示例中,槲皮素包合物共晶中,槲皮素的质量百分比为10.5%~11.5%。
[0061]
可以理解地,在本发明中,槲皮素包合物共晶中,槲皮素的质量百分比包括但不限于10.5%、10.6%、10.7%、10.8%、10.9%、11.0%、11.1%、11.2%、11.3%、11.4%、11.5%。
[0062]
在一个具体的示例中,槲皮素包合物共晶的晶体呈块状。
[0063]
结合图1,本发明还提供一种上述槲皮素包合物共晶的制备方法,包括如下步骤:
[0064]
将槲皮素与第一溶剂混合,制备槲皮素溶液;
[0065]
将环糊精与水混合,制备环糊精水溶液;
[0066]
将环糊精水溶液加热至30℃~60℃,然后加入槲皮素溶液,制备混合液;
[0067]
将混合液冷却,静置,收集析出的固体;
[0068]
其中,第一溶剂为可与水混溶的有机溶剂。
[0069]
第一溶剂一方面作为槲皮素的溶剂,可以作为药物的稀释剂和传递介质。当槲皮素溶液注入环糊精的水溶液后,溶剂可迅速与水分子发生结合,从而促进了槲皮素在水中
的分散和包合物共晶的形成;另一方面,有机溶剂可作为环糊精的不良溶剂,促进包合物共晶从溶液中析出。
[0070]
在一个具体的示例中,第一溶剂选自甲醇、乙醇、乙腈、丙酮、四氢呋喃、异丙醇与乙二醇中的一种或多种。
[0071]
在一个具体的示例中,混合液中,第一溶剂与水的体积比为3:(7~60)。
[0072]
可以理解地,在本发明中,混合液中,第一溶剂与水的体积比包括但不限于3:7、3:8、3:9、3:10、3:11、3:12、3:13、3:14、3:15、3:20、3:25、3:30、3:35、3:40、3:45、3:50、3:55、3:60。
[0073]
更具体地,把固定体积的槲皮素溶液注入环糊精水溶液中,有机溶剂与水的比例控制在一定范围内,如甲醇:水=1:20-3:7;乙醇:水=1:20-3:7;乙腈:水=1:20-3:7;丙酮:水=1:20-3:7;异丙醇:水=1:20-3:7;乙二醇:水=1:20-3:7,当槲皮素溶剂不足时可用空白溶剂补足至上述溶剂/水的比例范围内。
[0074]
在一个具体的示例中,混合液中,槲皮素与环糊精的摩尔比为1:(1~20)。
[0075]
可以理解地,在本发明中,混合液中,槲皮素与环糊精的摩尔比包括但不限于1:1、1:2、1:3、1:4、1:5、1:10、1:15、1:16、1:17、1:18、1:19、1:20。
[0076]
在一个具体的示例中,槲皮素溶液中,槲皮素的浓度为5mg/ml。
[0077]
在一个具体的示例中,环糊精水溶液中,环糊精的浓度为3mg/ml~50mg/ml。更具体地,γ-环糊精水溶液中,γ-环糊精的浓度为3mg/ml~50mg/ml。可以理解地,在本发明中,γ-环糊精水溶液中,γ-环糊精的浓度包括但不限于3mg/ml、5mg/ml、7mg/ml、10mg/ml、11mg/ml、12mg/ml、13mg/ml、14mg/ml、15mg/ml、16mg/ml、17mg/ml、18mg/ml、19mg/ml、20mg/ml、25mg/ml、30mg/ml、40mg/ml、50mg/ml。优选地,γ-环糊精水溶液中,γ-环糊精的浓度为20mg/ml。
[0078]
在一个具体的示例中,加入槲皮素溶液的过程中,以1ml~3ml所述槲皮素溶液计,控制加入的时间为0.5min~30min。
[0079]
可以理解地,在本发明中,加入槲皮素溶液的过程中,以1ml~3ml所述槲皮素溶液计,控制加入的时间包括但不限于0.5min、0.6min、0.7min、0.8min、1min、1.2min、1.4min、1.5min、1.6min、1.7min、1.8min、1.9min、2min、2.1min、2.2min、2.3min、2.4min、2.5min、3min、4min、5min、6min、7min、8min、10min、15min、20min、25min、30min。优选地,控制加入的时间为3min。
[0080]
在一个具体的示例中,加入槲皮素溶液的过程中,以100rpm~1000rpm的转速搅拌环糊精水溶液。
[0081]
可以理解地,在本发明中,加入槲皮素溶液的过程中,搅拌环糊精水溶液的转速包括但不限于100rpm、200rpm、300rpm、400rpm、500rpm、600rpm、700rpm、800rpm、900rpm、1000rpm。
[0082]
在一个具体的示例中,将混合液冷却至4℃~30℃。
[0083]
在一个具体的示例中,静置4小时~72小时。
[0084]
在一个具体的示例中,收集析出的固体后还包括如下步骤:
[0085]
将析出的固体抽滤,用冰水或预冷的析晶溶剂洗涤1次~3次,收集白色固体;然后将白色固体置于30℃~60℃条件下干燥1小时~24小时。
[0086]
本发明还提供一种中药组合物,中药组合物包括上述槲皮素包合物共晶,以及载体或辅料。
[0087]
在一个具体的示例中,载体或辅料为药学上可接受的载体或药学上可接受的辅料。
[0088]
本发明还提供上述槲皮素包合物共晶,或上述中药组合物在制备化学制剂、药物或食品中的应用。
[0089]
以下结合具体实施例对本发明的槲皮素包合物共晶及其制备方法做进一步详细的说明。以下实施例中所用的原料,如无特别说明,均为市售产品。
[0090]
实施例1
[0091]
本实施例提供一种槲皮素包合物共晶,具体制备过程如下:
[0092]
(1)分别配制γ-环糊精的水溶液与槲皮素溶液。其中槲皮素的溶剂为甲醇,其浓度为5mg/ml,γ-环糊精的浓度为15mg/ml。
[0093]
(2)把环糊精水溶液加热至50℃;在300rpm搅拌条件下,把1ml的槲皮素溶液注入7ml环糊精水溶液中,控制加入时间为2分钟,另加2ml甲醇,继续搅拌3分钟。
[0094]
(3)停止加热和搅拌,将槲皮素与环糊精的混合溶液冷却至15℃;放置6小时,待溶液中晶体析出完全。
[0095]
(4)抽滤得到白色固体,用4℃的水洗涤3次;然后将产品置于55℃条件下干燥12小时,即可得到白色粉末为槲皮素与环糊精形成的包合物共晶。产品以槲皮素计,收率为80%。
[0096]
对上述实施例1制备得到的槲皮素包合物共晶进行表征,包括晶体形貌、h-nmr、红外光谱、x射线粉末衍射(xrd)以及差示扫描量热(dsc),表征结果具体如下:
[0097]
(1)晶体形貌
[0098]
将上述实施例1制备得到的包合物共晶置于载玻片上,于光学显微镜下(10
×
20)观察和记录各样品的形态,槲皮素药物在相同条件下(不含环糊精)析出针状晶体,而槲皮素与γ-环糊精形成的共晶具有明确的晶习:呈透明块状,晶体约为20μm~50μm。
[0099]
(2)h-nmr
[0100]
将槲皮素、γ-环糊精以及上述实施例1制备得到的包合物共晶用d
6-dmso溶解后测定氢谱,结果如图3所示,可见包合物共晶的h-nmr数据中同时包含了槲皮素与γ-环糊精的信号,证实晶体是由两种成分组成的。
[0101]
(3)红外光谱
[0102]
槲皮素、环糊精及上述实施例1制备得到的包合物共晶的红外光谱如图4所示。其中槲皮素的特征峰在602cm-1
、637cm-1
、720cm-1
、819cm-1
、1013cm-1
、1165cm-1
、1195cm-1
、1212cm-1
、1257cm-1
、1316cm-1
、1378cm-1
、1518cm-1
、1605cm-1
;环糊精的特征峰在400-2000cm-1
之间;与二者相比,槲皮素与γ-环糊精形成的包合物共晶的红外光谱中有关槲皮素的大部分特征峰均消失,其红外光谱整体上与环糊精一致,表明药物与环糊精形成了包合物,因而结构中槲皮素的特征峰被环糊精所掩盖。
[0103]
(4)xrd
[0104]
槲皮素、γ-环糊精及上述实施例1制备得到的包合物共晶的xprd图谱如图5所示。其中上述实施例1制备得到的包合物共晶的xrd衍射峰在9.3
°±
0.2
°
、10.1
°±
0.2
°
、11.6
°
±
0.2
°
、11.9
°±
0.2
°
、12.4
°±
0.2
°
、12.8
°±
0.2
°
、14.1
°±
0.2
°
、16.9
°±
0.2
°
、17.2
°±
0.2
°
、17.9
°±
0.2
°
、22.1
°±
0.2
°
、23.8
°±
0.2
°
与26.4
°±
0.2
°
,其晶体xprd的特征衍射峰与γ-环糊精完全不同,表明不是简单的物理混合,而是形成了新的晶型,并且hnmr结果显示该晶体同时包含环糊精和槲皮素形成,因此可确定为槲皮素-γ环糊精共晶。
[0105]
(5)dsc
[0106]
槲皮素、γ-环糊精与上述实施例1制备得到的包合物共晶的dsc(dsc测定的升温速率为10k/min),图谱如图6所示。槲皮素的熔点为321℃,在与γ-环糊精形成共晶之后,其包合物共晶的熔点为295℃。这是由于γ-环糊精的熔点比游离槲皮素低,因此形成的共晶熔点略有降低。
[0107]
对槲皮素、槲皮素包合物与上述实施例1制备得到的槲皮素包合物共晶进行溶出累积曲线测定实验,结果如下:
[0108]
槲皮素、槲皮素包合物以及槲皮素-γ环糊精包合物共晶的溶出累积曲线图谱如图7所示,可见无论是人工肠液还是人工胃液,槲皮素-γ环糊精包合物共晶的溶出速率是最快的,30分钟内可完成溶出,其次是槲皮素包合物,游离药物槲皮素溶出速率最慢。
[0109]
对槲皮素、γ-环糊精与上述实施例1制备得到的槲皮素-γ环糊精包合物共晶进行溶解度测定实验,结果如下:
[0110]
实施例1制备得到的槲皮素包合物共晶提高了槲皮素在水中的溶解性,槲皮素在水中几乎不溶,溶解度约为8μg/ml,而槲皮素-γ环糊精包合物共晶在水中的溶解度约为60μg/ml,水溶性显著增加。
[0111]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0112]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或者有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。