1.本发明属于生物医药技术领域,具体涉及一种聚果糖丙酸酯的制备及其应用。
背景技术:
2.丙酸是一种主要的短链脂肪酸,其在人体结肠部位大量存在。丙酸具有降脂、降低胆固醇、抗炎和抗癌等生物活性。但是丙酸并不能直接利用,以丙酸盐形式被摄取的丙酸不仅没有降脂的作用,反而会导致发胖的现象。现有技术有利用菊粉与丙酸酐结合,利用酸酐法制备菊粉丙酸酯,服用菊粉丙酸酯能够让肠道释放更多的丙酸酯,增强人的饱腹感、减少热量摄入,对食用更多的食品抑制效果更强,从而减低肥胖机会。然而利用酸酐法制备的菊粉丙酸酯并不能被肠道菌群很好的降解。因此,是否有必要提供一种新的能够被肠道菌群很好的降解的菊粉丙酸酯的制备方法。
3.低聚果糖(fructo oligosaccharide,fos)是一类难消化的低聚糖,是以β-(1
→
2)糖苷键与1到3个果糖分子结合成的蔗果三糖、蔗果四糖、蔗果五糖,分子式为g-fn(n=1,2,3;g为葡萄糖;f为果糖),它属于果糖和葡萄糖构成的直链杂低聚糖。主要存在于蔬菜和水果之中。低聚果糖的合成原料有菊粉和蔗糖,以菊粉为原料合成的低聚果糖属于果-果型低聚糖,其所有单元均为果糖。以蔗糖为原料合成的低聚果糖为蔗-果型低聚糖,其非还原段为葡萄糖,其余糖环为果糖环。低聚果糖具有很多益生功效,其甜度低、性能稳定,长期服用可以降低胆固醇、改善脂质代谢、有利于肠道菌群。低聚果糖能够不被内源酶水解,能完整的到达结肠部位,被结肠部位的肠道微生物群所利用并选择性的影响肠道菌群的组成和功能。并对于高脂血症、骨质疏松症、免疫功能受损、结肠癌和溃疡性结肠炎等疾病状态产生有益的结果。
4.现有技术也公开了菊粉丙酸酯能够一定程度缓解肥胖,同时具有缓解炎症的功效。但是菊粉丙酸酯酯化度很高,难以被人类利用彻底,因此有必要制备出酯化度低的丙酸酯,进而用于肥胖的治疗。
技术实现要素:
5.本发明要解决的技术问题是克服现有肥胖治疗的不足,提供一种聚果糖丙酸酯的制备及其应用。
6.本发明的目的在于提供一种低聚果糖丙酸酯的制备方法。
7.本发明的目的还在于提供利用所述制备方法制备的聚果糖丙酸酯。
8.本发明的目的还在于提供所述聚果糖丙酸酯在缓解肥胖、改善肠道菌群、促进益生菌生长中的应用。
9.本发明的目的还在于提供所述聚果糖丙酸酯在制备治疗和/或缓解肥胖的食品或药品中的应用。
10.本发明的上述目的通过以下技术手段实现:
11.本发明提供了一种聚果糖丙酸酯的制备方法,聚果糖与丙酰化试剂经酶催化酯化
后即得聚果糖丙酸酯,所述聚果糖的聚合度小于等于60。
12.优选地,所述制备方法:将聚果糖溶液与丙酰化试剂、酶充分反应,反应液过滤,滤液纯化。
13.优选地,所述丙酰化试剂为丙酸或丙酸乙烯酯。
14.进一步优选地,所述丙酰化试剂为丙酸乙烯酯。
15.优选地,所述酶为固定化脂肪酶tlim。
16.优选地,所述聚果糖为低聚果糖或菊粉。
17.进一步优选地,所述聚果糖为低聚果糖。
18.优选地,所述聚果糖溶液的溶剂为无水吡啶或四氢呋喃。
19.进一步优选地,所述聚果糖溶液的溶剂为无水吡啶。
20.优选地,所述纯化为:将滤液浓缩并溶于乙醇后利用柱层析分离纯化。
21.进一步优选地,所述纯化为:将滤液浓缩并溶于40%~50%乙醇后利用柱层析分离纯化。
22.进一步优选地,所述柱层析为c18柱层析。
23.优选地,所述利用柱层析分离纯化具体为:将滤液浓缩液的40%~50%乙醇溶液上层析柱,分别用40~50%乙醇和70%乙醇进行洗脱,收集70%乙醇洗脱的洗脱液,干燥。
24.优选地,所述充分反应为40~45℃环境下反应24~36h。
25.进一步优选地,所述充分反应为40℃环境下反应36h。
26.利用所述制备方法制备得到的聚果糖丙酸酯也在本发明的保护范围之内。
27.所述聚果糖丙酸酯在治疗和/或缓解肥胖、改善肠道菌群、促进益生菌生长中的应用也在本发明的保护范围之内。
28.所述聚果糖丙酸酯在制备治疗和/或缓解肥胖的食品或药品中的应用也在本发明的保护范围之内。
29.优选地,所述聚果糖丙酸酯为低聚果糖丙酸酯或菊粉丙酸酯。
30.优选地,所述聚果糖丙酸酯为低聚果糖丙酸酯。
31.相比现有技术,本发明具有以下有益效果:
32.本发明利用固定化脂肪酶tlim促进丙酸乙烯酯与低聚果糖或菊粉结合形成酯键制备得到低聚果糖丙酸酯或菊粉丙酸酯(聚果糖丙酸酯),所述低聚果糖丙酸酯或菊粉丙酸酯(聚果糖丙酸酯)被肠道菌群很好的降解和利用,同时产生丙酸,能够降低细菌firmicutes与bacteroidota的比例,具有减肥的效果;可以减轻高脂饮食诱导的肥胖,还可以改善肠道菌群,促进益生菌的生长、抑制有害菌的生长。
附图说明
33.图1为本发明实施例2中低聚果糖丙酸酯红外吸收光谱图。
34.图2为本发明实施例2中低聚果糖丙酸酯飞行质谱图,其中a为fos的飞行质谱图,b为p-fos的飞行质谱图,c为ap-fos的飞行质谱图。
35.图3为本发明实施例2中低聚果糖丙酸酯的1h核磁共振分析光谱图。
36.图4为本发明实施例2中低聚果糖丙酸酯总糖含量测定结果。
37.图5为本发明实施例3中低聚果糖丙酸酯体外发酵过程中不同时间点样品的累积
产气量和ph变化情况,a为产气量变化,b为ph变化;c代表空白对照组,f代表fos对照组,pf代表p-fos组,apf代表ap-fos组,fap代表fos 正丙酸组。
38.图6为本发明实施例3中体外发酵过程中总糖含量的变化情况,c代表空白对照组,f代表fos对照组,pf代表p-fos组,apf代表ap-fos组,fap代表fos 正丙酸组。
39.图7为本发明实施例3中低聚果糖丙酸酯体外发酵液短链脂肪酸含量变化情况;a为乙酸,b为丙酸,c为丁酸,d为异丁酸,e为戊酸,f为异戊酸,g为己酸,h为总短链脂肪酸含量;图中值表示为平均值
±
sem,n=3,字母不同表示差异显著,p《0.05,ns表示差异不显著。
40.图8为本发明实施例3中发酵液微生物的beta多样性中nmds分析结果;图中1个点代表一个样本,不同组的颜色不同,样本间距离越远则表示微生物群落构成差异越大。
41.图9为本发明实施例3中低聚果糖丙酸酯体外发酵门水平微生物相对丰度和组成结构;a-f为发酵液门水平微生物相对丰度差异,g为发酵液门水平微生物相对丰度柱状图;图中值表示为平均值
±
sem,n=3,字母不同表示差异显著,p《0.05。
42.图10为本发明实施例3中低聚果糖丙酸酯体外发酵属水平微生物相对丰度和组成结构;a-h为发酵液属水平微生物相对丰度差异,i为发酵液属水平微生物相对丰度柱状图;图中值表示为平均值
±
sem,n=3,字母不同表示差异显著,p《0.05。
43.图11为本发明实施例4中b-fos对益生菌生长曲线的影响,a为p-fos对bifidobacterium lactis bb-12生长曲线的影响,b为p-fos对lactobacillus casei strain shirota生长曲线的影响。
44.图12为本发明实施例5中ibd病人体外发酵过程中不同时间点累积产气量和ph变化情况,a为产气量变化,图b为ph变化;其中con为空白对照组,f为fos对照组,fb为fos 正丙酸组,pf为p-fos组,apf为ap-fos组;r为缓解期病人粪便样本,a为活动期粪便病人样品。
45.图13为本发明实施例5中ibd病人粪便体外发酵液短链脂肪酸含量变化情况,a为乙酸,b为丙酸,c为丁酸,其中con为空白对照组,f为fos对照组,fb为fos 正丙酸组,pf为p-fos组,apf为ap-fos组;r为缓解期病人粪便样本,a为活动期粪便病人样品;图中值表示为平均值
±
sem,n=3,字母不同表示差异显著,p《0.05,ns表示差异不显著。
46.图14为本发明实施例5中ibd体外发酵过程中总糖含量的变化情况,con为空白对照组,f为fos对照组,fb为fos 正丙酸组,pf为p-fos组,apf为ap-fos组;r为缓解期病人粪便样本,a为活动期粪便病人样品。
47.图15为本发明实施例5中ibd病人粪便体外发酵的微生物门水平柱状图(a)、微生物属水平柱状图(b)、微生物属水平热图(c)。
48.图16为本发明实施例6中小鼠体重变化率。
49.图17为本发明实施例7中肥胖小鼠造模干预流程图。
50.图18为本发明实施例7中小鼠体重增长结果。
51.图19为本发明实施例7中lee’s指数结果。
52.图20为本发明实施例7中con、hfd-c、hfd-pf组小鼠形态对比。
具体实施方式
53.以下结合具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
54.除非特别说明,以下实施例所用试剂和材料均为市购。
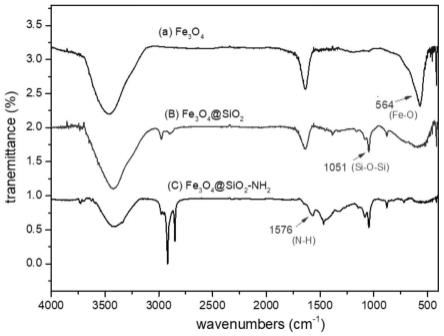
55.低聚果糖:量子高科(中国)生物股份有限公司,批号:fosp95s;
56.菊粉:维乐夫集团有限公司,批号:nanost p90。
57.实施例1聚果糖丙酸酯的制备
58.1.低聚果糖丙酸酯的制备
59.将1g的低聚果糖溶于5ml的吡啶中,利用磁力搅拌器和磁力搅拌转子(d=1cm)加快溶解,然后加入1g的固定化脂肪酶tlim、1ml的丙酸乙烯酯,得到的混合液置于40℃的油浴搅拌锅内反应36h。反应结束后,过滤,收集滤液,残留的固定化脂肪酶tlim依次利用二氯甲烷、乙醇各洗涤三次,并收集滤液,合并滤液,累计得到液体15ml,于40℃下旋蒸,得到2ml浓缩液。
60.将浓缩液与5ml 50%乙醇混合,混合后的液体通过c18柱层析分离纯化,依次用200ml 50%乙醇、200ml 70%乙醇进行洗脱,收集200ml 70%乙醇洗脱的洗脱液,旋蒸并冷冻干燥,得到低聚果糖丙酸酯(propionyl-fos,p-fos)。
61.2.菊粉丙酸酯的制备
62.将6g的菊粉溶于40ml四氢呋喃中,利用磁力搅拌器和磁力搅拌转子(d=2cm)加快溶解,然后加入10g的固定化脂肪酶tlim、5ml的丙酸乙烯酯,得到的混合液置于40℃的油浴搅拌锅内反应24h。反应结束后,过滤,收集滤液,残留的固定化脂肪酶tlim依次利用二氯甲烷、乙醇各洗涤三次,并收集滤液,合并滤液,累计得到液体100ml,于50℃下旋蒸,得到5ml浓缩液。
63.将浓缩液与10ml 40%乙醇混合,混合后的液体通过c18柱层析分离纯化,先用500ml 40%乙醇洗脱,然后利用500ml 70%乙醇与50ml正丙醇的混合液体洗脱,收集550ml 70%乙醇与正丙醇混合洗脱的洗脱液,旋蒸并冷冻干燥,得到菊粉丙酸酯(propionyl-inulin,p-inulin)。
64.对比例1利用酸酐法制备聚果糖丙酸酯的制备
65.1.低聚果糖丙酸酯
66.将1g的低聚果糖、10ml吡啶、0.8ml丙酸酐和磁力搅拌转子(d=1cm)依次加入到50ml圆底烧瓶,25℃水浴锅反应72h。待反应完成后,反应液于40℃下旋蒸得到2ml浓缩液。将浓缩液用40%乙醇溶解,然后利用c18柱层析分离纯化,依次用200ml 40%乙醇和200ml 70%乙醇进行洗脱,收集200ml70%乙醇洗脱的洗脱液,将洗脱液旋蒸冻干后,得到低聚果糖丙酸酯(ap-fos)。
67.2.菊粉丙酸酯
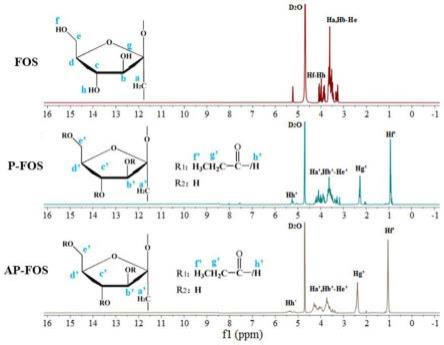
68.将1g的菊粉、10ml吡啶、0.8ml丙酸酐和磁力搅拌转子(d=1cm)依次加入到50ml圆底烧瓶,25℃水浴锅反应48h。待反应完成后,反应液于40℃下旋蒸得到2ml浓缩液。将浓缩液用40%乙醇溶解,然后利用c18柱层析分离纯化,先用500ml 40%乙醇洗脱,然后利用500ml 70%乙醇与50ml正丙醇的混合液体洗脱,收集550ml 70%乙醇与正丙醇混合洗脱的洗脱液,旋蒸并冷冻干燥,得到菊粉丙酸酯(ap-inulin)。
69.实施例2低聚果糖丙酸酯的鉴定
70.1.低聚果糖丙酸酯红外光谱鉴定
71.通过傅里叶红外光谱仪(ft-ir)对实施例1制备的p-fos、对比例1制备的ap-fos和
原料fos中的化学键进行了简单的分析鉴定和比较。
72.分别称取1mg纯化的p-fos样品、ap-fos样品,分别与100mg干燥溴化钾固体,在研磨器中研磨至面粉状。使用压片机对样品粉末进行压片,装片后使用傅里叶红外光谱仪(ft-ir),在4000~500cm-1
波数范围内扫描红外吸收光谱。
73.低聚果糖丙酸酯红外吸收光谱图如图1所示。
74.图1显示,p-fos、ap-fos和fos中均存在大量的羟基(-oh),在红外图谱上表现为3350cm-1
左右出现的伸缩振动吸收峰。2700~3000cm-1
处则是烷烃链饱和c-h的伸缩振动特征吸收峰,1600~1630cm-1
是羰基(coo-)的伸缩振动特征吸收峰,1300~1500cm-1
是弯曲振动基团(och、coh、cch);800~1200cm-1
区域是糖苷键的拉伸振动。相较于fos,p-fos和ap-fos在1731cm-1
处出现了酯键的特征吸收峰(c=o),表明丙酸成功通过酯键与低聚果糖相连,成功合成两种低聚果糖丙酸酯p-fos和ap-fos。
75.从图1中可以观察到,除了p-fos和ap-fos均在1730cm-1
处出现了酯键的特征吸收峰外,两条曲线高度相似。因此,产物中存在fos与丙酸成功结合形成的酯键,说明成功合成了低聚果糖丙酸酯p-fos和ap-fos,且ap-fos的酯化度比p-fos更高。
76.利用红外光谱鉴定,发现p-inulin和ap-inulin产物中存在inulin与丙酸成功结合形成的酯键,说明成功合成了菊粉丙酸酯。
77.2.低聚果糖丙酸酯飞行质谱分析
78.在分析之前,低聚果糖丙酸酯样品与小分子基质混合溶液加在靶盘上,待溶剂挥发后形成共结晶。参考tian等人的方法,使用基质辅助激光解吸电离飞行时间质谱(maldi-tof ms)ultraflextreme工作站分析低聚果糖丁酸酯纯化样品。使用337nm的氮激光器以正模式获得质谱,在200ns的延迟提取后,离子被加速到12kv的动能,并使用反射器模式进行检测。使用ag 50w-x4树脂将样品脱盐,并将1μl脱盐的样品加入maldi板上的1μl 10mg/ml 2,5-二羟基苯甲酸的50%乙腈溶液(v/v)中。
79.低聚果糖丙酸酯飞行质谱图如图2所示;其中a为fos的飞行质谱图,b为p-fos的飞行质谱图,c为ap-fos的飞行质谱图。
80.根据图2中a的m/z 527、689、851和1013的分子离子峰,确定其真实的分子量应分别为504、666、828和990,与fos的分子量相符,本实验中p-fos和ap-fos的合成底物fos主要由gf2、gf3、gf4、gf5四种糖组成。图2中b则显示,合成产物p-fos的分子量分别为583、639、745、801、857、907、963,比fos的分子量均多出56或112,即为1~2个丙酸脱水后的分子量。
81.图2中c结果表明,ap-fos的分子量分别为639、695、751、801、807、857、863、913、929、969、1019、1025、1075、1081、1131、1137、1187、1237、1243、1293、1299、1349,结合红外谱图图1确定ap-fos主要为2~8个丙酸和fos通过酯键组合而成。
82.结果表明:低聚果糖上成功接上了丙酸,其中p-fos主要以接两个丙酸为主。ap-fos主要以接6个丙酸为主,并且在p-fos和ap-fos图中未发现fos的峰代表fos被完全除去。
83.3.低聚果糖丙酸酯核磁氢谱分析
84.分别称取50mg干燥fos、p-fos和ap-fos样品溶于500μl氘水(d2o)中,混匀后加入核磁管中。核磁检测(1h nmr)使用br
ü
ker advance 400(1h:400mhz),化学位移(δ)以ppm为单位,内标以氘代试剂的残留溶剂峰为准(例如1h nmr:d2o,4.79)。
85.使用maldi-tof ms对fos、p-fos和ap-fos的组成进行鉴定,低聚果糖丙酸酯的1h
核磁共振分析光谱图如图3所示。
86.图3结果显示,fos在3.0~5.30ppm范围内都有果糖环骨架上对应的c-h特征峰,而p-fos果糖环和ap-fos果糖环上的质子峰则由于反应后接上了羰基(c=o)电子团,降低了氢核周围的电子云密度,导致屏蔽效益降低,化学位移值增大,而造成质子峰向左移动。与fos相比,p-fos和ap-fos的谱图中分别在1.0ppm、2.5ppm处出现了吸收峰,它们分别是丙酰基上-ch2-ch3、的吸收峰,因此我们推断丙酰基被成功连接到了fos的糖环上。
87.结合图2和图3可以确定p-fos主要为一个或两个丙酸和fos通过酯键组合而成。
88.4.低聚果糖丙酸酯总糖含量测定
89.(1)使用苯酚-硫酸法对原料fos、实施例1制备纯化的p-fos、对比例1制备纯化的ap-fos的总糖含量(w/w)进行测定,准确称取10mg样品粉末或含液体于k-max管并置于冰浴,边震荡边加入0.45ml 72%浓硫酸,于30℃水浴中加热1h,期间每隔20min振荡反应管一次,确保样品冻干粉充分与浓硫酸反应。试管冷却后,加入6ml蒸馏水,振荡均匀,于100℃金属浴中加热1h,每间隔30min振荡反应管一次,反应完成后冷却至室温。
90.(2)标准曲线的制作
91.试管中分别加入0、10、20、30、40、50、60μl的150μg/ml葡萄糖标准溶液,再分别用2.5%苯酚溶液补充至200μl,振荡混匀。加入0.5ml浓硫酸,混匀后冷却至室温,于490nm处测量吸光度,以吸光度为纵坐标,浓度为横坐标绘制标准曲线。
92.(3)样品总糖测定
93.稀释水解后样品溶液5~10倍,于试管中加入40μl稀释样品溶液和160μl2.5%苯酚溶液,振荡混匀。按照步骤(2)方法测定混合液490nm处吸光值。通过标准曲线计算样品对应的总糖含量。
94.低聚果糖丙酸酯总糖含量测定结果如图4所示,图4显示,fos的含糖量为60.23%,p-fos的含糖量为45.90%,ap-fos的含糖量为35.62%,ap-fos的含糖量最低。
95.实施例3低聚果糖丙酸酯的体外发酵特性测定
96.1.体外模拟结肠发酵模型的构建
97.参考yang等人的方法(yang z x,huang t,li p,et al.dietary fiber modulates the fermentation patterns of cyanidin-3-o-glucoside in a fiber-type dependent manner[j].foods,2021,10(6).)构建体外模拟结肠发酵模型,完成培养基的制备和接种菌液的制备。
[0098]
利用构建的结肠发酵模型对低聚果糖丙酸酯进行发酵特性的探究,分别在培养进行到0、6、12、24、36h取出样品进行后续处理。通过对发酵体系中的ph、产气量、总糖变化等以分析低聚果糖丙酸酯的基本发酵特性,并对发酵液中菌群进行测序探究低聚果糖丙酸酯对肠道菌群造成的影响,及分析其代谢产物在肠道菌群作用下的变化。
[0099]
样品采用实施例1制得并纯化的低聚果糖丙酸酯p-fos和ap-fos。siem培养基提前12h放入厌氧操作平台中进行氧气的置换,直至培养基颜色由红变黄,在接种前与适量样品混合,振荡使其溶解。共设置5个组别,分别是空白对照组(c组)、fos对照组(f组)、fos 正丙酸组(fap组)、p-fos组,(pf组)、ap-fos组(apf组),每组样品每个时间平行3次。以fos的糖含量为基础,为了保证样品在发酵液中的浓度相同,以各组间总糖含量一致作为标准,使发酵液的终浓度均为总糖含量6mg/ml,fap组中丙酸的添加量是ap-fos糖含量等量情况下包
含的丙酸量。新鲜的粪便菌液制备后马上转移至厌氧操作平台中进行接种,带有样品的培养基和粪便菌液按体积比9:1的比例加入到厌氧发酵管中,密封混匀。随后放入37℃的恒温振摇箱中进行培养,
[0100]
2.发酵液产气量及ph的测定
[0101]
使用无菌注射器直接插入发酵管上的胶塞,对不同时间发酵管中的气体产量进行检测并记录。
[0102]
使用微型ph计对不同时间发酵液的ph进行测定并记录。
[0103]
低聚果糖丙酸酯体外发酵过程中不同时间点样品的累积产气量和ph变化情况如图5所示,其中a为产气量变化,b为ph变化;c代表空白对照组,f代表fos对照组,pf代表p-fos组,apf代表ap-fos组,fap代表fos 正丙酸组。
[0104]
图5中a显示,体外发酵的0~12h,发酵管中累积气体产量逐渐升高,尤其是pf组和f组,分别达到1.50ml和1.49ml。但c组和fap组的产气并不明显,apf组仅有少许产气,其累积产气量显著低于pf组,当发酵进行到12h后,f组已停止产气,pf组的产气速率也明显下降,但其仍在被降解并产气。当发酵结束时,pf组累积产气量最高,达到2.1ml。
[0105]
图5中b显示,发酵过程中c组的ph几乎没有变化,体外发酵的0~12h时,fap组、f组、pf组和apf组的ph都持续降低。其中fap组和f组ph降幅最快,当发酵进行到12h时分别达到了4.14和4.36,pf组发酵液的ph略高于fap组和f组,达到了4.79,12h后除了apf,各组发酵液的ph不再产生明显的变化,apf组在在24h时基本保持平缓,大概在5.17。
[0106]
3.发酵液总糖变化
[0107]
(1)样品水解
[0108]
同实施例2中4(1)。
[0109]
(2)标准曲线的制作
[0110]
同实施例2中4(2)。
[0111]
(3)样品总糖测定
[0112]
同实施例2中4(3)。
[0113]
(4)结果
[0114]
体外发酵过程中总糖含量的变化情况如图6所示,c代表空白对照组,f代表fos对照组,pf代表p-fos组,apf代表ap-fos组,fap代表fos 正丙酸组。
[0115]
图6显示,随着体外发酵的进行,发酵液中总糖含量总体呈下降趋势。发酵进行的前12h,发酵液中的糖被微生物快速利用,总糖含量下降明显,且f组和fap组的总糖降解的速度相似,均比pf和apf组的更为迅速,在12h时已几乎被降解完全。当发酵进行到24h的时候pf组几乎完全降解,apf组降解速率也大大减缓。pf组和apf组在24h发酵液中的总糖含量仅为1.77mg/ml和4.03mg/ml,分别降解了约75.06%和59.57%。综合可知,p-fos能促进了发酵液中更多产气菌的生长,而初始丙酸浓度高似乎可以抑制产气菌的生长。ap-fos可能由于其高酯化度,其总糖降解速率不如p-fos。
[0116]
综合上述结果,p-fos在体外发酵体系中具有较好的可发酵性,且与fos相比更能被肠道菌群稳定地降解,而ap-fos不能被肠道菌群很好地降解。
[0117]
同样的,实验发现实施例1制备的p-inulin和对比例1制备的ap-inulin中,p-inulin在体外发酵体系中具有较好的可发酵性,且与inulin相比更能被肠道菌群稳定地降
解,而ap-inulin不能被肠道菌群很好地降解。
[0118]
4.发酵液短链脂肪酸(scfas)的测定
[0119]
低聚果糖丙酸酯体外发酵液短链脂肪酸含量变化情况如图7所示;a为乙酸,b为丙酸,c为丁酸,d为异丁酸,e为戊酸,f为异戊酸,g为己酸,h为总短链脂肪酸含量;图中值表示为平均值
±
sem,n=3,字母不同表示差异显著,p《0.05,ns表示差异不显著。
[0120]
图7显示,随着发酵时间的延长,发酵液中各短链脂肪酸含量逐渐增加。其中fap组的乙酸产量最高,其次是f组。发酵液中丙酸含量最高的是pf组,其丙酸含量显著高于其他四组(p《0.05),大于10mm,其次是apf组和fap组。随着发酵时间的延长,pf组的丁酸产量逐渐升高,发酵进行到12h时,pf组和apf组的丁酸浓度已显著高于其他三组(p《0.05)。
[0121]
综上所述,fos、fos与丙酸混合物、p-fos均能被肠道菌群酵解产生scfas,但ap-fos则具有较差的可发酵性。其中,p-fos在肠道菌群的作用下表现出突出的产丙酸能力。同样的,实验发现实施例1制备的p-inulin在肠道菌群的作用下也表现出突出的产丙酸能力。
[0122]
5.发酵液16s rrna基因测序
[0123]
参考yang等人的方法(yang z x,huang t,li p,et al.dietary fiber modulates the fermentation patterns of cyanidin-3-o-glucoside in a fiber-type dependent manner[j].foods,2021,10(6).),对体外发酵36h时的发酵液进行16s rrna基因测序,以研究发酵液中肠道菌群的多样性和组成变化。
[0124]
通过非度量多维尺度分析(non-metricmulti-dimensional scaling,nmds)等分析方法从中发现不同样品间的差异。
[0125]
发酵液微生物的beta多样性中nmds分析结果如图8所示;图中1个点代表一个样本,不同组的颜色不同,样本间距离越远则表示微生物群落构成差异越大。图8中nmds分析中stress为0.0388,分析结果代表性极好。本次实验的组内样本距离较近,表明实验重复性好。各组间样本明显分离且距离较远,说明fos、fos 正丙酸、p-fos和ap-fos在体外发酵中均对微生物组成造成了影响,且影响因素各不相同。
[0126]
(2)体外发酵微生物门水平组成变化
[0127]
低聚果糖丙酸酯体外发酵门水平微生物相对丰度和组成结构如图9所示;a-f为发酵液门水平微生物相对丰度差异,g为发酵液门水平微生物相对丰度柱状图;图中值表示为平均值
±
sem,n=3,字母不同表示差异显著,p《0.05。
[0128]
图9中g显示,体外发酵24h后,发酵液中拟杆菌门(bacteroidota)、厚壁菌门(firmicutes)、变形杆菌门(proteobacteria)、梭杆菌门(fusobacteria)为5组样本中的优势菌门,占发酵液中菌群总量的82.29%以上。发酵液中的bacteroidota和firmicutes是构成人类肠道菌群的两个主要的门类,bacteroidetes在人类胃肠道主要是厌氧类杆菌,环境中主要存在吞噬几丁质菌、吞噬细胞、黄杆菌、腐螺旋菌等细菌,可以降解聚合物有机物。当肠道中的bacteroidetes数量下降甚至消失时,可能导致肠道内的多种感染和脓肿,甚至影响到全身组织和器官。厚壁菌门中的一些细菌可以通过编码碳水化合物活性酶,从而促进碳水化合物的水解和利用。
[0129]
图9中a显示,pf的存在显著提高了发酵液中bacteroidota(p《0.05),其次是apf组。相比于c组,f组和fap组都提升了bacteroidota的相对丰度,但与c组相比无显著性差异。f组发酵液中firmicutes(p《0.05)的丰度最高,其次是fap组和pf组,都显著提高了发酵
液中firmicutes的相对丰度,对比c组,apf组也有所提升,但无显著性差异。
[0130]
firmicutes与bacteroidota的比例(f/b的比例)是肥胖生物学的重要指标之一,肥胖个体肠道f/b比例相对较高,f/b比值的降低可能会降低胰岛素抵抗和体重增加的风险。实验组及对照组各组f/b的结果如下表1,
[0131]
表1
[0132][0133]
表1显示,与对照相比,pf组、apf组的f/b比值均有所降低,pf组的f/b比值显著降低,f组和fap组的f/b比值反而升高,说明pf组、apf组能够降低胰岛素抵抗和体重增加的风险,具有减肥的效果;pf组降低效果更显著,减肥效果更好。同样的,实验发现实施例1制备的p-inulin也具有降低胰岛素抵抗和体重增加的风险,具有减肥的效果,效果优于ap-inulin。
[0134]
proteobacteria的细菌都是革兰氏阴性菌,其含有许多病原菌,比如大肠杆菌、埃希氏菌、沙门氏菌、志贺氏菌、绿脓杆菌、幽门螺杆菌等,该菌门在肠道内的过度生长会导致一系列疾病。图9中c显示,与c组相比,f组、pf组、fap组均能显著抑制proteobacteria的生长(p《0.05),apf组也降低了proteobacteria在发酵液中的相对丰度,这有助于肠道菌群组成结构恢复到一个相对健康的状态。尤其是fap组,其改善的效果最为显著,说明丙酸直接存在对proteobacteria的生长会有一定的抑制作用,pf组的改善效果虽然不及fap组,但比fos更为明显。能在一定程度上说明pf组结合了丙酸和fos的良好特质。
[0135]
fusobacteria是常见的存在于消化道和口腔中致病菌,可引起各类例如阑尾炎、口腔炎症和感染性疾病,甚至癌症等。图9中d显示,与c组相比,pf组、f组和fap组都明显抑制了fusobacteria的相对丰度(p《0.05),apf组也抑制了fusobacteria的生长,其中效果最好的是pf组,其发酵液中没有检测到fusobacteria。
[0136]
actinobacteria是一种革兰氏阳性菌,这一门的大多数成员都有复杂的菌丝生活方式,形成气生和底物菌丝体,具有特征的色素沉着和产孢量,具有强大的生物合成潜力,可以产生具有广泛结构多样性和商业意义的次生代谢物。其中bifidobacterium在人体肠道最为常见,是fos等功能性低聚糖的主要利用者之一。图9中e显示,与c组相比,fap组、pf组和f组都显著增加了actinobacteria的丰度(p《0.05),能促进actinobacteria的生长,且fos和p-fos在维护肠道菌群平衡方面也能起到较好的效果。而apf组actinobacteria的丰度明显低于c组,存在抑制actinobacteria的丰度的现象。
[0137]
desulfobacterota包含一些致病菌,有研究表明发现,与健康人群相比,糖尿病伴有视网膜病变患者肠道微生物的组成中的desulfobacterota相对丰度增加。高脂饮食会促进desulfobacterota的增长,进而破坏小鼠体内的菌群结构。图9中f显示,与c组相比,f、pf、fap和apf组都能显著抑制desulfobacterota的生长,而f组、pf组和fap组的抑制效果更优于apf组。说明fos和丙酸同时存在能抑制desulfobacterota的生长。
[0138]
(4)体外发酵微生物属水平组成变化
[0139]
低聚果糖丙酸酯体外发酵属水平微生物相对丰度和组成结构如图10所示;a-h为发酵液属水平微生物相对丰度差异,i为发酵液属水平微生物相对丰度柱状图;图中值表示
为平均值
±
sem,n=3,字母不同表示差异显著,p《0.05。
[0140]
图10显示,体外发酵24h后,fusobacterium、bacteroides、escherichia_shigella、sutterella、phascolarctobacterium和dialister为c组的优势菌属。fusobacterium是一种革兰氏阴性厌氧菌,有研究表明其与结直肠癌发生有关系,并且也与溃疡性结肠炎(uc)和克罗恩病(cd)的发生有关联。图10中a显示,与c组相比,pf、fap和f组都显著降低了发酵液fusobacterium的相对丰度(p<0.05),pf组的相对丰度最低,并且与fos组有显著性差异。而apf组fusobacterium的相对丰度虽然也有所降低,但是并不显著。
[0141]
escherichia_shigella是一种常见的具有促炎特性的致病菌,其包括大肠杆菌和沙门氏菌。与健康人群相比,在非酒精性脂肪性肝病(non-alcoholic fatty liver disease,nafld)患者、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,nash)患者和肝纤维化患者体内存在更多的escherichia_shigella,而在nafld患者体内存在大量的escherichia_shigella可能会导致escherichia_shigella数量的激增而穿透肠道上皮屏障,加剧肠道渗漏。图10中b显示,与c组相比,pf、fap和f组都有效降低了发酵液escherichia_shigella的相对丰度(p<0.05),fap组的相对丰度最低,其次是pf组,这两组都与f组具有显著性差异(p<0.05)。apf组与c组和f组都没有显著性差异,但其抑制escherichia_shigella生长的能力介于c组和f组之间。说明丙酸对于抑制escherichia_shigella生长的效果较好,fos也具有一定降低escherichia_shigella生长的效果,apf组抑制escherichia_shigella生长的能力并不如fos和pf组突出。
[0142]
klebsiella也是一种致病菌,可产生肠毒素,诱导肠上皮细胞凋亡。图10中c显示,与c组相比,fap组、pf组、f组和apf组都能显著降低klebsiella相对丰度(p<0.05)。其中pf组的降低效果优于apf组。
[0143]
dialister属于厚壁菌门,包括厌氧、非运动和革兰氏阴性杆菌。dialister的一些物种可能在糖代谢的调节中发挥作用,dialister与scfas的水平升高密切相关。图10中d显示,与c组相比,fap组、pf组和f组都能显著提高发酵液中dialister相对丰度(p《0.05),f组提升的最大,而apf组dialister相对丰度基本与c组接近。
[0144]
bifidobacterium是肠道中典型的益生菌,可发酵fos等聚糖产生乙酸和乳酸等,并且具有如调节肠道菌群、改善肠道功能、抗肿瘤活性和改善营养等功能活性。图10中e显示,与c组相比,fap组、pf组和f组都能显著提高发酵液中bifidobacterium相对丰度(p《0.05),fap组对bifidobacterium的促生长作用显著高于其他所有组。而apf组提高bifidobacterium相对丰度的效果显著低于pf组。
[0145]
普雷沃氏菌属(prevotela_9)在人的微生物组中富集、多样,分布于不同器官、生态位,如口腔、肠道内,具糖分解功能,可以将多糖代谢成琥珀酸,且与丙酸的产生密切相关。zhao等人使用红曲发酵人参(pm)对hfd引起的大鼠肥胖的治疗作用,发现经过pm治疗后的大鼠,其f/b的比例降低,prevotela_9的相对丰度显著提高,有效缓解了代谢性疾病引起的肠道微生物区系紊乱。图10中f显示,与c组相比,fap组、pf组、f组和apf组都能显著提升prevotela_9相对丰度(p<0.05)。其中pf组提升效果最显著。
[0146]
faecalibacterium和collinsella都是重要的产生丁酸的细菌。图10中g显示,与c组相比,f组和pf组发酵液中faecalibacterium相对丰富显著提升(p《0.05),图10中h显示,与c组相比,所有其他组collinsella相对丰度均降低,collinsella降低,丁酸含量升高。pf
组相对于f组有显著性差异(p《0.05),fos组抑制了collinsella的生长。同时这也解释了pf和apf组发酵产生的丁酸含量高的原因。
[0147]
实施例4低聚果糖丙酸酯的益生活性测定
[0148]
将实施例1制备的p-fos作为碳源分别与双歧杆菌(bifidobacterium lactis bb-12,b.lactis bb-12)和干酪乳杆菌(lactobacillus casei strain shirota,)共同培养,以不添加任何碳源作为空白对照组(con组),以fos(fos组)与fos 正丙酸(fap组)作为阳性对照,探究p-fos对常见益生菌bifidobacterium和lactobacillus的生长促进作用。
[0149]
双歧杆菌(bifidobacterium lactis bb-12)、干酪乳杆菌(lactobacillus casei strain shirota)由本实验室自主分离得到,并已进行测序鉴定确定。p-fos对两种益生菌的增殖作用测定在厌氧培养箱中进行,使用无菌mrs培养基在96孔v型培养板中对两种菌株进行培养。以未添加任何碳源的培养基为空白对照组(con组),以fos(fos组)与fos 正丙酸(fap组)作为阳性对照,以添加了p-fos为实验组。在无菌条件下,往每个培养板中添加150μl培养基,每个样品设三个复孔,分别在每个培养板中接种2%培养基体积的菌种母液,在37℃厌氧箱中培养24h,且每2h使用酶标仪在od
600nm
处检测两种菌株的生长情况,并绘制两种益生菌的生长曲线。
[0150]
(2)结果
[0151]
b-fos对益生菌生长曲线的影响如图11所示,a为p-fos对bifidobacterium lactis bb-12生长曲线的影响,b为p-fos对lactobacillus casei strain shirota生长曲线的影响。
[0152]
图11中a显示,0~6h是b.lactis bb-12的生长延滞期,6~16h是其对数生长期,而在16h之后b.lactis bb-12的生长速度开始减缓。与空白对照相比,fos组、p-fos和fap组对b.lactis bb-12的生长都具有显著的促进作用。p-fos和fos一样都能使b.lactis bb-12良好的增长。在厌氧培养进行到6h时,p-fos组对b.lactis bb-12生长的促进作用与fos组和fap组产生了显著的差异。而p-fos组在整个培养过程中表现出比fos组更好的促生长作用。
[0153]
图11中b显示,0~4h是lactobacillus casei strain shirota的生长延滞期,4~10h是对数生长期,而在培养进行到10h之后,乳酸杆菌的生长速度开始减缓直至稳定。很明显能看出fos组、p-fos组、fap组对lactobacillus casei strain shirota的生长均具有显著的促进作用。
[0154]
实施例5低聚果糖丙酸酯对ibd病人粪便的改善作用
[0155]
1.发酵液产气量及ph的测定
[0156]
按照实施例3中发酵液产气量及ph的测定方法进行测定。
[0157]
ibd病人体外发酵过程中不同时间点累积产气量和ph变化情况如图12所示,a为产气量变化,图b为ph变化;其中con为空白对照组,f为fos对照组,fb为fos 正丙酸组,pf为p-fos组,apf为ap-fos组;r为缓解期病人粪便样本,a为活动期粪便病人样品。
[0158]
图12显示,随着体外发酵的进行,发酵管中累计气体体积总体上升,发酵液除con组外其余ph呈下降趋势。图12中a显示,体外发酵的0~24h,各组的产气量逐渐上升,尤其是con-r,ap-fos-r和p-fos-r,说明其中的产气菌含量增多,对比活动期和缓解期病人粪便的产气量可以看出,活动期病人粪便中含有的产气菌较多。图12中b显示,ph随着发酵时间延长呈下降趋势,fos-r和fos-a组下降的趋势最大,其次是p-fos-r和p-fos-a。ap-fos-a基本
无变化。ph下降说明发酵在进行,如果没有营养物质就如同con组ph就下降的很缓慢。
[0159]
2.发酵液短链脂肪酸(scfas)的测定
[0160]
测定方法同实施例3。
[0161]
ibd病人粪便体外发酵液短链脂肪酸含量变化情况如图13所示,a为乙酸,b为丙酸,c为丁酸;其中con为空白对照组,f为fos对照组,fb为fos 正丙酸组,pf为p-fos组,apf为ap-fos组;r为缓解期病人粪便样本,a为活动期粪便病人样品;图中值表示为平均值
±
sem,n=3,字母不同表示差异显著,p《0.05,ns表示差异不显著。
[0162]
从图13结果可以看出随着发酵时间的延长,各个样品组短链脂肪酸都出现了增长。p-fos和ap-fos无论是在活动期还是缓解期,产生丙酸情况都显著性大于其他组,都在20mm以上
[0163]
2.发酵液总糖变化
[0164]
发酵液总糖变化的测定方法同实施例2中4。
[0165]
ibd体外发酵过程中总糖含量的变化情况如图14所示,con为空白对照组,f为fos对照组,fb为fos 正丙酸组,pf为p-fos组,apf为ap-fos组;r为缓解期病人粪便样本,a为活动期粪便病人样品。
[0166]
图14显示,随着体外发酵的进行,发酵液中总糖含量总体呈下降趋势。发酵24h后,fos-r和fos-a被消耗的最多,其次是p-fos-r和p-fos-a,ap-fos-r也有所消耗,但是ap-fos-a基本没有消耗。说明ap-fos由于其高酯化度可能难以被ibd病人的粪便利用。
[0167]
ibd病人粪便体外发酵的微生物门水平柱状图如图15中a,微生物属水平柱状图如图15中b,微生物属水平热图如图15中c。
[0168]
图15显示,p-fos和fos都对活动期病人体内的微生物有着有益的改善作用。fos在活动期病人粪便中促进了双歧杆菌属的生长,在缓解期病人体内促进了乳酸菌的增长。p-fos在活动期病人粪便中促进了双歧杆菌属和乳酸杆菌属的增长。除了con组,其余组的干预处理都抑制了结肠癌和结肠瘤的生物标记物lachnoclostridium属的增长。
[0169]
综上所述,本发明的低聚果糖丙酸酯干预组pf组在活动期病人粪便中,改善了粪便中微生物群结构,促进了双歧杆菌、乳酸杆菌等一些有益菌的生长,同时抑制了许多有害菌的生长;表现出一定改善ibd病人粪便菌群的能力。同样的,实验发现实施例1制备的p-inulin同样能改善ibd病人粪便菌群微生物群结构,促进双歧杆菌、乳酸杆菌等一些有益菌的生长。
[0170]
实施例6低聚果糖丙酸酯和低聚果糖丁酸酯对正常饲养的小鼠体重的影响
[0171]
低聚果糖丁酸酯的制备:
[0172]
准确称取1g低聚果糖于圆底烧瓶中,并加入洁净干燥的磁力搅拌转子,向烧瓶中添加10ml的无水吡啶,置于磁力搅拌器上搅拌至低聚果糖溶解。向烧瓶中投入1g固定化脂肪酶tlim,准确量取2.36ml丁酸乙烯酯加入反应体系。最后将圆底烧瓶置于恒温水浴磁力搅拌器中,在55℃环境下反应48h。反应完成后将圆底烧瓶内样品进行抽滤,分离固定化脂肪酶tlim,得酶法制低聚果糖丁酸酯(butyric-fos,b-fos)反应液。使用真空旋转蒸发仪旋至固体状,以除去反应液中大部分的吡啶。配制体积百分数5%甲醇水溶液,将固体加入圆底烧瓶中,不断吹打、搅拌,使其均匀分散在甲醇水溶液中。
[0173]
使用c18柱层析分离反应液。首先使用体积百分数5%酸化甲醇(5%甲酸和95%甲
醇混合)对c18柱进行清洗,然后使用体积百分数5%甲醇水溶液将柱内残留的酸化甲醇进行置换。吸取分散在体积百分数5%甲醇水溶液中的样品悬液,小心加至层析柱中,使用3个柱体积的体积百分数5%甲醇水溶液对样品进行洗脱,以除去样品中剩余的吡啶、尚未接上丁酸的低聚果糖及丁酸乙烯酯等。吡啶在紫外下会显色,因此当接取到的洗脱剂已不再在紫外下显色时,说明吡啶被除尽。最后向层析柱中加入甲醇对样品进行洗脱,并收集此时的黄色洗脱液。使用正丁醇:正丙醇:水=1:6:1为展开剂对收集液进行tlc鉴定,将fos除尽的洗脱液合并。利用真空旋转蒸发仪将收集到的样品洗脱液旋干,再向烧瓶中加入纯水溶解黄色样品,转移至离心管中使用真空冻干机除去样品中的水,得到的黄色固体则为纯化b-fos。
[0174]
经暨南大学动物管理中心伦理委员会批准,从浙江维通利华购入72只6周龄c57bl/6雄性小鼠(18~22g),在标准条件下,饲养于暨南大学动物管理中心。隔离检疫期间食用动物房提供的饲料(协同生物鼠饲料),自由饮水,定期更换水、饲料和鼠笼中的垫料。
[0175]
经过10天的隔离检疫,将小鼠随机分为3组,每组12只,分别为空白对照组(control组,con)、低聚果糖丁酸酯对照组(b-fos组)、低聚果糖丙酸干预组(p-fos组)。造模共计23天,所有小鼠统一喂养d12450h普通饲料23日。所有小鼠随机分为3组,所有组饲喂d12450h普通饲料(control),所有组全程饮用动物中心提供的无菌水。b-fos组在造模期间每天用60mg/ml溶于生理盐水的纯化的b-fos溶液进行灌胃。p-fos组在造模期间每天用60mg/ml溶于生理盐水的实施例1制备的p-fos溶液进行灌胃,三组小鼠每天自由食用由暨南大学动物实验中心提供的饲料,并从造模的0天起,两天记录和更换一次饲料和水,定期更换垫料。记录喂养23天中小鼠体重,并计算小鼠体重变化率。
[0176]
小鼠体重变化率如图16所示。
[0177]
图16显示,b-fos组小鼠体重变化率明显高于对照组和p-fos组,相同饲喂时间,对照组和p-fos组小鼠体重变化率基本接近。说明低聚果糖丙酸酯相比于低聚果糖丁酸酯对小鼠体重控制更具有效果。
[0178]
实施例7低聚果糖丙酸酯对高脂饮食饲养的肥胖小鼠的改善作用
[0179]
1.小鼠肥胖模型的建立
[0180]
经暨南大学动物管理中心伦理委员会批准,从浙江维通利华购入72只6周龄c57bl/6雄性小鼠(18~22g),在标准条件下,饲养于暨南大学动物管理中心。隔离检疫期间食用动物房提供的饲料(协同生物鼠饲料),自由饮水,定期更换水、饲料和鼠笼中的垫料。
[0181]
经过10天的隔离检疫,将小鼠随机分为6组,每组8只,分别为空白对照组(control组,con)、造模对照组(hfd组,hfd-c)、低聚果糖干预组(hfd fos组,hfd-fos)、低聚果糖-正丙酸混合物干预组(hfd fos p组,hfd-fap)、实施例1制备的p-fos干预组(hfd p-fos组,hfd-pf)、实施例1制备的ap-fos干预组(hfd ap-fos,hfd-apf)。造模共计11周,所有小鼠统一喂养d12450h普通饲料7日。所有小鼠随机分为6组,正常对照组饲喂d12450h普通饲料(control),高脂饮食组饲喂高脂d12451饲料(hed),所有组全程饮用动物中心提供的无菌水,以建立小鼠肥胖模型。hfd-pf组在造模期间每天用60mg/ml溶于生理盐水的p-fos溶液进行灌胃,hfd-apf每天用81mg/ml溶于生理盐水的ap-fos溶液进行灌胃。fos组每天用50mg/ml溶于生理盐水的低聚果糖溶液灌胃,hfd-fap组每天用溶于生理盐水的低聚果糖(50mg/ml)和正丙酸(7μl/ml)的混合物溶液进行灌胃。六组小鼠每天自由食用由暨南大学
动物实验中心提供的饲料,并从造模的0天起,两天记录和更换一次饲料和水,定期更换垫料。
[0182]
肥胖小鼠造模干预流程图如图17所示。
[0183]
2.p-fos对结肠炎小鼠体重的影响
[0184]
实验期间对小鼠体重进行记录,实验结束计算小鼠体重增长及lee’s指数,小鼠体重增长结果如图18所示,lee’s指数结果如图19所示。
[0185]
跟图18和图19可知,随着饲养时间延长,con组小鼠体重平稳增长,hfd和高脂加饮食干预小鼠体重增长趋势大于con组,在第6周hfd组与con组小鼠体重出现显著性差异(p《0.05)。饲养11周后,小鼠的肥胖指数(lee’s)结果表明hfd小鼠肥胖指数显著高于con组(p《0.05),造模成功。统计饲养过程中小鼠体重增量,结果显示,hfd组小鼠增重量显著性高于con组(p《0.05),hfd-pf组(p《0.05)、hfd-fos组(p《0.05)显著降低了小鼠体重增量。但是由于直接灌胃丙酸导致刺激小鼠,影响了小鼠的进食量和饮水量,导致小鼠异常体重下降。
[0186]
con、hfd-c、hfd-pf组小鼠形态对比如图20所示,图20显示,hfd-c组小鼠明显比con组小鼠体型大,结合图18可知,hfd-c组小鼠体重也明显增加,说明高脂小鼠造模成功。hfd-pf组小鼠的明显比hfd-c组小鼠体型小,结合图18可知,hfd-pf组小鼠的体重也明显低于hfd-c组,说明hfd-pf组小鼠的肥胖得到了缓解,p-fos起到了缓解肥胖发生的作用。
[0187]
综上所述,p-fos对小鼠体重增量有显著性控制效果,说明p-fos的日常摄入在一定程度地减轻了高脂饮食诱导的肥胖。
[0188]
同样的,实验发现实施例1制备的p-inulin对小鼠体重增量也有显著性控制效果,说明p-fos的日常摄入在一定程度地减轻了高脂饮食诱导的肥胖。
[0189]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。