1.本发明涉及药物化学领域,尤其涉及n-((3s,4s)-3-((6-(2,6-二氯-3,5-二甲氧基苯基)喹唑啉-2-基)氨基)四氢-2h-吡喃-4-基)丙烯酰胺的盐晶型或共晶及其制备方法。
背景技术:
2.fgfr4是局部晚期或转移性肝细胞癌(hcc)患者的致癌驱动因子。fgf19作为fgfr4的配体,可激活fgfr4,从而促进肝细胞增殖和调节肝内胆酸平衡。大约30%的hcc患者存在fgf19/fgfr4信号通路的异常激活。非索替尼(blu-554)是由blueprint medicines开发的一款在研的强效、高选择性成纤维细胞生长因子受体-4(fgfr4)抑制剂,用于治疗fgfr4驱动的晚期hcc。该药物尚未上市,其临床i期试验数据表明,非索替尼单药在具有多次治疗史的局部晚期或转移性肝细胞癌(hcc)患者中表现出临床疗效和良好的耐受性。该药物可以刺激t细胞浸润到肿瘤微环境中,这提示它联合抗pd-l1抑制剂将有可能在fgfr4驱动的晚期hcc患者中展现出更强的疗效。
3.非索替尼(blu-554)的化学名称为n-((3s,4s)-3-((6-(2,6-二氯-3,5-二甲氧基苯基)喹唑啉-2-基)氨基)四氢-2h-吡喃-4-基)丙烯酰胺,化学式为c
24h24
cl2n4o4,分子量为503.38,其分子结构式如下所示:
[0004][0005]
专利wo2015061572报道了式(i)化合物,经本发明人研究可知,该化合物的无定型在水中溶解度较差,50℃下,小于1mg/ml。溶解性差会导致药物吸收缓慢,生物利用度低。而药物共晶和盐是提高药物溶解性的有效手段。
[0006]
为了克服现有技术的缺点,本领域亟待针对该化合物的盐型或共晶开展研究,以找到溶解度较大、满足药物开发、制剂配方制备及工业化生产需要的盐型或共晶。
技术实现要素:
[0007]
本发明的目的是提供式(i)化合物非索替尼的固态形式,以满足药物研究及工业化生产的需要。
[0008]
本发明的另一目的是提供一种制备高稳定性的非索替尼的固态形式的方法。
[0009]
本发明的第一方面,提供了一种如式(i)所示化合物的固体形式,
[0010][0011]
其中,所述的固体形式选自下组:
[0012]
非索替尼与马来酸形成的盐晶型或共晶xm-i;
[0013]
非索替尼与马来酸形成的盐晶型或共晶xm-ii;
[0014]
非索替尼与硫酸形成的盐晶型或共晶xm-iii;
[0015]
非索替尼与盐酸形成的盐晶型或共晶xm-iv;或,
[0016]
非索替尼与硬脂酸形成的盐晶型或共晶xm-v。
[0017]
在另一优选例中,所述的固体形式为盐晶型或共晶xm-i。
[0018]
在另一优选例中,所述盐晶型或共晶xm-i的x-射线粉末衍射图包括以下2θ值:3.2
°±
0.2
°
;和至少2个选自下组的2θ值:8.7
°±
0.2
°
、9.8
°±
0.2
°
、11.8
°±
0.2
°
、23.1
°±
0.2
°
。
[0019]
在另一优选例中,所述盐晶型或共晶xm-i的x-射线粉末衍射图还具有1个或1个以上选自下组的2θ值:5.6
°±
0.2
°
、6.5
°±
0.2
°
、11.4
°±
0.2
°
、13.1
°±
0.2
°
、15.0
°±
0.2
°
。
[0020]
在另一优选例中,所述盐晶型或共晶xm-i的差式扫描量热分析图在200℃-210℃范围内有吸热峰。
[0021]
在另一优选例中,所述盐晶型或共晶xm-i在150℃-250℃失重约15wt%。
[0022]
在另一优选例中,所述盐晶型或共晶xm-i具有基本如表1所示的xrpd数据。
[0023]
在另一优选例中,所述盐晶型或共晶xm-i具有基本如图1所示的xrpd谱图。
[0024]
在另一优选例中,所述盐晶型或共晶xm-i具有基本如图2所示的tga谱图。
[0025]
在另一优选例中,所述盐晶型或共晶xm-i具有基本如图3所示的dsc谱图。
[0026]
在另一优选例中,所述盐晶型或共晶xm-i具有基本如图4所示的1h nmr图谱。
[0027]
在另一优选例中,所述的固体形式为盐晶型或共晶xm-ii。
[0028]
在另一优选例中,所述盐晶型或共晶xm-ii的x-射线粉末衍射图包括3个或3个以上,较佳地为4个或4个以上,更佳地为5个,选自下组的2θ值:8.3
°±
0.2
°
、12.5
°±
0.2
°
、17.5
°±
0.2
°
、18.0
°±
0.2
°
、24.6
°±
0.2
°
。
[0029]
在另一优选例中,所述盐晶型或共晶xm-ii的x-射线粉末衍射图还具有1个或1个以上选自下组的2θ值:4.1
°±
0.2
°
、5.9
°±
0.2
°
、15.9
°±
0.2
°
、19.9
°±
0.2
°
、21.6
°±
0.2
°
。
[0030]
在另一优选例中,所述盐晶型或共晶xm-ii的差式扫描量热分析图在195℃-205℃和330℃-340℃范围内各有一个吸热峰。
[0031]
在另一优选例中,所述盐晶型或共晶xm-ii在100℃-220℃失重约10%。
[0032]
在另一优选例中,所述盐晶型或共晶xm-ii具有基本如表2所示的xrpd数据。
[0033]
在另一优选例中,所述盐晶型或共晶xm-ii具有基本如图5所示的xrpd谱图。
[0034]
在另一优选例中,所述盐晶型或共晶xm-ii具有基本如图6所示的tga谱图。
[0035]
在另一优选例中,所述盐晶型或共晶xm-ii具有基本如图7所示的dsc谱图。
[0036]
在另一优选例中,所述盐晶型或共晶xm-ii具有基本如图8所示的1h nmr图谱。
[0037]
在另一优选例中,所述的固体形式为盐晶型或共晶xm-iii。
[0038]
在另一优选例中,所述盐晶型或共晶xm-iii的x-射线粉末衍射图包括3个或3个以上,较佳地为4个或4个以上,更佳地为5个选自下组的2θ值:5.1
°±
0.2
°
、8.1
°±
0.2
°
、10.2
°±
0.2
°
、13.1
°±
0.2
°
、20.4
°±
0.2
°
。
[0039]
在另一优选例中,所述盐晶型或共晶xm-iii的x-射线粉末衍射图还具有1个或1个以上选自下组的2θ值:7.2
°±
0.2
°
、11.7
°±
0.2
°
、17.6
°±
0.2
°
、21.2
°±
0.2
°
、25.2
°±
0.2
°
。
[0040]
在另一优选例中,所述盐晶型或共晶xm-iii具有基本如表3所示的xrpd数据。
[0041]
在另一优选例中,所述盐晶型或共晶xm-iii具有基本如图9所示的xrpd谱图。
[0042]
在另一优选例中,所述盐晶型或共晶xm-iii具有基本如图10所示的tga谱图。
[0043]
在另一优选例中,所述盐晶型或共晶xm-iii具有基本如图11所示的dsc谱图。
[0044]
在另一优选例中,所述盐晶型或共晶xm-iii具有基本如图12所示的1hnmr图谱。
[0045]
在另一优选例中,所述的固体形式为盐晶型或共晶xm-iv。
[0046]
在另一优选例中,所述盐晶型或共晶xm-iv的x-射线粉末衍射图包括3个或3个以上,较佳地为4个或4个以上,更佳地为5个,选自下组的2θ值:3.6
°±
0.2
°
、5.4
°±
0.2
°
、9.8
°±
0.2
°
、21.8
°±
0.2
°
、25.1
°±
0.2
°
。
[0047]
在另一优选例中,所述盐晶型或共晶xm-iv的x-射线粉末衍射图还具有1个或1个以上选自下组的2θ值:5.0
°±
0.2
°
、13.2
°±
0.2
°
、13.8
°±
0.2
°
、17.5
°±
0.2
°
、19.8
°±
0.2
°
。
[0048]
在另一优选例中,所述盐晶型或共晶xm-iv具有基本如表4所示的xrpd数据。
[0049]
在另一优选例中,所述盐晶型或共晶xm-iv具有基本如图13所示的xrpd谱图。
[0050]
在另一优选例中,所述的固体形式为盐晶型或共晶xm-v。
[0051]
在另一优选例中,所述盐晶型或共晶xm-v的x-射线粉末衍射图包括选自下组的2θ值:5.7
°±
0.2
°
,和至少1个,较佳地为2个或3个选自下组的2θ值:3.8
°±
0.2
°
、9.5
°±
0.2
°
、24.6
°±
0.2
°
。
[0052]
在另一优选例中,所述盐晶型或共晶xm-v的x-射线粉末衍射图还具有1个或1个以上选自下组的2θ值:7.6
°±
0.2
°
、13.3
°±
0.2
°
、23.1
°±
0.2
°
。
[0053]
在另一优选例中,所述盐晶型或共晶xm-v的差式扫描量热分析图在60℃-70℃和210℃-220℃范围内各有一个吸热峰。
[0054]
在另一优选例中,所述盐晶型或共晶xm-v在25℃-150℃失重约4%,150℃-250℃失重约15%。
[0055]
在另一优选例中,所述盐晶型或共晶xm-v具有基本如表5所示的xrpd数据。
[0056]
在另一优选例中,所述盐晶型或共晶xm-v具有基本如图14所示的xrpd谱图。
[0057]
在另一优选例中,所述盐晶型或共晶xm-v具有基本如图15所示的tga谱图。
[0058]
在另一优选例中,所述盐晶型或共晶xm-v具有基本如图16所示的dsc谱图。
[0059]
在另一优选例中,所述的x射线粉末衍射是用cukα辐射的条件下测试的。
[0060]
本发明的第二方面,提供了一种如本发明第一方面所述的非索替尼固体形式的制备方法,包括步骤:
[0061]
(a)在第一溶剂中,用非索替尼原料和酸反应,从而得到非索替尼盐或共晶的混合
物;且所述酸选自下组:马来酸、浓硫酸、盐酸或硬脂酸;
[0062]
(b)从所述的混合物中收集固体,从而得到如本发明第一方面所述的晶型。
[0063]
在另一优选例中,步骤(a)还包括搅拌步骤。
[0064]
在另一优选例中,步骤(b)中包括将所述的混合物在室温下挥发,析出非索替尼固体形式。
[0065]
在另一优选例中,步骤(b)中包括在收集固体后,用水或乙醚对固体进行润洗。
[0066]
在另一优选例中,步骤(a)中,所述非索替尼原料为非索替尼的无定型。
[0067]
在另一优选例中,步骤(a)中,所述第一溶剂选自下组:醇类溶剂、酮类溶剂、芳烃类溶剂、水,或其组合。
[0068]
在另一优选例中,步骤(a)中,所述非索替尼与第一溶剂形成的第一分散体为晶浆或悬浮液。
[0069]
在另一优选例中,步骤(a)中,所述醇类溶剂为c1-c4醇类溶剂;较佳地,所述醇类溶剂选自:甲醇、乙醇、异丙醇、正丙醇,或其组合。
[0070]
在另一优选例中,步骤(a)中,所述酮类溶剂为c2-c6酮类溶剂;较佳地,所述酮类溶剂选自:丙酮、2-丁酮、甲基异丁基酮、n-甲基吡咯烷酮,或其组合。
[0071]
在另一优选例中,步骤(a)中,所述芳烃类溶剂选自:苯、甲苯。
[0072]
在另一优选例中,步骤(a)中,所述第一溶剂与非索替尼原料的体积(ml)/质量(mg)比为1:(20-40)。
[0073]
在另一优选例中,步骤(a)中,所述第一溶剂选自下组:异丙醇/水=2:1~1:4(v/v)、丙酮/水=2:1~1:4(v/v)。
[0074]
在另一优选例中,步骤(a)中,所述反应温度为16~23℃。
[0075]
在另一优选例中,步骤(a)中,搅拌时间选自0.5~6d。
[0076]
在另一优选例中,步骤(a)中,搅拌时间为5d。
[0077]
在另一优选例中,步骤(a)中,搅拌时间为1d。
[0078]
在另一优选例中,步骤(b)中,所述的收集包括过滤。
[0079]
在另一优选例中,步骤(b)中,润洗溶剂选自水或乙醚。
[0080]
在另一优选例中,当所述的固体形式为盐晶型或共晶xm-i的情况下,步骤(a)中包括:
[0081]
(i)在第二溶剂中,用非索替尼原料和马来酸反应,从而得到非索替尼盐或共晶的混合物;
[0082]
(ii)搅拌所述混合物。
[0083]
在另一优选例中,所述第二溶剂选自:醇类溶剂、水或其组合。
[0084]
在另一优选例中,所述醇类溶剂为c1-c4醇类溶剂;较佳地,所述醇类溶剂选自:甲醇、乙醇、异丙醇、正丙醇,或其组合。
[0085]
在另一优选例中,所述醇类溶剂为异丙醇。
[0086]
在另一优选例中,所述第二溶剂选自下组:异丙醇:水=2:1~1:2(v/v)。
[0087]
在另一优选例中,所述第二溶剂为异丙醇:水=1:1(v/v)。
[0088]
在另一优选例中,在步骤(ii)中,所述搅拌在室温下进行。
[0089]
在另一优选例中,在步骤(ii)中,搅拌5天。
[0090]
在另一优选例中,所述第二溶剂与非索替尼原料的体积(ml)/质量(mg)比为1:(10-20)。
[0091]
在另一优选例中,所述马来酸与非索替尼原料的质量比为1:(1-10)。
[0092]
在另一优选例中,当所述的固体形式为盐晶型或共晶xm-ii的情况下,步骤(a)中包括:
[0093]
(i)在第三溶剂中,用非索替尼原料和马来酸反应,从而得到非索替尼盐或共晶的混合物;
[0094]
(ii)搅拌所述混合物。
[0095]
在另一优选例中,所述第三溶剂选自下组:酮类溶剂、水或其组合。
[0096]
在另一优选例中,所述酮类溶剂为丙酮。
[0097]
在另一优选例中,所述第三溶剂选自下组:丙酮:水=1:(2-10)(v/v)。
[0098]
在另一优选例中,所述第三溶剂为丙酮:水=1:4(v/v)。
[0099]
在另一优选例中,当所述的固体形式为盐晶型或共晶xm-iii的情况下,步骤(a)中包括:
[0100]
(i)在第四溶剂中,用非索替尼原料和浓硫酸反应,从而得到非索替尼盐或共晶的混合物;
[0101]
(ii)搅拌所述混合物。
[0102]
在另一优选例中,所述第四溶剂选自下组:醇类溶剂、水,或其组合。
[0103]
在另一优选例中,所述醇类溶剂为c1-c4醇类溶剂;较佳地,所述醇类溶剂选自:甲醇、乙醇、异丙醇、正丙醇,或其组合。
[0104]
在另一优选例中,所述醇类溶剂为异丙醇。
[0105]
在另一优选例中,所述第四溶剂选自下组:异丙醇:水=2:1~1:2(v/v)。
[0106]
在另一优选例中,所述第四溶剂为异丙醇:水=1:1(v/v)。
[0107]
在另一优选例中,所述第四溶剂与非索替尼原料的体积(ml)/质量(mg)比为1:(10-20)。
[0108]
在另一优选例中,当所述的固体形式为盐晶型或共晶xm-iv的情况下,步骤(a)中包括:
[0109]
(i)在第五溶剂中,用非索替尼原料和盐酸反应,从而得到非索替尼盐或共晶的混合物;
[0110]
(ii)搅拌所述混合物。
[0111]
在另一优选例中,所述第五溶剂选自下组:芳烃类溶剂。
[0112]
在另一优选例中,所述第五溶剂为甲苯。
[0113]
在另一优选例中,所述第五溶剂与与非索替尼原料的体积(ml)/质量(mg)比为1:(20-40)。
[0114]
在另一优选例中,当所述的固体形式为盐晶型或共晶xm-v的情况下,步骤(a)中包括:
[0115]
(i)在第六溶剂中,用非索替尼原料和硬脂酸反应,从而得到非索替尼盐或共晶的混合物。
[0116]
在另一优选例中,所述第六溶剂选自下组:芳烃类溶剂。
[0117]
在另一优选例中,所述第六溶剂为甲苯。
[0118]
在另一优选例中,所述第六溶剂与非索替尼原料的体积(ml)/质量(mg)比为1:(20-40)。
[0119]
在另一优选例中,所述硬脂酸与非索替尼原料的质量比为1:(1-5)。
[0120]
在另一优选例中,润洗溶剂为乙醚。
[0121]
本发明的第三方面,提供了一种药物组合物,所述药物组合物含有(a)活性成分为本发明第一方面所述的非索替尼的固体形式;以及(b)药学上可接受的载体。
[0122]
在另一优选例中,所述药物组合物或制剂的剂型选自下组:粉剂、胶囊剂、颗粒剂、片剂、丸剂或注射剂。
[0123]
在另一优选例中,所述的药物组合物用于治疗fgfr4驱动的局部晚期或转移性肝细胞癌(hcc)患者。
[0124]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0125]
图1是本发明盐晶型或共晶xm-i的xrpd图;
[0126]
图2是本发明盐晶型或共晶xm-i的tga图;
[0127]
图3是本发明盐晶型或共晶xm-i的dsc图;
[0128]
图4是本发明盐晶型或共晶xm-i的1h nmr谱图;
[0129]
图5是本发明盐晶型或共晶xm-ii的xrpd图;
[0130]
图6是本发明盐晶型或共晶xm-ii的tga图;
[0131]
图7是本发明盐晶型或共晶xm-ii的dsc图;
[0132]
图8是本发明盐晶型或共晶xm-ii的1h nmr谱图;
[0133]
图9是本发明盐晶型或共晶xm-iii的xrpd图;
[0134]
图10是本发明盐晶型或共晶xm-iii的tga图;
[0135]
图11是本发明盐晶型或共晶xm-iii的dsc图;
[0136]
图12是本发明盐晶型或共晶xm-iii的1h nmr谱图;
[0137]
图13是本发明盐晶型或共晶xm-iv的xrpd图;
[0138]
图14是本发明盐晶型或共晶xm-v的xrpd图;
[0139]
图15是本发明盐晶型或共晶xm-v的tga图;
[0140]
图16是本发明盐晶型或共晶xm-v的dsc图。
具体实施方式
[0141]
本发明人在经过长期而深入地研究,提供了一种式(i)化合物非索替尼的盐型或共晶—盐晶型或共晶xm-i、xm-ii、xm-iii、xm-iv和xm-v。这5个晶型在稳定性、溶解度、引湿性、压片稳定性、机械稳定性、流动性、工艺可开发性、制剂开发、提纯作用及粉体加工性能等方面至少存在一方面的优势。基于上述发现,发明人完成了本发明。
[0142]
术语
[0143]
在本文中,除非特别说明,各缩写均为本领域技术人员所理解的常规含义。
[0144]
如本文所用,除非特别说明,术语“式(i)化合物原料”是指式(i)化合物的无定型(形)和/或各种晶型,包括本文提及的各种晶型和无定型、公开或未公开的各种文献或专利中提及的晶型或无定型。
[0145]
如本文所用,除非特别说明,加入溶剂或溶液的方式为直接倒入或匀速加入等。
[0146]
如本文所用,术语“室温”一般指4-30℃,较佳地指20
±
5℃。
[0147]
如本文所用,“缓慢加入”的方式,包括但不限于:逐滴滴加,沿容器壁缓慢加入等。
[0148]
非索替尼盐晶型或共晶
[0149]
如本文所用,“本发明的晶型”是指如本文中所述的盐晶型或共晶xm-i、盐晶型或共晶xm-ii、盐晶型或共晶xm-iii、盐晶型或共晶xm-iv和盐晶型或共晶xm-v。其中,盐晶型或共晶xm-i和xm-ii是非索替尼与马来酸形成的晶型或共晶,盐晶型或共晶xm-iii为非索替尼与硫酸形成的晶型或共晶,盐晶型或共晶xm-iv非索替尼与盐酸形成的晶型或共晶;盐晶型或共晶xm-v是非索替尼与硬脂酸形成的晶型或共晶。
[0150]
其中,盐晶型或共晶xm-i为非索替尼与马来酸形成的晶型或共晶,其xrpd图包括3个或以上(较佳地为6个或6个以上)选自下组的2θ值:3.2
°±
0.2
°
、5.6
°±
0.2
°
、6.5
°±
0.2
°
、8.7
°±
0.2
°
、9.8
°±
0.2
°
、11.4
°±
0.2
°
、11.8
°±
0.2
°
、13.1
°±
0.2
°
、14.3
°±
0.2
°
、15.0
°±
0.2
°
、20.0
°±
0.2
°
、20.6
°±
0.2
°
、23.1
°±
0.2
°
。
[0151]
一种优选的实施方式下,盐晶型或共晶xm-i具有基本如图1所示的xrpd图。
[0152]
另一种优选的实施方式下,所述盐晶型或共晶xm-i具有基本如图2所示的tga图。
[0153]
另一种优选的实施方式下,所述盐晶型或共晶xm-i具有基本如图3所示的dsc图。
[0154]
另一种优选的实施方式下,所述盐晶型或共晶xm-i具有基本如图4所示的1h nmr图谱。
[0155]
所述的盐晶型或共晶xm-ii为非索替尼与马来酸形成的晶型或共晶,其xrpd图包括3个或以上(较佳地为6个或6个以上)选自下组的2θ值:4.1
°±
0.2
°
、5.9
°±
0.2
°
、8.3
°±
0.2
°
、12.5
°±
0.2
°
、14.2
°±
0.2
°
、15.9
°±
0.2
°
、16.7
°±
0.2
°
、17.5
°±
0.2
°
、18.0
°±
0.2
°
、19.9
°±
0.2
°
、21.6
°±
0.2
°
、22.7
°±
0.2
°
、24.6
°±
0.2
°
、25.0
°±
0.2
°
、26.1
°±
0.2
°
、27.7
°±
0.2
°
、29.7
°±
0.2
°
。
[0156]
一种优选的实施方式下,盐晶型或共晶xm-ii具有基本如图5所示的xrpd图;
[0157]
另一种优选的实施方式下,所述盐晶型或共晶xm-ii具有基本如图6所示的tga图;
[0158]
另一种优选的实施方式下,所述盐晶型或共晶xm-ii具有基本如图7所示的dsc图;
[0159]
另一种优选的实施方式下,所述盐晶型或共晶xm-ii具有基本如图8所示的1h nmr图谱。
[0160]
盐晶型或共晶xm-iii为非索替尼与硫酸形成的晶型或共晶,其xrpd图包括6个或6个以上选自下组的2θ值:5.1
°±
0.2
°
、7.2
°±
0.2
°
、8.1
°±
0.2
°
、10.2
°±
0.2
°
、11.7
°±
0.2
°
、13.1
°±
0.2
°
、15.0
°±
0.2
°
、16.2
°±
0.2
°
、17.6
°±
0.2
°
、19.5
°±
0.2
°
、20.4
°±
0.2
°
、21.2
°±
0.2
°
、25.2
°±
0.2
°
、26.3
°±
0.2
°
;
[0161]
一种优选的实施方式下,所述盐晶型或共晶xm-iii具有基本如图9所示的xrpd图;
[0162]
另一种优选的实施方式下,所述盐晶型或共晶xm-iii具有基本如图10所示的tga图;
[0163]
另一种优选的实施方式下,所述盐晶型或共晶xm-iii具有基本如图11所示的dsc图;
[0164]
另一种优选的实施方式下,所述盐晶型或共晶xm-iii具有基本如图12所示的1h nmr图谱。
[0165]
盐晶型或共晶xm-iv为非索替尼与盐酸形成的晶型或共晶,其xrpd图包括6个或6个以上选自下组的2θ值:3.6
°±
0.2
°
、5.0
°±
0.2
°
、5.4
°±
0.2
°
、9.8
°±
0.2
°
、13.2
°±
0.2
°
、13.8
°±
0.2
°
、16.4
°±
0.2
°
、17.5
°±
0.2
°
、18.6
°±
0.2
°
、19.8
°±
0.2
°
、20.8
°±
0.2
°
、21.8
°±
0.2
°
、24.1
°±
0.2
°
、25.1
°±
0.2
°
、26.4
°±
0.2
°
。
[0166]
一种优选的实施方式下,所述盐晶型或共晶xm-iv具有基本如图13所示的xrpd图。
[0167]
盐晶型或共晶xm-v是非索替尼与硬脂酸形成的晶型或共晶,其xrpd图包括6个或6个以上选自下组的2θ值:3.8
°±
0.2
°
、5.7
°±
0.2
°
、7.6
°±
0.2
°
、9.5
°±
0.2
°
、13.3
°±
0.2
°
、23.1
°±
0.2
°
、24.6
°±
0.2
°
;
[0168]
另一种优选的实施方式下,所述盐晶型或共晶xm-v具有基本如图14所示的xrpd图;
[0169]
另一种优选的实施方式下,所述盐晶型或共晶xm-v具有基本如图15所示的tga图;
[0170]
另一种优选的实施方式下,所述盐晶型或共晶xm-v具有基本如图16所示的dsc图。
[0171]
含有非索替尼晶型的药物组合物
[0172]
本发明的另一方面提供了一种药物组合物,其含有治疗有效量的如本发明所述的非索替尼晶型,以及任选地,一种或多种可药用的载体、赋形剂、佐剂、辅料和/或稀释剂。所述辅料例如为气味剂、香味剂、甜味剂等。
[0173]
本发明所提供的药物组合物优选含有重量比为1-99%的活性成份,其优选的比例是,通式i化合物作为活性成分占总重量的65wt%~99wt%,其余部分为药学可接受的载体、稀释液或溶液或盐溶液。
[0174]
本发明所提供的化合物和药物组合物可以是多种形式,如片剂、胶囊、粉剂、糖浆、溶液状、悬浮液和气雾剂等,并可以存在于适宜的固体或液体的载体或稀释液中和适宜的用于注射或滴注的消毒器具中。
[0175]
本发明的药物组合物的各种剂型可按照药学领域的常规制备方法制备。其制剂配方的单位计量中包含1mg-700mg通式i化合物,优选地,制剂配方的单位计量中包含25mg-300mg通式i化合物。
[0176]
本发明的化合物和药物组合物可对哺乳动物临床使用,包括人和动物,可以通过口、鼻、皮肤、肺或者胃肠道等的给药途径。最优选为口服。最优选日剂量为50-1400mg/kg体重,一次性服用,或25-700mg/kg体重分次服用。不管用何种服用方法,个人的最佳剂量应依据具体的治疗而定。通常情况下是从小剂量开始,逐渐增加剂量一直到找到最适合的剂量。
[0177]
本发明的药物组合物可以用于fgfr4驱动的局部晚期或转移性肝细胞癌(hcc)患者的治疗,在用于治疗时,本发明的晶型或由本发明的晶型制得的非索替尼(无定型)可以单独给药,或者与其他药学上可接受的化合物联合给药。
[0178]
在本发明中,除非特别说明,干燥所用的方法为本领域的常规干燥方法,例如在本发明的实施例中干燥是指在常规干燥用烘箱进行真空干燥或常压干燥。一般地,干燥0.1~50h或1~30h。
[0179]
本发明的主要优点在于:
[0180]
本发明的晶型在制备过程中使用的溶剂可选低毒或无毒溶剂,制备方法均为常规的、可工业化生产的结晶方法,可通过控制工艺参数,进而控制粒度、晶习和晶型等,进而得到稳定高质量的产品。
[0181]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0182]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
[0183]
通用方法和试剂
[0184]
本发明中所用的溶剂均为分析纯,含水量约为0.1%。实施例中作为原料的式(i)化合物均通过购买。本发明所有的测试方法均为通用方法,测试参数如下:
[0185]
xrpd图测定方法:
[0186]
x-射线粉末衍射仪器:bruker d2 phaser x-射线粉末衍射仪;辐射源射线粉末衍射仪;辐射源发生器(generator)kv:30kv;发生器(generator)ma:10ma;起始的2θ:2.000
°
,扫描范围:2.0000~35.000
°
,扫描步长0.02
°
,扫描速度0.1s/step。
[0187]
tga图测定方法:
[0188]
热重分析法(tga)仪器:美国ta公司的tga55型;加热速率:10℃/min;氮气流速:40ml/min。
[0189]
dsc图测定方法:
[0190]
差示扫描量热法(dsc)仪器:美国ta公司的ta q2000型;加热速率:10℃/min,氮气流速:50ml/min。
[0191]
核磁共振氢谱数据(1h nmr)采自于bruker avance ii dmx 400m hz核磁共振波谱仪。称取2mg样品,溶于0.6ml氘代二甲亚砜中,过滤,滤液加入核磁管中进行测试。
[0192]
实施例1:盐晶型或共晶xm-i的制备
[0193]
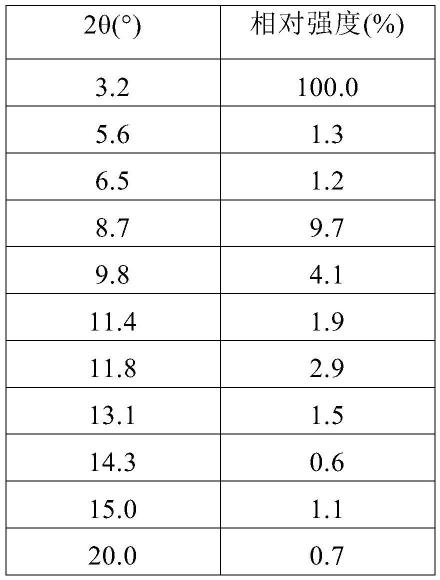
在0.2ml的异丙醇/水(1:1,v/v)溶液中,加入6.7mg式(i)化合物非索替尼,搅拌均匀。然后,缓慢滴入马来酸溶液(2.0mg马来酸溶于0.2ml的异丙醇/水(1:1,v/v)),在20℃下搅拌5天,过滤,收集固体,用1ml水润洗,所得固体为式(i)非索替尼与马来酸结合的盐晶型或共晶xm-i。
[0194]
对得到的盐晶型或共晶xm-i进行xrpd测试,其结果如图1,图谱数据见表1;对所得固体进行tga测试,其谱图如图2所示;对所得固体进行dsc测试,其谱图如图3所示;对所得固体进行1h nmr测试,其谱图如图4所示,核磁数据:1h nmr(400mhz,dmso-d6)δ9.19(s,1h),8.02(d,j=8.8hz,1h),7.69(s,1h),7.57
–
7.48(m,2h),7.03(d,j=17.8hz,2h),6.25(s,2h),6.06(dd,j=17.1,2.2hz,1h),5.55(dd,j=10.1,2.1hz,1h),4.33(s,2h),3.97(s,6h),3.85(d,j=11.7hz,2h),3.65(d,j=12.8hz,1h),3.55
–
3.53(m,1h),1.98(d,j=6.0hz,1h),1.69(d,j=12.8hz,1h)。
[0195]
表1非索替尼盐晶型或共晶xm-i的xrpd谱图
[0196][0197][0198]
实施例2:盐晶型或共晶xm-ii的制备
[0199]
在0.2ml的丙酮/水(1:4,v/v)溶液中,加入7.5mg式(i)化合物非索替尼,搅拌均匀。然后,缓慢滴入马来酸溶液(2.7mg马来酸溶于0.2ml的异丙酮/水(1:4,v/v)溶液),在20℃下搅拌5天,过滤,收集固体,用1ml水润洗,所得固体为式(i)非索替尼与马来酸结合的盐晶型或共晶xm-ii。
[0200]
对得到的固体进行xrpd测试,其结果如图5,图谱数据见表2;对所得固体进行tga测试,其谱图如图6所示;对所得固体进行dsc测试,其谱图如图7所示;对所得固体进行1h nmr测试,其谱图如图8所示,核磁数据:1h nmr(400mhz,dmso-d6)δ9.18(s,1h),8.01(d,j=7.7hz,1h),7.69(s,1h),7.53(d,j=9.2hz,2h),7.01(s,2h),6.30
–
6.19(m,3h),6.06(dd,j=17.1,2.1hz,1h),5.55(dd,j=10.1,2.2hz,1h),4.33(s,2h),3.97(s,6h),3.85(d,j=10.4hz,2h),3.65(d,j=12.6hz,1h),3.55
–
3.53(m,1h),1.99
–
1.96(m,1h),1.69(d,j=15.3hz,1h)。
[0201]
表2非索替尼盐晶型或共晶xm-ii的xrpd谱图
[0202][0203][0204]
实施例3:盐晶型或共晶xm-iii的制备
[0205]
称取37.5mg式(i)化合物非索替尼于2ml ipa/水(1:1,v/v)溶液中,振荡均匀。然后将非索替尼溶液与硫酸溶液(1ml浓硫酸(95%~98%)于1.5ml ipa/水(1:1,v/v)中)混合。在17℃下,搅拌5天。收集固体,用1ml水润洗,所得固体为式(i)化合物非索替尼与硫酸结合的盐晶型或共晶xm-iii。
[0206]
对得到的固体进行xrpd测试,其结果如图9,图谱数据见表3;对所得固体进行tga测试,其谱图如图10所示;对所得固体进行dsc测试,其谱图如图11所示;对所得固体进行1h nmr测试,其谱图如图12所示,核磁数据:1h nmr(400mhz,dmso-d6)δ9.18(s,1h),8.00(d,j=3.0hz,1h),7.69(s,1h),7.56
–
7.50(m,2h),7.10
–
6.94(m,2h),6.25(dd,j=15.5,11.3hz,1h),6.06(d,j=18.6hz,1h),5.55(d,j=10.1hz,1h),4.35(s,2h),3.97(s,6h),3.85(d,j=10.9hz,2h),3.65(d,j=10.9hz,1h),3.51(d,j=3.2hz,1h),2.03
–
2.01(m,1h),1.69(d,j=9.4hz,1h)。
[0207]
表3非索替尼盐晶型或共晶xm-iii的xrpd谱图
[0208][0209][0210]
实施例4:盐晶型或共晶xm-iv的制备
[0211]
在0.2ml的甲苯中加入7.4mg式(i)化合物非索替尼,搅拌均匀。然后,将非索替尼溶液与盐酸溶液(在0.2ml的甲苯中加入2μl盐酸)混合。在18℃下,搅拌24h。收集固体,用1ml水润洗,所得固体为式(i)化合物与盐酸结合的盐晶型或共晶xm-iv。
[0212]
对得到的固体进行xrpd测试,其结果如图13,图谱数据见表4。
[0213]
表4非索替尼盐晶型或共晶xm-iv的xrpd谱图
[0214]
2θ(
°
)相对强度(%)3.6100.05.067.05.473.39.896.013.248.113.852.716.437.217.540.618.635.019.847.620.841.0
21.899.924.165.425.173.926.451.4
[0215]
实施例5:盐晶型或共晶xm-v的制备
[0216]
在0.2ml的甲苯中,加入7.2mg式(i)化合物非索替尼,搅拌均匀。然后,缓慢滴入硬脂酸溶液(4.9mg硬脂酸溶于0.2ml的甲苯),在18℃下,搅拌24h。待溶液澄清后,将澄清液置于18℃的环境下快速挥发,有固体析出。收集固体,用1ml乙醚润洗,所得固体为式(i)化合物与硬脂酸结合的盐晶型或共晶xm-v。
[0217]
对得到的固体进行xrpd测试,其结果如图14,图谱数据见表5;对所得固体进行tga测试,其谱图如图15所示;对所得固体进行dsc测试,其谱图如图16所示。
[0218]
表5非索替尼盐晶型或共晶xm-v的xrpd谱图
[0219]
2θ(
°
)相对强度(%)3.832.35.7100.07.614.29.534.613.35.823.111.124.629.8
[0220]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。