1.本发明涉及在不使用作为亲和层析的蛋白a(protein a)柱的情况下以低成本高纯度及高收率地纯化抗体的方法。
背景技术:
2.生物制药研究研发的最新趋势在于,重点在于抗体片段的开发。相比于以往,开发了更多的生物类似药(biosimilar)治疗蛋白质,但在开发生物类似药产品时的重大难点有分离纯化工艺(downstream processing)的高费用、工艺及与生成物关联的杂质的非选择性清除、生成物的蛋白质分解等。相比于全尺寸的单克隆抗体(mab)治疗剂,抗体片段提供特定优点,这优点为如增强对肿瘤的深度渗透、无法接近全尺寸的mab的特异性表位结合等。如高效价克隆及连续性生物-制备(bio-manufacturing)的发酵培养工艺(up stream processes)中的进步将生物制药产品的重点转移到提高整体分离纯化工艺的经济性。分离纯化工艺占用于单克隆抗体治疗剂的整体制备费用的约60%至70%。分离纯化工艺的捕获程序、中间程序及打磨(polishing)程序包括使用昂贵的各种层析操作。
3.由此,关于抗体药物,对纯化工艺进行更多的研究研发。
4.例如,对于单克隆抗体的纯化方法通常包括4个基本步骤来进行技术开发,并具有与此相关的诸多研究。这些步骤如下:步骤(1),从回收-发酵培养物中分离宿主细胞;步骤(2),从捕获-净化的回收物中大部分成分中分离抗体;步骤(3),去除微细纯化-残留宿主细胞污染物及凝聚物;以及步骤(4),将剂型化-抗体配置于对于最大稳定性及储存期限适合的载体。但是这些步骤并不是一定生成足以在药剂学情况中使用的纯度的抗体组合物。因此,最重要的是生成及纯化去除足以适合药剂学使用程度的杂质的纯化形式的目标抗体。
5.具体地,作为用于生产抗体药物的纯化工艺,主要进行利用蛋白a柱的纯化工艺。但是,在利用蛋白a柱的纯化方法的情况下,具有可在初始步骤中能够以高纯度生产的优点,但是,价格相比于普通离子交换树脂高30倍以上,从而具有生产成本高的缺点。
6.根据以往的报告,蛋白a树脂占相当于抗体药品生产原料成本的约35%的高比例,在柱中洗脱的微量的蛋白a可在人体内部引起免疫反应或生理反应。因此,在利用蛋白a柱的纯化工艺的情况下,具有按照工艺监控并去除残留的蛋白a的困难。并且,作为生物相容性基团的蛋白a具有化学稳定性弱的缺点,在柱的再生步骤中,需在保持蛋白a的活性的状态下再生,因此,无法使用在洗涤工艺中必须使用的1m的naoh,因此无法完全去除附着在柱的杂质,从而,具有再生柱来使用的次数相比于其他普通化学数值显著降低的局限。
7.为了解决这种问题,已经进行了许多努力以使用阳离子交换柱、疏水性柱、阴离子交换柱等来去除杂质并研发高纯度抗体。
8.尤其,利用在抗体的生产中使用的动物细胞,尤其,cho细胞株生产的抗体的培养液中不仅包含目标抗体,还包含大量的cho细胞本身中产生的源自宿主细胞蛋白质(hcp)、源自宿主细胞dna(hcd)等的杂质,并且,还包含用于细胞生长的因子。因此,在不使用蛋白a层析柱的情况下纯化抗体时,尤其重要的是在初始步骤中可去除的杂质的量。但是,为了开
发不使用蛋白a层析的情况下能够提高低hcp水平和主要活性抗体的比例的抗体纯化工艺,具有需要开发适合的层析种类及顺序、以及工艺的优化过程的困难。
9.例如,通常,在使用阳离子交换柱的情况下,为了降低异构抗体的比例、提高主要活性抗体的比例,混合使用各种缓冲液。由此,由于使用多个缓冲液而引起的复杂的工艺,难以收集洗脱(elution)的蛋白质。尤其,在使用阳离子交换柱时,洗涤(washing)工艺需要使用具有大量的不同成分的缓冲液组成成分,在洗涤过程中使用的柱体积相当大,因此,工艺过程中丢弃的缓冲液的量相当多,而且,具有在制备工艺中耗时长的问题。
10.由于如上所述的问题,抗体生产费用及生产时间大大增加,即使确保质量,具有收率可能低的问题。
11.在这种背景下,提供便于获得生物类似药产品,尤其,纯化的抗体片段的分离纯化步骤非常重要。在坚持现有技术的分离纯化步骤而提出的问题中,本发明人所要提供用于纯化抗体的方法。通过本发明获得的纯化的抗体在满足优秀的纯度及活性标准的同时满足高于现有工艺的收率。
技术实现要素:
12.要解决的技术问题
13.本发明人确认若在适当的缓冲液条件下,将调节ph及导电率的试料在阳离子交换柱中纯化,则获取高主要活性抗体比例以及高收率,并可制备高质量的抗体制剂,从而完成了本发明。尤其,在本发明中,在阳离子交换柱的洗脱工艺中使用的大量的洗脱步骤的缓冲液减少一半左右,并缩减工艺时间,减少缓冲液的使用量,并且,大大增加所生成的抗体收率,从而完成了本发明。由此,本发明提供下述目的的发明。
14.本发明的一目的在于,提供一种抗体的纯化方法,包括下述步骤,即,将包含抗体及一种以上的宿主细胞蛋白质(host cell protein,hcp)的ph 5.5至7.0及导电率为5ms/cm至8ms/cm的试料加载到平衡化的阳离子交换柱,利用洗涤缓冲液洗涤阳离子交换柱后,利用洗脱缓冲液对与柱结合的抗体进行洗脱,在上述抗体的纯化方法中,
15.上述利用洗涤缓冲液进行洗涤的步骤包括:
16.1),利用包含0mm至38mm的氯化钠且包含ph 5.5至7.0的10mm至50mm的磷酸盐的缓冲液对抗体进行洗涤,
17.上述利用洗脱缓冲液进行洗脱的步骤包括:
18.步骤1),利用包含38mm至50mm的氯化钠且包含ph 6.0至7.0的10mm至50mm的磷酸盐的缓冲液对抗体进行第一次洗脱;以及
19.步骤2),利用包含50mm至60mm的氯化钠且包含ph 6.0至7.0的10mm至50mm的磷酸盐的缓冲液对抗体进行第二次洗脱。
20.本发明的另一目的在于,提供通过上述方法制备的抗体。
21.用于解决问题的手段
22.作为用于实现上述目的的一实施方式,本发明提供一种抗体的纯化方法,其包括下述步骤:包含抗体及一种以上的宿主细胞蛋白质的ph 5.5至7.0及导电率为5ms/cm至8ms/cm的试料加载到平衡化的阳离子交换柱,利用洗涤缓冲液洗涤阳离子交换柱后,利用洗脱缓冲液对与柱结合的抗体进行洗脱。
23.具体地,提供一种抗体的纯化方法,其包括下述步骤:将包含抗体及一种以上的宿主细胞蛋白质的ph 5.5至7.0及导电率为5ms/cm至8ms/cm的试料加载到平衡化的阳离子交换柱,利用洗涤缓冲液洗涤阳离子交换柱后,利用洗脱缓冲液对与柱结合的抗体进行洗脱,在上述抗体的纯化方法中,
24.上述利用洗涤缓冲液进行洗涤的步骤包括步骤1),利用包含0mm至38mm的氯化钠且包含10mm至50mm的磷酸盐(优选为磷酸钠)(ph 5.5至7.0)的缓冲液对抗体进行洗涤,
25.上述利用洗脱缓冲液进行洗脱的步骤包括:
26.步骤1),利用包含38mm至50mm的氯化钠且包含10mm至50mm的磷酸盐(优选为磷酸钠)(ph 6.0至7.0)的缓冲液对抗体进行第一次洗脱;以及
27.步骤2),利用包含50mm至60mm的氯化钠且包含10mm至50mm的磷酸盐(优选为磷酸钠)(ph 6.0至7.0)的缓冲液对抗体进行第二次洗脱。
28.相比于现有技术,在本发明的抗体的纯化方法中,能够以少量的缓冲液进行更高收率的纯化,由此,减少生产成本,可快速进行纯化工艺,从而对于抗体的纯化工艺具有优秀的优点。
29.具体地,本发明的方法为如下的方法:在包含抗体及一种以上的源自宿主细胞的蛋白质的混合物中,不使用蛋白a柱工艺,也可生产显著减少源自宿主细胞的蛋白质及异构抗体的抗体纯化物。在从表达动物细胞等的宿主细胞表达抗体并由此获取抗体的情况下,其中除目标抗体之外,还存在宿主细胞蛋白质、源自宿主细胞的dna(hcd)及生长因子等,进而,可存在目标抗体的异构抗体(例:酸性异构抗体、碱性异构抗体)等。因此,为了制备抗体制剂,通过去除上述混合存在的杂质来提高纯度,并需要获取所要质量的抗体的纯化过程,尤其,需要可有效去除宿主细胞蛋白质及异构抗体的纯化过程。但是,需明确为了开发其优化方法而使用的柱的类型、纯化顺序及优化条件,实际难以开发其工艺。
30.因此,本发明提供如下的方法:调节表达抗体的宿主细胞的培养上清液的ph及导电率,在阳离子交换层析中,在洗涤步骤及洗脱步骤的条件,尤其,缓冲液的性状及柱体积条件中给予差异,从而,不仅可显著减少宿主细胞蛋白质及异构抗体水平,还能够以高收率纯化抗体。
31.在本发明中,术语“包含抗体及一种以上的宿主细胞蛋白质的试料”为生产抗体的细胞的培养上清液、上述细胞的破碎物或由此部分纯化的试料,是指包含所要纯化的目标抗体及宿主细胞蛋白质的试料。上述部分纯化是指执行了过滤过程,但除所要纯化的抗体之外还存在其他蛋白质的状态。
32.其中,为了在本发明的方法中有效去除异构抗体,可将上述试料调节为如下,即,ph 5.5至7.0,导电率为5.0ms/cm至8.0ms/cm。
33.详细地,上述ph可以为5.8至6.2。上述导电率为5.0ms/cm至8.0ms/cm,更详细地,上述导电率为6.0ms/cm至8.0ms/cm,更加详细地,上述导电率可以为7.0ms/cm至8.0ms/cm,具体地,可约为7.0ms/cm。
34.在本发明中,以试料的ph 5.8至6.2的条件及导电率为7.0ms/cm至8.0ms/cm的条件执行阳离子柱层析的结果,即使利用少量的缓冲液,也能够以高收率执行纯化,而且,还大大减少了碱性异构抗体的含量。
35.在将具有如上所述的ph及导电率的试料适用于阳离子交换层析的情况下,在很好
地将所要纯化的抗体吸附在阳离子交换柱的同时如宿主细胞蛋白质的杂质灌注排出,或者与阳离子交换树脂弱结合或非特异性结合,从而可在洗涤步骤中容易去除。并且,容易降低异构抗体,尤其,碱性异构抗体的比例,由此,容易调节所要的抗体比例。
36.在本发明中,术语“导电率”是指使两个电极之间的电流通过的水溶液的能力。在溶液中,电流通过离子输送流动。因此,若增加水溶液中存在的离子量,则溶液具有更高的导电率。导电率为可搬运电流的溶液中的离子的能力,因此,可通过改变溶液的离子浓度来变更溶液的导电率。例如,为了获取所要的导电率,可改变溶液中的缓冲剂的浓度和/或盐(例如,氯化钠、乙酸钠或氯化钾)的浓度。详细地,可通过改变各种缓冲液的盐浓度来获取所要的导电率。
37.在本发明中,术语“抗体”为通过刺激免疫系统中的抗原而产生的物质,是指通过与特定抗原特异性结合来在淋巴和血液中循环以引起抗原-抗体反应的物质。出于本发明的目的,上述抗体为用于高质量纯化的蛋白质之一,可通过本发明的方法有效纯化。
38.通常,上述抗体的等电点比其他蛋白质高,因此,通过使用初始阳离子交换树脂将培养上清液吸附在柱后,当进行洗脱时,能够以较高的纯度进行第一次纯化。上述等电点(isoelectric point,pi)为蛋白质分子表面的平均有效电荷,即,蛋白质分子的双电层的电势成为0的ph,意味着蛋白质的基团解离而使阳离子基团、阴离子基团的数变得相同,从而使有效电荷变为0的点。在本发明中用于纯化的抗体并不局限于此,详细地,等电点可以为6至11,更详细地,可以为7至10的抗体。并且,本发明的抗体并不局限于此,详细地,可包括所有在本领域中通常使用的用于治疗的抗体。可通过本发明的方法有效纯化的抗体可以为靶向血管内皮生长因子a(vascular endothelial growth factor a,vegf-a)的抗体——贝伐单抗(bevacizumab)。上述贝伐单抗抗体可具有1至3水平的抗体效价。详细地,可具有2至3水平的抗体效价。
39.在本发明中,术语“主要活性抗体”为包括在本发明的抗体群的主要成分,是指抗体中的一部分氨基酸通过脱氨基或氧化而修饰(modification)而不降低生物活性的状态的抗体,即,并不是酸性或碱性异构抗体的抗体。上述主要活性抗体为用于调节所要的抗体群的质量的最重要的成分,是抗体的成分中生物活性最高的抗体。
40.在本发明中,术语“异构抗体”是指主要活性抗体的一部分氨基酸通过脱氨基或氧化而修饰的抗体,包括酸性异构抗体以及碱性异构抗体。例如,有氨基酸中的天冬酰胺(asparagine)被脱氨基而成为天冬氨酸盐(aspatate)的异构抗体、氨基酸中的蛋氨酸(methionine)被氧化而成为蛋氨酸硫酸(methionine sulfate)的异构抗体等。并且,当在重链的n末端存在谷氨酸盐(glutamate)的情况下,包含上述谷氨酸盐形成五边形环结构而修饰为丙酮谷氨酸(pyruglutamate)的异构抗体。在如cho细胞的宿主细胞中生成抗体的情况下,上述异构抗体以高比例包含在宿主细胞培养液,由此,应通过如层析的过程被去除而以所要的比例包含在抗体群。
41.因此,在引入包含编码抗体的多核苷酸的载体的宿主细胞中,为了制备高质量的抗体群,需要适当的去除如上所述的异构抗体而以所要的含量包含主要活性抗体及异构抗体。并且,为了制备高纯度的抗体群,需去除如宿主细胞蛋白、源自宿主细胞的dna(hcd)及用于细胞生长的因子的杂质。因此,在本发明中开发了一种抗体的制备方法,其不仅调节上述异构抗体的含量,还有效地去除了如宿主细胞蛋白的杂质。
42.在本发明中,术语“宿主细胞蛋白质(host cell protein,hcp)”为与相应抗体不同的蛋白质,通常是指抗体生产的供给源,即,源自宿主细胞的蛋白质。优选地,在可用作药物的抗体中,hcp应从最初抗体制剂排除。上述去除的宿主细胞蛋白质为包括除所要纯化的抗体之外的所有杂质的概念,不仅可包括宿主细胞蛋白质本身,还可包括源自宿主细胞的dna及用于细胞生长的因子等。因此,若去除上述宿主细胞蛋白质,则能够以高纯度仅纯化所要纯化的抗体。
43.在本发明中,术语“阳离子交换层析”是指利用填充阳离子交换树脂的柱的层析,可通过执行阳离子交换层析来去除杂质,详细地,可去除宿主细胞蛋白及异构抗体。上述阳离子交换树脂为起到交换水溶液中的阳离子与自身的阳离子的作用的合成树脂,在抗体的情况下,等电点高,因此,在等电点值以下的ph缓冲液中带阳离子。因此,利用可吸附带上述阳离子的抗体的阳离子交换树脂,在本发明的方法中可提高抗体纯化效率,尤其,上述ph可以为5.8至6.2,上述导电率可以为5.0ms/cm至8.0ms/cm,详细地,上述导电率可以为6.0ms/cm至8.0ms/cm,更详细地,上述导电率可以为7.0ms/cm至8.0ms/cm。具体地,可约为7.0ms/cm。
44.在本发明中,包括下述步骤作为洗涤步骤:
45.步骤1),利用包含0mm至38mm的氯化钠且包含10mm至50mm的磷酸盐(ph 5.5至7.0)的缓冲液对抗体进行洗涤。
46.优选地,在这种洗涤步骤的情况下,以约7柱体积至20柱体积,详细地,以约13柱体积使用上述洗涤缓冲液。
47.在这种洗涤步骤的情况下,在以规定的摩尔浓度保持10mm至50mm的磷酸盐的条件的同时使用增加氯化钠的摩尔浓度的洗涤缓冲液,执行多次的洗涤。
48.例如,可利用如下的缓冲液执行第一次洗涤,即,包含10mm至50mm的磷酸盐,详细地,包含15mm至30mm的磷酸盐,更详细地,包含约20mm的磷酸盐,不包含氯化钠,ph 5.5至7.0。之后,可利用上述相似缓冲液(例如,仅使ph条件设定得不同的缓冲液等)重复执行第二次洗涤。接着,可利用如下的缓冲液执行第三次洗涤,即,包含10mm至50mm的磷酸盐,详细地,包含15mm至30mm的磷酸盐,更详细地,包含约20mm的磷酸盐,包含20mm至38mm的氯化钠;ph 6.0至7.0。
49.由此,利用包含0mm至38mm的氯化钠且包含10mm至50mm的磷酸盐(ph 5.5至7.0)的缓冲液对抗体进行洗涤的上述步骤1)可包括下述步骤:
50.步骤a),利用不包含氯化钠且包含10mm至50mm的磷酸盐(ph 5.5至7.0)的洗涤缓冲液进行第一次洗涤;
51.步骤b),利用不包含氯化钠且包含10mm至50mm的磷酸盐(ph 6.0至7.0)的洗涤缓冲液进行第二次洗涤;以及
52.步骤c),利用包含20mm至38mm的氯化钠且包含10mm至50mm的磷酸盐(ph 6.0至7.0)的洗涤缓冲液进行第三次洗涤。
53.详细地,上述步骤中的磷酸盐的含量可以为15mm至30mm,具体地,可以为约20mm的磷酸盐。上述步骤中的氯化钠的含量分别可以为0mm、0mm及37.5mm。
54.优选地,在进行第一次洗涤的步骤的情况下,以约1柱体积至7柱体积,详细地,以约5柱体积使用上述洗涤缓冲液。
55.优选地,在进行第二次洗涤的步骤的情况下,以约1柱体积至5柱体积,详细地,以约3柱体积使用上述洗涤缓冲液。
56.根据本发明的具体一实施例,上述第一次洗涤及第二次洗涤分别为利用包含约ph 6.0及6.48的20mm的磷酸盐的缓冲液进行洗涤来使为附着在柱的抗体附着的洗涤步骤。
57.优选地,在进行第三次洗涤的步骤的情况下,以约3柱体积至7柱体积,详细地,以约5柱体积使用上述洗涤缓冲液。根据本发明的具体实施例,在进行第三次洗涤的步骤中,可利用包含约ph 6.48的37.5mm的nacl的20mm的磷酸盐执行洗涤。
58.在本发明中,包括下述步骤作为进行洗脱的步骤:
59.步骤1),利用包含38mm至50mm的氯化钠且包含10mm至50mm的磷酸盐(ph 6.0至7.0)的缓冲液对抗体进行第一次洗脱;以及
60.步骤2),利用包含50mm至60mm的氯化钠且包含10mm至50mm的磷酸盐(ph 6.0至7.0)的缓冲液对抗体进行第二次洗脱。
61.优选地,在这种进行第一次洗脱的步骤的情况下,以约10柱体积至20柱体积,详细地,以约16柱体积使用上述缓冲液。
62.优选地,在这种进行第二次洗脱的步骤的情况下,以约5柱体积至12柱体积,详细地,以约7柱体积使用上述缓冲液。
63.详细地,在上述步骤中,磷酸盐的含量可以为15mm至30mm,具体地,可以为约20mm的磷酸盐。
64.在将本发明的包含所要纯化的抗体及宿主细胞蛋白质的试料注入至阳离子交换树脂的情况下,抗体与阳离子交换树脂结合,包含宿主细胞蛋白质的杂质在不结合的情况下通过(灌注)柱,或者与柱弱结合,因此,在将上述试料注入至阳离子交换树脂后,处理洗涤缓冲液来去除弱结合的宿主细胞蛋白质及异构抗体等后,可处理洗脱缓冲液来获取所要纯化的抗体。
65.在本发明的方法中使用的上述阳离子交换树脂可使用本领域广泛使用的,但并不局限于此,详细地,可使用羧甲基(cm)、磺乙基(se)、磺丙基(sp)、磷酸盐(p)或磺酸盐(s)等,更详细地,可使用羧酸盐(coo-)或磺酸盐(so3),在上述官能团为磺酸盐的阳离子交换树脂中,尤其,可使用fractogel
tm emd so3,但并不局限于此。
66.详细地,使用上述fractogel
tm emd so3作为上述阳离子交换树脂来纯化抗体的方法可包括:
67.步骤(i),向利用包含10mm至50mm的磷酸盐(ph 5.5至7.0)的平衡缓冲液平衡化的fractogel
tm emd so3柱加载包含抗体的混合液的试料;
68.步骤(ii),利用包含0mm至38mm的氯化钠且包含10mm至50mm的磷酸盐(ph 5.5至7.0)的缓冲液进行洗涤;
69.步骤(iii),利用包含38mm至50mm的氯化钠且包含10mm至50mm的磷酸盐(ph 6.0至7.0)的缓冲液对抗体进行第一次洗脱;以及
70.步骤(iv),利用包含50mm至60mm的氯化钠且包含10mm至50mm的磷酸盐(ph 6.0至7.0)的缓冲液对抗体进行第二次洗脱。
71.尤其,利用包含0mm至38mm的氯化钠且包含10mm至50mm的磷酸盐(ph 5.5至7.0)的缓冲液进行洗涤的上述步骤(ii)可包括:
72.步骤a),利用不包含氯化钠且包含10mm至50mm的磷酸盐(ph 5.5至7.0)的洗涤缓冲液进行第一次洗涤;
73.步骤b),利用不包含氯化钠且包含10mm至50mm的磷酸盐(ph 6.0至7.0)的洗涤缓冲液进行第二次洗涤;以及
74.步骤c),利用包含20至38mm的氯化钠且包含10mm至50mm的磷酸盐(ph 6.0至7.0)的洗涤缓冲液进行第三次洗涤。
75.详细地,上述步骤中的磷酸盐的含量可以为15mm至30mm,具体地,可以为约20mm的磷酸盐。
76.具体地,本发明的纯化抗体的方法包括步骤(i),向利用包含10mm至50mm的磷酸盐(ph 5.5至7.0)的平衡缓冲液平衡化的fractogel
tm emd so3柱加载包含抗体的混合液的试料。根据本发明的具体实施例,可以为利用约ph 6.0的20mm的磷酸盐执行平衡化。优选地,在这种平衡化的情况下,以约1柱体积至5柱体积,详细地,以约3柱体积使用上述缓冲液。
77.在本发明的加载试料的步骤后的利用包含0mm至38mm的氯化钠且包含10mm至50mm的磷酸盐(ph 5.5至7.0)的缓冲液进行洗涤的步骤(ii)可包括之前说明的洗涤步骤的各步骤。
78.具体地,本发明的纯化抗体的方法包括步骤(iii),利用包含38mm至50mm的氯化钠且包含10mm至50mm的磷酸盐(ph 6.0至7.0)的缓冲液对抗体进行第一次洗脱。根据本发明的具体实施例,可利用包含约ph 6.48的40mm的nacl的20mm的磷酸盐执行洗脱。优选地,在这种洗脱的情况下,以约10柱体积至20柱体积,详细地,以约16柱体积使用上述缓冲液。
79.具体地,本发明的纯化抗体的方法包括步骤(iv),利用包含50mm至60mm的氯化钠且包含10mm至50mm的磷酸盐(ph 6.0至7.0)的缓冲液对抗体进行第二次洗脱。根据本发明的具体实施例,可利用包含约ph 6.48的58mm的nacl的20mm的磷酸盐执行洗脱。优选地,在这种洗脱的情况下,以约5柱体积至12柱体积,详细地,以约7柱体积使用上述缓冲液。
80.与现有技术不同地,本发明在上述洗脱步骤中示出优秀的特性。具体地,本发明的阳离子交换层析的洗脱工序具有大大减少在洗脱步骤中使用的缓冲液的优点。在周知的工艺中,通常,使用如20柱体积以上的缓冲液来执行2次以上的洗脱工艺。
81.相反,在本发明中,大大减少在这种洗脱工艺中使用的缓冲液的量(体积),并大大减少源自宿主细胞的蛋白质及异构抗体,并以高收率纯化抗体。制备生物类似药的大批量工艺具有如下的优点,即,这种缓冲液量(体积)的减少不仅在制备成本方面大大减少费用,大大缩短在纯化工艺中通常消耗长时间而周知的洗脱工艺的时间。同时,本发明在最大限度地提高洗脱的收率方面具有优秀的效果。
82.本发明的抗体的纯化方法可包括:包含抗体及一种以上的宿主细胞蛋白质的ph 5.5至7.0及导电率为5ms/cm至8ms/cm的试料加载到平衡化的阳离子交换柱,利用洗涤缓冲液对阳离子交换柱进行洗涤后,利用洗脱缓冲液对与柱结合的抗体进行洗脱;
83.对通过上述洗脱回收的滤液进行超滤及渗滤;以及
84.通过多层过滤器来回收滤液。
85.在上述超滤及渗滤的步骤以及通过多层过滤器来回收滤液的步骤中,进一步去除在利用阳离子交换柱的洗脱步骤中未去除的宿主细胞蛋白质等的杂质,从而具有进一步提高抗体制剂的纯度。在本步骤中,可使用与阳离子交换柱的分离机制不同的利用静电电荷
及输水反应等的能够去除源自宿主细胞的蛋白质的过滤装置更有效地去除宿主细胞蛋白质。
86.对回收的滤液进行超滤及渗滤的步骤可以为执行超滤及渗滤。
87.详细地,可执行超滤。在本发明中使用的术语“超滤(ultrafiltration)”或“uf”是指利用在使溶剂或溶质分子通过的同时保持大分子的半透膜处理溶液或悬浮液的任意技术。超滤可以为了在溶液或悬浮液中增加大分子的浓度而使用。
88.并且,详细地,可执行渗滤。在本发明中使用的术语“渗滤(diafiltration)”或“df”是指为了减少可溶性渗透物(permeate)成分而利用溶剂稀释残留物(retentate)并再过滤的特化的过滤分类而使用。例如,渗滤可诱导或不诱导包含蛋白质的保留成分的浓度增加。例如,在连续渗滤中,溶剂以与滤液的生成速度相同的速度连续添加至残留物。在此情况下,残留物容积及保留的成分的浓度在工艺过程中不会变化。另外,在非连续或依次稀释渗滤中,超滤步骤伴随向残留物侧添加溶剂;在添加至残留物的溶剂的容积为生成的滤液的容积以上的情况下,保留的成分可具有高浓度。渗滤可为了变更ph、离子强度、盐组成成分、缓冲剂组成或大分子的溶液或悬浮液的其他特性而使用。
89.可通过这种过滤工艺进一步减少宿主细胞蛋白的含量。
90.优选地,在上述超滤及渗滤工艺中,设定ph 5.5至7.0,详细地,ph 5.8至6.2的条件。可通过利用如上所述的ph条件来使可在纯化过程中产生的聚合(aggregate)最小化。并且,可使用磷酸盐缓冲液(优选为磷酸钠缓冲液)。更详细地,可使用10mm至50mm的磷酸盐缓冲液,更详细地,可使用20mm的磷酸盐缓冲液。
91.后续可执行通过多层过滤器来回收滤液的步骤。
92.这种注入至多层过滤器的洗脱的抗体洗脱液包括洗脱的抗体洗脱液本身或加工上述洗脱液的形式两者。
93.例如,在本发明的纯化工艺中使用的洗脱的抗体洗脱液可以为在通过多层过滤器之前进行病毒失活。这种病毒失活可在超滤及渗滤步骤前或后执行。
94.其中,病毒失活包括使包含在上述洗脱液的病毒失去功能或从上述洗脱液去除病毒。在使病毒失去功能或去除病毒的方法中,包括热失活、ph失活或化学失活方法等,详细地,可使用ph失活方法,但并不局限于此。上述ph失活方法为利用可使病毒充分失去功能的程度的ph处理的方法,这种ph失活方法包括低-ph病毒失活方法,上述方法可在ph 3.0至4.0的范围,详细地,ph 3.8中滴定洗脱的抗体洗脱液来执行,但并不局限于此。
95.并且,上述抗体洗脱液为在病毒失活步骤之后且通过多层过滤器之前调节为ph 5.5至7.0的,详细地,为ph 6.0,但并不局限于此。
96.其中,可使用缓冲液来调节ph,此时使用的缓冲液的种类并不特别地局限于此,但详细地,可使用bis-tris或磷酸盐缓冲液,更详细地,可使用磷酸盐缓冲液。
97.并且,在将洗脱的抗体洗脱液适用于多层过滤器前,优选地,调节ph和/或导电率,在此情况下,可将抗体洗脱液的ph调整为5.5至7.0,在导电率的情况下,详细地,可调整为1.2ms/cm至10ms/cm,更详细地,可调整为1.3ms/cm至5ms/cm。
98.在本发明中,术语“多层过滤器”是指包含硅藻土的过滤装置。上述多层过滤器为一系列的过滤器层叠为孔大小变小的形态的过滤器,可具有如迷宫的三维矩阵结构。作为这种多层过滤器的作用机制的例,可例举带阳离子而与阴离子性的dna、宿主细胞蛋白质等
的物质结合来有效去除宿主细胞蛋白质的,但并不局限于此。这种多层过滤器可使用本领域通常使用的,详细地,可使用x0hc、a1hc(millipore销售)等,更详细地,可使用x0hc,但并不局限于此。
99.通过这种多层过滤器过程,所获取的抗体滤液可利用阳离子交换柱相比于洗脱的抗体滤液大大减少宿主细胞蛋白质的含量。
100.本发明的方法在上述洗脱步骤、超滤及渗滤步骤、以及通过多层过滤器来回收滤液的步骤之后,还可包括利用阴离子交换柱去除宿主细胞蛋白质的步骤。具体地,还可包括纯化步骤,其将回收的上述滤液通过阴离子交换柱来收集通过液(flow through)。
101.在本发明中,术语“阴离子交换层析”是指利用填充有阴离子交换树脂的柱的层析,在上述步骤中,是指可执行阴离子交换层析来去除杂质,详细地,可去除宿主细胞蛋白。
102.上述阴离子交换树脂是指添加至其他水溶液来起到交换水溶液中的特定阴离子与自身阴离子的作用的合成树脂,阴离子交换柱可在等电点以上吸附带阴离子的蛋白质。对于抗体,等电点高,因此,在使用中性ph的缓冲液的情况下,抗体并不附着于阴离子交换树脂并溢出,但包含宿主细胞蛋白的杂质的等电点低,可吸附于阴离子交换树脂而被去除,从而可利用上述原理执行纯化步骤。
103.上述阴离子交换树脂可使用本领域通常使用的,虽并不局限于此,详细地,可使用q sepharose、季氨基乙基或季氨(q)等,更详细地,可使用q fast flow
tm
。
104.上述去除的宿主细胞蛋白是包括除在上述中提及的所要纯化的抗体之外的所有杂质的概念,不仅包括宿主细胞蛋白本身,还可包括源自宿主细胞的dna及用于细胞生长的因子等。因此,若去除上述宿主细胞蛋白质,则能够以高纯度仅纯化所要纯化的抗体。
105.并且,上述阴离子交换柱不仅可去除宿主细胞蛋白质,还可有效去除内毒素,因此,在最终纯化步骤中,具有可与宿主细胞蛋白质一同去除内毒素来纯化纯度高的目标抗体的优点。
106.根据本发明,当进行上述提及的步骤中的抗体纯化方法时,最终,可纯化有效去除杂质,尤其,有效去除宿主细胞蛋白质的高纯度及高收率的抗体。
107.尤其,本发明的方法大大减少在现有技术中使用的大量的缓冲液的使用,由此大大缩减制备成本及制备时间,从而具有抗体制备工艺上的优秀的优点。
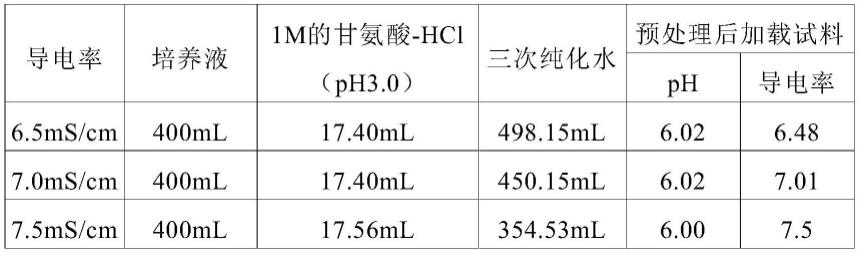
108.最终纯化后,详细地,宿主细胞蛋白质的含量可以为0.001ppm至10ppm,更详细地,可以为0.01ppm至5ppm。
109.由此,作为本发明的另一实施方式,本发明提供通过上述方法制备的抗体。
110.发明效果
111.当利用本发明的抗体的纯化方法时,在不使用昂贵的蛋白a柱的情况下去除杂质,从而可制备高纯度及高质量的目标抗体。尤其,在本发明中,在大大减少在洗脱工艺中使用的缓冲液的量(体积)的同时以高收率纯化抗体的方面具有优秀的效果。
附图说明
112.图1为示出本发明一实施例的阳离子交换层析(cation exchange chromatography)步骤的洗脱曲线图。
113.图2为根据本发明的一实施例获取的洗脱液的ce-hplc分析曲线图。
114.图3为示出本发明一实施例的超滤及渗滤的适当ph条件的曲线图。
具体实施方式
115.以下,通过实施例详细说明本发明。但是,下述实施例仅例示本发明,本发明并不限定于下述实施例。
116.实施例1:贝伐单抗预处理步骤
117.培养表达贝伐单抗抗体的重组cho细胞来表达贝伐单抗抗体。确认本发明实施例的贝伐单抗抗体具有2至3的水平的抗体效价,并将其用于本发明的实验。
118.为了在阳离子交换柱吸附抗体,通过向培养液添加1m的甘氨酸(glycine)hcl(ph 3.0)缓冲液来将ph调整至6.0,将导电率调整至6.5ms/cm至8.5ms/cm,从而执行实验。
119.用于各实验组的培养液预处理的1m的甘氨酸-hcl(ph 3.0)及所添加的三次纯化水的量、预处理后的加载(loading)试料条件如下述表1。
120.表1
[0121][0122][0123]
实施例2:阳离子交换柱层析
[0124]
在本实施例中,使用fractogel
tm emd so3柱作为阳离子交换柱,其过程如下。
[0125]
为了平衡化,将20mm的磷酸盐缓冲液(ph 6.0)以3柱体积流入而使柱平衡化。之后,以so3的吸附容量以下加载上述实施例1的预处理结束的上清液。加载量为相对于每1l树脂体积30g以下的蛋白质,加载速度为150cm/hr。
[0126]
之后,由下述表2的条件执行三个步骤的洗涤步骤及两个步骤的洗脱步骤。
[0127]
表2
[0128][0129]
由上可确认,在本发明中,将分别对应于下述比较例的第四次洗涤步骤及第一次洗脱步骤的第一次洗脱步骤及第二次洗脱步骤柱体积分别减少至16柱体积、7柱体积。
[0130]
另外,为了比较,设定将第四次洗涤步骤(对应于上述实施例的第一次洗脱步骤)及第一次洗脱步骤(对应于上述实施例的第二次洗脱步骤)中的柱体积分别设置为30柱体积、20柱体积的下述表3的条件下设置比较例。
[0131]
表3
[0132][0133][0134]
尤其,在上述比较例的情况下,以与韩国授权专利第10-1569783号的发明中实际使用的方式相同的形式使用柱体积。
[0135]
实施例3:根据预处理导电率差异的收率及电荷变体(charge variants)含量确认
[0136]
将根据上述实施例1的导电率制备的预处理的贝伐单抗试料以实施例2的条件执行阳离子交换层析,从而确认步骤收率及电荷变体含量变化。
[0137]
在表4及表5示出其结果。
[0138]
表4
[0139]
导电率加载蛋白质量洗脱液体积总次数蛋白质量步骤收率
6.5ms/cm409.5mg167.26ml348.0mg84.9%7.0ms/cm402.7mg166.56ml389.1mg96.7%7.5ms/cm400.7mg166.56ml373.1mg93.2%8.0ms/cm422.1mg164.72ml388.6mg92.0%8.5ms/cm394.8mg123.10ml117.8mg29.8%
[0140]
表5
[0141][0142]
上述表4示出确认根据预处理导电率差异的收率变化的结果。在表4中,可确认在7.0ms/cm至8.0ms/cm中示出90.0%以上的步骤收率,尤其,确认在7.0ms/cm中示出最优秀的步骤收率。
[0143]
并且,表5示出根据预处理导电率差异的电荷变体含量比较结果。在表5中,在本发明的7.0ms/cm至8.0ms/cm中,示出与作为对照药物的安维汀相似的主要峰、酸性异构体及碱性异构体峰,尤其,在7.0ms/cm中,示出与作为对照药物的安维汀最相似的主要峰及酸性异构体及碱性异构体峰。
[0144]
尤其,当在改变如上所述的导电率的变化的同时使用少量的缓冲液来执行洗脱工艺时,可确认优秀的步骤收率及低碱性异构体含量。
[0145]
实施例4:确认根据柱体积减少的收率增加
[0146]
在上述实施例2的条件下,对于具有7.0ms/cm的导电率的下述试料执行阳离子交换层析。
[0147]
在上述实施例1的预处理的试料的情况下,试料浓度为1.04mg/ml,加载体积为162ml,总蛋白给药量为168.8mg。
[0148]
纯化工艺利用cv:5ml(预装(pre-packed))、床高(bed height):10.0cm、流速(flow rate):0.67ml/min或0.84ml/min的条件。
[0149]
另外,与上述条件相同地,一同实验表3的比较例条件来确认收率变化。
[0150]
在表6示出其结果。
[0151]
表6
[0152][0153]
如上可见,当适用比较例的纯化工艺时,收率仅为50%左右。相反,在利用本发明的方法的情况下,即使大大减少洗涤工艺及洗脱工艺的时间及所使用的缓冲液的量,也示出约60%以上的高收率。并且,确认在电荷变体含量方面,示出适合制备生物类似药的水平的电荷变体含量。
[0154]
实施例5:病毒失活
[0155]
向执行上述实施例2的阳离子交换层析的洗脱液添加1m的甘氨酸-hcl(ph 3.0)的缓冲液,并在ph 3.8中尽心病毒失活1小时。失活完成后,通过0.2μm的过滤器来过滤后,对于试料的ph,添加1m的tris-hcl(ph 9.0)缓冲液来将试料的ph调整至6.0。
[0156]
实施例6:超滤及渗滤工艺
[0157]
考虑试料量,超滤及渗滤(uf/df1)工艺使用micro-centricon(0.5ml),按照各条件重复三次(triplicate)。
[0158]
micro-centricon使用amicon ultra 0.5ml ultracel,为了浓缩及交换缓冲液而使用的离心分离器使用埃普多夫离心机(eppendorf centrifuge)。为了调整初始浓缩浓度为20mg/ml,将uf/df1注入试料400μl(5.13mg/ml)添加至micro-centricon,在5000rpm中离心分离10分钟来浓缩至100μl。对浓缩至100μl的试料添加表7的各ph的缓冲液100μl,并2倍稀释后,再次在5000rpm中离心分离5分钟来浓缩至100μl。将上述过程执行7次来完成uf/df1。
[0159]
为了最大限度地准确的实验,micro-centricon、uf/df1注入试料、uf后的体积均按重量测量。
[0160]
表7
[0161][0162][0163]
用于上述se-hplc分析的整合事件(integration event)适用通过适用在sop中定义的整合事件来分析聚合含量。
[0164]
在表8示出其结果。
[0165]
表8
[0166][0167]
分析各ph条件的聚合含量的结果,如表8,可确认聚合含量根据ph的变化而增加。
[0168]
并且,如可在图3中确认,为了确认在根据ph增加的uf/df1工艺中的聚合含量增加的显著性,确认自变量(ph)的线性结果,确认了y=2.4x-12.6的直线的方程式,r2为0.88。确认由于斜率的值(2.4)具有正的值,y轴的因变量(聚合含量)随着x轴的自变量(ph)增加而增加。
[0169]
通过上述结果,在利用tris-hcl缓冲液的ph 7.5以上的条件中,uf/df1步骤中的聚合含量增加,因此,判断为难以适用于工艺。相反,确认适合适用20mm的磷酸钠ph 6.0条件。
[0170]
实施例7:多层过滤工艺
[0171]
多层过滤器可通过静电特性等减少源自宿主细胞的dna(hcd)、源自宿主细胞的蛋白质等。因此,准备xohc形态的多层过滤器,并流过三次纯化水及20mm的磷酸钠(sodium phosphate)(ph 6.0)缓冲液进行取代并平衡化。之后,将进行病毒失活后进行过滤工艺的实施例6的试料取代为20mm的磷酸钠(ph 6.0)缓冲液后,流向多层过滤器并以100lmh(liter/
㎡
/hour)的流速过滤。回收所有完成过滤的试料,并用作用于阴离子交换柱层析纯化的试料。
[0172]
实施例8:阴离子交换柱层析
[0173]
阴离子交换柱在等电点以上吸附带阴离子的蛋白质,因此,在等电点为7以上的抗
体的情况下(在贝伐单抗的情况下,等电点为8.3),当使用中性ph的缓冲液的时,本抗体并不附着在阴离子交换树脂且溢出至通过液(flow-through)。由此,为了确认适合于本发明的制备工艺的阴离子交换树脂及缓冲液条件,执行了如下的实验。
[0174]
具体地,在本实施例中,利用在生产规模中广泛使用的季氨(quaterna ry amine)系列的q sepharose
tm fastflow作为阴离子交换树脂来实施纯化。
[0175]
首先,如上述实施例,对于用于加载到阴离子交换树脂的样品,在培养上清液中完成阳离子交换柱、病毒失活后,进行一次超滤后,取代为50mm的磷酸钠(ph 6.0)平衡缓冲液来以ph 6.0及1.4ms/cm的导电率准备。
[0176]
加载量为相对于每1l的树脂体积的30g以下的蛋白质,加载及洗脱速度以150cm/hr执行,若a280nm中的吸光度上升,则收集柱灌注物。柱以1m的nacl再生后,利用平衡缓冲液平衡化。
[0177]
对于根据上述实施例7制备的贝伐单抗试料,以如上所述的方式执行阴离子交换层析,并确认各ph条件的步骤收率。
[0178]
在表9示出其结果。
[0179]
表9
[0180]
ph状态(condition)步骤收率(step yield(%))6.096.6%7.095.4%7.593.2%8.090.3%8.562.8%
[0181]
上述表9示出确认根据ph状态差异的步骤收率变化的结果。如表9,可确认当执行阴离子交换层析时,在ph 6.0至8.0的范围内示出90.0%以上的步骤收率,尤其,确认在ph 6.0中,示出最优秀的步骤收率。
[0182]
从以上说明可理解,本发明所属技术领域的普通技术人员可在不变更其技术思想或必要特征的情况下由其他具体实施方式实施本发明。与此相关地,需要理解的是,以上所记述的实施例在所有方面仅为例示,并不是限定性的。本发明的范围应解释为相比于上述详细的说明,所附的发明要求保护范围的含义及范围以及由其等价概念导出的所有变更或变形的形态包含在本发明的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。