1.本发明涉及干细胞与再生医学技术领域,具体涉及一种人成体心源性间充质样干细胞的制备方法。
背景技术:
2.心肌损伤与修复再生一直是当代医学的一大难题。传统疗法能够拯救存活的心肌组织,但随着疾病的进展,最终不可避免发展为心力衰竭。近年来,以干细胞疗法为代表的再生医学为心脏再生领域带来了新希望。在心脏再生研究的干细胞类型中,以胚胎干细胞和诱导多能干细胞为代表的全/多能干细胞理论上可以分化为心房、心室和结样特性的细胞。但实际操作中有研究报导,与成年心肌细胞相比多能干细胞衍生的心肌细胞在结构和功能上都是未成熟的,未成熟心肌细胞或失调的电偶联导致心律失常是最紧迫的问题之一。此外,全/多能干细胞还存在以下临床应用困境:首先是免疫排斥、伦理、法律及宗教层面的限制;其次,全/多能干细胞的可塑性也是一把双刃剑,由于培养和诱导环境的问题,可能存在诱导不完全或诱导后变异等潜在致瘤性;最后,由于诱导技术的多环节质量控制较难,操作成本高,难以在临床开展和普及。与之相比,成体干细胞来源广泛,制备简单,无免疫排斥、致瘤以及伦理等问题,临床上便于实施个体化治疗。
3.目前用于心脏再生研究的成体干细胞主要有非心源性和心脏来源两种细胞类型。在非心源性干细胞中,脐带、脂肪和骨髓间充质干细胞是目前处于临床研究阶段中发展最为迅速的干细胞类型。心源性干细胞是一群来源于心脏组织,具备一定自我更新和心肌谱系分化潜能的细胞群。其中心肌球源性干细胞和特异性抗原(c-kit
、sca-1
等)干细胞的研究最为广泛。尽管最新研究否定了c-kit
和sca-1
干细胞在体内分化为心肌的能力,但心肌球源性干细胞在心脏再生中的积极作用已经被越来越多的动物及临床试验证实。目前,国际公认外源成体细胞的主要作用机制是对内源修复过程的调节作用,包括通过旁分泌(细胞因子、胞外囊泡等),局部细胞之间(心肌细胞、免疫细胞、内皮细胞及成纤维细胞等)的相互作用调节血管生成、炎症反应、对抗凋亡及纤维化等病理过程。因此,由于心源性干细胞具备独特的组织特异性优势,是具有临床应用优势的种子细胞。然而,由于心脏是一个重要的组织器官,从心脏中安全并高效地获取心源性干细胞是一个关键性技术问题。首先,心脏组织取材对于制备心源性干细胞至关重要。心肌活检主要用于病因不明的心脏疾病诊断,此途径取材的心脏组织基本都是病态的。并且此方法对临床水平要求高,临床实施风险大。其次,心肌球源干细胞最常见的分离方法包括以下步骤:组织块培养、细胞球形成以及细胞球衍生细胞的扩增。其中,细胞球形成的目的是为了富集具有干性的细胞,但这也需要更多的操作步骤和较长的培养时间。因此,有必要提供一种不仅操作简便,并且安全和高效的心源性干细胞制备方法,可以降低由于细胞长期体外培养所获得的表型漂移和致瘤性变异等风险,提高细胞制备效率的同时增加了体外培养过程的稳定性。
技术实现要素:
4.针对上述问题,本发明的目的在于提供一种操作简便、安全高效的人成体心源性间充质样干细胞的分离提取与扩增筛选制备方法。
5.为实现上述目的,本发明提供如下技术方案:
6.一种人成体心源性间充质样干细胞的制备方法,包括以下步骤:
7.(1)心耳组织分离:取新鲜心耳组织,清洗去除血液,取其中梳状肌并剪碎为组织碎片,备用;
8.(2)组织消化:取上述组织碎片,采用优化的酶消化法分离原代心源细胞;
9.(3)细胞培养与筛选:将上述分离的原代细胞接种于含有特定生长因子的培养体系中贴壁培养,使具备一定特性的细胞达到生长优势,并通过传代扩增的过程使细胞自然富集筛选,获得所述人成体心源性间充质样干细胞;
10.(4)特征鉴定:取上述人成体心源性间充质样干细胞,进行表面标记分子和基因表达分析,证明所获得的人成体心源性间充质样干细胞的表型特征。
11.在其中一些实施例中,所述心耳组织为源自患有瓣膜病合并房颤的人成体,所述人成体其一为生理上完成分化和发育的机体;其二是法律上已达到法定成年年龄的人(大多数情况下为18岁)。在开胸手术中切除的心耳组织,并排除其它心脏疾病,如:心肌病、心肌炎及心脏肿瘤等。
12.在其中一些实施例中,所述分离梳状肌应尽可能去除瓣膜、内皮及结缔组织等,否则影响组织消化效率,梳状肌质量应大于30mg,低于30mg起始组织会降低分离的细胞密度,延长原代细胞形成克隆的时间,影响细胞收获率。
13.在其中一些实施例中,所述优化的酶消化法包括以下步骤:
14.(1)在少量组织消化液中将梳状肌剪至1mm3碎块;
15.(2)加入组织消化液,进行首次震荡消化;
16.(3)首次消化结束后,室温静置消化悬液3-5min,上层细胞悬液加入等体积中和培养液,过滤后于4℃暂存备用,再次加入组织消化液至下层未消化组织沉淀中,进行二次震荡消化;
17.(4)再次消化结束后,加入等体积中和培养液并过滤,将上述两次所得滤液离心去除上清,获得细胞。
18.在其中一些实施例中,所述组织消化液为:无钙、镁和酚红的pbs缓冲液,0.4%ⅱ型胶原酶。采用该组织消化液能够快速消化获得心源性原代细胞,该组织消化液配置简便、成分明确,对原代细胞损伤小,获得的原代细胞具有较高的活性和增殖能力。
19.在其中一些实施例中,所述ⅱ型胶原酶组织消化液需要在组织消化前1小时配置,并置于37℃空气浴中,100g恒温震荡备用。
20.在其中一些实施例中,所述组织消化液的加入量为0.5
±
0.1ml组织消化液/1mg梳状肌组织,二次组织消化液加入量与首次相同。
21.在其中一些实施例中,所述震荡消化条件为,首次消化:37℃,150rpm,震荡30min,二次消化:37℃,150rpm,震荡20min。采用上述二步消化法,能够提高组织消化效率,降低消化液对细胞的损伤。
22.在其中一些实施例中,所述中和培养液为4℃预冷的无血清dmem/f12培养液。
23.在其中一些实施例中,所述过滤的方法为:细胞悬液经滴管以画圈的方式缓慢滴加入70μm细胞滤膜中,首次过滤后的滤液再按照相同的方式加入40μm细胞滤膜中进行二次过滤。细胞过滤能够在细胞提取和培养过程中去除杂质,是获得单细胞悬液的一种简单易行的方法。中国市场上适应最广泛的商品化细胞滤网产品(如:美国bd falcon细胞滤网、韩国spl细胞滤网)有三种规格的滤网孔径:40、70、100μm,根据本发明制备细胞的特性,选择上述两个规格的细胞滤膜。
24.在其中一些实施例中,所述离心条件为:4℃,1500rpm,5min。
25.在其中一些实施例中,所述人成体心源性间充质样干细胞完全培养基由dmem/f12培养基、10%fbs和40ng/ml bfgf组成。间充质干细胞具有成纤维细胞生长特性,在碱性成纤维细胞生长因子的刺激下可以快速增殖。采用上述配方培养液,使心源性间充质样干细胞通过扩增和传代达到生长优势,起到自然富集筛选的目的。
26.在其中一些实施例中,所述细胞培养步骤中,原代培养7-14天出现较大细胞克隆团时进行传代,随后每5-6天细胞汇合度为75-85%时进行传代培养,传至3代后可以获得108数量级高纯度人成体心源性间充质样干细胞。采用上述细胞培养步骤,通过扩大心源性间充质样干细胞增殖速度和细胞数量,使心源性间充质样干细胞达到生长优势,经3-4次传代培养后即可获得大量高纯度人成体心源性间充质样干细胞。
27.在其中一些实施例中,所述传代培养时按104细胞/cm2底面积比例接种。采用上述比例进行传代,保证了细胞有足够的生长空间,同时使细胞之间有足够的接触,能够使细胞具有较好生长状态的特点。
28.在其中一些实施例中,所述特征鉴定步骤中,检测传代培养获得的人成体心源性间充质样干细胞表面标记分子,cd105、cd29阳性率均应>95%,cd31、cd45、cd34及hla-dr阳性率均应<5%,cd90阳性率在10%-90%之间。当检测细胞符合上述指标,即可证明获得人成体心源性间充质样干细胞。
29.在其中一些实施例中,所述特征鉴定步骤中,对传代培养获得的人成体心源性间充质样干细胞进行基因表达分析,心肌转录因子nkx2-5、gata4基因均应表达,多能性基因rex1、sox2、oct3/4和nanog中至少表达三种。
30.在其中一些实施例中,所述组织分离步骤之前还包括心耳组织采集步骤:取术中切除的心耳组织置于pbs中,0-4℃运输,2h内开始上述细胞制备。
31.基于上述技术方案,本发明具有以下有益效果:
32.本发明所述的人成体心源性间充质样干细胞的制备方法,取材方便、安全,具有代表性。通过优化的组织酶消化分离原代心源细胞,并创新性的利用细胞自然传代扩增,使细胞在含有特定生长因子的培养体系中达到生长优势,具备特定表型的细胞形成自然富集筛选的过程,最终获得人成体心源性间充质样干细胞。这种自然扩增筛选与特异抗原筛选和细胞球形成筛选相比,具备更高的细胞扩增效率。对取材组织量需求小,在等量分离组织和制备时间内能够收获更多细胞,并且本发明的制备方法最大程度减小对细胞活性的损伤,收获细胞存活率均>98%。最后,本发明所述方法操作简便,可以避免细胞由于长期体外培养造成的表型改变、癌变及污染等风险,更易于大规模操作和标准化管控。可用于建立体外干细胞模型、干细胞库及为临床个体化治疗提供备选种子细胞。
33.本发明所述的人成体心源性间充质样干细胞的制备方法,与现有应用于心脏再生
中的干细胞技术相比具有以下优势:
34.1.本发明所述心源性间充质样干细胞源自非胚胎人成体组织,隶属于人成体干细胞范畴。避免了胚胎干细胞、诱导多能干细胞等全、多能干细胞面临的伦理、免疫排斥、安全性以及诱导技术等临床难以应用的困境。
35.2.制备人成体心源性间充质样干细胞的组织为人成体心耳中的梳状肌组织,其相对独立于心脏心肌组织以外,利用瓣膜病合并房颤的外科手术治疗中切除的心耳组织可以避免心肌活检取材造成的心肌损伤等安全问题,且方便操作。此外,心耳组织的取材排除了心肌病、心肌炎及心脏肿瘤等心脏疾病,细胞提取于非病变组织,所获得的心源性间充质样干细胞具有代表性,有利于保障获得人成体心源性间充质样干细胞的活性与功能。
36.3.本发明提供的人成体心源性间充质样干细胞的制备方法,与其它现有的心源性干细胞制备方法存在以下技术优势。首先与心源性特异抗原阳性细胞,如:c-kit 、sca-1 等细胞相比,这类心源性干细胞需要在原代分离时根据某种抗原表达进行筛选,通过抗原筛选的细胞由于表型单一,功能也相对单一,如:c-kit 细胞已有研究证明只作为心脏内皮祖细胞。并且机械筛选过程对起始细胞量有较大需求,对细胞活性造成一定损害,影响后续细胞大量扩增。因此,在有限心脏组织的条件下获得大量具有高活性和纯度的细胞具有一定难度。而本发明提供的人成体心源性间充质样干细胞的制备方法,不需要特异抗原筛选,其中可能包含不同抗原表型和不同分化潜能的细胞群及其支持细胞,或者包含处于不同发育和分化阶段的祖细胞。就功能而言,非单一表型细胞群可能在体内起到更好的支持和促进组织再生的作用。其次,与心肌球源性干细胞相比,心肌球源性干细胞的制备需要首先在体外形成心肌球,再将心肌球衍生的细胞进行扩增,这需要较多的操作步骤和较长的培养时间。文献报导,使用548
±
90mg的心肌组织,经过35天的培养后平均细胞产量为(5
±
1)
×
107。本发明提供的制备方法省略了体外成心肌细胞球的培养过程,心肌组织经消化后,在含有特定生长因子的贴壁培养体系中达到生长优势,细胞通过增殖扩增自然筛选和富集。可以减少组织用量前提下并在相同时间内提高细胞的收获率。如,本发明使用50
±
10mg的心肌组织,经过30-40天培养后可以收获不少于108细胞数量,细胞活性均大于98%。并且,人成体心源性间充质样干细胞与目前已报导的心肌球源性干细胞表型基本一致。这种简化并高效的培养过程不仅可以降低长期体外培养获得的细胞表型改变及癌变的风险,更容易满足实际操作和应用需求。
37.4.本发明所述优化的组织酶消化法与其它酶消化法提取组织原代细胞相比,本发明通过调整消化酶的配方和采用二步消化的方法,并对其中各步骤所选用的条件和参数进行了优化。首先,消化酶选择方面,胰蛋白酶和胶原酶均常用于组织消化。胰蛋白酶适于消化细胞间质较小的软组织,如胚胎组织、羊膜、上皮、肝、肾等,但消化纤维性组织或较硬的组织则较差。此外,胰酶作用较强,浓度稍高或作用时间长会对细胞造成损伤,而组织中的干细胞本身含量较低,为了尽量避免消化过程中对干细胞活性的影响,本发明选择了作用较温和的胶原酶。胶原酶能在生理ph和温度条件下特异性水解胶原蛋白,而不损伤其它蛋白质和组织,可根据所要分离消化的特定组织选择合适的胶原酶类型。其中ⅱ型胶原酶含有更高的梭菌蛋白酶活性,推荐用于心脏、骨骼、肌肉等组织的细胞分离。实践表明,采用ⅱ型胶原酶即可对分离的组织高效消化,单一消化酶成分明确且操作简便,故本发明最终采用ⅱ型胶原酶。浓度选择方面,本发明预先在0.1-0.5%(w/v)的浓度之间进行调整,发现当
胶原酶浓度≤0.3%时,消化1小时后仍存在肉眼可见的未消化组织,显微镜下观察细胞悬液,可见较大组织块,故消化效果欠佳。当胶原酶浓度调整至0.4%,消化40-50分钟后基本无肉眼可见组织碎片,显微镜下可见消化的单个细胞悬浮,细胞存活率>95%。继续增加胶原酶浓度至0.5%时,细胞存活率略有下降,故最终选择胶原酶浓度为0.4%。其次,本发明采用分步消化方法的目的是为了提高消化效率的同时尽可能降低对分离细胞的损害。在同样条件下,两步消化的方法能够在达到同等消化效果的同时缩短约1/4的消化时间。首次消化的细胞能够避免过度消化造成的损伤,因此两步消化法能提高消化效率同时提高细胞存活率。最后,本发明对组织消化液的用量进行了优化。在两次消化过程中均按0.5
±
0.1ml消化液/mg起始组织的剂量加入消化液,能够保障组织被充分消化,且不会出现过度消化而损伤细胞活性的现象。
附图说明
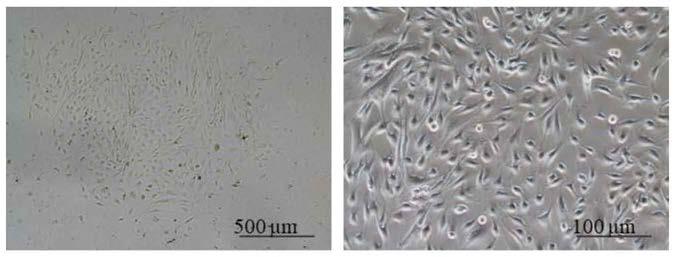
38.图1为实施例1中培养的p0代细胞形成的细胞克隆形态;
39.左图为光镜下50倍放大后单克隆的形态;右图为光镜下100倍放大后克隆内部细胞生长状态,可见细胞体积较小,呈椭圆形排列紧密。
40.图2为实施例1中细胞传代培养后的细胞形态;
41.如图分别为细胞扩增至第3、5、7代细胞形态,光镜下细胞呈梭形、纺锤形规律排列,具有与间充质干细胞相似的形态特征,且细胞传代扩增的不同时期形态无肉眼可见的差异。图3为实施例1中不同代次的人心源性间充质样干细胞的生长增殖曲线;
42.如图所示横坐标为细胞体外培养时间,纵坐标为加入cck-8后od450吸光度,观察细胞体外培养1-7天的增殖情况,可见不同扩增代次(p3、5、7)细胞保持旺盛的自我更新能力,增殖曲线无统计学差异。
43.图4为实施例1中人心源性间充质样干细胞表面标志分子的流式细胞检测结果;
44.结果显示人心源性间充质样干细胞高表达间充质谱系细胞表面标志抗原cd105(>95%)和cd29(>95%),cd90在该细胞中表达具有差异性(10-80%)。血细胞谱系表面标志抗原cd45,内皮谱系表面标志抗原cd34以及人白细胞抗原hla-dr几乎不表达(<5%)。
45.图5为实施例1-3中p3、5、7人心源性间充质样干细胞多能性基因(rex1、sox2、oct3/4、nanog)和心肌早期转录因子(nkx2-5、gata4)的实时定量pcr检测结果;
46.结果显示第3、5、7代人心源性间充质样干细胞均表达多能性基因rex1(0.45
±
0.43)、sox2(3.45
±
2.03)、oct3/4(4.26
±
1.02)、nanog(6.10
±
3.40),其中oct3/4表达显著高于对照间充质干细胞(1.00
±
0.02,p<0.0001)。组织特异性基因方面,人心源性间充质样干细胞不同程度表达心脏特异性转录因子nkx2-5(19.70
±
16.32)、gata4(46627.78
±
25637.06),而在脐带间充质干细胞中表达很低(nkx2-5:1.00
±
0.12,p<0.001;gata4:1.00
±
0.85,p<0.0001)。
47.图6为实施例2中细胞免疫荧光检测p5人心源性间充质样干细胞rex1、sox2、nanog、nkx2-5及gata4的表达;
48.结果显示左侧为多能分子rex1、sox2、nanog和心肌特异性转录因子nkx2-5、gata4在细胞中的表达,dapi染色显示所有细胞核,右侧为与光镜merge后的结果。由图可见,几乎所有人心源性间充质样干细胞中均表达多能分子与心肌转录因子,且特异性表达于细胞核
中。
49.图7为实施例3中诱导人心源性间充质样干细胞向心脏谱系细胞分化后,心肌特异性蛋白(ctnt、asa)和血管平滑肌肌动蛋白asma蛋白质免疫印迹杂交检测结果;
50.结果显示上图为向心肌诱导分化,下图为向血管平滑肌诱导分化,before differentiation为诱导前细胞,cardiac/smooth muscle differentiation为诱导分化15天后的细胞,结果显示诱导后心肌组织特异性蛋白ctnt、α-sa以及血管平滑肌组织特异性蛋白α-sma表达水平显著高于诱导前细胞的表达。
具体实施方式
51.为了便于理解本发明,下面将参照实施例对本发明进行更全面的描述。以下给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
52.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
53.实施例1
54.本实施例的人成体心源性间充质样干细胞由以下方法制备得到:
55.1.心耳组织采集。
56.选择确诊患有心脏瓣膜病合并房颤并具备接受心脏病房颤外科手术治疗指征的组织提供者,性别不限,年龄18-80周岁。排除标准:患有心肌病或心肌炎等其它心肌疾病、乙肝、梅毒、艾滋阳性或其它已知重大活动性感染者;肝、肾、造血系统等严重原发性疾病者;滥用药物、毒品或酗酒史者。组织采集前签署知情同意书。标本提供者在接受心脏外科手术治疗过程中,无菌采集术中切除的心耳组织,立即置于含1ml无钙镁pbs溶液(磷酸缓冲盐溶液)的2ml冻存管中。组织于4℃立即送往实验室,运输过程中确保心耳组织浸没在pbs中以保护心耳组织的生物学活性。可在pbs中添加终浓度1
×
青链霉素双抗(100u/ml;0.1mg/ml)或25μg/ml的硫酸庆大霉素和5μg/ml两性霉素b,确保组织采集过程中无细菌和真菌污染。
57.2.心耳组织分离。
58.(1)组织漂洗:超净工作台中用眼科镊取出心耳组织置于10cm皿中,加入5ml 4℃预冷的pbs溶液。将心耳腔剪开,用4℃预冷的pbs溶液充分漂洗组织2-3次至无明显血液残留。无菌纱布吸干组织表面液体,称重为0.9g。
59.(2)分离梳状肌:暴露心耳腔内部肌肉组织,眼科剪贴心耳腔内壁分离梳状肌,迅速无菌称量分离的梳状肌为40mg。注意分离过程中始终保持组织的低温(0-4℃)和湿润;勿取组织膜,因组织膜含大量纤维和胶原成分,将影响肌肉组织的消化效率。
60.3.组织消化。
61.(1)剪碎:培养皿中加入几滴(约100-300μl)组织消化液于上述梳状肌组织,剪成约1mm3的组织碎片。组织消化液配方如下:无钙、镁和酚红的pbs缓冲液40ml,ⅱ型胶原酶(胶原酶ii型)0.16g。
62.(2)组织消化与终止:将上述组织碎片加入到含20ml组织消化液的50ml离心管中,于37℃空气浴,150rpm,震荡消化30min。首次消化结束后,室温静置离心管3min,移液管吸取上层消化悬液加入到20ml 4℃预冷的无血清dmem/f12培养液中,4℃暂存备用。继续向下层未消化组织碎块中加入20ml组织消化液,于37℃空气浴,150rpm,再次震荡消化20min。第二次消化结束后,基本无肉眼可见组织碎片,立即向消化悬液中加入20ml 4℃预冷的无血清dmem/f12培养液进行中和。
63.(3)细胞过滤:将两次消化得到的细胞悬液经滴管以画圈的方式缓慢滴加到孔径70μm细胞滤膜中,首次过滤后的滤液再按照相同的方式加入孔径40μm细胞滤膜中进行二次过滤。
64.(4)收集细胞:收集上述细胞滤液,进行离心1500r/min,5分钟。去除上清液,加入40ml无血清dmem/f12培养液,再次以上述条件离心以洗涤细胞,收集细胞沉淀。
65.4.细胞培养。
66.(1)计算细胞存活率:上述细胞沉淀充分重悬于1ml人成体心源性间充质样干细胞完全培养基中,所用完全培养基由dmem/f12培养基、体积含量10%fbs和40ng/ml bfgf(现用现加)组成。用胎盘蓝染色法计数细胞总数约为7
×
105,并计算细胞存活率为97%。计数过程中注意排除红细胞、死细胞及组织碎片等。
67.(2)原代细胞接种:以上获得的原代细胞全部接种到1个6cm贴壁培养皿中,加入少量人成体心源性间充质样干细胞完全培养基共3ml。置于37℃,体积含量5%co2的空气细胞培养箱培养,48小时内勿移动,促进细胞贴壁。
68.(3)原代培养及克隆形成:48小时后可见少数散在贴壁细胞,进行首次细胞换液,加入完全培养液5ml。之后隔天观察并换液,第9天p0代细胞成克隆样生长如图1所示,图1可见培养皿中约有10余个克隆形成,克隆内部细胞生长状态良好,当出现克隆内部细胞生长过密情况时,进行首次细胞传代。
69.(4)细胞传代与扩增:6cm培养皿中加入1ml消化液(tryple select enzyme,gibco),37℃消化3分钟,快速轻轻拍打培养皿约10次使细胞脱落,加入1ml完全培养液中和后收集消化悬液,离心1500rpm/min,5min。细胞沉淀中加入新鲜的完全培养基进行细胞计数,细胞总数为106,接种于2个10cm培养皿中继续培养,细胞传代后成梭形规律排列如图2所示,其后,隔天更换完全培养液,传代5天后细胞汇合度达到85%时,再次按照104细胞/cm2底面积的比例进行传代,并绘制不同代次人成体心源性间充质样干细胞生长增殖曲线如图3所示。
70.5.特征鉴定。
71.(1)表面标志分子检测:取p3人成体心源性间充质样干细胞分析表面标志分子表达如图4所示,经流式细胞术检测间充质谱系表面标志物cd105、cd29、cd90阳性率分别为99.88%、99.92%、42.80%。造血谱系表面标志物cd45阳性率为3.24%,内皮谱系表面标志物cd34表达率为2.66%,以及人白细胞抗原hla-dr表达率为0.23%。上述结果证明,获得的人心源性间充质样干细胞具备间充质干细胞的部分分子特征,与人心肌球源性干细胞的表面分子表达情况基本一致。
72.(2)特异性分子表达检测:取p3人成体心源性间充质样干细胞,实时定量pcr检测如图5所示,获得的人成体心源性间充质样干细胞均表达多能性基因rex1、sox2、oct3/4以
及nanog,和心肌早期转录因子nkx2-5、gata4。
73.实施例2
74.本实施例的人成体心源性间充质样干细胞由以下方法制备得到:
75.1.心耳组织采集:同实施例1。
76.2.分离心耳组织:与实施例1的方法基本相同,区别在于心耳组织总质量为1.7g,分离出梳状肌为90mg。
77.3.组织消化:与实施例1的方法基本相同,区别在于将分离出的梳状肌组织平均分到两个50ml离心管中,每支离心管中各加入20ml组织消化液进行同实施例1相同的消化步骤。
78.4.细胞培养:与实施例1的方法基本相同,区别在于原代细胞数为2
×
106,将上述原代细胞全部接种至1个10cm培养皿,加入8ml完全培养基,第7天p0代细胞成克隆样生长。其它细胞培养过程同实施例1。
79.5.特征鉴定:取p5人成体心源性间充质样干细胞分析表面标志分子表达。同实施例1,cd105、cd29阳性率均>95%,cd45、cd34、hla-dr阳性率均<5%,区别仅在于cd90阳性率为78.32%。同实施例1,检测rex1、sox2、oct3/4、nanog以及nkx2-5和gata4的基因表达情况,如图5所示。
80.6.免疫荧光检测结果显示,p5人成体心源性间充质样干细胞核中均表达rex1、sox2、nanog,以及nkx2-5和gata4,如图6所示。
81.实施例3
82.本实施例的人成体心源性间充质样干细胞由以下方法制备得到:
83.1.心耳组织采集:同实施例1。
84.2.分离心耳组织:与实施例1的方法基本相同,区别在于心耳组织总质量为0.6g,分离出梳状肌为25mg。
85.3.组织消化:同实施例1。
86.4.细胞培养:与实施例1的方法基本相同,区别在于原代细胞数为4
×
105,第14天p0代细胞成克隆样生长。其它细胞培养过程同实施例1。
87.5.特征鉴定:取p7人成体心源性间充质样干细胞分析表面标志分子表达。同实施例1,区别仅在于cd90阳性率为32.57%。同实施例1,检测rex1、sox2、oct3/4、nanog以及nkx2-5和gata4的基因表达情况,如图5所示。条件培养基向心脏谱系诱导分化,如图7所示蛋白质免疫印迹杂交结果显示,诱导后心肌特异性蛋白ctnt和asa,以及血管平滑肌肌动蛋白asma的表达显著高于未诱导细胞。
88.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
89.本发明提供一种操作简便,易于扩大规模且安全可控的心源性干细胞制备方法。可以降低由于细胞长期体外培养所获得的表型漂移和致瘤性变异等风险,提高细胞制备效率的同时增加了体外培养过程的稳定性。可用于建立体外干细胞模型、干细胞库及为临床个体化治疗提供备选种子细胞。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。