试剂及其用于模块化对映发散性合成c-p键的用途
相关申请的交叉引用
1.本技术要求2020年1月16日提交的美国临时申请号62/962,066的权益。
背景技术:
2.对p中心的立体化学的控制是在各个领域中存在的经常遇到的挑战。参见corbridge,d.e.c.phosphorus:chemistry,biochemistry and technology,第6版;taylor&francis,2013。一个最近的例子源自反义寡核苷酸(aso)治疗剂的出现,其中硫代磷酸酯键中的p立体中心的精确控制可能影响功效和物理特性。参见bohr,h.g.;等人,“electronic structures of lna phosphorothioate oligonucleotides.”mol.ther.nucleic acids 2017,8,428-441;还参见iwamoto,n.;“control of phosphorothioate stereochemistry substantially increases the efficacy of antisense oligonucleotides.”nat.biotechnol.2017,35(9),845-851。美国专利申请公开2019/0322694描述了一种使用在廉价柠檬烯支架上构建的基于p(v)的试剂(简称为磷-硫掺入或ψ)精确控制此类系统的立体化学结局的方法。此类方法的优点是,不像经典的亚磷酰胺基于p(iii)的试剂,ψ启动的aso合成是氧化还原经济的并且涉及耐空气和水分的结构单元。
3.膦酸甲酯寡核苷酸或mpo中发现了越来越受到关注的另一种基于p的手性键。参见pritchard,c.e.等人,“methylphosphonate mapping of phosphate contacts critical for rna recognition by the human immunodeficiency virus tat and rev proteins,”nucleic acids res.1994,22(13),2592-2600;还参见koch,m.等人,role of a ribosomal rna phosphate oxygen during the ef-g-triggered gtp hydrolysis,proc.natl.acad.sci.2015,112(20),e2561;hamma,t.等人,“interactions of hairpin oligo-2'-o-methylribonucleotides containing methylphosphonate linkages with hiv tar rna,”antisense and nucleic acid drug dev.2003,13(1),19-30。预期此类结构具有优越的稳定性,因为它们对磷酸二酯酶降解具有高度抗性。参见agrawal,s.等人,“oligodeoxynucleoside methylphosphonates:synthesis and enzymic degradation,”tetrahedron lett.1987,28(31),3539-3542;reynolds,m.a.等人,“synthesis and thermodynamics of oligonucleotides containing chirally pure rp methylphosphonate linkages,”nucleic acids res.1996,24(22),4584-4591。非桥接氧原子的不存在使骨架呈电荷中性并且无法形成h键。当形成dna-rna双链体时,这可能导致稳定或不稳定作用。与基于硫代磷酸酯的aso一样,mpo在磷处引入手性,并且因此,s
p
和r
p
异构体具有不同的结合亲和力和生物学活性。确实,第一类aso类似物中的一种采用mpo键。目前,将基于mpo的结构单元的制备融入需要繁琐的非对映异构体分离的基于p(iii)的策略。参见miller,p.s.等人,nonionic nucleic acid analogs.synthesis and characterization of dideoxyribonucleoside methylphosphonates.biochemistry 1979,18(23),5134-5143;engels,j.等人,eine neue synthese von nukleosidmethylph
osphonaten.angew.chem.int.ed.eng.1982,21(s12),2010-2015;lebedev,a.v.等人,“a new dmap-catalyzed phosphonamidite coupling reaction for synthesis of oligonucleotide methylphosphonate derivatives,”tetrahedron lett.1990,31(6),851-854;heli
ń
ski,j.等人,“n,n-diisopropyl-o-p-nitrophenyl-p-methylphosphonoamidite:novel difunctional piii reagent in oligonucleoside methylphosphonate synthesis containing 4-nitrophenoxy group,”tetrahedron lett.1991,32(37),4981-4984。这些局限性肯定会阻碍对用于现代治疗应用的此类键的广泛探索。
4.此外,在磷处呈手性的立体基于p的系统代表一些已知的最重要的配体。参见vineyard,b.d.等人,asymmetric hydrogenation:rhodium chiral bisphosphine catalyst,j.am.chem.soc.1977,99(18),5946-5952;还参见knowles,w.s.,“asymmetric hydrogenations(nobel lecture 2001),”adv.synth.catal.2003,345(1-2),3-13。例如,dipamp是第一类用于非对称氢化中的手性膦之一,在非常有名的l-dopa过程中用作核心部件。从那时起,已经出现了许多有用的配体支架,如duanphos和bibop,以在近乎完美的控制下安置新的立体碳中心。尽管它们的实用性很大,但是p-手性膦的简单模块化合成仍然是未满足的挑战。
5.因此,需要高效直接的方法来控制基于p的立体化学,其中应用包括寡核苷酸化学和不对称合成。
技术实现要素:
6.在一方面,本公开文本涉及一种式(i)的化合物:或其盐;其中r1、r4、r5、r7和n是下文所定义的。
7.在一方面,本公开文本涉及一种式(ia)的化合物:其盐、其对映异构体或其组合。
8.在一方面,本公开文本涉及一种制造硫代次膦酸的方法,所述方法包括:使负碳离子试剂与式(ia)的化合物:
其盐、其对映异构体或其组合反应;其中r1是下文所定义的;以形成硫代次膦酸。
9.在一方面,上述方法中形成的硫代次膦酸由式(ii)表示:其中r1和r2是下文所定义的。
10.在一方面,所述方法进一步包括使所述硫代次膦酸与烷基化试剂反应以形成硫代次膦酸酯。
11.在一方面,上述方法中形成的硫代次膦酸酯由式(iii)表示:其中r1、r2和r'是下文所定义的。
12.在一方面,所述方法进一步包括使所述硫代次膦酸酯醇盐剂反应以形成有机次膦酸酯。
13.在一方面,上述方法中形成的有机次膦酸酯由式(iv)表示其中r1、r2和r'是下文所定义的。
14.在一方面,所述方法进一步包括使所述有机次膦酸酯与负碳离子试剂反应以形成氧化膦。
15.在一方面,上述方法中形成的氧化膦由式(v)表示:
其中r1、r2和r3是下文所定义的。
16.在一方面,所述方法进一步包括使所述氧化膦与还原剂反应以形成膦。
17.在一方面,上述方法中形成的膦由式(vi)表示:其中r1、r2和r3是下文所定义的。
18.在一方面,本公开文本涉及一种制造负载核苷的有机磷化合物的方法,所述方法包括使式(ia)的化合物或其对映异构体与核苷反应。
19.在一方面,上述方法中形成的负载核苷的有机磷化合物由式(vii)或(viia)表示或其非对映异构体;其中r1、r'或nu1是下文所定义的。
20.在一方面,所述方法进一步包括使所述负载核苷的有机磷化合物与第二核苷反应以形成二核苷酸。
21.在一方面,上述方法中形成的二核苷酸由式(viii)或(viiia)表示:其中r1、nu1或nu2是下文所定义的。
22.在一方面,所述方法进一步包括a)使所述二核苷酸与式(ia)的化合物反应以形成负载的二核苷酸;b)使步骤(a)中形成的负载的二核苷酸与第三核苷反应以形成三核苷酸;c)重复步骤(a)和(b)一次或多次以形成具有所希望数量的核苷酸的寡核苷酸。
23.在一方面,所述方法进一步包括a)使所述二核苷酸与式c的化合物:
或其对映异构体反应以形成负载的嵌合二核苷酸;以及b)使步骤(a)中形成的负载的嵌合二核苷与第三核苷反应以形成带有膦酸酯键和硫代磷酸酯键的嵌合三核苷酸。
24.在一方面,本公开文本涉及一种式(iiia)的化合物:或其对映异构体;其中r1和r2是下文所定义的。
25.在一方面,本公开文本涉及一种式(iva)的化合物:或其对映异构体;
26.其中r1和r2是下文所定义的。
27.在一方面,本公开文本涉及一种式(vii)的化合物:或其对映异构体;其中r1、r'和nu1是下文所定义的。
28.在一方面,本公开文本涉及一种制造式(ia)的化合物:
或其对映异构体的方法;其中r1是下文所定义的;所述方法包括使负碳离子试剂与式a的化合物:或其对映异构体反应,以形成式(ia)的化合物。
具体实施方式
本公开文本的试剂
29.本公开文本的试剂和化合物是用于模块化对映发散性合成c-p键的基于p(v)的化合物。a.二硫代膦酸酯试剂
30.在一方面,所述二硫代膦酸酯试剂是由式(i)表示的化合物:或其盐;其中:r1是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基,其中r1任选地被一个或多个相同或不同的ra基团取代;ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳
基或c附接的杂芳基;r4是氢、c
1-6
烷基、c
2-6
烯基或c
2-6
炔基;r5是c
1-6
烷基、c
2-6
烯基或c
2-6
炔基;r7是取代氢的取代基并且是以下中的一种:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基或c
6-10
芳基;并且n是0、1、2、3、4、5、6、7或8。
31.在一方面,所述二硫代膦酸酯试剂是式(ia)的化合物:其盐、其对映异构体或其组合。其中r1是上文所定义的。
32.在一方面,r1选自:
33.其中是在r1与式(i)的磷之间的键。
34.在一方面,r1是-ch3。在另一方面,r1是苯基。
35.在一方面,所述二硫代膦酸酯试剂是表1中所列的任一种或多种化合物。表1
36.在一方面,本公开文本的二硫代膦酸酯试剂具有至少50%(即至少75%的一种对映异构体和至多25%的另一种对映异构体)、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的光学纯度或对映异构体过量(如通过本领域的标准方法确定的)。
b.硫代次膦酸酯试剂
37.在另一方面,本公开文本提供了由式(iiia)表示的硫代次膦酸酯试剂:或其对映异构体;其中r1和r2中的每一个是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;其中r1和r2中的每一个任选地被一个或多个相同或不同的ra基团取代;ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基。
38.在一方面,所述硫代次膦酸酯试剂是表2中所列的任一种或多种化合物。表2
39.在一方面,本公开文本的硫代次膦酸酯试剂具有至少50%(即至少75%的一种对映异构体和至多25%的另一种对映异构体)、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的光学纯度或对映异构体过量(如通过本领域的标准方法确定的)。c.有机次膦酸酯试剂
40.在另一方面,本公开文本提供了由式(iva)表示的有机次膦酸酯试剂:其中r1和r2中的每一个是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;其中r1和r2中的每一个任选地被一个或多个相同或不同的ra基团取代;
ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;或其对映异构体。
41.在一方面,所述有机次膦酸酯试剂是表3中所列的任一种或多种化合物。表3
42.在一方面,本公开文本的有机次膦酸酯试剂具有至少50%(即至少75%的一种对映异构体和至多25%的另一种对映异构体)、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的光学纯度或对映异构体过量(如通过本领域的标准方法确定的)。d.负载核苷的有机磷试剂
43.在一方面,本公开文本提供了由式(vii)或(viia)表示的负载核苷的有机磷试剂:
或其非对映异构体,其中r1是c
1-6
烷基、c
2-6
烯基或c
2-6
炔基;r'是c
1-6
烷基、c
2-6
烯基或c
2-6
炔基;nu1是核苷,并且其中nu1任选地包含,彼此独立地,一个或多个相同或不同的修饰或一个或多个相同或不同的保护基团。
44.在一方面,r1和r'中的每一个是-ch3。
45.在一方面,nu1是选自以下的核苷其中t是a
bz
是gibu
是并且c
bz
是
46.在一方面,所述负载核苷的有机磷试剂是表4中所列的任一种或多种化合物。表4
47.在一方面,本公开文本的负载核苷的有机磷试剂具有以下的非对映异构体比率(“d.r.”,如通过本领域的标准方法确定的):至少5:1、至少10:1、至少15:1、至少20:1、至少25:1、至少30:1、至少35:1、至少40:1、至少45:1、至少50:1、至少55:1、至少60:1、至少65:1、至少70:1、至少75:1、至少80:1、至少85:1、至少90:1、至少95:1或至少99:1。
48.在一方面,所述核苷是核糖核苷。在另一方面,所述核苷是脱氧核糖核苷。
49.核苷可以是天然存在的核苷或非天然存在的核苷类似物。由于糖和/或碱基部分中的修饰,如本文所用的“核苷类似物”是天然核苷(如dna或rna核苷)的变体。在寡核苷酸的上下文中,类似物可能大体上是“沉默的”或与天然核苷“等效的”,即,对寡核苷酸工作方式没有功能性影响。然而,如果例如此类“等效的”类似物制造起来更容易或更便宜,或者对于储存或制造条件更稳定,或者表示标签或标记,那么它们可以是有用的。然而,在一些方
面,类似物将对寡核苷酸功能的方式具有功能性影响;例如通过产生增加的对靶标的结合亲和力和/或增加的对细胞内核酸酶的抗性和/或增加的向细胞内转运的容易性而具有功能性影响。
50.本文采用的有用核苷也可以包括经修饰的糖。2'-糖修饰包括氟、o-烷基、o-烷基氨基、o-烷基烷氧基、经保护的o-烷基氨基、o-烷基氨基烷基、o-烷基咪唑和式(o-烷基)m(其中m是1至约10)的聚醚。这些聚醚中优选的是线性和环状聚乙二醇(peg)和含peg的基团,如冠醚以及以下文献中公开的那些:ouchi等人,drug design and discovery 1992,9,93;ravasio等人,j.org.chem.1991,56,4329;和delgardo等人,critical reviews in therapeutic drug carrier systems 1992,9,249,将其各自通过引用以其整体特此并入。体现糖修饰的进一步的核苷公开于cook,anti-cancer drug design,1991,6,585-607和美国公开号2016/237427中,将其通过引用以其整体特此并入。氟、o-烷基、o-烷基氨基、o-烷基咪唑、o-烷基氨基烷基和烷基氨基取代基描述于标题为“oligomeric compounds having pyrimidine nucleotide(s)with 2'and 5'substitutions(具有2'和5'取代的一种或多种嘧啶核苷酸的寡聚化合物)”的美国专利号6,166,197中,将所述专利通过引用以其整体特此并入。
51.具有2'-糖修饰的另外有用的核苷包括2'-sr和2'-nr2基团,其中每个r独立地是氢、保护基团或经取代或未经取代的烷基、烯基或炔基。2'-sr核苷公开于1997年9月23日授权的美国专利号5,670,633中,将所述专利通过引用以其整体特此并入。
52.有用的核苷还包括用硒(se)衍生的核苷。se衍生的核苷的例子包括这样的核苷,其中糖的位置2'和/或5'处的o原子被se替代。其他例子包括在呋喃糖环、核碱基和非桥接磷酸酯中用se替代氧。此类核酸描述于例如pallan等人,nat.protoc.,2(3):647-51(2007)和nat.protoc.,2(3);640-646(2007)中,将其通过引用以其整体特此并入。
53.合适的核苷的其他例子包括含硼核苷,如描述于schinazi等人,nucleosides and nucleotides,17(635-647(1998);biochem.,35(18):5741-5746(1996);j.org.chem.,79(8):3465-3472(2014)中,将其通过引用以其整体特此并入。
54.另外的有用的核苷类似物包括但不限于,锁核酸(lna);2'-o-烷基-rna;2'-氨基-dna;2'-氟-dna;阿拉伯糖核酸(ana);2'-氟-ana、己糖醇核酸(hna)、嵌入核酸(ina)、约束乙基核苷(cet)、2'-o-甲基核酸(2'-ome)、2'-o-甲氧基乙基核酸(2'-moe)或其任何组合。
[0055]“己糖醇核酸”或“hna”由具有位于2-[s]-位置的核碱基的磷酸化的2,3-二脱氧-d-阿拉伯糖-己糖醇单元构成。
[0056]“cet”或“约束乙基”意指具有包含连接4'-碳和2'-碳的桥的糖部分的双环核苷,其中所述桥具有式:4'-ch(ch3)-0-2'。
[0057]“2'-o-甲氧基乙基”(也称为2'-moe和2'-o(ch2)
2-och3和moe)是指在呋喃糖环的2'位置处的o-甲氧基-乙基修饰。2'-o-甲氧基乙基修饰的糖是经修饰的糖。
[0058]“2'-f”是指呋喃糖基糖环的2'位置的修饰以包含氟基团。
[0059]
如本文所用,“2'-ome”或“2'-och
3”或“2'-o-甲基”各自是指在呋喃糖基糖环的2'位置处的修饰以包含-och3基团。
[0060]
合适的核苷酸类似物的例子由wo 2007/031091提供,将其通过引用以其整体并入或参考。
[0061]
在非特异性或异常结合发生之前,在寡聚体中掺入增强亲和力的核苷酸类似物(如lna或2'取代的糖)可以允许特异性结合寡聚体的大小减小,并且也可以减小寡聚体大小的上限。
[0062]
在一些实施方案中,所述核苷是包括双环糖在内的核苷类似物。双环糖的非限制性例子包括cet、2',4'-约束2'-o-甲氧基乙基(cmoe)、lna、α-lna、β-lna、2'-o,4'-c-亚乙基桥接的核酸(ena)、氨基-lna、氧基-lna或硫代-lna。
[0063]
术语“lna”是指双环核苷类似物,称为“锁核酸”。它可以指lna单体,或者在“lna寡核苷酸”的上下文中使用时,lna是指含有一个或多个此类双环核苷酸类似物的寡核苷酸。lna核苷的特征在于在核糖环的c2'与c4'之间存在接头基团(如桥)。这种桥包括但不限于选自以下的二基(二价基团):-ch
2-o-、-ch
2-s-、-ch
2-nh-、-ch
2-n(ch3)-、-ch
2-ch
2-o-、-ch
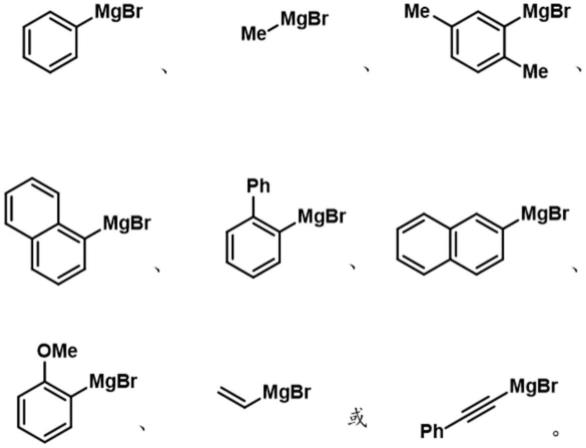
2-ch(ch3)-、-ch
2-ch
2-s-、-ch
2-ch
2-nh-、-ch
2-ch
2-ch
2-、-ch
2-ch
2-ch
2-o-、-ch
2-ch
2-ch(ch3)-、-ch=ch-ch
2-、-ch
2-o-ch
2-o-、-ch
2-nh-o-、-ch
2-n(ch3)-o-、-ch
2-o-ch
2-、-ch(ch3)-o-和-ch(ch
2-o-ch3)-o-、和/或-ch
2-ch
2-、和-ch=ch-,对于所有手性中心,可以发现不对称基团呈r或s取向。
[0064]
在一些实施方案中,二基可以是-c(rarb)-o-c(rcrd)-o-,其中ra、rb、rc和rd独立地选自氢、卤素、c
1-6
烷基、经取代的c
1-6
烷基、c
2-6
烯基、经取代的c
2-6
烯基、c
2-6
炔基或经取代的c
2-6
炔基、c
1-6
烷氧基、经取代的c
1-6
烷氧基、酰基、经取代的酰基、c
1-6
氨基烷基或经取代的c
1-6
氨基烷基,如氢。
[0065]
合适的双环核苷公开于wo 2007/134181、wo 2008/154401、wo 2008/150729、wo 2009/067647(α-l-双环核酸类似物)和wo 2009006478a中,将其全部通过引用以其整体特此并入。
[0066]
进一步的双环核苷类似物及其在反义寡核苷酸中的用途公开于wo 2011/115818、wo 2011/085102、wo 2011/017521、wo 2009/100320、wo 2010/036698、wo 2009/124295和wo 2009/006478中,将其各自通过引用以其整体并入本文。
[0067]
术语“硫代-lna”包括这样的锁核苷,其中下文通式iii中的y选自s或-ch
2-s-。硫代-lna可以呈β-d和α-l-构型。
[0068]
术语“氨基-lna”包括这样的锁核苷,其中下文通式iii中的y选自-n(h)-、n(r)-、ch
2-n(h)-和-ch
2-n(r)-,其中r选自氢和c
1-4-烷基。氨基-lna可以呈β-d和α-l-构型两者。
[0069]
术语“氧基-lna”包括这样的锁核苷,其中下文通式iii中的y表示-o-。氧基-lna可以呈β-d和α-l-构型两者。
[0070]
术语“ena”包括这样的锁核苷,其中下文通式iii中的y是-ch
2-o-(其中-ch
2-o-的氧原子与相对于碱基b的2'位置附接)。re是氢或甲基。
[0071]
在一些示例性实施方案中,lna选自β-d-氧基-lna、α-l-氧基-lna、β-d-氨基-lna和β-d-硫代-lna。
[0072]
在一些实施方案中,核苷类似物可以是例如:2'-o-烷基-rna单元、2'-氨基-dna单元、2'-氟-dna单元、lna单元、阿拉伯糖核酸(ana)单元、2'-氟-ana单元、hna单元、ina(嵌入核酸-christensen,2002.nucl.acids.res.2002 30:4918-4925,通过引用特此并入)单元和2'-moe单元。
[0073]
术语“核碱基”是指核苷酸的碱基部分并且覆盖天然存在的变体以及非天然存在
溴腺苷三磷酸酯;2'-b-三氟甲基腺苷三磷酸酯;2-氯腺苷三磷酸酯;2'-脱氧-2',2'-二氟腺苷三磷酸酯;2'-脱氧-2'-a-巯基腺苷三磷酸酯;2'-脱氧-2'-a-硫代甲氧基腺苷三磷酸酯;2'-脱氧-2'-b-氨基腺苷三磷酸酯;2'-脱氧-2'-b-叠氮基腺苷三磷酸酯;2'-脱氧-2'-b-溴腺苷三磷酸酯;2'-脱氧-2'-b-氯腺苷三磷酸酯;2'-脱氧-2'-b-氟腺苷三磷酸酯;2'-脱氧-2'-b-碘腺苷三磷酸酯;2'-脱氧-2'-b-巯基腺苷三磷酸酯;2'-脱氧-2'-b-硫代甲氧基腺苷三磷酸酯;2-氟腺苷三磷酸酯;2-碘腺苷三磷酸酯;2-巯基腺苷三磷酸酯;2-甲氧基-腺嘌呤;2-甲硫基-腺嘌呤;2-三氟甲基腺苷三磷酸酯;3-脱氮-3-溴腺苷三磷酸酯;3-脱氮-3-氯腺苷三磷酸酯;3-脱氮-3-氟腺苷三磷酸酯;3-脱氮-3-碘腺苷三磷酸酯;3-脱氮腺苷三磷酸酯;4'-叠氮基腺苷三磷酸酯;4'-碳环腺苷三磷酸酯;4'-乙炔基腺苷三磷酸酯;5'-同-腺苷三磷酸酯;8-氮杂-腺苷三磷酸酯;8-溴-腺苷三磷酸酯;8-三氟甲基腺苷三磷酸酯;9-脱氮腺苷三磷酸酯;2-氨基嘌呤;7-脱氮-2,6-二氨基嘌呤;7-脱氮-8-氮杂-2,6-二氨基嘌呤;7-脱氮-8-氮杂-2-氨基嘌呤;2,6-二氨基嘌呤;7-脱氮-8-氮杂-腺嘌呤、7-脱氮-2-氨基嘌呤;2-硫代胞苷;3-甲基胞苷;5-甲酰基胞苷;5-羟基甲基胞苷;5-甲基胞苷;n4-乙酰基胞苷;2'-o-甲基胞苷;5,2'-o-二甲基胞苷;5-甲酰基-2'-o-甲基胞苷;赖胞苷;n4,2'-o-二甲基胞苷;n4-乙酰基-2'-o-甲基胞苷;n4-甲基胞苷;n4,n4-二甲基-2'-ome-胞苷tp;4-甲基胞苷;5-氮杂-胞苷;假-异-胞苷;吡咯并-胞苷;α-硫代-胞苷;2-(硫代)胞嘧啶;2'-氨基-2'-脱氧-胞苷三磷酸酯;2'-叠氮基-2'-脱氧-胞苷三磷酸酯;2'-脱氧-2'-a-氨基胞苷三磷酸酯;2'-脱氧-2'-a-叠氮基胞苷三磷酸酯;3(脱氮)5(氮杂)胞嘧啶;3(甲基)胞嘧啶;3-(烷基)胞嘧啶;3-(脱氮)5(氮杂)胞嘧啶;3-(甲基)胞苷;4,2'-o-二甲基胞苷;5(卤代)胞嘧啶;5(甲基)胞嘧啶;5(丙炔基)胞嘧啶;5(三氟甲基)胞嘧啶;5-(烷基)胞嘧啶;5-(炔基)胞嘧啶;5-(卤代)胞嘧啶;5-(丙炔基)胞嘧啶;5-(三氟甲基)胞嘧啶;5-溴-胞苷;5-碘-胞苷;5-丙炔基胞嘧啶;6-(偶氮)胞嘧啶;6-氮杂-胞苷;氮杂胞嘧啶;脱氮胞嘧啶;n4(乙酰基)胞嘧啶;1-甲基-1-脱氮-假异胞苷;1-甲基-假异胞苷;2-甲氧基-5-甲基-胞苷;2-甲氧基-胞苷;2-硫代-5-甲基-胞苷;4-甲氧基-1-甲基-假异胞苷;4-甲氧基-假异胞苷;4-硫代-1-甲基-1-脱氮-假异胞苷;4-硫代-1-甲基-假异胞苷;4-硫代-假异胞苷;5-氮杂-泽布拉林(zebularine);5-甲基-泽布拉林;吡咯并-假异胞苷;泽布拉林;(e)-5-(2-溴-乙烯基)胞苷三磷酸酯;2,2'-脱水-胞苷三磷酸酯盐酸盐;2'氟-n4-bz-胞苷三磷酸酯;2'氟-n4-乙酰基-胞苷三磷酸酯;2'-o-甲基-n4-乙酰基-胞苷三磷酸酯;2'o-甲基-n4-bz-胞苷三磷酸酯;2'-a-乙炔基胞苷三磷酸酯;2'-a-三氟甲基胞苷三磷酸酯;2'-b-乙炔基胞苷三磷酸酯;2'-b-三氟甲基胞苷三磷酸酯;2'-脱氧-2',2'-二氟胞苷三磷酸酯;2'-脱氧-2'-a-巯基胞苷三磷酸酯;2'-脱氧-2'-a-硫代甲氧基胞苷三磷酸酯;2'-脱氧-2'-b-氨基胞苷三磷酸酯;2'-脱氧-2'-b-叠氮基胞苷三磷酸酯;2'-脱氧-2'-b-溴胞苷三磷酸酯;2'-脱氧-2'-b-氯胞苷三磷酸酯;2'-脱氧-2'-b-氟胞苷三磷酸酯;2'-脱氧-2'-b-碘胞苷三磷酸酯;2'-脱氧-2'-b-巯基胞苷三磷酸酯;2'-脱氧-2'-b-硫代甲氧基胞苷三磷酸酯;2'-o-甲基-5-(1-丙炔基)胞苷三磷酸酯;3'-乙炔基胞苷三磷酸酯;4'-叠氮基胞苷三磷酸酯;4'-碳环胞苷三磷酸酯;4'-乙炔基胞苷三磷酸酯;5-(1-丙炔基)阿拉伯糖-胞苷三磷酸酯;5-(2-氯-苯基)-2-硫代胞苷三磷酸酯;5-(4-氨基-苯基)-2-硫代胞苷三磷酸酯;5-氨基烯丙基-胞苷三磷酸酯;5-氰基胞苷三磷酸酯;5-乙炔基阿拉伯糖-胞苷三磷酸酯;5-乙炔基胞苷三磷酸酯;5'-同-胞苷三磷酸酯;5-甲氧基胞苷三磷酸酯;5-三氟甲基-胞苷三磷酸酯;n4-氨基-胞苷三磷酸酯;
n4-苯甲酰基-胞苷三磷酸酯;假异胞苷;7-甲基鸟苷;n2,2'-o-二甲基鸟苷;n2-甲基鸟苷;怀俄苷;1,2'-o-二甲基鸟苷;1-甲基鸟苷;2'-o-甲基鸟苷;2'-o-核糖基鸟苷(磷酸酯);2'-o-甲基鸟苷;2'-o-核糖基鸟苷(磷酸酯);7-氨基甲基-7-脱氮鸟苷;7-氰基-7-脱氮鸟苷;古嘌苷;甲基怀俄苷;n2,7-二甲基鸟苷;n2,n2,2'-o-三甲基鸟苷;n2,n2,7-三甲基鸟苷;n2,n2-二甲基鸟苷;n2,7,2'-o-三甲基鸟苷;6-硫代-鸟苷;7-脱氮-鸟苷;8-氧代-鸟苷;n1-甲基-鸟苷;α-硫代-鸟苷;2(丙基)鸟嘌呤;2-(烷基)鸟嘌呤;2'-氨基-2'-脱氧-鸟苷三磷酸酯;2'-叠氮基-2'-脱氧-鸟苷三磷酸酯;2'-脱氧-2'-a-氨基鸟苷三磷酸酯;2'-脱氧-2'-a-叠氮基鸟苷三磷酸酯;6-(烷基)鸟嘌呤;6-甲基-鸟苷;7-(烷基)鸟嘌呤;7-(脱氮)鸟嘌呤;7-(甲基)鸟嘌呤;8-(烯基)鸟嘌呤;8-(烷基)鸟嘌呤;8-(炔基)鸟嘌呤;8-(氨基)鸟嘌呤;8-(卤代)鸟嘌呤;8-(羟基)鸟嘌呤;8-(硫烷基)鸟嘌呤;8-(硫醇)鸟嘌呤;氮杂鸟嘌呤;脱氮鸟嘌呤;n-(甲基)鸟嘌呤;1-甲基-6-硫代-鸟苷;6-甲氧基-鸟苷;6-硫代-7-脱氮-8-氮杂-鸟苷;6-硫代-7-脱氮-鸟苷;6-硫代-7-甲基-鸟苷;7-脱氮-8-氮杂-鸟苷;7-甲基-8-氧代-鸟苷;n2,n2-二甲基-6-硫代-鸟苷;n2-甲基-6-硫代-鸟苷;1-me-鸟苷三磷酸酯;2'氟-n2-异丁基-鸟苷三磷酸酯;2'o-甲基-n2-异丁基-鸟苷三磷酸酯;2'-a-乙炔基鸟苷三磷酸酯;2'-a-三氟甲基鸟苷三磷酸酯;2'-b-乙炔基鸟苷三磷酸酯;2'-b-三氟甲基鸟苷三磷酸酯;2'-脱氧-2',2'-二氟鸟苷三磷酸酯;2'-脱氧-2'-a-巯基鸟苷三磷酸酯;2'-脱氧-2'-a-硫代甲氧基鸟苷三磷酸酯;2'-脱氧-2'-b-氨基鸟苷三磷酸酯;2'-脱氧-2'-b-叠氮基鸟苷三磷酸酯;2'-脱氧-2'-b-溴鸟苷三磷酸酯;2'-脱氧-2'-b-氯鸟苷三磷酸酯;2'-脱氧-2'-b-氟鸟苷三磷酸酯;2'-脱氧-2'-b-碘鸟苷三磷酸酯;2'-脱氧-2'-b-巯基鸟苷三磷酸酯;2'-脱氧-2'-b-硫代甲氧基鸟苷三磷酸酯;4'-叠氮基鸟苷三磷酸酯;4'-碳环鸟苷三磷酸酯;4'-乙炔基鸟苷三磷酸酯;5'-同-鸟苷三磷酸酯;8-溴-鸟苷三磷酸酯;9-脱氮鸟苷三磷酸酯;n2-异丁基-鸟苷三磷酸酯;1-甲基肌苷;肌苷;1,2'-o-二甲基肌苷;7-甲基肌苷;2'-o-甲基肌苷;环氧辫苷;半乳糖基-辫苷;甘露糖基辫苷;辫苷;烯丙基氨基-胸腺嘧啶;氮杂胸腺嘧啶;脱氮胸腺嘧啶;脱氧-胸腺嘧啶;2-硫代尿苷;3-甲基尿苷;5-羧甲基尿苷;5-羟基尿苷;5-甲基尿苷;5-牛磺酸甲基-2-硫代尿苷;5-牛磺酸甲基尿苷;二氢尿苷;假尿苷;1-甲基-3-(3-氨基-5-羧丙基)假尿苷;1-甲基假尿苷;1-乙基-假尿苷;2'-o-甲基尿苷;2'-o-甲基假尿苷;2'-o-甲基尿苷;2-硫代-2'-o-甲基尿苷;3-(3-氨基-3-羧丙基)尿苷;3,2'-o-二甲基尿苷;3-甲基-假-尿苷三磷酸酯;4-硫代尿苷;5-(羧基羟基甲基)尿苷;5-(羧基羟基甲基)尿苷甲酯;5,2'-o-二甲基尿苷;5,6-二氢-尿苷;5-氨基甲基-2-硫代尿苷;5-氨基甲酰基甲基-2'-o-甲基尿苷;5-氨基甲酰基甲基尿苷;5-羧基羟基甲基尿苷;5-羧基羟基甲基尿苷甲酯;5-羧甲基氨基甲基-2'-o-甲基尿苷;5-羧甲基氨基甲基-2-硫代尿苷;5-羧甲基氨基甲基尿苷;5-氨基甲酰基甲基尿苷三磷酸酯;5-甲氧基羰基甲基-2'-o-甲基尿苷;5-甲氧基羰基甲基-2-硫代尿苷;5-甲氧基羰基甲基尿苷;5-甲氧基尿苷;5-甲基-2-硫代尿苷;5-甲基氨基甲基-2-硒尿苷;5-甲基氨基甲基-2-硫代尿苷;5-甲基氨基甲基尿苷;5-甲基二氢尿苷;5-氧乙酸-尿苷三磷酸酯;5-氧乙酸-甲酯-尿苷三磷酸酯;n1-甲基-假-尿嘧啶;n1-乙基-假-尿嘧啶;尿苷5-氧乙酸;尿苷5-氧乙酸甲酯;3-(3-氨基-3-羧丙基)-尿苷三磷酸酯;5-(异戊烯基氨基甲基)-2-硫代尿苷三磷酸酯;5-(异戊烯基氨基甲基)-2'-o-甲基尿苷三磷酸酯;5-(异戊烯基氨基甲基)尿苷三磷酸酯;5-丙炔基尿嘧啶;α-硫代-尿苷;1(氨基烷基氨基-羰基乙烯基)-2(硫代)-假尿嘧啶;1(氨基烷基氨基羰基乙烯基)-2,4-(二硫代)假尿嘧啶;1
(氨基烷基氨基羰基乙烯基)-4(硫代)假尿嘧啶;1(氨基烷基氨基羰基乙烯基)-假尿嘧啶;1(氨基羰基乙烯基)-2(硫代)-假尿嘧啶;1(氨基羰基乙烯基)-2,4-(二硫代)假尿嘧啶;1(氨基羰基乙烯基)-4(硫代)假尿嘧啶;1(氨基羰基乙烯基)-假尿嘧啶;1取代的2(硫代)-假尿嘧啶;1取代的2,4-(二硫代)假尿嘧啶;1取代的4(硫代)假尿嘧啶;1取代的假尿嘧啶;1-(氨基烷基氨基-羰基乙烯基)-2-(硫代)-假尿嘧啶;1-甲基-3-(3-氨基-3-羧丙基)假尿苷三磷酸酯;1-甲基-3-(3-氨基-3-羧丙基)假-尿苷三磷酸酯;1-甲基-假-尿苷三磷酸酯;1-乙基-假-尿苷三磷酸酯;2(硫代)假尿嘧啶;2'脱氧尿苷;2'氟尿苷;2-(硫代)尿嘧啶;2,4-(二硫代)假尿嘧啶;2'甲基、2'氨基、2'叠氮基、2'氟-鸟苷;2'-氨基-2'-脱氧-尿苷三磷酸酯;2'-叠氮基-2'-脱氧-尿苷三磷酸酯;2'-叠氮基-脱氧尿苷三磷酸酯;2'脱氧尿苷;2'氟尿苷;2'-脱氧-2'-a-氨基尿苷三磷酸酯;2'-脱氧-2'-a-叠氮基尿苷三磷酸酯;2-甲基假尿苷;3(3氨基-3羧丙基)尿嘧啶;4-(硫代)假尿嘧啶;4-硫代尿嘧啶;5(1,3-二唑-1-烷基)尿嘧啶;5(2-氨基丙基)尿嘧啶;5(氨基烷基)尿嘧啶;5(二甲基氨基烷基)尿嘧啶;5(胍烷基)尿嘧啶;5(甲氧基羰基甲基)-2-(硫代)尿嘧啶;5(甲氧基羰基-甲基)尿嘧啶;5(甲基)2(硫代)尿嘧啶;5(甲基)2,4(二硫代)尿嘧啶;5(甲基)4(硫代)尿嘧啶;5(甲基氨基甲基)-2(硫代)尿嘧啶;5(甲基氨基甲基)-2,4(二硫代)尿嘧啶;5(甲基氨基甲基)-4(硫代)尿嘧啶;5(丙炔基)尿嘧啶;5(三氟甲基)尿嘧啶;5-(2-氨基丙基)尿嘧啶;5-(烷基)-2-(硫代)假尿嘧啶;5-(烷基)-2,4(二硫代)假尿嘧啶;5-(烷基)-4(硫代)假尿嘧啶;5-(烷基)假尿嘧啶;5-(烷基)尿嘧啶;5-(炔基)尿嘧啶;5-(烯丙基氨基)尿嘧啶;5-(氰基烷基)尿嘧啶;5-(二烷基氨基烷基)尿嘧啶;5-(二甲基氨基烷基)尿嘧啶;5-(胍烷基)尿嘧啶;5-(卤代)尿嘧啶;5-(l,3-二唑-l-烷基)尿嘧啶;5-(甲氧基)尿嘧啶;5-(甲氧基羰基甲基)-2-(硫代)尿嘧啶;5-(甲氧基羰基-甲基)尿嘧啶;5-(甲基)2(硫代)尿嘧啶;5-(甲基)2,4(二硫代)尿嘧啶;5-(甲基)4(硫代)尿嘧啶;5-(甲基)-2-(硫代)假尿嘧啶;5-(甲基)-2,4(二硫代)假尿嘧啶;5-(甲基)-4(硫代)假尿嘧啶;5-(甲基)假尿嘧啶;5-(甲基氨基甲基)-2(硫代)尿嘧啶;5-(甲基氨基甲基)-2,4(二硫代)尿嘧啶;5-(甲基氨基甲基)-4-(硫代)尿嘧啶;5-(丙炔基)尿嘧啶;5-(三氟甲基)尿嘧啶;5-氨基烯丙基-尿苷;5-溴-尿苷;5-碘-尿苷;5-尿嘧啶;6-(偶氮)尿嘧啶;6-氮杂-尿苷;烯丙基氨基-尿嘧啶;氮杂尿嘧啶;脱氮尿嘧啶;n3(甲基)尿嘧啶;假-尿苷三磷酸酯-1-2-乙酸;假尿嘧啶;4-硫代-假-尿苷三磷酸酯;1-羧甲基-假尿苷;1-甲基-1-脱氮-假尿苷;1-丙炔基-尿苷;1-牛磺酸甲基-1-甲基-尿苷;1-牛磺酸甲基-4-硫代-尿苷;1-牛磺酸甲基-假尿苷;2-甲氧基-4-硫代-假尿苷;2-硫代-1-甲基-1-脱氮-假尿苷;2-硫代-1-甲基-假尿苷;2-硫代-5-氮杂-尿苷;2-硫代-二氢假尿苷;2-硫代-二氢尿苷;2-硫代-假尿苷;4-甲氧基-2-硫代-假尿苷;4-甲氧基-假尿苷;4-硫代-1-甲基-假尿苷;4-硫代-假尿苷;5-氮杂-尿苷;二氢假尿苷;(
±
)1-(2-羟基丙基)假尿苷三磷酸酯;(2r)-1-(2-羟基丙基)假尿苷三磷酸酯;(2s)-1-(2-羟基丙基)假尿苷三磷酸酯;(e)-5-(2-溴-乙烯基)阿拉伯糖-尿苷三磷酸酯;(e)-5-(2-溴-乙烯基)尿苷三磷酸酯;(z)-5-(2-溴-乙烯基)阿拉伯糖-尿苷三磷酸酯;(z)-5-(2-溴-乙烯基)尿苷三磷酸酯;1-(2,2,2-三氟乙基)-假-尿苷三磷酸酯;1-(2,2,3,3,3-五氟丙基)假尿苷三磷酸酯;1-(2,2-二乙氧基乙基)假尿苷三磷酸酯;1-(2,4,6-三甲基苄基)假尿苷三磷酸酯;1-(2,4,6-三甲基-苄基)假-尿苷三磷酸酯;1-(2,4,6-三甲基-苯基)假-尿苷三磷酸酯;1-(2-氨基-2-羧基乙基)假-尿苷三磷酸酯;1-(2-氨基-乙基)假-尿苷三磷酸酯;1-(2-羟基乙基)假尿苷三磷酸酯;1-(2-甲氧基乙基)假尿苷三磷
酸酯;1-(3,4-双-三氟甲氧基苄基)假尿苷三磷酸酯;1-(3,4-二甲氧基苄基)假尿苷三磷酸酯;1-(3-氨基-3-羧丙基)假-尿苷三磷酸酯;1-(3-氨基-丙基)假-尿苷三磷酸酯;1-(3-环丙基-丙-2-炔基)假尿苷三磷酸酯;1-(4-氨基-4-羧基丁基)假-尿苷三磷酸酯;1-(4-氨基-苄基)假-尿苷三磷酸酯;1-(4-氨基-丁基)假-尿苷三磷酸酯;1-(4-氨基-苯基)假-尿苷三磷酸酯;1-(4-叠氮基苄基)假尿苷三磷酸酯;1-(4-溴苄基)假尿苷三磷酸酯;1-(4-氯苄基)假尿苷三磷酸酯;1-(4-氟苄基)假尿苷三磷酸酯;1-(4-碘苄基)假尿苷三磷酸酯;1-(4-甲烷磺酰基苄基)假尿苷三磷酸酯;1-(4-甲氧基苄基)假尿苷三磷酸酯;1-(4-甲氧基-苄基)假-尿苷三磷酸酯;1-(4-甲氧基-苯基)假-尿苷三磷酸酯;1-(4-甲基-苄基)假-尿苷三磷酸酯;1-(4-硝基-苄基)假-尿苷三磷酸酯;1(4-硝基-苯基)假-尿苷三磷酸酯;1-(4-硫代甲氧基苄基)假尿苷三磷酸酯;1-(4-三氟甲氧基苄基)假尿苷三磷酸酯;1-(4-三氟甲基苄基)假尿苷三磷酸酯;1-(5-氨基-戊基)假-尿苷三磷酸酯;1-(6-氨基-己基)假-尿苷三磷酸酯;1,6-二甲基-假-尿苷三磷酸酯;1-[3-(2-{2-[2-(2-氨基乙氧基)-乙氧基]-乙氧基}-乙氧基)-丙酰基]假尿苷三磷酸酯;1-{3-[2-(2-氨基乙氧基)-乙氧基]-丙酰基}假尿苷三磷酸酯;1-乙酰基假尿苷三磷酸酯;1-烷基-6-(1-丙炔基)-假-尿苷三磷酸酯;1-烷基-6-(2-丙炔基)-假-尿苷三磷酸酯;1-烷基-6-烯丙基-假-尿苷三磷酸酯;1-烷基-6-乙炔基-假-尿苷三磷酸酯;1-烷基-6-同烯丙基-假-尿苷三磷酸酯;1-烷基-6-乙烯基-假-尿苷三磷酸酯;1-烯丙基假尿苷三磷酸酯;1-氨基甲基-假-尿苷三磷酸酯;1-苯甲酰基假尿苷三磷酸酯;1-苄基氧基甲基假尿苷三磷酸酯;1-苄基-假-尿苷三磷酸酯;1-生物素基-peg2-假尿苷三磷酸酯;1-生物素基假尿苷三磷酸酯;1-丁基-假-尿苷三磷酸酯;1-氰基甲基假尿苷三磷酸酯;1-环丁基甲基-假-尿苷三磷酸酯;1-环丁基-假-尿苷三磷酸酯;1-环庚基甲基-假-尿苷三磷酸酯;1-环庚基-假-尿苷三磷酸酯;1-环己基甲基-假-尿苷三磷酸酯;1-环己基-假-尿苷三磷酸酯;1-环辛基甲基-假-尿苷三磷酸酯;1-环辛基-假-尿苷三磷酸酯;1-环戊基甲基-假-尿苷三磷酸酯;1-环戊基-假-尿苷三磷酸酯;1-环丙基甲基-假-尿苷三磷酸酯;1-环丙基-假-尿苷三磷酸酯;1-己基-假-尿苷三磷酸酯;1-同烯丙基假尿苷三磷酸酯;1-羟基甲基假尿苷三磷酸酯;1-异-丙基-假-尿苷三磷酸酯;1-me-2-硫代-假-尿苷三磷酸酯;1-me-4-硫代-假-尿苷三磷酸酯;1-me-α-硫代-假-尿苷三磷酸酯;1-甲烷磺酰基甲基假尿苷三磷酸酯;1-甲氧基甲基假尿苷三磷酸酯;1-甲基-6-(2,2,2-三氟乙基)假-尿苷三磷酸酯;1-甲基-6-(4-吗啉代)-假-尿苷三磷酸酯;1-甲基-6-(4-硫代吗啉代)-假-尿苷三磷酸酯;1-甲基-6-(取代的苯基)假-尿苷三磷酸酯;1-甲基-6-氨基-假-尿苷三磷酸酯;1-甲基-6-叠氮基-假-尿苷三磷酸酯;1-甲基-6-溴-假-尿苷三磷酸酯;1-甲基-6-丁基-假-尿苷三磷酸酯;1-甲基-6-氯-假-尿苷三磷酸酯;1-甲基-6-氰基-假-尿苷三磷酸酯;1-甲基-6-二甲基氨基-假-尿苷三磷酸酯;1-甲基-6-乙氧基-假-尿苷三磷酸酯;1-甲基-6-乙基羧化-假-尿苷三磷酸酯;1-甲基-6-乙基-假-尿苷三磷酸酯;1-甲基-6-氟-假-尿苷三磷酸酯;1-甲基-6-甲酰基-假-尿苷三磷酸酯;1-甲基-6-羟基氨基-假-尿苷三磷酸酯;1-甲基-6-羟基-假-尿苷三磷酸酯;1-甲基-6-碘-假-尿苷三磷酸酯;1-甲基-6-异-丙基-假-尿苷三磷酸酯;1-甲基-6-甲氧基-假-尿苷三磷酸酯;1-甲基-6-甲基氨基-假-尿苷三磷酸酯;1-甲基-6-苯基-假-尿苷三磷酸酯;1-甲基-6-丙基-假-尿苷三磷酸酯;1-甲基-6-叔丁基-假-尿苷三磷酸酯;1-甲基-6-三氟甲氧基-假-尿苷三磷酸酯;1-甲基-6-三氟甲基-假-尿苷三磷酸酯;1-吗啉代甲基假尿苷三磷酸酯;1-戊基-假-尿苷三磷酸酯;1-苯基-假-尿苷三磷酸酯;1-新戊酰
基假尿苷三磷酸酯;1-炔丙基假尿苷三磷酸酯;1-丙基-假-尿苷三磷酸酯;1-丙炔基-假尿苷;1-p-甲苯基-假-尿苷三磷酸酯;1-叔丁基-假-尿苷三磷酸酯;1-硫代甲氧基甲基假尿苷三磷酸酯;1-硫代吗啉代甲基假尿苷三磷酸酯;1-三氟乙酰基假尿苷三磷酸酯;1-三氟甲基-假-尿苷三磷酸酯;1-乙烯基假尿苷三磷酸酯;2,2'-脱水-尿苷三磷酸酯;2'-溴-脱氧尿苷三磷酸酯;2'-f-5-甲基-2'-脱氧-尿苷三磷酸酯;2'-甲氧基-5-甲基-尿苷三磷酸酯;2'-甲氧基-假-尿苷三磷酸酯;2'-a-乙炔基尿苷三磷酸酯;2'-a-三氟甲基尿苷三磷酸酯;2'-b-乙炔基尿苷三磷酸酯;2'-b-三氟甲基尿苷三磷酸酯;2'-脱氧-2',2'-二氟尿苷三磷酸酯;2'-脱氧-2'-a-巯基尿苷三磷酸酯;2'-脱氧-2'-a-硫代甲氧基尿苷三磷酸酯;2'-脱氧-2'-b-氨基尿苷三磷酸酯;2'-脱氧-2'-b-叠氮基尿苷三磷酸酯;2'-脱氧-2'-b-溴尿苷三磷酸酯;2'-脱氧-2'-b-氯尿苷三磷酸酯;2'-脱氧-2'-b-氟尿苷三磷酸酯;2'-脱氧-2'-b-碘尿苷三磷酸酯;2'-脱氧-2'-b-巯基尿苷三磷酸酯;2'-脱氧-2'-b-硫代甲氧基尿苷三磷酸酯;2-甲氧基-4-硫代-尿苷;2-甲氧基尿苷;2'-o-甲基-5-(1-丙炔基)尿苷三磷酸酯;3-烷基-假-尿苷三磷酸酯;4'-叠氮基尿苷三磷酸酯;4'-碳环尿苷三磷酸酯;4'-乙炔基尿苷三磷酸酯;5-(1-丙炔基)阿拉伯糖-尿苷三磷酸酯;5-(2-呋喃基)尿苷三磷酸酯;5-氰基尿苷三磷酸酯;5-二甲基氨基尿苷三磷酸酯;5'-同-尿苷三磷酸酯;5-碘-2'-氟-脱氧尿苷三磷酸酯;5-苯基乙炔基尿苷三磷酸酯;5-三氘代甲基-6-氘代尿苷三磷酸酯;5-三氟甲基-尿苷三磷酸酯;5-乙烯基ara尿苷三磷酸酯;6-(2,2,2-三氟乙基)-假-尿苷三磷酸酯;6-(4-吗啉代)-假-尿苷三磷酸酯;6-(4-硫代吗啉代)-假-尿苷三磷酸酯;6-(取代的苯基)-假-尿苷三磷酸酯;6-氨基-假-尿苷三磷酸酯;6-叠氮基-假-尿苷三磷酸酯;6-溴-假-尿苷三磷酸酯;6-丁基-假-尿苷三磷酸酯;6-氯-假-尿苷三磷酸酯;6-氰基-假-尿苷三磷酸酯;6-二甲基氨基-假-尿苷三磷酸酯;6-乙氧基-假-尿苷三磷酸酯;6-乙基羧化-假-尿苷三磷酸酯;6-乙基-假-尿苷三磷酸酯;6-氟-假-尿苷三磷酸酯;6-甲酰基-假-尿苷三磷酸酯;6-羟基氨基-假-尿苷三磷酸酯;6-羟基-假-尿苷三磷酸酯;6-碘-假-尿苷三磷酸酯;6-异-丙基-假-尿苷三磷酸酯;6-甲氧基-假-尿苷三磷酸酯;6-甲基氨基-假-尿苷三磷酸酯;6-甲基-假-尿苷三磷酸酯;6-苯基-假-尿苷三磷酸酯;6-丙基-假-尿苷三磷酸酯;6-叔丁基-假-尿苷三磷酸酯;6-三氟甲氧基-假-尿苷三磷酸酯;6-三氟甲基-假-尿苷三磷酸酯;α-硫代-假-尿苷三磷酸酯;假尿苷1-(4-甲基苯磺酸)三磷酸酯;假尿苷1-(4-甲基苯甲酸)三磷酸酯;假尿苷三磷酸酯1-[3-(2-乙氧基)]丙酸;假尿苷三磷酸酯1-[3-{2-(2-[2-(2-乙氧基)-乙氧基]-乙氧基)-乙氧基}]丙酸;假尿苷三磷酸酯1-[3-{2-(2-[2-{2(2-乙氧基)-乙氧基}-乙氧基]-乙氧基)-乙氧基}]丙酸;假尿苷三磷酸酯1-[3-{2-(2-[2-乙氧基]-乙氧基)-乙氧基}]丙酸;假尿苷三磷酸酯1-[3-{2-(2-乙氧基)-乙氧基}]丙酸;假尿苷三磷酸酯1-甲基膦酸;假尿苷三磷酸酯1-甲基膦酸二乙酯;假-尿苷三磷酸酯-n1-3-丙酸;假-尿苷三磷酸酯-n1-4-丁酸;假-尿苷三磷酸酯-n1-5-戊酸;假-尿苷三磷酸酯-n1-6-己酸;假-尿苷三磷酸酯-n1-7-庚酸;假-尿苷三磷酸酯-n1-甲基-p-苯甲酸;假-尿苷三磷酸酯-n1-p-苯甲酸;怀丁苷;羟基怀丁苷;异怀俄苷;过氧怀丁苷;未经修饰的羟基怀丁苷;4-去甲基怀俄苷;2,6-(二氨基)嘌呤;1-(氮杂)-2-(硫代)-3-(氮杂)-吩噁嗪-1-基;1,3-(二氮杂)-2-(氧代)-吩噻嗪-l-基;1,3-(二氮杂)-2-(氧代)-吩噁嗪-1-基;1,3,5-(三氮杂)-2,6-(二氧杂)-萘;2(氨基)嘌呤;2,4,5-(三甲基)苯基;2'甲基、2'氨基、2'叠氮基、2'氟-胞苷;2'甲基、2'氨基、2'叠氮基、2'氟-腺嘌呤;2'甲基、2'氨基、2'叠氮基、2'氟-尿苷;2'-氨基-2'-脱氧核糖;2-氨基-6-氯-嘌
呤;2-氮杂-肌苷基;2'-叠氮基-2'-脱氧核糖;2'氟-2'-脱氧核糖;2'-氟-修饰的碱基;2'-o-甲基-核糖;2-氧代-7-氨基吡啶并嘧啶-3-基;2-氧代-吡啶并嘧啶-3-基;2-吡啶酮;3硝基吡咯;3-(甲基)-7-(丙炔基)异喹诺酮基;3-(甲基)异喹诺酮基;4-(氟)-6-(甲基)苯并咪唑;4-(甲基)苯并咪唑;4-(甲基)吲哚基;4,6-(二甲基)吲哚基;5硝基吲哚;5取代的嘧啶;5-(甲基)异喹诺酮基;5-硝基吲哚;6-(氮杂)嘧啶;6-(偶氮)胸腺嘧啶;6-(甲基)-7-(氮杂)吲哚基;6-氯-嘌呤;6-苯基-吡咯并-嘧啶-2-酮-3-基;7-(氨基烷基羟基)-1-(氮杂)-2-(硫代)-3-(氮杂)-吩噻嗪-l-基;7-(氨基烷基羟基)-1-(氮杂)-2-(硫代)-3-(氮杂)-吩噁嗪-1-基;7-(氨基烷基羟基)-1,3-(二氮杂)-2-(氧代)-吩噁嗪-1-基;7-(氨基烷基羟基)-l,3-(二氮杂)-2-(氧代)-吩噻嗪-l-基;7-(氨基烷基羟基)-l,3-(二氮杂)-2-(氧代)-吩噁嗪-l-基;7-(氮杂)吲哚基;7-(胍烷基羟基)-1-(氮杂)-2-(硫代)-3-(氮杂)-吩噁嗪l-基;7-(胍烷基羟基)-1-(氮杂)-2-(硫代)-3-(氮杂)-吩噻嗪-l-基;7-(胍烷基羟基)-1-(氮杂)-2-(硫代)-3-(氮杂)-吩噁嗪-1-基;7-(胍烷基羟基)-1,3-(二氮杂)-2-(氧代)-吩噁嗪-1-基;7-(胍烷基-羟基)-l,3-(二氮杂)-2-(氧代)-吩噻嗪-l-基;7-(胍烷基羟基)-l,3-(二氮杂)-2-(氧代)-吩噁嗪-l-基;7-(丙炔基)异喹诺酮基;7-(丙炔基)异喹诺酮基、7-脱氮-肌苷基;7-取代的1-(氮杂)-2-(硫代)-3-(氮杂)-吩噁嗪-1-基;7-取代的1,3-(二氮杂)-2-(氧代)-吩噁嗪-1-基;9-(甲基)-咪唑并吡啶基;氨基吲哚基;蒽基;双-邻-(氨基烷基羟基)-6-苯基-吡咯并-嘧啶-2-酮-3-基;双-邻-取代的-6-苯基-吡咯并-嘧啶-2-酮-3-基;二氟甲苯基;次黄嘌呤;咪唑并吡啶基;肌苷基;异喹诺酮基;异尿苷;n2-取代的嘌呤;n6-甲基-2-氨基-嘌呤;n6-取代的嘌呤;n-烷基化衍生物;萘基;硝基苯并咪唑基;硝基咪唑基;硝基吲唑基;硝基吡唑基;nubularine;o6-取代的嘌呤;o-烷基化衍生物;邻-(氨基烷基羟基)-6-苯基-吡咯并-嘧啶-2-酮-3-基;邻-取代的-6-苯基-吡咯并-嘧啶-2-酮-3-基;氧间型霉素(oxoformycin)三磷酸酯;对-(氨基烷基羟基)-6-苯基-吡咯并-嘧啶-2-酮-3-基;对-取代的-6-苯基-吡咯并-嘧啶-2-酮-3-基;并五苯基;菲基(phenanthracenyl);苯基;芘基;吡啶并嘧啶-3-基;2-氧代-7-氨基-吡啶并嘧啶-3-基;吡咯并-嘧啶-2-酮-3-基;吡咯并嘧啶基;吡咯并吡嗪基;均二苯乙烯基(stilbenzyl);经取代的1,2,4-三唑;并四苯基;杀结核菌素(tubercidine);黄嘌呤;黄苷-5'-三磷酸酯;2-硫代-泽布拉林;5-氮杂-2-硫代-泽布拉林;7-脱氮-2-氨基-嘌呤;吡啶-4-酮核糖核苷;2-氨基-核糖核苷-三磷酸酯;间型霉素a三磷酸酯;间型霉素b三磷酸酯;吡咯苷(pyrrolosine)三磷酸酯;2'-羟基-阿拉伯糖-腺苷三磷酸酯;2'-羟基-阿拉伯糖-胞苷三磷酸酯;2'-羟基-阿拉伯糖-尿苷三磷酸酯;2'-羟基-阿拉伯糖-鸟苷三磷酸酯;5-(2-羰甲氧基乙烯基)尿苷三磷酸酯;和n6-(19-氨基-五氧杂十九基)腺苷三磷酸酯。
[0077]
在一些实施方案中,核苷的核碱基或经修饰的核碱基包括保护基团。上文描述了合适的保护基团。熟练的技术人员应认识到保护基团的选择将由核碱基或经修饰的核碱基的性质决定。例如,胺可以通过ac、ibu、bn或bz保护。制造p-手性膦的方法
[0078]
本公开文本提供了一种制造p-手性膦的方法。下文方案1中描绘了合成方法。方案1
[0079]
方案1展示了能够通过tlo-psi试剂(1)进行的模块化膦合成,其以组装线的方式发生:负载(以安装r1)、偶联(以安装r2)、置换(离去基团安装,然后r3安装)和还原:如通过x射线晶体学证实的,在此序列的所有步骤中观察到p处的净立体保留(stereoretention)。
[0080]
为了确保清楚,源自(-)-或( )-tlo-psi的化合物用后缀a和b表示[a表示(-)并且b表示( )]。然而,如果手头只有一种试剂,则简单地改变此模块化策略中的添加顺序可能导致偶联的对映异构体或置换产物(反之亦然)。
[0081]
在制造手性膦的方法中,出乎意料地发现源自反式柠檬烯氧化物的p(v)试剂(“tlo-psi”)具有比源自顺式柠檬烯氧化物的p(v)试剂(“clo-psi”)更优越的反应性特征。方案2展示了源自tlo-psi的试剂8a可以与负碳离子试剂平稳反应以产生硫代次膦酸9a,并且随后产生硫代次膦酸酯11a,而源自clo-psi的试剂3则没有这样的反应性。方案2
[0082]
在一方面,本公开文本提供了一种制造硫代次膦酸的方法,所述方法包括:
使负碳离子试剂与式(ia)的化合物:其盐、其对映异构体或其组合反应;其中r1是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基,其中r1任选地被一个或多个相同或不同的ra基团取代;ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;以形成硫代次膦酸。
[0083]
在一方面,上述方法中形成的硫代次膦酸由式(ii)表示:其中r1和r2中的每一个独立地是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基,其中r1和r2中的每一个任选地被一个或多个相同或不同的ra基团取代;并且ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基。
[0084]
在一方面,所述负碳离子试剂是有机锂试剂r2li,其中r2是如上文所定义的。
[0085]
在一方面,上述方法中形成的硫代次膦酸由式(iia)表示:或其对映异构体,其中r1和r2是如上文所定义的。
[0086]
在一方面,制造硫代次膦酸的方法在有机溶剂中进行。在一方面,所述有机溶剂包括但不限于醚、thf、己烷和二噁烷。
[0087]
在一方面,制造硫代次膦酸的方法在室温下进行约2至约12小时、约2至约10小时、约2至约8小时或约2至约6小时。
[0088]
在一方面,所述方法进一步包括使所述硫代次膦酸与烷基化试剂反应以形成硫代次膦酸酯。
[0089]
在一方面,所述硫代次膦酸酯由式(iii)表示:其中r1和r2中的每一个独立地是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;其中r1和r2中的每一个任选地被一个或多个相同或不同的ra基团取代;ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;并且r'是c
1-6
烷基、c
2-6
烯基或c
2-6
炔基。
[0090]
在一方面,所述硫代次膦酸酯是具有式(iiia)的化合物:或其对映异构体;其中r1和r2是如上文所定义的。
[0091]
在一方面,所述硫代次膦酸酯选自
[0092]
在一方面,所述烷基化试剂包括但不限于碘甲烷、碘乙烷和碘丙烷。
[0093]
在一方面,制造硫代次膦酸酯的方法在室温下在碱的存在下在有机溶剂中进行。在一方面,所述有机溶剂包括但不限于醚、thf、己烷和二噁烷。在一方面,所述有机溶剂是thf。在一方面,所述碱包括但不限于三乙胺、dipea、吡啶、2,6-二甲基砒啶和咪唑。
[0094]
在一方面,所述方法进一步包括使所述硫代次膦酸酯醇盐剂反应以形成有机次膦酸酯。
[0095]
在一方面,所述有机次膦酸酯具有式(iv):其中r1和r2中的每一个独立地是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;其中r1和r2中的每一个任选地被一个或多个相同或不同的ra基团取代;ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;并且r'是c
1-6
烷基、c
2-6
烯基或c
2-6
炔基。
[0096]
在一方面,所述有机次膦酸酯是具有式(iva)的化合物:或其对映异构体。
[0097]
在一方面,所述有机次膦酸酯选自
[0098]
在一方面,制造氧化膦的方法在有机溶剂中进行。在一方面,所述有机溶剂包括但
不限于醇、醚、thf、己烷和二噁烷。在一方面,所述方法在醇中进行。在一方面,所述方法在室温下进行约4小时。
[0099]
在一方面,所述方法进一步包括有机次膦酸酯与负碳离子试剂以形成氧化膦。
[0100]
在一方面,所述氧化膦是具有式(v)的化合物:其中r1、r2和r3中的每一个独立地是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;其中r1、r2和r3中的每一个任选地被一个或多个相同或不同的ra基团取代;ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基。
[0101]
在一方面,所述氧化膦是具有式(va)的化合物:或其对映异构体。
[0102]
在一方面,所述负碳离子试剂是格氏试剂(grignard reagent)r3mgbr,其中r3是上文所定义的。
[0103]
在一方面,所述格氏试剂选自
[0104]
在一方面,所述氧化膦选自
[0105]
当制备对映异构体纯的硫代次膦酸[r1r2p(o)sh]时,进行在最终置换反应期间最佳离去基团的搜索。下表5表明,硫化氯膦(条目1)对亲核攻击并不活跃,而氯氧化膦(条目2)易于反应,但得到降低的对映异构体比率(“e.r.”)。相比之下,硫代次膦酸酯(游离sh的烷基化)作为合格离去基团起作用。出乎意料地发现置换反应的e.r.增强至98:2,而当离去基团是甲氧基时,维持高的反应性。表5
[0106]
在一方面,制造氧化膦的方法在有机溶剂中进行。在一方面,所述有机溶剂包括但不限于醚、thf、己烷和二噁烷。在一方面,所述方法在thf中进行。在一方面,所述方法在-78℃下进行约2至约12小时、2至约10小时、2至约8小时、2至约6小时或2至约4小时。
[0107]
在一方面,所述方法进一步包括使所述氧化膦与还原剂反应以形成膦。
[0108]
在一方面,所述膦是具有式(vi)的化合物:其中r1、r2和r3独立地是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;其中r1、r2和r3中的每一个任选地被一个或多个相同或不同的ra基团取代;并且ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基。
[0109]
在一方面,所述膦是具有式(via)的化合物:或其对映异构体。
[0110]
在一方面,所述还原剂包括但不限于hsicl3(有或没有et3n)、具有牺牲的pph3的hsicl3、聚甲基氢硅氧烷(pmhs)和ti(oipr)4、和meotf/米尔文盐(meerwein’s salt)和nabh4。
[0111]
在一方面,制造膦的方法在有机溶剂中进行。在一方面,所述有机溶剂包括但不限于二氯甲烷、醚、thf、己烷和二噁烷。在一方面,所述方法在二氯甲烷中进行。在一方面,所述方法在50℃下进行约2至约4小时。
[0112]
上述反应条件是示例性的并且不意在限制。熟练的技术人员应认识到反应条件,
如反应时间和温度、溶剂的身份和量等,可以根据本领域已知的方法来改变。制造寡核苷酸的方法
[0113]
本公开文本提供了一种制造寡核苷酸的方法。下文方案3中描绘了合成方法。
[0114]
方案3展示了生成具有膦酸甲酯键的二核苷酸的有效工作流程。将甲基安装在试剂tlo-psi上后,使化合物12a或12b与核苷反应以得到负载核苷的有机磷化合物(r
p
)-12或(s
p
)-12。然后,将每种化合物与第二核苷偶联以得到具有高立体特异性的二核苷酸。方案3
[0115]
在上文制造二核苷酸的开发中,出乎意料地发现源自反式柠檬烯氧化物的p(v)试剂(“tlo-psi”)也具有比源自顺式柠檬烯氧化物的p(v)试剂(“clo-psi”)更优越的反应性特征。方案4显示,化合物12a可以容易地与1-金刚烷基甲醇(ad-ch
2-oh)反应以产生化合物(s
p
)-6,而化合物5则没有这样的反应性。方案4
[0116]
在一方面,本公开文本提供了一种制造负载核苷的有机磷化合物的方法,所述方
法包括使核苷与式(ia)的化合物:其盐、其对映异构体或其组合反应;其中r1是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基,其中r1任选地被一个或多个相同或不同的ra基团取代;ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;以形成负载核苷的有机磷化合物。
[0117]
在一方面,所述负载核苷的有机磷化合物是具有式(vii)或(viia)的化合物:或其非对映异构体,其中r1是c
1-6
烷基、c
2-6
烯基或c
2-6
炔基;r'是c
1-6
烷基、c
2-6
烯基或c
2-6
炔基;nu1是核苷,并且其中nu1任选地包含,彼此独立地,一个或多个相同或不同的修饰或一个或多个相同或不同的保护基团。
[0118]
在一方面,r1和r'中的每一个是-ch3。
[0119]
在一方面,nu1是选自以下的核苷
其中t是a
bz
是g
ibu
是并且cbz
是
[0120]
在一方面,制造负载核苷的有机磷化合物的方法在有机溶剂中进行。在一方面,所述有机溶剂包括但不限于醚、thf、己烷和二噁烷。
[0121]
在一方面,制造负载核苷的有机磷化合物的方法在室温下进行约2至约12小时、约2至约10小时、约2至约8小时或约2至约6小时。
[0122]
在一方面,制造负载核苷的有机磷化合物的方法在碱的存在下进行。在一方面,所述碱包括但不限于dbu、三乙胺、dipea、吡啶、2,6-二甲基砒啶和咪唑。
[0123]
在一方面,所述方法进一步包括使所述负载核苷的有机磷化合物与第二核苷反应以形成二核苷酸。
[0124]
在一方面,所述二核苷酸是具有式(viii)或(viiia)的化合物:其中r1是c
1-6
烷基、c
2-6
烯基或c
2-6
炔基;nu1和nu2中的每一个是核苷;并且其中nu1和nu2中的一个或两个任选地包含,彼此独立地,一个或多个相同或不同的修饰或一个或多个相同或不同的保护基团。
[0125]
在一方面,r1是-ch3;并且nu1和nu2中的每一个独立地是选自以下的核苷:
其中t是a
bz
是g
ibu
是并且cbz
是
[0126]
在一方面,制造二核苷酸的方法在有机溶剂中进行。在一方面,所述有机溶剂包括但不限于醚、thf、己烷和二噁烷。
[0127]
在一方面,制造二核苷酸的方法在室温下进行约2至约16小时、约2至约14小时、约2至约12小时或约2至约10小时。
[0128]
在一方面,制造二核苷酸的方法在碱的存在下进行。在一方面,所述碱包括但不限于dbu、三乙胺、dipea、吡啶、2,6-二甲基砒啶和咪唑。
[0129]
在一方面,所述方法进一步包括:a)使所述二核苷酸与式(ia)的化合物反应以形成负载的二核苷酸;b)使步骤(a)中形成的负载的二核苷酸与第三核苷反应以形成三核苷酸;c)重复步骤(a)和(b)一次或多次以形成具有所希望数量的核苷酸的寡核苷酸。
[0130]
在一方面,制造寡核苷酸的方法的步骤a)的反应条件与制造负载核苷的有机磷化合物的方法中的条件相同。在一方面,制造寡核苷酸的方法的步骤b)的反应条件与制造二核苷酸的方法中的条件相同。
[0131]
在一方面,所述二核苷酸是具有式(viii)或(viiia)的化合物:或其对映异构体;其中r1是c
1-6
烷基、c
2-6
烯基或c
2-6
炔基;nu1和nu2中的每一个是核苷;其中nu1和nu2中的一个或两个任选地包含,彼此独立地,一个或多个相同或不同的修饰或一个或多个相同或不同的保护基团。
[0132]
在一方面,用于形成二核苷酸的方法进一步包括a)使所述二核苷酸与式c的化合物:
或其对映异构体反应以形成负载的嵌合二核苷酸;以及b)使步骤(a)中形成的负载的嵌合二核苷与第三核苷反应以形成带有膦酸酯键和硫代磷酸酯键的嵌合三核苷酸。
[0133]
在一方面,用于形成嵌合三核苷酸的方法的步骤a)在有机溶剂中进行。在一方面,所述有机溶剂包括但不限于acn、醚、thf、己烷和二噁烷。
[0134]
在一方面,制造负载核苷的有机磷化合物的方法在室温下进行约2至约12小时、约2至约10小时、约2至约8小时或约2至约6小时。
[0135]
在一方面,制造负载核苷的有机磷化合物的方法在碱的存在下进行。在一方面,所述碱包括但不限于dbu、三乙胺、dipea、吡啶、2,6-二甲基砒啶和咪唑。
[0136]
上述反应条件是示例性的并且不意在限制。熟练的技术人员应认识到反应条件,如反应时间和温度、溶剂的身份和量等,可以根据本领域已知的方法来改变。制造式(ia)的化合物的方法
[0137]
在一方面,本公开文本涉及一种制造式(ia)的化合物:或其对映异构体的方法;其中r1是c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;其中r1任选地被一个或多个相同或不同的ra基团取代;ra是氘、cd3、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、卤素、cf3、c
1-6
烷氧基、c
3-10
环烷基、c
6-10
芳基或c附接的杂芳基;所述方法包括使负碳离子试剂与式a的化合物:
或其对映异构体反应以形成式(ia)的化合物。
[0138]
在一方面,所述负碳离子试剂是格氏试剂。在一方面,所述格氏试剂是r1mgbr,其中r1是上文所定义的。
[0139]
在一方面,所述格氏试剂选自
[0140]
在一方面,制造式(ia)的化合物的方法在室温下进行约2至约12小时、约2至约10小时、约2至约8小时或约2至约6小时。
[0141]
在一方面,制造式(ia)的化合物的方法在有机溶剂中进行。在一方面,所述有机溶剂包括但不限于醚、thf、己烷和二噁烷。
[0142]
上述反应条件是示例性的并且不意在限制。熟练的技术人员应认识到反应条件,如反应时间和温度、溶剂的身份和量等,可以根据本领域已知的方法来改变。定义
[0143]
除非另有说明,否则本技术(包括说明书和权利要求书)中使用的以下术语具有下面给出的定义。必须指出,如在说明书和所附权利要求书中所用,单数形式“一个/一种(a、an)”和“所述(the)”包括复数指示物,除非上下文另外清楚地规定。除非另有指示,否则使用质谱法、nmr、hplc、蛋白质化学、生物化学、重组dna技术和药理学的常规方法。在本技术中,除非另有说明,否则“或”或“和”的使用意指“和/或”。此外,术语“包括(including)”以及其他形式,如“包括(include)”、“包括(includes)”和“包括(included)”的使用是非限制
性的。
[0144]
单位、前缀和符号均以其国际单位制(si)可接受的形式表示。数值范围包括限定所述范围的数字。在列举值的范围的情况下,应理解,在列举的所述范围的上限与下限之间的每个中间整数值及其分数,以及这些值之间的每个子范围也被具体公开。任何范围的上限和下限可独立地包括在所述范围中或从所述范围中排除,并且其中任一个、两个或两个限制都不包括的每个范围也包含在本发明中。在明确列举值的情况下,应理解,与列举值大约相同数量或量的值也在本发明的范围内。在公开了组合的情况下,所述组合的要素的每个子组合也被具体公开,并且在本发明的范围内。相反,当不同的要素或要素组被单独公开时,它们的组合也被公开。当本发明的任何要素被公开为具有多个替代方案时,其中每个替代方案被单独排除或者与其他替代方案组合排除的本发明的例子也因此被公开;本发明的多于一个要素可具有此类排除,并且具有此类排除的要素的所有组合在此被公开。
[0145]
本公开文本旨在包括本发明的化合物中存在的原子的所有同位素。同位素包括原子数相同但质量数不同的那些原子。通过一般举例而非限制的方式,氢的同位素包括氘和氚。氢的同位素可以表示为1h(氢)、2h(氘)和3h(氚)。它们通常也表示为d(氘)和t(氚)。在应用中,cd3表示甲基,其中所有氢原子都是氘。碳的同位素包括
13
c和
14
c。本发明的同位素标记的化合物通常可以通过本领域技术人员已知的常规技术或通过与本文所述的那些类似的方法,使用适当的同位素标记的试剂代替以其他方式使用的未标记的试剂来制备。
[0146]
在本公开文本中,术语“立体异构体”本身是指化合物(例如,本文所述的任何式的化合物)可能具有的所有可能的不同异构形式以及构象形式,特别是基本分子结构的所有可能的立体化学和构象上的异构形式,所有非对映异构体、对映异构体和/或构象异构体。本公开文本的一些化合物可能以不同的互变异构体形式存在,所有后者都包括在本公开文本范围内。
[0147]
在本公开文本中,术语“对映异构体”意指本公开文本化合物的每种单独的光学活性形式。
[0148]
在本公开文本中,术语“非对映异构体”意指彼此并非镜像并且彼此不可重叠的立体异构体。
[0149]
在本公开文本中,术语“核酸”涵盖聚或寡核糖核苷酸(rna)和聚或寡脱氧核糖核苷酸(dna);源自核碱基和/或经修饰的核碱基的n-糖苷或c-糖苷的rna或dna;源自糖和/或经修饰的糖的核酸;和源自磷酸酯桥和/或经修饰的磷原子桥的核酸。所述术语涵盖这样的核酸,其含有核碱基、经修饰的核碱基、糖、经修饰的糖、磷酸酯桥或经修饰的磷原子桥的任何组合。例子包括并且不限于含有核糖部分的核酸、含有脱氧核糖部分的核酸、含有核糖和脱氧核糖部分二者的核酸、含有核糖和经修饰的核糖部分的核酸。前缀“聚”是指含有约1至约10,000个核苷酸单体单元的核酸,而前缀“寡”是指含有约1至约200个核苷酸单体单元的核酸。术语“核酸”也可以涵盖cdn。
[0150]
在本公开文本中,术语“核碱基”和“核苷碱基部分”可互换使用,是指参与氢键的核酸部分,所述氢键以序列特异性方式将一个核酸链与互补链结合。最常见的天然存在的核碱基是腺嘌呤(a)、鸟嘌呤(g)、尿嘧啶(u)、胞嘧啶(c)和胸腺嘧啶(t)。
[0151]
在本公开文本中,核碱基可以由缩写a、g、u、c、t、hyp表示。缩写a是指腺嘌呤;g是指鸟嘌呤;u是指尿嘧啶;c是指胞嘧啶;t是指胸腺嘧啶;hyp是指次黄嘌呤。
[0152]
在本公开文本中,术语“经修饰的核碱基”和“经修饰的核苷碱基部分”可互换使用,是指可以替代核碱基的部分。经修饰的核碱基模拟核碱基的空间排列、电子特性或一些其他物理化学特性,并且保留了以序列特异性方式将一个核酸链与另一个核酸链结合的氢键的特性。经修饰的核碱基通常可以与天然存在的碱基(例如尿嘧啶、胸腺嘧啶、腺嘌呤、胞嘧啶、鸟嘌呤)配对,而不显著地影响解链行为、被细胞内酶的识别或寡核苷酸双链体的活性。术语“经修饰的核碱基”和“经修饰的核苷碱基部分”可互换使用,进一步旨在包括可以用作核苷碱基的杂环化合物,包括在最经典的意义上不是核苷碱基但是用作核苷碱基的某些“通用碱基”。作为通用碱基,尤其提及的是3-硝基吡咯。
[0153]
在本公开文本中,术语“核苷”是指这样的化合物糖基胺,其中核碱基(含氮碱基,如腺嘌呤、鸟嘌呤、胸腺嘧啶、尿嘧啶、5-甲基尿嘧啶等)或经修饰的核碱基与五碳糖(核糖或脱氧核糖)或经修饰的糖共价结合。
[0154]
在本公开文本中,术语“糖”是指呈封闭和/或开放形式的单糖。糖包括但不限于核糖、脱氧核糖、呋喃戊糖、吡喃戊糖、吗啉寡聚核苷酸(morpholinos)、碳环类似物、吡喃己糖部分和双环糖(如锁核酸中发现的那些)。锁核酸的例子包括但不限于wo 2016/079181中公开的那些。
[0155]
在本公开文本中,术语“经修饰的糖”是指可以替代糖的部分。经修饰的糖模拟糖的空间排列、电子特性或一些其他物理化学特性。
[0156]
在本公开文本中,术语“核苷酸”是指这样的部分,其中核碱基或经修饰的核碱基与糖或经修饰的糖共价连接,并且所述糖或经修饰的糖与磷酸酯基团或经修饰的磷原子部分(如硫代磷酸酯基团)共价连接。
[0157]
在本公开文本中,术语“肽”是指通过肽键连接的氨基酸单体的链。通常,肽将具有不多于约50个氨基酸。术语“肽”涵盖天然氨基酸和非天然存在的氨基酸二者。肽可以是线性的或环状的。
[0158]
在本公开文本中,术语“蛋白质”包括以生物学功能的方式排列的一种或多种多肽。生物学功能蛋白的例子包括但不限于酶、抗体、细胞因子、激素、跨膜蛋白等。
[0159]
在本公开文本中,术语“部分”是指分子的特定区段或官能团。化学部分通常是公认的嵌入或附加到分子的化学实体。
[0160]
在本公开文本中,术语“固体支持物”或“树脂”在本文中可互换使用,是指能够进行核酸和/或肽的合成大批量生产并且可以在需要时再利用的任何支持物。如本文所述,所述术语是指在合成核酸和/或肽所进行的反应步骤中采用的介质中不溶并且进行衍生化以包含反应性基团的聚合物。
[0161]
在本公开文本中,术语“连接部分”是指在末端核苷与固体支持物之间或在末端核苷与另一个核苷、核苷酸或核酸之间的任何部分。
[0162]
在本公开文本中,当与核酸相关使用时,术语“纯化的”是指与至少一种污染物分离的核酸。如本文所用,“污染物”是使另一种不合格、不纯净或较差的任何物质。因此,纯化的寡核苷酸以一种形式或设置存在,所述形式或设置不同于在使其经受纯化方法之前所存在的形式或设置。
[0163]
在本公开文本中,如本身或作为另一个基团的一部分使用的术语“烷基”是指未经取代的直链或支链脂肪族烃,所述脂肪族烃含有一至十二个碳原子(即c
1-12
烷基)或指定的
碳原子的数量,例如,c1烷基如甲基、c2烷基如乙基、c3烷基如丙基或异丙基等。在一方面,所述烷基是c
1-10
烷基。在另一方面,所述烷基是c
1-6
烷基。在另一方面,所述烷基是c
1-4
烷基。非限制性示例性c
1-10
烷基包括甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、异丁基、3-戊基、己基、庚基、辛基、壬基和癸基。非限制性示例性c
1-6
烷基包括甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、异丁基和己基。非限制性示例性c
1-4
烷基包括甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基和异丁基。
[0164]
在本公开文本中,术语“任选经取代的烷基”是具有一个或多个ra基团的如上文定义的烷基。
[0165]
在本公开文本中,如本身或作为另一个基团的一部分使用的术语“环烷基”是指未经取代的饱和的和部分不饱和的(例如,含有一个或两个双键)、环状脂肪族烃,所述脂肪族烃含有一至三个具有从三至十二个碳原子(即c
3-12
环烷基)或指定的碳数量的环。在一方面,所述环烷基具有两个环。在一方面,所述环烷基具有一个环。在另一方面,所述环烷基是饱和的。在另一方面,所述环烷基是不饱和的。在另一方面,所述环烷基是c
3-8
环烷基。在另一方面,所述环烷基是c
3-7
环烷基。在另一方面,所述环烷基是c
5-7
环烷基。在另一方面,所述环烷基是c
3-6
环烷基。术语“环烷基”包括其中环-ch
2-被-c(=o)-替代的环。非限制性示例性环烷基包括环丙基、环丁基、环戊基、环己基、环庚基、环辛基、降冰片基、十氢化萘、金刚烷基、环己烯基、环戊烯基、环己烯基和环戊酮。
[0166]
在本公开文本中,术语“任选经取代的环烷基”是具有一个或多个ra基团的如上文所定义的环烷基。
[0167]
术语任选经取代的环烷基包括具有稠合的任选经取代的芳基(例如苯基)或稠合的任选经取代的杂芳基(例如吡啶基)的环烷基。具有稠合的任选经取代的芳基或稠合的任选经取代的杂芳基的任选经取代的环烷基可以在环烷基环上的任何可用碳原子处与分子的剩余部分附接。在一方面,所述任选经取代的环烷基是具有稠合的苯基的5、6或7元环烷基,其中所述苯基任选地被一个、两个或三个取代基取代。
[0168]
在本公开文本中,如本身或作为另一个基团的一部分使用的术语“烯基”是指含有一个、两个或三个碳碳双键的烷基。在一方面,所述烯基是c
2-6
烯基。在另一方面,所述烯基是c
2-4
烯基。非限制性示例性烯基包括乙烯基、丙烯基、异丙烯基、丁烯基、仲丁烯基、戊烯基和己烯基。
[0169]
在本公开文本中,如在本文中本身或作为另一个基团的一部分使用的术语“任选经取代的烯基”是指未经取代的或用一个或多个ra取代基取代的烯基。
[0170]
在本公开文本中,如本身或作为另一个基团的一部分使用的术语“炔基”是指含有一至三个碳碳三键的烷基。在一方面,所述炔基具有一个碳碳三键。在一方面,所述炔基是c
2-6
炔基。在另一方面,所述炔基是c
2-4
炔基。非限制性示例性炔基包括乙炔基、丙炔基、丁炔基、2-丁炔基、戊炔基和己炔基。
[0171]
在本公开文本中,如在本文中本身或作为另一个基团的一部分使用的术语“任选经取代的炔基”是指未经取代的或被一个或多个ra取代的炔基。
[0172]
在本公开文本中,如本身或作为另一个基团的一部分使用的术语“芳基”是指包含未经取代的芳族环系统的基团。在一方面,所述芳基具有具有从五至十四个碳原子的单环、双环或多环芳族环,即c
5-14
芳基、c
6-12
芳基、c
6-10
芳基或c
6-8
芳基。非限制性示例性芳基包括
苯基(缩写为“ph”)、萘基、菲基、蒽基、茚基、薁基、联苯基、联苯烯基和芴基。在一方面,所述芳基是苯基或萘基。在一方面,所述芳基包括其中芳族环与金属原子结合的有机金属基团。非限制性示例性芳基包括二茂铁和二茂钴。附接的基团或点是在芳族环上。
[0173]
在本公开文本中,如在本文中本身或作为另一个基团的一部分使用的术语“任选经取代的芳基”是指未经取代的乎用一个或多个ra取代基取代的芳基。
[0174]
在一方面,所述任选经取代的芳基是任选经取代的苯基。在一方面,所述任选经取代的苯基具有四个取代基。在另一方面,所述任选经取代的苯基具有三个取代基。在另一方面,所述任选经取代的苯基具有两个取代基。在另一方面,所述任选经取代的苯基具有一个取代基。非限制性示例性经取代的芳基包括2-甲基苯基、2-甲氧基苯基、2-氟苯基、2-氯苯基、2-溴苯基、3-甲基苯基、3-甲氧基苯基、3-氟苯基、3-氯苯基、4-甲基苯基、4-乙基苯基、4-甲氧基苯基、4-氟苯基、4-氯苯基、2,6-二-氟苯基、2,6-二-氯苯基、2-甲基、3-甲氧基苯基、2-乙基、3-甲氧基苯基、3,4-二-甲氧基苯基、3,5-二-氟苯基、3,5-二-甲基苯基、3,5-二甲氧基、4-甲基苯基、2-氟-3-氯苯基和3-氯-4-氟苯基。术语任选经取代的芳基包括具有稠合的任选经取代的环烷基和稠合的任选经取代的杂环的苯基。具有稠合的任选经取代的环烷基和稠合的任选经取代的杂环的任选经取代的芳基在芳环上的任何可用碳原子处与分子的剩余部分附接。非限制性例子包括:
[0175]
在本公开文本中,如本身或作为另一个基团的一部分使用的术语“芳氧基”是指与末端氧原子附接的任选经取代的芳基。非限制性示例性芳氧基是pho-。
[0176]
在本公开文本中,术语“杂环”、“杂环基”或“杂环基团”旨在意指稳定的3、4、5、6、或7元单环或双环或7、8、9、10、11、12、13、或14元多环杂环,所述多环杂环是饱和的、部分不饱和的或完全不饱和的并且含有碳原子和1、2、3或4个独立地选自n、o和s的杂原子;并且包括任何多环基团,其中任何上文所定义的杂环与苯环稠合。氮和硫杂原子可以任选被氧化(即,n
→
o和s(o)p,其中p是0、1或2)。氮原子可以是经取代的或未经取代的(即,n或nr,其中r是h或另一个取代基,如果定义的话)。杂环可以在导致稳定结构的任何杂原子或碳原子上附接至其侧基。如果所得的化合物是稳定的,则本文所述的杂环可以在碳上或在氮原子上被取代。杂环中的氮可以任选地被季铵化。优选的是,当杂环中的s和o原子的总数超过1时,则这些杂原子彼此不相邻。优选的是,杂环中s和o原子的总数不多于1。当使用术语“杂环”时,它旨在包括杂芳基。
[0177]
杂环的例子包括但不限于吖啶基、氮杂环丁烷基、吖辛因基、苯并咪唑基、苯并呋喃基、苯并硫代呋喃基、苯并噻吩基、苯并噁唑基、苯并噁唑啉基、苯并噻唑基、苯并三唑基、苯并四唑基、苯并异噁唑基、苯并异噻唑基、苯并咪唑烷基、咔唑基、4ah-咔唑基、咔啉基、色满基、色烯基、噌啉基、十氢喹啉基、2h,6h-1,5,2-二噻嗪基、二氢呋喃并[2,3-b]四氢呋喃、呋喃基、呋咱基、咪唑烷基、咪唑啉基、咪唑基、1h-吲唑基、咪唑并吡啶基、吲哚烯基、吲哚啉基、吲嗪基、吲哚基、3h-吲哚基、靛红酰基(isatinoyl)、异苯并呋喃基、异色满基、异吲唑
基、异吲哚啉基、异吲哚基、异喹啉基、异噻唑基、异噻唑并吡啶基、异噁唑基、异噁唑并吡啶基、亚甲基二氧苯基、吗啉基、萘啶基、八氢异喹啉基、噁二唑基、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、噁唑烷基、噁唑基、噁唑并吡啶基、噁唑烷基呸啶(oxazolidinylperimidinyl)、氧化吲哚基、嘧啶基、菲啶基、菲咯啉基、吩嗪基、吩噻嗪基、吩噁噻基(phenoxathianyl)、吩噁嗪基、酞嗪基、哌嗪基、哌啶基、哌啶酮基、4-哌啶酮基、胡椒基、蝶啶基、嘌呤基、吡喃基、吡嗪基、吡唑烷基、吡唑啉基、吡唑基吡啶基、吡唑基、哒嗪基、吡啶并噁唑基、吡啶并咪唑基、吡啶并噻唑基、吡啶基、嘧啶基、吡咯烷基、吡咯啉基、2-吡咯烷酮基、2h-吡咯基、吡咯基、喹唑啉基、喹啉基、4h-喹嗪基、喹喔啉基、奎宁环基、四唑基、四氢呋喃基、四氢异喹啉基、四氢喹啉基、6h-1,2,5-噻二嗪基、1,2,3-噻二唑基、1,2,4-噻二唑基、1,2,5-噻二唑基、1,3,4-噻二唑基、噻蒽基、噻唑基、噻吩基、噻唑并吡啶基、噻吩并噻唑基、噻吩并噁唑基、噻吩并咪唑基、噻吩基、三嗪基、1,2,3-三唑基、1,2,4-三唑基、1,2,5-三唑基、1,3,4-三唑基、和呫吨基。还包括稠环和螺化合物,其含有例如以上杂环。
[0178]
如本文所用,术语“二环杂环”或“二环杂环基团”旨在意指稳定的9元或10元杂环的环系统,其含有两个稠环并且由碳原子和1个、2个、3个或4个独立地选自n、o和s的杂原子组成。在两个稠环中,一个环是5元或6元单环的芳香族环,包含5元杂芳基环、6元杂芳基环或苯并环,每个与第二环稠合。第二个环是5或6元单环的环,所述单环的环是饱和的、部分不饱和的或不饱和的并且包括5元杂环、6元杂环或碳环(条件是当第二个环是碳环时,第一个环不是苯)。
[0179]
双环杂环基团可以在任何杂原子或碳原子上与其侧基附接,这产生稳定的结构。如果所得的化合物是稳定的,则本文所述的双环杂环基团可以在碳上或在氮原子上被取代。优选的是,当杂环中的s和o原子的总数超过1时,则这些杂原子彼此不相邻。优选的是,杂环中s和o原子的总数不多于1。
[0180]
双环杂环基团的例子是但不限于喹啉基、异喹啉基、酞嗪基、喹唑啉基、吲哚基、异吲哚基、吲哚啉基、1h-吲唑基、苯并咪唑基、1,2,3,4-四氢喹啉基、1,2,3,4-四氢异喹啉基、5,6,7,8-四氢-喹啉基、2,3-二氢-苯并呋喃基、色满基、1,2,3,4-四氢-喹喔啉基、和1,2,3,4-四氢-喹唑啉基。
[0181]
桥环也包括在杂环的定义中。当一个或多个、优选一至三个原子(即,c、o、n、或s)连接两个不相邻的碳或氮原子时,桥环出现。桥环的例子包括但不限于一个碳原子、两个碳原子、一个氮原子、两个氮原子、和碳-氮基团。注意,桥总是将单环转化为三环。当环是桥接的时,针对所述环所列举的取代基也可以存在于桥上。
[0182]
术语“杂环烷基”是指与连接到化合物核心的烷基键合的杂环基或经取代的杂环基。
[0183]
如本文所用,术语“芳族杂环基团”或“杂芳基”旨在意指稳定的单环和多环芳族烃,所述烃包含至少一个杂原子环成员,如硫、氧或氮。杂芳基包括但不限于吡啶基、嘧啶基、吡嗪基、哒嗪基、三嗪基、呋喃基、喹啉基、异喹啉基、噻吩基、咪唑基、噻唑基、吲哚基、吡咯基、噁唑基、苯并呋喃基、苯并噻吩基、苯并噻唑基、异噁唑基、吡唑基、三唑基、四唑基、吲唑基、1,2,4-噻二唑基、异噻唑基、嘌呤基、咔唑基、苯并咪唑基、吲哚啉基、苯并二氧戊环基、和苯并二噁烷。杂芳基是经取代的或未经取代的。氮原子是经取代的或未经取代的(即,
n或nr,其中r是h或另一个取代基,如果定义的话)。氮和硫杂原子可以任选被氧化(即,n
→
o和s(o)p,其中p是0、1或2)。
[0184]
在一方面,术语“杂芳基”或“杂芳族的”是指具有5至14个环原子的未经取代的单环和双环芳族环系统,即5至14元的杂芳基,其中一个环的至少一个碳原子被独立地选自氧、氮和硫的杂原子替代。在一方面,杂芳基含有1、2、3或4个独立地选自氧、氮和硫的杂原子。在一方面,所述杂芳基具有三个杂原子。在另一方面,所述杂芳基具有两个杂原子。在另一方面,所述杂芳基具有一个杂原子。在另一方面,所述杂芳基是5至10元杂芳基。在另一方面,所述杂芳基是5或6元杂芳基。在另一方面,所述杂芳基具有5个环原子,例如噻吩基,具有四个碳原子和一个硫原子的5元杂芳基。在另一方面,所述杂芳基具有6个环原子,例如吡啶基,具有五个碳原子和一个氮原子的6元杂芳基。非限制性示例性杂芳基包括噻吩基、苯并[b]噻吩基、萘并[2,3-b]噻吩基、噻蒽基、呋喃基、苯并呋喃基、吡喃基、异苯并呋喃基、苯并噁嗪酮基(benzooxazonyl)、色烯基、吨基、2h-吡咯基、吡咯基、咪唑基、吡唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、异吲哚基、3h-吲哚基、吲哚基、吲唑基、嘌呤基、异喹啉基、喹啉基、酞嗪基、萘啶基、噌啉基、喹唑啉基、蝶啶基、4ah-咔唑基、咔唑基、β-咔啉基、菲啶基、吖啶基、嘧啶基、菲咯啉基、吩嗪基、噻唑基、异噻唑基、苯并噻唑基、异噁唑基、呋咱基和吩噁嗪基。在一方面,所述杂芳基是噻吩基(例如,噻吩-2-基和噻吩-3-基)、呋喃基(例如,2-呋喃基和3-呋喃基)、吡咯基(例如,1h-吡咯-2-基和1h-吡咯-3-基)、咪唑基(例如,2h-咪唑-2-基和2h-咪唑-4-基)、吡唑基(例如,1h-吡唑-3-基、1h-吡唑-4-基和1h-吡唑-5-基)、吡啶基(例如,吡啶-2-基、吡啶-3-基和吡啶-4-基)、嘧啶基(例如,嘧啶-2-基、嘧啶-4-基和嘧啶-5-基)、噻唑基(例如,噻唑-2-基、噻唑-4-基和噻唑-5-基)、异噻唑基(例如,异噻唑-3-基、异噻唑-4-基和异噻唑-5-基)、噁唑基(例如,噁唑-2-基、噁唑-4-基和噁唑-5-基)、异噁唑基(例如,异噁唑-3-基、异噁唑-4-基和异噁唑-5-基)或吲唑基(例如,1h-吲唑-3-基)。术语“杂芳基”还包括可能的n-氧化物。非限制性示例性n-氧化物是吡啶基n-氧化物。
[0185]
在一方面,所述杂芳基是5或6元杂芳基。在一方面,所述杂芳基是5元杂芳基,即所述杂芳基是具有5个环原子的单环芳族环系统,其中环的至少一个碳原子被独立地选自氮、氧和硫的杂原子替代。非限制性示例性5元杂芳基包括噻吩基、呋喃基、吡咯基、噁唑基、吡唑基、咪唑基、噻唑基、异噻唑基和异噁唑基。
[0186]
在另一方面,所述杂芳基是6元杂芳基,例如所述杂芳基是具有6个环原子的单环芳族环系统,其中环的至少一个碳原子被氮原子替代。非限制性示例性6元杂芳基包括吡啶基、吡嗪基、嘧啶基和哒嗪基。
[0187]
在一方面,杂芳基的附接基团或点在芳族环上,所述基团或点可以是碳原子或杂原子。
[0188]
在本公开文本中,如本身或作为另一个基团的一部分使用的术语“c附接的杂芳基”或“碳附接的杂芳基”是指其中在杂芳环的任何可用碳原子处与分子的剩余部分附接的杂芳基。
[0189]
在本公开文本中,如本身或作为另一个基团的一部分使用的术语“任选经取代的杂芳基”是指未经取代的或被一至四个独立地选自以下的取代基(例如一个或两个取代基)取代的杂芳基:卤代、硝基、氰基、羟基、氨基、烷基氨基、二烷基氨基、卤代烷基、羟基烷基、烷氧基、卤代烷氧基、芳氧基、芳烷氧基、烷硫基、甲酰胺基、磺酰胺基、烷基羰基、芳基羰基、
烷基磺酰基、芳基磺酰基、羧基、羧基烷基、任选经取代的烷基、任选经取代的环烷基、烯基、炔基、芳基、杂芳基、杂环、(烷氧基)烷基、(氨基)烷基、(甲酰胺基)烷基、巯基烷基和(杂环)烷基。在一方面,所述任选经取代的杂芳基具有一个取代基。任何可用的碳或氮原子都可以被取代。非限制性示例性经取代的杂芳基包括但不限于:
[0190]
术语“任选经取代的杂芳基”包括具有稠合的任选经取代的环烷基或稠合的任选经取代的杂环基团的杂芳基。具有稠合的任选经取代的环烷基或稠和的任选经取代的杂环的任选经取代的杂芳基可以在杂芳环的任何可用碳原子处与分子的剩余部分附接。非限制性例子包括:
[0191]
在本公开文本中,术语“卤素”旨在包括氟、氯、溴和碘。
[0192]
在本公开文本中,术语“核苷间键”是指在寡核苷酸或cdn中的两个相邻核苷之间的天然存在的或经修饰的键。天然存在的rna和dna含有磷酸二酯核苷间键。经修饰的核苷间键的例子是硫代磷酸酯键。
[0193]
在本公开文本中,术语“嵌合核酸”或“嵌合序列”是指具有不同核苷间键的核酸。在一方面,所述嵌合核酸具有硫代磷酸酯键和膦酸酯键的组合。
[0194]
在本公开文本中,术语“杂手性核酸”是指包含含有呈不同立体化学构型的磷原子的核苷间键的核酸。通过类比,术语“同手性核酸”是指包含含有呈相同立体化学构型的磷原子的核苷间键的核酸。
[0195]
在本公开文本中,术语“保护基团”是指保护官能团(如醇、胺、羰基、羧酸、磷酸酯、末端炔等)免于不希望的化学反应的基团。在一些方面,所述官能团是亲核试剂。醇保护基团的例子包括但不限于乙酰基(ac)、苯甲酰基(bz)、苄基(bn)、β-甲氧基乙氧基甲基醚(mem)、二甲氧基三苯甲基(dmt)、甲氧基甲基醚(mom)、甲氧基三苯甲基(mmt)、对甲氧基苄基醚(pmb)、三甲基甲硅烷基(tms)、叔丁基二甲基甲硅烷基(tbs)、叔丁基二苯基甲硅烷基醚(tbdps)、三-异-丙基甲硅烷基氧基甲基(tom)、三苯甲基(三苯基甲基,tr)、新戊酰基(piv)等。在一方面,所述保护基团是所述保护基团是4,4'-二甲氧基三苯甲基。胺保护基团的例子包括但不限于苄氧羰基(cbz)、异丁酰基(ibu)、对甲氧基苄基羰基(moz)、叔丁基羰基(boc)、乙酰基(ac)、苯甲酰基(bz)、苄基(bn)、对甲氧基苄基(pmb)、对甲氧基苯基(pmp)、甲苯磺酰基(ts)等。羰基保护基团的例子包括但不限于缩醛和缩酮、酰基缩醛、二噻烷等。羧酸保护基团的例子包括但不限于甲酯、苄酯、叔丁酯、甲硅烷酯、原酸酯、噁唑啉等。磷酸酯保护基团的例子包括但不限于2-氰基乙基、甲基等。末端炔保护基团的例子包括但不限于炔丙基和甲硅烷基。在一方面,保护基团用于保护本公开文本的方法中使用的核苷的5'-羟基。在一方面,所述保护基团是dmt。在另一方面,保护基团用于保护本公开文本的方法中
使用的核苷的核碱基。在一些方面,所述保护基团是胺保护基团。在一方面,所述保护基团是ac。在另一方面,所述保护基团是bz。在又另一方面,所述保护基团是ibu。实施例
[0196]
以下实施例中提供了本公开文本的化合物/试剂和方法的有用的实施方案。应该理解,实施例仅以说明的方式给出。通用实验
[0197]
四氢呋喃(thf)、n,n-二甲基甲酰胺(dmf)、二氯甲烷(dcm)、乙腈(mecn)和甲醇(meoh)是通过使先前脱气的溶剂通过活化铝柱获得的。dbu购自chem-impex。所有的携带常规核碱基保护的5
’‑
dmtr保护的核苷(t=无,a=苯甲酰基、g=异丁酰基、c=苯甲酰基)购自chem-impex。除非另有说明,否则所有试剂均以最高商业质量购买并且不经进一步纯化使用。除非另有说明,否则产率是指色谱和波谱(1h nmr)上均匀的材料。通过薄层色谱法(tlc)、gc/ms、gc/fid或lc/ms监测反应。使用0.25mm e.merck二氧化硅板(60f-254),使用短波紫外线作为可视化剂,以及磷酸二酸、对甲氧基苯甲醛或kmno4和热作为显色剂进行tlc。在bruker drx-600、drx-500和amx-400仪器上记录nmr波谱,并且使用残余非氘代溶剂(对于1h nmr分别以7.26、5.32、2.50、3.31和2.05ppm,并且对于
13
c nmr分别以77.16、53.84、39.52、49.00和29.84ppm的chcl3、ch2cl2、dmso、meoh、丙酮)校准。以下缩写用于解释多重性:s=单重态,d=双重态,t=三重态,q=四重态,m=多重态,br=宽。使用e.merck硅胶(60,粒度0.043-0.063mm)进行柱色谱法,并且在merck二氧化硅板(60f-254)上进行制备型tlc(ptlc)。通过电喷雾电离飞行时间反射量实验在agilent lc/msd tof质谱仪上记录高分辨率质谱(hrm)。在fisher-johns 12-144熔点设备上记录熔点,并且是未校正的。用配备有光电二极管阵列检测器的waters upc2 sfc或agilent technologies 1220infinity ii lc hplc确定对映异构体比率。在anton paar 100模块化旋光仪上记录旋光数据。实施例1pi试剂的合成a.si-1和si-2的合成
[0198]
根据公开的程序合成化合物si-1和si-2(两种对映异构体)。参见knouse等人,unlocking p(v):reagents for chiral phosphorothioate synthesis,science 2018,361,1234。
b.(-)-π(1a)的合成:
[0199]
(-)-π的合成遵循与前述报道的ψ试剂的合成类似的程序,其中可以找到详细的图示指导。参见knouse等人,unlocking p(v):reagents for chiral phosphorothioate synthesis,science 2018,361,1234。向si-1(1.00g,1.68mmol,1.0当量)和反式-( )-柠檬烯氧化物si-2(0.383g,2.52mmol,1.5当量)在二氯甲烷(5.0ml)的溶液中添加三氟乙酸(0.19ml,2.52mmol,1.5当量)。将反应温热至35℃并且允许搅拌1小时。将反应混合物冷却至环境温度,并且将己烷(10ml)添加到批料中以形成双相混合物。将流用水(5ml)、饱和nahco3(10ml)和kh2po4(10%水溶液,3ml)洗涤。将有机相通过mgso4垫过滤并且浓缩至约3ml。添加甲醇(5ml),将批料浓缩至约3ml;将此程序重复两次。将混合物冷却至5℃-10℃并且搅拌5min。将所得浆料过滤并且将反应器和饼用冷甲醇(1ml)洗涤。将滤饼在真空中干燥以得到呈结晶性白色固体的1a[(-)-π](0.56g,75%产率,》20:1d.r.,》98:2e.r.)。物理状态:白色结晶固体;m.p.=104℃-106℃;[α]
25d
=-125
°
(在chcl3中c=1.00);rf=0.50(己烷:甲苯=1:1)。1h nmr(600mhz,cdcl3)δ4.96(s,1h),4.70(d,j=2.1hz,1h),2.90(dd,j=13.4,2.9hz,1h),2.42(s,1h),2.10(ddp,j=13.7,6.4,2.2hz,2h),2.02(ddd,j=12.5,4.3,2.7hz,1h),1.77
–
1.66(m,2h),1.65(s,3h),1.64(s,3h),1.52(td,j=13.3,4.2hz,1h)。
13
c nmr(151mhz,cdcl3)δ148.86,147.19,144.69,144.02,142.28,138.75,137.05,111.83,104.30,93.64,93.60,58.65,58.64,38.81,34.21,34.13,28.39,28.32,24.89,22.18,18.74。
19
f nmr(376mhz,cdcl3)δ-128.54(dd,j=20.7,4.6hz,2f),-146.87(ddd,j=25.5,14.7,6.0hz,1f),-159.16
–‑
160.51(m,2f)。
31
p nmr(162mhz,cdcl3)δ102.08。hrms(esi-tof):针对c
16h17
f5ops3的计算值[m h] :447.0094,实测值:447.0093。c.( )-π(1b)的合成:
[0200]
1b的合成遵循针对1a概述的相同程序。所有特征数据均相同,旋光度[α]
25d
= 124
°
(在chcl3中c=1.00)除外。实施例2负载金刚烷基甲醇的硫代膦酸酯的合成
[0201]
向在氩气下火焰干燥的培养管中装入1-金刚烷甲醇(16.6mg,0.1mmol,1.0当量)、12a(52.5mg,0.2mmol,2.0当量)和mecn(1ml)。添加dbu(0.05ml,3.0mmol,3.0当量)并且将所得溶液在室温下搅拌4h。添加2ml的1x pbs溶液,并且将混合物用dcm(3x3ml)萃取。将合并的有机物用盐水(1ml)洗涤,经na2so4干燥,过滤并且浓缩。将所得的粗油状物溶解于thf(1ml)中。添加et3n(2当量)和bnbr(2当量),并且将所得混合物搅拌12h。将反应用1ml水淬灭并且用etoac(3x 3ml)萃取。将合并的有机物经na2so4干燥,过滤并且浓缩。通过硅胶色谱法(己烷/etoac=5:2)纯化得到24.0mg(69%)标题化合物si-3。物理状态:无色油状物;rf=0.40(己烷/etoac=5:2)。1h nmr(400mhz,cdcl3)δ7.41
–
7.22(m,5h),4.14
–
3.97(m,2h),3.65(dd,j=9.6,6.5hz,1h),3.46(dd,j=9.7,6.8hz,1h),1.98(s,3h),1.77
–
1.57(m,9h),1.50(d,j=2.9hz,6h)。
13
c nmr(151mhz,cdcl3)δ138.13,138.11,129.05,128.82,127.64,74.81,74.76,39.02,37.03,34.68,34.65,33.68,33.63,28.10,20.35,19.62。
31
p nmr(162mhz,cdcl3)δ53.64。hrms(esi-tof):针对c
19h28
o2ps的计算值[m h] :351.1548,实测值:351.1546。实施例3格氏试剂和有机锂试剂的合成a.格氏试剂的合成
[0202]
所有格氏试剂均是在licl的存在下经由mg插入从芳基溴化物制备的,或购自商业来源。1.mg插入的通用程序:
[0203]
将licl(0.530g,12.5mmol,1.25当量)在真空下火焰干燥。冷却后,将烧瓶放置在ar气氛下,并且添加mg屑(0.608g,25mmol,2.5当量)、碘(几粒)和thf(2ml)。在ar气氛下的
单独烧瓶中,制备芳基溴化物(10mmol,1.0当量)在thf(8ml)中的溶液。将在thf中的几滴芳基溴化物溶液添加到含mg的烧瓶中,并且将混合物用热风枪轻轻加热直到溶液颜色从棕色变为无色。然后缓慢添加剩余的芳基溴化物溶液。添加完成后,将混合物置于油浴(55℃)中并且加热1-2h。针对碘/licl滴定格氏试剂,然后根据knochel公开的程序使用。
[0204]
使用上述程序合成以下格氏试剂:
[0205]
以下格氏试剂直接购自sigma-aldrich:b.格氏试剂的合成
[0206]
除非另有说明,否则所有有机锂试剂都是经由末端炔的直接脱保护通过芳基溴化物的锂-卤素交换新鲜制备的,或购自商业来源。根据公开的程序制备fcli。参见han,z.s.等人,efficient asymmetric synthesis of p-chiral phosphine oxides via properly designed and activated benzoxazaphosphinine-2-oxide agents.j.am.chem.soc.2013,135,2474-2477。1.锂-卤素交换的通用程序:
[0207]
向在氩气气氛下的火焰干燥的圆底烧瓶中装入芳基溴化物(11mmol,1.1当量)和thf(40ml)。将混合物冷却至-78℃并且逐滴添加nbuli溶液(10mmol,1.0当量)。允许将所得混合物在-78℃下搅拌30min并且直接使用。
[0208]
使用上述方法合成以下有机锂试剂:
[0209]
末端炔的直接脱保护遵循与锂-卤素交换相同的程序。通过直接脱保护合成以下有机锂试剂:2.fcli的合成:
[0210]
向在氩气气氛下的火焰干燥的圆底烧瓶中装入二茂铁(186mg,1mmol,1.0当量)、
t
buok(0.15ml,1.0m,0.15mmol,0.15当量)和thf(8ml)。将反应冷却至-78℃并且逐滴添加
t
buli(1.18ml,1.7m,2mmol,2.0当量)。允许将所得混合物在-78℃下搅拌1h,达到0℃持续30min,并且然后直接使用。
[0211]
以下有机锂试剂购自sigma-aldrich:实施例4p-手性膦的合成a.负载1.通用程序a
[0212]
向火焰干燥的250ml圆底烧瓶中装入1(4.46g,10mmol,1当量)。将烧瓶排空并且回填氩气,此后经由注射筒引入无水thf(100ml,0.1m)。然后逐滴添加格氏试剂(20mmol,2当量),并且允许将所得溶液在室温下搅拌直到
31
p nmr显示起始材料完全消耗。将反应用缓慢添加饱和nh4cl水溶液(20ml)淬灭,并且用水(80ml)和etoac(150ml)稀释。将两层分离,并且将水层用etoac(2x 80ml)洗涤两次。将合并的有机层用饱和nahco3水溶液(50ml)、盐水(50ml)洗涤,并且经无水na2so4干燥。然后将混合物过滤,在真空中浓缩,并且通过硅胶色谱法纯化以得到所希望的产物。2.化合物8a:
[0213]
根据通用程序a,以10mmol的规模用1a和格氏试剂si-10。反应时间2h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:2)纯化得到1.93g(60%,》20:1d.r.)标题化合物8a。以50mmol
的规模,纯化后获得9.20g(57%,》20:1d.r.)8a。物理状态:白色固体;m.p.=108℃-110℃;[α]
25d
=-27.3
°
(在chcl3中c=1.00);rf=0.35(己烷/甲苯=1:2)。1h nmr(400mhz,cdcl3)δ7.87(ddd,j=15.2,8.1,1.5hz,2h),7.56
–
7.40(m,3h),4.98(s,1h),4.89(s,1h),3.86(dd,j=13.2,3.1hz,1h),2.50(s,1h),2.26
–
2.09(m,3h),2.08
–
1.84(m,2h),1.83(s,3h),1.73(s,3h)。
13
c nmr(126mhz,cdcl3)δ145.45,138.93,138.02,132.21,132.19,130.30,130.20,128.70,128.58,111.94,92.62,92.59,57.25,57.24,39.00,34.91,34.82,29.05,28.98,25.36,22.83,19.33。
31
p nmr(162mhz,cdcl3)δ97.21。hrms(esi-tof):针对c
16h22
ops2的计算值[m h] :325.0850,实测值:325.0849。3.化合物8b:
[0214]
根据通用程序a,以10mmol的规模用1b和格氏试剂si-10。反应时间2h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:2)纯化得到2.11g(65%,》20:1d.r.)标题化合物8b。所有物理和光谱特性均与8a相同,旋光度:[α]
25d
= 31.6
°
(在chcl3中c=1.00)除外。4.化合物12a:
[0215]
根据通用程序a,以10mmol的规模用1a和格氏试剂si-11。反应时间2h。通过硅胶柱色谱法(己烷/甲苯/etoac=1:1:0至1:2:0至1:2:0.05)纯化得到1.73g(66%,》20:1d.r.)标题化合物12a。物理状态:白色固体;m.p.=102℃-105℃;[α]
25d
= 136.4
°
(在chcl3中c=0.50);rf=0.20(己烷/甲苯=1:2)。1h nmr(400mhz,cdcl3)δ5.01(s,1h),4.89(s,1h),3.74(dd,j=13.3,3.1hz,1h),2.48(s,1h),2.23(d,j=13.8hz,1h),2.20(s,3h),2.17(d,j=0.8hz,3h),2.11(d,j=11.2hz,1h),2.06
–
2.00(m,1h),1.80(d,j=8.1hz,3h),1.76(s,3h),1.68(s,3h)。
13
c nmr(151mhz,cdcl3)δ145.25,112.07,92.26,92.23,56.99,56.97,38.93,35.16,35.08,31.27,30.74,28.99,28.93,25.21,22.78,18.85。
31
p nmr(162mhz,cdcl3)δ106.19。hrms(esi-tof):针对c
11h20
ops2的计算值[m h] :263.0693,实测值:263.0697。5.化合物12b:
[0216]
根据通用程序a,以5mmol的规模用1b和格氏试剂si-11。反应时间2h。通过硅胶柱色谱法(己烷/甲苯/etoac=1:1:0至1:2:0至1:2:0.05)纯化得到923mg(70%,》20:1d.r.)标题化合物12b。以25mmol的规模,纯化后获得3.41g(52%,》20:1d.r.)的12b。所有物理和光谱特性均与8a相同,[α]
25d
=-130.2
°
(在chcl3中c=0.50)除外。6.化合物13a:
[0217]
根据通用程序a,以0.5mmol的规模用1a和格氏试剂si-5。反应时间12h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:2)纯化得到60mg(33%,》20:1d.r.)标题化合物13a。物理状态:无色凝胶;[α]
25d
=-25.0
°
(在chcl3中c=0.70);rf=0.41(己烷/etoac=92:8)。1h nmr(400mhz,cdcl3)δ7.51(dd,j=15.2,1.8hz,1h),7.23
–
7.09(m,2h),4.85(d,j=1.4hz,1h),4.78(s,1h),3.55(ddd,j=13.3,3.2,1.6hz,1h),2.70(s,3h),2.44(t,j=5.3hz,1h),2.33(s,3h),2.23
–
2.06(m,3h),2.02
–
1.81(m,3h),1.79(s,3h),1.66(s,3h)。
13
c nmr(151mhz,cdcl3)δ145.29,137.41,136.73,136.68,136.63,135.04,134.95,132.36,132.34,132.29,132.19,129.44,129.38,111.88,92.48,92.44,77.37,77.16,77.08,76.95,56.19,56.17,38.89,34.78,34.71,28.96,28.89,25.35,22.78,21.56,21.53,21.13,19.69。
31
p nmr(162mhz,cdcl3)δ94.99。hrms(esi-tof):针对c
18h26
ops2的计算值[m h] :353.1163,实测值:353.1168。7.化合物13b:
[0218]
根据通用程序a,以0.5mmol的规模用1b和格氏试剂si-5。反应时间12h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:2)纯化得到58mg(32%,》20:1d.r.)标题化合物13b。所有物理和光谱特性均与13a相同,旋光度:[α]
25d
= 31
°
(在chcl3中c=0.60)除外。8.化合物14a:
[0219]
根据通用程序a,以1mmol的规模用1a和格氏试剂si-6。反应时间12h。通过硅胶柱
色谱法(己烷/甲苯=2:1至1:2)纯化得到292mg(77%,》20:1d.r.)标题化合物14a。物理状态:浅黄色固体;m.p.=114℃-116℃;[α]
25d
=-121.8
°
(在chcl3中c=1.00);rf=0.24(己烷/et2o=9:1)。1h nmr(500mhz,cdcl3)δ8.84(dd,j=8.4,0.9hz,1h),8.03
–
7.83(m,3h),7.65(ddd,j=8.5,6.9,1.4hz,1h),7.56(ddd,j=8.1,6.9,1.2hz,1h),7.47(ddd,j=8.1,7.3,3.6hz,1h),4.80(d,j=1.4hz,1h),4.73(s,1h),3.57(ddd,j=13.3,3.2,1.6hz,1h),2.44(d,j=6.0hz,1h),2.22(ddd,j=12.4,4.4,2.8hz,1h),2.16
–
2.08(m,2h),2.02
–
1.78(m,3h),1.86(s,3h),1.62(d,j=1.3hz,3h)。
13
c nmr(151mhz,cdcl3)δ163.86,163.74,159.73,159.72,145.52,145.34,145.15,136.41,136.32,134.58,133.59,131.03,130.99,129.45,129.43,129.17,129.08,128.80,127.79,114.09,114.07,114.03,97.12,87.93,87.76,87.69,86.90,86.86,85.92,85.89,75.87,75.84,72.60,65.22,65.18,63.37,55.55,42.11,40.79,40.77,26.16,18.50,12.25,11.30,-4.52,-4.65。
31
p nmr(162mhz,cdcl3)δ92.77。hrms(esi-tof):针对c
20h24
ops2的计算值[m h] :375.1006,实测值:375.1006。9.化合物14b:
[0220]
根据通用程序a,以0.5mmol的规模用1b和格氏试剂si-6。反应时间12h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:2)纯化得到152mg(80%,》20:1d.r.)标题化合物14b。所有物理和光谱特性均与14a相同,旋光度:[α]
25d
= 125.1
°
(在dcm中c=0.35)除外。10.化合物15a:
[0221]
根据通用程序a,以0.5mmol的规模用1a和格氏试剂si-4。反应时间12h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:2)纯化得到74mg(37%,》20:1d.r.)标题化合物15a。物理状态:浅黄色凝胶[α]
25d
=-83.8
°
(在dcm中c=0.22)rf=0.31(己烷/et2o=9:1)1h nmr(400mhz,cdcl3)δ7.44(dd,j=7.6,1.4hz,1h),7.40
–
7.27(m,8h),4.95(d,j=1.4hz,1h),4.89
–
4.82(m,1h),3.74(ddd,j=13.3,3.2,1.6hz,1h),2.50(s,1h),2.25
–
2.10(m,3h),1.97
–
1.77(m,3h),1.75(s,3h),1.74
–
1.71(m,3h)。
13
c nmr(151mhz,cdcl3)δ145.07,143.68,140.20,131.89,131.05,129.01,128.55,128.41,128.25,127.68,112.31,93.62,93.59,56.99,56.97,38.84,34.76,34.68,
28.76,28.69,25.31,22.78,19.60。
31
p nmr(162mhz,cdcl3)δ77.83。hrms(esi-tof):针对c
22h26
ops2的计算值[m h] :401.1163,实测值:401.1157。11.化合物15b:
[0222]
根据通用程序a,以4mmol的规模用1b和格氏试剂si-4。反应时间2h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:2)纯化得到882mg(55%,》20:1d.r.)标题化合物15b。所有物理和光谱特性均与15a相同,旋光度:[α]
25d
= 95.7
°
(在chcl3中c=1.00)除外。12.化合物16a:
[0223]
根据通用程序a,以0.5mmol的规模用1a和格氏试剂si-7。反应时间12h。通过硅胶柱色谱法(己烷/甲苯=2:1)纯化得到126mg(68%,》20:1d.r.)标题化合物16a。物理状态:浅黄色凝胶[α]
25d
=-48.8
°
(在chcl3中c=0.50)rf=0.2(己烷/甲苯=2:1)1h nmr(400mhz,cdcl3)δ8.41(d,j=17.9hz,1h),7.95
–
7.81(m,4h),7.63
–
7.53(m,2h),4.99(d,j=1.4hz,1h),4.92(s,1h),3.95(dd,j=13.3,3.1hz,1h),2.51(s,1h),2.26
–
2.15(m,3h),2.09(td,j=13.3,12.6,4.1hz,1h),1.99
–
1.88(m,2h),1.87(s,3h),1.73(s,3h)。
13
c nmr(151mhz,cdcl3)δ144.93,135.15,134.39,134.31,134.29,131.82,131.71,131.46,131.38,128.80,128.20,128.10,127.93,127.29,126.61,124.81,124.72,111.35,92.14,92.11,56.73,56.72,38.47,34.38,34.31,28.49,28.43,24.82,22.26,18.84。
31
p nmr(162mhz,cdcl3)δ97.21。hrms(esi-tof):针对c
20h24
ops2的计算值[m h] :375.1006,实测值:375.0999。13.化合物16b:
[0224]
根据通用程序a,以0.5mmol的规模用1b和格氏试剂si-7。反应时间12h。通过硅胶
柱色谱法(己烷/甲苯=2:1)纯化得到137mg(72%,》20:1d.r.)标题化合物16b。所有物理和光谱特性均与16a相同,旋光度:[α]
25d
= 40.1
°
(在dcm中c=0.21)除外。14.化合物17a:
[0225]
根据通用程序a,以2mmol的规模用1a和格氏试剂si-13。反应时间12h。通过硅胶柱色谱法(己烷/甲苯/etoac=2:1:0至1:1:0至1:1:0.05)纯化得到420mg(59%,》20:1d.r.)标题化合物17a。物理状态:无色油状物[α]
25d
=-38.2
°
(在dcm中c=0.50)rf=0.22(己烷/et2o=9:1)1h nmr(400mhz,cdcl3)δ7.98(ddd,j=17.3,7.7,1.7hz,1h),7.52
–
7.42(m,1h),7.01(tdd,j=7.6,3.4,1.0hz,1h),6.95(ddd,j=8.2,7.1,0.9hz,1h),4.95(q,j=1.4hz,1h),4.88(s,1h),3.98(ddd,j=13.5,3.1,0.7hz,1h),3.92(s,3h),2.48(s,1h),2.25
–
2.07(m,3h),2.00
–
1.84(m,3h),1.82(s,3h),1.73(dt,j=1.4,0.7hz,3h)。
13
c nmr(151mhz,cdcl3)δ159.92,159.89,145.68,134.24,134.22,134.07,134.01,125.12,124.37,120.49,120.39,111.99,111.94,111.88,92.25,92.22,56.65,56.64,55.93,39.05,34.93,34.85,28.82,28.76,25.26,22.78,19.49。
31
p nmr(162mhz,cdcl3)δ93.72。hrms(esi-tof):针对c
17h24
o2ps2的计算值[m h] :355.0955,实测值:355.0951。15.化合物17b:
[0226]
根据通用程序a,以2.5mmol的规模用1b和格氏试剂si-13。反应时间12h。通过硅胶柱色谱法(己烷/甲苯/etoac=2:1:0至1:1:0至1:1:0.05)纯化得到525mg(59%,》20:1d.r.)标题化合物17b。所有物理和光谱特性均与17a相同,旋光度:[α]
25d
= 50.8
°
(在chcl3中c=1.00)除外。16.化合物18a:
[0227]
根据通用程序a,以1mmol的规模用1a和格氏试剂si-15。反应时间0.5h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:1)纯化得到146mg(54%,》20:1d.r.)标题化合物18a。物理状态:无色油状物
[α]
25d
= 12.5
°
(在chcl3中c=0.28)rf=0.41(己烷/et2o=9:1)1h nmr(500mhz,cdcl3)δ6.38(ddd,j=29.8,17.7,11.4hz,1h),6.20(ddd,j=29.4,17.7,1.3hz,1h),5.98(ddd,j=57.5,11.4,1.3hz,1h),4.99(d,j=1.5hz,1h),4.88(s,1h),3.74(dd,j=13.3,3.2hz,1h),2.48(s,1h),2.22(dd,j=13.8,1.8hz,1h),2.16
–
2.09(m,1h),2.06(dd,j=7.3,4.7hz,1h),1.92
–
1.77(m,3h),1.75(dt,j=1.5,0.8hz,3h),1.72(s,3h)。
13
c nmr(151mhz,cdcl3)δ163.86,163.74,159.73,159.72,145.52,145.34,145.15,136.41,136.32,134.58,133.59,131.03,130.99,129.45,129.43,129.17,129.08,128.80,127.79,114.09,114.07,114.03,97.12,87.93,87.76,87.69,86.90,86.86,85.92,85.89,75.87,75.84,72.60,65.22,65.18,63.37,55.55,42.11,40.79,40.77,26.16,18.50,12.25,11.30,-4.52,-4.65。
31
p nmr(162mhz,cdcl3)δ93.96。hrms(esi-tof):针对c
12h20
ops2的计算值[m h] :275.0693,实测值:275.0695。17.化合物18b:
[0228]
根据通用程序a,以0.5mmol的规模用1b和格氏试剂si-15。反应时间0.5h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:1)纯化得到85mg(63%,》20:1d.r.)标题化合物18b。所有物理和光谱特性均与18a相同,旋光度:[α]
25d
=-7.96
°
(在dcm中c=0.21)除外。18.化合物19a:
[0229]
根据通用程序a,以1mmol的规模用1a和格氏试剂si-14。反应时间1h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:2)纯化得到232mg(67%,》20:1d.r.)标题化合物19a。物理状态:浅黄色固体m.p.=107℃-110℃[α]
25d
= 115.3
°
(在dcm中c=0.22)。rf=0.24(己烷/et2o=9:1)1h nmr(500mhz,cdcl3)δ7.57
–
7.49(m,2h),7.48
–
7.40(m,1h),7.40
–
7.33(m,2h),5.02(d,j=1.5hz,1h),4.95(s,1h),4.14(dt,j=13.2,2.7hz,1h),2.51(t,j=6.0hz,1h),2.29(ddd,j=13.8,3.4,1.7hz,1h),2.15(d,j=15.0hz,1h),2.10(ddd,j=12.5,4.4,2.9hz,1h),2.03
–
1.86(m,2h),1.85
–
1.79(m,1h),1.78(s,3h),1.67(s,3h)。
13
c nmr(151mhz,cdcl3)δ145.31,132.66,132.65,130.72,128.62,120.06,120.03,112.15,99.29,99.03,93.04,93.01,87.23,85.86,57.13,57.10,39.01,35.14,
35.06,29.03,28.96,25.49,22.86,19.79。
31
p nmr(162mhz,cdcl3)δ60.28。hrms(esi-tof):针对c
18h22
ops2的计算值[m h] :349.0850,实测值:349.0841。19.化合物19b:
[0230]
根据通用程序a,以0.5mmol的规模用1b和格氏试剂si-14。反应时间1h。通过硅胶柱色谱法(己烷/甲苯=2:1至1:2)纯化得到118mg(68%,》20:1d.r.)标题化合物19b。所有物理和光谱特性均与19a相同,旋光度:[α]
25d
=-104.0
°
(在dcm中c=0.20)除外。b.偶联1.通用程序b(一锅法mei淬灭):
[0231]
如果尚未在-78℃,则将在14ml的thf中的有机锂试剂(4.0mmol,2.0当量,参见实施例3,格氏试剂和有机锂试剂的合成)冷却至此温度。在氩气气氛下在火焰干燥的烧瓶中制备起始材料(2.0mmol,1.0当量)在6ml thf中的溶液,然后将其逐滴添加到含有有机锂试剂的烧瓶中。将所得混合物在保持在-78℃下的同时搅拌3h。在小等分试样的
31
p nmr分析显示起始材料完全消耗后,将反应用过量的碘甲烷(8.0mmol,4.0当量)淬灭,温热至室温,并且搅拌另一小时。向所得混合物中添加饱和nh4cl水溶液(20ml)和etoac(40ml)。分离各层,并且将水层用etoac(2x20ml)洗涤。将合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥,过滤并且浓缩。将残余物通过硅胶色谱法纯化以得到所希望的产物。2.通用程序c(逐步):
[0232]
如果尚未在-78℃,则将在14ml的thf中的有机锂试剂(4.0mmol,2.0当量,参见实施例3,格氏试剂和有机锂试剂的合成)冷却至此温度。在氩气气氛下在火焰干燥的烧瓶中制备起始材料(2.0mmol,1.0当量)在6ml thf中的溶液,然后将其逐滴添加到含有有机锂试剂的烧瓶中。将所得混合物在保持在-78℃下的同时搅拌3h。在小等分试样的
31
p nmr分析显示起始材料完全消耗后,将反应用缓慢添加饱和nh4cl水溶液(20ml)小心淬灭,并且然后用水(10ml)和dcm(40ml)稀释。分离各层,并且将水层用dcm(2x20ml)洗涤。将合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥,过滤并且浓缩。将残余物溶解于thf(10ml)中,向其中添加et3n(4.0mmol,2.0当量)和mei(4.0mmol,2.0当量)。搅拌1h后,将反应用水(20ml)稀释并且用etoac(3x40ml)萃取。将合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥,过滤并且浓缩。将残余物通过硅胶色谱法纯化以得到所希望的产物。3.化合物11a
[0233]
根据通用程序b,以4mmol的规模用8a和有机锂试剂si-16。通过硅胶柱色谱法(己烷/etoac=2:1至1:2)纯化得到916mg(82%,》98:2e.r.)标题化合物11a。以20mmol的规模,纯化后获得4.70g(84%,》98:2e.r.)11a。物理状态:浅黄色固体m.p.=89℃-92℃[α]
25d
=-13.1
°
(在chcl3中c=1.00)rf=0.42(己烷/etoac=1:2)1h nmr(400mhz,cdcl3)δ7.97(dddd,j=14.2,7.6,1.8,0.4hz,1h),7.94
–
7.86(m,2h),7.55
–
7.40(m,4h),7.08(tdd,j=7.5,2.5,0.9hz,1h),6.89(ddd,j=8.3,6.1,0.9hz,1h),3.71(s,3h),2.27(d,j=12.3hz,3h)。
13
c nmr(126mhz,cdcl3)δ160.45,160.41,134.73,134.55,134.53,134.01,133.95,133.85,131.89,131.86,131.53,131.44,128.36,128.25,121.66,120.99,120.89,120.82,111.66,111.60,55.57,10.43,10.41。
31
p nmr(162mhz,cdcl3)δ41.34。hrms(esi-tof):针对c
14h16
o2ps的计算值[m h] :279.0609,实测值:279.0612。4.化合物11b
[0234]
根据通用程序b,以5mmol的规模用8b和有机锂试剂si-16。通过硅胶柱色谱法(己烷/etoac=2:1至1:2)纯化得到1.07g(77%,》98:2e.r.)标题化合物11b。所有物理和光谱特性均与11a相同,旋光度:[α]
25d
= 15.6(在chcl3中c=1.00)除外。5.化合物20a
[0235]
根据通用程序b,以0.5mmol的规模用8a和有机锂试剂si-17。硅胶柱色谱法(己烷/etoac=3:1至1:1)纯化得到72.0mg(52%,》98:2e.r.)标题化合物20a。物理状态:白色无定形固体[α]
25d
= 15.5(在chcl3中c=0.40)rf=0.45(己烷/etoac=1:2)1h nmr(400mhz,cdcl3)δ7.85
–
7.76(m,2h),7.65(dd,j=14.8,8.3hz,1h),7.57
–
7.50(m,1h),7.50
–
7.43(m,2h),7.07(ddd,j=5.5,1.6,0.8hz,2h),2.49(s,1h),2.35(s,4h),2.27(d,j=11.9hz,3h)。
13
c nmr(126mhz,cdcl3)δ143.15,143.13,142.59,142.51,134.02,133.17,133.14,133.12,133.04,133.02,132.22,132.20,131.68,131.60,128.81,128.71,127.83,126.98,126.46,126.35,21.65,21.62,21.50,10.83,10.81。
31
p nmr(162mhz,cdcl3)δ46.50。hrms(esi-tof):针对c
15h18
ops的计算值[m h] :277.0816,实测值:277.0818。6.化合物20b
[0236]
根据通用程序b,以1mmol的规模用8b和有机锂试剂si-17。通过硅胶柱色谱法(己烷/etoac=3:1至1:1)纯化得到176mg(64%,》98:2e.r.)标题化合物20b。所有物理和光谱特性均与20a相同,旋光度:[α]
25d
=-15.1
°
(在chcl3中c=0.40)除外。7.化合物21a
[0237]
根据通用程序c,以0.2mmol的规模用8a和有机锂试剂si-18。通过ptlc(己烷/
etoac=1:1)纯化得到47mg(81%,61:39e.r.)标题化合物21a。物理状态:无色油状物[α]
25d
=-4.9
°
(在chcl3中c=0.45)rf=0.45(己烷/etoac=1:2)1h nmr(400mhz,cdcl3)δ7.82
–
7.73(m,2h),7.53
–
7.39(m,3h),6.89(dd,j=4.3,0.6hz,2h),2.44(s,6h),2.39(d,j=11.8hz,3h),2.29(s,3h)。
13
c nmr(151mhz,cdcl3)δ143.55,143.48,142.30,142.28,137.36,136.66,131.89,131.87,131.39,131.31,130.51,130.44,128.92,128.83,125.85,125.16,23.76,23.74,21.19,21.18,11.02,11.00。
31
p nmr(162mhz,cdcl3)δ47.36。hrms(esi-tof):针对c
16h20
ops的计算值[m h] :291.0972,实测值:291.0975。8.化合物21b
[0238]
根据通用程序c,以0.2mmol的规模用8b和有机锂试剂si-18。通过ptlc(己烷/etoac=1:1)纯化得到48mg(83%,37:63e.r.)标题化合物21b。所有物理和光谱特性均与21a相同,旋光度:[α]
25d
= 3.5
°
(在chcl3中c=1.00)除外。9.化合物22a
[0239]
根据通用程序b,以2mmol的规模用8a和有机锂试剂si-27。通过硅胶柱色谱法(己烷/etoac=2:1至1:2)纯化得到364mg(80%,》98:2e.r.)标题化合物22a。物理状态:白色固体m.p.=80℃-82℃[α]
25d
= 142.5
°
(在chcl3中c=1.00)rf=0.56(己烷:etoac=1:2)1h nmr(400mhz,cdcl3)δ7.92
–
7.85(m,2h),7.56
–
7.44(m,3h),2.12(d,j=10.5hz,3h),1.17(d,j=16.9hz,9h)。
13
c nmr(151mhz,cdcl3)δ133.23,133.17,132.06,132.04,130.64,130.03,128.47,128.39,36.67,36.20,24.80,9.61,9.59。
31
p nmr(162mhz,cdcl3)δ68.92。hrms(esi-tof):针对c
11h18
ops的计算值[m h] :229.0806,实测值:229.0818。10.化合物22b
[0240]
根据通用程序b,以2mmol的规模用8b和有机锂试剂si-27。通过硅胶柱色谱法(己烷/etoac=2:1至1:2)纯化得到352mg(77%,》98:2e.r.)标题化合物22b。所有物理和光谱特性均与22a相同,旋光度:[α]
25d
=-135.2
°
(在chcl3中c=1.00)除外。11.化合物23a
[0241]
根据通用程序c,以0.2mmol的规模用8a和有机锂试剂si-19。通过硅胶柱色谱法(己烷/etoac=1:2至纯etoac)纯化得到15.1mg(30%,》98:2e.r.)标题化合物23a。物理状态:浅黄色油状物[α]
25d
=-21.6
°
(在chcl3中c=0.38)rf=0.34(己烷/etoac=1:4)1h nmr(600mhz,cdcl3)δ8.81(d,j=4.7hz,1h),8.16(ddt,j=7.7,5.5,1.1hz,1h),8.12
–
8.02(m,2h),7.83(tdd,j=7.7,4.8,1.7hz,1h),7.57
–
7.52(m,1h),7.50
–
7.45(m,2h),7.40(dddd,j=7.6,4.8,2.7,1.3hz,1h),2.23(d,j=12.2hz,3h)。
13
c nmr(151mhz,cdcl3)δ156.56,155.64,150.74,150.60,136.49,136.42,132.63,132.61,132.18,132.14,132.07,131.48,128.73,128.66,128.65,128.15,128.00,125.92,125.90,10.21,10.19。
31
p nmr(162mhz,cdcl3)δ40.29。hrms(esi-tof):针对c
12h13
nops的计算值[m h] :250.0455,实测值:250.0459。12.化合物23b
[0242]
根据通用程序c,以0.2mmol的规模用8b和有机锂试剂si-19。通过硅胶柱色谱法(己烷/etoac=1:2至纯etoac)纯化得到15.9mg(32%,98:2e.r.)标题化合物23b。所有物理和光谱特性均与23a相同,旋光度:[α]
25d
= 24.1
°
(在chcl3中c=0.80)除外。13.化合物24a
[0243]
根据通用程序c,以0.05mmol的规模用8a和有机锂试剂si-23。通过ptlc(己烷/etoac=1:1)纯化得到8.6mg(63%,》98:2e.r.)标题化合物24a。物理状态:白色无定形固体[α]
25d
=-10.5
°
(在chcl3中c=0.43)rf=0.50(己烷/etoac=1:2)1h nmr(500mhz,cdcl3)δ8.01(dd,j=15.1,8.4hz,2h),7.66
–
7.50(m,5h),7.46(t,
j=7.5hz,1h),7.38(t,j=8.1hz,2h),2.40(d,j=14.1hz,3h)。
13
c nmr(126mhz,cdcl3)δ133.07,133.04,132.93,132.76,132.74,131.90,131.12,131.03,128.98,128.86,128.75,119.75,119.71,104.97,104.71,83.08,81.64,11.56,11.53。
31
p nmr(162mhz,cdcl3)δ18.40。hrms(esi-tof):针对c
15h14
ops的计算值[m h] :273.0503,实测值:273.0508。14.化合物24b
[0244]
根据通用程序c,以0.05mmol的规模用8b和有机锂试剂si-23。通过ptlc(己烷/etoac=1:1)纯化得到8.3mg(61%,》98:2e.r.)标题化合物24b。所有物理和光谱特性均与24a相同,旋光度:[α]
25d
= 11.9
°
(在chcl3中c=0.42)除外。15.化合物25a
[0245]
根据通用程序c,以1mmol的规模用8a和有机锂试剂si-20。通过硅胶柱色谱法(己烷/etoac=3:1至2:1)纯化得到94mg(32%,96:4e.r.)标题化合物25a。物理状态:白色无定形固体[α]
25d
=-39.2
°
(在chcl3中c=0.24)rf=0.44(己烷/etoac=1:1)1h nmr(400mhz,cdcl3)δ8.78
–
8.72(m,1h),8.08
–
7.98(m,2h),7.94
–
7.84(m,3h),7.60
–
7.44(m,6h),2.34(d,j=12.1hz,3h)。
13
c nmr(151mhz,cdcl3)δ134.17,134.10,133.94,133.92,133.67,133.47,133.40,133.26,133.20,132.96,132.53,132.51,131.83,131.76,129.02,129.01,128.97,128.88,128.82,128.13,127.51,127.12,127.09,126.72,124.58,124.48,11.19,11.17。
31
p nmr(162mhz,cdcl3)δ46.99。hrms(esi-tof):针对c
17h16
ops的计算值[m h] :299.0659,实测值:299.0662。16.化合物25b
[0246]
根据通用程序c,以1mmol的规模用8b和有机锂试剂si-20。通过硅胶柱色谱法(己烷/etoac=3:1至2:1)纯化得到68mg(23%,97:3e.r.)标题化合物25b。所有物理和光谱特性均与25a相同,旋光度:[α]
25d
= 37.5
°
(在chcl3中c=1.00)除外。c.离去基团安装
1.通用程序d
[0247]
向火焰干燥的50ml圆底烧瓶中装入起始材料(1.0mmol,1.0当量)。将烧瓶排空并且回填氩气,并且然后经由注射筒引入无水甲醇(8ml),然后引入naome(2.0ml,在meoh中的0.5m溶液,1.0mmol,1.0当量)。将所得混合物在室温下搅拌4h,此后添加饱和nh4cl水溶液(10ml)和etoac(20ml)。分离各层,并且将水层用etoac(2x10ml)洗涤。将合并的有机层用盐水(10ml)洗涤,经无水na2so4干燥,过滤并且浓缩。(注意:如果浓缩后观察到白色沉淀物,则再次过滤)。将粗产物通过硅胶色谱法纯化以得到所希望的产物。2.化合物si-28a
[0248]
根据通用程序d,以1mmol的规模用11a。通过硅胶柱色谱法(己烷/etoac=1:1至1:4)纯化得到186mg(70%,98:2e.r.)标题化合物si-28a。以16mmol的规模,纯化后获得3.24g(77%,97:3e.r.)si-28a。物理状态:无色油状物[α]
25d
=-16.5
°
(在chcl3中c=0.84)rf=0.25(己烷/etoac=1:3)1h nmr(400mhz,cdcl3)δ7.98(ddd,j=13.3,7.5,1.8hz,1h),7.88
–
7.80(m,2h),7.50(dddd,j=9.6,6.8,2.1,1.1hz,2h),7.46
–
7.38(m,2h),7.06(tdd,j=7.5,2.6,0.9hz,1h),6.87(dd,j=6.1,2.2hz,1h),3.75(d,j=11.4hz,3h),3.71(s,3h)。
13
c nmr(151mhz,cdcl3)δ161.11,161.08,134.90,134.86,134.59,134.57,132.54,131.93,131.90,131.87,131.86,131.59,128.18,128.10,120.79,120.71,119.41,118.51,111.39,111.34,55.62,51.53,51.49。
31
p nmr(162mhz,cdcl3)δ31.78。hrms(esi-tof):针对c
14h16
o3p的计算值[m h] :263.0837,实测值:263.0842。3.化合物si-28b
[0249]
根据通用程序d,以0.9mmol的规模用有机锂试剂11b。通过硅胶柱色谱法(己烷/etoac=1:1至1:4)纯化得到151mg(64%,98:2e.r.)标题化合物si-28b。所有物理和光谱特性均与si-28a相同,旋光度:[α]
25d
= 19.2
°
(在chcl3中c=0.91)除外。4.化合物si-29a
[0250]
根据通用程序d,以0.30mmol的规模用有机锂试剂25a。通过硅胶柱色谱法(己烷:/etoac=2:1至1:1)纯化得到68.4mg(80%,92:8e.r.)标题化合物si-29a。物理状态:白色无定形固体[α]
25d
=-18.6
°
(在chcl3中c=0.65)rf=0.33(己烷/etoac=1:1)1h nmr(600mhz,cdcl3)δ8.55
–
8.48(m,1h),8.21(ddd,j=14.8,7.1,1.3hz,1h),8.04(d,j=8.1hz,1h),7.91
–
7.85(m,1h),7.85
–
7.77(m,2h),7.56(ddd,j=8.3,7.1,2.8hz,1h),7.53
–
7.47(m,3h),7.42(td,j=7.5,3.1hz,2h),3.82(d,j=11.1hz,3h)。
13
c nmr(151mhz,cdcl3)δ134.31,134.26,133.84,133.80,133.78,133.77,133.07,132.99,132.40,132.30,132.28,131.56,131.49,129.03,129.02,128.73,128.64,127.64,127.21,126.47,126.43,126.33,124.80,124.70,51.75,51.71。
31
p nmr(162mhz,cdcl3)δ34.77。hrms(esi-tof):针对c
17h16
o2p的计算值[m h] :283.0888,实测值:283.0890。5.化合物si-29b
[0251]
根据通用程序d,以0.22mmol的规模用有机锂试剂25b。通过硅胶柱色谱法(己烷/etoac=2:1至1:1)纯化得到50.6mg(81%,92:8e.r.)标题化合物si-29b。所有物理和光谱特性均与si-29a相同,旋光度:[α]
25d
= 14.3
°
(在chcl3中c=0.59)除外。6.化合物si-30a
[0252]
根据通用程序d,以0.66mmol的规模用有机锂试剂20a。通过硅胶柱色谱法(己烷:etoac 2:1至1:1)纯化得到97mg(56%,97:3e.r.)标题化合物si-30a。物理状态:无色油状物[α]
25d
= 16.1
°
(在chcl3中c=0.80)rf=0.30(己烷/etoac=1:2)1h nmr(400mhz,cdcl3)δ7.83
–
7.68(m,3h),7.55
–
7.48(m,1h),7.48
–
7.38(m,2h),7.10(dt,j=7.9,2.2hz,1h),7.03(d,j=4.9hz,1h),3.74(d,j=11.1hz,3h),2.36(s,3h),2.34(s,3h)。
13
c nmr(126mhz,cdcl3)δ143.07,143.05,142.03,141.94,133.66,133.59,132.53,132.50,132.43,132.09,132.07,131.72,131.64,131.43,128.63,128.53,126.47,126.36,125.26,51.30,51.25,21.55,21.26,21.22。
31
p nmr(162mhz,cdcl3)δ34.34。hrms(esi-tof):针对c
15h18
o2p的计算值[m h] :261.1044,实测值:261.1050。7.化合物si-30b
[0253]
根据通用程序d,以0.59mmol的规模用有机锂试剂20b。通过硅胶柱色谱法(己烷:etoac 2:1至1:1)纯化得到80mg(52%,98:2e.r.)标题化合物si-30b。所有物理和光谱特性均与si-30a相同,旋光度:[α]
25d
=-16.9
°
(在chcl3中c=0.80)除外。d.置换1.通用程序e:
[0254]
向在氩气下的火焰干燥的13x 100mm培养管中装入在thf(0.5ml)中的起始材料(0.05mmol,1.0当量)。逐滴添加格氏试剂(0.10mmol,2.0当量,除非另有指定),并且将反应在室温下搅拌12h。添加饱和nh4cl水溶液(1ml)和etoac(2ml)。分离各层,并且将水层用etoac(2x 2ml)洗涤。将合并的有机层用盐水(1ml)洗涤,经无水na2so4干燥,过滤并且浓缩。将粗产物通过ptlc或硅胶色谱法纯化以得到所希望的产物。2.通用程序f:
[0255]
向在氩气下的火焰干燥的13x 100mm培养管中装入在thf(0.5ml)中的起始材料(0.05mmol,1.0当量)并且冷却至-78℃。逐滴添加有机锂试剂(0.10mmol,2.0当量,除非另有指定),并且将反应在-78℃下搅拌3h。添加饱和nh4cl水溶液(1ml)和etoac(2ml)。分离各层,并且将水层用etoac(2x 2ml)洗涤。将合并的有机层用盐水(1ml)洗涤,经无水na2so4干燥,过滤并且浓缩。将粗产物通过ptlc或硅胶色谱法纯化以得到所希望的产物。3.通用程序g:
[0256]
在氩气下的火焰干燥的13x100mm培养管中制备在0.3ml的thf中的有机锂试剂(0.10mmol,2.0当量,除非另有指定)(参见格氏试剂和有机锂试剂的合成)。逐滴添加在
0.2ml的thf中的起始材料(0.05mmol,1.0当量),并且将反应在-78℃下搅拌3h。添加饱和nh4cl水溶液(1ml)和etoac(2ml)。分离各层,并且将水层用etoac(2x2ml)洗涤。将合并的有机层用盐水(1ml)洗涤,经无水na2so4干燥,过滤并且浓缩。将粗产物通过ptlc或硅胶色谱法纯化以得到所希望的产物。4.化合物26a
[0257]
根据通用程序e,以0.05mmol的规模用si-28a和格氏试剂si-11。通过ptlc(在etoac中的5%meoh)纯化得到10.9mg(89%,98:2e.r.)标题化合物26a。以12mmol的规模,纯化后获得2.54g(84%,97:3e.r.)26a。物理状态:白色固体m.p.=81℃-83℃[α]
25d
= 30.4
°
(在chcl3中c=0.55)rf=0.43(在etoac中的5%meoh)1h nmr(400mhz,cdcl3)δ7.95(ddd,j=13.1,7.5,1.8hz,1h),7.79
–
7.68(m,2h),7.55
–
7.37(m,4h),7.10(t,j=7.5hz,1h),6.88(dd,j=8.3,5.2hz,1h),3.72(s,3h),2.08(d,j=14.0hz,3h)。
13
c nmr(151mhz,cdcl3)δ160.04,160.01,135.34,134.67,134.06,134.05,134.03,131.42,131.40,130.40,130.34,128.38,128.30,121.80,121.22,121.15,111.03,110.99,55.42,16.53,16.03。
31
p nmr(162mhz,cdcl3)δ29.41。hrms(esi-tof):针对c
14h16
o2p的计算值[m h] :247.0888,实测值:247.0889。5.化合物26b
[0258]
根据通用程序e,以0.05mmol的规模用si-28b和格氏试剂si-11。通过ptlc(在etoac中的5%meoh)纯化得到10.0mg(81%,98:2e.r.)标题化合物26b。所有物理和光谱特性均与26a相同,旋光度:[α]
25d
=-28.5
°
(在chcl3中c=0.64)除外。6.化合物27a
[0259]
根据通用程序e,以0.05mmol的规模用si-28a和格氏试剂si-12。通过ptlc(在etoac中的5%meoh)纯化得到11.4mg(87%,97:3e.r.)标题化合物27a。7.化合物27b
[0260]
根据通用程序e,以0.03mmol的规模用si-28b和格氏试剂si-12。通过ptlc(在etoac中的5%meoh)纯化得到6.6mg(85%,97:3e.r.)标题化合物27b。所有物理和光谱特性均与27a相同,旋光度:[α]
25d
=-18.1
°
(在chcl3中c=0.33)除外。8.化合物28a
[0261]
根据通用程序f,以0.05mmol的规模用si-28a和有机锂试剂si-25。通过ptlc(己烷/etoac=1:3)纯化得到10.5mg(77%,97:3e.r.)标题化合物28a。物理状态:白色无定形固体[α]
25d
= 13.8
°
(在chcl3中c=0.50)rf=0.5(etoac)1h nmr(400mhz,cdcl3)δ8.08(ddd,j=12.4,7.6,1.8hz,1h),7.88(ddd,j=11.2,7.9,1.7hz,2h),7.52
–
7.36(m,4h),7.09(t,j=7.7hz,1h),6.87(dd,j=8.3,5.2hz,1h),3.83(s,3h),2.87(dq,j=14.1,7.1hz,1h),1.15(ddd,j=38.7,17.0,7.2hz,6h)。
13
c nmr(151mhz,cdcl3)δ159.43,159.39,134.88,134.85,133.70,133.65,133.63,133.07,131.26,131.24,131.22,131.20,128.23,128.16,121.44,121.37,121.12,120.50,110.64,110.59,55.30,26.66,26.17,15.45,15.44,15.09,15.07。
31
p nmr(162mhz,cdcl3)δ38.08。hrms(esi-tof):针对c
16h20
o2p的计算值[m h] :275.1201,实测值:275.1203。9.化合物28b
[0262]
根据通用程序f,以0.03mmol的规模用si-28b和有机锂试剂si-25。通过ptlc(己烷/etoac=1:3)纯化得到5.6mg(68%,》98:2e.r.)标题化合物28b。所有物理和光谱特性均与28a相同,旋光度:[α]
25d
= 12.6
°
(在chcl3中c=0.28)除外。10.化合物29a
[0263]
根据通用程序f,以0.05mmol的规模用si-28a和有机锂试剂si-26。通过ptlc(己烷/etoac=1:3)纯化得到13.6mg(94%,97:3e.r.)标题化合物29a。
物理状态:无色油状物[α]
25d
= 5.3
°
(在chcl3中c=0.43)rf=0.54(etoac)1h nmr(600mhz,丙酮-d6)δ8.01
–
7.94(m,1h),7.88
–
7.80(m,2h),7.57
–
7.41(m,4h),7.14
–
7.09(m,1h),7.09
–
7.04(m,1h),3.85(s,3h),2.51
–
2.40(m,1h),2.38
–
2.26(m,1h),1.61
–
1.48(m,1h),1.47
–
1.35(m,3h),0.90
–
0.81(m,3h)。
13
c nmr(151mhz,丙酮-d6)δ160.67,160.64,136.89,136.23,134.97,134.94,134.51,134.50,131.82,131.81,131.51,131.45,128.96,128.89,123.05,122.43,121.67,121.60,111.99,111.94,55.72,29.77,29.28,24.64,24.61,24.58,24.54,13.95。
31
p nmr(162mhz,丙酮-d6)δ29.39。hrms(esi-tof):针对c
17h22
o2p的计算值[m h] :289.1357,实测值:289.1362。11.化合物29b
[0264]
根据通用程序f,以0.03mmol的规模用si-28b和有机锂试剂si-26。通过ptlc(己烷/etoac=1:3)纯化得到7.4mg(86%,97:3e.r.)标题化合物29b。所有物理和光谱特性均与29a相同,旋光度:[α]
25d
=-7.1
°
(在chcl3中c=0.37)除外。12.化合物30a
[0265]
根据通用程序f,以0.05mmol的规模用si-28a和有机锂试剂si-27。通过ptlc(己烷/etoac=1:3)纯化得到12.0mg(83%,90:10e.r.)标题化合物30a。物理状态:白色无定形固体[α]
25d
= 10.7
°
(在chcl3中c=0.27)rf=0.53(etoac)1h nmr(400mhz,cdcl3)δ8.16(ddd,j=12.1,7.6,1.8hz,1h),7.99
–
7.88(m,2h),7.54
–
7.36(m,4h),7.11(tt,j=7.5,1.2hz,1h),6.91(dd,j=8.3,5.1hz,1h),3.75(s,3h),1.26(d,j=15.4hz,9h)。
13
c nmr(151mhz,cdcl3)δ159.73,159.70,136.27,136.24,133.70,133.69,133.27,132.65,132.18,132.12,131.18,131.16,127.97,127.89,121.27,121.20,120.56,119.97,110.97,110.93,54.77,35.10,34.63,26.11,26.10。
31
p nmr(162mhz,cdcl3)δ43.50。hrms(esi-tof):针对c
17h22
o2p的计算值[m h] :289.1357,实测值:289.1361。13.化合物30b
[0266]
根据通用程序f,以0.03mmol的规模用si-28b和有机锂试剂si-27。通过ptlc(己烷/etoac=1:3)纯化得到6.8mg(79%,87:13e.r.)标题化合物30b。所有物理和光谱特性均与30a相同,旋光度:[α]
25d
=-12.5
°
(在chcl3中c=0.33)除外。14.化合物31a
[0267]
根据通用程序e,以0.05mmol的规模用si-28a和格氏试剂si-8(4.0当量)。通过ptlc(己烷/etoac=1:2)纯化得到14.5mg(90%,96:4e.r.)标题化合物31a。物理状态:无色凝胶[α]
25d
=-6.7
°
(在chcl3中c=0.73)rf=0.35(己烷/etoac=1:3)1h nmr(400mhz,cdcl3)δ7.75(ddd,j=13.4,7.6,1.8hz,1h),7.68(ddd,j=12.5,8.2,1.3hz,2h),7.59(dd,j=12.3,8.0hz,2h),7.55
–
7.45(m,2h),7.44
–
7.37(m,2h),7.23(dd,j=8.3,2.7hz,2h),7.10
–
7.02(m,1h),6.90(dd,j=8.3,5.2hz,1h),3.55(s,3h),2.38(s,3h)。
13
c nmr(126mhz,cdcl3)δ161.01(d,j=3.2hz),141.96(d,j=2.6hz),135.08(d,j=7.1hz),134.28(d,j=1.8hz),133.67(d,j=107.6hz),132.01(d,j=10.6hz),131.88(d,j=10.2hz),131.44(d,j=2.7hz),129.85(d,j=109.8hz),128.99(d,j=12.9hz),128.16(d,j=12.4hz),121.02(d,j=11.6hz),120.62(d,j=103.8hz),111.50(d,j=6.5hz),55.37,21.71。
31
p nmr(162mhz,cdcl3)δ27.45。hrms(esi-tof):针对c
20h20
o2p的计算值[m h] :323.1201,实测值:323.1200。15.化合物31b
[0268]
根据通用程序e,以0.05mmol的规模用si-28b和格氏试剂si-8(4.0当量)。通过ptlc(己烷/etoac=1:2)纯化得到13.6mg(84%,97:3e.r.)标题化合物31b。所有物理和光谱特性均与31a相同,旋光度:[α]
25d
= 6.5
°
(在chcl3中c=0.68)除外。16.化合物32a
[0269]
根据通用程序e,以0.05mmol的规模用si-28a和格氏试剂si-9。通过ptlc(己烷/etoac=1:3)纯化得到15.8mg(93%,97:3e.r.)标题化合物32a。物理状态:白色无定形固体[α]
25d
=-9.5
°
(在chcl3中c=0.78)rf=0.33(己烷/etoac=1:3)1h nmr(400mhz,cdcl3)δ7.76
–
7.64(m,3h),7.56
–
7.46(m,2h),7.45
–
7.38(m,2h),7.36
–
7.28(m,2h),7.22(ddt,j=12.1,7.5,1.2hz,1h),7.10
–
7.00(m,2h),6.91(dd,j=8.2,5.3hz,1h),3.78(s,3h),3.57(s,3h)。
13
c nmr(151mhz,cdcl3)δ161.14,161.12,159.49,159.39,135.10,135.05,134.93,134.44,134.43,134.23,133.61,132.89,131.91,131.85,131.61,131.59,129.46,129.36,128.29,128.20,124.28,124.22,121.08,121.00,120.69,120.01,117.84,117.82,116.77,116.69,111.62,111.57,55.52,55.44。
31
p nmr(162mhz,cdcl3)δ27.38。hrms(esi-tof):针对c
20h20
o3p的计算值[m h] :339.1150,实测值:339.1150。17.化合物32b
[0270]
根据通用程序e,以0.05mmol的规模用si-28b和格氏试剂si-9。通过ptlc(己烷/etoac=1:3)纯化得到15.8mg(93%,97:3e.r.)标题化合物32b。所有物理和光谱特性均与32a相同,旋光度:[α]
25d
= 8.1
°
(在chcl3中c=0.78)除外。18.化合物33a
[0271]
根据通用程序e,以0.05mmol的规模用si-28a和格氏试剂si-7(10当量)。通过硅胶柱色谱法(己烷/etoac=1:2至纯etoac)纯化得到16.7mg(93%,95:5e.r.)标题化合物33a。物理状态:无色凝胶[α]
25d
=-7.6
°
(在chcl3中c=0.50)rf=0.37(己烷/etoac=1:4)1h nmr(600mhz,cdcl3)δ8.37
–
8.31(m,1h),7.90
–
7.83(m,3h),7.76(dddd,j=23.9,12.5,8.0,1.6hz,3h),7.67(ddd,j=10.2,8.4,1.5hz,1h),7.60
–
7.49(m,4h),7.44
(ddd,j=8.9,7.0,3.0hz,2h),7.12
–
7.05(m,1h),6.96
–
6.90(m,1h),3.55(s,3h)。
13
c nmr(151mhz,cdcl3)δ161.14,161.12,135.19,135.14,134.75,134.73,134.50,134.49,133.79,133.73,133.02,132.66,132.57,131.97,131.90,131.66,131.64,130.81,130.09,129.09,128.36,128.28,128.03,127.88,127.86,127.78,127.20,127.13,126.76,121.17,121.09,120.71,120.02,111.60,111.56,55.44。
31
p nmr(162mhz,cdcl3)δ27.55。hrms(esi-tof):针对c
23h20
o2p的计算值[m h] :359.1201,实测值:359.1205。19.化合物33b
[0272]
根据通用程序e,0.05mmol的规模用si-28b和格氏试剂si-7(10当量)。通过硅胶柱色谱法(己烷/etoac=1:2至纯etoac)纯化得到16.5mg(92%,80:20e.r.)标题化合物33b。所有物理和光谱特性均与33a相同,旋光度:[α]
25d
= 8.1
°
(在chcl3中c=0.83)除外。20.化合物34a
[0273]
根据通用程序g,以0.05mmol的规模用si-28a和有机锂试剂si-20。通过ptlc(己烷/etoac=1:3)纯化得到11.7mg(65%,98:2e.r.)标题化合物34a。物理状态:白色结晶固体m.p.=167℃-169℃[α]
25d
= 21.3(在chcl3中c=0.52)rf=0.36(己烷/etoac=1:3)1h nmr(400mhz,cdcl3)δ8.57(d,j=8.5hz,1h),7.98(d,j=8.0hz,1h),7.87(d,j=8.2hz,1h),7.83
–
7.70(m,3h),7.57
–
7.36(m,8h),7.08(tdd,j=7.5,2.1,0.9hz,1h),6.91(dd,j=7.9,5.3hz,1h),3.46(s,3h)。
13
c nmr(151mhz,cdcl3)δ161.17,161.15,134.99,134.94,134.36,134.35,134.05,133.94,133.88,133.82,133.34,133.18,133.10,132.84,132.82,132.25,132.18,131.58,131.56,129.60,128.89,128.80,128.79,128.31,128.23,127.62,127.58,127.17,126.32,124.39,124.29,121.42,121.29,121.22,120.74,111.75,111.71,55.45。
31
p nmr(162mhz,cdcl3)δ30.93。hrms(esi-tof):针对c
23h20
o2p的计算值[m h] :359.1201,实测值:359.1197。21.化合物34b
[0274]
根据通用程序g,以0.03mmol的规模用si-28b和有机锂试剂si-20。通过ptlc(己烷/etoac=1:3)纯化得到5.7mg(53%,97:3e.r.)标题化合物34b。所有物理和光谱特性均与34a相同,旋光度:[α]
25d
=-22.5
°
(在chcl3中c=0.29)除外。22.化合物35a
[0275]
根据通用程序g,以0.05mmol的规模用si-28a和有机锂试剂si-24。通过ptlc(己烷/etoac=1:3)纯化得到19.3mg(93%,97:3e.r.)标题化合物35a。物理状态:橙色凝胶[α]
25d
=-38.2
°
(在chcl3中c=0.10)rf=0.29(己烷/etoac=1:3)1h nmr(400mhz,cdcl3)δ7.95(ddd,j=13.4,7.5,1.8hz,1h),7.71
–
7.62(m,2h),7.54
–
7.45(m,1h),7.44(td,j=7.2,1.6hz,1h),7.41
–
7.34(m,2h),7.10(tdd,j=7.5,1.8,0.9hz,1h),6.87(dd,j=8.3,5.3hz,1h),4.59(s,1h),4.47(s,1h),4.44(s,2h),4.12(s,5h),3.51(s,3h)。
13
c nmr(126mhz,cdcl3)δ160.44,160.41,136.23,135.35,134.48,134.43,133.84,133.83,131.00,130.98,130.90,127.90,127.80,123.26,122.42,120.92,120.83,111.64,111.59,73.41,72.97,72.87,72.45,72.29,72.19,71.42,71.33,71.17,71.08,69.69,55.35。
31
p nmr(162mhz,cdcl3)δ27.37。hrms(esi-tof):针对c
23h22
feo2p的计算值[m h] :415.0754,实测值:415.0747。23.化合物35b
[0276]
根据通用程序g,以0.05mmol的规模用si-28b和有机锂试剂si-24。通过ptlc(己烷:etoac=1:3)纯化得到18.3mg(88%,97:3e.r.)标题化合物35b。所有物理和光谱特性均与35a相同,旋光度:[α]
25d
= 39.0(在chcl3中c=0.10)除外。
24.化合物36a
[0277]
根据通用程序g,以0.05mmol的规模用si-28a和有机锂试剂si-21。通过ptlc(己烷/etoac=1:3)纯化得到18.3mg(83%,93:7e.r.)标题化合物36a。物理状态:白色固体m.p.=187℃-189℃[α]
25d
= 49.6
°
(在chcl3中c=0.74)rf=0.25(己烷/etoac=1:3)1h nmr(400mhz,cdcl3)δ7.70
–
7.58(m,3h),7.55
–
7.45(m,2h),7.41
–
7.30(m,3h),7.30
–
7.24(m,2h),7.19(dddd,j=7.6,4.2,1.3,0.5hz,1h),7.03(t,j=8.3hz,1h),6.89(tdd,j=7.5,2.0,0.9hz,1h),6.76(dd,j=8.0,5.2hz,1h),6.28(dd,j=8.4,0.8hz,1h),6.19(dd,j=8.4,0.8hz,1h),3.52(s,3h),3.50(s,3h),3.43(s,3h)。
13
c nmr(126mhz,cdcl3)δ160.58,160.55,157.95,157.61,139.20,139.13,134.76,134.70,134.35,133.66,133.56,133.50,133.27,133.26,132.70,132.56,132.48,132.11,132.03,131.01,130.99,130.70,130.68,129.22,127.51,127.41,126.39,126.28,122.33,121.51,120.60,120.50,117.83,117.80,111.02,110.97,103.04,102.92,55.37,55.28,55.12。
31
p nmr(162mhz,cdcl3)δ26.90。hrms(esi-tof):针对c
27h26
o4p的计算值[m h] :445.1569,实测值:445.1565。25.化合物36b
[0278]
根据通用程序g,以0.05mmol的规模用si-28b和有机锂试剂si-21。通过ptlc(己烷/etoac=1:3)纯化得到18.3mg(83%,93:7e.r.)标题化合物36b。所有物理和光谱特性均与36a相同,旋光度:[α]
25d
=-44.5
°
(在chcl3中c=1.00)除外。26.化合物37a
[0279]
根据通用程序g,以0.05mmol的规模用si-29a和有机锂试剂si-22(4当量)。通过
ptlc(己烷/etoac=1:2)纯化得到11.4mg(56%,94:6e.r.)标题化合物37a。物理状态:黄色无定形固体[α]
25d
=-23.5
°
(在chcl3中c=0.38)rf=0.40(己烷/etoac=1:2)1h nmr(400mhz,丙酮-d6)δ8.65(d,j=8.6hz,1h),8.12(d,j=8.2hz,1h),8.00(d,j=8.3hz,1h),7.79
–
7.70(m,3h),7.67(tt,j=7.6,1.6hz,1h),7.64
–
7.47(m,7h),7.45
–
7.36(m,2h),3.91(ddd,j=10.1,8.8,7.7hz,1h),3.80(ddd,j=10.5,8.4,7.7hz,1h),3.65
–
3.48(m,2h)。
13
c nmr(151mhz,丙酮-d6)δ164.58,164.56,135.47,134.90,134.84,134.76,134.71,134.64,134.61,134.56,134.15,134.11,134.10,134.02,133.34,133.32,133.11,133.04,132.45,132.43,132.38,132.36,131.66,131.27,131.21,130.97,130.83,130.75,129.63,129.63,129.15,129.07,128.59,128.56,127.45,127.16,125.25,125.15,68.28,55.74。
31
p nmr(162mhz,丙酮-d6)δ32.05。hrms(esi-tof):针对c
25h21
no2p的计算值[m h] :398.1310,实测值:398.1306。27.化合物37b
[0280]
根据通用程序g,以0.05mmol的规模用si-29b和有机锂试剂si-22(4当量)。通过ptlc(己烷/etoac=1:2)纯化得到8.0mg(40%,e.r.在89:11至94:6之间,不满意的手性hplc分离,参见下文)标题化合物37b。所有物理和光谱特性均与37a相同,旋光度:[α]
25d
= 22.8
°
(在chcl3中c=0.40)除外。28.化合物38a
[0281]
根据通用程序g,以0.05mmol的规模用si-30a和有机锂试剂si-24。通过ptlc(己烷/etoac=1:3)纯化得到16.6mg(84%,98:2e.r.)标题化合物38a。物理状态:橙色无定形固体[α]
25d
= 88.0
°
(在chcl3中c=0.10)rf=0.35(己烷/etoac=1:3)1h nmr(400mhz,cdcl3)δ7.76
–
7.67(m,2h),7.51(dtd,j=16.2,8.6,8.1,6.2hz,3h),7.11(dd,j=14.0,7.8hz,1h),6.99(s,1h),6.92(d,j=7.9hz,1h),4.72(s,1h),4.54(s,1h),4.40(s,1h),4.21(s,5h),3.93(s,1h),2.30(d,j=4.1hz,6h)。
13
c nmr(151mhz,cdcl3)δ142.33,142.27,142.10,142.08,134.78,134.09,133.58,133.49,132.56,132.49,131.45,131.43,131.32,131.26,130.16,129.45,128.33,128.25,125.79,125.71,74.30,73.52,72.84,72.75,72.35,72.28,71.97,71.90,71.33,71.26,69.81,21.47,21.39,21.36。
31
p nmr(162mhz,cdcl3)δ31.77。hrms(esi-tof):针对c
24h24
feop的计算值[m h] :413.0961,实测值:413.0954。29.化合物38b
[0282]
根据通用程序g,以0.05mmol的规模用si-30b和有机锂试剂si-24。通过ptlc(己烷/etoac=1:3)纯化得到15.8mg(76%,在97:3与98:2之间的e.r.,不满意的手性hplc分离,参见下文)标题化合物38b。所有物理和光谱特性均与38a相同,旋光度:[α]
25d
=-79.0
°
(在chcl3中c=0.10)除外。e.氧化膦的立体特异性还原
[0283]
手性膦的还原遵循报道的程序(参见rajendran,k.v.等人,simple unprecedented conversion of phosphine oxides and sulfides to phosphine boranes using sodium borohydride.chem.comm.2012,48,817-819):在氩气气氛下,将26a(0.5mmol,1.0当量)在dcm(1ml)中的溶液在室温下逐滴添加到米尔文盐(0.5mmol,1.0当量)在dcm(1ml)中的搅拌溶液中。将反应混合物轻轻回流2h,这时
31
p nmr显示氧化膦完全转化为烷氧基鏻盐。冷却至室温后,将溶解于二甘醇二甲醚(1ml)中的硼氢化钠(3mmol,6.0当量)逐滴添加到反应混合物中。将此混合物轻轻回流2h。一旦
31
p nmr显示盐完全转化为膦硼烷,则将反应混合物用水(5ml)洗涤,并且将分离的有机层经无水mgso4干燥。通过过滤去除干燥剂,并且在真空中去除溶剂以得到无色油状物,将其通过硅胶色谱法(己烷/etoac=4:1)纯化以得到呈白色固体的39a(60%,96:4e.r.)。所有光谱数据均与文献相同。用chiralpak ad-h柱(用在己烷中的2%异丙醇作为洗脱剂并且流速为1ml/min)测量对映异构体比率。实施例53
’‑
o-保护的核苷的合成1.合成3
’‑
o-保护的核苷的通用程序(通用程序g)
[0284]3’‑
o-tbs保护的核苷的合成方法改编自文献程序。将5'-o-dmtr保护的核苷(10mmol,1.0当量)和咪唑(3.14g,46.2mmol,2.0当量)在dmf(30ml)中的溶液冷却至0℃,向其中添加tbscl(20mmol,2.0当量)。将反应在室温下搅拌3天,并且然后用etoac(80ml)稀释并且用水(100ml x 3)洗涤。将有机层经mgso4干燥并且在真空中去除溶剂。将残余物溶解于100ml dcm和40ml meoh中,然后冷却至0℃。添加对甲苯磺酸(20mmol,2.0当量)在10ml meoh中的溶液,并且将反应在0℃下搅拌30min。添加吡啶(1ml)以中和过量的酸。将粗反应混合物蒸发至干,在etoac(100ml)中稀释并且用饱和nahco3(50ml)和盐水(50ml)洗涤。将有机层经na2so4干燥,过滤并且在真空中浓缩。将粗产物通过硅胶色谱法(纯dcm至在dcm中5%meoh的梯度)纯化以得到所希望的产物。2.化合物si-31
[0285]
根据通用程序g,以10mmol的规模用5'-o-(4,4'-二甲氧基三苯甲基)胸腺嘧啶。将si-31(2.8g,79%)分离为白色泡沫,其具有与文献报道相同的光谱特性。参见huang,h.-s.等人,a practical method for regioselective 5'-o-tert-butyldimethylsilyl deprotection of persilylated nucleosides by methanolic phosphomolybdic acid.synlett 2018,29,2437-2443。3.化合物si-32
[0286]
根据通用程序g,以10mmol的规模用n
6-苯甲酰基-5'-o-(4,4'-二甲氧基三苯甲基)-2'-脱氧腺苷。将si-32(3.8g,81%)分离为白色泡沫,其具有与文献报道相同的光谱特性。参见molina,a.g.等人,acetylated and methylatedβ-cyclodextrins as viable soluble supports for the synthesis of short 2'-oligodeoxyribo-nucleotides in solution.molecules 2012,17,12102-12120。4.化合物si-33
[0287]
根据通用程序g,以10mmol的规模用n
4-苯甲酰基-5'-o-(4,4'-二甲氧基三苯甲基)-2'-脱氧胞苷。将si-33(3.7g,83%)分离为白色泡沫,其具有与文献报道相同的光谱特性。参见huang,h.-s.等人,synlett 2018,29,2437-2443。5.化合物si-34
[0288]
根据通用程序g,以10mmol的规模用n
2-异丁酰基-5'-o-(4,4'-二甲氧基三苯甲基)-2'-脱氧鸟苷。将si-34(3.3g,72%)分离为白色泡沫,其具有与文献报道相同的光谱特性。参见huang,h.-s.等人,synlett 2018,29,2437-2443。实施例6mpo合成a.负载1.通用程序h
[0289]
向在氩气下的火焰干燥的50ml圆底烧瓶中装入核苷(1.0mmol,1.0当量)、12(524.6mg,2.0mmol,2.0当量)和thf(10ml)。逐滴添加dbu(3.0mmol,3.0当量),并且将所得溶液在室温下搅拌12h。然后将反应用20ml的1x pbs溶液淬灭并且用dcm(3x30ml)萃取。将合并的有机层用饱和nahco3水溶液(10ml)、盐水(10ml)洗涤,经na2so4干燥,过滤并且浓缩。将残余物重新溶解于thf(5ml)中。添加et3n(2当量)和mei(2当量),并且将不均匀的混合物剧烈搅拌1h。将反应用10ml水淬灭并且用etoac(3x20ml)萃取。将合并的有机层经na2so4干燥,过滤并且浓缩。将残余物通过硅胶色谱法纯化以得到所希望的产物。
[0290]
核碱基命名法:除非另有说明,否则本公开文本中的核碱基将采用以下命名惯例:2.化合物(r
p
)-40
[0291]
根据通用程序h,以0.5mmol的规模用12b和5'-o-(4,4'-二甲氧基三苯甲基)胸腺嘧啶。通过硅胶柱色谱法(在dcm中的2%至5%meoh)纯化得到275mg(85%,》20:1d.r.)标题化合物(r
p
)-40。物理状态:白色泡沫rf=0.3(etoac)1h nmr(600mhz,丙酮-d6)δ10.01(s,1h),7.58(d,j=1.3hz,1h),7.53
–
7.47(m,2h),7.41
–
7.31(m,6h),7.30
–
7.23(m,1h),6.95
–
6.89(m,4h),6.38(dd,j=8.3,6.0hz,1h),5.32(ddt,j=10.9,5.3,2.5hz,1h),4.23(q,j=3.2hz,1h),3.79(s,6h),3.49
–
3.40(m,2h),2.63
–
2.57(m,2h),2.18(d,j=13.1hz,3h),1.82(d,j=15.7hz,3h),1.50(d,j=1.2hz,3h)。
13
c nmr(151mhz,丙酮-d6)δ164.22,159.94,159.93,151.35,145.81,138.60,136.58,136.44,136.24,131.13,130.15,129.86,129.14,129.13,128.90,128.88,128.39,127.95,127.51,126.23,114.18,113.71,111.44,87.82,85.26,85.21,85.19,76.47,76.43,64.33,55.67,55.57,39.94,39.92,21.51,19.11,18.39,12.51,12.49,12.28。
31
p nmr(162mhz,丙酮-d6)δ56.16。hrms(esi-tof):针对c
33h37
n2o8psna的计算值[m na] :675.1906,实测值:675.1914。3.化合物(s
p
)-40
[0292]
根据通用程序h,以1mmol的规模用12a和5'-o-(4,4'-二甲氧基三苯甲基)胸腺嘧啶。通过硅胶柱色谱法(在dcm中的2%至5%meoh)纯化得到574mg(88%,》20:1d.r.)标题化合物(s
p
)-40。物理状态:白色泡沫rf=0.34(etoac)1h nmr(600mhz,丙酮-d6)δ10.13(s,1h),7.61(d,j=1.3hz,1h),7.53
–
7.47(m,2h),7.40
–
7.35(m,4h),7.33(t,j=7.8hz,2h),7.28
–
7.22(m,1h),6.94
–
6.87(m,4h),6.39(dd,j=8.3,6.1hz,1h),5.38(ddd,j=10.0,5.4,2.9hz,1h),4.36(q,j=3.0hz,1h),3.78(s,6h),3.46(ddd,j=49.2,10.6,3.2hz,2h),2.63
–
2.53(m,2h),2.31(d,j=13.0hz,3h),1.82(d,j=15.7hz,3h),1.46(d,j=1.3hz,3h)。
13
c nmr(151mhz,丙酮-d6)δ164.19,159.77,159.75,151.29,145.77,136.51,136.34,136.11,131.03,129.02,128.77,127.78,114.05,111.31,87.71,85.72,85.70,85.11,76.74,76.70,64.10,55.54,39.35,39.32,19.09,18.37,12.36,12.34,12.14。
31
p nmr(162mhz,丙酮-d6)δ56.63。hrms(esi-tof):针对c
33h37
n2o8psna的计算值[m na] :675.1906,实测值:675.1988。4.化合物(r
p
)-41
[0293]
根据通用程序h,以1mmol的规模用12b和n
6-苯甲酰基-5'-o-(4,4'-二甲氧基三苯甲基)-2'-脱氧腺苷。通过硅胶柱色谱法(在dcm中的2%至5%meoh)纯化得到628mg(82%,20:1d.r.)标题化合物(r
p
)-41。物理状态:白色泡沫rf=0.23(dcm/meoh=98:2)1h nmr(600mhz,丙酮-d6)δ9.97(s,1h),8.55(s,1h),8.41(s,1h),8.12(d,j=7.6hz,2h),7.64(t,j=7.4hz,1h),7.56(dd,j=8.3,6.9hz,2h),7.51
–
7.44(m,2h),7.38
–
7.30(m,4h),7.28(dd,j=8.3,6.6hz,2h),7.25
–
7.17(m,1h),6.90
–
6.80(m,4h),6.60(dd,j=7.7,6.2hz,1h),5.48(ddt,j=8.8,5.6,2.7hz,1h),4.37(td,j=5.3,2.5hz,1h),3.77(d,j=1.9hz,6h),3.51
–
3.28(m,3h),2.92
–
2.85(m,1h),2.27(d,j=13.0hz,3h),1.85(d,j=15.7hz,3h)。
13
c nmr(151mhz,丙酮-d6)δ165.93,159.80,159.78,153.02,152.69,151.42,146.06,143.84,136.77,136.75,135.18,133.34,131.11,131.04,129.88,129.54,129.26,129.16,129.10,128.73,127.75,126.46,126.24,114.04,87.40,85.78,85.73,76.98,76.93,64.29,55.65,38.56,21.53,19.21,18.49,12.65,12.63。
31
p nmr(162mhz,丙酮-d6)δ55.94。hrms(esi-tof):针对c
40h41
n5o7ps的计算值[m h] :766.2464,实测值:766.2474。5.化合物(s
p
)-41
[0294]
根据通用程序h,以1mmol的规模用12a和n
6-苯甲酰基-5'-o-(4,4'-二甲氧基三苯甲基)-2'-脱氧腺苷。通过硅胶柱色谱法(在dcm中的2%至5%meoh)纯化得到690mg(90%,》20:1d.r.)标题化合物(s
p
)-41。物理状态:白色泡沫rf=0.38(etoac/丙酮=2:1)1h nmr(600mhz,丙酮-d6)δ10.06(s,1h),8.54(s,1h),8.41(s,1h),8.11(d,j=7.7hz,2h),7.65
–
7.58(m,1h),7.53(t,j=7.9hz,2h),7.47(dd,j=8.4,1.3hz,2h),7.34(d,j=8.6hz,4h),7.25(t,j=7.7hz,2h),7.21
–
7.16(m,1h),6.82(t,j=9.1hz,4h),6.59(dd,j=7.8,6.2hz,1h),5.49(ddd,j=12.3,5.5,2.5hz,1h),4.52(td,j=5.0,2.5hz,1h),3.75(d,j=2.6hz,6h),3.51
–
3.41(m,2h),3.41
–
3.33(m,1h),2.77(ddd,j=14.1,6.2,2.7hz,1h),2.33(d,j=13.0hz,3h),1.85(d,j=15.7hz,3h)。
13
c nmr(151mhz,丙酮-d6)δ165.90,159.57,159.55,152.86,152.55,151.28,145.98,143.66,136.67,135.01,133.17,130.99,130.93,129.36,129.15,128.99,128.55,127.53,126.26,113.87,87.18,86.17,86.14,85.63,76.94,76.89,64.25,55.50,38.10,38.07,19.21,18.49,12.35,12.33。
31
p nmr(162mhz,丙酮-d6)δ56.03。hrms(esi-tof):针对c
40h41
n5o7ps的计算值[m h] :766.2464,实测值:766.2480。6.化合物(r
p
)-42
[0295]
根据通用程序h,以1mmol的规模用12b和n
2-异丁酰基-5'-o-(4,4'-二甲氧基三苯甲基)-2'-脱氧鸟苷。通过硅胶柱色谱法(在dcm中的2%至5%meoh)纯化得到343mg(46%,》20:1d.r.)标题化合物(r
p
)-42。物理状态:白色泡沫rf=0.18(etoac/丙酮=2:1)1h nmr(600mhz,丙酮-d6)δ12.02(s,1h),10.52(s,1h),7.96(s,1h),7.47
–
7.42(m,2h),7.35
–
7.17(m,7h),6.89
–
6.82(m,4h),6.33(dd,j=7.5,6.0hz,1h),5.54
–
5.47(m,1h),4.28(td,j=4.6,3.0hz,1h),3.81
–
3.78(m,6h),3.43
–
3.37(m,1h),3.12(ddd,j=13.6,7.4,5.9hz,1h),2.82(td,j=6.3,5.7,2.9hz,1h),2.33(d,j=0.7hz,2h),2.23(d,j=13.1hz,3h),1.90(d,j=15.7hz,3h),1.24(dd,j=6.9,2.7hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ180.83,159.80,159.78,155.87,149.35,149.22,145.94,138.12,136.72,136.64,131.10,131.02,129.88,129.16,129.11,128.89,128.40,127.77,126.24,122.35,114.01,87.40,85.40,85.35,84.67,76.55,76.51,64.26,55.63,39.14,36.74,21.53,19.43,19.35,19.21,18.49,12.61,12.58。
31
p nmr(162mhz,丙酮-d6)δ57.29。hrms(esi-tof):针对c
37h43
n5o8ps的计算值[m h] :748.2570,实测值:748.2568。7.化合物(s
p
)-42
[0296]
根据通用程序h,以1mmol的规模用12a和n
2-异丁酰基-5'-o-(4,4'-二甲氧基三苯甲基)-2'-脱氧鸟苷。通过硅胶柱色谱法(在dcm中的2%至5%meoh)纯化得到441mg(59%,》20:1d.r.)标题化合物(s
p
)-42。物理状态:白色泡沫rf=0.25(etoac/丙酮=2:1)1h nmr(600mhz,丙酮-d6)δ12.04(s,1h),10.84(s,1h),7.92(s,1h),7.41
–
7.37(m,2h),7.30
–
7.15(m,7h),6.79(dd,j=9.0,2.5hz,4h),6.40(dd,j=8.0,5.8hz,1h),5.59(ddt,j=10.8,5.6,2.7hz,1h),4.62
–
4.55(m,1h),3.75(d,j=2.1hz,6h),3.43(dd,j=10.4,5.0hz,1h),3.32(dd,j=10.4,3.8hz,1h),3.06(ddd,j=13.9,8.0,5.9hz,1h),2.82
–
2.72(m,2h),2.38(d,j=13.4hz,3h),1.98(d,j=15.6hz,3h),1.15(dd,j=34.6,6.8hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ180.81,159.55,155.79,149.27,149.24,145.80,137.82,136.54,130.88,130.86,128.95,128.54,127.56,122.03,113.83,87.07,85.87,85.85,84.46,76.90,76.85,64.11,55.47,39.14,39.11,36.44,19.35,19.31,19.19,18.60,12.46,12.43。
31
p nmr(162mhz,丙酮-d6)δ58.75。hrms(esi-tof):针对c
37h43
n5o8ps的计算值[m h] :748.2570,实测值:748.2573。8.化合物(r
p
)-43
[0297]
根据通用程序h,以1mmol的规模用12b和n
4-苯甲酰基-5'-o-(4,4'-二甲氧基三苯甲基)-2'-脱氧胞苷。通过硅胶柱色谱法(在dcm中的2%至5%meoh)纯化得到652mg(88%,》20:1d.r.)标题化合物(r
p
)-43。物理状态:白色泡沫rf=0.21(dcm/meoh=98:2)1h nmr(600mhz,丙酮-d6)δ9.79(s,1h),8.25(d,j=7.4hz,1h),8.17(ddt,j=7.5,6.2,2.6hz,2h),7.68
–
7.65(m,1h),7.61
–
7.55(m,2h),7.51(dt,j=8.8,2.2hz,2h),7.42
–
7.34(m,5h),7.31
–
7.17(m,3h),6.96
–
6.92(m,4h),6.29(t,j=6.4hz,1h),5.27(ddt,j=10.4,7.2,3.8hz,1h),4.38(q,j=3.8hz,1h),3.82(s,6h),3.54(d,j=4.0hz,2h),2.88(ddd,j=14.4,6.3,3.5hz,1h),2.50(dt,j=12.3,5.9hz,1h),2.22(d,j=13.0hz,3h),1.84(d,j=15.7hz,3h)。
13
c nmr(151mhz,丙酮-d6)δ159.94,145.68,145.16,138.63,136.51,136.45,133.75,131.18,131.16,129.89,129.61,129.24,129.21,129.17,128.90,127.96,126.25,114.20,87.89,87.76,85.94,85.89,75.80,75.76,63.74,55.67,41.31,21.54,19.21,18.48,12.53,12.51。
31
p nmr(162mhz,丙酮-d6)δ56.15。hrms(esi-tof):针对c
39h41
n3o8ps的计算值[m h] :742.2352,实测值:742.2360。9.化合物(s
p
)-43
[0298]
根据通用程序h,以1mmol的规模用12a和n
4-苯甲酰基-5'-o-(4,4'-二甲氧基三苯甲基)-2'-脱氧胞苷。通过硅胶柱色谱法(在dcm中的2%至5%meoh)纯化得到534mg(72%,》20:1d.r.)标题化合物(s
p
)-43。物理状态:白色泡沫rf=0.33(etoac/丙酮=2:1)1h nmr(600mhz,丙酮-d6)δ10.07(s,1h),8.25(d,j=7.5hz,1h),8.15(dd,j=8.4,1.3hz,2h),7.66
–
7.59(m,1h),7.57
–
7.51(m,2h),7.51
–
7.47(m,2h),7.40
–
7.35(m,4h),7.33(dd,j=8.4,7.1hz,2h),7.29
–
7.21(m,2h),6.93
–
6.88(m,4h),6.25(t,j=6.4hz,1h),5.33(ddt,j=9.7,6.5,3.3hz,1h),4.47(q,j=3.6hz,1h),3.78(d,j=1.3hz,6h),3.51(ddd,j=37.0,10.8,3.8hz,2h),2.80(ddd,j=14.3,6.2,3.4hz,1h),2.50(dt,j=14.2,6.5hz,1h),2.31(d,j=13.1hz,3h),1.83(d,j=15.7hz,3h)。
13
c nmr(151mhz,丙酮-d6)δ163.77,159.70,159.69,145.60,145.05,136.47,136.33,134.59,133.57,131.05,130.98,129.41,129.13,129.04,128.74,127.72,114.04,97.09,87.70,86.33,86.30,75.76,75.72,63.44,55.51,40.72,40.69,19.10,18.38,12.37,12.35。
31
p nmr(162mhz,丙酮-d6)δ56.56。hrms(esi-tof):针对c
39h41
n3o8ps的计算值[m h] :742.2352,实测值:742.2343。b.偶联1.通用程序i
[0299]
偶联步骤遵循报道的程序的修改版本。向培养管装入licl(12.7mg,0.3mmol,10当量),在真空下火焰干燥,并且允许冷却回至室温。将负载的化合物(0.06mmol,2.0当量)和3
’‑
tbs-核苷(0.03mmol,1.0当量)添加到培养管中,然后将其密封并且用ar回填三次。添加dmf(0.5ml),并且将反应搅拌大约15min直到所有licl均溶解。然后经由注射筒引入dbu(91.3mg,0.09ml,0.6mmol,20当量),并且将所得混合物搅拌过夜持续16h。将反应用添加1x pbs溶液(10ml)淬灭并且用dcm(3x 10ml)萃取。将合并的有机层用水(2x10ml)和盐水(10ml)洗涤,经mgso4干燥,过滤并且浓缩。如果需要,可以用甲苯共沸去除残余的dmf。将残余物通过ptlc纯化以得到所希望的化合物。2.化合物(s
p
)-44
[0300]
根据通用程序i,以0.03mmol的规模用(s
p
)-40和si-31。通过ptlc(etoac/dcm:丙酮=5:5:2)纯化得到23.9mg(83%,》20:1d.r.)标题化合物(s
p
)-44。物理状态:白色无定形固体rf=0.32(etoac/dcm/丙酮=5:5:2)1h nmr(600mhz,丙酮-d6)δ10.12(s,1h),10.06(s,1h),7.58(q,j=1.2hz,1h),7.54(q,j=1.3hz,1h),7.51
–
7.47(m,2h),7.39
–
7.31(m,6h),7.28
–
7.23(m,1h),6.93
–
6.88(m,4h),6.37(t,j=7.1hz,1h),6.30(dd,j=7.7,6.1hz,1h),5.34(dtd,j=8.3,4.2,
2.6hz,1h),4.52(dt,j=6.1,3.2hz,1h),4.27(q,j=3.0hz,1h),4.26
–
4.22(m,1h),4.09(ddd,j=11.4,7.0,3.5hz,1h),4.00(dt,j=5.2,3.3hz,1h),3.79(s,6h),3.48
–
3.39(m,2h),2.61
–
2.55(m,2h),2.31
–
2.16(m,2h),1.81(d,j=1.3hz,3h),1.59(d,j=17.7hz,3h),1.45(d,j=1.2hz,3h),0.91(s,9h),0.12(d,j=2.0hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ164.26,164.19,159.80,159.78,151.29,151.26,145.73,136.55,136.45,136.33,136.17,131.05,131.04,129.05,128.79,127.83,114.07,111.30,111.11,87.74,86.32,86.27,85.74,85.49,85.46,85.07,76.99,76.95,73.06,65.66,65.62,64.22,55.57,40.73,39.57,39.54,26.13,18.49,12.57,12.18,12.13,11.24,-4.56,-4.65。
31
p nmr(162mhz,丙酮-d6)δ33.33。hrms(esi-tof):针对c
48h61
n4o
13
psi的计算值[m na] :983.3640,实测值:983.3629。3.化合物(s
p
)-45
[0301]
根据通用程序i,以0.03mmol的规模用(s
p
)-40和si-32。通过ptlc(etoac/dcm/丙酮=5:5:2)纯化得到29.3mg(91%,20:1d.r.)标题化合物(s
p
)-45。物理状态:白色无定形固体rf=0.32(etoac/dc/丙酮=5:5:2)1h nmr(600mhz,丙酮-d6)δ10.25(s,1h),10.06(s,1h),8.64(s,1h),8.46(s,1h),8.10(d,j=7.7hz,2h),7.64
–
7.60(m,1h),7.57
–
7.51(m,3h),7.47
–
7.44(m,2h),7.36
–
7.28(m,6h),7.24
–
7.19(m,1h),6.88(dd,j=9.0,1.2hz,4h),6.56(t,j=6.5hz,1h),6.33(dd,j=8.0,6.1hz,1h),5.26(ddt,j=8.2,5.5,2.7hz,1h),4.88(dt,j=6.0,4.0hz,1h),4.26
–
4.10(m,4h),3.76(s,6h),3.41
–
3.31(m,2h),3.06(dt,j=13.0,6.2hz,1h),2.56
–
2.49(m,3h),1.50(d,j=17.7hz,3h),1.42(d,j=1.2hz,3h),0.95(s,9h),0.18(s,6h)。
13
c nmr(151mhz,丙酮-d6)δ165.88,164.25,159.75,159.73,152.85,152.63,151.33,151.23,145.74,143.57,136.45,136.31,136.22,135.01,133.18,131.03,131.01,129.37,129.21,129.01,128.77,127.77,126.04,114.05,111.26,87.69,86.64,86.60,85.43,85.40,85.36,85.09,76.91,76.87,73.07,65.14,65.10,64.14,55.55,40.44,39.57,39.55,26.18,18.55,12.11,11.16,-4.51,-4.61。
31
p nmr(162mhz,丙酮-d6)δ32.99。hrms(esi-tof):针对c
55h64
n7o12psi的计算值[m h] :1074.4198,实测值:1074.4181。4.化合物(s
p
)-46
[0302]
根据通用程序i,以0.03mmol的规模用(s
p
)-40和si-33。通过ptlc(etoac/丙酮=15:1)纯化得到25.5mg(81%,》20:1d.r.)标题化合物(s
p
)-46。物理状态:白色无定形固体rf=0.50(etoac/丙酮=10:1)1h nmr(600mhz,丙酮-d6)δ10.09(s,1h),9.95(s,1h),8.22(d,j=7.6hz,1h),8.17
–
8.13(m,2h),7.67
–
7.62(m,1h),7.58(d,j=1.3hz,1h),7.55(t,j=7.8hz,2h),7.50
–
7.46(m,2h),7.39
–
7.29(m,7h),7.26
–
7.21(m,1h),6.89(d,j=9.0hz,4h),6.37(t,j=7.0hz,1h),6.23(t,j=6.3hz,1h),5.35(dtd,j=8.1,4.3,2.5hz,1h),4.54(dt,j=6.1,4.0hz,1h),4.35
–
4.28(m,2h),4.17(ddd,j=11.4,6.8,3.5hz,1h),4.12(q,j=4.1hz,1h),3.77(s,6h),3.45(ddd,j=31.5,10.6,3.3hz,2h),2.60(dd,j=7.1,4.4hz,2h),2.46(ddd,j=13.6,6.3,4.1hz,1h),2.24(dt,j=13.5,6.3hz,1h),1.61(d,j=17.7hz,3h),1.45(d,j=1.3hz,3h),0.91(s,9h),0.12(d,j=1.6hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ164.19,163.70,159.77,159.76,151.27,145.73,145.27,136.46,136.32,136.25,134.62,133.59,131.04,129.44,129.16,129.04,128.78,127.81,114.06,114.05,111.24,97.15,87.85,87.72,86.91,86.87,85.48,85.45,85.20,77.05,77.01,72.59,65.27,65.23,64.24,55.55,42.10,39.57,39.55,26.14,18.49,12.22,12.15,11.28,-4.53,-4.68。
31
p nmr(162mhz,丙酮-d6)δ33.43。hrms(esi-tof):针对c
54h64
n5o
13
psi的计算值[m h] :1050.4086,实测值:1050.4083。5.化合物(s
p
)-47
[0303]
根据通用程序i,以0.03mmol的规模用(s
p
)-40和si-34。通过ptlc(etoac/丙酮=10:1)纯化得到25.0mg(80%,》20:1d.r.)标题化合物(s
p
)-47。物理状态:白色无定形固体rf=0.37(etoac/丙酮=10:1)1h nmr(600mhz,丙酮-d6)δ12.06(s,1h),11.00(s,1h),10.06(s,1h),7.97(s,1h),7.58(d,j=1.3hz,1h),7.48(dd,j=8.4,1.2hz,2h),7.38
–
7.29(m,6h),7.26
–
7.20(m,1h),6.91
–
6.86(m,4h),6.38(dd,j=7.7,6.5hz,1h),6.33(dd,j=8.9,5.7hz,1h),5.36(ddt,j=7.8,5.8,3.1hz,1h),4.63(dt,j=5.2,1.8hz,1h),4.45(ddd,j=11.0,7.0,4.9hz,1h),4.37
–
4.29(m,2h),4.18(td,j=5.4,5.0,1.6hz,1h),3.77(d,j=1.7hz,6h),3.45(qd,j=10.6,3.4hz,2h),2.99
–
2.89(m,1h),2.84
–
2.80(m,1h),2.63
–
2.58(m,2h),2.27(ddd,j=13.3,5.8,1.9hz,1h),1.62(d,j=17.6hz,3h),1.45(d,j=1.1hz,3h),1.16(dd,j=16.4,6.9hz,6h),0.92(s,9h),0.13(d,j=3.7hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ181.00,164.13,159.80,159.78,155.81,151.25,149.07,148.92,145.67,139.55,136.40,136.30,136.22,131.02,131.00,129.04,128.78,127.85,123.14,114.05,111.28,87.74,87.07,87.02,86.90,85.48,85.45,85.25,77.51,77.48,73.92,66.07,66.03,64.26,55.56,39.92,39.47,39.44,36.41,26.17,19.40,19.23,18.56,12.14,11.71,10.78,-4.54,-4.61。
31
p nmr(162mhz,丙酮-d6)δ34.75。hrms(esi-tof):针对c
52h66
n7o
13
psi的计算值[m na] :1078.4123,实测值:1078.4097。6.化合物(s
p
)-48
[0304]
根据通用程序i,以0.03mmol的规模用(s
p
)-41和si-31。通过ptlc(etoac/丙酮=7:1)纯化得到24.2mg(75%,》20:1d.r.)标题化合物(s
p
)-48。物理状态:白色无定形固体rf=0.32(etoac/丙酮=7:1)1h nmr(600mhz,丙酮-d6)δ10.28(s,1h),10.08(s,1h),8.55(s,1h),8.41(s,1h),8.12(d,j=7.6hz,2h),7.63(t,j=7.4hz,1h),7.59(d,j=1.3hz,1h),7.54(t,j=7.8hz,2h),7.45(dd,j=8.5,1.3hz,2h),7.35
–
7.30(m,4h),7.26(t,j=7.6hz,2h),7.22
–
7.16(m,1h),6.86
–
6.81(m,4h),6.58(dd,j=7.7,6.2hz,1h),6.34(dd,j=7.7,6.1hz,1h),5.47(td,j=5.7,2.9hz,1h),4.56(dt,j=6.1,3.2hz,1h),4.42(td,j=5.1,2.6hz,1h),4.32(ddd,j=11.4,7.7,5.2hz,1h),4.19(ddd,j=11.4,7.1,3.5hz,1h),4.05(dt,j=5.5,3.2hz,1h),3.76(d,j=2.6hz,6h),3.51
–
3.41(m,2h),3.37(ddd,j=13.9,7.8,6.1hz,1h),2.81(ddd,j=14.1,6.2,2.8hz,1h),2.34
–
2.21(m,2h),1.83(d,j=1.2hz,3h),1.63(d,j=17.7hz,3h),0.91(s,9h),0.13(s,6h)。
13
c nmr(151mhz,丙酮-d6)δ164.56,163.02,158.28,158.26,151.54,151.22,150.01,144.58,142.37,135.30,135.26,133.68,131.86,129.65,129.58,128.03,127.87,
127.66,127.26,126.27,124.90,112.56,109.82,85.93,85.05,85.01,84.61,84.58,84.42,84.27,75.95,75.91,71.72,64.36,64.32,62.93,54.18,39.46,36.94,36.91,24.81,17.16,11.27,10.92,9.97,-5.88,-5.96。
31
p nmr(162mhz,丙酮-d6)δ33.03。hrms(esi-tof):针对c
55h64
n7o
12
psi的计算值[m h] :1074.4198,实测值:1074.4185。7.化合物(s
p
)-49
[0305]
根据通用程序i,以0.03mmol的规模用(s
p
)-41和si-32。通过ptlc(在etoac中的10%meoh)纯化得到27.5mg(77%,》20:1d.r.)标题化合物(s
p
)-49。物理状态:白色无定形固体rf=0.28(在etoac中的10%meoh)1h nmr(600mhz,丙酮-d6)δ9.99(d,j=12.5hz,2h),8.66(s,1h),8.52(d,j=7.4hz,2h),8.42(s,1h),8.13(t,j=6.2hz,4h),7.65(dt,j=15.2,7.4hz,2h),7.56(dt,j=15.6,7.6hz,4h),7.47
–
7.42(m,2h),7.34
–
7.30(m,4h),7.26(dd,j=8.5,7.0hz,2h),7.21
–
7.16(m,1h),6.85
–
6.80(m,4h),6.61(t,j=6.5hz,1h),6.55(dd,j=7.7,6.2hz,1h),5.40(ddt,j=8.4,5.8,2.7hz,1h),4.93(dt,j=6.0,4.0hz,1h),4.35(td,j=5.1,2.5hz,1h),4.31(dd,j=7.2,4.4hz,2h),4.20(q,j=4.2hz,1h),3.76(d,j=2.0hz,6h),3.46
–
3.36(m,2h),3.31(dt,j=14.2,7.6hz,1h),3.09(dt,j=12.9,6.2hz,1h),2.76(ddd,j=14.0,6.2,2.8hz,1h),2.58(ddd,j=13.4,6.5,4.3hz,1h),1.55(d,j=17.7hz,3h),0.97(s,9h),0.21(s,6h)。
13
c nmr(151mhz,丙酮-d6)δ165.92,165.85,159.60,159.58,152.91,152.82,152.65,152.51,151.20,145.95,143.83,143.55,136.66,136.65,135.07,134.99,133.22,133.19,130.98,130.92,129.41,129.39,129.20,129.17,128.99,128.58,127.56,126.48,126.29,126.19,113.89,87.21,86.72,86.68,85.88,85.85,85.64,85.42,77.27,77.24,73.09,65.14,65.10,64.24,55.51,40.64,38.14,26.20,18.57,12.11,11.16,-4.50,-4.58。
31
p nmr(162mhz,丙酮-d6)δ32.60。hrms(esi-tof):针对c
62h67n10o11
psi的计算值[m h] :1187.4576,实测值:1187.4561。8.化合物(s
p
)-50
[0306]
根据通用程序i,以0.03mmol的规模用(s
p
)-41和si-33。通过ptlc(etoac/丙酮=7:1)纯化得到26.8mg(77%,》20:1d.r.)标题化合物(s
p
)-50。物理状态:白色无定形固体rf=0.50(etoac/丙酮=5:1)1h nmr(600mhz,丙酮-d6)δ10.06(s,2h),8.55(s,1h),8.46(s,1h),8.31(d,j=7.5hz,1h),8.16
–
8.10(m,4h),7.67
–
7.60(m,2h),7.55(q,j=8.6,7.7hz,4h),7.47(d,j=7.3hz,2h),7.41(s,1h),7.35
–
7.31(m,4h),7.26(t,j=7.7hz,2h),7.22
–
7.17(m,1h),6.86
–
6.80(m,4h),6.62(dd,j=7.6,6.2hz,1h),6.28(t,j=6.3hz,1h),5.50(ddt,j=8.5,5.8,2.6hz,1h),4.60(dt,j=6.2,4.0hz,1h),4.46(dt,j=8.0,3.9hz,1h),4.40(ddd,j=11.8,7.3,4.8hz,1h),4.31(ddt,j=10.3,6.9,3.3hz,1h),4.18(q,j=4.0hz,1h),3.76(dd,j=2.4,1.5hz,6h),3.53
–
3.44(m,2h),3.41(dt,j=13.7,6.7hz,1h),2.85(ddd,j=14.0,6.2,2.8hz,1h),2.50(ddt,j=11.8,5.7,2.8hz,1h),2.29(dt,j=13.2,6.3hz,1h),1.67(d,j=17.7hz,3h),0.93(s,9h),0.15(s,6h)。
13
c nmr(151mhz,丙酮-d6)δ166.11,163.70,159.60,159.58,152.81,152.56,151.17,145.92,145.34,143.93,136.64,136.61,134.96,134.56,133.60,133.27,130.98,130.91,129.44,129.39,129.18,129.14,128.99,128.58,127.59,126.14,113.89,97.10,87.94,87.24,86.98,86.94,85.97,85.94,85.70,77.37,77.33,72.57,65.30,65.26,64.29,55.51,42.21,38.24,38.22,26.15,18.49,12.31,11.36,-4.52,-4.65。
31
p nmr(162mhz,丙酮-d6)δ33.17。hrms(esi-tof):针对c
61h67
n8o
12
psi的计算值[m h] :1163.4464,实测值:1163.4448。9.化合物(s
p
)-51
[0307]
根据通用程序i,以0.03mmol的规模用(s
p
)-41和si-34。通过ptlc(在etoac中的10%meoh)纯化得到20.0mg(60%,》20:1d.r.)标题化合物(s
p
)-51。物理状态:白色无定形固体
rf=0.25(etoac:丙酮=5:1)1h nmr(600mhz,丙酮-d6)δ12.08(s,1h),11.07(s,1h),10.00(s,1h),8.54(s,1h),8.43(s,1h),8.13(d,j=7.6hz,2h),8.01(s,1h),7.67
–
7.61(m,1h),7.55(t,j=7.7hz,2h),7.47
–
7.40(m,2h),7.34
–
7.27(m,4h),7.23(dd,j=8.3,6.8hz,2h),7.20
–
7.15(m,1h),6.80(t,j=8.7hz,4h),6.62(dd,j=7.6,6.2hz,1h),6.36(dd,j=8.8,5.7hz,1h),5.50(ddt,j=8.4,5.8,2.7hz,1h),4.71
–
4.64(m,1h),4.53(ddd,j=11.6,7.1,4.7hz,1h),4.47(td,j=5.1,2.5hz,1h),4.40(dt,j=11.1,6.1hz,1h),4.22(t,j=4.5hz,1h),3.74(d,j=2.7hz,6h),3.50
–
3.38(m,3h),2.99(ddd,j=13.7,8.8,5.2hz,1h),2.85
–
2.82(m,2h),2.31(ddd,j=13.2,5.8,1.9hz,1h),1.65(d,j=17.6hz,3h),1.15(dd,j=24.8,6.8hz,6h),0.93(s,9h),0.15(d,j=1.4hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ181.01,165.88,159.61,159.58,155.87,152.84,152.51,151.32,149.11,148.97,145.85,143.87,139.57,136.61,136.57,135.03,133.23,130.95,130.88,129.41,129.17,128.99,128.56,127.61,126.31,123.15,113.86,87.20,87.14,87.10,86.92,86.00,85.97,85.71,77.72,77.68,73.91,66.12,66.08,64.35,55.51,40.06,38.10,38.07,36.41,26.18,19.39,19.23,18.56,11.84,10.91,-4.50,-4.57。
31
p nmr(162mhz,丙酮-d6)δ34.58。hrms(esi-tof):针对c
59h69n10o12
psi的计算值[m h] :1169.4682,实测值:1169.4675。10.化合物(s
p
)-52
[0308]
根据通用程序i,以0.03mmol的规模用(s
p
)-43和si-31。通过ptlc(etoac/dcm:丙酮=5:5:3)纯化得到14.2mg(46%,》20:1d.r.)标题化合物(s
p
)-52。物理状态:白色无定形固体rf=0.33(etoac/dcm:丙酮=5:5:3)1h nmr(600mhz,丙酮-d6)δ9.98(s,1h),9.90(s,1h),8.24(d,j=7.5hz,1h),8.18
–
8.12(m,2h),7.68
–
7.63(m,1h),7.58
–
7.53(m,3h),7.50
–
7.47(m,2h),7.39
–
7.32(m,6h),7.28
–
7.19(m,2h),6.95
–
6.88(m,4h),6.31(dd,j=7.7,6.1hz,1h),6.23(t,j=6.2hz,1h),5.27(ddt,j=7.7,6.2,3.9hz,1h),4.54(dt,j=6.1,3.1hz,1h),4.37(q,j=3.8hz,1h),4.26(ddd,j=11.4,7.7,5.2hz,1h),4.10(ddd,j=11.4,7.0,3.6hz,1h),4.02(dt,j=5.2,3.3hz,1h),3.80(d,j=1.5hz,6h),3.55
–
3.46(m,2h),2.82
–
2.77(m,1h),2.52(dt,j=14.2,6.3hz,1h),2.31
–
2.19(m,2h),1.82(d,j=1.2hz,3h),1.61(d,j=17.7hz,3h),0.91(s,9h),0.12(d,j=1.8hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ164.20,163.77,159.77,151.25,145.56,145.05,136.53,136.40,136.34,134.60,133.62,131.05,131.02,129.47,129.13,129.09,128.80,127.81,114.09,111.10,97.08,87.79,87.60,86.33,86.29,86.00,85.97,85.76,75.89,75.85,73.08,65.57,65.53,63.41,55.55,40.85,40.83,40.75,26.14,18.50,12.60,12.20,11.25,-4.55,-4.64。
31
p nmr(162mhz,丙酮-d6)δ33.25。hrms(esi-tof):针对c
54h64
n5o
13
psi的计算值[m na] :1072.3905,实测值:1072.3926。11.化合物(s
p
)-53
[0309]
根据通用程序i,以0.03mmol的规模用(s
p
)-43和si-32。通过ptlc(etoac/dcm/丙酮=10:10:7)纯化得到27.6mg(79%,》20:1d.r.)标题化合物(s
p
)-53。物理状态:白色无定形固体rf=0.34(etoac/dcm/丙酮=5:5:3)1h nmr(600mhz,丙酮-d6)δ10.03(s,2h),8.64(s,1h),8.47(s,1h),8.22(d,j=7.5hz,1h),8.13(ddd,j=8.7,4.0,2.6hz,4h),7.65
–
7.59(m,2h),7.56
–
7.50(m,4h),7.46
–
7.41(m,2h),7.34
–
7.28(m,6h),7.27
–
7.15(m,2h),6.90
–
6.85(m,4h),6.56(t,j=6.5hz,1h),6.18(t,j=6.1hz,1h),5.21(ddt,j=8.0,6.3,4.2hz,1h),4.90(dt,j=5.9,4.0hz,1h),4.28
–
4.17(m,3h),4.14(q,j=4.3hz,1h),3.77(d,j=1.7hz,6h),3.42(dd,j=3.6,1.2hz,2h),3.06(dt,j=13.5,6.2hz,1h),2.73(ddd,j=14.1,6.3,4.4hz,1h),2.57
–
2.46(m,2h),1.55(d,j=17.8hz,3h),0.95(s,9h),0.17(s,6h)。
13
c nmr(151mhz,丙酮-d6)δ165.90,163.82,159.69,152.86,152.61,151.24,145.50,145.05,143.58,136.40,136.29,135.06,134.59,133.55,133.16,130.99,130.95,129.39,129.22,129.19,129.08,129.04,128.76,127.72,126.18,114.06,97.01,87.71,87.53,86.63,86.59,85.77,85.74,85.34,75.55,75.51,73.10,65.04,65.00,63.17,55.53,40.73,40.71,40.45,26.19,18.56,12.15,11.21,-4.51,-4.60。
31
p nmr(162mhz,丙酮-d6)δ33.13。hrms(esi-tof):针对c
61h67
n8o
12
psi的计算值[m h] :1163.4464,实测值:1163.4436。12.化合物(s
p
)-54
[0310]
根据通用程序i,以0.03mmol的规模用(s
p
)-43和si-33。通过ptlc(dcm/丙酮=2:1)纯化得到22.4mg(66%,》20:1d.r.)标题化合物(s
p
)-54。物理状态:白色无定形固体rf=0.31(dcm/丙酮=2:1)1h nmr(600mhz,丙酮-d6)δ10.02(s,2h),8.24(dd,j=24.8,7.5hz,2h),8.15(ddd,j=8.6,2.4,1.3hz,4h),7.65
–
7.61(m,2h),7.53(dd,j=8.2,7.4hz,4h),7.47(dd,j=8.5,1.3hz,2h),7.38
–
7.31(m,7h),7.25
–
7.20(m,2h),6.89(dd,j=9.0,1.9hz,4h),6.24(td,j=6.3,1.8hz,2h),5.29(ddt,j=8.0,6.3,4.2hz,1h),4.57(dt,j=6.1,4.0hz,1h),4.39(q,j=3.8hz,1h),4.34(ddd,j=11.8,7.3,4.8hz,1h),4.20(ddd,j=11.5,6.8,3.6hz,1h),4.14(q,j=4.0hz,1h),3.78(d,j=1.0hz,6h),3.51(t,j=3.4hz,2h),2.81(ddd,j=14.1,6.3,4.3hz,1h),2.57(dt,j=14.2,6.1hz,1h),2.47(ddd,j=13.5,6.3,4.1hz,1h),2.27(dt,j=13.6,6.3hz,1h),1.66(d,j=17.7hz,3h),0.91(s,9h),0.12(s,6h)。
13
c nmr(151mhz,丙酮-d6)δ163.84,163.72,159.72,159.70,145.50,145.33,145.14,136.40,136.30,134.56,133.58,131.01,130.98,129.44,129.41,129.16,129.06,128.78,127.78,114.07,114.06,97.10,87.91,87.74,87.68,86.89,86.84,85.91,85.87,75.86,75.82,72.58,65.20,65.16,63.36,55.54,42.09,40.78,40.75,26.14,18.48,12.23,11.29,-4.54,-4.67。
31
p nmr(162mhz,丙酮-d6)δ33.53。hrms(esi-tof):针对c
60h67
n6o
13
psi的计算值[m h] :1139.4351,实测值:1139.4324。13.化合物(s
p
)-55
[0311]
根据通用程序i,以0.03mmol的规模用(s
p
)-43和si-34。通过ptlc(在etoac中的10%meoh)纯化得到20.3mg(59%,》20:1d.r.)标题化合物(s
p
)-55。物理状态:白色无定形固体rf=0.33(在etoac中的10%meoh)1h nmr(600mhz,丙酮-d6)δ12.08(s,1h),11.07(s,1h),8.26(d,j=7.5hz,1h),8.20
–
8.14(m,2h),7.98(s,1h),7.70
–
7.66(m,1h),7.59(t,j=7.8hz,2h),7.52
–
7.47(m,2h),7.40
–
7.32(m,6h),7.28
–
7.23(m,1h),6.92(dd,j=9.0,2.8hz,4h),6.36(dd,j=9.0,5.7hz,1h),6.27(t,j=6.3hz,1h),5.30(tt,j=7.0,3.6hz,1h),4.67(d,j=5.2hz,1h),4.51
–
4.43(m,2h),4.40(dt,j=11.2,6.2hz,1h),4.21(t,j=5.0hz,1h),3.79(d,j=0.8hz,6h),3.53(qd,j=10.7,3.8hz,2h),3.00(ddd,j=13.7,9.0,5.2hz,1h),2.91
–
2.84(m,2h),2.54(dt,j=21.2,6.9hz,2h),2.35
–
2.28(m,2h),1.64(d,j=17.6hz,3h),1.20(d,j=6.8hz,3h),1.16(d,j=6.9hz,3h),0.94(s,9h),0.15(d,j=5.4hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ180.96,159.78,155.87,149.12,148.93,145.52,139.61,136.39,136.29,133.67,131.04,130.99,129.51,129.40,129.09,128.79,127.84,126.50,123.23,114.08,108.73,87.79,87.15,87.10,87.02,86.09,76.39,73.95,66.21,63.49,62.77,55.54,40.81,39.99,36.44,26.17,19.41,19.25,18.57,11.68,10.75,-4.53,-4.60。
31
p nmr(162mhz,丙酮-d6)δ34.67。hrms(esi-tof):针对c
58h69
n8o
13
psi的计算值[m h] :1145.4569,实测值:1145.4559。14.化合物(s
p
)-56
[0312]
根据通用程序i,以0.03mmol的规模用(s
p
)-42和si-31。通过ptlc(etoac/dcm/丙酮=5:5:3)纯化得到13.3mg(42%,》20:1d.r.)标题化合物(s
p
)-56。物理状态:白色无定形固体rf=0.19(etoac/dcm/丙酮=5:5:3)1h nmr(600mhz,丙酮-d6)δ12.03(s,1h),10.51(s,1h),10.17(s,1h),7.92(s,1h),7.59(d,j=1.3hz,1h),7.44
–
7.41(m,2h),7.32
–
7.29(m,4h),7.28
–
7.25(m,2h),7.23
–
7.18(m,1h),6.86
–
6.80(m,4h),6.34(t,j=6.8hz,1h),6.25(dd,j=7.9,5.8hz,1h),5.50(ddt,j=8.4,5.6,2.8hz,1h),4.58(dt,j=6.3,3.8hz,1h),4.33(td,j=4.7,2.7hz,1h),4.24
–
4.15(m,2h),3.98(qd,j=3.6,1.1hz,1h),3.77(s,6h),3.38(ddd,j=47.0,10.3,4.7hz,2h),3.03(ddd,j=13.9,8.0,5.9hz,1h),2.89(p,j=6.9hz,1h),2.70(ddd,j=13.9,5.9,2.9hz,1h),2.37
–
2.22(m,2h),1.92(d,j=1.2hz,3h),1.66(d,j=17.7hz,3h),1.23(dd,j=6.9,0.8hz,6h),0.91(s,9h),0.12(s,6h)。
13
c nmr(151mhz,丙酮-d6)δ179.49,163.52,158.30,158.29,154.41,149.87,147.98,147.86,144.50,136.52,135.63,135.25,135.18,129.66,129.60,127.68,127.25,126.29,120.77,112.54,109.65,85.97,84.70,84.66,84.35,84.32,84.16,82.89,75.87,
75.83,71.18,63.65,63.60,63.00,54.15,39.60,37.65,35.19,24.76,18.02,17.90,17.13,11.46,11.14,10.18,-5.91,-6.04。
31
p nmr(162mhz,丙酮-d6)δ33.50。hrms(esi-tof):针对c
52h66
n7o
13
psi的计算值[m h] :1056.4304,实测值:1056.4304。15.化合物(s
p
)-57
[0313]
根据通用程序i,以0.03mmol的规模用(s
p
)-42和si-32。通过ptlc(etoac/dcm/丙酮=1:1:1)纯化得到25.0mg(71%,》20:1d.r.)标题化合物(s
p
)-57。物理状态:白色无定形固体rf=0.26(etoac/dcm/丙酮=1:1:1)1h nmr(600mhz,丙酮-d6)δ11.97(s,1h),10.73(s,1h),10.03(s,1h),8.69(s,1h),8.51(s,1h),8.07(d,j=7.6hz,2h),7.90(s,1h),7.63(t,j=7.4hz,1h),7.55
–
7.49(m,2h),7.41
–
7.36(m,2h),7.28
–
7.20(m,6h),7.19
–
7.14(m,1h),6.79(dd,j=9.0,2.9hz,4h),6.57(t,j=6.4hz,1h),6.16(dd,j=7.5,6.0hz,1h),5.35(ddt,j=8.8,6.1,3.2hz,1h),4.95(q,j=4.9hz,1h),4.28
–
4.09(m,4h),3.74(d,j=1.7hz,6h),3.36
–
3.25(m,2h),3.12(dt,j=12.8,6.1hz,1h),2.96(ddd,j=13.6,7.6,6.0hz,1h),2.84
–
2.81(m,1h),2.64
–
2.53(m,2h),1.53(d,j=17.7hz,3h),1.19(dd,j=19.1,6.9hz,6h),0.95(s,9h),0.18(d,j=3.5hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ180.76,166.01,159.59,155.79,152.91,152.68,151.19,149.27,149.09,145.87,143.90,138.06,136.61,136.56,134.78,133.31,130.95,130.91,129.41,129.16,129.00,128.57,127.57,126.20,122.22,113.86,87.20,86.55,86.51,85.51,85.47,84.38,76.87,76.83,72.83,64.96,64.92,64.20,55.49,40.42,38.68,38.65,36.53,26.18,19.38,19.23,18.55,12.21,11.26,-4.49,-4.61。
31
p nmr(162mhz,丙酮-d6)δ33.01。hrms(esi-tof):针对c
59h69n10o12
psi的计算值[m h] :1169.4682,实测值:1169.4667。16.化合物(s
p
)-58
[0314]
根据通用程序i,以0.03mmol的规模用(s
p
)-42和si-33。通过ptlc(etoac/丙酮=5:1)纯化得到17.4mg(51%,》20:1d.r.)标题化合物(s
p
)-58。物理状态:白色无定形固体rf=0.51(etoac/丙酮=5:1)1h nmr(600mhz,丙酮-d6)δ12.04(s,1h),10.68(s,1h),10.00(s,1h),8.28(d,j=7.5hz,1h),8.10
–
8.03(m,2h),7.94(s,1h),7.66
–
7.60(m,1h),7.53(dd,j=8.3,7.3hz,2h),7.46
–
7.38(m,3h),7.30
–
7.26(m,4h),7.26
–
7.21(m,2h),7.20
–
7.15(m,1h),6.84
–
6.76(m,4h),6.30
–
6.24(m,2h),5.46(dp,j=8.6,3.0hz,1h),4.58(dt,j=6.2,4.3hz,1h),4.39
–
4.34(m,1h),4.34
–
4.24(m,2h),4.14(dt,j=4.7,3.6hz,1h),3.75(d,j=0.8hz,6h),3.46
–
3.33(m,2h),3.08(dt,j=13.7,6.7hz,1h),2.73(ddd,j=13.8,6.1,3.2hz,1h),2.52(ddd,j=13.5,6.5,4.6hz,1h),2.30(dt,j=13.6,6.1hz,1h),1.67(d,j=17.6hz,3h),1.38(s,1h),1.22(dd,j=6.9,0.8hz,6h),0.91(s,9h),0.12(d,j=0.9hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ180.72,163.78,159.61,159.60,155.87,149.33,149.10,145.85,145.44,138.09,136.60,136.53,134.50,133.64,130.98,130.92,129.46,129.09,129.01,128.58,127.60,122.17,113.87,97.20,87.91,87.24,86.77,86.72,85.76,85.73,84.39,77.25,77.22,72.27,65.00,64.96,64.37,55.49,42.23,38.89,38.86,36.54,26.13,19.35,19.31,18.49,12.29,11.35,-4.54,-4.69。
31
p nmr(162mhz,丙酮-d6)δ33.52。hrms(esi-tof):针对c
58h69
n8o
13
psi的计算值[m h] :1145.4569,实测值:1145.4556。17.化合物(s
p
)-59
[0315]
根据通用程序i,以0.03mmol的规模用(s
p
)-42和si-34。通过ptlc(etoac/丙酮/meoh=5:5:1)纯化得到13.4mg(39%,》20:1d.r.)标题化合物(s
p
)-59。物理状态:白色无定形固体rf=0.21(etoac/丙酮/meoh=5:5:1)1h nmr(600mhz,丙酮-d6)δ12.10(s,2h),10.82(s,1h),10.72(s,1h),8.06(s,1h),7.92(s,1h),7.47
–
7.42(m,2h),7.34
–
7.25(m,6h),7.24
–
7.19(m,1h),6.87
–
6.81(m,4h),6.34(t,j=6.6hz,1h),6.22(dd,j=8.3,5.7hz,1h),5.37(ddt,j=8.1,5.3,2.5hz,1h),4.75(dt,j=6.1,3.3hz,1h),4.37
–
4.23(m,3h),4.15(q,j=3.9hz,1h),3.78(s,6h),3.44
–
3.33(m,2h),3.05
–
2.87(m,3h),2.84
–
2.82(m,1h),2.68(ddd,j=14.0,5.7,2.5hz,1h),2.44(ddd,j=13.4,6.2,3.7hz,1h),1.59(d,j=17.8hz,3h),1.25(dd,j=6.8,1.7hz,6h),1.17(d,j=6.8hz,3h),1.10(d,j=6.9hz,3h),0.95(s,9h),0.18(d,j=2.9hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ180.92,180.78,159.67,156.16,155.78,149.55,149.46,149.23,149.09,145.84,138.86,137.65,136.60,136.50,131.00,130.95,129.01,128.62,127.67,122.57,122.10,113.91,87.31,86.89,86.85,85.72,85.66,85.63,84.16,77.35,77.31,73.15,65.31,65.27,64.46,55.51,40.40,38.94,38.92,36.64,36.43,26.16,19.37,19.26,19.15,18.54,12.08,11.13,-4.51,-4.65。
31
p nmr(162mhz,丙酮-d6)δ34.00。hrms(esi-tof):针对c
56h71n10o13
psi的计算值[m h] :1151.4787,实测值:1151.4779。18.化合物(r
p
)-48
[0316]
根据通用程序i,以0.03mmol的规模用(r
p
)-41和si-31。通过ptlc(etoac/丙酮=7:1)纯化得到22.1mg(69%,》20:1d.r.)标题化合物(r
p
)-48。物理状态:白色无定形固体rf=0.31(etoac/dcm/丙酮=5:5:2)1h nmr(600mhz,丙酮-d6)δ10.01(s,1h),9.95(s,1h),8.57(s,1h),8.38(s,1h),8.14(d,j=7.7hz,2h),7.69
–
7.64(m,1h),7.63(q,j=1.2hz,1h),7.58(t,j=7.6hz,2h),7.49
–
7.44(m,2h),7.36
–
7.32(m,3h),7.32
–
7.12(m,4h),6.89
–
6.80(m,4h),6.60(dd,j=7.6,6.2hz,1h),6.29(dd,j=7.7,6.1hz,1h),5.44(ddt,j=8.5,5.8,2.9hz,1h),4.60(dt,j=6.2,3.2hz,1h),4.41(td,j=4.9,2.6hz,1h),4.37
–
4.28(m,1h),4.26
–
4.19(m,1h),4.09(q,j=4.0hz,1h),3.79(s,6h),3.49
–
3.44(m,2h),3.38
–
3.32(m,1h),2.82
–
2.78(m,1h),2.37
–
2.30(m,1h),2.25(ddd,j=13.4,6.2,3.3hz,1h),1.81(d,j=1.2hz,3h),1.61(d,j=17.6hz,3h),0.92(s,9h),0.14(d,j=2.7hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ165.94,164.32,159.78,159.76,153.02,152.76,151.41,151.35,146.06,143.61,136.76,136.69,135.21,133.35,132.16,131.12,131.05,129.90,129.78,129.56,129.30,129.18,129.13,128.74,127.74,126.38,126.26,114.05,113.97,111.27,87.39,86.40,86.35,86.14,86.10,85.94,85.61,77.24,77.20,73.24,
68.46,65.79,65.75,64.49,55.65,40.81,39.81,38.61,31.32,26.26,24.64,23.78,18.64,14.46,12.63,12.30,11.45,11.35,-4.41,-4.52。
31
p nmr(162mhz,丙酮-d6)δ32.39。hrms(esi-tof):针对c
55h64
n7o
12
psi的计算值[m h] :1074.4198,实测值:1074.4189。19.化合物(r
p
)-46
[0317]
根据通用程序i,以0.03mmol的规模用(r
p
)-40和si-33。通过ptlc(etoac/丙酮=15:1)纯化得到22.0mg(70%,》20:1d.r.)标题化合物(r
p
)-46。物理状态:白色无定形固体rf=0.63(etoac/丙酮=7:1)1h nmr(600mhz,丙酮-d6)δ10.08(s,1h),8.30(d,j=7.5hz,1h),8.16
–
8.12(m,2h),7.66
–
7.62(m,1h),7.58(d,j=1.3hz,1h),7.57
–
7.52(m,2h),7.49
–
7.45(m,2h),7.41
–
7.30(m,7h),7.26
–
7.21(m,1h),6.89(dd,j=8.9,1.7hz,3h),6.37(dd,j=8.1,6.1hz,1h),6.22(t,j=6.3hz,1h),5.35(ddt,j=8.4,5.6,2.7hz,1h),4.57(dt,j=6.2,4.1hz,1h),4.38
–
4.25(m,3h),4.18(q,j=4.2hz,1h),3.77(s,6h),3.43(qd,j=10.6,3.4hz,2h),2.65
–
2.54(m,2h),2.48(ddd,j=13.5,6.3,4.2hz,1h),2.29(dt,j=13.6,6.3hz,1h),1.55(d,j=17.7hz,3h),1.43(d,j=1.2hz,3h),0.92(s,9h),0.13(d,j=1.5hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ164.17,163.70,159.78,159.76,151.28,145.70,145.42,136.44,136.32,136.21,133.57,131.03,131.00,129.42,129.17,129.03,128.77,127.81,114.05,111.29,88.05,87.71,86.86,86.82,85.39,85.35,85.06,77.07,77.04,72.72,65.43,65.39,64.24,55.55,42.01,39.61,39.58,26.14,18.51,12.18,12.14,11.23,-4.51,-4.66。
31
p nmr(162mhz,丙酮-d6)δ32.91。hrms(esi-tof):针对c
54h64
n5o
13
psi的计算值[m h] :1050.4086,实测值:1050.4081。20.化合物(r
p
)-57
[0318]
根据通用程序i,以0.03mmol的规模用(r
p
)-42和si-32。通过ptlc(etoac/丙酮=9:2)纯化得到22.1mg(63%,》20:1d.r.)标题化合物(r
p
)-57。物理状态:白色无定形固体rf=0.29(etoac/丙酮=5:1)1h nmr(600mhz,丙酮-d6)δ11.96(s,1h),10.82(s,1h),10.01(s,1h),8.67(s,1h),8.55(s,1h),8.12(d,j=7.6hz,2h),7.90(s,1h),7.63(t,j=7.4hz,1h),7.53(t,j=7.8hz,2h),7.38
–
7.33(m,2h),7.26
–
7.19(m,6h),7.18
–
7.13(m,1h),6.81
–
6.76(m,4h),6.57(t,j=6.5hz,1h),6.17(t,j=6.3hz,1h),5.56(dq,j=9.1,5.1hz,1h),4.95(dt,j=6.2,4.5hz,1h),4.38(ddd,j=11.0,7.0,3.9hz,1h),4.31(dt,j=11.2,6.2hz,1h),4.15(dq,j=16.6,4.1hz,2h),3.74(d,j=0.9hz,6h),3.29(d,j=4.3hz,2h),3.16(dt,j=12.9,6.2hz,1h),2.93
–
2.89(m,1h),2.83
–
2.79(m,1h),2.59
–
2.50(m,2h),1.43(d,j=17.7hz,3h),1.14(dd,j=8.5,6.8hz,6h),0.93(s,9h),0.16(d,j=2.5hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ180.76,166.10,159.57,159.56,156.00,152.71,151.02,148.97,145.81,144.13,138.61,136.65,136.55,134.69,133.36,130.97,130.92,130.85,129.43,129.21,128.97,128.54,128.52,127.56,125.99,122.25,113.84,87.06,86.62,86.58,85.48,84.93,84.89,84.33,75.86,75.82,73.04,65.84,65.79,63.63,55.48,40.15,38.51,36.57,26.15,19.39,19.17,18.53,12.07,11.11,-4.49,-4.64。
31
p nmr(162mhz,丙酮-d6)δ33.13。hrms(esi-tof):针对c
59h69n10o12
psi的计算值[m h] :1169.4682,实测值:1169.4670。21.化合物(r
p
)-55
[0319]
根据通用程序i,以0.03mmol的规模用(r
p
)-43和si-34。通过ptlc(在etoac中的10%meoh)纯化得到16.1mg(48%,》20:1d.r.)标题化合物(r
p
)-55。物理状态:白色无定形固体rf=0.30(在etoac中的10%meoh)1h nmr(600mhz,丙酮-d6)δ12.02(s,1h),10.86(s,1h),8.20
–
8.16(m,2h),8.14(d,j=7.6hz,1h),7.93(s,1h),7.69
–
7.63(m,1h),7.56(t,j=7.8hz,2h),7.46
–
7.41(m,2h),7.35
–
7.28(m,5h),7.22(ddt,j=7.8,6.8,1.3hz,1h),6.94
–
6.87(m,4h),6.33(dd,j=8.5,6.0hz,1h),6.15(t,j=6.3hz,1h),5.25
–
5.18(m,1h),4.79
–
4.72(m,2h),4.36
–
4.29(m,1h),4.29
–
4.18(m,3h),3.79(d,j=3.0hz,6h),3.41(m,2h),3.00(ddd,j=13.6,8.6,5.4hz,1h),2.80
–
2.74(m,3h),2.44(dt,j=13.8,6.3hz,1h),2.34(ddd,j=13.4,6.1,2.0hz,1h),1.62(d,j=17.7hz,3h),1.49
–
1.36(m,1h),1.18(d,j=6.9hz,3h),1.08(d,j=6.8hz,3h),0.97
–
0.86(m,9h),0.18(d,j=6.5hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ181.04,168.14,159.91,159.88,156.08,149.03,148.95,145.62,139.61,136.55,136.33,133.74,133.61,132.17,131.17,131.04,129.90,129.78,129.62,129.18,129.14,128.90,127.90,126.26,123.35,114.21,88.08,87.91,87.20,87.15,87.08,86.05,86.01,76.62,74.18,68.46,65.91,65.87,63.73,55.68,40.98,40.07,39.81,36.46,32.76,31.32,27.91,26.32,24.64,23.78,19.60,19.35,18.73,14.46,11.96,11.45,11.01,-4.40,-4.51。
31
p nmr(162mhz,丙酮-d6)δ33.24。hrms(esi-tof):针对c
58h69
n8o
13
psi的计算值[m h] :1145.4569,实测值:1145.4553。22.化合物(r
p
)-44
[0320]
根据通用程序i,以1.5mmol的规模用(r
p
)-40和si-31。通过硅胶柱色谱法(dcm/meoh=95:5)纯化得到1.1g(75%,》20:1d.r.)标题化合物(r
p
)-44。物理状态:白色无定形固体rf=0.38(etoac/dcm:丙酮=5:5:2)1h nmr(600mhz,丙酮-d6)δ10.02(s,1h),9.96(s,1h),7.63(q,j=1.2hz,1h),7.58(q,j=1.2hz,1h),7.52
–
7.47(m,2h),7.40
–
7.32(m,6h),7.30
–
7.24(m,1h),6.95
–
6.90(m,4h),6.39(dd,j=8.3,5.9hz,1h),6.30(dd,j=7.6,6.1hz,1h),5.33(ddt,j=8.2,5.4,2.6hz,1h),4.60(dt,j=6.2,3.2hz,1h),4.33
–
4.27(m,3h),4.24(ddd,j=11.4,6.7,4.7hz,1h),4.11
–
4.05(m,1h),3.81(s,6h),3.47
–
3.43(m,2h),2.65
–
2.53(m,2h),2.33(ddd,j=13.6,7.6,6.1hz,1h),2.25(ddd,j=13.4,6.2,3.3hz,1h),1.83(d,j=1.2hz,3h),1.55(d,j=17.6hz,3h),1.45(d,j=1.2hz,3h),0.93(s,9h),0.15(d,j=1.5hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ164.32,164.20,159.95,159.93,151.39,151.35,145.80,136.70,136.59,136.43,136.25,131.16,129.18,128.92,127.97,114.20,111.44,111.23,87.88,86.37,86.33,85.95,85.55,85.51,85.15,77.24,77.20,73.26,65.71,
65.67,64.40,55.68,40.83,39.65,39.63,26.26,18.64,12.61,12.24,11.29,-4.41,-4.52。
31
p nmr(162mhz,丙酮-d6)δ32.53。hrms(esi-tof):针对c
48h61
n4o
13
psi的计算值[m na] :983.3640,实测值:983.3632。实施例7mpo二聚体的ψ激活1.tbs脱保护以得到si-35
[0321]
将二核苷酸(s
p
)-44(290mg,0.3mmol,1.0当量)和tbaf(在thf中1.0m,0.75ml,0.75mmol,2.5当量)在thf(5ml)中的混合物在室温下搅拌12h,然后将混合物在减压下浓缩至干并且与甲苯(2x 3ml)共蒸发。通过硅胶柱色谱法(dcm/meoh=9:1)纯化得到223mg(75%,》20:1d.r.)标题化合物si-35。物理状态:白色无定形固体rf=0.43(dcm/meoh=85:15)1h nmr(600mhz,丙酮-d6)δ10.05(d,j=15.0hz,1h),9.98(d,j=14.4hz,1h),7.57(dq,j=13.1,1.2hz,2h),7.51
–
7.46(m,2h),7.39
–
7.33(m,4h),7.33
–
7.31(m,2h),7.28
–
7.23(m,1h),6.94
–
6.88(m,4h),6.36(t,j=7.1hz,1h),6.31(dd,j=7.7,6.2hz,1h),5.32(dtt,j=10.4,4.2,2.0hz,1h),4.59(s,1h),4.44
–
4.40(m,1h),4.27(q,j=3.2hz,1h),4.26
–
4.18(m,1h),4.08(ddd,j=11.1,7.3,3.3hz,1h),4.01(dt,j=6.2,3.3hz,1h),3.79(s,6h),3.46(dd,j=10.6,3.5hz,1h),3.42(dd,j=10.6,3.3hz,1h),2,2.60
–
2.55(m,2h),2.25(ddd,j=13.6,6.2,3.4hz,1h),2.19(dddd,j=13.9,7.6,6.2,1.2hz,1h),1.82(d,j=1.2hz,3h),1.58(d,j=17.7hz,3h),1.46(d,j=1.2hz,3h)。
13
c nmr(151mhz,丙酮-d6)δ164.34,164.26,164.19,159.92,159.90,151.39,151.32,145.87,136.61,136.55,136.49,136.32,131.18,131.15,129.17,128.91,127.95,114.19,111.40,111.22,87.84,86.18,86.14,85.68,85.57,85.53,85.23,76.91,76.87,71.89,71.78,66.26,66.22,64.33,55.68,40.52,40.47,39.67,39.64,12.66,12.25,12.19,11.24。
31
p nmr(162mhz,丙酮-d6)δ33.29。hrms(esi-tof):针对c
42h47
n4o
13
p的计算值[m na] :869.2775,实测值:869.2766。2.( )-clo-ψ的负载以得到60
[0322]
将si-35(170mg,0.2mmol,1.0当量)和( )-clo-ψ(120mg,0.26mmol,1.3当量)溶解于在火焰干燥的圆底烧瓶中的无水乙腈(2ml,0.1m)中。在搅拌的同时将dbu(39μl,0.26mmol,1.3当量)逐滴添加到反应混合物中。30分钟后,将粗反应混合物用添加1x pbs溶液(10ml)淬灭并且用dcm(10ml x 3)萃取。将合并的有机层用水(10ml x 2)和盐水(10ml)洗涤,经mgso4干燥,过滤并且浓缩。将残余粗产物通过硅胶柱色谱法(dcm:meoh=98:2)纯化得到168mg(77%,》20:1d.r.)标题化合物60。物理状态:浅黄色无定形固体rf=0.48(dcm:meoh=95:5)1h nmr(600mhz,丙酮-d6)δ7.60(t,j=1.2hz,1h),7.55(q,j=1.3hz,1h),7.54
–
7.48(m,2h),7.41
–
7.33(m,4h),7.31
–
7.22(m,2h),7.21
–
7.12(m,1h),6.96
–
6.90(m,4h),6.39(t,j=7.1hz,1h),6.29(dd,j=7.9,6.4hz,1h),5.34(dddt,j=19.3,11.2,5.6,2.7hz,2h),5.02(t,j=1.5hz,1h),4.98
–
4.94(m,1h),4.54(dt,j=12.8,3.3hz,1h),4.36
–
4.27(m,3h),4.18(ddd,j=9.7,7.1,2.6hz,1h),4.02
–
3.97(m,1h),3.81(s,6h),3.52
–
3.42(m,2h),3.29
–
3.23(m,1h),2.67(s,1h),2.60(dd,j=7.2,4.3hz,2h),2.51
–
2.44(m,1h),2.39
–
2.34(m,1h),2.16
–
2.09(m,1h),2.03
–
1.86(m,3h),1.84(d,j=1.2hz,3h),1.82
–
1.79(m,3h),1.71(s,3h),1.63(d,j=17.7hz,3h),1.47(d,j=1.2hz,3h)。
13
c nmr(151mhz,丙酮-d6)δ164.16,159.91,159.89,151.31,151.26,146.54,145.83,138.60,136.58,136.56,136.45,136.26,131.16,131.14,129.86,129.18,129.14,128.92,127.96,126.22,114.20,112.24,111.52,111.40,87.87,87.18,86.01,85.57,85.54,85.16,84.33,84.30,84.26,79.38,79.33,77.13,77.09,67.11,65.53,65.49,64.41,64.38,59.48,55.70,54.92,49.38,46.32,44.03,39.89,39.72,39.69,38.45,38.41,34.62,34.56,32.77,28.36,28.26,27.36,27.32,24.71,24.52,24.06,22.92,22.15,21.51,20.48,20.23,13.94,12.64,12.28,12.22,11.33。
31
p nmr(162mhz,丙酮-d6)δ101.46,33.22。hrms(esi-tof):针对c
52h62
n4o
14
p2s2na的计算值[m na] :1115.3077,实测值:1115.3088。实施例8p-手性膦:倒序负载和偶联实验
[0323]
根据通用程序c,以0.05mmol的规模从17a制备化合物11b,产率为35%并且e.r.》98:2。所有物理和光谱数据均与从8b合成11b匹配。用反应产物和源自8b的11b的标准样品的手性hplc分析(chiralpak ad-h,异丙醇/己烷=15:85,0.8ml/min,280nm)进行立体化学结局的确定。实施例9mpo:倒序负载和偶联实验1.负载
[0324]
向在氩气下的火焰干燥的50ml圆底烧瓶中装入核苷(1.0mmol,1.0当量)、12a(524.6mg,2.0mmol,2.0当量)和thf(10ml)。逐滴添加dbu(3.0mmol,3.0当量),并且将所得溶液在室温下搅拌12h。然后将反应用20ml的1x pbs溶液淬灭并且用dcm(3x 30ml)萃取。将合并的有机层用饱和nahco3水溶液(10ml)、盐水(10ml)洗涤,经na2so4干燥,过滤并且浓缩。将残余物重新溶解于thf(5ml)中。添加et3n(2当量)和mei(2当量),并且将不均匀的混合物剧烈搅拌1h。将反应用10ml水淬灭并且用etoac(3x 20ml)萃取。将合并的有机层经na2so4干燥,过滤并且浓缩。将残余物通过硅胶色谱法纯化以得到所希望的产物si-36。物理状态:白色无定形固体rf=0.3(etoac)1h nmr(600mhz,丙酮-d6)δ10.00(s,1h),7.54(q,j=1.3hz,1h),6.39
–
6.31(m,1h),4.66(dt,j=6.4,3.3hz,1h),4.36
–
4.17(m,2h),4.15
–
4.07(m,1h),2.40
–
2.22(m,5h),1.90
–
1.79(m,6h),0.94(s,9h),0.17(d,j=3.3hz,6h)。
13
c nmr(151mhz,丙酮-d6)δ164.29,164.21,151.37,136.64,136.55,132.16,129.77,111.18,86.37,86.32,85.89,85.72,73.66,73.35,68.45,65.08,64.85,64.81,40.86,40.73,39.80,31.31,27.29,26.26,24.64,23.77,18.83,18.63,18.11,14.46,12.68,12.58,12.29,12.27,11.45,-4.43,-4.45,-4.55。2.核苷3
’‑
oh的偶联:
[0325]
根据通用程序i,5
’‑
dmtr-dt-3
’‑
oh与si-36的偶联反应得到所希望的dt-dt二聚体产物。它的
31
p nmrδ32.57对应于(r
p
)dt-dt二聚体的报告
31
p位移(参见上文)。因此反应产物的磷处的立体化学被指定为r
p
。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。