识别amh的单克隆抗体及其应用
技术领域
1.本发明属于生物技术领域,具体涉及识别amh的单克隆抗体及其应用。
背景技术:
2.卵巢是女性的生殖器官,与女性生殖能力和健康状况有着密切的关系。卵巢不仅是卵泡储存、发育、成熟以至排卵的场所,也是女性重要的内分泌腺体。重要的雌性激素包括雌二醇、孕酮都主要由卵泡颗粒细胞分泌,同时也受到下丘脑和垂体分泌激素的调控。人抗缪勒氏管激素(anti-mullerian hormone,amh)就是反映卵巢储备功能的计时器,是由卵巢窦前卵泡和小窦卵泡的颗粒细胞分泌的蛋白,amh是一种同型二聚体二硫键连接的糖蛋白,分子量为140kda,活性amh蛋白复合体(amh
n,c
)分为amhn和amhc两个部分,由前体蛋白proamh经过剪切而成,人体内amh主要以proamh和amh
n,c
这两种形态存在,也会存在少量amhn和amhc的单体。
3.多囊卵巢综合征(pcos)患者会分泌更多的amh,此外,amh在一些卵巢肿瘤(如成人颗粒细胞瘤)患者中异常升高,它可以用作肿瘤标志物来衡量对治疗的反应和监测复发。amh已被证实是颗粒细胞肿瘤的一个特异循环指标,amh可比其他临床指标早11个月提示颗粒细胞肿瘤的复发。ahm的检测对于上述疾病的诊断和预后监测也有重要意义。
4.目前临床检测试剂盒能够测定amh总量,但是无法区分proamh、amh
n,c
复合物以及amhn和amhc。因此,在准确检测amh总量的同时,区分检测amhn和amhc具有潜在的临床意义。
技术实现要素:
5.本发明的目的在于提供识别amh的单克隆抗体及其应用,准确检测amh总量,区分检测amhn和amhc。
6.本发明提供了一种识别amh的单克隆抗体,包括单克隆抗体a和/或单克隆抗体b;
7.所述单克隆抗体a具有如seq id no:7所示的轻链互补决定区cdr3和如seq id no:10所示的重链互补决定区cdr3;
8.所述单克隆抗体b具有如seq id no:17所示的轻链互补决定区cdr3和如seq id no:20所示的重链互补决定区cdr3。
9.优选的,所述单克隆抗体a的轻链互补决定区cdr1包括如seq id no:5所示的氨基酸序列;所述单克隆抗体a的轻链互补决定区cdr2包括如seq id no:6所示的氨基酸序列;
10.所述单克隆抗体b的轻链互补决定区cdr1包括如seq id no:15所示的氨基酸序列;所述单克隆抗体b的轻链互补决定区cdr2包括如seq id no:16所示的氨基酸序列。
11.优选的,所述单克隆抗体a的重链互补决定区cdr1包括如seq id no:8所示的氨基酸序列;所述单克隆抗体a的重链互补决定区cdr2包括如seq id no:9所示的氨基酸序列;
12.所述单克隆抗体b的重链互补决定区cdr1包括如seq id no:18所示的氨基酸序列;所述单克隆抗体b的重链互补决定区cdr2包括如seq id no:19所示的氨基酸序列。
13.优选的,所述单克隆抗体a的轻链可变区包括如seq id no:3所示的氨基酸序列,
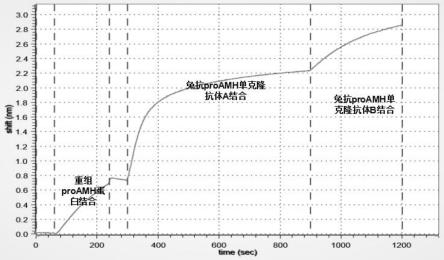
所述单克隆抗体a的重链可变区包括如seq id no:4所示的氨基酸序列;
14.所述单克隆抗体b的轻链可变区包括如seq id no:13所示的氨基酸序列,所述单克隆抗体b的重链可变区包括如seq id no:14所示的氨基酸序列。
15.优选的,所述单克隆抗体a的轻链氨基酸序列如seq id no:1所示,重链氨基酸序列如seq id no:2所示;
16.所述单克隆抗体b的轻链氨基酸序列如seq id no:11所示,重链氨基酸序列如seq id no:12所示。
17.优选的,所述单克隆抗体a和单克隆抗体b的轻链恒定区均为κ链,重链恒定区均为igg1型。
18.优选的,所述单克隆抗体a和单克隆抗体b均包括兔单克隆抗体。
19.本发明还提供了上述技术方案所述的单克隆抗体在制备酶联免疫试剂盒中的应用。
20.本发明所述单克隆抗体a和单克隆抗体b均能够识别重组人proamh蛋白,并且单克隆抗体a和重组人proamh蛋白结合后,单克隆抗体b仍旧能够结合重组人proamh蛋白,单克隆抗体a和单克隆抗体b配对使用时对于amhn、amhc单体没有交叉反应,能够区分检测proamh及amhn或amhc单体。利用本发明所述单克隆抗体对开发的酶联免疫试剂盒具有特异性高、抗干扰能力强、检测灵敏度高和稳定性好等优点,能够检测极微量水平amh蛋白,区分amhn或amhc单体。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
22.图1-1~图1-2为各单克隆抗体a、单克隆抗体b的亲和力测定结果;
23.图2为单克隆抗体a和b在人amh蛋白上面所结合的抗原识别表位鉴定结果;
24.图3为灵敏度检测结果;
25.图4为单克隆抗体a和b特异性的检测结果;
26.图5为单克隆抗体a和b稳定性的检测结果。
具体实施方式
27.本发明提供了一种识别amh的单克隆抗体,包括单克隆抗体a和/或单克隆抗体b;所述单克隆抗体a具有如seq id no:7所示的轻链互补决定区cdr3和如seq id no:10所示的重链互补决定区cdr3;所述单克隆抗体b具有如seq id no:17所示的轻链互补决定区cdr3和如seq id no:20所示的重链互补决定区cdr3。
28.在本发明中,所述单克隆抗体a的轻链互补决定区cdr1优选包括如seq id no:5所示的氨基酸序列;所述单克隆抗体a的轻链互补决定区cdr2优选包括如seq id no:6所示的氨基酸序列;所述单克隆抗体a具有如seq id no:7所示的轻链互补决定区cdr3;本发明所述单克隆抗体a的重链互补决定区cdr1优选包括如seq id no:8所示的氨基酸序列;所述单克隆抗体a的重链互补决定区cdr2优选包括如seq id no:9所示的氨基酸序列,所述单克隆抗体a具有如seq id no:10所示的重链互补决定区cdr3。本发明所述单克隆抗体a的轻链可
变区优选包括如seq id no:3所示的氨基酸序列;所述单克隆抗体a的重链可变区优选包括如seq id no:4所示的氨基酸序列;所述单克隆抗体a的轻链氨基酸序列优选如seq id no:1所示,重链氨基酸序列优选如seq id no:2所示;本发明所述单克隆抗体a的轻链恒定区优选为κ链,重链恒定区优选为igg1型。
29.本发明所述seq id no:1~seq id no:10所述的氨基酸序列具体如下:
30.seq id no:1:advvmtqtpasvsdpvggtvtikcqasqtitnflswfqqkpgqppklliyntmtlasgvpsrfkgsgsgteytltisgvecadaatyycqegdnwdevdavfgggtevvvkgdpvaptvlifppaadqvatgtvtivcvankyfpdvtvtwevdgttqttgiensktpqnsadctynlsstltltstqynshkeytckvtqgttsvvqsfnrgdc。
31.seq id no:2:qsvkesegglfkptdtltltctvsafsistygvswvrqapgngleyigwiaatgkvfyaswaksrstitrntyentvtlkmtsltvadtatyfcahviwatqtfdfwgpgtlvtvssgqpkapsvfplapccgdtpsstvtlgclvkgylpepvtvtwnsgtltngvrtfpsvrqssglyslssvvsvtsssqpvtcnvahpatntkvdktvapstcskpmcpppelpggpsvfifppkpkdtlmisrtpevtcvvvdvsqddpevqftwyinneqvrtarpplreqqfnstirvvstlpiahqdwlrgkefkckvhnkalpapiektiskargqplepkvytmgppreelssrsvsltcmingfypsdisvewekngkaednykttptvldsdgsyflysklsvptsewqrgdvftcsvmhealhnhytqksisrspgk。
32.seq id no:3:advvmtqtpasvsdpvggtvtikcqasqtitnflswfqqkpgqppklliyntmtlasgvpsrfkgsgsgteytltisgvecadaatyycqegdnwdevdavfgggtevvvk。
33.seq id no:4:qsvkesegglfkptdtltltctvsafsistygvswvrqapgngleyigwiaatgkvfyaswaksrstitrntyentvtlkmtsltvadtatyfcahviwatqtfdfwgpgtlvtvss。
34.seq id no:5:qtitnf。
35.seq id no:6:ntm。
36.seq id no:7:qegdnwdevdav。
37.seq id no:8:afsistyg。
38.seq id no:9:iaatgkv。
39.seq id no:10:ahviwatqtfdf。
40.本发明所述单克隆抗体a能够结合重组人proamh蛋白,并特异性结合于amhc表面,和抗繆勒氏管激素蛋白具有超高的亲和力,具体为6.02
×
10-9
m,能够检测细胞分泌的抗繆勒氏管激素蛋白,以及血清中抗繆勒氏管激素的水平。
41.在本发明中,所述单克隆抗体b的轻链互补决定区cdr1优选包括如seq id no:15所示的氨基酸序列;所述单克隆抗体b的轻链互补决定区cdr2优选包括如seq id no:16所示的氨基酸序列,所述单克隆抗体b具有如seq id no:17所示的轻链互补决定区cdr3;所述单克隆抗体b的重链互补决定区cdr1优选包括如seq id no:18所示的氨基酸序列;所述单克隆抗体b的重链互补决定区cdr2优选包括如seq id no:19所示的氨基酸序列;所述单克隆抗体b具有如seq id no:20所示的重链互补决定区cdr3。本发明所述单克隆抗体b的轻链可变区优选包括如seq id no:13所示的氨基酸序列;所述单克隆抗体b的重链可变区优选包括如seq id no:14所示的氨基酸序列;所述单克隆抗体b的轻链氨基酸序列优选如seq id no:11所示,重链氨基酸序列优选如seq id no:12所示;本发明所述单克隆抗体b的轻链恒定区优选为κ链,重链恒定区优选为igg1型。
42.本发明所述seq id no:11~seq id no:20所述的氨基酸序列具体如下:
43.seq id no:11:aiemtqtpssvsatvggtvtincqsseqinrflawyqqkpgqppklliywgstlasgvpsrfkgsgsgtdytltisgvkcddaatyycqsafyscstntfylfgggtevvvrgdpvaptvlifppsadlvatgtvtivcvankyfpdvtvtwevdgttqttgiensktpqnsadctynlsstltltstqynshkeytckvtqgttsvvqsfnrgdc。
44.seq id no:12:qsveesggrlvspgtpltltctvsaftlssramswvrqapgkglewigiigvtgqtyyaswakgrftisktsttvdlkitspttedtatyfcakdltydsfayayitdwygsdlwgpgtlvtvssgqpkapsvfplapccgdtpsstvtlgclvkgylpepvtvtwnsgtltngvrtfpsvrqssglyslssvvsvtsssqpvtcnvahpatntkvdktvapstcskpmcpppelpggpsvfifppkpkdtlmisrtpevtcvvvdvsqddpevqftwyinneqvrtarpplreqqfnstirvvstlpiahqdwlrgkefkckvhnkalpapiektiskargqplepkvytmgppreelssrsvsltcmingfypsdisvewekngkaednykttptvldsdgsyflysklsvptsewqrgdvftcsvmhealhnhytqksisrspgk。
45.seq id no:13:aiemtqtpssvsatvggtvtincqsseqinrflawyqqkpgqppklliywgstlasgvpsrfkgsgsgtdytltisgvkcddaatyycqsafyscstntfylfgggtevvvr。
46.seq id no:14:qsveesggrlvspgtpltltctvsaftlssramswvrqapgkglewigiigvtgqtyyaswakgrftisktsttvdlkitspttedtatyfcakdltydsfayayitdwygsdlwgpgtlvtvss。
47.seq id no:15:eqinrf。
48.seq id no:16:wgs。
49.seq id no:17:qsafyscstntfyl。
50.seq id no:18:aftlssra。
51.seq id no:19:igvtgqt。
52.seq id no:20:akdltydsfayayitdwygsdl。
53.本发明所述单克隆抗体b能够结合重组人proamh蛋白,并特异性结合于amhn表面,和抗繆勒氏管激素蛋白具有超高的亲和力,具体为4.7
×
10-11
m,能够检测细胞分泌的抗繆勒氏管激素蛋白,以及血清中抗繆勒氏管激素的水平。
54.本发明将所述单克隆抗体a和所述单克隆抗体b组合使用,所述单克隆抗体a特异性结合于amhc表面,所述单克隆抗体b特异性结合于amhn表面。所述单克隆抗体a和重组人proamh蛋白结合后,单克隆抗体b仍旧能够结合重组人proamh蛋白,单克隆抗体a和单克隆抗体b抗体对对amhn、amhc单体没有交叉反应,能够区分检测amhn或amhc。
55.本发明对所述单克隆抗体a和/或单克隆抗体b的制备方法没有严格要求,选用本领域熟知的方式即可。
56.本发明还提供了所述的单克隆抗体组合在制备酶联免疫试剂盒中的应用。利用本发明所述单克隆抗体组合开发的酶联免疫试剂盒具有特异性高、抗干扰能力强、检测灵敏度高和稳定性好等优点,能够稳定检测极微量水平amh蛋白,区分amhn或amhc。
57.为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
58.实施例1
59.amhn、amhc和proamh蛋白的制备
60.1.构建表达质粒
61.合成编码amhn、amhc和proamh的核苷酸序列(uniprot序列号:p03971),并在起始密码子atg前面加kozac序列,以ecori/bamhi酶点,分别将编码amhn、amhc和proamh的核苷酸序列构建进pcdna3.4哺乳细胞表达载体并进行测序,以上过程均由由通用生物系统(安徽)有限公司进行,显示测序正确,构建成功。
62.2.瞬时转染及蛋白表达纯化
63.expi29细胞培养及转染采用expi293表达体系,摇瓶瞬时转染expi293细胞后,第4天收获,10000rpm离心获得细胞上清;
64.使用5ml的ni-imac亲和预装柱分别分离洗脱amhn、amhc和proamh蛋白,具体的:利用ph为7.4的平衡缓冲液(20mm pb,500mm nacl和余量的去离子水。将收获的1l细胞上清分批次加入到平衡后的ni-imac亲和预装柱中。
65.以ph为7.4的缓冲液(20mm pb,500mm nacl,30mm imizazole和余量的去离子水)冲洗5个柱体积,收集洗脱液,得到amhn蛋白;
66.以ph为7.4的缓冲液(20mm pb,500mm nacl,50mm imizazole和余量的去离子水)冲洗5个柱体积,收集洗脱液,得到amhc蛋白;
67.以ph为7.4的缓冲液(20mm pb,500mm nacl,500mm imizazole和余量的去离子水)冲洗5个柱体积,收集洗脱液,得到proamh蛋白;
68.实施例2
69.人amh兔单克隆抗体的制备
70.1)动物免疫:分别以实施例1得到的amhc、amhn蛋白为免疫原,免疫新西兰大白兔;每只大白兔免疫200μg,首次免疫将免疫原与等量的完全弗式佐剂混合制成乳化剂,腹部及背部皮下多点注射,间隔3周取100μg免疫原与等量的不完全弗式佐剂混合制成乳化剂,腹部及背部皮下多点注射,加强免疫两次,三次免疫后用elisa方法测定血清效价,取血清效价高的兔子,用200μg免疫原就皮下多点注射加强免疫一次,三天后取脾脏,分离脾脏细胞。
71.2)b淋巴细胞分选:参见专利201910125091.4《从脾脏细胞中高效分离单个抗原特异性b淋巴细胞的方法》。
72.3)编码兔单克隆抗体基因的克隆
73.培养后的b细胞上清用抗原包被的elisa来鉴定阳性克隆。阳性克隆的细胞收集裂解后提取rna,利用总rna提取试剂盒反转录成cdna(65℃反转录5min)。采用pcr方法,将天然配对的兔单克隆抗体轻重链可变区基因(vh和vl)从对应阳性克隆的cdna中被扩增出来,并经测序确定序列。
74.4)单克隆抗体的生产和纯化:
75.将步骤3)兔单克隆抗体重链、轻链基因分别装载在pcdn3.4表达载体上,将质粒转染293f细胞;转染72~96小时获得培养上清中含有重组的识别人proamh蛋白的兔单克隆抗体。使用protein a亲和凝胶树脂从转染后的培养基上清中纯化出多株重组的识别人proamh蛋白的兔单克隆抗体,依次命名为单克隆抗体a和单克隆抗体b,抗体鉴定后分装,于-20℃低温保存备用。
76.实施例3
77.抗体的筛选和鉴定
78.1)利用美国通用电气(ge)公司的biacore 3000生物分子相互作用分析仪对实施
例2各单克隆抗体的亲和力进行精确测定,其中使用所选定单克隆抗体a和单克隆抗体b的浓度分别为37nm,并将其固定在cm5芯片上,然后分别针对单克隆抗体a和单克隆抗体b用100nm、50nm、33.33nm、11.11nm和3nm五个浓度的重组人proamh蛋白去结合,获得亲和力曲线,最终通过曲线拟合和计算,获得单克隆抗体a和b的亲和力,亲和力曲线如图1-1~1-2所示,拟合结果如表1所述。
79.表1各单克隆抗体的亲和力测定结果
80.单克隆抗体koff(1/s)kon(1/ms)亲和(m)a1.17
×
10-4
1.95
×
1046.02
×
10-9
b7.01
×
10-6
1.49
×
1054.7
×
10-11
81.注:koff(dissociation rate constant)表示分子之间的解离速率常数,代表分子间解离时的快慢;kon(association rate constant)为分子间的结合速率常数,代表分子间结合时的快慢。
82.根据表1和图1-1~图1-2可以看出,单克隆抗体a的亲和力为6.02
×
10-9
m,单克隆抗体b的亲和力为4.7
×
10-11
m。
83.2)使用probe life公司的gator生物分子相互作用分析仪来对实施例2所获得的兔抗人proamh单克隆抗体a和b在人amh蛋白上面所结合的抗原识别表位进行鉴定,其中使用到的材料为his-tag重组人proamh蛋白,使用浓度为50nm,使用所获得单克隆抗体a和b的浓度分别为600nm和300nm,鉴定结果如图2所示。
84.根据图2可以看出,通过分析单克隆抗体a和b之间的配对数据可知,在单克隆抗体a和重组人proamh蛋白结合后,单克隆抗体b仍旧能够结合重组人proamh蛋白,单克隆抗体a和b结合在proamh蛋白表面不同的部位,且相互不干扰。检测单克隆抗体a轻链恒定区为κ链,重链恒定区为igg1型,轻链上互补决定区cdr1,cdr2,cdr3的氨基酸序列分别如seq id no:5,seq id no:6和seq id no:7所示,重链上互补决定区cdr1,cdr2,cdr3的氨基酸序列分别如seq id no:8,seq id no:9和seq id no:10所示,轻链可变区氨基酸序列如seq id no:3所示,重链可变区氨基酸序列如seq id no:4所示,轻链氨基酸序列为seq id no:1,重链氨基酸序列为seq id no:2所示;单克隆抗体b轻链恒定区为κ链,重链恒定区为igg1型,轻链上互补决定区cdr1,cdr2,cdr3的氨基酸序列分别如seq id no:15,seq id no:16和seq id no:17所示,重链上互补决定区cdr1,cdr2,cdr3的氨基酸序列分别如seq id no:18,seq id no:19和seq id no:20所示,轻链可变区氨基酸序列如seq id no:13所示,重链可变区氨基酸序列如seq id no:14所示,轻链氨基酸序列为seq id no:11,重链氨基酸序列为seq id no:12所示。
85.实施例4
86.1.基于抗人amh蛋白兔单克隆抗体a和b建立双抗夹心法酶联免疫检测方法,具体如下:
87.1)使用碳酸盐缓冲液(ph9.4,0.05m)将捕获抗体,抗人proamh蛋白兔单克隆抗体a进行包被,4度孵育过夜;洗涤液洗板;
88.2)用含有5%牛血清白蛋白、0.05%tween-20的磷酸盐缓冲液(ph7.2,0.05m)进行封闭;
89.3)将标准样品(重组人proamh蛋白)或待测样品用含1%牛血清白蛋白、0.05%
tween-20的磷酸盐缓冲液稀释后,加入到酶标板中,常温条件孵育1小时,然后用洗涤液洗板;
90.4)将用含1%牛血清白蛋白、0.05%tween-20的磷酸盐缓冲液稀释的经生物素标记的抗人proamh蛋白兔单克隆抗体b加入到板中,常温条件孵育1小时,然后用洗涤液洗板;
91.5)加入用含1%牛血清白蛋白、0.05%tween-20的磷酸盐缓冲液稀释的亲和素标记的辣根过氧化物酶(hrp),常温条件孵育1小时,然后用洗涤液洗板;
92.6)加入tmb显色液,常温显色10分钟,加草酸终止显色,然后分别于450nm和630nm下测定吸光值(od450减去od630为校正后的吸光值)。
93.2.灵敏度检测
94.按照步骤1方法进行检测,选择抗人proamh蛋白兔单克隆抗体a的包被浓度为2μg/ml,生物标记的抗人proamh蛋白兔单克隆抗体b的检测浓度为1μg/ml;步骤3)加入的样品为重组人proamh蛋白,样品用含1%牛血清白蛋白、0.05%tween-20的磷酸盐缓冲液稀释,浓度分别为10000ng/ml,5000ng/ml,2500ng/ml,1250ng/ml,625ng/ml,312.5ng/ml,156.25ng/ml,78.125ng/ml,39.062ng/ml,19.531ng/ml,9.765ng/ml,4.882ng/ml,2.441ng/ml,1.220ng/ml,0.610ng/ml,0ng/ml,加样量为25μl/孔,以人proamh蛋白浓度的对数值(log10)为横坐标,吸光值的校正值(od450-od630)为纵坐标作图,建立标准曲线,以吸光值平均值大于三倍空白对照吸光值平均值的最低人amh蛋白浓度为双抗夹心法酶联免疫检测方法的灵敏度,结果如图3所示,根据图3可以看出,单克隆抗体a和b建立双抗夹心法酶联免疫检测方法的检测灵敏度达到1ng/ml。
95.3.单克隆抗体a和b特异性的检测
96.按照步骤1方法进行检测,分别以proamh蛋白、amhn蛋白、amhc蛋白为标准蛋白进行检测,其中所有标准品蛋白(proamh蛋白、amhn蛋白、amhc蛋白)的浓度均为1μg/ml,结果如图4所示,根据图4可以看出,基于抗人proamh蛋白兔单克隆抗体a和b的双抗夹心法酶联免疫检测方法对于amhn、amhc蛋白均无任何交叉反应,抗人proamh蛋白兔单克隆抗体a和b对于人proamh蛋白具有高度的特异性。
97.4.单克隆抗体a和b热稳定的检测
98.将抗人proamh蛋白兔单克隆抗体a和b被放置于37度保温箱中,并于第3、6、9和14天分别取样,然后按照步骤1方法进行检测,来对人proamh标准品蛋白进行检测,根据所比较经37度处理不同时间的抗体样品和未经37度处理的抗体样品,所建立的标准曲线,来比较抗人proamh蛋白兔单克隆抗体a和b热稳定性,结果如图5。根据图5可以看出,本发明中的两株兔抗amh单克隆抗体在37℃下处理14天后,对检测灵敏度和线性范围的影响小于1%,证明抗人amh蛋白兔单克隆抗体a和b热稳定性强。
99.本发明提供的单克隆抗体a和单克隆抗体b均对抗繆勒氏管激素蛋白具有超高的亲和力,单克隆抗体a特异性检测amhn,单克隆抗体b特异性检测amhc,且对于amhn或amhc单体没有交叉反应,利用本发明所述单克隆抗体组合开发的酶联免疫试剂盒具有特异性高、抗干扰能力强、检测灵敏度高和稳定性好等优点。
100.尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。