1.本发明提供了用于制备透明且弯曲的基质细胞组织(stromal cell tissue)及其脱细胞形式的新方法。还提供了新的组织。
背景技术:
2.创造角膜基质等效物,特别是使用天然成分,代表着组织工程中的多种挑战。合适的角膜基质替代物需要是生物相容的、机械稳定的和光学透明的,并且能够在组织移植前后抵抗收缩和蛋白质降解(ghezzi等人,2015)。
3.越来越多地认识到,细胞环境的3d几何形状是细胞行为的重要调节因素(li等人,2014),因此可用作组织再生中的潜在指导诱因。具体地,基底曲率已经被认为是发育过程中调节细胞和组织表型的重要因素(he和jiang,2017)。在人类中,在发育约8周时,神经嵴细胞迁移穿过晶状体和角膜的假定结构,分化为角膜上皮和基质成纤维细胞(ligwale,2015)。后者继续合成基质胶原蛋白和富含蛋白聚糖的细胞外基质、以及晶体蛋白,晶体蛋白是维持组织透明度和折射所必需的一类结构蛋白(hassell和birk,2010)。已经显示,在此期间角膜的粘弹性性质和物理环境的变化在角膜曲率的发展中起重要作用,这反过来又影响参与器官发生的细胞迁移和分化的精确模式(mcmonnie和boneham,2007;ligwale,2015)。
4.迄今为止,一些最有希望的角膜基质替代物以基于胶原蛋白的支架材料为代表,一旦交联,其显示可用作长期角膜基质替代物。通常,这些材料以自顶向下(top-down)的方式使用,具有水凝胶形成的初始步骤,接着是细胞接种,以及接种后的基质重排(fagerholm等人,2014;lewis等人,2013;rafat等人,2008)。
5.最近,角膜基质组织已经通过自底向上(bottom-up)的策略在体外被工程化,使用细胞自身产生细胞外基质,从而重建天然角膜的明确定义的3d微结构(wu等人,2014;gouveia等人,2016)。在此上下文中,组织模板显示出优于其它方法的几个优点,由于其可以引导细胞对齐,进而产生它们自己对齐的胶原蛋白基质,以及用最少的操作促进容易的组织恢复。然而,目前的自底向上的模板系统仍然很大程度上局限于产生缺少角膜天然曲率的平面组织,因此对于移植到眼睛上并非最佳。
6.重建几何弯曲的基质组织等效物的策略仍然很少,一般基于:(i)产生基于胶原蛋白的弯曲凝胶,随后向其加入细胞(li等人,2003;li等人,2017);或(ii)施加机械应变以诱导含有角膜基质细胞的平面胶原蛋白水凝胶的球形曲率(zhang等人,2017)。然而,这些方法并不能使组织功能改进,并且依赖于非生理条件(即动物来源的血清补充)。
7.明显需要改进的方法来生产具有改进功能的角膜基质等效物,特别是在生理条件下使用天然成分。
技术实现要素:
8.发明人先前已经证明,曲率在基质胶原蛋白的高度有组织的各向异性排列中起重
要作用,这又有助于人角膜的机械性质和光学性质(gouveia等人,2017)。gouveia及同事表明了表面曲率诱导人角膜基质细胞迁移、对齐并随后沉积高度有组织的细胞外基质(ecm),以形成单片角膜状基质组织等效物。
9.本发明人进一步研究了基质细胞感知表面曲率宏观变化的能力。令人惊奇的是,发明人现在已经发现,除了能够感知和适应与其直接接触的表面的曲率(在2d中),基质细胞也能够感知和适应它们不直接接触的弯曲表面(在3d中)。
10.因此,本发明基于以下令人惊奇的发现:即使基质细胞被包封或截留(entrap,包埋)在随后顺应弯曲表面的3d水凝胶中,基质细胞也能感知其宏观环境并适应于该环境。令人惊奇的是,基质细胞仍然能够感知表面的曲率并迁移、对齐并随后在3d水凝胶结构内沉积高度有组织的细胞外基质(ecm)。此外,细胞可以迁移、对齐并随后沉积高度有组织的ecm,而不需要对齐诱导基底(alignment-inducing substrate)(如例如丝素蛋白膜)。有利的是,所得3d组织保持了以前对于单片细胞观察到的透明性质(gouveia等人,2017)。
11.根据本发明的组织更厚、更致密和更有组织,同时保持了对于单片弯曲基质组织观察到的透明度。此类性质使得本文所述的透明且弯曲的基质细胞组织具有更大的结构稳定性。有利的是,这些组织更加坚固,因此在移植过程中更容易处理。
12.本文提供了一种制备透明且弯曲的基质细胞组织的方法,该基质细胞组织具有至少50μm的最小厚度,该方法包括:
13.i)将基质细胞包封或截留在水凝胶中,其中该水凝胶包含细胞粘附基序;
14.ii)将水凝胶转移到弯曲表面上;以及
15.iii)在合适的细胞培养条件下将水凝胶保持在弯曲表面上至少24小时,以产生具有至少0.5的最小可见光透射率值的弯曲的基质细胞组织,其中弯曲表面具有约0.04至约0.5mm-1
的曲率。
16.合适地,细胞粘附基序可以是细胞外基质蛋白序列或它们的片段或变体。
17.合适地,细胞外基质蛋白可以选自由以下组成的组中:纤连蛋白、胶原蛋白、光蛋白聚糖、核心蛋白聚糖、层粘连蛋白、玻连蛋白、纤维蛋白原、弹性蛋白、二聚糖、肝素、肌腱蛋白和骨桥蛋白。
18.合适地,细胞粘附基序可以是:
19.a)纤连蛋白片段,包含选自以下的氨基酸序列或由其组成:rgd(seq id no:1)、rgds(seq id no:5)、phsrn(seq id no:6)、ldvp(seq id no:7)、wqpprari(seq id no:8)、igd(seq id no:9)、redv(seq id no:10)和idap(seq id no:11)或它们的变体;
20.b)胶原蛋白片段,包含选自以下的氨基酸序列或由其组成:kttks(seq id no:2)、gtpgpqgiagqrgvv(seq id no:12)、groger(seq id no:13)、glkgen(seq id no:14)、gfoger(seq id no:15)和mnyysns(seq id no:16)或其变体;或
21.c)光蛋白聚糖片段,包含选自以下的氨基酸序列或由其组成:evtln(seq id no:17)、eldlsynklk(seq id no:18)和yealrvanevtln(seq id no:3);或
22.d)层粘连蛋白片段,包含选自以下的氨基酸序列或由其组成:yigsr(seq id no:19),ikvav(seq id no:20)、ccrrikvavwlc(seq id no:21)和rgd。
23.合适地,水凝胶可以具有约0.25至约0.50g/cm3的总凝胶密度。
24.合适地,水凝胶可以具有约70%至约90%的凝胶水合度。
25.合适地,水凝胶可以具有约0.5至约35
×
106pa的凝胶刚度。
26.合适地,水凝胶可以具有约0.1-12.0mm的厚度。
27.合适地,水凝胶可以具有约0.07至约0.3g/cm3的胶原蛋白密度。
28.合适地,水凝胶可以为薄层或盘的形式。
29.合适地,细胞培养条件可以包括将水凝胶保留在细胞培养基中的弯曲表面上。
30.合适地,细胞培养基可以是杜尔贝科改良伊格尔培养基(dmem)、ham’s f12或dmem-f12。
31.合适地,细胞培养基可以是无血清的。
32.合适地,细胞培养基可以包含维甲酸(retinoic acid)。
33.合适地,细胞培养基可以包含溶液中的kttks脂肽。
34.合适地,弯曲表面可以是聚苯乙烯、聚乙烯、聚对苯二甲酸乙二醇酯、聚乳酸、聚碳酸酯、丙烯腈-丁二烯-苯乙烯、琼脂糖、水凝胶或玻璃表面。可选地,玻璃表面可以是硼硅酸盐玻璃表面。
35.合适地,可以在合适的细胞培养条件下将水凝胶保持在弯曲表面上至少4天。
36.合适地,基质细胞可以是角膜基质细胞。
37.合适地,角膜基质细胞可以是角膜成纤维细胞。
38.合适地,基质细胞可以是人的。
39.合适地,基质细胞可以来自第一物种,并且细胞外基质蛋白序列可以来自第二物种。
40.合适地,可以使用3d生物打印产生包含细胞粘附基序的水凝胶。
41.合适地,基质细胞组织随后可被脱细胞。
42.还提供了通过本文所述的方法可获得或获得的基质细胞组织。
43.还提供了通过本文所述的方法可获得或获得的脱细胞的组织。
44.还提供了一种基质细胞组织,具有至少50μm的最小厚度、至少0.5的最小可见光透射率值以及约0.04至约0.5mm-1
的曲率,其中该组织包含:
45.a)来自第一物种的基质细胞,以及
46.b)痕量的:
47.(i)来自第二物种的细胞外基质蛋白序列或它们的片段或变体;或
48.(ii)合成的细胞外基质蛋白序列或它们的片段或变体。
49.合适地,第一物种可以是人,并且第二物种可以是非人。
50.合适地,基质细胞可以是角膜基质细胞。
51.合适地,角膜基质细胞可以是角膜成纤维细胞。
52.还提供了一种脱细胞的组织,具有至少50μm的最小厚度、至少0.5的最小可见光透射率值以及约0.04至约0.5mm-1
的曲率,其中该组织包含:
53.a)来自第一物种的细胞外基质蛋白序列,以及
54.b)痕量的:
55.(i)来自第二物种的细胞外基质蛋白序列或它们的片段或变体;或
56.(ii)合成的细胞外基质蛋白序列或它们的片段或变体。
57.合适地,第一物种可以是人,并且第二物种可以是非人。
58.合适地,该组织可以具有约0.1至12.0mm的厚度。
59.合适地,来自第二物种的细胞外基质蛋白序列或合成的细胞外基质蛋白可以是胶原蛋白。
60.本文描述了组织用于在疗法中使用。可选地,该组织是复合组织。
61.本文描述了组织用于在角膜移植术中使用。可选地,该组织是复合组织。
62.本文还提供了用于研究角膜疾病或病症的体外模型,其包括本发明的组织。
63.还提供了本发明的组织作为体外角膜模型的用途。合适地,角膜模型可以是角膜疾病或病症模型。
64.还提供了一种筛选用于治疗角膜疾病或病症的试剂的方法,包括:
65.a)提供本发明的组织;
66.b)将所述组织暴露于试剂;以及
67.c)确定该试剂是否对该组织具有治疗作用。
68.还提供了一种筛选任何分子或化学试剂的方法,包括:
69.a)提供本发明的组织;
70.b)将所述组织暴露于试剂;以及
71.c)确定该试剂是否对该组织具有毒性作用或影响细胞生长或生存力、或改变组织中的基因表达。
72.在本说明书的整个描述和权利要求中,词语“包括”和“包含”及其变体是指“包括但不限于”,并且它们不旨在(并且不)排除其它部分、添加剂、组分、整数或步骤。
73.在本说明书的整个描述和权利要求中,单数涵盖复数,除非上下文另有要求。特别地,在使用不确定的制品的情况下,除非上下文另有要求,否则说明书应理解为考虑到多个以及单个。
74.结合本发明的特定方面、实施方案或实施例所述的特征、整数、特性、化合物、化学部分或基团应理解为可应用于本文所述的任何其它方面、实施方案或实施例,除非与其不相容。
75.下面将更详细地描述本发明的各个方面。
附图说明
76.下面将参考附图进一步描述本发明的实施方案,其中:
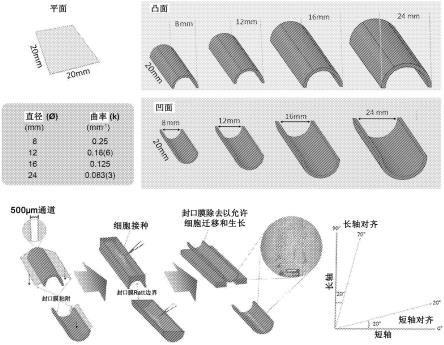
77.图1示出了本研究中使用的细胞培养表面和方法的示意图。定制的凸面和凹面的不同尺寸(12、16和24mm,分别对应于k=0.25、0.16(6),0.125和0.083(3)mm-1
,其中,括号指的是重复的数字)用于确定能够影响角膜基质细胞行为的中尺度表面曲率的最优和限制范围。将正常的玻璃盖片用作平面对照。角膜基质细胞的初始接种被限定为沿着表面的线长(纵)轴的500μm宽用封口膜硅酮包裹。该明确限定的接种点(小图(inset))允许更好地监视细胞迁移模式,以用于随后的对齐(即如果在任一短轴的长度的20
°
内对齐)。
78.图2示出了生长在不同培养表面上的角膜基质细胞的明场和荧光显微镜。平面和凸面上的细胞呈现更多的拉伸形态,而凹面上的细胞迁移更快,高达(k=0.125mm-1
)的曲率。凹弯曲表面和凸弯曲表面都促进细胞对齐。比例尺,100μm。
79.图3示出了在不同培养表面上生长的角膜基质细胞的迁移率。平面和凸面上的细
胞表现出相似的迁移率,与曲率程度无关,而凹面上的细胞高达(k=0.125mm-1
),迁移更快。数据对应于3个实验的平均值
±
s.d.(n=3;n.s.,不显著)。
80.图4示出了不同培养表面上的角膜基质细胞对齐。在凸面和凹面上的细胞朝向曲率的长(纵)和小(弧形)轴呈现高度的细胞对齐,高达mm(k=0.125mm-1
)且最优为(k=0.16(6)mm-1
)。在(k=0.083(3)mm-1
)的弯曲表面上生长的细胞显示出与平面对照上的细胞相似的取向。数据对应于3个实验的平均值
±
s.d.(n=3;n.s.,不显著)。
81.图5示出了在不同培养表面上生长的角膜基质细胞的细胞核圆度。平面和凸面上的细胞呈现相似的较低细胞核圆度,与曲率程度无关,而凹面上的细胞高达(k=0.125mm-1
),显示出比平面对照显著更高的细胞核圆度。数据对应于3个实验的平均值
±
s.d.(n=3;n.s.,不显著)。
82.图6示出了由平面、凹面和凸面培养表面促进的细胞效果的总结。
83.图7示出了包封角膜基质细胞的3d胶原蛋白凝胶上的产生和曲率诱导。a)用于在培养期间过程中实现和培养弯曲的3d胶原蛋白凝胶(顶部)的策略示意图以及此类凝胶的代表性照片(底部面板)。b)在无血清培养基中培养7天的弯曲的3d胶原蛋白凝胶的代表性照片。比例尺:500μm。
84.图8示出了在3d胶原蛋白凝胶中诱导的曲率对角膜基质细胞表型的影响。提取弯曲或平面3d胶原蛋白凝胶内细胞的mrna,并分析角膜a)细胞外基质、b)成纤维细胞、c)肌成纤维细胞和d)蛋白酶/基质转换的基因标志物的相对表达。由三个独立的实验(n=3)获得数据(平均值
±
sd),使用学生t-检验(student’s t-test)(*对应于p《0.05)进行统计学分析。
85.图9示出了曲率对包封角膜基质细胞的3d胶原蛋白凝胶的光学性质的影响。报告a)透射率、b)反射率、c)降低的散射系数和d)吸收系数的曲线图表明,与平面胶原蛋白凝胶(描记线)相比,在培养物中诱导的曲率将胶原蛋白凝胶透明度提高到与猪角膜的透明度(黑线)相当的水平。由两个独立的实验(n=2)获得数据(平均值
±
sd),使用学生t检验进行统计学分析(*、**、***和****分别对应于p《0.05、0.01、0.001和0.0001)。
86.此处提到的专利、科学和技术文献确立了本领域技术人员在提交时可获得的知识。在此引用的公开专利、公开的和未决的专利申请以及其它出版物的全部公开内容在此引入作为参考,如同每个专利都被明确地和单独地指出引入作为参考一样。在任何不一致的情况下,本公开内容将占优势。
87.下面将更详细地描述本发明的各个方面。
具体实施方式
88.制备组织的方法
89.本文所述的方法用于制备组织。本文所述的组织也可称作结缔组织。因此,术语“组织”和“结缔组织”在本文可互换使用。
90.术语“结缔组织”涵盖包含基质细胞的结缔组织(即“基质细胞结缔组织”)以及随后已经脱细胞的结缔组织(即“脱细胞的结缔组织”)。因此,术语“脱细胞的组织”和“脱细胞
的结缔组织”在本文可互换使用。脱细胞的组织也可称作“脱细胞的基质细胞组织”、“组织支架”、“结缔组织支架”或“细胞外基质支架”。
91.结缔组织是连续的网络或结构,其将组织结合成它们的器官形状,向它们提供血管和导管,并适当地将器官固定在体腔内以及将器官相互结合。典型地,结缔组织包含细胞外基质内的细胞(其中细胞外基质还包含纤维蛋白和非纤维基底质)。当结缔组织被脱细胞时,细胞被除去,但大部分细胞外基质组分(即纤维蛋白和非纤维基底质)被保留。包含细胞的结缔组织及其脱细胞形式对于本领域技术人员来说是可容易确定的。
92.细胞外基质的“基底质”是无定形凝胶状材料。它是一种透明、无色、粘稠的流体,充满纤维和细胞之间的空间。它由蛋白聚糖和细胞粘附蛋白组成,细胞粘附蛋白允许结缔组织充当细胞粘附到基质上的胶水。基底质用作物质在毛细血管和细胞之间迁移的分子筛。在角膜内,它还影响整个组织的折射率。
93.本文所述的方法可包括制备组织和随后使组织脱细胞。术语“脱细胞”是指从组织中去除细胞同时保留由细胞产生的细胞外基质的组分和结构的方法。因此,本文别处所述的脱细胞的组织是指其中细胞被去除且其中由细胞产生的细胞外基质的组分和结构被保留的组织。合适的脱细胞方法在本领域中是众所周知的。作为非限制性实例,合适的脱细胞方法包括物理方法、酶方法、或化学方法、或组合方法。
94.本文所述的方法使用基质细胞来制备组织。术语“基质细胞”是指器官的结缔组织细胞,例如眼睛的结缔组织细胞,例如角膜的结缔组织、或此类细胞的前体(例如,间充质基质细胞)。基质细胞支持器官实质细胞的功能。
95.本文所述的方法当与角膜基质细胞联合使用时特别有用,因为它们导致产生光学透明的坚固的角膜基质细胞组织。角膜主要由三种细胞类型组成:上皮细胞、基质细胞和内皮细胞,虽然也可以存在其它细胞类型(例如,朗格汉斯(langerhans)和树突骨髓来源的免疫细胞、三叉神经树突、施旺(schwann)细胞和组织细胞)。
96.因此,在一个实例中,基质细胞是角膜基质细胞。合适的角膜基质细胞的实例包括角膜成纤维细胞。角膜成纤维细胞,也称为角膜角化细胞,是角膜基质的间充质来源的细胞。术语“角膜成纤维细胞”和“角膜角化细胞”在本文中可互换使用。角膜基质细胞也可以是角膜干细胞,其优选包含角膜缘上皮细胞,即干细胞和分化细胞的异种混合物,其从角膜边缘的角膜缘可获得。在另一个实例中,基质细胞包括分化或未分化形式的基质祖细胞如角膜成纤维细胞(角质细胞)。优选地,从外周角膜缘或从角膜缘环获得这些角膜成纤维细胞。在另一个实例中,基质细胞是骨髓细胞。基质细胞也可以来源于ipsc。
97.角膜基质是致密结缔组织。它是角膜的最厚层,并且位于角膜上皮和角膜内皮之间。它构成了角膜的绝大部分,并且主要由2μm厚的、平坦的胶原薄片(200-250层)组成,该薄片平行于角膜表面取向并在角膜缘处与巩膜连续。在薄片之间存在被称为角膜细胞的极平坦的修饰成纤维细胞。角膜细胞(成纤维细胞)分泌细胞外基质,该细胞外基质包括胶原蛋白和蛋白聚糖,并且还产生晶体蛋白以保持角膜透明度。当在常规截面中观察时,这些细胞呈星形,具有薄的细胞质延伸,含有显著少的有区别的细胞器。然而,前缘部分显示出丰富的细胞器以及其表面上的新穿孔网络。角膜细胞通过间隙连接与它们的相邻细胞连接,并且从上皮盘旋到内皮以螺旋状排列。
98.本文所述的方法特别适用于使用角膜基质细胞(如角膜成纤维细胞)制备透明且
弯曲的角膜基质细胞组织。
99.在本文中,“透明”组织是最小可见光透射率值为至少0.5的组织。如本文所用,可见光是指波长为约380nm至约750nm的光,即人眼可见的光。
100.当可见光移动通过透明(或半透明)材料时,它可以被透射、吸收或反射。本文所用的术语“可见光透射率”是指入射可见光一直通过组织的比例,即从其进入的一侧到其出射的一侧的入射可见光的比例。例如,最小可见光透射率值为至少0.5的组织是这样的组织,其中至少50%的入射可见光透射通过该组织以在另一侧出射。通常,在组织的整个厚度上测量可见光透射率。
101.本文所述的透明组织是最小可见光透射率值为至少0.5的组织。在一个实例中,该组织的最小可见光透射率值为至少0.6。在另一个实例中,该组织的最小可见光透射率值为至少0.7。在另一个实例中,该组织的最小可见光透射率值为至少0.8。在又一个实例中,该组织的最小可见光透射率值为至少0.9。
102.用于测量可见光透射率的方法在本领域中是众所周知的。例如,可以将样品放置在分光光度计内,介于特定波长的入射光和检测器之间。特定波长的入射光与被检测光之间的强度差可用于计算样品的透射率值。
103.本文所述方法中使用的基质细胞可以直接从活的动物中获得,从动物中分离基质细胞的方法在本领域中是众所周知的。
104.基质细胞可以是人的或来自任何其它合适的物种(本文也称作“第一物种”)。细胞可以是真核的(例如,动物、植物和真菌细胞)或原核的(例如,细菌细胞)。细胞可以是动物细胞。例如,细胞是哺乳动物的(例如,人或小鼠的)。仅仅作为实例,人细胞可以是人基质祖细胞。在另一个实例中,细胞是鱼细胞。合适细胞类型的非限制性实例包括人细胞,或来自非人灵长类、啮齿动物(例如大鼠和小鼠)、兔、马、狗、猫、羊、牛、猪、鱼或鸟的细胞。
105.用于本文所述方法中的基质细胞可以包含同种或异种细胞类型。例如,基质细胞可以是来自不同物种的基质细胞的混合物。例如,基质细胞可以包括人基质细胞和另外的基质细胞,例如,来自非人灵长类、啮齿动物(例如大鼠和小鼠)、兔、马、狗、猫、羊、牛、猪、鱼或鸟中的一种或多种。可替代地,基质细胞可以是非人灵长类动物、啮齿动物(例如大鼠和小鼠)、兔、马、狗、猫、羊、牛、猪、鱼或鸟中的任意两种或更多种的基质细胞的混合物。
106.本文提供的方法用于制备包含弯曲表面的组织,该弯曲表面的曲率为约0.04至约0.5mm-1
。例如,本文提供的方法用于制备包含弯曲表面的组织,该弯曲表面的曲率为约0.1至约0.4mm-1
,例如约0.2至约0.3mm-1
。用于测量表面曲率的标准方法在本领域中是众所周知的。为了避免不确定,本文所述的曲率是使用以下方法测量的:k(曲率,以mm-1
计)=1/r(曲率半径,以mm计)。有利地,包含曲率为约0.04至约0.5mm-1
(例如约0.2至0.3mm-1
)的弯曲表面的组织模仿人角膜表面的天然曲率。因此,这些组织对于角膜治疗特别有用,这将在本文别处详细讨论。
107.本文提供的方法用于制备最小厚度为至少约50μm的组织。例如,最小厚度可以是至少约0.1mm、至少约0.5mm或至少约1mm。如将清楚的,本文所述的组织“厚度”是外组织表面与内组织表面之间的距离,其中内组织表面和外组织表面都沿相同取向弯曲。
108.在一个实例中,组织的厚度为约50μm至约12.0mm。例如,厚度可以为约0.1至12.0mm,诸如约0.1至约10mm、约0.5至约5mm、或约1.0至约2.0mm。这些单独的组织(所述厚
度)中的每一个都可以被堆叠以产生所得厚度为约10至约50mm的复合组织。
109.组织可以具有任何合适的体积。组织的体积例如可以为约0.2至约100ml,例如约0.2至约50ml,诸如约0.2至约25ml、或约0.2至约10ml。在一些实例中,组织的体积为约0.4至约5ml、约0.4至约4ml、或约0.4至约3ml。
110.可以堆叠通过本文所述方法产生的单个基质细胞组织,以产生组织复合材料。本文所用的术语“堆叠”是指将两个或更多个单独的组织层叠放置。例如,通过本文所述方法产生的基质细胞组织可以堆叠在通过所述方法产生的第二基质细胞组织上,以形成组织复合材料。用于堆叠组织的合适方法在本领域中是众所周知的。
111.在一个实例中,可以堆叠通过本文所述方法产生的1,000个或更多个单独的基质细胞组织,以产生组织复合材料。
112.在另一个实例中,可以堆叠2,000个或更多个单独的基质细胞组织,以产生组织复合材料。例如,可以堆叠3,000个或更多个、或4,000个或更多个单独的基质细胞组织,以产生组织复合材料。在另一个实例中,可以堆叠通过本文所述方法产生的5,000个或更多个单独的基质细胞组织,以产生组织复合材料。
113.正如本领域技术人员所清楚的,可以堆叠任何合适数量的单独的基质细胞组织,以产生具有特定厚度的组织复合材料。本文别处描述了合适的组织复合材料厚度。
114.本文所用的“组织复合材料”是指由两个或更多个元件产生的组织,其中每个元件包括单独的组织和/或细胞层。例如,如本文别处所述,可通过堆叠由本文提供的方法产生的两个或更多个(例如,1,000个或更多个、2,000个或更多个、3,000个或更多个、4,000个或更多个、5,000个或更多个)单独的基质细胞组织来产生组织复合材料。在一个替代实例中,组织复合材料可以由内皮或上皮细胞层和单独的基质细胞组织形成。
115.通过本文所述方法产生的组织复合材料可以具有任何合适的厚度。例如,组织复合材料的厚度可以根据其预期用途而不同(即用于角膜移植术的组织复合材料的厚度与用于心脏外科手术的组织复合材料的厚度可能不同)。组织复合材料的合适厚度对于本领域技术人员来说是可容易确定的。
116.在一个非限制性实例中,通过本文所述方法产生的组织复合材料的厚度为约10mm至约100mm。
117.在一个特定实例中,通过本文所述方法产生的组织复合材料的厚度为约10mm至约50mm。
118.在另一个实例中,通过本文所述方法产生的组织复合材料的厚度可以为约15mm至约45mm。在另一个实例中,组织复合材料的厚度可以为约20mm至约40mm、或约25mm至约35mm。
119.本文所述的方法包括将基质细胞包封或截留在水凝胶中的步骤。本文所用的术语“水凝胶”是指由交联聚合物制成的结构。水凝胶可以不溶于水,但是可能够吸收和保留大量的水,以形成稳定的、通常柔软且柔韧的结构。水凝胶可以包含内部孔隙。
120.在一个实例中,水凝胶是可逆交联的水凝胶。本文所用的“可逆交联的水凝胶”是指通过可逆交联形成的水凝胶(即,交联可以逆转,使得水凝胶恢复为溶液)。交联的逆转使得截留或包封的细胞/组织能够从水凝胶中释放(例如,在它们的使用点)。可逆交联的水凝胶的实例在本领域中是众所周知的。因此,本领域技术人员可以容易地确定合适的水凝胶。
121.本文所称的水凝胶可以包含具有交联或网状结构或基质的形成水凝胶的聚合物;以及间质液。术语“形成水凝胶的聚合物”是指能够在合适条件下形成交联或网状结构或基质的聚合物,其中间质液和截留或包封的基质细胞可以保留在此类结构或基质中。根据聚合物的性质,可以通过任何合适的方法引发交联或网状结构或基质的形成。
122.聚合物通常是亲水性聚合物。它能在水性液体中膨胀。在一个实例中,形成水凝胶的聚合物是胶原蛋白。
123.如本文所用,术语“胶原蛋白”是指结缔组织的主要蛋白,其具有高拉伸强度,并且发现于大多数多细胞生物体中。胶原蛋白是主要的纤维蛋白,并且它也是基底膜中的非原纤蛋白。它含有丰富的甘氨酸、脯氨酸、羟脯氨酸和羟赖氨酸。在本公开的上下文中,胶原蛋白包括任何一种或多种类型的胶原蛋白,无论是否天然,例如去端肽胶原蛋白(atelocollagen)、不溶性胶原蛋白、胶原蛋白纤维、可溶性胶原蛋白和酸溶性胶原蛋白。目前存在至少28种类型的鉴定胶原蛋白,所有这些类型都涵盖在本文中。胶原蛋白可以是例如纤维状(fibrillar)或非纤维状(non-fibrillar)。原纤胶原蛋白可以是例如i型、ii型、iii型、v型、xi型。非原纤胶原蛋白可以是例如具有中断的三股螺旋的原纤相关胶原蛋白(ix、xii、xiv、xix、xxi型)、短链胶原蛋白(viii、x型)、基底膜胶原蛋白(iv型)、multiplexin(xv、xviii)、具有中断的三股螺旋的膜相关胶原蛋白(xiii、xvii型)以及vi型和vii型胶原蛋白。在一个实例中,胶原蛋白可以是i型胶原蛋白或iii型胶原蛋白。
124.通常,胶原蛋白水凝胶包含胶原蛋白原纤维的基质,胶原蛋白原纤维在间质液以及截留或包封的基质细胞/组织周围形成连续支架。可通过加入稀碱来诱导溶解的胶原蛋白聚合/聚集,以形成交联的胶原蛋白原纤维的胶凝网络。原纤维的胶凝网络支持溶解的胶原蛋白纤维的原始体积,保留间质液。产生此类胶原蛋白凝胶的一般方法在本领域中是众所周知的(例如wo2006/003442、wo2007/060459和wo2009/004351)。
125.通常,用于胶原蛋白水凝胶中的胶原蛋白可以是任何形成原纤维的胶原蛋白。形成原纤维的胶原蛋白的实例是i型、ii型、iii型、v型、vi型、ix型和xi型。水凝胶可以包含所有一种类型的胶原蛋白或不同类型的胶原蛋白的混合物。优选地,水凝胶包含i型胶原蛋白或v型胶原蛋白(其负责保持角膜的透明度),或者由i型胶原蛋白或v型胶原蛋白组成。在一些实例中,水凝胶完全或基本上由胶原蛋白原纤维形成,即胶原蛋白原纤维是水凝胶中唯一或基本上唯一的聚合物。在其它实例中,胶原蛋白水凝胶可另外包含其它天然存在的聚合物,例如丝、纤连蛋白、弹性蛋白、甲壳素和/或纤维素。通常,非胶原蛋白的天然存在的聚合物的量将小于水凝胶(重量/重量)的5%,优选小于4%、3%、2%或1%。类似量的非天然聚合物也可以存在于水凝胶中,例如,肽两亲物、聚内酯、聚交酯、多聚糖(polyglycone)、聚己内酯和/或磷酸盐玻璃。
126.在一些实例中,形成水凝胶的聚合物是海藻酸或金属离子的海藻酸盐。优选地,金属是1族金属(例如,海藻酸锂、海藻酸钠或海藻酸钾)或2族金属(例如,海藻酸钙、海藻酸镁、海藻酸钡或海藻酸锶)。优选地,聚合物是海藻酸钙或海藻酸钠或海藻酸锶,最优选海藻酸钙。
127.在一些实例中,形成水凝胶的聚合物是海藻酸盐。在其它实例中,形成水凝胶的聚合物是海藻酸盐与另一种形成水凝胶的聚合物的混合物。在一些实例中,海藻酸盐被修饰(例如用肽)。
128.在其它实例中,形成水凝胶的聚合物是交联的丙烯酸基(例如聚丙烯酰胺)聚合物。
129.在又一个实例中,形成水凝胶的聚合物是可交联的纤维素衍生物、羟基醚聚合物(例如泊洛沙姆)、果胶或天然树胶。
130.在一些实例中,水凝胶在生理温度下不是热可逆的,即在0-40℃的温度下不能获得水凝胶的溶胶-凝胶转变。
131.可以通过改变水凝胶中形成水凝胶的聚合物的浓度来改变水凝胶的结构。该结构影响水凝胶中细胞的生存力、细胞分化速率以及凝胶的坚固性及其处理性能。形成水凝胶的聚合物在水凝胶中的优选浓度为0.2-5%(聚合物重量相对于间质液体积),并且包括例如0.2-0.4%、0.4-0.5%、0.5-0.7%、0.7-1.1%、1.1-1.3%、1.3-2.2%、2.2-2.6%、2.6-3.0%、3.0-3.5%、3.5-4.0%、4.0-4.5%和4.5-5.0%(或其任意组合,例如0.2-0.5%、0.2-0.7%等)。
132.在一个实例中,非胶凝的水凝胶溶液的粘度高达500mpa.s,可选地,非胶凝的水凝胶溶液的粘度为5至200mpa.s(优选5至100mpa.s)。
133.在其它实例中,形成水凝胶的聚合物在水凝胶中的浓度高于0.25%、0.3%、0.4%、0.5%或0.6%。在其它实例中,形成水凝胶的聚合物在水凝胶中的浓度低于5%、4.5%、4.0%、3.5%、3.0%、2.6%、2.4%、1.5%、1.4%、1.3%或1.2%。在一些优选实例中,形成水凝胶的聚合物在水凝胶中的浓度为约0.3%、约0.6%或约1.2%。在一些特定实例中,形成水凝胶的聚合物在水凝胶中的浓度为约1%。在一些特定实例中,由约1%的海藻酸钠或约1%的海藻酸钙或约1.2%的海藻酸锶形成水凝胶。
134.在一些实例中,使用包含多价金属阳离子的化合物,例如使用氯化钙,促进水凝胶的胶凝。特别地,氯化钙(例如50-200mm氯化钙,优选75-120mm氯化钙)可用于胶凝海藻酸盐水凝胶。
135.在其它实例中,使用可替换的金属氯化物,例如氯化镁或氯化钡或氯化锶。可替代地,可以使用其它多价阳离子,例如la
3
或铁
3
。
136.在一些实例中,凝胶(优选海藻酸盐凝胶)还包含co2。
137.在一些实例中,水凝胶包含交联的海藻酸盐。例如,水凝胶可以包含交联的海藻酸钙、海藻酸锶、海藻酸钡、海藻酸镁或海藻酸钠。在一个特定实例中,交联的海藻酸盐是约0.5%(w/v)至约5.0%(w/v)的海藻酸钙。例如,交联的海藻酸盐可以是约1.0%(w/v)至约2.5%(w/v)、约1.5%(w/v)至约2.0%(w/v)的海藻酸钙或它们之间的任何范围。
138.间质液可以是聚合物可溶解在其中并且聚合物可在其中胶凝的任何液体。通常,它将是水性液体,例如水性缓冲液或细胞培养基。液体可以含有抗生素。优选地,水凝胶是灭菌的,即无菌的。优选地,该液体不含动物来源的产品,例如胎牛血清或牛血清白蛋白。
139.已经发现,可以通过在凝胶内包封增强结构、支架或网,来增强水凝胶的机械强度。它可以是合成的或天然的聚合物。优选地,增强结构、支架或网是可生物降解的。增强结构、支架或网可以是例如包含聚乳酸(例如聚-(乳酸-共-己内酯)(placl))、胶原蛋白或尼龙的聚合物。
140.用于本文所述方法中的水凝胶通常为薄层或盘的形式。对于水凝胶盘,优选的水凝胶聚合物浓度约为1.2%,这是由于该浓度提供了增加的结构稳定性。优选地,水凝胶(例
如盘)是未压缩的水凝胶,即它没有经受轴向压缩力。
141.在一些实例中,水凝胶可以通过针挤出形成薄层或盘。换言之,水凝胶可以通过3d打印产生。3d打印的标准方法在本领域中是众所周知的。
142.用于本文所述方法中的水凝胶通常具有约0.25至约0.50g/cm3的总凝胶密度。例如,可以考虑约0.35至约0.48g/cm3的总凝胶密度,或者可以使用约0.38至约0.45g/cm3的总凝胶密度。也可以选择该范围内的最佳值,例如约0.4g/cm3。
143.用于本文所述方法中的水凝胶通常具有约70%至约90%的凝胶水合度。例如,可以考虑约73%至约86%的凝胶水合度,或者可以使用约75%至约80%的凝胶水合度。也可以选择该范围内的最佳值,例如约76%。
144.用于本文所述方法中的水凝胶通常具有约0.5至约35
×
106pa的凝胶刚度。例如,可以考虑约0.5至约20
×
106pa的凝胶刚度,或者可以使用约0.5至约10
×
106pa的凝胶刚度。例如,可以考虑约0.5至约5.5
×
106pa的凝胶刚度,或者可以使用约2至约5
×
106pa的凝胶刚度。也可以选择该范围内的最佳值,例如约4
×
106pa。
145.用于本文所述方法中的水凝胶通常具有约0.1-12.0mm的厚度。例如,水凝胶厚度可以为约0.1至约10mm、约0.5至约5mm、或约1.0至约2.0mm。
146.水凝胶可以具有任何合适的体积。例如,水凝胶的体积可以为约0.2至约100ml,例如约0.2至约50ml,诸如约0.2至约25ml、或约0.2至约10ml。在一些实例中,水凝胶的体积为约0.4至约5ml、约0.4至约4ml、或约0.4至约3ml。
147.如本文别处详细描述的,用于本文所述方法中的水凝胶可以包含胶原蛋白。胶原蛋白水凝胶通常具有约0.07至约0.3g/cm3的胶原蛋白密度。例如,可以考虑约0.07至约0.2g/cm3的胶原蛋白密度,或可以使用约0.08至约0.15g/cm3的胶原蛋白密度。也可以选择该范围内的最佳值,例如约0.1g/cm3。
148.在胶原蛋白水凝胶的上下文中,可以考虑约0.35至约0.48g/cm3的总凝胶密度(例如,约0.38至约0.45g/cm3,优选约0.4g/cm3)。另外,可以考虑约73%至约86%的凝胶水合度(例如,约75%至约80%,优选约76%)。此外,可以考虑约0.5至约5.5
×
106pa的凝胶刚度(例如,约2至约5
×
106pa,优选约4
×
106pa)。
149.本文所述的方法包括将基质细胞(例如,角膜基质细胞如角膜细胞)包封或截留在水凝胶中。如本文所用,术语“截留”是指基质细胞被水凝胶物理捕获/捕捉,使得它们不从水凝胶中释放(例如,除非水凝胶中的交联被逆转,使得水凝胶恢复为溶液)。基质细胞可以借助于通过水凝胶完全包围而被截留,或者它们可以借助于大部分(但不是全部)细胞被水凝胶包围而被截留。在本文中,“大部分”是指至少约50%、至少约60%、至少约70%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%或至少约99%的细胞(以体积计)被水凝胶包围。在本文中,“完全包围”是指约100%的细胞(以体积计)被水凝胶包围。术语“包封”是指将基质细胞封闭在水凝胶中。当细胞完全被水凝胶包围时,它被水凝胶“包封”。“包封”的细胞也是“截留”的细胞。相反,“截留”的细胞可以是或可以不是被水凝胶“包封的”。
150.水凝胶可以与基质细胞分开形成,使得细胞被加入到已经胶凝的水凝胶(即其中已经发生交联的水凝胶)中。可替代地,可以在基质细胞的存在下形成水凝胶。用于制备水凝胶以及将细胞截留或包封在此类水凝胶中的方法在本领域中是众所周知的。
151.例如,可以通过在基质细胞存在下使形成水凝胶的聚合物聚合来形成水凝胶,以形成水凝胶,其中基质细胞被截留或包封在水凝胶本身中。用于使形成水凝胶的聚合物聚合以形成水凝胶的方法在本领域中是众所周知的,并且取决于所用的聚合物而不同。例如,可由化学试剂如氯化钙诱导海藻酸盐溶液的聚合(以形成海藻酸盐水凝胶)。如本文所用,术语“聚合”和“胶凝”水凝胶可互换使用,是指形成水凝胶的聚合物从液体到水凝胶的状态变化。水凝胶可以在合适的细胞相容性条件下胶凝,即在对细胞的生存力没有不利影响或没有明显不利影响的条件下。在一些实例中,在cgmp(现行良好操作规范)条件下制备水凝胶。
152.可以在由水凝胶的组成聚合物形成水凝胶的过程中,将基质细胞接种到水凝胶中,例如通过在聚合/聚集之前或在形成水凝胶的聚合物交联之前将细胞与单体的溶液混合。因此,水凝胶可以在合适的细胞相容性条件下胶凝,即在对细胞的生存力没有不利影响或没有明显不利影响的条件下。因此,本文所述的方法可包括在基质细胞存在下形成水凝胶的步骤,使得基质细胞被包封或截留在水凝胶中。本发明还提供了一种用于制备水凝胶的方法,该方法包括使形成水凝胶的聚合物胶凝(例如使用选自由镁盐和钙盐组成的组中的2族金属盐)的步骤。
153.在一些实例中,存在于水凝胶中的细胞的浓度为1
×
10
3-1
×
106个细胞/ml水凝胶溶液。通常,细胞的浓度小于5
×
105,优选0.1
×
10
5-5
×
105个细胞/ml水凝胶,更优选0.5
×
10
5-2.3
×
105个细胞/ml水凝胶,并且最优选1.0
×
10
5-2.0
×
105个细胞/ml水凝胶。
154.在一个实例中,可以使用可逆交联的水凝胶。可逆交联的水凝胶是可从其中释放活细胞的水凝胶。因此,该方法可以包括在基质细胞组织制备之后解离水凝胶以释放基质细胞组织的步骤。换言之,在制备基质细胞组织之后,水凝胶能够被解离,从而使得释放或去除先前保留在其中的所有或基本上所有细胞。水凝胶在合适的细胞相容条件下解离,即在对细胞没有不利影响或没有明显不利影响的条件下。优选地,水凝胶通过化学分解或溶解而解离。
155.本文所述方法的水凝胶包含细胞粘附基序。如本文所用,术语“细胞粘附基序”涵盖参与细胞粘附的细胞外基质蛋白基序及其片段和变体。因此,术语“细胞粘附基序”涵盖细胞外基质蛋白序列或它们的片段或变体,其中片段或变体参与细胞粘附。如本文所用,术语“参与细胞粘附”是指促进细胞粘附,和/或直接粘附或结合到细胞上,例如,经由显示在细胞表面上的细胞表面分子(诸如整联蛋白)结合到细胞上。细胞粘附基序通常能够直接粘附到细胞上,例如,经由显示在细胞表面上的细胞表面分子(诸如整联蛋白)结合到细胞上。
156.在一个实例中,细胞粘附基序是细胞外基质蛋白序列或它们的片段或变体。
157.许多参与细胞粘附的细胞外基质蛋白在本领域中是已知的。例如,参与细胞粘附的细胞外基质蛋白可以选自由以下组成的组中:纤连蛋白、胶原蛋白(诸如i、ii、iii和v型)、光蛋白聚糖、核心蛋白聚糖、层粘连蛋白、玻连蛋白、明胶、壳聚糖、纤维蛋白、纤维蛋白原、弹性蛋白、二聚糖、肝素、肌腱蛋白和骨桥蛋白。此外,细胞粘附基序可以是衍生自任何上述蛋白质的任何肽,包括含有上述分子的结合结构域的衍生物或片段。示例性基序包括整联蛋白结合基序,诸如rgd(seq id no:1-精氨酸-甘氨酸-天冬氨酸)基序、yigsr(seq id no:19-酪氨酸-异亮氨酸-甘氨酸-丝氨酸-精氨酸)基序、以及为功能等效物的相关肽。例如,已知含有rgd(seq id no:1)序列(例如rgd(seq id no:5))和wqpprari(seq id no:8)
序列的肽引导内皮细胞的扩散和迁移特性,并且已经显示yigsr(seq id no:19)肽促进上皮细胞连接。可通过筛选肽文库对特定细胞类型的粘附性和选择性来确定氨基酸序列是否为细胞粘附基序。也可以通过噬菌体展示技术凭经验开发细胞粘附基序。
158.水凝胶可以包含参与细胞粘附的细胞外基质蛋白序列(即细胞外基质蛋白序列;也称作基序)。可替代地,水凝胶可以包含此类序列的片段或变体,其中该片段或变体也参与细胞粘附。此类序列(包括其片段和变体)在本文中被称作“细胞粘附基序”。
159.水凝胶可以包含一种或多种不同的细胞粘附基序。例如,水凝胶可以包含2、3、4、5或更多种不同的细胞粘附基序。在一个实例中,其中水凝胶包含多于一种细胞粘附基序。
160.细胞粘附基序可以是参与细胞粘附的细胞外基质蛋白或它们的片段或变体(即参与细胞粘附的细胞外基质蛋白;细胞外基质蛋白的变体,其中该变体参与细胞粘附;细胞外基质蛋白的片段,其中该片段参与细胞粘附;或细胞外基质蛋白片段的变体,其中该片段的变体参与细胞粘附)。
161.细胞粘附基序可以是纤连蛋白片段,其包括选自由以下组成的组中的氨基酸序列或由其组成:rgd(seq id no:1)、rgds(seq id no:5)、phsrn(seq id no:6)、ldvp(seq id no:7)、wqpprari(seq id no:8)、igd(seq id no:9)、redv(seq id no:10)和idap(seq id no:11)或它们的变体。该变体可以是保守氨基酸置换变体,例如,与选自由rgd(seq id no:1)、rgds(seq id no:5)、phsrn(seq id no:6)、ldvp(seq id no:7)、wqpprari(seq id no:8)、igd(seq id no:9)、redv(seq id no:10)和idap(seq id no:11)组成的组中的氨基酸序列相比,具有一个、两个或三个保守氨基酸置换。
162.可替代地,细胞粘附基序可以是胶原蛋白片段,其包括选自由以下组成的组中的氨基酸序列或由其组成:kttks(seq id no:2)、gtpgpqgiagqrgvv(seq id no:12)、groger(seq id no:13)、glkgen(seq id no:14)、gfoger(seq id no:15)和mnyysns(seq id no:16)或它们的变体。该变体可以是保守氨基酸置换变体,例如,与选自由kttks(seq id no:2)、gtpgpqgiagqrgvv(seq id no:12)、groger(seq id no:13)、glkgen(seq id no:14)、gfoger(seq id no:15)和mnyysns(seq id no:16)组成的组中的氨基酸序列相比,具有一个、两个或三个保守氨基酸置换。
163.可替代地,细胞粘附基序可以是光蛋白聚糖片段,其包括选自由以下组成的组中的氨基酸序列或由其组成:evtln(seq id no:17)、eldlsynklk(seq id no:18)和yealrvanevtln(seq id no:3)或它们的变体。该变体可以是保守氨基酸置换变体,例如,与选自由evtln(seq id no:17)、eldlsynklk(seq id no:18)和yealrvanevtln(seq id no:3)组成的组中的氨基酸序列相比,具有一个、两个或三个保守氨基酸置换。
164.可替代地,细胞粘附基序可以是层粘连蛋白片段,其包括选自由以下组成的组中的氨基酸序列或由其组成:yigsr(seq id no:19)、ikvav(seq id no:20)、ccrrikvavwlc(seq id no:21)和rgd(seq id no:1)或它们的变体。该变体可以是保守氨基酸置换变体,例如,与选自由yigsr(seq id no:19)、ikvav(seq id no:20)、ccrrikvavwlc(seq id no:21)和rgd(seq id no:1)组成的组中的氨基酸序列相比,具有一个、两个或三个保守氨基酸置换。
165.细胞粘附基序可以是天然的或合成的。合成的氨基酸序列可以类似于天然存在的氨基酸序列,例如肽。仅仅作为实施例,合成的细胞粘附基序可以选自由以下组成的组中:
v2a2e2、hsnglplgggseeeaaavvv(seq id no:22)、hsnglplgggseeeaaavvv(k)(seq id no:23)和hsnglplgggseeeaaavvvk(seq id no:4)或它们的变体。
166.细胞粘附蛋白的片段或变体可基本上保留相应野生型肽的生物学功能。本文所用的术语“生物学功能”可以是指促进细胞结合的能力。“基本上保留”生物学功能是指片段或变体保留至少约50%、60%、75%、85%、90%、95%、97%、98%、99%或更多的野生型肽的生物学功能,以例如促进细胞结合。确实,片段或变体可以具有比野生型肽更高的生物学功能。片段或变体可以具有野生型肽的生物学功能的110%、120%、130%、140%、150%、160%、170%、180%、190%、200%或更多,以例如促进细胞结合。
167.本文所述的细胞外基质蛋白(或其片段或变体)可以来自任何合适的物种。在一些实例中,存在于水凝胶中的细胞外基质蛋白(或其片段或变体)来自与被截留或包封在水凝胶中的基质细胞(其中基质细胞来自第一物种)不同的物种(也称作“第二物种”)。换言之,水凝胶中基质细胞的物种可以不同于水凝胶中存在的细胞粘附基序(或相应的细胞外基质蛋白)的物种。这导致包含来自第一物种的基质细胞以及来自第二(不同的)物种的痕量细胞外基质蛋白序列(或其片段或变体)的组织。
168.换言之,本文所述的组织可以包含来自第一物种的基质细胞以及来自第二物种的痕量细胞外基质蛋白序列(或其片段或变体),其中第一物种与第二物种不相同。此类组织的实例包括具有人基质细胞和痕量猪细胞外基质蛋白序列(或其片段或变体)的组织,反之亦然(即具有猪基质细胞和痕量人细胞外基质蛋白序列(或其片段或变体)的组织)。本领域技术人员可以容易地确定细胞与细胞外基质蛋白序列(或其片段或变体)的其它合适组合。
169.本文提供的方法通常导致包含痕量细胞外基质蛋白序列的组织,所述细胞外基质蛋白序列最初是用于截留或包封基质细胞的水凝胶的一部分。如本文所用,“痕量”细胞外基质蛋白序列是指使用标准方法如免疫组织化学、免疫印迹/elisa、质谱、酶学等的可检测水平的细胞外基质蛋白序列。
170.如本文别处所述,通过本发明的方法制备的基质细胞组织也可以脱细胞。与上述基质细胞组织类似,脱细胞的组织也可以包含来自至少两种不同物种的组分。例如,当使用具有细胞外基质蛋白序列(或其片段或变体)的水凝胶产生基质细胞组织(在脱细胞之前)时,该细胞外基质蛋白序列(或其片段或变体)来自与被截留或包封在水凝胶中的基质细胞(其来自“第一物种”)不同的物种(也称作“第二物种”),脱细胞的组织将保留来自第一物种的细胞外基质蛋白(由“第一物种”基质细胞产生)并且还保留来自第二(不同的)物种的痕量细胞外基质蛋白序列(或其片段或变体)。
171.换言之,本文所述的脱细胞的组织可以包含来自第一物种的细胞外基质蛋白以及来自第二物种的痕量细胞外基质蛋白序列(或其片段或变体),其中第一物种与第二物种不相同。此类组织的实例包括具有人细胞外基质蛋白和痕量猪细胞外基质蛋白序列(或其片段或变体)的组织,反之亦然(即具有猪细胞外基质蛋白和痕量人细胞外基质蛋白序列(或其片段或变体)的组织。本领域技术人员可以容易地确定细胞和细胞外基质蛋白序列(或其片段或变体)的其它合适组合。
172.本文所述的细胞外基质蛋白序列(或其片段或变体)也可以是合成的。例如,存在于水凝胶中的细胞外基质蛋白序列(或其片段或变体)可以是合成的。这导致包含基质细胞和痕量的合成细胞外基质蛋白序列(或其片段或变体)的组织。
173.换言之,本文所述的组织可以包含人基质细胞和痕量的合成细胞外基质蛋白序列(或其片段或变体)。本领域技术人员可以容易地确定细胞和细胞外基质蛋白序列(或其片段或变体)的其它合适组合。
174.如本文所用,术语“合成的”是指通过化学合成制备的产品,尤其是模仿天然产品。因此,该术语用于描述不是由细胞产生的细胞外基质蛋白序列(或其片段或变体)。本文中也将合成的氨基酸序列称作合成肽。用于制备合成肽的方法在本领域中是众所周知的。非限制性实例包括液相肽合成方法或固相肽合成方法,例如根据merrifield的固相肽合成方法、t-boc固相肽合成、fmoc固相肽合成、基于bop(苯并三唑-1-基-氧基-三-(二甲氨基)-六氟磷酸鏻)的固相肽合成等。
175.肽可以包括天然氨基酸和/或合成氨基酸。“天然氨基酸”是由遗传密码定义的、通过正常肽键相互连接的常规氨基酸。相反,“合成氨基酸”是并非由遗传密码定义的常规氨基酸的氨基酸。合成氨基酸的实例在文献中是众所周知的。
176.肽可以被修饰。换言之,肽可以包含通过天然方法(如翻译后成熟方法)或通过化学方法修饰的氨基酸,其为本领域技术人员所熟知的。文献中详细描述了此类修饰。这些修饰可以出现在肽中的任何地方:在肽骨架中、在氨基酸链中、或在羧基或氨基末端。肽修饰的非限制性实例包括乙酰化、酰化、adp-核糖基化、酰胺化、核苷酸或核苷酸衍生物的共价固定、脂质或脂质衍生物的共价固定、磷脂酰肌醇的共价固定、共价或非共价交联、环化、二硫键形成、脱甲基化、糖基化(包括聚乙二醇化)、羟基化、碘化、甲基化、肉豆蔻酰化、氧化、蛋白水解法、磷酸化、异戊烯化、外消旋化、硒酰化(seneloylation)、硫酸化、氨基酸加成(amino acid addition)(诸如精氨酰化)或泛素化。文献中详细描述了此类修饰。因此,术语“肽”、“多肽”、“蛋白”可以包括例如脂肽、脂蛋白、糖肽、糖蛋白等。作为另一个非限制性实例,肽可以在泛素化后支化,或者是带有或不带有分支的环状的。这种类型的修饰可以是本领域技术人员所熟知的天然或合成翻译后处理的结果。
177.如本文别处所述,本文所述的基质细胞组织也可以是脱细胞的。与上述组织类似,脱细胞的组织也可以包含合成组分。例如,当使用具有合成细胞外基质蛋白序列(或其片段或变体)的水凝胶产生基质细胞组织(在脱细胞之前)时,脱细胞的组织将保留痕量的合成细胞外基质蛋白序列(或其片段或变体)。
178.换言之,本文所述的脱细胞的组织可以包含人细胞外基质蛋白和痕量的合成细胞外基质蛋白序列(或其片段或变体)。本领域技术人员可以容易地确定细胞和细胞外基质蛋白序列(或其片段或变体)的其它合适组合。
179.本文所述的方法包括将包含截留或包封的基质细胞的水凝胶转移/放置到弯曲表面上的步骤。可替代地或附加地,本文所述的方法可以包括例如通过挤压水凝胶覆盖弯曲表面(例如使用3d打印)在弯曲表面上产生水凝胶。
180.当该方法涉及将包含截留或包封的基质细胞的水凝胶转移/放置到弯曲表面上时,水凝胶可以在被转移到弯曲表面上之前聚合/胶凝。合适地,水凝胶可以在被转移/放置到弯曲表面上之前在基本平坦的表面上聚合/胶凝。在该上下文中,“基本平坦的表面”是曲率(在凹面或凸面方向)小于0.03mm-1
、小于0.02mm-1
或小于0.01mm-1
或更少的表面。合适地,基本平坦的表面是平坦的表面(即没有曲率)。
181.可以将水凝胶保留在基本平坦的表面上持续至少水凝胶聚合/胶凝所需的时间长
度。应当理解,水凝胶聚合/胶凝所需的时间长度将取决于例如形成水凝胶的聚合物的性质和/或环境条件(诸如温度和/或湿度)。仅作为实例,可以将水凝胶保留在基本平坦的表面上约30分钟或更长、约1小时或更长、约2小时或更长、约3小时或更长、约4小时或更长、约6小时或更长、约9小时或更长、约12小时或更长、约24小时或更长、约48小时或更长、约72小时或更长。然而,本发明人认为,曲率对被截留或包封在水凝胶中的细胞的影响可能与将水凝胶保留在基本平坦的表面上的时间长度无关。因此,可以将水凝胶保留在基本平坦的表面上几天、几周、几个月或更长时间。
182.术语“将水凝胶保留在弯曲表面上”是指在本文所述方法的步骤iii)的持续时间内将水凝胶保持在弯曲表面上。
183.弯曲表面可以是任何合适的弯曲表面,例如它可以是凹面或凸面。换言之,在本文所述的方法期间,可以将水凝胶放置并保留在凹(或凸)面上。如下面的实施例部分中详细描述的,凹面导致降低的细胞平坦度、高迁移率、增加的细胞核圆度和高度对齐的细胞(相对于平面)。这可以在不使用对齐诱导基底(例如丝素蛋白膜)的情况下实现。因此,在一些实施方案中,制备透明且弯曲的基质细胞组织的方法不包括在对齐诱导基底(例如丝素蛋白膜)上培养基质细胞。另一方面,凸面导致增加的细胞平坦度、迁移率高、降低的细胞核圆度和增加的细胞对齐(相对于平面)。在一些情况下,优选凹面,因为它们促进最高水平的细胞对齐。
184.在本文所述的方法中,弯曲表面通常具有约0.04至约0.5mm-1
的曲率(在凹或凸方向上)。使用本领域中众所周知的标准工具(如本文别处所述)来测量表面的曲率。弯曲表面可具有0.04至约0.5mm-1
的曲率(例如约0.1-0.4mm-1
,特别是约0.2-0.3mm-1
)。表面的曲率决定了由本文所述方法产生的基质细胞组织(和随后的脱细胞的组织)的曲率。
185.弯曲表面可以由任何合适的材料形成。合适的材料可以由本领域技术人员容易地确定,并且包括例如聚苯乙烯、聚乙烯、聚对苯二甲酸乙二醇酯、聚乳酸、聚碳酸酯、丙烯腈-丁二烯-苯乙烯、琼脂糖、水凝胶或玻璃表面。在一个特定实例中,可以使用硼硅酸盐玻璃表面。
186.在一个特定实例中,弯曲表面由水凝胶形成。在具体实例中,弯曲表面由水凝胶形成,其中水凝胶包含胶原蛋白。
187.例如,在合适的细胞培养条件下,可以将含有基质细胞的水凝胶保持在弯曲表面上至少两天、至少三天、至少四天等,直到产生本文别处所述的基质细胞组织。
188.在合适的细胞培养条件下,将含有基质细胞的水凝胶保持在弯曲表面上至少24小时。合适的细胞培养条件可以由本领域技术人员容易地确定,并且将取决于所使用的基质细胞的类型、细胞培养的持续时间等。
189.例如,合适的细胞培养条件可以包括将水凝胶保持在细胞培养基中的弯曲表面上。例如,水凝胶可以浸入细胞培养基中,同时保持在弯曲表面上。水凝胶可以部分浸入细胞培养基中,但更通常地是完全浸入细胞培养基中。
190.本文所用的术语“细胞培养”是指在有利于细胞生长、分化和/或持续生存力的条件下将细胞保持在人工环境中。例如,如果细胞数量和/或细胞生存力与合适的对照相比增加,则可以促进细胞生长。
191.术语“细胞培养基”和“培养基”(在每种情况下是复数个“培养基”)是指用于培养
活细胞的营养液,并且可以互换使用。细胞培养基可以是完全配制品,即不需要补充物来培养细胞的细胞培养基,或者可以是不完全配制品,即需要补充物的细胞培养基,或者可以是可以补充不完全配制品的培养基,或者在完全配制品的情况下可以改善培养或培养结果的培养基。
192.各种细胞培养基对于本领域技术人员来说是已知的,他们也将认识到待培养的细胞的类型可以决定所使用的培养基的类型。
193.仅作为实例而非限制,培养基可选自由以下组成的组中:杜尔贝科改良伊格尔培养基(dmem)、ham’s f-12(f-12)、最小必需培养基(mem)、伊格尔基础培养基(bme)、rpmi-1640、ham’s f-10、α最小必需培养基(αmem)、格拉斯哥最小必需培养基(g-mem)和伊斯科夫改良杜尔贝科培养基(imdm)、或它们的任何组合。商业上可获得的(例如,来自thermo fisher scientific,waltham,ma)或本领域其它已知的其它培养基可等效地用于本公开的上下文中。同样,仅作为实例,培养基可选自由以下组成的组中:293sfm、cd-cho培养基、vp sfm、bgjb培养基、brinster’s bmoc-3培养基、细胞培养冷冻培养基、cmrl培养基、ehaa培养基、erdf培养基、fischer’s培养基、gamborg’s b-5培养基、glutamax
tm
补充培养基、grace’s昆虫细胞培养基、hepes缓冲培养基、richter’s改良mem、ipl-41昆虫细胞培养基、leibovitz’s l-15培养基、mccoy’s 5a培养基、mcdb 131培养基、培养基199、改良伊格尔氏培养基(mem)、培养基nctc-109、schneider’s果蝇培养基、tc-100昆虫培养基、waymouth’s mb 752/1培养基、william’s培养基e、无蛋白杂交瘤培养基ii(pfhmii)、aim v培养基、角质形成细胞sfm、限定的角质形成细胞sfm、stempro sfm、全甲基纤维素培养基、hepatozyme-sfm、neurobasal
tm
培养基、neurobasal-a培养基、hibernate
tm a培养基、hibernate e培养基、内皮sfm、人内皮sfm、杂交瘤sfm、pfhm ii、sf 900培养基、sf 900ii sfm、express培养基、cho-s-sfm、aminomax-ii完全培养基、aminomax-c100完全培养基、aminomax-c140基础培养基、pub-max
tm
核型培养基、karyomax骨髓核型培养基以及knockout d-mem、或它们的任意组合。
194.细胞培养基可以是无血清的。例如,无血清培养基可以是dmem或f-12、或它们的组合。
195.培养基(例如dmem或f-12、或它们的组合)还可以包含补充剂。可以在该方法的步骤ii)开始时加入补充剂,或者在此后的任何点加入。补充剂可以在整个方法中存在于细胞培养基中,或者可以酌情以较短时间段加入。
196.补充剂可以是例如抗坏血酸、胰岛素、转铁蛋白和/或亚硒酸钠。其它合适的补充剂包括维甲酸。换言之,维甲酸可以加入到本文所述方法的步骤ii)中所用的细胞培养基中。用维甲酸补充细胞培养基是有利的,因为它增强无血清培养中的细胞存活和细胞外基质沉积,从而再现基质组织的天然生理状态。
197.水凝胶内的基质细胞可以在维甲酸存在下培养一段时间,该时间适合于保持细胞活力并增强特定细胞外基质组分的沉积。在一个实例中,细胞可在维甲酸存在下培养至少0.5天、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少7天、至少8天、至少9天、至少10天、至少12天、至少15天、至少17天、至少21天、至少27天、至少30天、或更多。例如,细胞可在维甲酸存在下培养至少7天、至少15天、至少30天、至少45天、至少60天、至少75天、或至少90天、或更多。在一个实例中,细胞可在维甲酸存在下培养约1天至约90天、或约7
天至约60天的持续时间。
198.同样地,细胞可在维甲酸存在下培养,其中维甲酸的浓度适于保持细胞生存力并增强特定细胞外基质组分的沉积。在一个实例中,细胞可在约0.1μm、约0.2μm、约0.3μm、约0.4μm、约0.5μm、约0.6μm、约0.7μm、约0.8μm、约0.9μm、约1μm、约2μm、约3μm、约4μm、约5μm、约6μm、约7μm、约8μm、约9μm或更大的维甲酸浓度下培养。例如,约10μm、约15μm、约20μm、约25μm、约30μm、约35μm、约40μm、约45μm、约50μm、约55μm、约60μm、约65μm、约70μm、约75μm、约80μm、约85μm、约90μm、约95μm、或约100μm、或更大。例如,约150μm、约200μm、约250μm、约300μm、约350μm、约400μm、约450μm、约500μm、约550μm、约600μm、约650μm、约700μm、约750μm、约800μm、约850μm、约900μm、约950μm、约1000μm、或更大。
199.用于评估是否保持细胞生存力的方法在本领域中是众所周知的。此外,还已知用于分析特定细胞外基质组分的增强沉积的方法。
200.例如,细胞可在维甲酸存在下培养,其中维甲酸的浓度为约0.1μm至约1000μm、约0.5μm至约750μm、或约1μm至约500μm。例如,细胞可在维甲酸存在下培养,其中维甲酸的浓度为约0.1μm至约10μm或约0.5μm至约5μm。确定合适浓度的方法对于本领域技术人员来说是已知的。
201.其它合适的补充剂是本领域已知的,并且包括kttks脂肽。换言之,可以将kttks脂肽添加到细胞培养基中,使得用于本文所述方法的步骤ii)中的细胞培养基包含溶液中的kttks脂肽。用溶液中的kttks脂肽补充细胞培养基是有利的,因为已经表明它增加基质细胞中胶原产生。
202.水凝胶内的基质细胞可以在kttks脂肽存在下培养适于增加细胞胶原产生的一段时间。在一个实例中,细胞可在kttks脂肽存在下培养至少1小时、至少2小时、至少3小时、至少4小时、至少5小时、至少6小时、至少7小时、至少8小时、至少9小时、至少10小时、至少12小时、至少14小时、至少16小时、至少18小时、至少20小时、至少22小时、至少24小时、或更多。例如,细胞可在脂肽存在下培养至少36小时、至少48小时、至少60小时、至少72小时、至少84小时、至少96小时、至少108小时、或至少120小时、或更多。在一个实例中,细胞可在溶液中kttks脂肽存在下培养约1小时至约120小时、或约24小时至约96小时的持续时间。
203.同理,细胞可以在kttks脂肽存在下培养,其中脂肽的浓度适于增加细胞胶原蛋白的产生。在一个实例中,细胞可在约0.1μm、约0.2μm、约0.3μm、约0.4μm、约0.5μm、约0.6μm、约0.7μm、约0.8μm、约0.9μm、约1μm、约2μm、约3μm、约4μm、约5μm、约6μm、约7μm、约8μm、约9μm或更大的kttks脂肽浓度下培养。例如,约10μm、约15μm、约20μm、约25μm、约30μm、约35μm、约40μm、约45μm、约50μm、约55μm、约60μm、约65μm、约70μm、约75μm、约80μm、约85μm、约90μm、约95μm、或约100μm或更大。例如,约150μm、约200μm、约250μm、约300μm、约350μm、约400μm、约450μm、约500μm、约550μm、约600μm、约650μm、约700μm、约750μm、约800μm、约850μm、约900μm、约950μm、约1000μm或更大。
204.例如,细胞可以在kttks脂肽存在下培养,其中kttks脂肽的浓度为约0.1μm至约1000μm、约0.5μm至约750μm、或约1μm至约500μm。例如,细胞可在脂肽存在下培养,其中脂肽的浓度为约0.1μm至约10μm、或约0.5μm至约5μm。确定合适浓度的方法对于本领域技术人员来说是已知的。
205.本文所用的术语“脂肽”是指包含脂质部分和氨基酸部分或由其组成的两亲分子。
术语“脂肽”、“两亲分子”、“肽两亲物”和“pa”在本文中可互换使用。两亲性能使多种脂肽自组装成超分子结构。脂肽是众所周知的,并且它们的自组装性能在本领域中已详尽表征(参见,例如cui h.等人,biopolymers,2010;94(1):1
–
18)。因此,本领域技术人员可以容易地确定合适的脂肽,例如通过测试它们在某些条件下自组装并形成超分子结构的倾向。可通过硫磺素(tht)和芘(pyr)荧光光谱法来评估脂肽自组装和相应的c.a.c.。用荧光光谱仪记录荧光光谱。对于tht测定,通常使用激发波长λ
ex
=440nm和溶于4-5
×
10-3
%(w/v)tht溶液中的脂肽记录460至600nm的光谱。对于pyr测定,通常使用激发波长λ
ex
=339nm记录360至550nm的光谱。pyr测定使用1-1.5
×
10-5
%(w/v)pyr溶液作为稀释剂进行。将荧光强度相对于脂肽浓度的对数(log)作图。数据的拐点表示tht/pyr分子的环境变化,并用于确定c.a.c.。
206.kttks脂肽是其中氨基酸部分包含氨基酸序列kttks或其片段或变体或由其组成的脂肽。kttks片段是比相应的kttks氨基酸序列更短的肽。kttks片段可以与其对应的kttks氨基酸序列的部分具有100%同一性。片段的长度可以是至少3个氨基酸残基。例如,片段的长度可以是3或4个氨基酸残基。例如,片段可以具有选自由ktt、ttk、tks、kttk和ttks组成的组中的序列。kttks变体是指与kttks氨基酸序列相比,其中一个或多个氨基酸被不同的氨基酸替代的氨基酸序列。例如,变体可以选自由以下组成的组中:ktkts、ttkks、skktt、sktet、tkstk、或上述变体中的任一种,其中任一个或多个谷氨酸(e)残基被天冬氨酸(d)残基置换。在本公开内容的上下文中,片段或变体可以基本上保留相应序列的生物学功能。例如,当相应的序列是kttks时,片段或变体可以基本上保留kttks序列的生物学功能。
207.本文所用的术语“生物学功能”可以指增加细胞胶原蛋白产生的能力。该生物学功能与kttks脂肽及其片段或变体特别相关。“基本上保留”生物学功能是指片段或变体保留至少约50%、60%、75%、85%、90%、95%、97%、98%、99%或更多的相应kttks序列的生物学功能。确实,片段或变体可能具有比相应的kttks序列更高的生物学功能。片段或变体可以具有110%、120%、130%、140%、150%、160%、170%、180%、190%、200%或更多的相应kttks序列的生物学功能。生物学功能可以是例如增加细胞中胶原蛋白产生的能力。本领域技术人员将知道确定片段或变体是否具有增加细胞中胶原蛋白产生的能力的方法。仅仅作为实例,此类实例包括胶原蛋白染色、总胶原蛋白测定、或细胞迁移测定。
208.如本文所用,术语“变体”是指与相应的氨基酸序列相比,其中一个或多个氨基酸被不同的氨基酸替代的氨基酸序列。本领域公知的是,在不改变肽活性的性质(保守性置换)的情况下,一些氨基酸可以改变为具有大致相似性质的其它氨基酸。通常,可能在肽的性质上产生最大变化的置换是以下这些:(a)亲水残基(例如ser或thr)被疏水残基(例如leu、lie、phe或val)置换;(b)半胱氨酸或脯氨酸被任何其它残基置换;(c)具有正电侧链的残基(例如,arg、his或lys)被负电性残基(例如,glu或asp)置换;或者(d)具有庞大侧链的残基(例如,phe或trp)被具有较小侧链的残基(例如,ala、ser)或没有侧链的残基(例如,gly)置换。
209.组织
210.本文还提供了通过上述方法获得或可获得的组织。具体地,描述了通过这些方法获得或可获得的基质细胞组织和相应的脱细胞的组织。以上在该方法上下文中提供的定义
同样适用于组织本身。
211.本文所述的组织具有至少50μm的最小厚度、至少0.5的最小可见光透射率值、以及约0.04至约0.5mm-1
的曲率。该组织还包含:
212.a)来自第一物种的基质细胞,以及
213.b)痕量的:
214.(i)来自第二物种的细胞外基质蛋白序列或它们的片段或变体;或
215.(ii)合成的细胞外基质蛋白序列或它们的片段或变体。
216.在一个特定实例中,组织的基质细胞来自第一物种,并且细胞外基质蛋白序列来自第二(不同的)物种。
217.在一个特定实例中,组织中的基质细胞是人的,并且该组织包含痕量的合成或非人细胞外基质蛋白序列或它们的片段或变体。换言之,在一个特定实例中,基质细胞组织具有至少50μm的最小厚度,包含痕量的非人或合成的细胞外基质蛋白序列或它们的片段或变体,具有至少0.5的最小可见光透射率值以及约0.04至约0.5mm-1
的曲率,其中基质细胞是人的。在本实例的一个实例中,人基质细胞可以是角膜基质细胞如角膜成纤维细胞。
218.在一个特定实例中,组织包含痕量的来自第二物种或它们的片段或变体的胶原蛋白或合成胶原蛋白。例如,组织可以包含痕量的合成或非人胶原蛋白,其中基质细胞是人基质细胞。在该上下文中,胶原蛋白片段或它们的变体可以包含选自以下的氨基酸序列或由其组成:kttks(seq id no:2)、gtpgpqgiagqrgvv(seq id no:12)、groger(seq id no:13)、glkgen(seq id no:14)、gfoger(seq id no:15)和mnyysns(seq id no:16)或它们的变体。
219.在一个特定实例中,组织可以是薄层或盘的形式。
220.在一个特定实例中,组织具有约0.1至12.0mm的厚度。
221.本文所述的基质细胞组织可以是脱细胞的。因此,还提供了通过本文所述方法可获得或获得的脱细胞的组织。
222.本文所述的脱细胞的组织具有至少50μm的最小厚度、至少0.5的最小可见光透射率值以及约0.04至约0.5mm-1
的曲率。脱细胞的组织还包含:
223.a)来自第一物种的细胞外基质蛋白序列,以及
224.b)痕量的:
225.(i)来自第二物种的细胞外基质蛋白序列或它们的片段或变体;或
226.(ii)合成的细胞外基质蛋白序列或它们的片段或变体。
227.在一个特定实例中,组织的细胞外基质蛋白主要是人的,并且组织包含痕量的合成的或非人的细胞外基质蛋白序列或它们的片段或变体。换言之,在一个特定实例中,脱细胞的组织具有至少50μm的最小厚度,包含痕量的非人或合成的细胞外基质蛋白序列或它们的片段或变体,具有至少0.5的最小可见光透射率值以及约0.04至约0.5mm-1
的曲率,其中组织的细胞外基质蛋白主要是人的。在该上下文中,其中细胞外基质蛋白“主要是人的”的组织是以下组织:其中组织中至少90%(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%等)的细胞外基质蛋白是人细胞外基质蛋白的组织。
228.在一个特定实例中,脱细胞的组织包含痕量的来自第二物种的胶原蛋白或它们的片段或变体;或合成胶原蛋白。例如,脱细胞的组织可以包含痕量的合成或非人胶原蛋白,
其中组织主要包含人细胞外基质蛋白。在该上下文中,胶原蛋白片段或其变体可以包含选自以下的氨基酸序列或由其组成:kttks(seq id no:2)、gtpgpqgiagqrgvv(seq id no:12)、groger(seq id no:13),glkgen(seq id no:14)、gfoger(seq id no:15)和mnyysns(seq id no:16)或它们的变体。
229.在一个特定实例中,脱细胞的组织可以是薄层或盘的形式。
230.在一个特定实例中,脱细胞的组织具有约0.1至12.0mm的厚度。
231.本文提供的组织可用于支持上皮生长。因此,本文提供了组织复合材料,其中组织复合材料由基质细胞组织和上皮或内皮细胞层形成。这些复合材料可以包含具有不同机械性能/刚度的组织的堆叠层,即上层或下层可以具有比下层更高的刚度,以支持角膜上皮和/或内皮细胞的增殖和功能。
232.用途
233.本文所述的组织可冷冻保存并返回培养,使得便于运输和商业化。
234.本文所述的组织当放置在天然基底(例如角膜基质)上时具有产生外生长的能力。因此,本文所述的组织可用于疗法,例如用于改变受试者的角膜透明度和/或折射性质。这可以用于替代全部或部分(微透镜)供体角膜组织。
235.本文所述的组织可单独用于本文所述的目的,或可用作组织复合材料。组织复合材料在本文别处进行了描述。因此,当提到本文的组织用途时,这涵盖组织复合材料(其包含本发明的组织)的用途。
236.例如,组织可用于基质内或覆盖式板层角膜移植术(onlay lamellar keratoplasty)。
237.对于覆盖式板层角膜移植术,将组织缝合或胶合到角膜的前部上,以改变前部曲率,从而改变折射特性。这可以在除去或不除去宿主角膜基质组织的情况下进行(即其中仅除去上皮的表皮角膜移植术或其中除去来自子代膜的宿主组织并用组织透镜替代的深层板层角膜移植术)。
238.对于基质内角膜移植术,对角膜制作全部或部分切口(袋、瓣),并将组织透镜插入切口组织之间。基质内组织透镜可以被定位在中心(即板层角膜切除)或周边(角膜内环)。
239.如本文所用,术语“受试者”是指可以从给予组织(例如作为角膜移植物的一部分)中受益的任何个体。优选地,受试者是哺乳动物,最优选是人。
240.术语“处理(treat)”、“处理(treating)”或“处理(treatment)”是指患有该疾病的患者的相关疾病的临床改善。此类临床改善可以通过与疾病相关的病理和/或症状的改善来证明。与角膜缺损、疾病或损伤相关的症状可包括屈光不正、角膜基质营养不良、fuch’s内皮营养不良、圆锥形角膜、角膜溃疡、持续性上皮缺损、角膜炎、角膜混浊、角膜烧伤、角膜磨损、角膜缘干细胞缺损、大疱性角膜病变。
241.组织可以是组合物的一部分,该组合物还包含药用稀释剂、载体或赋形剂。组合物还可以常规地含有药用浓度的盐、缓冲剂、防腐剂(例如抗氧化剂)、辅助免疫增强剂诸如佐剂和细胞因子以及可选的其它治疗剂。
242.术语“药用”在此用于指那些化合物、材料、组合物和/或剂型,其在合理的医学判断范围内,适于与人类或动物的组织接触而没有过度毒性、刺激性、过敏反应、或其它问题或并发症,其与合理的利益/风险比相适应。
243.稀释剂是稀释试剂。药用稀释剂在本领域中是众所周知的。因此,本领域普通技术人员容易确定合适的稀释剂。
244.载体在所用剂量和浓度下对接受者无毒,并且与组合物的其它成分(如脂肽)相容。术语“载体”表示天然或合成的有机或无机成分,活性成分与该成分结合以促进应用。药用载体在本领域中是众所周知的。因此,本领域普通技术人员可以容易地确定合适的载体。
245.赋形剂是与活性成分一起配制的天然或合成物质(例如本文所提供的脂肽),包括用于使配制品膨松或赋予最终剂型中的活性成分治疗增强(如有利于药物吸收或溶解)的目的。赋形剂也可用于制备过程中,以如通过促进粉末流动性或不粘性来帮助处理有关的活性物质,此外还有助于体外稳定性如防止在预期的保质期内变性。药用赋形剂在本领域中是众所周知的。因此,本领域普通技术人员可容易确定合适的赋形剂。作为实例,合适的药用赋形剂包括水、盐水、葡萄糖水溶液、甘油、乙醇等。
246.佐剂是改变制剂中其它试剂作用的药理学和/或免疫学试剂。药用佐剂在本领域中是众所周知的。因此,本领域普通技术人员可容易确定合适的佐剂。
247.防腐剂可以是抗氧化剂。作为抗氧化剂,可以提及硫醇衍生物(例如硫代甘油、半胱氨酸、乙酰半胱氨酸、胱氨酸、二硫赤藓糖醇、二硫苏糖醇、谷胱甘肽)、生育酚、丁基化羟基茴香醚、丁基化羟基甲苯、含硫酸的盐(例如硫酸钠、亚硫酸氢钠、丙酮亚硫酸氢钠、焦亚硫酸钠、亚硫酸钠、甲醛合次硫酸氢钠、硫代硫酸钠)和去甲二氢愈创木酸。合适的防腐剂可以是例如苯酚、氯丁醇、苄醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯扎氯铵和氯化十六烷基吡啶。
248.用于产生本文所述组织的细胞可以从待治疗的受试者、待治疗的受试者的亲友或非相关供体获得。在一些实施方案中,细胞可以来源于来自待治疗受试者的非受损眼睛。
249.优选地,从与受试者相同的物种获得细胞。
250.可以通过除去患病的细胞和/或组织来制备受损的眼表面。这可以使用标准的外科手术程序来完成,以便暴露下面的角膜基质。然后可以将组织放置在受损的眼表面上或上方,例如角膜基质上或上方。
251.可以通过合适的方法将水凝胶固定在合适的位置,例如,使用治疗性隐形眼镜或将组织插入结膜下(角膜周围的膜),例如通过首先将结膜与巩膜分离,然后将结膜拉过角膜和水凝胶。可以使用合适的缝合,例如荷包缝合。结膜现在覆盖组织和角膜。治疗性隐形眼镜也可用于覆盖结膜。
252.可选地,组织可以化学键合到角膜上,例如通过将合适的粘合剂施用到组织或角膜上,例如纤维蛋白胶、氰基丙烯酸酯、白蛋白或戊二醛。可替代地,组织可以通过例如加入核黄素和紫外光以在组织中的胶原蛋白和角膜中的胶原蛋白之间形成交联而化学键合到角膜上。
253.可选地,眼睑可缝合闭合以防止感染和/或保持水凝胶的位置,例如1至14天。
254.本文所述的组织也可用作体外组织模型,例如用于理解基质细胞相互作用的模型、用于理解角膜疾病进展的疾病模型或筛选模型。
255.例如,本文所述的组织可用作体外筛选模型,例如用于毒性分析和其它应用中。组织还可适用于研究信号分子的蛋白质和基因表达以及正常和病理条件下的全基因表达谱。
256.此外,此类组织可用于临床前研究、药物开发、药物和其它测试、靶基因治疗、毒性
测试、作为角膜疾病模型。与角膜疾病、肿瘤生物学、瘢痕形成等相关的临床前策略也可受益于本文所述的组织。
257.对于某些应用,可以通过使用来自患病组织的细胞来形成组织。例如,可以使用来自患病角膜组织的基质细胞来形成组织。患病角膜组织包括角膜疾病,诸如角膜扩张、角膜基质营养不良、角膜缘干细胞缺陷、持续性上皮缺损、fuch’s内皮营养不良、上皮基膜营养不良。
258.例如,可以通过使用来自临床患者的基质细胞来建立反映临床角膜疾病的异常组织。然后可以将该组织与从正常基质细胞产生的那些组织进行比较,这有助于研究导致疾病形成的分子和基因分布以及开发基因治疗。
259.使用本文所述组织的疾病模型也可用于相关角膜疾病的药物测试或临床前治疗。此类组织为动物疾病模型和2d细胞培养系统提供了一种可替代的且极大改进的工具。
260.本文所述的组织可用于观察试剂对器官即患病组织的作用,并确定能够治疗疾病和减轻其症状的试剂。
261.因此,本文还提供了筛选化合物以确定可用于治疗疾病(特别是角膜疾病)的试剂的方法。
262.该方法包括提供本发明的组织(使用非患病基质细胞、患病基质细胞或其组合产生),将其与测试化合物接触,并确定测试化合物对组织的影响。
263.优选地,以足以对所述组织施加作用所需的量和时间,将测试化合物施用于该组织。这些量和时间可以由本领域技术人员使用本领域已知的标准程序来确定。可以作为测试化合物的效果的指示测量的参数可以包括例如细胞完整性的改变、细胞生存力的改变和/或组织内的结构改变。
264.除非本文另外定义,否则本文所用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。例如,singleton和sainsbury,dictionary of microbiology and molecular biology,第二版,john wiley和sons,ny(1994);以及hale和marham,the harper collins dictionary of biology,harper perfornial,ny(1991),为本领域技术人员提供了本发明中所用的许多术语的一般字典。尽管任何类似于或等效于本文所述的方法和材料都可用于本发明的实践,但本文描述了优选的方法和材料。因此,通过参考说明书整体内容,对紧接在下面定义的术语进行更全面的描述。此外,本文所用的单数术语“一个”、“一种”和“该”包括复数指代物,除非上下文另外清楚地指出。除非另外指出,否则核酸以5'到3'方向从左向右书写;氨基酸序列分别以氨基-羧基方向从左至右书写。应当理解,本发明不限于所述的特定方法、方案和试剂,因为这些可以根据本领域技术人员所使用的场景而变化。
265.通过以下非限制性实施例说明了本发明的各方面。
266.实施例
267.实施例1:表面曲率对角膜基质细胞行为的影响
268.介绍
269.表征作为影响不同细胞类型迁移和对齐的表面诱因的曲率的影响的研究已经在很大程度上被限制在纳米和微米级的基底直径(分别为),其具有相应的曲率(k=1/r)。使用球体上表面的研究表明,与显示相应直径的凸曲率的表面相比,
的凹曲率促进了人骨髓间充质干细胞(msc)中更持久的迁移、对齐和改变的附着形态(werner等人,2017)。先前,发明人还表明,由从平坦表面迁移到凸面的角膜基质细胞形成的组织具有人角膜的平均尺寸(即胞形成的组织具有人角膜的平均尺寸(即),与平面对照相比,能够以显著更高的组织对齐和沉积胶原蛋白i型原纤维(gouveia等人,2017)。此外,生长在此类弯曲表面上的细胞显示出明显更高水平的角膜特征性晶体蛋白和蛋白聚糖。综上,这些研究认为,可以通过比细胞尺寸大许多倍的弯曲几何形状来调节细胞行为。
270.本发明人现在进一步研究了表面曲率对角膜基质细胞行为的影响,特别是能够促进这种细胞类型自组织进入高度对齐的培养物的曲率范围。
271.方法
272.细胞分离和培养
273.如前所述(gouveia等人,2017),从三个健康人供体的角膜缘环中提取细胞。然后用补充有5%fbs和1%(w/v)青霉素/链霉素的dmem/f-12体外扩增角膜基质细胞。在该培养基中扩增的细胞显示出基质成纤维细胞的伸长的纺锤形形态特征。在实验之前,在无血清培养基(dmem/f12,补充有1%(w/v)胰岛素-转铁蛋白-硒、1mm l-抗坏血酸2-磷酸酯(l-ascorbic acid 2-phosphate)和1%(w/v)青霉素/链霉素)中孵育传代不超过4次的细胞3天。这些细胞呈现树突状形态学,提示体内发现的静止角膜基质细胞。
274.基底制备和接种
275.定制具有不同直径的硼硅酸盐玻璃半圆柱体,以测试不同表面曲率对细胞行为的影响(图1)。正常的玻璃盖片20
×
20mm用作平面对照表面(图1)。所有的基底都用高压灭菌器灭菌。随后,用封口膜覆盖表面,使用该硅酮包裹物(wrap)作为“罩”,用于将初始细胞接种区域限制在限定的跨基底的500μm宽的纵向线上(图1)。然后悬浮血清饥饿细胞(serum-starved cell),使用tryple酶在37℃消化5分钟,离心除去酶,以1
×
105个细胞/ml重悬于无血清培养基中,并接种在玻璃基底的暴露表面上(每表面0.5ml)(图1)。37℃孵育2小时后,用镊子无菌地除去所有的封口膜包裹物,使剩余的玻璃表面在表面的长(纵)和短(弧形)轴上暴露于细胞迁移和生长(图1)。为此目的,将基底保持为完全浸入无血清培养基中4天,每隔一天更换一次培养基。
276.细胞迁移
277.使用leica dm il led组织培养显微镜进行定量显微镜检查,以跟踪3天时间段(t0、t1、t2、t3)内的细胞迁移,其中t0与初始细胞接种相对应。每24小时拍摄图像,并利用imagej扩展景深插件(extended depth of field plugin)处理多焦点图像堆栈。然后将图像分割成40,000μm2具有细胞群沿基底短轴迁移的栅格,通过跨这些栅格的线分析跟踪,其中正值将以每个栅格大于20%的细胞饱和度返回。在对应于沿短轴的迁移距离的设定坐标处每个视场(fov)(2100
×
2100μm)取采样尺寸的10个数据点,并且每天每个样品取3个fov图像。通过数字验证相对于每个半圆柱体和盖片上的标记的“前”边缘所拍摄的每个图像的表面坐标,来确保每个样品中设定fov的重复成像。使用等式[(2πr)*((((sin^(-1)((dist/2)/r)*2)))/360)]使每个外推迁移距离值经受弯曲表面校正,来校正弯曲表面上的成像多焦点误差,以保持差分曲率(k)几何特性的精度。
[0278]
细胞核形态
[0279]
用定量荧光显微镜对细胞核形状进行表征。在第4天(t4),在室温下将细胞固定在
4%的多聚甲醛中20分钟,随后用2.5%bsa在磷酸盐缓冲液中阻断,然后用双苯甲酰亚胺hoechst 33392 dna插入染色剂(350/461nm)和alexa fluor 594鬼笔环肽(581/609nm)染色2小时。在imagej中对在λ=461nm处拍摄的图像进行二值化,并使用等式(4π
×
([面积])/([周长]2))分析圆度,以给出范围为0至1的频率范围和圆度值,其中前者是最不像圆形的以及后者是完美圆。每次实验在每个基底上取三个fov样品。
[0280]
细胞取向
[0281]
通过f-肌动蛋白荧光显微照片的分析表征细胞取向/对齐。简言之,在λ=609nm下,对用alexa fluor 594鬼笔环肽染色的细胞成像,并用imagej插件orientation j分析显微照片,这将荧光标记的细胞结构转化为矢量图。然后按照优先取向(分别对应于短轴和长轴,在0和90
°
之间)对矢量进行分组,并且矢量频率以5
°
分档(bins)表示。当细胞相对于短轴或长轴显示优先肌动蛋白取向(在20
°
内)时,认为细胞是对齐的(图1)。
[0282]
统计分析
[0283]
使用graphpad prism 7.0进行统计学分析。使用每天从每个基底样品收集的3个fov的30个数据点,使细胞迁移数据经受参数anova测试,并用dunnett’s多重比较测试分析进一步的比较结果。然后对来自每个样品的每日迁移数据取平均值并取得标准偏差。由所有天的平均迁移率计算平均迁移率。然后在基底之间比较平均迁移分布,以确定当比较处于不同曲率(k)和取向的凸面和凹面时,在总迁移(表示为t0处初始接种百分比的在t3处的最终迁移宽度)或迁移率(μm/小时)之间是否存在显著差异。将0至90
°
之间的对齐矢量的频率标为矢量总数的%。在3次实验中将频率数据平均化,随后经受参数单向anova测试,并进一步与sidak’s多重比较测试进行比较。使用平面来确定没有观察到细胞对齐的假定阈值。圆度数据不是正常分布的,因此要进行非参数测试。每个实验取每个样品采样大小的50个数据点,并绘制成数据集,该数据集组合了所有3个实验中每个样品的数据。在mann-whitney’s测试之后,在所有样品之间采用具有dunn’s多重比较测试的kruskal-wallis测试,以确定在所有基底上是否出现细胞核圆度的显著差异。
[0284]
结果
[0285]
微米级凸结构中的共焦显微镜研究先前已经表明,细胞体被“向上”拉,使得与基底到不同粘合点的接触最小化。因此,本发明人定性地观察到,与观察到细胞采用“拉伸”形态且其在显微镜下显得更平坦的凸基底相比,细胞在所有凹基底表面上更不平坦(图2)。可以通过物理模型来解释凸面中增加的细胞表面积,其中沿着此类倾斜表面放置的连接点(焦点粘附点)之间的表面张力以向外的方式拉动细胞,从而使细胞变平。因此,在移动过程中,细胞需要重新建模更大的接触面积,从而导致更慢的迁移。与该模型一致,发明人观察到,角膜细胞在凹面上迁移明显快于在凸面上迁移(图2和图3)。在平面样品中观察到的迁移率与在先前研究中观察到的速率非常接近地重复(fernandez-perez等人,2019)。这些结果反映了弦物理模型,其中细胞被定义为具有有限粘弹性性质的拉伸元件,并在凸面上的焦点粘附点之间向上拉伸,并向下拉向凹面结构上的表面。对于人msc,差动提离效应的向上曲率阈值被确定为(werner等人,2017)。发明人现在已观察到角膜基质细胞表现出相同的行为,但是在中尺度曲率高达时(图3)。在细胞迁移过程中,细胞向基底表面延伸突起如层状足部和丝状足部,形成粘附,随后缩回它们的末端。根据这种迁移模型,细胞在迁移过程中以各向异性的方式极化和作用,以有效地将收缩作用转化为
运动。因此发明人发现,与平面对照相比,凹面和凸面都显著促进了更高的总细胞对齐(沿横向和弧形轴线)(图4)。然而,高达的凹面促进了最高程度的细胞取向,在时最佳(图4)。
[0286]
随着表面积的增加,拉紧的肌动蛋白细胞骨架元件也通过linc复合物将力传递到细胞核中。凸表面上的细胞核圆度降低表明高的细胞内张力施加在细胞核上。调节作用于细胞核的随后的弹性和压缩应力,导致核变形增加,细胞生长在凸面上,由于表面张力增加而表现出增加的表面积。根据这些概念,发明人观察到凹表面上的细胞中更高的细胞核圆度,高达(图5)。结果显示出细胞核圆度与凹直径之间的正相关性。这些发现表明,通过测量作为细胞核变形产物的细胞核圆度,发明人能够准确地假定细胞内应力状态。还特别引人关注的是,发现圆度观察结果在凸面基底比在凹面基底更多变。这与凸面基底上的较低对齐一起可以表明,不同的取向可以调节细胞与单轴曲率相互作用以及沿单轴曲率粘附的方式,从而改变细胞核所受到的压缩力。因此发明人得出结论,即使在明显大于细胞直径的尺度下,曲率也能够不同地调节细胞迁移率、形态、细胞核圆度和对齐(图6)。
[0287]
实施例2:表面曲率对水凝胶内细胞之间基因表达和透明度的影响
[0288]
方法
[0289]
胶原蛋白凝胶的生产和培养
[0290]
以1:7:1的体积比将冰冷胶原蛋白i型溶液(2g/l,在0.6%乙酸中从大鼠尾部提取;first link ltd,英国)与10x改良必需培养基(life technologies,美国)混合,并用1m naoh中和。将人角膜基质细胞以5-20
×
104个细胞/ml加入到该混合物中,温和搅拌均质30秒。然后将含有细胞的混合物移入24孔板(1ml/cm2),并在37℃下固化30分钟。应用吸收剂插入件(lonza,瑞士)将凝胶压缩成直径为13-16mm的胶原蛋白盘。通过将所得3d胶原蛋白凝胶轻轻转移到3mm高和10mm直径的玻璃圆顶上,使用金属垫圈将其固定就位(图7a),并在无血清培养基中培养达7天,从而使所得3d胶原蛋白凝胶经受曲率诱因。使用平面凝胶作为阴性对照。
[0291]
基因表达分析
[0292]
使用1ml trizol和注射器将弯曲的和平面的胶原蛋白凝胶均质化,补充200μl氯仿,并在室温下静置15分钟。相分离后,混合物以18,000
×
g离心15分钟。收集含有mrna的顶层相,悬浮在乙醇中,并根据制备商的说明书使用rneasy mini试剂盒(qiagen,uk)处理。然后用dna酶处理mrna以消除基因组dna。使用nanodrop 2000分光光度计(thermo scientific,uk)对定量和纯度进行rna的质量评估。在tc-plus热循环仪(techne,uk)中用rt2 first strand试剂盒(qiagen,uk)根据制造商的说明书对rna进行反转录,并使用直接染料结合将所得cdna用于在eco实时pcr系统(illumina,usa)中进行qpcr,使用合适的引物(参见下面的seq id no:24-53),使用95℃变性10秒、60℃退火30秒和72℃延伸15秒的40个循环。数据对应3个独立实验的平均值
±
sd,其中每个目的基因的表达标准化为看家基因gapdh。
[0293]
光学特性分析
[0294]
将3d胶原蛋白凝胶固定在4%多聚甲醛中30分钟,用pbs洗涤三次,并保持浸入pbs中进行分析。通过利用积分球的全反射和全透射测量,使用反相加倍增(iad)方法来确定弯曲和平面凝胶以及天然猪角膜(阳性对照)的散射和吸收系数。将样品放置在两个载玻片之
间,并在样品中心进行测量,λ=457.9、488、514.5nm(氩离子激光器-stellar-pro-l模型,modu-laser;us)和632.8nm(he-ne激光器-30564模型,research electro-optics;us)。径向切割弯曲的3d胶原蛋白凝胶和角膜以获得平坦可安装的样品。所有实验重复进行两次。
[0295]
结果
[0296]
中尺度/大尺度的曲率诱因也影响3d环境中的细胞表型。这通过将角膜基质细胞包封在压缩的胶原蛋白凝胶中而得到证明,胶原蛋白凝胶是能够被诱导成具有限定直径的圆顶形曲率的可模制3d支架(图7)。经受此类曲率的细胞改变了它们的基因表达谱,具有角膜细胞外基质(图8a)和驻留的基质细胞群(图8b)特征性的几种标记上调。特别地,与平面凝胶中的细胞相比,弯曲的3d胶原蛋白凝胶中的细胞表达的角膜特异性蛋白聚糖角蛋白聚糖以及aldh3晶体蛋白的转录物水平明显更高。这些分子以前被描述为确保角膜透明度的基础。相反,弯曲的3d胶原蛋白凝胶内的细胞显示出与角膜混浊/浑浊强烈相关的创伤反应/应激标志物的表达降低(图8c和d)。与由曲率法诱导的胶原原纤维组织和凝胶超微结构的可能改变一起,细胞行为的这些改变也可以解释与它们的平面对应物相比,弯曲的3d胶原蛋白凝胶的透明度增加(图9)。
[0297]
氨基酸序列:
[0298]
纤连蛋白:
[0299]
seq id no:1rgd
[0300]
seq id no:5rgds
[0301]
seq id no:6phsrn
[0302]
seq id no:7ldvp
[0303]
seq id no:8wqpprari
[0304]
seq id no:9igd
[0305]
seq id no:10redv
[0306]
seq id no:11idap
[0307]
胶原蛋白:
[0308]
seq id no:2kttks
[0309]
seq id no:12gtpgpqgiagqrgvv
[0310]
seq id no:13groger
[0311]
seq id no:14glkgen
[0312]
seq id no:15gfoger
[0313]
seq id no:16mnyysns
[0314]
光蛋白聚糖:
[0315]
seq id no:3yealrvanevtln
[0316]
seq id no:17evtln
[0317]
seq id no:18eldlsynklk
[0318]
层粘连蛋白:
[0319]
seq id no:1rgd
[0320]
seq id no:19yigsr
[0321]
seq id no:20ikvav
[0322]
seq id no:21ccrrikvavwlc
[0323]
seq id no:22hsnglplgggseeeaaavvv
[0324]
seq id no:23hsnglplgggseeeaaavvv(k)
[0325]
seq id no:4hsnglplgggseeeaaavvvk
[0326]
核酸序列:
[0327]
引物:
[0328]
胶原蛋白1
[0329]
seq id no:52f:cctgcgtgtaccccactca
[0330]
seq id no:53r:accagacatgcctcttgtcctt
[0331]
胶原蛋白5
[0332]
seq id no:24f:atcttccaaaggcccggatg
[0333]
seq id no:25r:aaatgcagacgcaggg-taca
[0334]
波形蛋白
[0335]
seq id no:26f:cctcctaccgcaggatgtt
[0336]
seq id no:27r:ctgtaggtgcgggtggac
[0337]
核心蛋白聚糖
[0338]
seq id no:28f:ctgcttgcacaagtttcctg
[0339]
seq id no:29r:gaccactcgaagatggcatt
[0340]
角蛋白聚糖
[0341]
seq id no:30f:tattcctggaaggcaaggtg
[0342]
seq id no:31r:acctgcctcacacttctagacc
[0343]
光蛋白聚糖
[0344]
seq id no:32f:cctggttgagctggatctgt
[0345]
seq id no:33r:taggatggccccagga
[0346]
aldh3
[0347]
seq id no:34f:ccccttcaacctcaccatcc
[0348]
seq id no:35r:gttctcactcagctccgagg
[0349]
mmp1
[0350]
seq id no:36f:aggtctctgagggtcaagca
[0351]
seq id no:37r:ctggttgaaaagcatgagca;
[0352]
sma
[0353]
seq id no:38f:ctgagcgtggctattccttc
[0354]
seq id no:39r:ttctcaagggaggatgagga
[0355]
mmp2
[0356]
seq id no:40f:ccaagcgtctagcaatacc
[0357]
seq id no:41r:tctggggcagtccaaagaac
[0358]
mmp3
[0359]
seq id no:42f:tgctttgtcctttgatgctg
[0360]
seq id no:43r:aagcttcctgagggatttgc;
new and improved technique of confined fluid loss.
″
curr eye res 38(1):41-52.
[0387]
li,f.,d.carlsson,c.lohmann,e.suuronen,s.vascotto,k.kobuch,h.sheardown,r.munger,m.nakamura and m.griffith(2003).
″
cellular and nerve regeneration within a biosynthetic extracellularmatrix for corneal transplantation.
″
proc natl acad sci usa 100(26):15346-15351.
[0388]
li,q.,a.kumar,e.makhija and g.v.shivashankar(2014).
″
the reguation of dynamic mechanical coupling between actin cytoskeleton and nucleus by matrix geometry
″
biomaterials 35(3):961-969.
[0389]
li,s.,y.han,h.lei,y.zeng,z.cui,q.zeng,d.zhu,r.lan,j.zhang,z.chen and j.chen(2017).
″
in vitro biomimetic platforms featuring a perfusion system and 3d spheroid culture promote the construction of tissue-engineered corneal endothelial layers.
″
sci rep 7(1):777.
[0390]
lwigale,p.y.(2015)chapter four-corneal development:different cells from a common progenitor.progress in molecular biology and translational science.j.f.hejtmancik and j.m.nickerson,academic press.134:43-59.
[0391]
mcmonnies,c.w.and g.c.boneham(2007).
″
corneal curvature stability with increased intraocular pressure.
″
eye contact lens 33(3):130-137.
[0392]
rafat,m.,f.li,p.fagerholm,n.s.lagali,m.a.watsky,r.munger,t.matsuura and m.griffith(2008).
″
peg-stabilized carbodiimide crosslinked collagen-chitosan hydrogels for corneal tissue engineering.
″
biomaterials 29(29):3960-3972.
[0393]
werner,m.,s.b.g.blanquer,s.p.haimi,g.korus,j.w.c.dunlop,g.n.duda,d.w.grijpma and a.petersen(2017).
″
surface curvature differentially regulates stem cell migration and differentiation via altered attachment morphology and nuclear deformation.
″
advanced science 4(2):1600347.
[0394]
wu,j.,j.rnjak-kovacina,y.du,m.l.funderburgh,d.l.kaplan and j.l.funderburgh (2014).
″
corneal stromal bioequivalents secreted on patterned silk substrates.
″
biomaterials 35(12):3744-3755.
[0395]
zhang,w.,j.chen,l.j.backman,a.d.malm and p.danielson(2017).
″
surface topography and mechanical strain promote keratocyte phenotype and extracellular matrix formation in a biomimetic 3d corneal model.
″
adv healthc mater 6(5).
[0396]
读者的注意力集中在与本技术相关的本说明书同时提交的或在本说明书之前提交的所有纸张和文件上,这些纸张和文件都可以通过本说明书进行公开检查,所有这些纸张和文件的内容在此引入作为参考。
[0397]
本说明书中公开的所有特征(包括任何所附权利要求、摘要和附图),和/或如此公开的任何方法或过程的所有步骤,可以以任何组合的形式进行组合,除非这些特征和/或步骤中的至少一些是相互排斥的组合。
[0398]
除非另有明确说明,本说明书中公开的每个特征(包括任何所附权利要求、摘要和
附图)可以由其相同、等效或类似目的的可替代特征代替。因此,除非另外明确说明,所公开的每个特征仅是一系列等效或类似特征的一般实例。
[0399]
本发明不限于任何前述实施方案的细节。本发明扩展到本说明书中公开的特征(包括任何所附权利要求、摘要和附图)中的任何新的一个或任何新的组合,或者扩展到如此公开的任何方法或过程的步骤中的任何新的一个或任何新的组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。