制备腺垂体或其前体组织的方法
1.本技术是申请日为2015年7月24日,中国申请号201580049128.x,发明名称为“制备腺垂体或其前体组织的方法”的分案申请。
[技术领域]
[0002]
本发明涉及用于在体外诱导多能干细胞分化成腺垂体或其祖先组织的技术。
[
背景技术:
]
[0003]
垂体(hypophysis)是邻近间脑下部的小的内分泌器官,并且作为多种激素的控制中心起主要作用。例如,其产生多种垂体激素,包括促进生命支持所必需的皮质类固醇产生的促肾上腺皮质素(acth),促进儿童生长的生长激素等。因此,垂体的机能障碍引起严重的系统疾病。然而,由于垂体是通过胚胎中极其复杂的发育过程形成的,所以难以由干细胞如胚胎干(es)细胞等形成垂体组织。
[0004]
本发明人应用快速聚集胚状体样聚集体无血清悬浮培养(serum-free floating culture of embryoid body-like aggregates with quick reaggregation,sfebq法,所述方法被确定为一种有效地由诸如es细胞等的多能干细胞分化神经细胞和视网膜细胞的方法),并且在体外成功地由小鼠es细胞自组织了垂体(非专利文件1)。在该方法中,通过在包含sag的无血清培养基中悬浮培养小鼠es细胞的聚集体激活hedgehog信号,并且同时在所述聚集体中形成下丘脑和口腔外胚层,并且其相互作用诱导垂体基板形成和拉特克囊的自组织。据报道,基于抑制实验,在该方法中,内源性bmp4信号是垂体基板形成所需要的。
[0005]
[文献列表]
[0006]
[非专利文件]
[0007]
非专利文件1:nature.2011 nov 9;480(7375):57-62
[0008]
[发明概述]
[0009]
[发明解决的问题]
[0010]
旨在由人多能干细胞自组织垂体,本发明人将上述方法应用于人多能干细胞。然而,他们不能如在小鼠中那样实现有效的垂体形成。
[0011]
因此,本发明的目的在于提供一种在体外由人多能干细胞有效诱导腺垂体或其前体组织的技术。
[0012]
[解决问题的方式]
[0013]
首先,本发明人添加对小鼠系统是外源性的bmp4,并且验证其作用。然而,在小鼠系统中,尽管添加外源性bmp4信号促进表面外胚层的形成,其相反对细胞聚集体内部神经上皮组织(下丘脑)的形成起抑制性作用,并且难以形成包括表面外胚层和下丘脑神经上皮组织二者的细胞聚集体。然而,出乎意料地发现,在使用人多能干细胞的系统中,与小鼠不同,外源性bmp4促进在表面上形成表面外胚层和在内部形成下丘脑神经上皮组织二者。当在包含bmp4和sag的培养基中悬浮培养人多能干细胞的聚集体时,在细胞聚集体中同时形成下丘脑神经上皮组织和表面外胚层二者,并且通过其相互作用在表面外胚层中形成垂体
基板。垂体基板内陷到内部,并且形成拉特克囊样囊结构。连续培育导致在垂体基板和拉特克囊中出现acth生产细胞、gh生产细胞和prl生产细胞。含有垂体基板或拉特克囊的细胞聚集体响应crh刺激分泌acth,并且acth分泌以反馈方式受糖皮质激素的抑制。因此,表明所述细胞聚集体具有响应下丘脑的刺激和来自下游靶组织的反馈调节以与机体内的垂体相同的方式控制垂体激素分泌的能力。
[0014]
本发明人基于上文提及的发现进行了进一步的研究并且完成了本发明。
[0015]
因此,本发明如下所述:
[0016]
[1]用于制备包含腺垂体或其前体组织的人细胞聚集体的方法,所述方法包括在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中悬浮培养人多能干细胞的聚集体。
[0017]
[2][1]的制备方法,其包括在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中悬浮培养人多能干细胞的聚集体,从而得到包含下丘脑神经上皮组织和表面外胚层的人细胞聚集体,并且将所得到的包含所述下丘脑神经上皮组织和表面外胚层的人细胞聚集体在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中进一步悬浮培养,从而诱导在表面外胚层中形成垂体基板和/或拉特克囊,由此得到包含1)下丘脑神经上皮组织和2)垂体基板和/或拉特克囊的人细胞聚集体。
[0018]
[3][2]的制备方法,其中用于所述进一步悬浮培养的培养基还包含fgf2。
[0019]
[4][2]或[3]的制备方法,其包括将所述包含1)下丘脑神经上皮组织和2)垂体基板和/或拉特克囊的人细胞聚集体在包含作用于shh信号途径的物质的培养基中进一步悬浮培养,从而诱导垂体基板和/或拉特克囊向垂体激素生产细胞分化,由此得到包含腺垂体的人细胞聚集体。
[0020]
[5][4]的制备方法,其中用于所述进一步悬浮培养的培养基还包含fgf2。
[0021]
[6][4]或[5]的制备方法,其中用于所述进一步悬浮培养的培养基还包含notch信号抑制剂。
[0022]
[7][6]的制备方法,其中所述notch信号抑制剂是dapt。
[0023]
[8][4]-[7]中任一项的制备方法,其中所述垂体激素生产细胞是选自由下述组成的组的至少一种:生长激素(gh)生产细胞,促乳素(prl)生产细胞和促肾上腺皮质素(acth)生产细胞。
[0024]
[9][1]-[8]中任一项的制备方法,其中所述骨形态发生蛋白信号转导途径激活物质是bmp4。
[0025]
[10][1]-[9]中任一项的制备方法,其中所述作用于shh信号途径的物质是sag。
[0026]
[11][1]-[10]中任一项的制备方法,其中所述下丘脑神经上皮组织是腹侧下丘脑神经上皮组织。
[0027]
[12][1]-[11]中任一项的制备方法,其中所述多能干细胞是胚胎干细胞或诱导的多能干细胞。
[0028]
[13][1]-[12]中任一项的制备方法,其中所述悬浮培养在不存在饲养细胞的条件下进行。
[0029]
[14]通过[1]-[13]中任一项的制备方法可得到的细胞聚集体。
[0030]
[发明的效果]
[0031]
按照本发明,可以在体外由人多能干细胞有效地诱导腺垂体或其前体组织。在人多能干细胞的聚集体中同时形成下丘脑神经上皮组织和表面外胚层二者,并且通过其相互作用自组织垂体基板和拉特克囊。按照本发明,以与体内垂体相同的方式,可以在体外构建能够响应下丘脑的刺激和来自下游靶组织的反馈调节而调节垂体激素分泌的人腺垂体。
[0032]
[附图简述]
[0033]
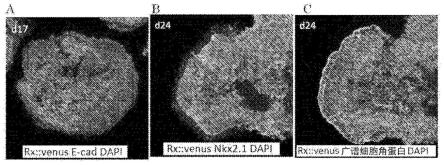
图1显示由人多能干细胞立体形成腹侧下丘脑和表皮基板。a:第17天的聚集体。rx::venus:绿色,e-钙黏着蛋白:红色,dapi:蓝色。b:第24天的聚集体。rx::venus:绿色,nkx2.1:红色,dapi:蓝色。c:第24天的聚集体。rx::venus:绿色,广谱细胞角蛋白(pan-cytokeratin):白色,dapi:蓝色。
[0034]
图2显示垂体基板的分化和拉特克囊的自组织。a:第30天的聚集体。左图,lim3:绿色,isl1/2:红色,dapi:蓝色。右图,pitx1:白色,dapi:蓝色。b:第27天的聚集体。rx::venus:绿色,lim3:红色,广谱细胞角蛋白:白色。c:第27天的聚集体.rx::venus:绿色,lim3:红色,广谱细胞角蛋白:白色。
[0035]
图3下式在不添加bmp4的条件下的分化诱导。第24或25天聚集体的照片。a和c:无sag。b和d:第6
–
25天,sag(200nm)。a和b:rx::venus:绿色,foxg1:红色,dapi:蓝色。c和d:rx::venus:绿色,nkx2.1:红色,pax6:白色。
[0036]
图4显示hedgehog信号在垂体基板诱导分化中的作用。第24天的聚集体的照片。a和c:无sag。b、d和e:第6
–
25天,sag(2μm)。a和b:rx::venus:绿色,广谱细胞角蛋白:白色。c和d:chx10:红色。e:rx::venus:绿色,nkx2.1:红色,dapi:蓝色。
[0037]
图5显示自垂体基板诱导分化生产acth的内分泌细胞。a:第67天的聚集体。pitx1:白色,dapi:蓝色。b:第67天的聚集体。acth:绿色,dapi:蓝色。c:第70天的聚集体。rx::venus:绿色,acth:红色,dapi:蓝色。d:第100天的聚集体。rx::venus:绿色,acth:红色,dapi:蓝色。
[0038]
图6显示通过crh诱导来源于人多能干细胞的垂体内分泌细胞释放acth。a:crh刺激后培养物上清中的atch浓度(pg/ml)。b:氢化可的松(hydrocortisone)对培养物上清中的atch浓度(pg/ml)的影响。
[0039]
图7显示通过crh的自来源于人es细胞的acth生产细胞的acth和皮质类固醇的体内分泌。a:在移植后14天的acth生产细胞。hnuclei:红色,dapi:蓝色。b:在移植后14天的acth生产细胞。acth:绿色,dapi:蓝色。c:chr加载后血浆中的acth浓度。误差条显示平均值
±
s.e.m。**p《0.01,配对t-检验。d:chr加载后血浆中的皮质酮浓度。
[0040]
图8显示通过移植来源于人es细胞的acth生产细胞的对垂体切除小鼠的活动性、存活和体重减轻的改善。a:显示转轮活动性试验(running wheel activity test)的结果。b:显示家笼活动性试验(home-cage activity test)的结果。c:显示通过移植acth生产细胞对存活的改善。d:显示通过移植acth生产细胞对体重减轻的改善。误差条显示平均值
±
s.e.m。*p《0.05,**p《0.01,***p《0.001。student’s t检验(a,b),时序检验(c),mann-whitney检验(d)。
[0041]
图9显示通过dapt处理在聚集体中诱导tbx19表达。
[0042]
图10显示自垂体基板诱导分化生产gh的内分泌细胞和生产prl的内分泌细胞。a:
第67天的聚集体。prl:绿色,acth:红色,pitx1:白色,dapi:蓝色。b:第70天的聚集体。rx::venus:绿色,pitx1:红色,gh:白色,dapi:蓝色。
[0043]
图11显示由人多能干细胞立体形成背侧下丘脑。a:第21天的聚集体。rx::venus:绿色,nkx2.1:红色,pax6:白色,dapi:蓝色。a:第81天的聚集体。otp:红色,dapi:蓝色。
[0044]
图12显示通过grf诱导gh自来源于人多能干细胞的垂体内分泌细胞的释放。垂直轴显示培养物上清的gh浓度(pg/ml)。
[0045]
图13显示通过地塞米松(dexamethasone)诱导gh生产细胞。(a)显示通过grf诱导gh自地塞米松诱导的gh生产细胞的释放。n=3,单向anova,*p《0.05,***p《0.001。(b)显示促生长素抑制素处理对gh释放的影响。n=3,student’s t检验,***p《0.001。
[0046]
图14显示自垂体基板诱导内分泌细胞。a:gh生产细胞,b:prl生产细胞,c:tsh生产细胞。
[0047]
图15显示自垂体基板诱导内分泌细胞。a:lh生产细胞,b:fsh生产细胞。
[0048]
[实施方案描述]
[0049]
(1)多能干细胞
[0050]“多能干细胞”是指具有分化成组成身体的所有细胞的潜能(多能性)和经由细胞分裂产生具有相同的分化能力的子细胞的潜能(自我复制能力)的细胞。
[0051]
多能性可以通过将评价主题的细胞移植到裸鼠中并且检测是否存在包含三个胚层(外胚层、中胚层、内胚层)的每种细胞的畸胎瘤的形成来评价。
[0052]
多能干细胞的实例包括胚胎干细胞(es细胞),胚胎生殖细胞(eg细胞),诱导的多能干细胞(ips细胞)等,并且多能干细胞没有限制,只要其具有多能性和自我复制能力二者即可。在本发明中,优选使用胚胎干细胞或诱导的多能干细胞。
[0053]
例如,胚胎干细胞(es细胞)可以通过培养预植入的早期胚胎、构成早期胚胎的内细胞团、单个卵裂球等而建立(manipulating the mouse embryo a laboratory manual(操作小鼠胚胎实验室手册),第二版,cold spring harbor laboratory press(1994);thomson,j.a.等人,science,282,1145-1147(1998))。作为早期胚胎,可以使用通过对体细胞的细胞核进行核移植制备的早期胚胎(wilmut等人(nature,385,810(1997)),cibelli等人(science,280,1256(1998)),akira iritani等人(tanpakushitsu kakusan koso,44,892(1999)),baguisi等人(nature biotechnology,17,456(1999)),wakayama等人(nature,394,369(1998);nature genetics,22,127(1999);proc.natl.acad.sci.usa,96,14984(1999)),rideout iii等人(nature genetics,24,109(2000),tachibana等人(human embryonic stem cells derived by somatic cell nuclear transfer(通过体细胞核转移获得的人胚胎干细胞),cell(2013),出版中))。作为早期胚胎,还可以使用单性生殖胚(kim等人(science,315,482-486(2007)),nakajima等人(stem cells,25,983-985(2007)),kim等人(cell stem cell,1,346-352(2007)),revazova等人(cloning stem cells,9,432-449(2007)),revazova等人(cloning stem cells,10,11-24(2008))。
[0054]
用于本发明方法的胚胎干细胞中还包括通过将es细胞与体细胞进行细胞融合获得的融合的es细胞。
[0055]
胚胎干细胞可从适当的机构获得,并且可以购买商业产品。例如,人胚胎干细胞khes-1、khes-2和khes-3可从京都大学(kyoto university)的前沿医学科学研究所
(institute for frontier medical sciences)获得。
[0056]
胚胎生殖细胞(eg细胞)可以通过在lif、bfgf、scf等存在下培养原生殖细胞而建立(matsui等人,cell,70,841-847(1992),shamblott等人,proc.natl.acad.sci.usa,95(23),13726-13731(1998),turnpenny等人,stem cells,21(5),598-609,(2003))。
[0057]
诱导的多能干细胞(ips细胞)是指通过使体细胞(例如,成纤维细胞、皮肤细胞、淋巴细胞等)与核重编程因子(nuclear reprogramming factor)接触而人工获得多能性和自我复制能力的细胞。通过包括向体细胞(例如,成纤维细胞、皮肤细胞等)中引入由oct3/4、sox2、klf4和c-myc构成的核重编程因子的方法首次发现ips细胞(cell,126:第663-676页,2006)。此后,多名研究者已经在重编程因子的组合和所述因子的引入方法方面进行了多种改进,并且已经报道了多种诱导的多能干细胞的制备方法。
[0058]
所述核重编程因子可以用任意物质配置,诸如蛋白质因子或编码其的核酸(包括结合在载体中的形式)或低分子化合物,只要其是能够由诸如成纤维细胞等的体细胞诱导具有多能性和自我复制能力的细胞的物质即可。当所述核重编程因子是蛋白质因子或编码其的核酸时,优选的核重编程因子由以下组合示例(以下,仅显示蛋白质因子的名称):
[0059]
(1)oct3/4,klf4,sox2,c-myc(其中sox2可被sox1、sox3、sox15、sox17或sox18替换。klf4可被klf1、klf2或klf5替换。此外,c-myc可被t58a(活性形式突变体)、n-myc或l-myc替换。)
[0060]
(2)oct3/4,klf4,sox2
[0061]
(3)oct3/4,klf4,c-myc
[0062]
(4)oct3/4,sox2,nanog,lin28
[0063]
(5)oct3/4,klf4,c-myc,sox2,nanog,lin28
[0064]
(6)oct3/4,klf4,sox2,bfgf
[0065]
(7)oct3/4,klf4,sox2,scf
[0066]
(8)oct3/4,klf4,c-myc,sox2,bfgf
[0067]
(9)oct3/4,klf4,c-myc,sox2,scf
[0068]
在这些组合中,当考虑将获得的ips细胞用于治疗应用时,优选的是oct3/4、sox2和klf4三种因子的组合。另一方面,当不考虑将ips细胞用于治疗应用时(例如,用作药物发现筛选等的研究工具),优选的是由oct3/4、klf4、sox2和c-myc组成的四种因子,或向其加入lin28或nanog的5种因子。
[0069]
ips细胞优选地用于自体移植。
[0070]
通过由已知的遗传工程方法修饰染色体中的基因而获得的多能干细胞也可以用于本发明。所述多能干细胞可以是这样的细胞,其中已经通过已知方法以符合读码框的(in-frame)方式在编码分化标记物的基因中敲入标记基因(例如,荧光蛋白,如gfp等),所述细胞可以通过使用所述标记基因的表达作为指标而被鉴定为已经达到相应的分化阶段。
[0071]
可以使用温血动物多能干细胞,优选哺乳动物多能干细胞作为多能干细胞。例如,哺乳动物包括实验室动物,包括啮齿动物,如小鼠、大鼠、仓鼠和豚鼠,和兔;家畜动物,如猪、牛、山羊、马和绵羊;陪伴动物,如狗和猫;灵长类动物,如人、猴、猩猩和黑猩猩。多能干细胞优选是啮齿动物(小鼠、大鼠等)或灵长类动物(人等)的多能干细胞,并且最优选是人多能干细胞。
[0072]
多能干细胞可以通过本身已知的方法培养来维持。例如,从临床应用方面来看,优选地通过使用血清替代品(如knockout
tm
血清替代物(knockout
tm serum replacement,ksr)等)的无血清培养或不含饲养细胞的培养维持多能干细胞。
[0073]
用于本发明的多能干细胞优选是分离的。成为“分离的”意指已经进行去除靶细胞或成分之外的因子的操作,并且所述细胞或成分不再以天然状态存在。“分离的人多能干细胞”的纯度(人多能干细胞的数目占总细胞数目的百分比)通常不小于70%,优选地不小于80%,更优选地不小于90%,进一步优选地不小于99%,最优选100%。
[0074]
(2)多能干细胞聚集体的形成
[0075]
可以通过在不粘附于培养容器的条件下培养(即,悬浮培养)分散的多能干细胞并且组装多个多能干细胞以允许聚集体形成,而获得多能干细胞聚集体。
[0076]
用于聚集体形成的培养容器没有特别限制,并且其实例包括烧瓶、组织培养瓶、平皿、培养皿、组织培养皿、多重平皿(multi-dishes)、微量板、微孔板、微孔、多重板(multi-plates)、多孔板、室载玻片(chamber slide)、碗(schale)、管、托盘、培养袋和旋转瓶。为了允许在非贴壁条件下的培养,培养容器优选是非细胞粘附的。可用的非细胞粘附培养容器包括其表面被人工处理成非细胞粘附的培养容器、其表面没有进行用于改善细胞粘附性的人工处理(例如,利用胞外基质的包被处理等)的培养容器等。
[0077]
用于聚集体形成的培养基可以使用用于培养哺乳动物细胞的培养基作为基础培养基来制备。所述基础培养基没有特别限制,只要其可以用于培养哺乳动物细胞即可,并且可以是bme培养基,bgjb培养基,cmrl1066培养基,glasgow mem培养基,改良的mem锌选择培养基(improved mem zinc option medium),imdm培养基,medium 199培养基,eagle mem培养基,αmem培养基,dmem培养基,ham培养基,ham’s f-12培养基,rpmi 1640培养基,fischer’s培养基,neurobasal培养基,其混合培养基等。在一个实施方案中,使用imdm培养基与ham’s f-12培养基的混合培养基。例如,混合比例为imdm:ham’s f-12=0.8-1.2:1.2-0.8(体积比)。
[0078]
用于培养的培养基可以是含有血清的培养基或无血清培养基。所述无血清培养基意指不含未调节的或未纯化的血清的培养基。含有纯化的来源于血液的成分和来源于动物组织的成分(例如,生长因子)的培养基对应于无血清培养基。为了避免化学上未确定的成分的污染,在本发明中优选使用无血清培养基。
[0079]
用于聚集体形成的培养基可以包含血清替代品。例如,所述血清替代品可以是适当地包含清蛋白、运铁蛋白、脂肪酸、胶原蛋白前体、痕量元素、2-巯基乙醇或3
’‑
硫代甘油或其等价物等的替代品。例如,这样的血清替代品可以通过wo98/30679中所述的方法制备。为了促使本发明的方法更容易实施,可以使用商购的血清替代品。所述商购血清替代品的实例包括敲除血清替代物(knockout serum replacement,ksr,由invitrogen制备),化学成分确定的浓缩脂质(chemically-defined lipid concentrated,由gibco company制备)和glutamax(由gibco company制备)。
[0080]
用于聚集体形成的培养基可以包含其他添加剂,只要对多能干细胞向垂体或其部分组织或其前体组织的分化诱导没有不利影响即可。添加剂的实例包括,但不限于,胰岛素、铁源(例如,运铁蛋白等)、矿物质(例如,硒酸钠等)、糖(例如,葡萄糖等)、有机酸(例如,丙酮酸、乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,
个、更优选约2
×
10
3-约1.2
×
104个多能干细胞构成的一个细胞聚集体。
[0088]
可以适当地确定至聚集体形成的时间,只要每个隔室形成一个聚集体,并且可以通过本发明的方法在所述聚集体中诱导多能干细胞向垂体或其部分组织、或其前体组织的分化。通过缩短所述时间,预期向目标垂体或其部分组织、或其前体组织的分化的有效诱导,并且,因此,所述时间优选更短。优选地,在24小时内形成多能干细胞聚集体,更优选地,在12小时内形成,更优选地在6小时内形成,最优选地在2
–
3小时内形成。可以通过由本领域技术人员选择用于细胞聚集的工具、离心条件等来适当地调节至聚集体形成的时间。
[0089]
可以适当地设定其他培养条件,如聚集体形成时的培养温度和co2浓度。培养温度没有特别限制,并且,例如,是约30-40℃,优选地约37℃。例如,co2浓度是约1-10%,优选约5%。
[0090]
此外,准备多个在相同培养条件下的培养隔室,并且在每个培养隔室中形成一个多能干细胞聚集体,由此可以获得多能干细胞聚集体的质量均一的群体。多能干细胞聚集体是否是质量均一的可以基于下述进行评价:聚集体团块的尺寸和其中的细胞数量,通过组织染色分析的其宏观形态学、微观形态学和同质性,分化和不分化标记物的表达及其同质性,分化标记物表达的调节及其同步性,聚集体间分化效率的重现性等。在一个实施方案中,用于本发明方法的多能干细胞聚集体的群体在所述聚集体中包含均一数量的多能干细胞。特定参数“均一”的多能干细胞聚集体的群体意指在其群体中的总聚集体的不低于90%落在所述聚集体群体中该参数的平均数
±
10%、优选
±
5%的范围内。
[0091]
(3)腺垂体或其前体组织的诱导
[0092]
本发明提供制备包含腺垂体或其祖先组织的细胞聚集体的方法,所述方法包括在含有骨形态发生蛋白信号转导途径激活物质和作用于sonic hedgehog(shh)信号途径的物质的培养基中悬浮培养多能干细胞的聚集体。
[0093]
在本发明中,腺垂体是指包含至少一种产生垂体前叶激素或垂体中叶激素的细胞的组织。垂体激素生产细胞的实例包括组成前叶的细胞,诸如生长激素(gh)生产细胞,促乳素(prl)生产细胞,促肾上腺皮质素(acth)生产细胞,促甲状腺激素(tsh)生产细胞,促卵泡激素(fsh)生产细胞,促黄体激素(lh)生产细胞等;和组成中叶的细胞,诸如促黑激素(msh)生产细胞等。在一个实施方案中,腺垂体包含至少一种、优选两种、更优选三种选自由下述组成的组的垂体激素生产细胞:生长激素(gh)生产细胞,促乳素(prl)生产细胞,和促肾上腺皮质素(acth)生产细胞。在另一个实施方案中,腺垂体包含至少一种、优选两种或更多种(2,3,4,5或6种)选自由下述组成的组的垂体激素生产细胞:生长激素(gh)生产细胞,促乳素(prl)生产细胞,促肾上腺皮质素(acth)生产细胞,促甲状腺激素(tsh)生产细胞,促卵泡激素(fsh)生产细胞,和促黄体激素(lh)生产细胞。
[0094]
在本发明中,组织是指具有这样的结构的细胞群体的结构:其中具有不同形式和特性的多种细胞以特定的样式立体排列。
[0095]
作为腺垂体的前体组织,可以提及垂体基板、拉特克囊等。垂体基板是在胚胎发生发育过程中在表面外胚层区中形成的加厚的结构,并且表达垂体祖先细胞标记。作为垂体祖先细胞标记,可以提及lim3、pitx1、isl1/2等。垂体基板表达至少一种、优选全部的选自由lim3、pitx1和isl1/2组成的组的垂体祖先细胞标记。拉特克囊是指通过垂体基板的内陷形成的囊结构。
[0096]
本发明的制备方法具体地包括在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中悬浮培养多能干细胞的聚集体,从而得到包含下丘脑神经上皮组织和表面外胚层的细胞聚集体(第一培养步骤),并且将得到的包含所述下丘脑神经上皮组织和表面外胚层的细胞聚集体在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中进一步悬浮培养,从而得到包含1)下丘脑神经上皮组织和2)垂体基板和/或拉特克囊的细胞聚集体(第二培养步骤)。第一培养步骤诱导所述多能干细胞分化下丘脑神经上皮组织和表面外胚层,并且通过使包含所述下丘脑神经上皮组织和表面外胚层的细胞聚集体进行第二培养步骤,诱导所述表面外胚层向垂体基板和/或拉特克囊的进一步分化。
[0097]
(3.1)第一培养步骤
[0098]
在第一培养步骤中,在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中悬浮培养多能干细胞的聚集体。
[0099]
多能干细胞聚集体的“悬浮培养”是指在不粘附培养容器的条件下在培养基中培养多能干细胞的聚集体。这允许腺垂体或其前体组织的有效诱导,而这在常规上是困难的。
[0100]
用于悬浮培养的培养基含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质。通过骨形态发生蛋白信号转导途径激活物质与作用于shh信号途径的物质的作用,诱导由多能干细胞分化下丘脑神经上皮组织和表面外胚层。
[0101]
在本发明中,骨形态发生因子信号转导途径激活物质是激活该途径的任意物质,在骨形态发生因子与受体结合后,信号通过该途径传递。所述骨形态发生因子信号转导途径激活物质的实例包括bmp2,bmp4,bmp7,gdf5等。优选地,所述骨形态发生因子信号转导途径激活物质是bmp4。尽管以下主要描述bmp4,但是,用于本发明的骨形态发生因子信号转导途径激活物质不限于bmp4。bmp4是已知的细胞因子,其氨基酸序列也是已知的。用于本发明的bmp4是哺乳动物bmp4。哺乳动物的实例包括实验动物,如啮齿动物(诸如小鼠、大鼠、仓鼠、豚鼠等),兔等;家养动物,如猪、牛、山羊、马、绵羊等;陪伴动物,如狗、猫等;和灵长类动物,如人、猴、猩猩、黑猩猩等。bmp4优选是啮齿动物(小鼠,大鼠等)或灵长类动物(人等)的bmp4,最优选是人bmp4。人bmp4意指bmp4具有在人体中天然表达的bmp4的氨基酸序列。代表性的人bmp4的氨基酸序列的实例包括ncbi登记号np_001193.2(2013年6月15日更新),np_570911.2(2013年6月15日更新),np_570912.2(2013年6月15日更新),通过从这些氨基酸序列中的每个去除n端信号序列(1-24)获得的氨基酸序列(成熟形式的人bmp4氨基酸序列)等。
[0102]
在本发明中,所述作用于shh信号途径的物质没有特别限制,只要其能够增强由shh介导的信号转导即可。所述作用于shh信号途径的物质的实例包括,但不限于,属于hedgehog家族的蛋白(例如,shh),shh受体,shh受体激动剂,purmorphamine,smoothened agonist(sag)(3-氯-n-[反式-4-(甲基氨基)环己基]-n-[[3-(4-吡啶基)苯基]甲基]-苯并[b]噻吩-2-甲酰胺)等。其中,优选sag。
[0103]
优选的骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的组合是bmp4和sag的组合。
[0104]
骨形态发生蛋白信号转导途径激活物质在培养基中的浓度可以适当地设定在允许在所述细胞聚集体中诱导多能干细胞向下丘脑神经上皮组织和表面外胚层分化的范围
内。当使用bmp4作为骨形态发生蛋白信号转导途径激活物质时,其浓度通常不小于0.01nm,优选不小于0.1nm,更优选不小于1nm。尽管没有特别设定上限,只要不发现对向下丘脑神经上皮组织和表面外胚层的分化的不利作用即可,从培养成本的方面来看,其通常不大于1000nm,优选不大于100nm,更优选不大于10nm。在一个实施方案中,培养基中bmp4的浓度通常为0.01-1000nm,优选0.1-100nm,更优选为1-10nm(例如,5nm)。由于外源性骨形态发生蛋白信号转导途径激活物质特别有助于:1)表面外胚层的侵入性形成,和2)在细胞聚集体中诱导下丘脑而不是大脑的神经上皮组织的分化,因此将其以能够提供这些作用的浓度包含在培养基中。
[0105]
不需要在第一培养步骤的整个时间期内都在培养基中包含所述骨形态发生蛋白信号转导途径激活物质。例如,可以自多能干细胞聚集体的悬浮培养开始起的2-4天(例如,3天)不向培养基中加入骨形态发生蛋白信号转导途径激活物质,并且可以在此后向培养基中加入所述骨形态发生蛋白信号转导途径激活物质。
[0106]
所述作用于shh信号途径的物质在培养基中的浓度可以适当地设定在允许在细胞聚集体中诱导多能干细胞向下丘脑神经上皮组织和表面外胚层分化的范围内。当使用sag作为所述作用于shh信号途径的物质时,其浓度通常不小于1nm,优选不小于10nm,更优选不小于100nm。尽管没有特别设定上限,只要不发现对向下丘脑神经上皮组织和表面外胚层的分化的不利作用即可,从培养成本的方面来看,其通常不大于1000μm,优选不大于100μm,更优选不大于10μm。在一个实施方案中,培养基中sag的浓度通常为1nm-1000μm,优选为10nm-100μm,更优选为100nm-10μm(例如,2μm)。由于外源性作用于shh信号途径的物质特别在诱导下丘脑(优选腹侧下丘脑)而不是神经视网膜的神经上皮组织的分化中起作用,因此,将其以能够提供这一作用的浓度包含在培养基中。
[0107]
不需要在第一培养步骤的整个时间期内都在培养基中包含所述作用于shh信号途径的物质。例如,可以自多能干细胞聚集体的悬浮培养开始起的5-7天(例如,6天)不向培养基中加入作用于shh信号途径的物质,并且可以在此后向培养基中加入作用于shh信号途径的物质。
[0108]
在一个实施方案中,将多能干细胞的聚集体在不含骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中悬浮培养2
–
4天,然后,将得到的聚集体在含有骨形态发生蛋白信号转导途径激活物质而不含作用于shh信号途径的物质的培养基中悬浮培养2
–
4天,并且进一步地,将得到的聚集体在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中悬浮培养直到诱导了下丘脑神经上皮组织和表面外胚层。
[0109]
用在本发明中的骨形态发生蛋白信号转导途径激活物质(如bmp4等)优选是分离的。“分离的”意指已经进行去除靶标成分或细胞之外的因子的操作,并且所述成分或细胞不再以天然状态存在。因此,“分离的蛋白x”不包括由培养的细胞或组织产生的内源性蛋白x。“分离的蛋白x”的纯度(蛋白x的重量占总蛋白重量的百分比)通常不小于70%,优选地不小于80%,更优选地不小于90%,进一步优选地不小于99%,最优选100%。在用于悬浮培养的培养基中包含的分离的骨形态发生蛋白信号转导途径激活物质是外源性添加到所述培养基中的。因此,在一个实施方案中,本发明包含向用于第一培养步骤中的培养基中外源性加入分离的骨形态发生蛋白信号转导途径激活物质的步骤。
[0110]
为了抑制由分散引起的多能干细胞(特别是人多能干细胞)的细胞死亡,优选的是自培育开始起就在用于第一培养步骤的培养基中加入rho相关卷曲螺旋激酶(rock)的抑制剂(jp-a-2008-99662)。例如,rock抑制剂在自培养开始起的15天内加入,优选在10天内加入,更优选在6天内加入。rock抑制剂的实例包括y-27632(( )-(r)-反式-4-(1-氨基乙基)-n-(4-吡啶基)环己烷甲酰胺二盐酸盐)等。用于悬浮培养的rock抑制剂的浓度是能够抑制由分散引起的多能干细胞的细胞死亡的浓度。例如,对于y-27632,该浓度通常约为0.1-200μm,优选地约2-50μm。rock抑制剂的浓度在其添加期间可以变化,例如,在后半阶段浓度可以减半。
[0111]
用于细胞聚集体悬浮培养的培养基可以使用用于培养哺乳动物细胞的培养基作为基础培养基来制备。所述基础培养基没有特别限制,只要其可以用于培养哺乳动物细胞即可,并且可以是bme培养基,bgjb培养基,cmrl 1066培养基,glasgow mem培养基,改良的mem锌选择培养基,imdm培养基,medium 199培养基,eagle mem培养基,αmem培养基,dmem培养基,ham培养基,ham’s f-12培养基,rpmi 1640培养基,fischer’s培养基,neurobasal培养基,其混合培养基等。在一个实施方案中,使用imdm培养基与ham’s f-12培养基的混合培养基。例如,混合比例为imdm:ham’s f-12=0.8-1.2:1.2-0.8(体积比)。
[0112]
用于培养的培养基可以是含有血清的培养基或无血清培养基。为了避免化学上未确定的成分的污染,用于悬浮培养细胞聚集体的培养基优选是无血清培养基。
[0113]
用于悬浮培养细胞聚集体的培养基可以包含血清替代品。例如,所述血清替代品可以是适当地包含清蛋白、运铁蛋白、脂肪酸、胶原蛋白前体、痕量元素、2-巯基乙醇或3
’‑
硫代甘油或它们的等价物等的替代品。这样的血清替代品可以例如通过wo98/30679中所述的方法制备。为了促使本发明的方法更容易实施,可以使用商购的血清替代品。所述商购血清替代品的实例包括ksr(敲除血清替代物)(由invitrogen制备),化学成分确定的浓缩脂质(由gibco company制备)和glutamax(由gibco company制备)。
[0114]
用于悬浮培养细胞聚集体的培养基可以包含其他添加剂,只要没有对多能干细胞向下丘脑神经上皮组织和表面外胚层的分化的诱导施加不利的影响即可。所述添加剂的实例包括,但不限于,胰岛素、铁源(例如,运铁蛋白等)、矿物质(例如,硒酸钠等)、糖(例如,葡萄糖等)、有机酸(例如,丙酮酸,乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇等)、维生素(例如,抗坏血酸,d-生物素等)、抗生素(例如,链霉素,青霉素,庆大霉素等)、缓冲剂(例如,hepes等)等。
[0115]
在一个实施方案中,为了避免对诱导向下丘脑神经上皮组织和表面外胚层的分化的不利影响,用于悬浮培养细胞聚集体的培养基是补充有血清替代品(ksr等)的除了本说明书中特别描述包含在培养基中的那些之外不含生长因子的化学合成的培养基(不含生长因子的化学成分确定的培养基(growth-factor-free chemically defined medium);gfcdm)。此处,“生长因子”包括模式形成因子(pattern formation factor),如fgf;bmp;wnt,nodal,notch,shh等;胰岛素和富脂质清蛋白。不含生长因子的化学合成的培养基的实例包括wataya等人,proc natl acad sci usa,105(33):11796-11801,2008中公开的gfcdm。
[0116]
可以适当地设定用于悬浮培养细胞聚集体的其他培养条件,如培养温度、co2浓度、o2浓度等。例如,培养温度是约30-40℃,优选约37℃。co2浓度例如是约1-10%,优选约
5%。o2浓度例如是约20%。
[0117]
在优选的实施方案中,将多能干细胞聚集体的质量均一的群体在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中悬浮培养。使用多能干细胞聚集体的质量均一的群体,可以将聚集体之间向腺垂体或其前体组织的分化水平的差异抑制至最小程度,并且可以提高目标分化诱导的效率。多能干细胞聚集体的质量均一的群体的悬浮培养包括以下实施方案:
[0118]
(1)准备多个培养隔室,并且接种多能干细胞聚集体的质量均一的群体,以使在一个培养隔室中包含一个多能干细胞聚集体(例如,在96孔板的每个孔中放置一个多能干细胞聚集体)。在每个培养隔室中,将一个多能干细胞聚集体在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中悬浮培养。
[0119]
(2)接种多能干细胞聚集体的质量均一的群体,以使在一个培养隔室中包含多个多能干细胞聚集体(例如,在10cm的平皿中放置多个多能干细胞聚集体)。在所述培养隔室中,将多个多能干细胞聚集体在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中悬浮培养。
[0120]
可以将实施方案(1)和(2)中任一个用于本发明的方法,并且在培养过程中可以改变实施方案(从实施方案(1)到实施方案(2),或从实施方案(2)到实施方案(1))。在一个实施方案中,在第一培养步骤中用(1)的实施方案,并且在第二培养步骤中用(2)的实施方案.
[0121]
第一培养步骤进行足以诱导由多能干细胞分化下丘脑神经上皮组织和表面外胚层的时间期。向下丘脑神经上皮组织和表面外胚层的分化可以通过例如rt-pcr或使用对下丘脑神经上皮组织或表面外胚层的标记特异性的抗体的免疫组织化学进行检测。例如,进行第一培养步骤,直到培养物中不少于10%、优选不少于30%、更优选不少于50%的细胞聚集体包含下丘脑神经上皮组织和表面外胚层。尽管由于培养时间期可以依据多能干细胞的动物物种以及骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的种类而变化而不能无条件地指定培养时间期,但是,当使用人多能干细胞时,第一培养步骤例如通常为15
–
20天(例如,18天)。
[0122]
通过进行第一培养步骤,可以得到包含下丘脑神经上皮组织和表面外胚层的细胞聚集体。
[0123]
所述下丘脑神经上皮组织是表达下丘脑标记的神经上皮组织。下丘脑包括腹侧下丘脑和背侧下丘脑。作为下丘脑标记,可以提及nkx2.1(腹侧下丘脑标记)、pax6(背侧下丘脑标记)等。在一个实施方案中,腹侧下丘脑神经上皮组织是rx-阳性、chx10-阴性和nkx2.1-阳性的神经上皮组织。在一个实施方案中,背侧下丘脑神经上皮组织是rx-阳性、chx10-阴性和pax6-阳性的神经上皮组织。在第一培养步骤中得到的细胞聚集体中包含的下丘脑神经上皮组织优选是腹侧下丘脑神经上皮组织。
[0124]
表面外胚层是在胚胎发生发育中在胚胎表层上形成的外胚层细胞层。作为表面外胚层标记,可以提及广谱细胞角蛋白。表面外胚层通常可以分化成垂体前叶、皮肤、口腔上皮、牙釉质、皮腺等。在一个实施方案中,表面外胚层是e-钙黏着蛋白阳性的和广谱细胞角蛋白-阳性的细胞层。
[0125]
优选地,下丘脑神经上皮组织占据在第一培养步骤中得到的细胞聚集体的内部,并且单层表面外胚层的细胞组成所述细胞聚集体的表面。表面外胚层可以在其一部分中包
含加厚的表皮基板。
[0126]
(3.2)第二培养步骤
[0127]
在第二培养步骤中,将在第一培养步骤中得到的包含下丘脑神经上皮组织和表面外胚层的细胞聚集体在含有骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的培养基中进一步悬浮培养,由此得到包含1)下丘脑神经上皮组织和2)垂体基板和/或拉特克囊的细胞聚集体。通过所述骨形态发生蛋白信号转导途径激活物质与所述作用于shh信号途径的物质的作用,诱导表面外胚层向垂体基板和/或拉特克囊的进一步分化。
[0128]
所述骨形态发生蛋白信号转导途径激活物质和所述作用于shh信号途径的物质的定义如在第一培养步骤的解释中所述。
[0129]
优选地,与第一培养步骤相同,用于第二培养步骤的骨形态发生蛋白信号转导途径激活物质是bmp4。优选地,与第一培养步骤相同,用于第二培养步骤的作用于shh信号途径的物质是sag。
[0130]
优选的骨形态发生蛋白信号转导途径激活物质与作用于shh信号途径的物质的组合是bmp4与sag的组合。
[0131]
所述骨形态发生因子信号转导途径激活物质在培养基中的浓度可以适当地确定在能够在所述细胞聚集体中诱导表面外胚层向垂体基板和/或拉特克囊分化的范围内。当使用bmp4作为骨形态发生因子信号转导途径激活物质时,其浓度通常不少于0.01nm,优选地,不少于0.1nm,更优选地不少于1nm。尽管上限没有特别设定,只要不发现对表面外胚层向垂体基板和/或拉特克囊的分化的不利作用即可,但从培养成本方面来看,其通常不大于1000nm,优选地不大于100nm,更优选地不大于10nm。在一个实施方案中,培养基中bmp4的浓度通常是0.01-1000nm,优选地0.1-100nm,更优选地1-10nm(例如,5nm)。骨形态发生蛋白信号转导途径激活物质的浓度在添加时间期内可以变化。例如,在第二培养步骤开始的时刻,浓度可以设定为前述浓度,并且每2
–
4天可以减少到一半。
[0132]
所述作用于shh信号途径的物质在培养基中的浓度可以适当设定在允许在所述细胞聚集体中诱导表面外胚层向垂体基板或拉特克囊分化的范围内。当使用sag作为所述作用于shh信号途径的物质时,其浓度通常不少于1nm,优选地不少于10nm,更优选地不少于100nm。尽管上限没有特别设定,只要不发现对向垂体基板或拉特克囊分化的不利作用即可,但从培养成本方面来看,其通常不大于1000μm,优选地不大于100μm,更优选地不大于10μm。在一个实施方案中,培养基中sag的浓度通常为1nm-1000μm,优选地10nm-100μm,更优选地100nm-10μm(例如,2μm)。
[0133]
在优选的实施方案中,用于第二培养步骤的培养基包含fgf2。fgf2促进表面外胚层向垂体基板的分化。
[0134]
fgf2是一种已知的细胞因子,其还称为碱性成纤维细胞生长因子(bfgf),并且其氨基酸序列是已知的。用于本发明的fgf2通常是哺乳动物fgf2。哺乳动物的实例包括上文提及的那些。由于fgf2在多种哺乳动物物种之间具有交叉反应性,也可以使用任意哺乳动物的fgf2,只要能够实现本发明的目的即可。优选地,使用与培养的细胞相同物种的哺乳动物fgf2。例如,使用啮齿动物(小鼠、大鼠等)或灵长动物(人等)的fgf2。此处,小鼠fgf2意指fgf2具有在小鼠体内天然表达的fgf2的氨基酸序列。在本说明书中,相似的解释也应用其
他蛋白等。代表性的小鼠fgf2的氨基酸序列的实例包括ncbi登记号np_032032.1(2014年2月18日更新),通过从所述氨基酸序列去除n-端信号序列(1-9)得到的氨基酸序列(成熟的小鼠fgf2氨基酸序列)等。代表性的人fgf2的氨基酸序列的实例包括ncbi登记号np_001997.5(2014年2月18日更新)等。
[0135]
尽管培养基中fgf2的浓度没有特别限定,只要其能够促进表面外胚层向垂体基板的分化即可,但是其通常不少于1ng/ml,优选地不少于10ng/ml。尽管fgf2浓度的上限没有特别设定,只要不发现对向垂体基板和/或拉特克囊分化的不利作用即可,但从培养成本方面来看,其通常不大于1000ng/ml,优选地不大于500ng/ml。在一个实施方案中,培养基中fgf2的浓度通常为1-1000ng/ml,优选地为10-100ng/ml。
[0136]
用在本发明中的骨形态发生蛋白信号转导途径激活物质(如bmp4等)和fgf2优选地是分离的。在用于第二培养步骤中的培养基中包含的分离的骨形态发生蛋白信号转导途径激活物质和分离的fgf2是外源添加到培养基中的。因此,在一个实施方案中,本发明包括向用于第二培养步骤的培养基中外源添加分离的骨形态发生蛋白信号转导途径激活物质(并且可选地,分离的fgf2)的步骤。
[0137]
如在第一培养步骤中使用的培养基,用于第二培养步骤的培养基可以通过使用用于培养哺乳动物细胞的培养基作为基础培养基而制备。基础培养基没有特别限制,只要其能够用于培养哺乳动物细胞即可,并且可以是bme培养基,bgjb培养基,cmrl 1066培养基,glasgow mem培养基,改良的mem锌选择培养基,imdm培养基,medium 199培养基,eagle mem培养基,αmem培养基,dmem培养基,ham培养基,ham’s f-12培养基,rpmi 1640培养基,fischer’s培养基,neurobasal培养基,它们的混合的培养基等。在一个实施方案中,使用imdm培养基与ham’s f-12培养基的混合培养基。例如,混合比例为imdm:ham’s f-12=0.8-1.2:1.2-0.8(体积比)。
[0138]
用于培养的培养基可以是含有血清的培养基或无血清培养基。为了避免化学上没有确定的成分的污染,用于悬浮培养细胞聚集体的培养基优选是无血清培养基。
[0139]
用于悬浮培养细胞聚集体的培养基可以包含血清替代品。例如,所述血清替代品可以是适当地包含清蛋白、运铁蛋白、脂肪酸、胶原蛋白前体、痕量元素、2-巯基乙醇或3
’‑
硫代甘油或它们的等价物等的替代品。这样的血清替代品可以例如通过wo98/30679中所述的方法制备。为了促使本发明的方法更容易实施,可以使用商购的血清替代品。所述商购血清替代品的实例包括ksr(敲除血清替代物)(由invitrogen制备),化学成分确定的浓缩脂质(由gibco company制备)和glutamax(由gibco company制备)。
[0140]
用于悬浮培养细胞聚集体的培养基可以包含其他添加剂,只要没有对诱导表面外胚层向垂体基板和/或拉特克囊分化施加不利影响即可。所述添加剂的实例包括,但不限于,胰岛素、铁源(例如,运铁蛋白等)、矿物质(例如,硒酸钠等)、糖(例如,葡萄糖等)、有机酸(例如,丙酮酸,乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇等)、维生素(例如,抗坏血酸,d-生物素等)、抗生素(例如,链霉素,青霉素,庆大霉素等)、缓冲剂(例如,hepes等)等。
[0141]
在一个实施方案中,为了避免对诱导向垂体基板和/或拉特克囊分化的不利影响,用于悬浮培养细胞聚集体的培养基是补充有血清替代品(ksr等)的除了本说明书中特别描述包含在培养基中的那些之外不含生长因子的化学合成的培养基(不含生长因子的化学成
分确定的培养基;gfcdm)。此处,“生长因子”包括模式形成因子,如fgf;bmp;wnt,nodal,notch,shh等;胰岛素和富脂质清蛋白。不含生长因子的化学合成的培养基的实例包括wataya等人,proc natl acad sci usa,105(33):11796-11801,2008中公开的gfcdm。
[0142]
在第二培养步骤中的悬浮培养优选地在高氧分压条件下进行。当在高氧分压条件下进一步悬浮培养包含下丘脑神经上皮组织和表面外胚层的细胞聚集体时,实现将氧气递送至所述细胞聚集体内部,以及长时间期维持所述细胞聚集体的培养,这能够允许向垂体基板和/或拉特克囊分化的有效诱导。
[0143]
高氧分压条件意指超过空气中的氧分压(20%)的氧分压条件。在第二培养步骤中的氧分压例如是30-60%,优选地是35-60%,更优选地是38-60%。
[0144]
可以适当地设定在第二培养步骤中的其他培养条件,如培养温度和co2浓度。例如,培养温度是约30-40℃,优选约37℃。co2浓度例如是约1-10%,优选约5%。
[0145]
进行第二培养步骤,持续足以诱导表面外胚层向垂体基板和/或拉特克囊分化的时间期。通过进行第二培养步骤,在所述表面外胚层中形成垂体基板。所述垂体基板中的一些或全部可以内陷到所述细胞聚集体内部(即,邻近下丘脑神经上皮),从而形成拉特克囊。表面外胚层向垂体基板和/或拉特克囊的分化主要需要在所述表面外胚层与下丘脑神经上皮组织(优选地,腹侧下丘脑神经上皮组织)之间的相互作用。在本发明中,通过第一培养步骤,在所述细胞聚集体中同时形成下丘脑神经上皮组织和表面外胚层;在优选的实施方案中,下丘脑神经上皮组织占据所述细胞聚集体的内部,并且单层表面外胚层的细胞组成所述细胞聚集体的表面。结果,在所述细胞聚集体内,在邻近的表面外胚层与下丘脑神经上皮组织之间的相互作用变得可能,并且可以在体外重现胚胎发生发育中的垂体的自组织过程,诸如在表面外胚层中的垂体基板形成,垂体基板的内陷,拉特克囊的形成等。例如,向垂体基板和/或拉特克囊的分化可以通过使用针对垂体祖先细胞标记(例如,lim3,pitx1,isl1/2等)的特异性抗体的免疫组织化学检测垂体祖先细胞标记-阳性的基板或囊结构的形成而证实。例如,进行第二培养步骤,直到培养物中不少于10%、优选地不少于30%、更优选地不少于50%的细胞聚集体包含垂体基板和/或拉特克囊。尽管由于培养时间期可以依据多能干细胞的动物物种以及骨形态发生蛋白信号转导途径激活物质和作用于shh信号途径的物质的种类而变化而不能无条件地指定培养时间期,但是,当使用人多能干细胞时,第二培养步骤例如通常不少于6天,例如,6
–
12天。
[0146]
通过进行第二培养步骤,可以得到包含1)下丘脑神经上皮组织和2)垂体基板和/或拉特克囊的细胞聚集体。
[0147]
(3.3)第三培养步骤
[0148]
将在第二培养步骤中得到的包含1)下丘脑神经上皮组织和2)垂体基板和/或拉特克囊的细胞聚集体在包含作用于shh信号途径的物质的培养基中进一步悬浮培养,由此可以得到包含腺垂体的细胞聚集体(第三培养步骤)。通过第三培养步骤,诱导垂体基板和/或拉特克囊向垂体激素生产细胞分化,并且在所述垂体基板和/或拉特克囊中产生了垂体激素生产细胞,由此可以形成腺垂体。
[0149]
所述作用于shh信号途径的物质的定义如在第一培养步骤的解释中所述。
[0150]
优选地,与在第一和第二培养步骤中相同,用于第三培养步骤的作用于shh信号途径的物质是sag。
[0151]
所述作用于shh信号途径的物质在培养基中的浓度可以适当地设定在允许在所述细胞聚集体中诱导垂体基板和/或拉特克囊向垂体激素生产细胞分化的范围内。当使用sag作为所述作用于shh信号途径的物质时,其浓度通常不少于1nm,优选地不少于10nm,更优选地不少于100nm。尽管没有特别设定上限,只要不发现对向垂体激素生产细胞的分化的不利作用即可,从培养成本的方面来看,其通常不大于不大于1000μm,优选地不大于100μm,更优选地不大于10μm。在一个实施方案中,培养基中sag的浓度通常为1nm-1000μm,优选地是10nm-100μm,更优选地是100nm-10μm(例如,2μm)。
[0152]
在优选的实施方案中,用于第三培养步骤的培养基包含fgf2。fgf2促进垂体基板和/或拉特克囊向垂体激素生产细胞的分化。
[0153]
fgf2的定义如在第二培养步骤的解释中所述。
[0154]
尽管培养基中fgf2的浓度没有特别限定,只要其能够促进垂体基板和/或拉特克囊向垂体激素生产细胞的分化即可,但其通常不少于1ng/ml,优选地不少于10ng/ml。尽管不特别设定fgf2浓度的上限,只要不发现对向垂体激素生产细胞的分化的不利作用即可,但从培养成本的方面看来,其通常不大于1000ng/ml,优选地不大于500ng/ml。在一个实施方案中,培养基中fgf2的浓度通常为1-1000ng/ml,优选地是10-100ng/ml。
[0155]
在优选的实施方案中,用在第三培养步骤的培养基包含notch信号抑制剂。notch信号抑制剂促进垂体基板和/或拉特克囊向垂体激素生产细胞(特别是acth生产细胞)的分化。notch信号抑制剂增加转录因子tbx19的表达,所述转录因子进行acth产生的上游调节。
[0156]
notch信号抑制剂没有特别限制,只要其抑制由notch介导的信号转导即可。notch信号抑制剂的实例包括γ分泌酶抑制剂,如dapt(n-[n-(3,5-二氟苯乙酰基)-1-丙氨酰基]-s-苯基甘氨酸叔丁基酯),dbz,mdl28170等。这些中优选dapt。
[0157]
尽管培养基中notch信号抑制剂的浓度没有特别限制,只要其能够促进垂体基板和/或拉特克囊向垂体激素生产细胞(特别是acth生产细胞)的分化即可,但是,例如,在dapt的情形中,其通常不少于0.1μm,优选地不少于1μm。尽管dapt浓度的上限没有特别设定,只要不发现对向垂体激素生产细胞的分化的不利作用即可,但从培养成本方面来看,其通常不大于1000μm,优选地不大于100μm。在一个实施方案中,培养基的dapt浓度通常是0.1-1000μm,优选地是1-100μm(例如,10μm)。
[0158]
在第三培养步骤中,向培养基中加入骨形态发生蛋白信号转导途径激活物质不是必需的。在一个实施方案中,用在第三培养步骤中的培养基不含有骨形态发生蛋白信号转导途径激活物质。
[0159]
用于本发明的fgf2优选是分离的。在用于第三培养步骤中的培养基中包含的分离的fgf2是外源添加到所述培养基中的。因此,在一个实施方案中,本发明包括向用于第三培养步骤的培养基中外源添加分离的fgf2的步骤。
[0160]
在第三培养步骤中,可以通过向培养基中加入皮质类固醇,而用皮质类固醇处理细胞聚集体。通过皮质类固醇处理,促使垂体基板和/或拉特克囊向垂体激素生产细胞的分化,而不是向acth生产细胞(即,gh生产细胞、prl生产细胞、tsh生产细胞、lh生产细胞、fsh生产细胞等)的分化。皮质类固醇的实例包括,但不限于,天然糖皮质激素,诸如氢化可的松,醋酸可的松(cortisone acetate),醋酸氟氢可的松(fludrocortisone acetate)等;以及人工合成的糖皮质激素,诸如地塞米松,倍他米松(betamethasone),泼尼松龙
(predonisolone),甲泼尼龙(methylprednisolone),和曲安西龙(triamcinolone)等。
[0161]
在培养基中皮质类固醇的浓度没有特别限制,只要其能够促进垂体基板和/或拉特克囊向垂体激素生产细胞(排除acth生产细胞)的分化即可,并且可以按照皮质类固醇的种类适当地确定。例如,在氢化可的松的情形中,其通常不少于100ng/ml,优选地不少于1μg/ml。尽管氢化可的松浓度的上限没有特别设定,只要不发现对向垂体激素生产细胞(排除acth生产细胞)的分化的不利作用即可,但从培养成本方面来看,其通常不大于1000μg/ml,优选地不大于100μg/ml。在一个实施方案中,培养基中氢化可的松的浓度通常是100ng/ml
–
1000μg/ml,优选地1
–
100μg/ml。当使用地塞米松作为皮质类固醇时,其在培养基中的浓度可以设定为约为氢化可的松的1/25。
[0162]
在第三培养步骤中,向培养基中添加皮质类固醇的时机没有特别限制,只要能够促进垂体基板和/或拉特克囊向垂体激素生产细胞(排除acth生产细胞)的分化即可,并且,可以在第三培养步骤开始时向培养基中加入皮质类固醇,或者在第三培养步骤开始后在不含皮质类固醇的培养基中培养给定时间期后向所述培养基中加入皮质类固醇。优选地,在第三培养步骤开始后,证实在细胞聚集体中出现acth生产细胞的阶段向所述培养基中加入皮质类固醇。即,将细胞聚集体在不含皮质类固醇的培养基中培养,直到证实在所述细胞聚集体中出现acth生产细胞,并且在证实出现acth生产细胞后,在包含皮质类固醇的培养基中继续第三培养步骤。acth生产细胞的出现可以通过使用针对acth的抗体的免疫组织化学染色验证。当使用人多能干细胞时,通常可以预测在自第三培养步骤开始起第37天或以后出现acth生产细胞。因此,在一个实施方案中,在自第三培养步骤开始起第37天或以后向培养基中加入皮质类固醇。
[0163]
尽管用皮质类固醇处理细胞聚集体的时间期没有特别限定,只要能够促进垂体基板和/或拉特克囊向垂体激素生产细胞(排除acth生产细胞)的分化即可,但是,通常将细胞聚集体用皮质类固醇处理至与未用皮质类固醇处理的组相比,在皮质类固醇-处理的组中证实了向垂体激素生产细胞(排除acth生产细胞)的分化的促进作用。处理时间期通常不少于7天,优选地不少于12天。尽管处理时间期的上限没有特别设定,但是,可以在与未用皮质类固醇处理的组相比,在皮质类固醇-处理的组中证实了向垂体激素生产细胞(排除acth生产细胞)的分化的促进作用的阶段从所述培养基中去除皮质类固醇。
[0164]
向培养基中加入皮质类固醇,由于反馈抑制,对acth生产细胞的分化诱导起抑制作用。
[0165]
如同用于第一和第二培养步骤的培养基,用于第三培养步骤的培养基可以使用用于培养哺乳动物细胞的培养基作为基础培养基进行制备。。所述基础培养基没有特别限制,只要其可以用于培养哺乳动物细胞即可,并且可以是bme培养基,bgjb培养基,cmrl 1066培养基,glasgow mem培养基,改良的mem锌选择培养基,imdm培养基,medium 199培养基,eagle mem培养基,αmem培养基,dmem培养基,ham培养基,ham’s f-12培养基,rpmi 1640培养基,fischer’s培养基,neurobasal培养基,其混合培养基等。在一个实施方案中,使用imdm培养基与ham’s f-12培养基的混合培养基。例如,混合比例为imdm:ham’s f-12=0.8-1.2:1.2-0.8(体积比)。
[0166]
用于培养的培养基可以是含有血清的培养基或无血清培养基。为了避免化学上未确定的成分的污染,优选使用无血清培养基进行细胞聚集体的悬浮培养。
[0167]
用于悬浮培养细胞聚集体的培养基可以包含血清替代品。例如,所述血清替代品可以是适当地包含清蛋白、运铁蛋白、脂肪酸、胶原蛋白前体、痕量元素、2-巯基乙醇或3
’‑
硫代甘油或它们的等价物等的替代品。这样的血清替代品可以例如通过wo98/30679中所述的方法制备。为了促使本发明的方法更容易实施,可以使用商购的血清替代品。所述商购血清替代品的实例包括ksr(敲除血清替代物)(由invitrogen制备),化学成分确定的浓缩脂质(由gibco company制备)和glutamax(由gibco company制备)。
[0168]
用于悬浮培养细胞聚集体的培养基可以包含其他添加剂,只要没有不利影响诱导多能干细胞向垂体基板的分化和/或拉特克囊向垂体激素生产细胞的分化即可。所述添加剂的实例包括,但不限于,胰岛素、铁源(例如,运铁蛋白等)、矿物质(例如,硒酸钠等)、糖(例如,葡萄糖等)、有机酸(例如,丙酮酸,乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇等)、维生素(例如,抗坏血酸,d-生物素等)、抗生素(例如,链霉素,青霉素,庆大霉素等)、缓冲剂(例如,hepes等)等。
[0169]
在一个实施方案中,为了避免对诱导向垂体激素生产细胞的分化的不利影响,用于悬浮培养细胞聚集体的培养基是补充有血清替代品(ksr等)的除了本说明书中特别描述包含在培养基中的那些之外不含生长因子的化学合成的培养基(不含生长因子的化学成分确定的培养基;gfcdm)。此处,“生长因子”包括模式形成因子,如fgf;bmp;wnt,nodal,notch,shh等;胰岛素和富脂质清蛋白。不含生长因子的化学合成的培养基的实例包括wataya等人,proc natl acad sci usa,105(33):11796-11801,2008中公开的gfcdm。
[0170]
在第三培养步骤中的悬浮培养优选地在高氧分压条件下进行。当在高氧分压条件下进一步悬浮培养包含1)下丘脑神经上皮组织和2)垂体基板和/或拉特克囊的细胞聚集体时,实现将氧气递送至所述细胞聚集体内部,以及长时间期维持所述细胞聚集体的培养,这能够允许向垂体激素生产细胞的分化的有效诱导。
[0171]
高氧分压条件意指超过空气中的氧分压(20%)的氧分压条件。在第三培养步骤中的氧分压例如是30-60%,优选地是35-60%,更优选地是38-60%。
[0172]
可以适当地设定在第三培养步骤中的其他培养条件,如培养温度、co2浓度等。培养温度没有特别限定,并且例如是约30-40℃,优选约37℃。co2浓度例如是约1-10%,优选约5%。
[0173]
进行第三培养步骤,持续足以诱导垂体基板和/或拉特克囊向垂体激素生产细胞分化的时间期。通过进行第三培养步骤,诱导垂体基板和/或拉特克囊向垂体激素生产细胞的分化,并且在所述垂体基板和/或拉特克囊中产生了垂体激素生产细胞,由此可以得到腺垂体。所述由垂体基板和/或拉特克囊诱导的垂体激素生产细胞的实例包括生长激素(gh)生产细胞,促乳素(prl)生产细胞,促肾上腺皮质素(acth)生产细胞。在优选的实施方案中,促肾上腺皮质素(acth)生产细胞响应crh刺激分泌acth,并且acth分泌以反馈方式受糖皮质激素的抑制。在一个实施方案中,诱导垂体基板和/或拉特克囊向选自由下述组成的组的至少一种、优选两种、更优选三种垂体激素生产细胞的分化:生长激素(gh)生产细胞,促乳素(prl)生产细胞,和促肾上腺皮质素(acth)生产细胞,并且形成包含选自由下述组成的组的至少一种、优选两种、更优选三种垂体激素生产细胞的腺垂体:生长激素(gh)生产细胞,促乳素(prl)生产细胞,和促肾上腺皮质素(acth)生产细胞。除了生长激素(gh)生产细胞、促乳素(prl)生产细胞和促肾上腺皮质素(acth)生产细胞外,可以从垂体基板和/或拉特克
囊诱导其他垂体激素生产细胞,诸如促甲状腺激素(tsh)生产细胞、促卵泡激素(fsh)生产细胞、促黄体激素(lh)生产细胞、促黑激素(msh)生产细胞等。即,除了至少一种、优选地两种、更优选地三种选自由生长激素(gh)生产细胞、促乳素(prl)生产细胞和促肾上腺皮质素(acth)生产细胞组成的组的细胞之外,通过第三培养步骤形成的腺垂体可以包含其他垂体激素生产细胞,诸如促甲状腺激素(tsh)生产细胞、促卵泡激素(fsh)生产细胞、促黄体激素(lh)生产细胞、促黑激素(msh)生产细胞等。向垂体激素生产细胞的分化可以例如通过使用针对垂体激素特异性的抗体的免疫组织化学检测垂体激素阳性的细胞而得到证实。例如,进行第三培养步骤,直至培养物中不少于10%、优选地不少于30%、更优选地不少于50%的细胞聚集体包含垂体激素生产细胞。尽管由于培养时间期可以依据多能干细胞的动物物种以及作用于shh信号途径的物质的种类而变化而不能无条件地指定培养时间期,但是,当使用人多能干细胞时,第三培养步骤例如通常进行不少于37天(例如,37-70天)。
[0174]
通过进行第三培养步骤,可以得到包含腺垂体的细胞聚集体。
[0175]
细胞聚集体的悬浮培养可以在存在或不存在饲养细胞的条件下进行,只要通过本发明的制备方法使自多能干细胞向腺垂体或其前体组织的分化诱导是可能的即可。为了避免不确定因素的污染,聚集体的悬浮培养优选在不存在饲养细胞的条件下进行。
[0176]
在本发明的制备方法中,用于细胞聚集体悬浮培养的培养容器没有特别限制,此类培养容器包括,例如,烧瓶、组织培养瓶、平皿、培养皿、组织培养皿、多重平皿、微量板、微孔板、微孔、多重板、多孔板、室载玻片、碗、管、托盘、培养袋和旋转瓶。为了允许在非贴壁条件下的培养,培养容器优选是非细胞粘附的。可用的非细胞粘附培养容器包括其表面被人工处理成非细胞粘附的培养容器、其表面没有进行用于改善细胞粘附性的人工处理(例如,利用胞外基质的包被处理等)的培养容器等。
[0177]
作为用于悬浮培养细胞聚集体的培养容器,可以使用氧气可透过的培养容器。使用氧气可透过的培养容器,可以提高向所述细胞聚集体的氧气供应,由此有助于细胞聚集体的长期维持培养。
[0178]
在聚集体的悬浮培养中,所述聚集体可以进行静置培养或可以通过旋转培养或摇动培养有意地移动,只要可以保持所述聚集体对所述培养容器的不粘附状态即可。然而,在本发明中,不需要通过旋转培养或摇动培养有意地移动聚集体。在一个实施方案中,在本发明的制备方法中的悬浮培养通过静置培养进行。静置培养是指在没有聚集体的有意移动的状态下培育所述聚集体的方法。可能发生,例如,由于与培养基温度的局部变化一起的培养基对流引起的聚集体移动。然而,由于聚集体不是有意地移动,所述状态也包括在本发明的静置培养中。可以在整个悬浮培养时间期内,或仅在该时间期的一部分中进行静置培养。在优选的实施方案中,可以在整个悬浮培养时间期内进行静置培养。静置培养不需要仪器,并且预计对细胞聚集体引起较少的损害,并且由于培养基的量可以是少量的而是有利的。
[0179]
(4)细胞聚集体、分离的腺垂体或其前体组织和垂体激素生产细胞的应用
[0180]
在进一步的方面中,可以从如上文提及获得的细胞聚集体中分离腺垂体或其前体组织(垂体基板,拉特克囊等)。此外,通过用酶(如胰蛋白酶等)和/或edta等处理腺垂体,可以分离垂体激素生产细胞。本发明提供可通过上文提及的本发明的方法获得的细胞聚集体、腺垂体或其前体组织以及垂体激素生产细胞。
[0181]
通过本发明的方法获得的细胞聚集体、腺垂体或其前体组织以及垂体激素生产细
胞可以用于移植疗法。例如,作为用于由腺垂体(前叶或中叶,优选前叶)的紊乱导致的疾病的治疗药,或用于补充腺垂体(前叶或中叶,优选前叶)损伤病症中的相关损伤部分,可以使用通过本发明的方法得到的细胞聚集体、腺垂体或其前体组织、或垂体激素生产细胞。通过将由本发明的方法得到的细胞聚集体、腺垂体或其前体组织、或垂体激素生产细胞移植给患有由腺垂体紊乱引起的疾病或腺垂体损伤病症的患者,可以治疗由腺垂体紊乱引起的疾病或腺垂体损伤病症。移植的部位没有特别限制,只要所植入的细胞聚集体、腺垂体或其前体组织以及垂体激素生产细胞能够起作用作为所述紊乱的腺垂体的替代物即可,并且,例如,可以提及肾被膜下等。由腺垂体紊乱导致的疾病的实例包括全垂体功能减退症(panhypopituitarism),垂体性侏儒症(pituitary dwarfism),肾上腺皮质功能减退症(adrenocortical insufficiency),部分垂体功能减退症(partial hypopituitarism),单一性垂体前叶功能不全(isolated deficiency of anterior pituitary hormone)等。此外,这些腺垂体损伤病症的实例包括腺垂体切除的患者、在对垂体肿瘤辐照后的患者、外伤。
[0182]
在移植疗法中,由于组织相容性抗原差异导致的排异通常构成问题。然而,该问题可以通过使用由移植接受体的体细胞建立的多能干细胞(例如,诱导的多能干细胞)得以解决。即,在优选的实施方案中,使用由接受体的体细胞建立的多能干细胞(例如,诱导的多能干细胞)作为本发明的方法中的多能干细胞,并且产生对所述接受者来说是免疫自身的腺垂体或其前体组织或垂体激素生产细胞并植入到所述接受者中。
[0183]
此外,通过本发明得到的细胞聚集体、腺垂体或其前体组织或垂体激素生产细胞可以用于药物筛选和评价。具体地,由于可通过本发明获得的腺垂体或其前体组织具有与体内的腺垂体或其前体组织的结构相似的高等结构,其可以用于筛选用于由腺垂体紊乱导致的疾病和损伤的腺垂体的治疗药,检测药物产物的副作用和毒性,并且开发用于腺垂体疾病的新治疗方法等。例如,从具有前述由腺垂体紊乱导致的疾病、特别是由腺垂体紊乱导致的遗传病的人患者制备ips细胞,并且使用该ips细胞,通过本发明的方法制备包含腺垂体或其前体组织的细胞聚集体。包含在所得到的细胞聚集体中的腺垂体或其前体组织可以在体外重现引起患者疾病的腺垂体紊乱。在存在或不存在(阴性对照)测试物质的条件下,培育包含紊乱的腺垂体或其前体组织的细胞聚集体或由所述细胞聚集体分离的紊乱的腺垂体或其前体组织。然后,将用所述测试物质处理的细胞聚集体、腺垂体或其前体组织的紊乱程度与阴性对照进行比较。结果,可以选择降低紊乱水平的测试物质作为用于由所述紊乱导致的疾病的治疗药的候选物质。另外,通过向作为用于筛选的所述细胞聚集体或腺垂体或其前体组织的来源的患者施用治疗有效量的通过使用具有证实的作为药物的安全性的物质作为测试物质而选择的物质,可以治疗该患者中由腺垂体紊乱导致的疾病。此外,使用包含紊乱的腺垂体或其前体组织的细胞聚集体或由所述细胞聚集体分离的紊乱的腺垂体或其前体组织,可以进行药物产品的毒性测试和开发用于由所述紊乱导致的疾病的新治疗方法。
[0184]
通过参考下述实施例更具体地解释本发明。所述实施例仅是本发明的示例,并不限制本发明的范围。
[实施例]
[0185]
[实施例1]由人多能干细胞立体形成腹侧下丘脑和表皮基板
[0186]
(方法)
[0187]
通过常规方法将人es细胞(khes-1)在mef上维持培养并使用。为了监测向下丘脑组织的分化诱导,使用khes-1,其中在作为下丘脑神经上皮标志物的rx基因中敲入了venus cdna。为了通过无血清悬浮培养聚集体(sfebq法)使人es细胞分化,通过nakano等人的方法(cell stem cell,2012)用酶将人es细胞分散成单个细胞,并且在低细胞粘附性v底96孔板(sumitomo bakelite)中重新聚集。每个孔接种5,000个细胞,并且在5%co2,37℃在下述分化培养基中培养:gfcdm培养基(不含生长因子的化学成分确定的培养基;wataya等人,pnas,2008) 5%ksr(invitrogen)。
[0188]
以接种的日子作为分化培养的第0天,从第0天至第3天,加入20μm y-27632(rock抑制剂;分散过程中细胞死亡的抑制剂:watanabe等人,nature biotechnology,2007),并且在培养的第3天和第6天,将一半的培养基更换为不含y-27632的分化培养基。从培养的第3天至第18天,向培养基中加入bmp4(终浓度为5nm)。在第18天以及之后,每3天将一半的培养基更换为不含bmp4的培养基,在培养的第6天以及之后,向培养基中加入sag(终浓度为2μm)。在第18天以及之后,将培养过程中的氧分压设为40%。通过荧光抗体方法分析组织分化。
[0189]
(结果)
[0190]
在分化培养的第17天,通过上文提及的方法培养的人es细胞的聚集体内部主要由rx::venus-阳性的、chx10(视网膜标志物)-阴性的下丘脑神经上皮组织占据,而e-钙黏着蛋白阳性的表面外胚层在表面上形成单细胞层(图1a)。在培养的第24天,大部分rx::venus-阳性的下丘脑表达nkx2.1,其是腹侧下丘脑标志物(图1b)。尽管表面外胚层表达广谱细胞角蛋白(其为表面外胚层(包括口腔外胚层)标志物),其一部分变厚,并且显现出表皮基板(包括垂体基板)的形式(图1c)。
[0191]
[实施例2]垂体基板的分化和拉特克囊的自组织
[0192]
(方法)
[0193]
通过实施例1的方法形成来源于人es细胞并且同时包含腹侧下丘脑组织和表皮基板的细胞聚集体,在相似的条件下继续培养直至培养的第27天或第30天,并且通过荧光抗体方法分析所述聚集体。在一些培养物中,从培养的第15天起向培养基中加入fgf2(终浓度为20ng/ml)。
[0194]
(结果)
[0195]
在培养的第27天和第30天,广谱细胞角蛋白阳性的表皮基板显著变厚,并且,在通过荧光抗体方法的分析中,其强烈表达垂体祖先细胞标志物,如lim3、pitx1和isl1/2等(图2a)。表达这些标志物的变厚的基板的一部分向内部内陷,如胎儿拉特克囊初始形成中一样(图2b),并且其他部分形成包囊(图2c)。添加fgf2使垂体基板的形成增加30%。
[0196]
[实施例3]bmp4在垂体基板分化诱导中的作用
[0197]
(方法)
[0198]
通过实施例1的方法,用荧光抗体方法分析存在或不存在bmp4添加对细胞聚集体分化的影响。
[0199]
(结果)
[0200]
当不添加bmp4时,在培养的第24天,在聚集体表面上没有形成表面外胚层,并且神经上皮占据整个表面。发现大部分的神经上皮不表达rx::venus,是foxg1-阳性的并且形成大脑组织(图3a,b)。当不加入sag时,foxg1-阳性的和pax6-阳性的大脑皮层分化,并且当添加sag时,foxg1-阳性的和nkx2.1-阳性的基底神经节分化(图3a-d)。因此,人多能干细胞的悬浮聚集体培养已经证明外源性bmp4同时起两种作用:1)活性形成表面外胚层,和2)分化诱导下丘脑(主要是诱导垂体基板)而不是大脑的神经组织。
[0201]
[实施例4]hedgehog信号在垂体基板分化诱导中的作用
[0202]
(方法)
[0203]
通过实施例1的方法,用荧光抗体方法分析存在或不存在hedgehog信号激动剂sag的添加对细胞聚集体分化的影响。
[0204]
(结果)
[0205]
加入或不加入sag,在培养的第24天和第27天,在聚集体表面上形成表面外胚层,并且rx::venus-阳性的组织占据所述聚集体的整个内部(图4a,b)。当自培养第6天起加入sag时,如实施例1、2一样,在聚集体内部形成腹侧下丘脑组织(rx::venus-阳性的,chx10-阴性的,nkx2.1-阳性的),并且在表面上形成垂体基板(图4b,d,e)。在另一方面,当不添加sag时,在内部形成神经视网膜组织(rx::venus-阳性的,chx10-阳性的,nkx2.1-阴性的),并且在表面上没有观察到垂体基板的形成(图4a,c)。由此,证明了通过允许强hedgehog信号在正确的时机起作用可以有效地形成腹侧下丘脑,而不是神经视网膜。
[0206]
[实施例5]诱导由垂体基板分化产生acth的内分泌细胞
[0207]
(方法)
[0208]
以与实施例1、2相同的方式,通过悬浮聚集培养人es细胞,使垂体基板自组装。自培养的第30天,将聚集体转移到ez球形板上,在40%o2,5%co2,37℃继续悬浮培养。自培养的第30天至第45天,使用补充有sag(2μm)、fgf2(20ng/ml)的gfcdm 10%ksr作为培养基。在培养的第45天及以后,使用相似的具有增加至20%的ksr浓度的培养基进行培养。通过荧光方法分析内分泌细胞的分化。
[0209]
(结果)
[0210]
在培养第67天的样品中,通过荧光抗体方法在pitx1-阳性垂体组织中证实有许多acth生产细胞(图5a,b)。在培养的第70天和第100天的样品中也确认了相似的acth-阳性细胞(图5c,d)。
[0211]
[实施例6]通过crh诱导自来源于人多能干细胞的垂体内分泌细胞的acth释放
[0212]
(方法)
[0213]
使用通过实施例5的方法制备的包含acth生产细胞的聚集体,分析体外激素分泌能力。使用包含250μl含有16个培养第80天的聚集体的hbss(-)的1.5ml eppendorf管,在存在或不存在crh(1μg/ml)的条件下,将所述聚集体在37℃培养10分钟。通过elisa法定量培养物上清中acth的浓度。
[0214]
此外,为了检验下游激素(糖皮质激素)所致的反馈抑制能力,将16个培养第80天的聚集体在存在或不存在氢化可的松(20μg/ml)的条件下在37℃预先温育3小时,并且分析crh处理后acth释放的影响。
[0215]
(结果)
[0216]
与在不存在crf的条件下培养后的培养物上清相比,在存在crh(1μg/ml)的条件下培养后的培养物上清中,acth以不少于5倍的浓度分泌(图6a)。
[0217]
在存在氢化可的松(20μg/ml)的条件下预先温育的组中,acth浓度减少为少于在不存在氢化可的松的条件下预先温育的组的浓度的七分之一(图6b)。
[0218]
[实施例7]体内通过crh的自来源于es细胞的acth生产细胞的acth和皮质类固醇分泌
[0219]
(方法)
[0220]
在垂体切除的小鼠的肾被膜下移植通过实施例5的方法(不同之处在于不加入fgf2)由人es细胞分化的acth生产细胞的聚集体。通过在垂体切除后进行crh加载检测,在移植之前证实这些小鼠失去了acth分泌能力。
[0221]
具体而言,将聚集体培养72-82天,从所述聚集体上切下包含acth生产细胞的垂体基板,并且用显微注射器移植到垂体切除的小鼠的肾被膜下。在移植后14天,进行crh加载检测,通过elisa法测量在加载前的血浆acth值和在加载后的血浆acth和皮质类固醇(皮质酮)值。
[0222]
(结果)
[0223]
通过荧光抗体方法发现,甚至在移植后14天,移植在肾被膜下的es细胞来源的acth生产细胞被植入(engrafted)(图7a,b)。在对照组(虚假手术)中,甚至在crh加载后,血浆acth值小于3pg/ml,并且皮质酮值小于0.2ng/ml。另一方面,在移植组中,在crh加载后,acth值为50-60pg/ml,并且皮质酮值为19ng/ml(图7c,d)。此外,在移植组中,crh加载后的acth值不少于加载前acth值的4倍(图7c)。
[0224]
[实施例8]在垂体切除的小鼠中通过移植来源于es细胞的acth生产细胞改善活动性、存活和体重减轻
[0225]
(方法)
[0226]
如实施例7,在垂体切除的小鼠(9周龄)的肾被膜下移植来源于人es细胞的acth生产细胞。随时间观察移植的小鼠的存活和体重变化,并且还与对照组(虚假手术)比较平价该小鼠的运动。关于小鼠的运动,使用env-044(medassociates,georgia)(转轮活动性试验)测量每天小鼠自发转动转轮多少次。另外,还使用ir传感器(mdc-w02(brain science idea,osaka))测量小鼠在笼中自发运动的距离(家笼活动性试验)。
[0227]
(结果)
[0228]
与对照组相比,移植组的小鼠表现出高运动水平(图8a,b)。
[0229]
在对照组中,所有的小鼠在虚假手术后64天全部死亡,而在移植组,83%的小鼠存活(图8c)。此外,与对照组相比,在手术后3和4周,移植组几乎没有表现出体重减轻(图8d)。
[0230]
[实施例9]通过notch信号抑制剂促进产生acth的内分泌细胞的分化诱导
[0231]
(方法)
[0232]
按照实施例5的方法,形成来源于人es细胞的垂体基板,并且长期培养。自培养的第65天到第74天,允许dapt(10μm)(notch信号抑制剂)对其起作用,并且通过qpcr方法分析该作用。
[0233]
(结果)
[0234]
通过qpcr方法比较dapt处理组和未处理组,在培养的第74天,在处理组中,在聚集体中转录因子tbx19的表达增加8倍以上(图9),该转录因子是acth生产细胞的标志物并且控制acth产生的上游。
[0235]
[实施例10]由垂体基板诱导产生gh的内分泌细胞和产生prl的内分泌细胞的分化
[0236]
(方法)
[0237]
按照实施例5的方法,形成来源于人es细胞的垂体基板,并且长期培养。在培养的第67天或第70天,通过荧光抗体方法分析内分泌细胞的分化。
[0238]
(结果)
[0239]
作为在培养第67天pitx1-阳性垂体基板分析的结果,除了acth生产细胞之外,还发现prl生产细胞(图10a)。作为在培养的第70天pitx1-阳性垂体基板的分析结果,还检测到许多gh生产细胞(图10b)。
[0240]
[实施例11]由人多能干细胞立体形成背侧下丘脑
[0241]
(方法)
[0242]
直至分化诱导后6天,将细胞在实施例1的培养条件下培养,并且在第6天及以后,每3天将一半的培养基更换为不含bmp4的培养基。自第6天到第12天,向培养基中加入sag(终浓度1μm)。在第18天及以后,将培养过程中的氧分压设定为40%。通过荧光抗体法分析组织分化。
[0243]
(结果)
[0244]
在通过上文提及的方法培养的人es细胞的聚集体内部,在分化培养的第24天,观察到背侧下丘脑的神经上皮(rx::venus-阳性的,pax6-阳性的,chx10-阴性的)以及腹侧下丘脑组织(rx::venus-阳性的,nkx2.1-阳性的,chx10-阴性的)(图11a)。在分化培养的第81天,还发现otp的表达,其为背侧下丘脑的晚期标志物(图11b)。因此,证明了通过较实施例1的分化条件缩短bmp4作用的时间并且进一步减少sag的浓度,可以有效地形成背侧下丘脑。
[0245]
[实施例12]通过grf诱导自来源于人多能干细胞的垂体内分泌细胞的gh释放
[0246]
(方法)
[0247]
除了实施例10的方法之外,从培养的第72天至第84天,使用在包含氢化可的松(1μg/ml)的培养基中分化的含有gh生产细胞的聚集体,分析体外激素分泌能力。使用包含500μl的含有在培养的第84天的33个聚集体的hbss的1.5ml eppendorf管,将聚集体在存在或不存在grf(100ng/ml)的条件下在37℃温育30分钟。通过elisa方法定量培养物上清中的gh浓度。
[0248]
(结果)
[0249]
与在不存在grf的条件下温育后的培养物上清相比,在存在grf的条件下温育后的培养物上清中,gh以不少于6倍的浓度分泌(图12)。[实施例13]通过grf自地塞米松诱导的gh生产细胞诱导gh释放
[0250]
(方法)
[0251]
除了实施例10的方法,从培养的第70天至第84天,使用在含地塞米松(40ng/ml)的培养基中分化的含gh生产细胞的聚集体,分析体外激素分泌能力。使用包含750μl的含有30个在培养第84天的聚集体的培养基的1.5ml eppendorf管,将所述聚集体在存在grf(0.1,1,10μg/ml)的条件下在37℃温育30分钟。通过elisa方法定量在培养物上清中的gh浓度。
[0252]
此外,为了研究促生长素抑制素抑制gh分泌的潜能,在存在或不存在促生长素抑制素(100ng/ml)的条件下将在培养第98天的18个聚集体在37℃温育90分钟,并且分析grf处理后对gh释放的作用。
[0253]
(结果)
[0254]
当没有向分化培养基中加入地塞米松时,甚至在用grf温育时,培养物上清中gh的浓度也非常低。相反,当加入地塞米松时,在培养物上清中发现响应grf的gh分泌(图13a)。
[0255]
与在不存在促生长素抑制素的条件下预先温育的组中的浓度相比,在存在促生长素抑制素(100ng/ml)的条件下预先温育的组中,gh浓度减少为约四分之一(图13b)。
[0256]
[实施例14]自垂体基板分化诱导产生tsh的内分泌细胞
[0257]
(方法)
[0258]
通过荧光抗体方法分析按照实施例13的方法培养84天的内分泌细胞的分化。
[0259]
(结果)
[0260]
作为在培养的第84天的垂体基板的分析的结果,除了gh生产细胞、prl生产细胞之外,还发现tsh生产细胞(图14a-c)。
[0261]
[实施例15]自垂体基板分化诱导产生lh/fsh的内分泌细胞
[0262]
(方法)
[0263]
除了实施例8的方法以外,通过荧光抗体方法分析自培养的第72天到第82天与notch信号抑制剂dapt(10μm)反应的垂体基板的分化。
[0264]
(结果)
[0265]
在垂体基板中发现lh生产细胞和fsh生产细胞(图15a,b)。
[0266]
[工业适用性]
[0267]
按照本发明,可以在体外从人多能干细胞有效地诱导腺垂体或其前体组织。在人多能干细胞的聚集体中同时形成下丘脑神经上皮组织和表面外胚层二者,并且通过其相互作用使垂体基板和拉特克囊自组织。按照本发明,可以在体外以与在体内的垂体相同的方式构建能够响应下丘脑的刺激和来自下游靶组织的反馈调节而调节垂体激素分泌的人腺垂体。
[0268]
在本文引用的任何公布(包括专利和专利申请)中公开的内容通过引用完全结合在本文中,结合的程度如同它们在此公开一样。
[0269]
本技术是基于在日本提交的专利申请号2014-152384(申请日:2014年7月25日),其内容完整地结合于此。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。