1.本发明涉及香料合成技术领域,特别是涉及一种酶法合成芳香族醛类香料化合物的方法。
背景技术:
2.芳香族醛类香料化合物是一种重要的芳香族类香料化合物,在香料化合物中占比大,其在食品、化妆品、医药和日化产品的合成领域有着广泛的应用,因而开发芳香族醛香料化合物的合成方法一直受到广大研究人员的关注。目前,芳香族醛类香料化合物主要是通过化学法来制备,比如芳香烃的friedel-craft酰基化反应、缩合反应偶联催化加氢还原反应、过渡金属催化的交叉偶联酰基化反应等。尽管已经有多种芳香族醛香料化合物的合成方法被公开,然而这些方法在反应过程中或需要使用强酸强碱或重金属离子作为催化剂,或需要高温条件。同时,美国和欧洲的法律规定,“天然”香料只能用物理过程从天然原料中萃取,或用酶/微生物工艺制备。
[0003]“芳香族醛类香料化合物的酶法生物合成研究”是食品科学研究热点前沿领域之一。与化学法相比,酶法不仅具有安全、催化高效、环境友好等特点,且是一些结构复杂的手性芳香族醛类化合物的唯一有效制备技术手段。因此,开发芳香族醛类香料化合物的酶法生物合成的关键技术,不仅迫在眉睫,且其科学意义与国家行业发展战略意义重大。
[0004]
芳基醇氧化酶(aryl-alcohol oxidases,aaox),是含有黄素-腺嘌呤-二核苷酸(fad)的酶,其属于葡萄糖-甲醇-胆碱(gmc)氧化还原酶超家族,能够催化芳香族和脂肪族烯丙基丙基醇氧化为相应的醛,同时不依赖于所需的昂贵的烟酰胺辅助因子,而只依赖于分子氧作为最终电子受体。除此之外,芳香醇氧化酶还具有广泛的底物谱和相当高的稳定性。但是芳基醇氧化酶将伯醇氧化成醛的转化率不高。
技术实现要素:
[0005]
基于此,本发明的提供了一种新的酶法合成芳香族醛类香料化合物的方法,该方法将芳基醇氧化酶与非特异性过氧合酶相结合协同氧化芳香醇,可以得到一系列不同种类的芳香族醛类香料化合物。
[0006]
本发明包括如下技术方案。
[0007]
一种酶法合成芳香族醛类香料化合物的方法,包括如下步骤:
[0008]
芳香醇在芳基醇氧化酶与非特异性过氧合酶的共同催化下进行氧化反应,即得所述芳香族醛类香料化合物。
[0009]
在其中一些实施例中,所述芳香醇具有如下式(i)所示结构,所述芳香族醛类香料化合物具有如下式(ii)所示结构:
[0010][0011]
其中,r选自:羟基、烷基、烷氧基;
[0012]
x选自:亚烷基、烯基;
[0013]
n为0,或者大于0的整数;
[0014]
m选自:0、1、2、3、4、5。
[0015]
在其中一些实施例中,r选自:羟基、c
1-c6烷基、c
1-c6烷氧基。
[0016]
在其中一些实施例中,r选自:羟基、甲氧基;m选自:0、1、2。
[0017]
x选自:c
1-c6亚烷基、c
2-c6烯基。
[0018]
在其中一些实施例中,x为乙烯基;n为0或者1。
[0019]
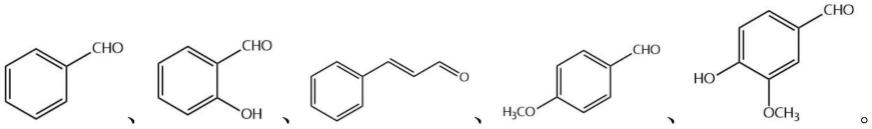
在其中一些实施例中,所述芳香醇选自如下化合物:
[0020][0021]
所述芳香族醛类香料化合物对应选自如下化合物:所述芳香族醛类香料化合物对应选自如下化合物:
[0022]
在其中一些实施例中,所述芳基醇氧化酶为来源于杏鲍菇的peaaox;所述非特异性过氧合酶为来源于茶树菇的aaeupo。
[0023]
在其中一些实施例中,所述芳香醇与所述芳基醇氧化酶的添加量之比为50mmol/l:10μmol/l-40μmol/l。
[0024]
在其中一些实施例中,所述芳香醇与所述芳基醇氧化酶的添加量之比为50mmol/l:25μmol/l-40μmol/l。
[0025]
在其中一些实施例中,所述芳香醇与所述芳基醇氧化酶的添加量之比为50mmol/l:28μmol/l-32μmol/l。
[0026]
在其中一些实施例中,所述芳香醇与所述芳基醇氧化酶的添加量之比为50mmol/l:30μmol/l。
[0027]
在其中一些实施例中,所述芳香醇与所述非特异性过氧合酶的添加量之比为50mmol/l:0.5μmol/l-5μmol/l。
[0028]
在其中一些实施例中,所述芳香醇与所述非特异性过氧合酶的添加量之比为50mmol/l:1.5μmol/l-4μmol/l。
[0029]
在其中一些实施例中,所述芳香醇与所述非特异性过氧合酶的添加量之比为50mmol/l:1.8μmol/l-2.2μmol/l。
[0030]
在其中一些实施例中,所述芳香醇与所述非特异性过氧合酶的添加量之比为50mmol/l:2μmol/l。
[0031]
在其中一些实施例中,所述反应的温度为5℃-50℃。
[0032]
在其中一些实施例中,所述反应的温度为20℃-42℃。
[0033]
在其中一些实施例中,所述反应的温度为25℃-41℃。
[0034]
在其中一些实施例中,所述反应的温度为35℃-41℃。
[0035]
在其中一些实施例中,所述反应的ph为5-9。
[0036]
在其中一些实施例中,所述反应的ph为6-8。
[0037]
在其中一些实施例中,所述反应的ph为6-7。
[0038]
在其中一些实施例中,所述反应的ph为6.5-7.2。
[0039]
在其中一些实施例中,所述反应的ph为7。
[0040]
在其中一些实施例中,所述反应的时间为6小时-36小时。
[0041]
在其中一些实施例中,所述反应的时间为12小时-36小时。
[0042]
在其中一些实施例中,所述反应的时间为18小时-36小时。
[0043]
在其中一些实施例中,所述反应的时间为22小时-24小时。
[0044]
本发明为了进一步提高芳基醇氧化酶将伯醇氧化成醛的催化效果,提高底物转化率和产物醛的得率,发明人通过大量的实验研究发现:芳基醇氧化酶将伯醇氧化成醛的催化效果不太好的原因是芳基醇氧化酶将伯醇氧化成醛的同时会产生副产物h2o2,体系中h2o2浓度过高会对酶的活性造成一定的损伤,因而会降低原料转化率,降低产物醛的得率。非特异性过氧合酶(unspecific peroxygenase,upo)是一类来源于真菌的氧化酶,upo被认为是非活化c-h键选择性氧官能化的“梦想催化剂”。可催化多种氧化反应,例如磺化反应、环氧化反应、羟基化反应、脱烷基化反应、有机杂原子和无机卤化物的氧化反应等。upo催化无需以昂贵的nad(p)h作为电子来源,可以仅利用h2o2作为氧供体,且upo的催化氧化反应的副产物仅为水。本发明的发明人进一步研究发现,将源于杏鲍菇的芳香醇氧化酶(peaaox)与来源于茶树菇的非特异性过氧合酶(aaeupo)通过级联工艺设计,可进行芳香族醛类香料化合物的制备。利用芳香醇氧化酶(peaaox)对底物芳香族伯醇类化合物催化氧化,同时产生h2o2供过氧合酶(aaeupo)可以共同催化氧化芳香族伯醇,从而得到一系列芳香族醛类香料化合物,从而为芳香族醛类香料化合物提供了一种全新的生物酶法合成路径。
[0045]
本发明首次将“peaaox偶联aaeupo”级联催化反应应用于制备芳香族醛类香料化合物,且副产物h2o2被aaeupo利用于与peaaox共同催化氧化伯醇,在消除h2o2潜在危害的同时,两种酶具有协同增效的作用,大大提高了酶催化效果,提高了底物转化率和产物醛的收率。通过对反应条件的进一步优化,底物转化率最高可达84%左右。
[0046]
本发明的酶法合成芳香族醛类香料化合物的方法在催化过程中不依赖于昂贵的
烟酰胺辅助因子,而只需分子氧作为最终电子受体,副产物仅仅为水,反应条件温和,操作简单,且无需使用大量有毒有害有机试剂,绿色环保。
附图说明
[0047]
图1为本发明生物酶法级联催化合成芳香醛示意图。
[0048]
图2为peaaox的sds-page图,其中,m:marker;1:总菌;2、3:上清液;4:复性酶液。
[0049]
图3为级联催化与peaaox单酶催化藜芦醇制备藜芦醛的结果对比。
[0050]
图4为级联催化与aaeupo单酶催化藜芦醇制备藜芦醛的结果对比。
[0051]
图5为不同peaaox酶加量催化藜芦醇反应24h的气相色谱图。
[0052]
图6为peaaox酶加量对藜芦醇氧化效果的影响,其中,(a)为产物浓度;(b)为转化率。
[0053]
图7为不同aaeupo酶加量催化藜芦醇反应24h的气相色谱图。
[0054]
图8为aaeupo酶加量对藜芦醇氧化效果的影响,其中,(a)为产物浓度;(b)为转化率。
[0055]
图9为温度对藜芦醇氧化的影响。
[0056]
图10为ph对藜芦醇氧化的影响。
[0057]
图11为不同底物氧化的气相色谱图。
具体实施方式
[0058]
下面通过具体实施例来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0059]
除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。
[0060]
本发明的术语“包括”和“具有”以及它们任何变形,意图在于覆盖不排他的包含。例如包含了一系列步骤的过程、方法、装置、产品或设备没有限定于已列出的步骤或模块,而是可选地还包括没有列出的步骤,或可选地还包括对于这些过程、方法、产品或设备固有的其它步骤。
[0061]
在本发明中提及的“多个”是指两个或两个以上。“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b这三种情况。字符“/”一般表示前后关联对象是一种“或”的关系。
[0062]
以下为具体实施例。
[0063]
本发明各实施例中所用的试剂均购自sigma-aldrich、麦克林或阿拉丁公司,无需进一步提纯即可直接使用。
[0064]
实施例1:peaaox的制备
[0065]
通过大肠杆菌系统重组表达peaaox:将质粒pflag1-peaaox转化到大肠杆菌感受态细胞e.coli bl21 star(de3)中,经过热激活化后用涂布棒均匀涂布到含氨苄青霉素抗性的lb固体培养基上,然后置于37℃下恒温培养12-18h,直至能明显观察到单个菌落。挑取转化平板上的单克隆菌落于5ml抗性lb液体培养基中,并在37℃和180rpm条件下过夜培养。
菌液按照1%比例放大到100ml抗性tb液体培养基中,在37℃,180rpm条件下培养2-3h至od600为0.7-0.8。按2.5%比例放大到500ml tb液体培养基中,在37℃,180rpm条件下培养2-3h至od600为0.8-1.0。加入1mm iptg进行诱导,并于37℃和180rpm条件下培养4h。
[0066]
将发酵液在4000rpm,4℃下离心30min,弃去培养基,将离心后获得的细菌沉淀重新悬浮在50mm tris-hcl缓冲液(ph 8.0,含有10mm edta和5mm dtt)中和2mg/ml溶菌酶在4℃孵育1h(使用缓慢磁力搅拌),使重新悬浮的细胞破裂。然后加入0.1mg/ml脱氧核糖核酸酶、1mm mgcl2和0.1mm pmsf,随后在冰上超声处理。离心(30min,12000rpm,4℃)并除去上清液后,将所得不溶性部分的沉淀重新悬浮,并在含有10mm edta和5mm dtt的tris/hcl缓冲液(20mm,ph 8.0)中洗涤三次,离心取出洗涤液后,将沉淀重新悬浮在含有2mm edta、50mm dtt和8m尿素的tris/hcl缓冲液(20mm,ph 8.0)中,并将混合物在冰上孵育30min,以溶解包涵体中的peaaox,再次离心,收集澄清的上清液并测定蛋白质含量,以用150μg/ml总蛋白质进行体外重折叠。体外重折叠在含有2.5mm gssg、1mm dtt、0.02mm fad、34%甘油和0.6m尿素的tris/hcl缓冲液(20mm,ph 9.0)中于4℃进行80h。随后利用10kda切向流膜包进行浓缩。粗酶液浓缩到一定的体积后,用阴离子交换层析法(qsepharose fast flow)进行纯化,纯化后的酶液使用换盐层析柱hiprep
tm
26/10换盐。最终得到的目的蛋白酶液通过用10kda超滤管浓缩到合适的浓度,分装,液氮预冻,置于-80℃储存。
[0067]
对上述经阴离子交换层析柱纯化后得到的目的蛋白进行sds-page测试,具体结果如图2所示。peaaox理论蛋白分子量为63.7kda,sds-page结果显示,peaaox分子量为64kda,与理论分子量大小基本一致,表明peaaox在大肠杆菌内成功表达。由于peaaox在大肠杆菌内基本上是以包涵体的形式表达,因此,在泳道2和3(细胞超声破碎然后离心的上清液)中观察不到与目的蛋白大小相近的条带。
[0068]
实施例2:peaaox偶联aaeupo级联催化与单酶催化效果对比
[0069]
(1)peaaox偶联aaeupo级联催化实验:在4ml的透明玻璃反应瓶中依次加入磷酸盐缓冲溶液(50mm,ph 7.0),peaaox酶液(终浓度为30μm),aaeupo酶液(终浓度为2μm),再加入底物藜芦醇(终浓度为50mm,底物预先溶于乙腈中),反应的总体积为1ml。将反应瓶放在圆孔反应架上,然后整体置于恒温油浴锅中,于反应温度为40℃、搅拌速度为500rpm的条件下反应6、12、24和36h。
[0070]
peaaox单酶催化实验:在4ml的透明玻璃反应瓶中依次加入磷酸盐缓冲溶液(50mm,ph 7.0),peaaox酶液(终浓度为32μm),再加入底物藜芦醇(终浓度为50mm,底物预先溶于乙腈中),反应的总体积为1ml。将反应瓶放在圆孔反应架上,然后整体置于恒温油浴锅中,于反应温度为40℃、搅拌速度为500rpm的条件下反应6、12、24和36h。
[0071]
(2)peaaox偶联aaeupo级联催化实验:在4ml的透明玻璃反应瓶中依次加入磷酸盐缓冲溶液(50mm,ph 7.0),peaaox酶液(终浓度为30μm),aaeupo酶液(终浓度为2μm),再加入底物藜芦醇(终浓度为50mm,底物预先溶于乙腈中),反应的总体积为1ml。将反应瓶放在圆孔反应架上,然后整体置于恒温油浴锅中,于反应温度为40℃、搅拌速度为500rpm的条件下反应6、12h。
[0072]
aaeupo单酶催化实验:在4ml的透明玻璃反应瓶中依次加入磷酸盐缓冲溶液(50mm,ph 7.0),aaeupo酶液(终浓度为32μm),再加入底物藜芦醇(终浓度为50mm,底物预先溶于乙腈中),最后加入h2o2(浓度为2mm)。将反应瓶放在圆孔反应架上,然后整体置于恒温
油浴锅中,于反应温度为40℃、搅拌速度为500rpm的条件下反应6、12h,期间每2h添加一次h2o2(浓度为2mm)。
[0073]
以上反应结束后用含有25mm正十二烷内标的乙酸乙酯萃取,并用无水硫酸钠干燥,12000rpm离心3min后,取上层有机相进行气相检测。
[0074]
产物检测方法:反应后产物醛的含量由安捷伦7890b气相色谱仪进行检测,采用产物的标准品进行气相色谱出峰时间定性(藜芦醇和藜芦醛的保留时间分别为21.7和19.8),并采用上述标准品配制不同浓度的标准溶液,正十二烷做内标,通过气相检测制作标准曲线,用于定量分析。色谱分析柱为kb-ffap(30m*0.25mm*0.25μm),升温程序为:初始温度60℃,以80℃/min升到120℃,保留6min,再以20℃/min升到230℃,保留8min。
[0075]
结果如图3和图4所示,图3结果表明,在反应的整个时间段内级联催化反应生成的产物芳香醛的浓度均高于peaaox单酶催化,反应24h,级联催化反应基本达到平衡状态,此时芳香醛的浓度为41mm;peaaox单酶催化过程反应36h似乎还未达到平衡,生成芳香醛的浓度(此时为35mm)仍低于级联催化反应24h所得到的芳香醛的浓度,反应24h时级联催化生成的产物浓度为peaaox单酶催化的1.24倍。
[0076]
图4结果表明,在反应的整个时间段内级联催化反应生成的产物芳香醛的浓度均高于aaeupo单酶催化,反应12h后前者生成的产物浓度为后者的4.93倍。
[0077]
实施例3:peaaox酶加量对藜芦醇氧化的影响
[0078][0079]
按实施例2的方法,将反应瓶置于恒温油浴锅,30℃、500rpm条件下进行反应,反应结束后用含有25mm正十二烷内标的乙酸乙酯萃取,并用无水硫酸钠干燥,12000rpm离心3min后,取上层有机相进行气相检测(检测方法同实施例2,气相色谱图如图5所示)。
[0080]
反应结果如图6所示:由图可得,在peaaox酶加量为30μm的情况下反应效果最好,反应24h,产物浓度达到35mm,底物转化率为70%。
[0081]
实施例4:aaeupo酶加量对藜芦醇氧化的影响
[0082][0083]
按实施例2的方法,将反应瓶置于恒温油浴锅,30℃、500rpm条件下进行反应,反应结束后用含有25mm正十二烷内标的乙酸乙酯萃取,并用无水硫酸钠干燥,12000rpm离心3min后,取上层有机相进行气相检测(检测方法同实施例2,气相色谱图如图7所示)。
[0084]
反应结果如图8所示:由图可得,在aaeupo酶加量为2.0μm的情况下反应24h,产物浓度达到35mm,底物转化率为70%。
[0085]
实施例6:温度对藜芦醇氧化的影响
[0086][0087]
按实施例2的方法,将反应瓶置于恒温油浴锅,25℃、30℃、35℃、40℃、45℃和50
℃,500rpm条件下进行反应24h,反应结束后用含有25mm正十二烷内标的乙酸乙酯萃取,并用无水硫酸钠干燥,12000rpm离心3min后,取上层有机相进行气相检测(检测方法同实施例2)。
[0088]
结果如图9所示:由图可知,在反应温度为40℃时,反应效果最好,双酶级联催化生成藜芦醛的浓度高达40.2mm,底物转化率为80.4%,进一步提高温度会降低产物藜芦醛的转化率。
[0089]
实施例6:ph对藜芦醇氧化的影响
[0090][0091]
按实施例2的方法,将反应瓶置于恒温油浴锅,40℃、500rpm条件下反应24h,反应结束后用含有25mm正十二烷内标的乙酸乙酯萃取,并用无水硫酸钠干燥,12000rpm离心3min后,取上层有机相进行气相检测(检测方法同实施例2)。
[0092]
结果如图10所示:由图可知,ph为7.0的条件下,级联催化效果最好,此时产物藜芦醛的浓度为41.5mm,转化率高达83%。
[0093]
实施例7:底物拓展
[0094][0095]
按实施例2的方法,将反应瓶置于恒温油浴锅,40℃、500rpm条件下进行反应24h,反应结束后用含有25mm正十二烷内标的乙酸乙酯萃取,并用无水硫酸钠干燥,12000rpm离心3min后,取上层有机相进行气相检测(检测方法同实施例2,气相色谱图如图11所示)。
[0096]
各底物和产物的气相定性结果如下表所示:
[0097]
芳香族伯醇/芳香醛的气相色谱保留时间
[0098]
[0099][0100]
反应结果如下表所示:
[0101][0102]
由上述结果可知:利用本发明的方法和反应条件,可合成不同种类的芳香族醛类香料化合物(转化率分别在10.12-84.06%之间)。
[0103]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0104]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求书为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
