1.本发明涉及细胞从支架的脱落得到抑制的高接种效率的细胞集合体、其制造方法、其制作试剂盒以及使用了该细胞集合体的化合物的评价方法。
背景技术:
2.已知在生物体内细胞三维地相互作用,即使在生物体外,通过使细胞三维地相互作用,功能也提高。由纤维片构成的细胞培养支架材料提供用于三维地培养细胞的场所且促进相互作用,因此期待在细胞的大量培养、医疗设备、细胞移植治疗、药的安全性评价、疾病模型等中的应用。特别是使用了生物相容性聚合物的纤维片适用作医疗用及细胞培养的支架。例如,专利文献1中记载了在纱布或海绵等支撑体上形成由明胶、胶原及纤维素等生物高分子构成的纳米纤维而用作培养基材。专利文献2中记载了使用使平均纤维直径为1~70μm的生物相容性长纤维的纤维交点部分地熔融粘合而成的生物相容性长纤维无纺布作为细胞培养用支架。
3.现有技术文献
4.专利文献
5.专利文献1:国际公开2014/196549号
6.专利文献2:国际公开2018/235745号
技术实现要素:
7.发明所要解决的课题
8.但是,已知当在由纤维片构成的细胞培养支架材料中接种细胞时,由于支架材料的纤维直径、空孔尺寸、疏密等结构的不同,细胞分布会发生变化。作为例子,在致密的支架中,细胞容易停留在表层,存在细胞围绕在支架的周围而发生脱落的问题。另一方面,在稀疏的支架中,虽然细胞侵入到内部,但存在细胞从支架贯通、或者从支架的侧面漏出而发生脱落的问题。
9.本发明为了解决上述以往的问题,提供细胞从支架的脱落得到抑制的接种效率高的细胞集合体、其制造方法、其制作试剂盒、以及使用了该细胞集合体的化合物的评价方法。
10.用于解决课题的手段
11.本发明涉及一种细胞集合体,其特征在于,其包含细胞和支架,所述支架由层叠体构成,所述层叠体包含以明胶为主成分的明胶无纺布和层叠在所述明胶无纺布的一个表面上的以明胶为主成分的明胶膜,所述细胞存在于所述明胶无纺布的表面和内部中的至少一者。
12.本发明还涉及上述细胞集合体的制造方法,其特征在于,其包含下述工序:准备由层叠体构成的支架和内表面未经亲水化处理的培养容器的工序,所述层叠体包含以明胶为
主成分的明胶无纺布、和层叠在所述明胶无纺布的一个表面上的以明胶为主成分的明胶膜;在内表面为干燥状态的培养容器中以明胶膜侧与培养容器的内底面接触的方式配置溶胀后的支架的工序;以及向支架的明胶无纺布上滴加细胞悬浮液进行培养的工序。
13.本发明还涉及一种对化合物的性质进行评价的化合物的评价方法,其包含下述工序:使化合物与所述细胞集合体接触的工序;和判断细胞集合体的生理学特性是否因与化合物接触而发生变更的工序。
14.发明效果
15.本发明能够提供一种细胞从支架的脱落得到抑制的接种效率高的细胞集合体。
16.根据本发明的制造方法,能够抑制细胞从支架脱落而以高接种效率制作细胞集合体。
17.通过使用本发明的制作试剂盒,能够抑制细胞从支架脱落而以高接种效率制作细胞集合体。
18.本发明通过使用经三维培养的细胞集合体,能够有效地对化合物的性质进行评价。
附图说明
19.图1是本发明的一个实施例中使用的支架(层叠体)的扫描型电子显微镜(100倍)的照片。
20.图2是本发明的另一实施例中使用的支架(层叠体)的扫描型电子显微镜(100倍)的照片。
21.图3是实施例1中用光学显微镜观察支架的端部而得到的图像(4倍),(a)是细胞接种后的结果,(b)是培养3小时后添加液体培养基时的结果。
22.图4是实施例1中对支架中的活细胞进行荧光观察而得到的图像,(a)是细胞接种后的支架的整体图像,(b)是其中心部的放大图像,(c)是在培养3小时后添加液体培养基时的支架(细胞集合体)的整体图像,(d)是其中心部的放大图像,(e)是培养72小时后的支架(细胞集合体)的整体图像,(f)是其中心部的放大图像。
23.图5是实施例2中对支架中的活细胞进行荧光观察而得到的图像,(a)是细胞接种后的支架的整体图像,(b)是其中心部的放大图像,(c)是在培养3小时后添加液体培养基时的支架(细胞集合体)的整体图像,(d)是其中心部的放大图像,(e)是培养72小时后的支架(细胞集合体)整体图像,(f)是其中心部的放大图像。
24.图6是实施例3中用光学显微镜观察支架的端部而得到的图像(4倍),(a)是细胞接种后的结果,(b)是培养3小时后添加液体培养基时的结果。
25.图7是实施例3中对支架中的活细胞进行荧光观察而得到的图像,(a)是细胞接种后的支架的整体图像,(b)是其中心部的放大图像,(c)是在培养3小时后添加液体培养基时的支架(细胞集合体)的整体图像,(d)是其中心部的放大图像,(e)是培养72小时后的支架(细胞集合体)的整体图像,(f)是其中心部的放大图像。
26.图8是实施例4中对支架中的活细胞进行荧光观察而得到的图像,(a)是细胞接种后的支架的整体图像,(b)是其中心部的放大图像,(c)是在培养3小时后添加液体培养基时的支架(细胞集合体)的整体图像,(d)是其中心部的放大图像,(e)是培养72小时后的支架
(细胞集合体)的整体图像,(f)是其中心部的放大图像。
27.图9是比较例1中用光学显微镜观察支架的端部而得到的图像(4倍),(a)是细胞接种后的结果,(b)是培养3小时后添加液体培养基时的结果。
28.图10是比较例2中用光学显微镜观察支架的端部而得到的图像(4倍),(a)是细胞接种后的结果,(b)是培养3小时后添加液体培养基时的结果。
29.图11是对实施例1中培养72小时后的支架中的活细胞的分布进行观察而得到的图像,(a)是对明胶无纺布侧的表面进行观察而得到的结果,(b)是在厚度方向上距离明胶无纺布表面100μm的部位的结果,(c)是在厚度方向上距离明胶无纺布表面200μm的部位的结果,(d)是在厚度方向上距离明胶膜表面200μm的部位的结果,(e)是在厚度方向上距离明胶膜表面100μm的部位的结果,(f)是对明胶膜侧的表面进行观察而得到的结果。
30.图12是对实施例2中培养72小时后的支架中的活细胞的分布进行观察而得到的图像,(a)是对明胶无纺布侧的表面进行观察而得到的结果,(b)是在厚度方向上距离明胶无纺布表面100μm的部位的结果,(c)是在厚度方向上距离明胶无纺布表面200μm的部位的结果,(d)是在厚度方向上距离明胶膜表面200μm的部位的结果,(e)是在厚度方向上距离明胶膜表面100μm的部位的结果,(f)是对明胶膜侧的表面进行观察而得到的结果。
31.图13是实施例5中培养第4天的细胞集合体的钙离子的成像观察结果,(a)是细胞集合体的亮视野图像,(b)是对规定时点的细胞内的钙离子进行荧光观察而得到的图像,(c)是对从(b)的时点起0.7秒后的细胞内的钙离子进行荧光观察而得到的图像,(d)是将测定点a和测定点b的荧光强度相对于时间作图而得到的图表。
32.图14是表示实施例5中培养第4天的细胞集合体对异丙肾上腺素的响应性的结果。
33.图15是实施例6中培养第4天的细胞集合体的钙离子的成像观察结果,(a)是细胞集合体的亮视野图像,(b)是对规定时点的细胞内的钙离子进行荧光观察而得到的图像,(c)是对从(b)的时点起0.7秒后的细胞内的钙离子进行荧光观察而得到的图像,(d)是将测定点a和测定点b的荧光强度相对于时间作图而得到的图表。
34.图16表示实施例6中培养第4天的基于e-4031的响应性的结果,(a)是对添加e-4031后经过120分钟后的细胞内的钙离子进行荧光观察而得到的图像,(b)是对从(a)的时点起0.4秒后的细胞内的钙离子进行荧光观察而得到的图像,(c)是将测定点a和测定点b的荧光强度相对于时间作图而得到的图。
35.图17是实施例7中的心肌细胞集合体的荧光染色结果。(a)是培养第3天的细胞核和肌动蛋白丝染色图像,(b)是培养第3天的α-肌动蛋白免疫染色图像,(c)是(b)的部分放大图像。(d)是培养第7天的细胞核和肌动蛋白丝染色图像,(e)是培养第7天的α-肌动蛋白免疫染色图像,(f)是(e)的部分放大图像。
36.图18是表示实施例7中对各化合物的响应性的图表。(a)是给予异丙肾上腺素前后的钙离子的信号波形,(b)是各浓度的异丙肾上腺素时的搏动数。(c)是给予e-4031前后的钙离子的信号波形,(d)是各浓度的e-4031时的搏动数。(e)是给予维拉帕米前后的钙离子的信号波形,(f)是各浓度的维拉帕米时的搏动数。
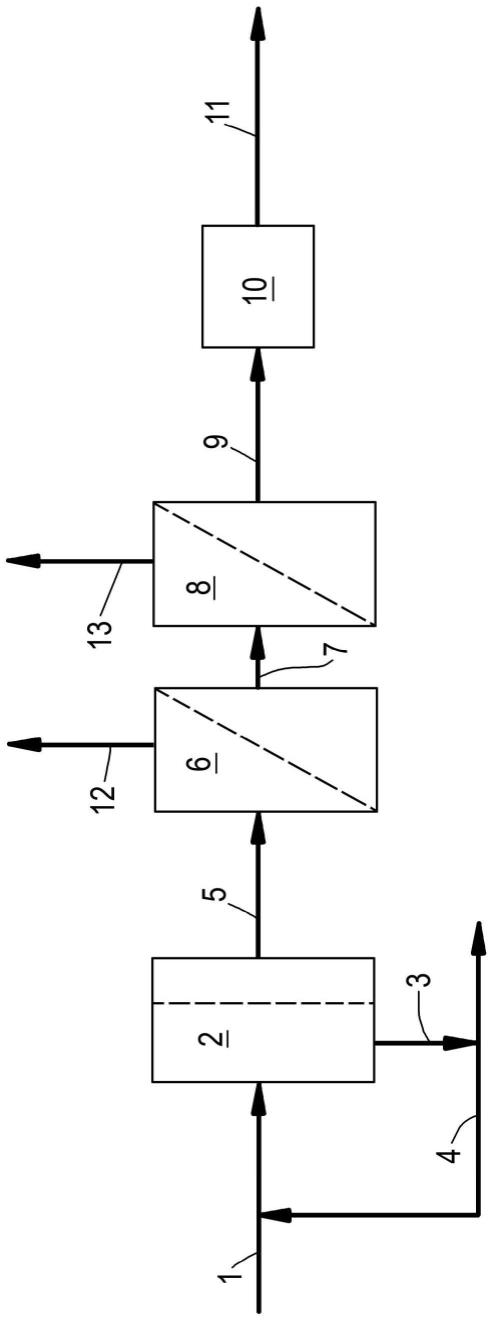
37.图19是表示实施例7中对各化合物的响应性的图表。(a)表示给予异丙肾上腺素前后的收缩力,(b)表示给予异丙肾上腺素前后的收缩舒张速度。(c)表示给予e-4031前后的收缩力,(d)表示给予e-4031前后的收缩舒张速度。(e)表示给予维拉帕米前后的收缩力,
(f)表示给予维拉帕米前后的收缩舒张速度。
38.图20是表示实施例8中对各化合物的响应性(钙离子的信号波形)的图表。(a)表示阿奇霉素的结果、(b)表示氯喹的结果、(c)表示羟基氯喹的结果、(d)表示阿奇霉素(3μm)与氯喹并用时的结果、(e)表示阿奇霉素(3μm)与羟基氯喹并用时的结果。
39.图21是表示实施例8中对各化合物的响应性(收缩力)的图表。(a)是阿奇霉素的结果、(b)是氯喹的结果、(c)是羟基氯喹的结果、(d)是阿奇霉素(3μm)与氯喹的结果、(e)是阿奇霉素(3μm)与羟基氯喹的结果。
40.图22是表示实施例9中对化合物的响应性的图表。
41.图23是本发明的一个实施例中使用的支架的制造装置的示意性说明图。
具体实施方式
42.本发明的发明者们为了解决上述问题反复进行了研究。其结果发现,通过使用由层叠体构成的支架,所述层叠体包含以明胶为主成分的明胶无纺布和层叠在所述明胶无纺布的一个表面上的以明胶为主成分的明胶膜,使细胞存在于所述明胶无纺布的表面和内部中的至少一者、优选两者,能够得到细胞从支架的脱落得到抑制的接种效率高的细胞集合体。
43.特别是发现,通过使用由层叠体构成的支架和培养容器的内表面(内底面和内侧面)未经亲水化处理的(非亲水性)培养容器,所述层叠体包含以明胶为主成分的明胶无纺布和层叠在所述明胶无纺布的一个表面上的以明胶为主成分的明胶膜,在内表面为干燥状态的培养容器中以明胶膜侧与培养容器的内底面接触的方式配置溶胀后的支架,在支架的明胶无纺布上滴加细胞悬浮液,令人惊讶的是,细胞悬浮液停留于支架,抑制细胞向支架的周围流出,即细胞从支架的脱落得到抑制,接种效率提高。推测这是由于由明胶无纺布和明胶膜的层叠体构成的支架的亲水性(润湿性)超过培养容器的内表面的亲水性(润湿性),因此细胞悬浮液不会从支架向培养容器侧流动,因此细胞不会从支架脱落。另外,即使在使细胞停留在支架内部和/或表面的状态下预培养规定时间,促进细胞粘附后,添加追加的液体培养基,将支架浸渍在液体培养基中,细胞也保持停留在支架的状态而不会从支架脱落。
44.另一方面,在为了提高与细胞的粘附性而对培养容器的内底面等内表面进行了亲水化处理的(亲水性)培养容器的情况下,当向支架滴加细胞悬浮液时,细胞悬浮液从支架向周围流出,细胞从支架脱落。
45.通常,对于增殖性的细胞而言,为了在支架内实现高密度化,需要设置1周以上的细胞增殖期间,另外对于非增殖性的细胞而言,若接种效率差,则难以在支架内进行细胞的高密度化,但若为上述的接种方法,则接种效率高,能够进行高密度接种,因此从培养初期也能够进行高密度的培养。
46.因此,能够得到从培养初期以高密度进行三维培养而得到的细胞集合体,通过使用该细胞集合体,能够有效地对化合物的性质进行评价。
47.在本发明中,“溶胀”是指用选自水、缓冲液或液体培养基中的一种以上的液体溶胀至饱和状态。
48.所述明胶无纺布和明胶膜均以明胶为主成分。在本发明中,主成分是指含有90质量%以上的明胶。10质量%以下的其他成分可以根据需要为其他生物相容性聚合物、交联
剂、药剂、增塑剂、其他添加剂等。也可以是实质上100质量%的明胶。本发明的支架以安全性高、生物体吸收性优异的明胶为主成分,因此该支架可以移植给生物体而适用作再生治疗用、细胞研究和药物开发研究所需要的三维细胞组织体等。
49.作为所述明胶的原材料的胶原所来源的动物的种类、部位没有特别限定。胶原例如可以为脊椎动物来源,也可以为鱼来源。另外,可以适当使用真皮、韧带、肌腱、骨、软骨等各种器官或组织来源的胶原。另外,由胶原制备明胶的方法也没有特别限定,例如可举出酸处理、碱处理和酶处理等。所述明胶的分子量也没有特别限定,可以适当选择使用各种分子量的明胶。另外,明胶可以使用1种,也可以将2种以上并用。
50.所述明胶没有特别限定,从具有适度的柔软性和硬度、提高支架的操作性的观点出发,胶质强度优选为100g以上且400g以下,更优选为150g以上且360g以下。在本发明中,胶质强度根据jis k 6503进行测定。所述明胶可以是市售品。
51.作为上述的其它生物相容性聚合物,没有特别限定,例如可以使用天然高分子、合成高分子。作为天然高分子,例如可举出蛋白、多糖类。作为蛋白,例如可举出胶原、纤连蛋白、纤维蛋白原、层粘连蛋白、纤维蛋白等。作为多糖类,例如可以使用壳聚糖、海藻酸钙、硫酸乙酰肝素、硫酸软骨素、透明质酸、肝素、淀粉、结冷胶、琼脂糖、瓜尔胶、黄原胶、角叉菜胶、果胶、刺槐豆胶、罗望子胶、迪特胶(diutan gum)等天然高分子,也可以使用羧甲基纤维素等天然高分子的衍生物。作为合成高分子,例如可举出聚乙二醇(polyethylene glycol)、聚对苯二甲酸乙二醇酯、聚乙烯醇、热塑性弹性体、聚丙烯、聚乙烯、聚苯乙烯、聚甲基丙烯酸甲酯、聚碳酸酯、聚二甲基硅氧烷、环烯烃聚合物、非晶氟树脂等非吸收性的合成高分子、聚乳酸、聚乙醇酸、聚己内酯、聚二氧杂环丁酮等生物吸收性高分子等。上述的其他生物相容性聚合物可以使用1种,也可以使用2种以上。
52.构成所述明胶无纺布的明胶纤维在溶胀后的平均纤维直径优选为2μm以上且400μm以下,更优选为5μm以上且200μm以下,进一步优选为10μm以上且100μm以下,特别优选为15μm以上且45μm以下。如果明胶纤维的平均纤维直径在上述范围内,则当将细胞接种在支架的明胶无纺布的表面上时,细胞容易侵入支架,并且容易在支架的内部均匀地分布。在本发明中,“溶胀后的平均纤维直径”是指从溶胀后的支架中的明胶无纺布中任意选择的50根纤维的直径的平均值。
53.优选构成所述明胶无纺布的明胶纤维的纤维交点部分地熔融粘合。该部分熔融粘合没有特别限定,例如如后所述,可以通过将支架制造时被压力流体吹飞的未完全固化的状态的明胶纤维堆积来表现。通过该部分熔融粘合,明胶无纺布成为桥接结构,容易成形为所希望的形状,且成形稳定性也高。另外,通过使纤维交点部分地熔融粘合,明胶无纺布即使被水润湿也不会疲软。另外,在明胶无纺布中,可以是纤维交点的一部分熔融粘合,也可以是纤维交点的全部熔融粘合。
54.所述明胶无纺布没有特别限定,例如从提高操作性和细胞的侵入性的观点出发,厚度优选为0.1mm以上、更优选为0.2mm以上、进一步优选为0.3mm以上、特别优选为0.4mm以上。另外,所述明胶无纺布没有特别限定,例如从提高三维培养中的细胞存活率的观点出发,厚度优选为2mm以下,更优选为1.5mm以下,进一步优选为1mm以下,特别优选为0.7mm以下。
55.所述明胶无纺布没有特别限定,例如从抑制细胞脱落的观点出发,单位面积重量
优选为10g/m2以上,更优选为25g/m2以上,进一步优选为50g/m2以上。另外,所述明胶无纺布没有特别限定,例如从提高细胞的侵入性和三维培养中的细胞存活率的观点出发,单位面积重量优选为600g/m2以下,更优选为500g/m2以下,进一步优选为400g/m2以下。
56.所述明胶无纺布没有特别限定,例如从提高细胞的侵入性和三维培养中的细胞的存活率的观点出发,细孔直径优选为20μm以上、更优选为30μm以上、进一步优选为40μm以上。另外,所述明胶无纺布没有特别限定,例如从抑制细胞脱落的观点出发,细孔直径优选为250μm以下,更优选为200μm以下,进一步优选为180μm以下。在本发明中,明胶无纺布的细孔直径可以基于wrotnowski的假定,通过下述计算式(1)算出。
57.[数学式1]
[0058]
[计算式1]
[0059][0060][0061]
d:细孔直径(μm)
[0062]
w:无纺布表观密度(g/cm3)
[0063]
f:纤度(d)
[0064]
f:纤维直径(μm)
[0065]
ρ:纤维密度(g/cm3)
[0066]
优选所述明胶膜配置在所述明胶无纺布的一个表面上,并且与构成所述明胶无纺布的明胶纤维部分地熔融粘合。该部分熔融粘合没有特别限定,例如如后所述,可以通过将在支架制造时被压力流体吹飞的未完全固化的状态的明胶纤维堆积在明胶膜上来实现。通过该部分熔融粘合,明胶无纺布与明胶膜被一体化,抑制细胞从支架贯通而从细胞脱落。另外,通过将明胶无纺布与明胶膜一体化,容易将细胞集合体从培养容器剥离,并且对细胞的损害少,由此在移植部位的植入性也变得良好。
[0067]
作为一例,从简便性和操作性的观点出发,所述明胶膜的厚度优选为0.5μm以上、更优选为0.6μm以上、进一步优选为0.7μm以上、特别优选为0.8μm以上。另外,作为一例,从提高与明胶无纺布的一体性及细胞的三维培养的效率的观点出发,所述明胶膜的厚度优选为10μm以下,更优选为8μm以下,进一步优选为6μm以下,更进一步优选为4μm以下,特别优选为2μm以下。
[0068]
所述明胶膜优选为无孔膜,但也可以具有细胞不会贯通的程度的大小、例如细孔直径为10μm以下或5μm以下左右的微小孔。
[0069]
所述明胶无纺布的厚度tn与所述明胶膜的厚度tf之比tf/tn优选为7.5
×
10-3
以下。由此,溶胀后的层叠体的翘曲得到抑制,细胞悬浮液更容易停留在支架上。此外,即使在层叠体溶胀的情况下,明胶膜也容易追随明胶无纺布而不易发生明胶膜的剥离或破坏。所述tf/tn更优选为7.0
×
10-3
以下,进一步优选为6.0
×
10-3
以下。另外,从容易抑制明胶膜的
剥离、破坏的观点出发,所述tf/tn优选为1.0
×
10-3
以上,更优选为1.5
×
10-3
以上。
[0070]
所述层叠体没有特别限定,例如从细胞培养时保持强度、提高三维培养中的细胞的存活率的观点出发,用水溶胀至饱和状态后的1.0kpa的压缩应力时的压缩变形率(以下也简记为“压缩变形率”)优选为40%以下,更优选为35%以下,进一步优选为30%以下。所述饱和状态是指水含有至最大限度的状态,是水的含量停留在一定限度而不会进一步增加的状态。在本说明书中,在用水溶胀至饱和状态后的层叠体中,在将无载荷时的厚度记为(h1)、将1.0kpa的压缩应力时的厚度记为(h2)的情况下,压缩变形率可通过下述式算出。压缩试验如后所述进行。
[0071]
压缩变形率(%)=100-{(h2/h1)
×
100}
[0072]
从容易维持细胞培养时的形态、有效地进行细胞的三维培养的观点出发,所述明胶无纺布和所述明胶膜优选进行交联。具体而言,交联可以如后述那样进行。
[0073]
在本发明的一个以上的实施方式中,所述明胶无纺布与明胶膜的层叠体可以用细胞粘附因子、细胞诱导因子、细胞生长因子、对细胞赋予营养、能量的物质、抑制或增强细胞功能的物质等进行涂布。作为细胞粘附因子,没有特别限定,例如可举出纤连蛋白等。通过用细胞粘附因子涂布层叠体,细胞变得更容易停留于支架。作为对细胞赋予营养、能量的物质,没有特别限定,例如可举出atp、丙酮酸、谷氨酰胺等。另外,在本发明的一个以上的实施方式中,也可以将所述明胶无纺布与明胶膜的层叠体浸渍在含有细胞诱导因子、细胞生长因子等生理活性物质的溶液中,使其含有这些成分。在细胞培养过程中,这些生理活性物质从层叠体缓慢释放,从而能够促进细胞培养。
[0074]
所述支架没有特别限定,但从抑制杂质的产生、防止产品污染、并且不使用粘合剂成分、热压接机构而使明胶无纺布与明胶膜一体化的观点出发,优选如下制作:将含有明胶的纺丝液从喷嘴喷出口挤出到空气中,从位于所述喷嘴喷出口的后方且与所述喷嘴喷出口为非接触状态的流体喷射口朝向前方喷射压力流体,使所述挤出的纺丝液伴随所述压力流体而形成纤维,使所述进行纤维形成得到的纤维聚集在以明胶为主成分的明胶膜上而制成明胶无纺布,由此得到所述明胶膜与所述明胶无纺布的层叠体。
[0075]
所述明胶膜没有特别限定,可以通过公知的膜的制造方法来制作。例如,可以通过将明胶溶液涂布于基材表面后进行干燥来制作。作为所述基材,例如可以使用聚对苯二甲酸乙二醇酯膜(pet膜)、玻璃板、聚苯乙烯片材、氟树脂片材等。也可以对pet膜、玻璃板、聚苯乙烯片材、氟树脂片材等进行防水处理。
[0076]
所述明胶溶液可以通过将明胶单独、或者根据需要将明胶与可以作为所述其它成分使用的其它生物相容聚合物溶解于溶剂中而得到。作为溶剂,例如可举出水、乙醇、1-丙醇、2-丙醇、甘油等醇类,或者二甲基甲酰胺、二甲基乙酰胺等酰胺类等。这些溶剂可以单独使用1种,也可以混合使用2种以上。其中,从处理性的观点出发,优选使用蒸馏水、纯水、超纯水、离子交换水等水。通过使明胶为水溶性,能够以水溶液的状态用于膜化,对生物体的安全性变高。
[0077]
明胶的浓度没有特别限定,例如从成膜性及流延性的观点出发,当将明胶溶液设为100质量%时,优选为0.1质量%以上且35质量%以下,更优选为1质量%以上且30质量%以下,进一步优选为3质量%以上且20质量%以下。溶解温度(溶剂的温度)优选为10℃以上且90℃以下,更优选为20℃以上且80℃以下,进一步优选为30℃以上且70℃以下。根据需
要,也可以在将明胶溶解于溶剂后,进行过滤而除去异物、垃圾等。另外,也可以根据需要,之后进行减压或真空脱泡而除去溶解空气。从高效地除去气体(气泡)的观点出发,减压脱泡时的真空度优选为5kpa以上且30kpa以下。
[0078]
所述干燥没有特别限定,例如可以通过自然干燥、加热干燥、减压干燥(真空干燥)、强制排气干燥、强制循环对流等来进行。具体而言,干燥温度例如可以为-40℃以上且90℃以下,可以为0℃以上且60℃以下,也可以为10℃以上且40℃以下。另外,干燥时间例如可以为1小时以上且200小时以下的范围,优选为3小时以上且100小时以下的范围,更优选为5小时以上且48小时以下的范围。
[0079]
在所述熔喷法中,由于将含有明胶的纺丝液从喷嘴喷出口挤出,从位于喷嘴喷出口的后方且与所述喷嘴喷出口为非接触状态的流体喷射口朝向前方喷射压力流体,使所述挤出的纺丝液伴随所述压力流体以干式直接纤维化,使得到的明胶纤维聚集在明胶膜上而形成无纺布,因此能够防止污染物(杂质)产生,能够卫生地进行制造。在纺丝后,当使纤维聚集(堆积)时,纤维彼此在包含水分的状态下层叠,因此纤维彼此熔融粘合或相互缠绕而一体化,并且构成该无纺布的明胶纤维与明胶膜熔融粘合而使明胶无纺布与明胶膜一体化。通过改变使纤维堆积时的捕集距离,能够容易地改变无纺布密度。
[0080]
图23是本发明的一个实施例中使用的支架的制造装置的示意性说明图。在支架的制造装置20中,将放入加温槽1的含有明胶的纺丝液2从喷嘴喷出口3挤出到空气中。利用压缩机4对加温槽1施加规定的压力。12为保温容器。
[0081]
另外,从位于喷嘴喷出口3的后方且与喷嘴喷出口3为非接触状态的流体喷射口5朝向前方喷射压力流体7。从压缩机6向流体喷射口5供给压力流体(例如压缩空气)。流体喷射口5与喷嘴喷出口3的距离优选为5~30mm。
[0082]
被挤出的纺丝液伴随压力流体7而成为明胶纤维8,在配置于卷取辊11上的明胶膜10上成为明胶无纺布9并堆积。此时,由于所堆积的纤维包含水分或未完全固化,因此在纤维交点的至少一部分处接触的纤维相互熔融粘合,并且构成无纺布的明胶纤维与明胶膜熔融粘合,从而使明胶无纺布与明胶膜一体化。其中,也可以代替卷取辊而使用网等其他捕集机构。
[0083]
首先,将明胶单独、或根据需要将明胶与上述可用作其他成分的其他生物相容聚合物溶解于溶剂、优选水中,制备纺丝液。溶解温度(水等溶剂的温度)优选为20℃以上且90℃以下,更优选为40℃以上且90℃以下。根据需要,也可以在将明胶溶解于水等溶剂后,进行过滤而除去异物、垃圾等。另外,也可以根据需要,之后进行减压或真空脱泡而除去溶解空气。从高效地除去气体(气泡)的观点出发,减压脱泡时的真空度优选为5kpa以上且30kpa以下。通过使明胶为水溶性,能够制成纺丝液而以水溶液的状态进行纺丝,对生物体的安全性变高。作为水,例如可以适当使用纯水、蒸馏水、超纯水等。需要说明的是,在使用其他生物相容性水溶性高分子作为其他成分的情况下,通过与明胶同时溶解于水,可以制备纺丝液。
[0084]
所述纺丝液的温度优选为20℃以上且90℃以下,更优选为40℃以上且90℃以下。若为上述范围,则明胶能够维持稳定的溶胶状态。另外,将明胶水溶液设为100质量%时,所述明胶水溶液的明胶浓度优选为30质量%以上且55质量%以下。更优选的浓度为35质量%以上且50质量%以下。若为上述浓度,则能够维持稳定的溶胶状态。所述明胶水溶液(纺丝
液)的粘度优选为500mpa
·
s以上且3000mpa
·
s以下。若明胶水溶液的粘度为上述范围,则能够进行稳定的纺丝。
[0085]
将所述纺丝液从纺丝机的喷嘴喷出,从所述喷嘴周围供给压力流体,使所述喷出的明胶水溶液伴随所述压力流体而形成纤维,使得到的明胶纤维聚集在明胶膜上而制成明胶无纺布。喷嘴的喷出压力没有特别限定,例如可以为0.1mpa以上且1mpa以下。
[0086]
所述压力流体的温度优选为20℃以上且120℃以下,更优选为80℃以上且120℃以下。虽然也取决于压力流体的流速以及周围气氛的温度,但只要在上述温度范围内就能够进行稳定的纺丝。压力流体优选使用空气,压力优选为0.1mpa以上且1mpa以下。若为上述范围,则能够将从喷嘴喷出口挤出到空气中的纺丝液吹飞而纤维化。
[0087]
通过适当调整喷嘴直径(内径)等,能够得到具有所期望的平均纤维直径的所述明胶无纺布。
[0088]
所述明胶无纺布和明胶膜的层叠体优选进行交联。由此,能够提高形态稳定性和耐水性。交联可以是使用了交联剂等化合物的化学交联,但从生物安全性的观点出发,优选为使用具有生物安全性的交联剂的交联、不使用交联剂的交联。作为不使用交联剂的交联,例如可举出热交联、电子束交联、γ射线等放射线交联、紫外线交联等。在电子束照射、γ射线等放射线照射的情况下,也可以同时进行灭菌和交联。从容易简便地得到所期望的交联效果的观点出发,优选为热交联,更优选为热脱水交联。热脱水交联例如可以在100℃以上且160℃以下进行24小时以上且96小时以下。另外,热脱水交联例如可以在1kpa以下的真空下进行。所述层叠体可以在交联前进行干燥。干燥可以是室温下的风干,也可以是真空冷冻干燥。
[0089]
可以根据需要将明胶无纺布与明胶膜一体化而成的层叠体切割成规定的形状、大小以作为支架使用。明胶具有生物相容性、生物降解性,因此明胶无纺布与明胶膜一体化而成的层叠体适合于医疗用或细胞培养的支架用。支架在使用时可以通过环氧乙烷气体灭菌、水蒸气(高压釜)、电子束照射、γ射线等放射线照射等进行灭菌,或者通过乙醇处理等进行杀菌。在电子束照射、γ射线等放射线照射的情况下,也可以与灭菌一起同时进行交联。
[0090]
上述明胶膜、层叠体的制造工序例如优选在洁净台、洁净室内无菌地进行。能够防止因作业中的杂菌繁殖而污染明胶膜、层叠体。所使用的制造器具例如优选使用通过高压釜、电子束照射、γ射线等放射线照射等进行了灭菌处理的器具。另外,上述明胶溶液也优选例如在进行以往公知的过滤器过滤灭菌后供于所述膜制造工序。
[0091]
在本发明中,作为一例,将交联后的层叠体冲裁成规定的形状等而成形,制成支架。或者,用水、缓冲液或规定的液体培养基溶胀后,制成目标支架。
[0092]
在本发明的一个以上的实施方式中,细胞集合体包含支架和细胞,细胞存在于明胶无纺布的表面和内部中的至少一者即可,但优选细胞存在于明胶无纺布的表面和内部这两者。在如此立体地配置有细胞的三维培养细胞团的情况下,能够用作组织。在本发明的一个以上的实施方式中,细胞集合体可以根据需要形成片状、块状等各种形状。另外,细胞集合体可以为2层以上的结构,各层包含支架和细胞,细胞存在于明胶无纺布的表面和内部中的至少一者,优选存在于两者。
[0093]
在本发明的一个以上的实施方式中,细胞只要是动物细胞即可,其来源没有特别
限定。作为动物,可以是人,也可以是除人以外的动物。作为除人以外的动物,例如可举出猴、黑猩猩等灵长类;小鼠、大鼠、仓鼠等啮齿类;牛、绵羊、山羊、猪等有蹄类等。另外,在本发明中,细胞包括各个细胞、细胞株、通过原代培养等培养得到的细胞等。作为所述细胞,没有特别限定,例如可举出体细胞、干细胞、前体细胞、生殖细胞、免疫细胞等。
[0094]
体细胞包括构成生物体的体细胞、从体细胞派生的癌细胞。作为构成生物体的体细胞,没有特别限定,例如可举出成纤维细胞、肌细胞、内皮细胞、成骨细胞、膀胱细胞、肺细胞、骨细胞、神经细胞、肝细胞、软骨细胞、上皮细胞、间皮细胞等。作为癌细胞,没有特别限定,例如可举出乳腺癌细胞、肾癌细胞、前列腺癌细胞、肺癌细胞、肝癌细胞、宫颈癌细胞、食道上皮癌、胰癌、大肠癌、膀胱癌等。
[0095]
干细胞是具有向各种特殊化的细胞型分化的可能性的细胞。作为干细胞,没有特别限定,例如可举出胚胎干细胞(es细胞)、胚胎癌细胞(ec)、胚胎生殖干细胞(eg)、人工多能性干细胞(ips细胞)、成体干细胞、囊胚来源干细胞、生殖嵴来源干细胞、畸胎瘤来源干细胞、制瘤素非依赖性干细胞(oisc)、骨髓来源间充质干细胞、脂肪来源间充质干细胞、羊水来源间充质干细胞、皮肤来源间充质干细胞、骨膜来源间充质干细胞等。
[0096]
前体细胞是能够由所述干细胞产生并向构成生物体的最终分化细胞分化的细胞。
[0097]
作为生殖细胞,例如可举出精子、精细胞、卵子、卵细胞等。
[0098]
作为免疫细胞,没有特别限定,例如可举出巨噬细胞、淋巴细胞、树突状细胞等。
[0099]
上述细胞可以单独使用1种,也可以根据目的等并用2种以上。例如,所述细胞优选为选自干细胞、癌细胞、干细胞来源的心肌细胞、神经细胞、肝细胞、成纤维细胞、内皮细胞及上皮细胞、以及生物体来源的心肌细胞、神经细胞、肝细胞、成纤维细胞、内皮细胞及上皮细胞中的1种以上。
[0100]
在本发明的一个以上的实施方式中,没有特别限定,所述细胞集合体可以如下制作:在内表面为干燥状态的培养容器中以明胶膜侧与培养容器的内底面接触的方式配置溶胀后的支架,在支架的明胶无纺布上滴加细胞悬浮液,由此在接种细胞后进行培养。由此,能够抑制细胞从支架脱落,提高接种效率,优选从培养初期以高密度培养细胞。支架的配置具体而言,可以用镊子夹住支架的端部来进行。
[0101]
本发明在一个以上的实施方式中,可以提供一种将细胞接种于支架的细胞接种方法,其特征在于,准备由层叠体构成的支架和培养容器的内表面未经亲水化处理的培养容器,所述层叠体包含以明胶为主成分的明胶无纺布和层叠在所述明胶无纺布的一个表面上的以明胶为主成分的明胶膜,在内表面为干燥状态的培养容器中以明胶膜侧与培养容器的内底面接触的方式配置溶胀后的支架,向支架的明胶无纺布上滴加细胞悬浮液。通过该细胞接种方法,可抑制细胞从支架脱落,接种效率提高。本发明在一个以上的实施方式中,可以提供一种细胞培养方法,其在所述的细胞接种方法中,在支架的明胶无纺布上滴加细胞悬浮液并静置规定时间后,添加液体培养基进行细胞培养。通过该细胞培养法,可以从培养初期以高密度培养细胞。
[0102]
在本发明的一个以上的实施方式中,培养容器只要是与细胞培养用支架、液体培养基接触的内表面未经亲水化处理的容器即可,没有特别限定,例如可以适当使用培养皿、平板、以及烧瓶等。具体而言,可以使用未进行用于提高细胞粘附性(附着性)的处理的未处理(细胞非粘附性)的培养皿,可以优选使用悬浮培养用的培养皿。例如,可以使用“iwaki悬
浮培养用微孔板(无表面处理)6孔”、“corning nontrement平板6孔”等市售品。
[0103]
细胞悬浮液可以使用将细胞悬浮在液体培养基中而得到的悬浮液。支架的每单位表面积的细胞悬浮液的液量(滴加量)可以根据支架的厚度、单位面积重量、细胞悬浮液的浓度等适当确定,没有特别限定,优选为0.1μl/mm2以上且0.6μl/mm2以下,更优选为0.2μl/mm2以上且0.5μl/mm2以下,进一步优选为0.3μl/mm2以上且0.4μl/mm2以下。当在上述范围内时,细胞悬浮液容易均匀地到达支架内,且容易在支架内保持细胞悬浮液。
[0104]
支架的每单位表面积的细胞的接种量没有特别限定,可以基于细胞种类、支架的厚度和单位面积重量等适当确定,例如从高密度地进行接种的观点出发,优选为200细胞/mm2以上且20000细胞/mm2以下,更优选为2000细胞/mm2以上且15000细胞/mm2以下,进一步优选为4000细胞/mm2以上且12000细胞/mm2以下。
[0105]
作为所述液体培养基,没有特别限定,可以根据细胞的种类适当使用包含细胞的生存生长需的成分的液体培养基。所述培养基可以含有血清、抗生素和生长因子等。血清例如可以适当使用牛血清、胎牛血清、马血清、人血清等。抗生素可以适当使用青霉素、链霉素、庆大霉素、两性霉素、氨苄青霉素、米诺霉素、卡那霉素等。生长因子可以适当使用细胞生长因子、分化诱导因子、细胞粘附因子等。
[0106]
在本发明的一个以上的实施方式中,可以在支架的明胶无纺布上滴加细胞悬浮液后,静置规定时间例如3~4小时,进行用于使细胞粘附于明胶无纺布(支架)的预培养后,添加液体培养基进行细胞培养。
[0107]
培养例如可以在27℃以上且40℃以下进行,也可以为31℃以上且37℃以下。二氧化碳可以为2%以上且10%以下的范围。
[0108]
培养时间可以根据细胞种类、细胞数等适当确定,例如可以持续培养2~21天,可以持续培养3~14天,也可以持续培养4~10天。培养基可以每2~4天进行更换。
[0109]
作为一例,可以在细胞接种3~4小时后确认细胞粘附于支架后,向培养容器中加入液体培养基,在规定条件(例如温度37℃、5%co2)的培养箱中静置培养。液体培养基可以每2~4天进行更换。或者,也可以在细胞接种后,在培养容器中加入液体培养基,在37℃、5%co2的培养箱中放置的磁力搅拌器上一边搅拌液体培养基使其循环,一边进行搅拌培养。可以每3~4天除去一半量的液体培养基,加入等量的新的液体培养基,由此进行培养基更换。或者,也可以在细胞接种后,在培养容器中加入液体培养基,在37℃、5%co2的培养箱中一边振荡一边培养。也可以每3~4天除去一半量的液体培养基,加入等量的新的液体培养基,由此进行培养基更换。本发明的支架在被水润湿时会变透明,因此可以在培养液中利用倒立显微镜观察支架的内部。
[0110]
通过如上述那样在支架中接种细胞,能够提高接种效率,并且能够进行高密度的接种,通过在接种后进行细胞培养,能够进行高密度培养。
[0111]
本发明在一个以上的实施方式中,提供一种细胞集合体的制作试剂盒,其包含由层叠体构成的支架、以及内表面未经亲水化处理的培养容器,所述层叠体包含上述的以明胶为主成分的明胶无纺布、和层叠在所述明胶无纺布的一个表面上的以明胶为主成分的明胶膜,在细胞集合体的制作时,在内表面为干燥状态的培养容器中以明胶膜侧与培养容器的内底面接触的方式配置溶胀后的支架,向支架的明胶无纺布上滴加细胞悬浮液。上述那样的细胞集合体的制作试剂盒也可以用作细胞接种试剂盒、细胞培养试剂盒。
[0112]
在本发明的一个以上的实施方式中,在所述心肌细胞为干细胞、或者从经基因直接重组的体细胞分化的心肌细胞的情况下,支架可以促进心肌细胞的成熟,可以得到成熟的心肌细胞以及心肌细胞的细胞集合体。在本发明的一个以上的优选的实施方式中,在心肌细胞存在于构成支架(明胶无纺布)的明胶纤维上的情况下,与纤维的直径方向相比,在纤维的长度方向上细胞能够伸展的区域更大范围地存在,因此附着于明胶纤维的细胞在纤维的长度方向上取向,并且明胶无纺布柔软且变形恢复性优异,因此通过明胶纤维与心肌细胞一起收缩、舒张,能够对心肌细胞赋予力学刺激,促进心肌细胞的成熟。
[0113]
在为从干细胞或经基因直接重组的体细胞分化的心肌细胞的情况下,与生物体的心肌细胞相比,有时会因未成熟而功能不够充分。在心肌细胞未成熟的情况下,在化合物的副作用的检测中,有时会不显示与致心率失常预测相关的离子通道、与心收缩障碍相关的肌节结构发育、在药剂添加时收缩力增强的作用(阳性变力作用)。
[0114]
作为促进心肌细胞成熟的方法,已知施加心肌细胞的拉伸刺激、电刺激的赋予这样的外部刺激,但需要使用特殊的培养皿。在本发明的一个以上的优选的实施方式中,即使在心肌细胞为从干细胞或经基因直接重组的体细胞分化的心肌细胞的情况下,也能够不使用特殊的培养皿而得到成熟的心肌细胞的细胞集合体。
[0115]
作为成熟的心肌细胞的特征,例如可举出心肌细胞的结构、收缩性、电生理、钙处理和代谢等的特征。作为成熟的心肌细胞的结构特征,可举出尺寸变大、细胞形状变为纵长、肌节结构取向、以及肌节长度为1.8μm~2.2μm等。作为成熟的心肌细胞的收缩性特征,可举出收缩力增加、α-mhc/β-mhc提高、titin n2a向titin n2b变化、由β-受体刺激引起的收缩力增加、以及依赖于蛋白激酶a的收缩力增加等。作为成熟的心肌细胞的电生理特征,可举出兴奋速度增加、静止膜电位降低和活动电位持续时间延长。作为成熟的心肌细胞的钙处理特征,可举出肌内质网的钙贮存量增加、由肾上腺素刺激引起的钙循环增加、以及t管发育等。作为成熟的心肌细胞的代谢特征,可举出脂肪酸利用以及线粒体数增加等。所述成熟的心肌细胞的特征可以通过成像测定、收缩力测定、收缩速度、药理评价、基因解析等来确认。
[0116]
作为在成熟的心肌细胞中表达的基因,作为与电生理相关的基因,例如可举出scn5a、kcnj2、gja1、及cn4等,作为与钙处理相关的基因,例如可举出atp2a2、cacna1c、ryr2、slc8a1、pln、bin1、及jph2,作为与收缩相关的基因,例如可举出myh7、myh6、myl2、tnni3、pln、serca2a等,作为与代谢相关的基因,例如可举出cpt1b、pgc1a、及tfam等。
[0117]
在本发明的一个以上的实施方式中,细胞集合体可适用于细胞移植治疗、化合物的安全性评价、化合物的毒性评价、医疗设备、疾病模型、使用了疾病模型的药物开发研究等。
[0118]
在本发明的一个以上的实施方式中,例如细胞集合体可以用于对化合物的性质进行评价的化合物的评价方法。具体而言,通过在使化合物与细胞集合体接触后,判断细胞集合体的生理学特性是否因与化合物接触而变更,可以对化合物的性质进行评价。化合物的性质没有特别限定,例如可以是代谢、药理作用和毒性作用等。更具体而言,如上所述,可以在支架中接种细胞并培养规定时间而得到细胞集合体后,在细胞培养所使用的液体培养基中添加目标化合物,在添加化合物后观察评价细胞集合体的生理学特性是否发生变更。
[0119]
在所述细胞为心肌细胞的情况下,细胞集合体可以用于对目标化合物的电生理学
特性、心收缩等的影响,例如致心律失常风险评价、心收缩障碍、心毒性评价。在本发明的一个以上的优选的实施方式中,心肌细胞存在于支架的表面和内部、且粘附于支架(具体而言,明胶纤维和明胶膜的明胶无纺布侧的表面)的细胞集合体、即立体地配置有心肌细胞的三维培养的细胞集合体在心肌细胞收缩时细胞集合体容易作为整体追随心肌细胞的动作,能够有效地评价心跳、活动电位、收缩行为等心肌细胞的功能性。具体而言,细胞集合体的活动电位可以通过细胞内的钙离子的成像、细胞的膜电位的成像、微小电极阵列等来评价,收缩行为可以通过观察支架和构成支架的纤维的动作来评价,可以自由地使用亮视野、钙离子成像、膜电位成像等。
[0120]
实施例
[0121]
以下,使用实施例更具体地进行说明。需要说明的是,本发明并不限定于下述的实施例。
[0122]
测定、评价方法如下所述。
[0123]
《平均纤维直径》
[0124]
用显微镜(横河电机公司、cq1)观察溶胀后的支架,使用任意选择的50根纤维,测定溶胀后的平均纤维直径。
[0125]
《厚度》
[0126]
用扫描型电子显微镜(日立high technologies制flexsem1000、100倍和500倍)观察层叠体(支架)的截面,测量从得到的扫描型电子显微镜照片中任意选择的10处明胶膜层厚度、明胶无纺布的厚度和层叠体的厚度,算出平均值。
[0127]
用mitutoyo公司制的数字游标卡尺测量溶胀后的层叠体(支架)的厚度。
[0128]
《单位面积重量(单位面积的质量)>
[0129]
明胶无纺布的单位面积重量依据jis l 1913进行测定。
[0130]
《表观密度》
[0131]
明胶无纺布的密度基于无纺布的厚度和单位面积重量算出。
[0132]
《细孔直径》
[0133]
明胶无纺布的细孔直径基于wrotnowski的假定,通过下述计算式1算出。
[0134]
[数学式2]
[0135]
[计算式1]
[0136][0137][0138]
d:细孔直径(μm)
[0139]
w:无纺布表观密度(g/cm3)
[0140]
f:纤度(d)
[0141]
f:纤维直径(μm)
[0142]
ρ:纤维密度(g/cm3)
[0143]
(实施例1)
[0144]
《层叠体(支架)的制作>
[0145]
作为明胶,使用新田明胶公司制(胶质强度为262g、原料:碱处理牛骨),使明胶:水=95:5的质量比(明胶浓度为5质量%),在温度60℃下溶解。将该明胶水溶液用tp技研株式会社制的棒涂机no.20涂布在聚四氟乙烯膜(膜厚为50μm)上,在室温下风干一晚,由此得到明胶膜。
[0146]
接着,使用新田明胶公司制(胶质强度为262g、原料:碱处理牛骨)作为明胶,使明胶:水=3:5的质量比(明胶浓度为37.5质量%),在温度60℃下溶解。60℃下的粘度为960~970mpa
·
s。将该明胶水溶液作为纺丝液,使用图23所示的制造装置,在配置于卷取辊上的明胶膜上聚集明胶纤维而制成无纺布,由此制造层叠体。纺丝液的温度为60℃、喷嘴直径(内径)为250μm、喷出压力为0.2mpa、喷嘴高度为5mm、空气压力为0.375mpa、空气温度为100℃、流体喷射口与喷嘴喷出口的距离为5mm、捕集距离为50cm。层叠体在室温下风干一晚,接着进行加热脱水交联。交联条件设为温度140℃、48小时。
[0147]
将得到的层叠体冲裁成直径为6mm的圆柱,制作支架。
[0148]
《细胞集合体的制作》
[0149]
(1)将上述得到的层叠体(支架)在环氧乙烷气体灭菌后,在dulbecco’s磷酸缓冲生理盐水(d-pbs(-)(1x)、nacalai tesque公司)中静置10分钟使其溶胀。溶胀后的层叠体的直径为8mm。
[0150]
(2)用移液管从溶胀后的层叠体中除去过量的液体后,用镊子夹住端部,以明胶膜与孔的内底面接触的方式设置在iwaki悬浮培养用微孔板(无表面处理)6孔的一个孔中。
[0151]
(3)将人胎儿肾细胞hek293细胞在液体培养基中(dulbecco'smodified eagle's medium,sigma公司(10%胎牛血清,添加有1%青霉素链霉素))以达到2
×
107cells/ml的方式悬浮而得到的细胞悬浮液在层叠体的明胶无纺布的表面上滴加20μl。在温度37℃、5%co2的培养箱中静置培养3小时,使细胞粘附于层叠体。支架每单位面积的细胞接种量为6250细胞/mm2。
[0152]
(4)加入上述液体培养基3ml,在温度37℃、5%co2的培养箱中静置培养72小时。
[0153]
(实施例2)
[0154]
《层叠体(支架)的制作>
[0155]
使喷嘴直径(内径)为150μm、喷嘴喷出压力为0.275mpa、喷嘴高度为5mm、空气压力为0.375mpa、空气温度为100℃、流体喷射口与喷嘴喷出口的距离为5mm、捕集距离为50cm,除此以外,与实施例1同样地制作层叠体。
[0156]
将得到的层叠体冲裁成直径为6mm的圆柱,作为支架使用。
[0157]
《细胞集合体的制作》
[0158]
除了使用上述得到的层叠体(支架)以外,与实施例1同样地制作细胞集合体。溶胀后的层叠体的直径为8mm。
[0159]
(实施例3)
[0160]
《层叠体(支架)的制作>
[0161]
将与实施例1同样地得到的层叠体冲裁成直径为6mm的圆柱,作为支架使用。溶胀
后的层叠体的直径为8mm。
[0162]
将该支架在含有纤连蛋白的磷酸缓冲液中浸渍2小时后,吸引除去纤连蛋白溶液,所述含有纤连蛋白的磷酸缓冲液是以相对于dulbecco’s磷酸缓冲生理盐水(d-pbs(-)(1x),nacalai tesque公司)达到1/100(体积比)的方式添加纤连蛋白溶液(1mg/ml、sigma公司)而得到的。
[0163]
《细胞集合体的制作》
[0164]
使用将经纤连蛋白处理的支架和ips细胞来源的心肌细胞(icell(注册商标)cardiomyocytes2、富士胶片和光纯药公司制)以达到1
×
107cells/ml的方式悬浮于液体培养基(icell(注册商标)心肌细胞解冻培养基、富士胶片和光纯药公司制)中而得到的细胞悬浮液,在培养4小时后添加液体培养基(icell(注册商标)心肌细胞维持培养基、富士胶片和光纯药公司制),除此以外,与实施例1同样地制作细胞集合体。支架每单位面积的细胞接种量为3125细胞/mm2。
[0165]
(实施例4)
[0166]
《层叠体(支架)的制作>
[0167]
将与实施例2同样地得到的层叠体冲裁成直径为6mm的圆柱,作为支架使用。溶胀后的层叠体的直径为8mm。
[0168]
将该支架在含有纤连蛋白的磷酸缓冲液中浸渍2小时后,吸引除去含有纤连蛋白的液体培养基,所述含有纤连蛋白的磷酸缓冲液是以相对于dulbecco’s磷酸缓冲生理盐水(d-pbs(-)(1x)、nacalai tesque公司)达到1/100(体积比)的方式添加纤连蛋白溶液(1mg/ml、sigma公司)而得到的。
[0169]
《细胞集合体的制作》
[0170]
使用将经纤连蛋白处理的支架和ips细胞来源的心肌细胞(icell(注册商标)cardiomyocytes2、富士胶片和光纯药公司制)以达到1
×
107cells/ml的方式悬浮于液体培养基(icell(注册商标)心肌细胞解冻培养基、富士胶片和光纯药公司制)中而得到的细胞悬浮液,在培养4小时后添加液体培养基(icell(注册商标)心肌细胞维持培养基、富士胶片和光纯药公司制),除此以外,与实施例2同样地制作细胞集合体。支架每单位面积的细胞接种量为3125细胞/mm2。
[0171]
(比较例1)
[0172]
作为培养容器,使用iwaki组织培养用微孔板(粘附性细胞用)6孔,除此以外,与实施例1同样地进行细胞接种和细胞培养。
[0173]
(比较例2)
[0174]
作为培养容器,使用iwaki组织培养用微孔板(粘附性细胞用)6孔,除此以外,与实施例3同样地进行细胞接种和细胞培养。
[0175]
将实施例中使用的支架的各种测定、评价结果示于下述表1。图1和2分别表示实施例1和2中使用的支架的截面照片。由图1和图2可知,构成所述明胶无纺布的明胶纤维的纤维交点至少部分地熔融粘合,并且所述明胶膜与构成所述明胶无纺布的明胶纤维部分地熔融粘合。
[0176]
[表1]
[0177][0178]
实施例1~2和比较例1中,如下观察刚接种细胞后(以下也记为“接种后”)、之后培养3小时并添加液体培养基后(以下也记为“培养3小时后”)、培养72小时后的支架。将其结果示于图3~5、图9和表2。在实施例3~4和比较例2中,如下观察刚接种细胞后(以下也记为“接种后”)、之后培养4小时并添加液体培养基后(以下也记为“培养4小时后”)、培养72小时后的支架。将其结果示于图6~8、图10和表3。
[0179]
(1)细胞有无脱落
[0180]
用光学显微镜(zeiss公司制,axio vert.a1)以4倍观察接种后及培养3小时后(实施例1~2)或培养4小时后(实施例3~4)的支架的端部。
[0181]
(2)活细胞的荧光观察
[0182]
向液体培养基中以1/100体积浓度(v/v)添加作为核染色荧光试剂的双苯甲酰亚胺h33342氟铬三盐酸盐的dmso溶液(1mg/ml、nacalai tesque公司),在37℃、5%co2的条件下培养30分钟后,用dulbecco’s磷酸缓冲生理盐水(d-pbs(-)(1x)、nacalai tesque公司)清洗,再次添加液体培养基。
[0183]
然后,使用横河电机公司制的共聚焦成像装置(cq1),对活细胞进行荧光观察。为了分别观察支架材料的表里,用镊子夹住支架材料的端部,反转进行观察。观察图像在厚度方向上以10μm间隔进行,通过最大值投影法(mip)将50张重叠。支架的整体图像连结4倍的观察图像。放大图像是20倍的观察图像。在图像中,看起来为白色的部分是细胞核。
[0184]
(3)活细胞数和活细胞比例的计算
[0185]
将接种1天后的支架用dulbecco’s磷酸缓冲生理盐水(d-pbs(-)(1x)、nacalai tesque公司)清洗后,将该支架移至15ml离心管中,滴加2.5g/l胰蛋白酶/1mmol/l edta溶液(nacalai tesque公司)1ml。在37℃、5%co2下培养25分钟,目视确认该支架溶解后,用0.5%台盼蓝染色液(nacalai tesque公司)对死细胞进行染色,用全自动细胞计数器(tc20
tm
、bio-rad laboratories公司)算出活细胞数和活细胞比例。
[0186]
(4)支架内的细胞分布
[0187]
对于培养72小时后的支架,向液体培养基中以1/100体积浓度(v/v)添加作为核染色荧光试剂的双苯甲酰亚胺h33342氟铬三盐酸盐的dmso溶液(1mg/ml、nacalai tesque公司),在37℃、5%co2的条件下培养30分钟后,用dulbecco’s磷酸缓冲生理盐水(d-pbs(-)(1x)、nacalai tesque公司)清洗,再次添加液体培养基。
[0188]
然后,使用横河电机公司制的共聚焦成像装置(cq1),对活细胞进行荧光观察。为了分别观察支架材料的表里,用镊子夹住支架材料的端部,反转进行观察。观察在厚度方向上以10μm的间隔进行,从明胶无纺布侧和明胶膜侧分别观察厚度为0μm(表面)、100μm、200μ
m的部位,由此研究细胞在深度方向上的分布。
[0189]
图3是实施例1中用光学显微镜观察支架端部而得到的(4倍)结果,(a)是细胞接种后的结果,(b)是培养3小时后添加液体培养基时的结果。
[0190]
图4是对支架中的活细胞(hek293细胞)进行荧光观察而得到的支架的整体图像,(a)是细胞接种后的支架的整体图像,(b)是其中心部的放大图像,(c)是在培养3小时后添加液体培养基时的支架(细胞集合体)的整体图像,(d)是其中心部的放大图像,(e)是培养72小时后的支架(细胞集合体)的整体图像,(f)是其中心部的放大图像。在图4的(a)、(c)及(e)中,比例尺表示1000μm,在图4的(b)、(d)及(f)中,比例尺表示100μm。
[0191]
图5是实施例2中对支架中的活细胞(hek293细胞)进行荧光观察而得到的支架的整体图像,(a)是细胞接种后的支架的整体图像,(b)是其中心部的放大图像,(c)是培养3小时后添加液体培养基时的支架(细胞集合体)的整体图像,(d)是其中心部的放大图像,(e)是培养72小时后的支架(细胞集合体)整体图像,(f)是其中心部的放大图像。在图5的(a)、(c)及(e)中,比例尺表示1000μm,在图5的(b)、(d)及(f)中,比例尺表示100μm。
[0192]
图6是实施例3中用光学显微镜观察支架的端部而得到的(4倍)结果,(a)是细胞接种后的结果,(b)是培养3小时后添加液体培养基时的结果。
[0193]
图7是实施例3中对支架中的活细胞(心肌细胞)进行荧光观察而得到的结果,(a)是细胞接种后的支架的整体图像,(b)是其中心部的放大图像,(c)是培养3小时后添加液体培养基时的支架(细胞集合体)的整体图像,(d)是其中心部的放大图像,(e)是培养72小时后的支架(细胞集合体)的整体图像,(f)是其中心部的放大图像。在图7的(a)、(c)及(e)中,比例尺表示1000μm,在图7的(b)、(d)及(f)中,比例尺表示100μm。
[0194]
图8是实施例4中对支架中的活细胞(心肌细胞)进行荧光观察而得到的结果,(a)是细胞接种后的支架的整体图像,(b)是其中心部的放大图像,(c)是培养3小时后添加液体培养基时的支架(细胞集合体)的整体图像,(d)是其中心部的放大图像,(e)是培养72小时后的支架(细胞集合体)的整体图像,(f)是其中心部的放大图像。在图8的(a)、(c)及(e)中,比例尺表示1000μm,在图8的(b)、(d)及(f)中,比例尺表示100μm。
[0195]
由图3~8可知,在实施例1~4中,在细胞接种后、培养3小时(实施例1~2)或4小时(实施例3~4)后添加液体培养基的阶段和培养72小时的任一阶段,均几乎没有细胞从支架脱落,接种效率高,能够从培养初期以高密度进行培养。
[0196]
图9是比较例1中用光学显微镜观察支架端部的细胞有无脱落而得到的(4倍)结果,(a)是细胞接种后的结果,(b)是培养3小时后添加液体培养基时的结果。由图9可知,在比较例1中,从刚细胞接种后就有大量的细胞从支架脱落,接种效率低。
[0197]
[表2]
[0198] 实施例1实施例2比较例1活细胞数39133.3395333.3250000.0接种效率(%)97.898.862.5活细胞比例(%)96.594.598
[0199]
由表2的数据可知,比较例1中接种效率为62.5%,与此相对,实施例1~2中接种效率为97.8%以上,接种效率显著地提高。
[0200]
图10是比较例2中用光学显微镜观察支架端部的细胞有无脱落而得到的(4倍)结
果,(a)是细胞接种后的结果,(b)是培养4小时后添加液体培养基时的结果。由图10可知,在比较例2中,细胞接种后大量的细胞从支架脱落,接种效率低。
[0201]
[表3]
[0202] 实施例3实施例4比较例2活细胞数63466.795500.020950.0接种效率(%)31.747.810.5活细胞比例(%)78.380.093
[0203]
由表3的数据可知,比较例2中接种效率为10.5%,与此相对,实施例3中接种效率为31.7%,实施例4中为47.8%,接种效率显著地提高。ips来源心肌细胞的细胞植入率低,即使在细胞粘附性培养皿上进行培养的情况下,植入率也为40~50%左右,在由该明胶无纺布及明胶膜构成的支架上的接种效率优异。
[0204]
图11是对实施例1中培养72小时后的支架中的活细胞的分布进行观察而得到的结果,(a)是对明胶无纺布侧的表面进行观察的结果,(b)是在厚度方向上距离明胶无纺布表面100μm的部位的结果,(c)是在厚度方向上距离明胶无纺布表面200μm的部位的结果,(d)是在厚度方向上距离明胶膜表面200μm的部位的结果,(e)是在厚度方向上距离明胶膜表面100μm的部位的结果,(f)是对明胶膜侧的表面进行观察而得到的结果。在图11中,比例尺表示500μm。
[0205]
图12是对实施例2中培养72小时后的支架中的活细胞的分布进行观察而得到的照片,(a)是对明胶无纺布侧的表面进行观察而得到的结果,(b)是在厚度方向上距离明胶无纺布表面100μm的部位的结果,(c)是在厚度方向上距离明胶无纺布表面200μm的部位的结果,(d)是在厚度方向上距离明胶膜表面200μm的部位的结果,(e)是在厚度方向上距离明胶膜表面100μm的部位的结果,(f)是对明胶膜侧的表面进行观察而得到的结果。在图12中,比例尺表示500μm。
[0206]
由图11和12可知,在实施例中,细胞也侵入到支架内部,进行了三维培养。在构成明胶无纺布的明胶纤维的平均纤维直径大(明胶无纺布的细孔直径大)的实施例1的情况下,在明胶无纺布侧细胞少,沿着厚度方向越靠近明胶膜侧细胞越多。与此相对,在构成明胶无纺布的明胶纤维的平均纤维直径小(明胶无纺布的细孔直径小)的实施例2的情况下,在明胶无纺布侧,细胞比明胶膜侧的细胞多。
[0207]
(实施例5)
[0208]
《使用了ips细胞来源的心肌细胞的化合物的评价1》
[0209]
(1)心肌细胞的同步搏动的评价
[0210]
与实施例4同样地进行细胞接种,4小时后添加液体培养基进行细胞培养。在培养第4天,向培养基中添加5/100(体积比)的钙指示剂(earlytox cardiotoxicity kit,molecular device公司),对心肌细胞内的钙离子进行荧光染色。
[0211]
使用横河电机公司制的共聚焦成像装置(cq1),以20fps进行动画拍摄。使用横河电机公司制的图像解析装置cellpathfinder,从得到的动画识别显色区域,将荧光强度相对于时间作图,由此得到心肌细胞中的钙离子的信号波形。
[0212]
图13是在培养第4天添加钙指示剂后的细胞集合体的细胞内的钙离子的成像评价结果,(a)是亮视野图像,(b)是从添加钙指示剂起120分钟后对细胞内的钙离子进行荧光观
察而得到的图像,(c)是从(b)的时点起0.7秒后对细胞内的钙离子进行荧光观察而得到的图像,(d)是将测定点a和测定点b的荧光强度相对于时间作图而得到的图。其中,测定点a与测定点b之间的距离为3145μm。
[0213]
由图13的(b)~(d)可知,在由明胶无纺布及明胶膜构成的支架上培养的心肌细胞即使在距离3mm以上的大范围的区域中,细胞内钙离子浓度也在同一时间点发生变化并同步地搏动。
[0214]
(2)对异丙肾上腺素的响应性的评价
[0215]
与上述同样地,向培养基中添加5/100(质量比)的钙指示剂,培养2小时后,对心肌细胞内的钙离子进行荧光染色观察。观察后,作为加快心肌搏动的化合物,以达到100nm的方式在液体培养基中添加在心动过缓、房室传导阻滞、支气管哮喘的治疗中使用的β刺激药异丙肾上腺素,5分钟后,对心肌细胞内的钙离子进行荧光染色观察。
[0216]
图14是表示实施例5中培养第4天对异丙肾上腺素的响应性的结果。通过添加100nm的异丙肾上腺素,细胞内的钙离子浓度变化变快,搏动次数在添加前是60bpm,与此相对,在添加后是76bpm,搏动次数发生了变化。
[0217]
由以上可知,通过比较使目标化合物与细胞集合体接触前和使目标化合物与细胞集合体接触后的心肌细胞的搏动数和/或伴随时间的荧光强度的峰形状,能够判断该化合物对心肌细胞施加的效果。
[0218]
(实施例6)
[0219]
《使用了ips细胞来源的心肌细胞的化合物的评价2》
[0220]
(1)心肌细胞的同步搏动的评价
[0221]
使用以细胞数达到2
×
107cells/ml的方式悬浮而得到的细胞悬浮液,除此以外,与实施例4同样地进行细胞接种,4小时后添加液体培养基进行细胞培养。在培养第4天以后,向培养基中添加5/100(体积比)的钙指示剂(earlytox cardiotoxicity kit,molecular device公司),对心肌细胞内的钙离子进行荧光染色。支架每单位面积的细胞接种量为6250细胞/mm2。
[0222]
使用横河电机公司制的共聚焦成像装置(cq1),以20fps进行动画拍摄。使用横河电机公司制的图像解析装置cellpathfinder,从得到的动画识别显色区域,将荧光强度相对于时间作图,由此得到心肌细胞中的钙离子的信号波形。
[0223]
图15是培养第4天的添加钙指示剂后的细胞集合体的细胞内的钙离子的成像评价结果,(a)是亮视野图像,(b)是从添加钙指示剂起120分钟后对细胞内的钙离子进行荧光观察而得到的图像,(c)是从(b)的时点起0.7秒后对细胞内的钙离子进行荧光观察而得到的图像,(d)是将测定点a和测定点b的荧光强度相对于时间作图而得到的图。其中,测定点a与测定点b之间的距离为2465μm。
[0224]
由图15的(b)~(d)可知,在由细胞集合体、即明胶无纺布和明胶膜构成的支架上培养的心肌细胞即使在距离2mm以上的宽范围的区域中,细胞内钙离子浓度也在同一时间点发生变化并同步地搏动。
[0225]
(2)对诱发心律不齐的化合物的响应性的评价
[0226]
与上述同样地,向培养基中添加5/100(体积比)的钙指示剂,培养2小时后,对心肌细胞内的钙离子进行荧光观察。然后,作为诱发心律失常的化合物,将延迟整流性钾电流
(ikr)的抑制剂e-4031(富士胶片和光纯药公司)以达到900nm的方式添加到液体培养基中,从添加起120分钟后进行荧光观察。
[0227]
图16是表示培养第4天的由e-4031产生的响应性的结果,(a)是对添加e-4031起120分钟后的细胞内的钙离子进行荧光观察而得到的图像,(b)是从(a)的时点起0.4秒后对细胞内的钙离子进行荧光观察而得到的图像,(c)是将测定点a和测定点b的荧光强度相对于时间作图而得到的图。
[0228]
由图16(a)~(c)可知,当在由细胞集合体、即明胶无纺布和明胶膜构成的支架上培养的心肌细胞中添加e-4031时,根据部位不同,细胞内的钙离子浓度在不同的时间点发生变化,并且同步搏动受到抑制。根据图16(c),在测定点b,与测定点a相比,搏动行为大幅变化,确认到心律不齐。
[0229]
(实施例7)
[0230]
《使用了ips细胞来源的心肌细胞的化合物的评价3》
[0231]
(1)心肌细胞集合体的制作
[0232]
以支架每单位面积的接种量达到6000细胞/mm2的方式接种细胞,除此以外,与实施例6同样地进行细胞接种和培养。
[0233]
(2)心肌细胞集合体的结构观察
[0234]
在培养第3天和第7天回收含有心肌细胞的支架(心肌细胞集合体),用16%多聚甲醛固定后,进行荧光染色。使用双苯甲酰亚胺h33342氟铬三盐酸盐的dmso溶液(1mg/ml、nacalai tesque公司)对细胞核进行染色,使用alexa fluor
tm 568鬼笔环肽(phalloidin,invitrogen公司)对肌动蛋白丝进行染色,作为1次抗体使用抗α-肌动蛋白(sarcomeric)抗体(sigma公司)对α-肌动蛋白进行免疫染色,进行结构观察。
[0235]
(3)心肌细胞集合体的通过钙成像进行的化合物的响应性评价
[0236]
在培养第6天,以细胞大量存在的面面向培养皿(iwaki悬浮培养用微孔板(无表面处理)6孔)底面的方式设置心肌细胞集合体后,静置1天。在培养第7天,向培养基中添加25/100(体积比)的钙指示剂(earlytox cardiotoxicity kit,molecular device公司),对心肌细胞内的钙离子进行荧光染色。
[0237]
将下述表4所示的化合物分别累积给予至目标浓度,根据钙离子的浓度变化,观察化合物响应性。以各浓度给予化合物10分钟后,使用横河电机公司制的共聚焦成像装置(cq1),以20fps拍摄荧光延迟图像。根据所得到的图像,使用横河电机公司制的图像解析装置cellpathfinder,将10倍的视野整体的荧光强度相对于时间作图,由此得到心肌细胞中的钙离子的信号波形。维拉帕米是具有icr抑制作用的ca通道拮抗剂。
[0238]
(4)心肌细胞集合体的收缩力的评价
[0239]
对于通过上述钙离子指示剂观察了下述表4的化合物的响应性的各标本,使用横河电机公司制的共聚焦成像装置(cq1),以20fps拍摄亮视野图像。使用imagej的plug-in工具musclemotion(sala et al,circu.res.,2018)对得到的图像评价心肌细胞集合体的收缩力和收缩舒张速度。
[0240]
[表4]
[0241][0242]
图17是实施例7中的心肌细胞集合体的荧光染色结果。(a)是培养第3天的细胞核和肌动蛋白丝染色图像,(b)是培养第3天的α-肌动蛋白免疫染色图像,(c)是(b)的部分放大图像。(d)是培养第7天的细胞核和肌动蛋白丝染色图像,(e)是培养第7天的α-肌动蛋白免疫染色图像,(f)是(e)的部分放大图像。在图17中,比例尺表示50μm。
[0243]
由图17(a)的鬼笔环肽染色的结果可知,在心肌细胞集合体中,在培养第3天的短期间的培养日期时间,肌动蛋白丝以覆盖构成支架的明胶纤维的方式存在,在大范围内连结。由图17(b)和(c)的α-肌动蛋白免疫染色结果可知,沿着明胶纤维的长度方向,表现出构成心肌细胞的肌节结构(条纹图案),并进行了取向。另外,在培养第7天时,该肌节结构更粗地发育,明胶纤维在长度方向上的取向变得更清楚。已知心肌细胞的肌节结构在成熟的心肌细胞中沿1个方向取向,心肌细胞集合体能够使ips细胞来源的心肌细胞提前取向,得到结构上成熟的心肌细胞。另外,由于该肌节结构内的肌节长度约为2μm,与成熟的心肌的肌节长度为同等程度,由此可知心肌细胞成熟。
[0244]
图18是表示实施例7中对各化合物的响应性的图表。(a)是给予异丙肾上腺素前及给予1000nm后的钙离子的信号波形,(b)是各浓度的异丙肾上腺素时的搏动数。(c)是给予e-4031前和给予1000nm后的钙离子的信号波形,(d)是各浓度的e-4031时的搏动数。(e)是给予维拉帕米前和给予1000nm后的钙离子的信号波形,(f)是各浓度的维拉帕米时的搏动数。
[0245]
由图18可知,心肌细胞集合体对具有不同作用的化合物显示出不同的响应性。在给予了异丙肾上腺素的情况下,与给予之前相比,钙离子的信号波形变得尖锐(a),心率也变快(b)。在给予了e-4031的情况下,与给予之前相比,钙离子的信号波形伸长(c),心率降低,在100nm以上发生心律不齐(d)。在给予了维拉帕米的情况下,与给予之前相比,钙离子的信号波形变小(e),另外心率增加(f)。
[0246]
图19是表示实施例7中对各化合物的响应性的图表。(a)表示给予异丙肾上腺素前及给予1000nm后的收缩力,(b)表示给予异丙肾上腺素前及给予1000nm后的收缩舒张速度。(c)表示给予e-4031前和给予1000nm后的收缩力,(d)表示给予e-4031前和给予1000nm后的收缩舒张速度。(e)表示给予维拉帕米前和给予1000nm后的收缩力,(f)表示给予维拉帕米前和给予1000nm后的收缩舒张速度。
[0247]
由图19可知,心肌细胞集合体对具有不同作用的化合物显示出不同的收缩力变化和收缩舒张速度的变化,容易地对化合物的响应性进行了评价。在给予了异丙肾上腺素的情况下,与给予之前相比,收缩力增加(a),收缩舒张速度也增加(b)。在给予了e-4031的情况下,与给予之前相比,收缩力降低(c),收缩舒张速度也降低(d)。在给予了维拉帕米的情况下,与给予前相比,收缩力降低(e),收缩舒张速度也降低(f)。通过添加β受体刺激药异丙肾上腺素,收缩力增加(确认到阳性变力作用),由此可知该心肌细胞集合体内的心肌细胞成熟。
[0248]
(实施例8)
[0249]
《使用了ips细胞来源的心肌细胞的化合物的评价4》
[0250]
(1)心肌细胞集合体的制作
[0251]
以支架的每单位面积的接种量达到8000细胞/mm2的方式接种细胞,除此以外,与实施例7同样地进行细胞接种、培养。
[0252]
(2)心肌细胞集合体的通过钙成像进行的化合物的响应性评价
[0253]
在钙指示剂添加前一天,以细胞大量存在的面面向培养皿底面的方式设置心肌细胞集合体,在培养第6~10天添加钙指示剂,除此以外,与实施例7同样地对心肌细胞内的钙离子进行荧光染色。
[0254]
将下述表5所示的化合物(用作covid-19的治疗药)累积给予至目标浓度,与实施例7同样地得到心肌细胞中的钙离子的信号波形。
[0255]
(3)心肌细胞集合体的收缩力的评价
[0256]
对于通过上述钙离子指示剂观察了下述表5的化合物的响应性的各标本,与实施例7同样地评价心肌集合体的收缩力。
[0257]
[表5]
[0258][0259]
图20是表示实施例8中对各化合物的响应性(钙离子的信号波形)的图表。(a)表示阿奇霉素、(b)表示氯喹、(c)表示羟基氯喹、(d)表示阿奇霉素(3μm)与氯喹并用、(e)表示阿奇霉素(3μm)与羟基氯喹并用时的结果。
[0260]
将实施例8中使用上述表5记载的化合物时的显示出心律不齐的钙离子信号波形的标本的概率示于下述表6。
[0261]
[表6]
[0262][0263]
由图20和表6可知,氯喹和羟基氯喹的心律不齐的风险高,另一方面,如果将阿奇霉素与氯喹或羟基氯喹并用,则心律不齐的风险降低。
[0264]
图21是表示实施例8中使用各化合物时的响应性(收缩力)的图表。(a)表示阿奇霉素、(b)表示氯喹、(c)表示羟基氯喹、(d)表示阿奇霉素(3μm)与氯喹并用、(e)表示阿奇霉素(3μm)与羟基氯喹并用的结果。
[0265]
将实施例8中上述表5记载的化合物的各浓度时的从化合物给予前收缩力减半了的标本的概率示于下述表7。
[0266]
[表7]
[0267][0268]
由图21和表7可知,当将阿奇霉素与氯喹或羟基氯喹并用时,与氯喹、羟基氯喹单独相比,在低浓度下收缩力降低、发生心收缩障碍的风险变高。
[0269]
(实施例9)
[0270]
《使用了ips细胞来源的心肌细胞的化合物的评价5》
[0271]
(1)心肌细胞集合体的制作
[0272]
作为ips细胞来源的心肌细胞使用ncardia公司制的pluricyte(注册商标),以支架的每单位面积的接种量达到6000细胞/mm2的方式接种细胞,除此以外,与实施例3同样地进行细胞接种和培养。
[0273]
(2)心肌细胞集合体的由膜电位指示剂进行的化合物的响应性评价
[0274]
在培养第7天,以细胞大量存在的面面向培养皿(iwaki悬浮培养用微孔板(无表面处理)6孔)底面的方式设置心肌细胞集合体后,静置1天。在培养第8天,向培养基中加入膜电位指示剂(fluovolt,invitrogen公司),在37℃下孵育30分钟,通过荧光染色测定心肌细胞内的膜电位。
[0275]
将e-4031以达到0、1、10、100、1000nm的方式累积给予到培养液中,根据膜电位的变化观察响应性。以各浓度给予化合物10分钟后,使用横河电机公司制的共聚焦成像装置(cq1),以20fps拍摄荧光延迟图像。根据所得到的图像,使用横河电机公司制的图像解析装置cellpathfinder,将x10的视野整体的荧光强度相对于时间作图,由此得到心肌细胞中的膜电位的信号波形。
[0276]
图22中示出了实施例9中的通过膜电位指示剂观察到的化合物响应性的结果。由图22可知,即使在由膜电位指示剂引起的膜电位的变化中,通过添加e-4031,也产生了心律不齐的波形,能够评价心律不齐。
[0277]
由以上可知,通过比较使目标化合物与细胞集合体接触前和使目标化合物与细胞集合体接触后的心肌细胞中的钙离子的信号波形、收缩力、膜电位的信号波形等,能够判断该化合物对心肌细胞的影响,例如是否具有心毒性。
[0278]
由上述可知,在本发明的一个以上的实施方式中,细胞集合体可以用于化合物的代谢、药理作用、毒性作用等各种性质的评价方法。
[0279]
本发明没有特别限定,优选包含以下的方式。
[0280]
[1]一种细胞集合体,其特征在于,包含细胞和支架,所述支架由层叠体构成,所述层叠体包含以明胶为主成分的明胶无纺布和层叠在所述明胶无纺布的一个表面上的以明胶为主成分的明胶膜,
[0281]
所述细胞存在于所述明胶无纺布的表面和内部中的至少一者。
[0282]
[2]根据[1]所述的细胞集合体,其中,
[0283]
构成所述明胶无纺布的明胶纤维的溶胀后的平均纤维直径为2μm以上且400μm以下,且纤维交点至少部分熔融粘合,并且所述明胶膜与构成所述明胶无纺布的明胶纤维部分熔融粘合。
[0284]
[3]根据[1]或[2]所述的细胞集合体,其中,
[0285]
所述明胶无纺布的厚度为0.1mm以上且2.0mm以下,单位面积重量为10g/m2以上且600g/m2以下。
[0286]
[4]根据[1]~[3]中任一项所述的细胞集合体,其中,
[0287]
所述明胶膜的厚度为0.80μm以上且3.20μm以下。
[0288]
[5]根据[1]~[4]中任一项所述的细胞集合体,其中,
[0289]
所述明胶无纺布的厚度tn与所述明胶膜的厚度tf之比tf/tn为7.5
×
10-3
以下。
[0290]
[6]根据[1]~[5]中任一项所述的细胞集合体,其中,
[0291]
所述明胶无纺布和明胶膜进行了热脱水交联。
[0292]
[7]根据[1]~[6]中任一项所述的细胞集合体,其中,
[0293]
所述细胞存在于所述明胶无纺布的表面和内部这两者。
[0294]
[8]根据[1]~[7]中任一项所述的细胞集合体,其中,
[0295]
所述细胞为选自干细胞、癌细胞、干细胞来源的心肌细胞、神经细胞、肝细胞、成纤维细胞、内皮细胞和上皮细胞、以及生物体来源的心肌细胞、神经细胞、肝细胞、成纤维细胞、内皮细胞和上皮细胞中的1种以上。
[0296]
[9]根据[1]~[8]中任一项所述的细胞集合体,其中,
[0297]
所述细胞包含成熟的心肌细胞,所述成熟的心肌细胞是由干细胞分化的心肌细胞或由体细胞分化的心肌细胞成熟而成的。
[0298]
[10][1]~[9]中任一项所述的细胞集合体的制造方法,其特征在于,包含下述工序:
[0299]
准备由层叠体构成的支架和内表面未经亲水化处理的培养容器的工序,所述层叠体包含以明胶为主成分的明胶无纺布、和层叠在所述明胶无纺布的一个表面上的以明胶为主成分的明胶膜;
[0300]
在内表面为干燥状态的培养容器中以明胶膜侧与培养容器的内底面接触的方式配置溶胀后的支架的工序;以及
[0301]
在支架的明胶无纺布上滴加细胞悬浮液并进行培养的工序。
[0302]
[11]根据[10]所述的细胞集合体的制造方法,其中,
[0303]
在支架的明胶无纺布上滴加细胞悬浮液并静置规定时间后,添加液体培养基进行
细胞培养。
[0304]
[12]根据[10]或[11]所述的细胞集合体的制造方法,其中,
[0305]
所述细胞悬浮液包含由干细胞分化的心肌细胞或由体细胞分化的心肌细胞,通过细胞培养规定时间使心肌细胞成熟。
[0306]
[13][1]~[9]中任一项所述的细胞集合体的制作试剂盒,其中,
[0307]
所述制作试剂盒包含由层叠体构成的支架和内表面未经亲水化处理的培养容器,所述层叠体包含以明胶为主成分的明胶无纺布、和层叠在所述明胶无纺布的一个表面上的以明胶为主成分的明胶膜;
[0308]
在细胞集合体的制作时,在内表面为干燥状态的培养容器中以明胶膜侧与培养容器的内底面接触的方式配置溶胀后的支架,向支架的明胶无纺布上滴加细胞悬浮液。
[0309]
[14]根据[13]所述的细胞集合体的制作试剂盒,其中,
[0310]
所述细胞悬浮液包含由干细胞分化的心肌细胞或由体细胞分化的心肌细胞,所述试剂盒用于成熟的心肌细胞的制作。
[0311]
[15]一种对化合物的性质进行评价的化合物的评价方法,其包含:
[0312]
使化合物与[1]~[9]中任一项所述的细胞集合体接触的工序;以及
[0313]
判断细胞集合体的生理学特性是否因与化合物接触而发生变更的工序。
[0314]
[16]根据[15]所述的化合物的评价方法,其中,
[0315]
所述化合物的性质为选自代谢、药理作用和毒性作用中的一种以上。
[0316]
[17]根据[15]或[16]所述的化合物的评价方法,其中,
[0317]
所述细胞集合体包含心肌细胞,
[0318]
所述判断工序通过选自细胞内的钙离子的成像、细胞内的膜电位的成像和细胞集合体的收缩力评价中的一种以上来进行。
[0319]
符号说明
[0320]1ꢀꢀꢀꢀꢀꢀ
加温槽
[0321]2ꢀꢀꢀꢀꢀꢀ
纺丝液
[0322]3ꢀꢀꢀꢀꢀꢀ
喷嘴喷出口
[0323]
4、6
ꢀꢀꢀ
压缩机
[0324]5ꢀꢀꢀꢀꢀꢀ
流体喷射口
[0325]7ꢀꢀꢀꢀꢀꢀ
压力流体
[0326]8ꢀꢀꢀꢀꢀꢀ
明胶纤维
[0327]9ꢀꢀꢀꢀꢀꢀ
明胶无纺布
[0328]
10
ꢀꢀꢀꢀꢀ
明胶膜
[0329]
11
ꢀꢀꢀꢀꢀ
卷取辊
[0330]
12
ꢀꢀꢀꢀꢀ
保温容器
[0331]
20
ꢀꢀꢀꢀꢀ
制造装置
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。