1.本发明涉及制药领域,具体涉及一种新型外泌体抑制剂及其制备方法。
背景技术:
2.外泌体是在大多数真核细胞的内体区室中产生的细胞外囊泡,并且在最近几年中引起了广泛关注。在1980年代后期,外泌体首次被发现在细胞外空间。外泌体包裹在多囊泡内体中,并在与质膜融合后,外泌体会被释放到细胞的外部。最初,从细胞释放的外泌体被认为是由于细胞损伤或细胞维持稳态产生的副产物或是细胞废物,对相邻细胞没有明显的影响。直到最近,才发现这些外泌体在细胞间通讯中发挥重要作用。它们携带多种物质,例如脂质,蛋白质和核酸,然后将这些物质运送到它们遇到的靶细胞中,当这些物质被受体细胞接收后,其功能可能会发生相应的改变。因此,外泌体作为一种新型的细胞间通讯方式,对许多细胞活动具有重要意义,例如参与信号转导和免疫反应。几乎所有的真核细胞都可以释放外泌体,因此它们的功能在功能上可能会有所不同。外泌体被发现也参与各种疾病过程,例如,在癌症中,肿瘤的外泌体与肿瘤的进展,血管生成和通过旁分泌破坏局部和远距离微环境的免疫逃逸有关。在许多肿瘤疾病中,已经报道了外泌体在癌症转移各个阶段的作用,包括诱导侵袭,迁移和转移前利基的形成。随着对外泌体的释放机理越来越清楚,人们做出了很多的努力来开发外泌体抑制剂作为各种疾病的辅助疗法。迄今为止,关于外泌体的研究已经发表了数千篇论文,并且发现了许多具有不同骨架的外泌体抑制剂。
3.我们的初步研究表明破骨细胞释放的外泌体可以抑制骨形成。我们还进一步发现,通过使用rab27a小干扰rna(sirna)抑制破骨细胞的外泌体释放可延缓骨关节炎小鼠的疾病进展。因此,外泌体抑制剂在疾病治疗中具有潜在价值。并且,rab27a是参与调控外泌体释放的关键蛋白,所以可以通过开发rab27a抑制剂来抑制外泌体的释放。jennifer等人通过筛选发现,化合物nexinhib20可以抑制rab27a的活性。但是,该化合物有着较强的毒性,其在raw264.7细胞的ic50为1.5μm,这一缺点限制了它在临床上的应用。因此,通过对该化合物进行结构改造,使其毒性降低并且不改变活性十分重要。
4.而目前尚无将nexinhib20进行结构修饰从而降低其毒性,降低其使用风险的报道。
技术实现要素:
5.针对nexinhib20的结构以及现有技术情况,本发明提供了新型外泌体抑制剂nexinhib20衍生物、其制备方法及其应用。
6.鉴于nexinhib20的毒性主要与其官能团有关(其结构如下):
氯苯基,2-甲氧苯基,苯乙烯基,3-甲氧基-4-羟苯基,4-甲酯苯基,2-碘苯基,2-溴-4,5-二甲氧苯基,2-氯苯基,2-氟苯基,2-溴-5-甲氧苯基,2-呋喃基,2-羧氧苯基,或3,4-二甲氧苯基。
18.本发明中,作为实施方案之一,所述外泌体抑制剂选自:
19.[0020][0021]
本发明还提供了制备前述任一外泌体抑制剂的方法,所述方法包括:
[0022]
1)将频那酮和溴水溶于有机溶剂中、在0℃下反应;
[0023]
2)将三氮唑或四氮唑与1)所得产物于有机溶剂中室温下进行反应;
[0024]
3)将芳香醛与2)所得产物于有机溶剂中95℃下进行反应。
[0025]
本发明中,作为实施方案之一,所述步骤1)中的有机溶剂为甲醇。
[0026]
本发明中,作为实施方案之一,所述步骤2)中的有机溶剂为乙腈,催化剂为碳酸铯。
[0027]
本发明中,作为实施方案之一,所述步骤3)中的有机溶剂为甲苯,催化剂为哌啶和醋酸。
[0028]
本发明中,作为实施方案之一,所述步骤3)中的芳香醛选自苯甲醛,2-羟基苯甲醛,桂醛,2-氟苯甲醛,4-氯苯甲醛,2-甲氧基苯甲醛,2-碘苯甲醛,2-氯苯甲醛,2-氟苯甲醛,2-溴-5-甲氧基苯甲醛,6-溴藜芦醛,4-溴苯甲醛,香兰素,3-羟基苯甲醛,藜芦醛,糠醛或它们的类似物。
[0029]
本发明中,作为实施方案之一,所述方法进一步包括:
[0030]
1)在室温条件下,向溶有br2的甲醇溶液加入频那酮;使反应体系降到0℃,并保持此温度下反应6小时;反应结束后(tlc监测),蒸干甲醇并将粗品溶于二氯甲烷中;用去离子
水洗涤后干燥并抽滤,然后适当浓缩;纯化:
[0031]
2)在室温条件下,将溶有1)所得产物的乙腈溶液加入到含有三氮唑或四氮唑的乙腈溶液中,并加入碳酸铯;在室温,氮气条件下反应8小时;反应结束后(tlc监测),将乙腈蒸干并将剩余物溶解在二氯甲烷中;用去离子水洗涤后干燥,抽滤,浓缩;粗品纯化;
[0032]
3)在室温条件下,将2)所得产物加入到含有芳香醛的甲苯溶液中,并加入哌啶和醋酸;在95℃的条件下反应12个小时;反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中;用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩;粗品经纯化后得到外泌体抑制剂。
[0033]
本发明还提供了又一制备前述外泌体抑制剂的方法,所述方法包括:将前述方法步骤1)中的频那酮替换为具有类似结构的起始原料,包括环丙甲基酮,乙酰基环己烷,环戊基乙酮,或1-环庚基乙烷-1-酮。
[0034]
本发明还提供了前述任一外泌体抑制剂在制备治疗骨性关节炎、阿尔兹海默症、或者辅助治疗癌症的药物中的应用。
[0035]
本发明中,作为实施方案之一,所述药物为权利要求1-6任一所述外泌体抑制剂与药用辅料制备得到的药物制剂,包括注射剂、口服液体剂、片剂、胶囊剂、或颗粒剂。
[0036]
本发明中,作为实施方案之一,所述药物的给药途径包括肌肉、皮下、静脉注射、口服、或鼻腔给药。
[0037]
本发明提供了具有如下式(1)化合物的新的nexinhib20衍生物:
[0038][0039]
其中,r1为ch或n;
[0040]
a选自苯基,2-羟苯基,3-羟苯基,4-溴苯基,4-氯苯基,2-甲氧苯基,苯乙烯基,3-甲氧基-4-羟苯基,4-甲酯苯基,2-碘苯基,2-溴-4,5-二甲氧苯基,2-氯苯基,2-氟苯基,2-溴-5-甲氧苯基,2-呋喃基,2-羧氧苯基,3,4-二甲氧苯基。
[0041]
作为本发明实施方式之一,a还包括芳烷基和烷基芳烷基、芳香基、杂环取代基,所述芳烷基和烷基芳烷基的示例包括但不限于苄基、二苯甲基、甲苯基甲基、三苯甲基、肉桂基、苯乙基、苯乙烯基、苯基丁基新苯基;所述芳香基包括但不限于苯基、二苯基、甲苯基、甲苄基、4,2,6-三甲苯基、枯烯基、二(叔丁基)苯基、蒽基、茚基、萘基、卤代芳基、卤代芳烷基苯氧基、甲苯氧基、二甲苯基氧基、2,4,6-三甲苯氧基和枯烯氧基、二苯基、苯胺基、甲苯氨基、甲苯磺酰基、烯丙苄基或苯基、呋喃基、吡啶基、2-吡啶基(吡啶-2-基)、吲哚-1-基、氯甲基苄基或苯基、三氟甲基苄基或苯基、羟基苄基或苯基、甲氧基苄基或苯基、乙氧基苄基或苯基、甲氧基乙氧基苄基或苯基、烯丙氧基苄基或苯基、苯氧基苄基或苯基、乙酰氧基苄基或苯基、苯甲酰氧基苄基或苯基、甲硫基苄基或苯基、苯硫基苄基或苯基、甲苯硫基苄基或
苯基、甲基氨基苄基或苯基、二甲基氨基苄基或苯基、乙基氨基苄基或苯基、二乙基氨基苄基或苯基、乙酰氨基苄基或苯基、羧基苄基或苯基、甲氧羰基苄基或苯基、乙氧羰基苄基或苯基、苯氧基羰基苄基或苯基、氯代苯氧基羰基苄基或苯基、n-环己基氨基甲酰氧基苄基或苯基、烯丙氧基羰基苄基或苯基、氨甲酰基苄基或苯基、n-甲基氨甲酰基苄基或苯基、n,n-二丙基氨甲酰基苄基或苯基、n-苯氨基甲酰基苄基或苯基、硝基苄基或苯基、氰基苄基或苯基、硫代苄基或苯基、硫酸根-苄基或苯基、膦酰基苄基或苯基、磷酸根苄基或苯基、和吗啉代苄基或苯基等;所述杂环包括但不限于吡啶基、喹啉基、噻吩基、呋喃基、嗯唑基、四唑基、噻唑基、咪唑基、吡唑基或吲哚基。
[0042]
本发明还进一步提供了新的nexinhib20衍生物的制备方法,所述方法包括:
[0043]
1)将频那酮和溴水溶于有机溶剂中、在0℃下反应;
[0044]
2)将三氮唑与1)所得产物于有机溶剂中室温下进行反应。
[0045]
3)将芳香醛与2)所得产物于有机溶剂中95℃下进行反应。
[0046]
作为本发明实施方式之一所述步骤1)中的有机溶剂为甲醇。
[0047]
作为本发明实施方式之一所述步骤2)中的催化剂为碳酸铯。
[0048]
作为本发明实施方式之一所述步骤2)中的三氮唑也可以为四氮唑。
[0049]
作为本发明实施方式之一所述步骤3)中的有机溶剂为甲苯,催化剂为哌啶和醋酸。
[0050]
作为本发明实施方式之一,所述步骤3)中的芳香醛可以选自苯甲醛,2-羟基苯甲醛,桂醛,2-氟苯甲醛,4-氯苯甲醛,2-甲氧基苯甲醛,2-碘苯甲醛,2-氯苯甲醛,2-氟苯甲醛,2-溴-5-甲氧基苯甲醛,6-溴藜芦醛,4-溴苯甲醛,香兰素,3-羟基苯甲醛,藜芦醛,糠醛或它们的类似物。
[0051]
本发明方法中的芳香醛为本领域已知的小分子化合物,既可以通过市售的方式进行购买、也可以由本领域技术人员通过现有技术文献记载内容制备而成,所述芳香醛包括但不限于苯甲醛,2-羟基苯甲醛,桂醛,2-氟苯甲醛,4-氯苯甲醛,2-甲氧基苯甲醛,2-碘苯甲醛,2-氯苯甲醛,2-氟苯甲醛,2-溴-5-甲氧基苯甲醛,6-溴藜芦醛,4-溴苯甲醛,香兰素,3-羟基苯甲醛,藜芦醛,糠醛或它们的类似物。
[0052]
木发明方法中涉及各反应中间产物及目的产物根据下一步反应需进行分离纯化步骤,所述步骤均可以由本领域技术人员根据本领域常识及本发明记载采用常规的方法进行分离纯化、所述分离纯化方法包括但不限于本领域常用的过滤、相分离、结晶、吸附、色谱柱洗脱等各种常规的方法。
[0053]
本发明中本领域技术人员可以根据本领域常识,例如利用包括但不限于眼睛观察、tlc、hplc的方法来判断各反应过程的反应完全程度,本发明根据需要所采用的上述方法均可以由本领域技术人员结合常识来进行操作。
[0054]
作为本发明实施方式之一,如采用水杨醛来制备a含有取代基a为苯基的新型外泌体抑制剂时;
[0055]
其制备方法可以采用本领域常规的制备方法进行制备,作为实施方式之一,其制备方法包括:
[0056]
将在常温条件下,将步骤2)所得产物加入到含有水杨醛的甲苯溶液中;然后在氮气保护的条件下,使反应体系升温至95℃、反应结束后,降至室温,分离精制所得产物、即得
到相应的本发明所述的新型外泌体抑制剂。
[0057]
作为本发明实施方式之一,采用水杨醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0058][0059]
作为本发明实施方式之一,采用糠醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0060][0061]
作为本发明实施方式之一,采用苯甲醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0062][0063]
作为本发明实施方式之一,采用桂醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0064][0065]
作为本发明实施方式之一,采用2-氟苯甲醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0066][0067]
作为本发明实施方式之一,采用4-氯苯甲醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0068][0069]
作为本发明实施方式之一,采用2-甲氧基苯甲醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0070][0071]
作为本发明实施方式之一,采用2-碘苯甲醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0072][0073]
作为本发明实施方式之一,采用2-氯苯甲醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0074][0075]
作为本发明实施方式之一,采用2-溴-5-甲氧基苯甲醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0076][0077]
作为本发明实施方式之一,采用6-溴藜芦醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0078][0079]
作为本发明实施方式之一,采用4-溴苯甲醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0080][0081]
作为本发明实施方式之一,采用香兰素作为反应物,制备式(i)化合物时,所述合成路线如下:
[0082][0083]
作为本发明实施方式之一,采用3-羟基苯甲醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0084][0085]
作为本发明实施方式之一,采用藜芦醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0086][0087]
作为本发明实施方式之一,采用藜芦醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0088][0089]
作为本发明实施方式之一,采用苯甲醛作为反应物,制备式(i)化合物时,所述合成路线如下:
[0090][0091]
本发明上述以合成路线图显示的采用不同的中间体以制备本发明新型外泌体抑制剂的方法中,仅是以频那酮为起始原料的示范例,上述合成路线并不仅仅限于频那酮本身、其同样适用于其他的具有类似结构的起始原料,例如包括但不限于环丙甲基酮,乙酰基环己烷,环戊基乙酮以及1-环庚基乙烷-1-酮。
[0092]
在本发明的制药应用中,可以将本发明nexinhib20衍生物与适当药用辅料制备本领域常用的各种制剂包括但不限于注射剂、口服剂等,其给药途径包括但不限于肌肉、皮下、静脉注射、以及口服、鼻腔等给药。
[0093]
本发明所述新型外泌体抑制剂相较于原化合物nexinhib20能够在保持活性的同时显著降低毒性,临床使用风险更低。并且该系列化合物分子量较低,和其他外泌体抑制剂相比,相同剂量下有效成分更多。
附图说明
[0094]
图1:为实施例1中的a-1的lc-ms图谱;
[0095]
图2:为实施例1中的a-1的h-nmr图谱;
[0096]
图3:为实施例2中的a-2的lc-ms图谱;
[0097]
图4:为实施例2中的a-2的h-nmr图谱;
[0098]
图5:为实施例3中的a-3的lc-ms图谱;
[0099]
图6:为实施例3中的a-3的h-nmr图谱;
[0100]
图7:为实施例4中的a-4的lc-ms图谱;
[0101]
图8:为实施例4中的a-4的h-nmr图谱;
[0102]
图9:为实施例5中的a-5的lc-ms图谱;
[0103]
图10:为实施例5中的a-5的h-nmr图谱;
[0104]
图11:为实施例6中的a-6的lc-ms图谱;
[0105]
图12:为实施例6中的a-6的h-nmr图谱;
[0106]
图13:为实施例7中的a-7的lc-ms图谱;
[0107]
图14:为实施例7中的a-7的h-nmr图谱;
[0108]
图15:为实施例8中的a-8的lc-ms图谱;
[0109]
图16:为实施例8中的a-8的h-nmr图谱;
[0110]
图17:为实施例9中的a-9的lc-ms图谱;
[0111]
图18:为实施例9中的a-9的h-nmr图谱;
[0112]
图19:为实施例10中的a-10的lc-ms图谱;
[0113]
图20:为实施例10中的a-10的h-nmr图谱;
[0114]
图21:为实施例11中的a-11的lc-ms图谱;
[0115]
图22:为实施例11中的a-11的h-nmr图谱;
[0116]
图23:为实施例12中的a-12的lc-ms图谱;
[0117]
图24:为实施例12中的a-12的h-nmr图谱;
[0118]
图25:为实施例13中的a-13的lc-ms图谱;
[0119]
图26:为实施例13中的a-13的h-nmr图谱;
[0120]
图27:为实施例14中的a-14的lc-ms图谱;
[0121]
图28:为实施例14中的a-14的h-nmr图谱;
[0122]
图29:为实施例15中的a-15的lc-ms图谱;
[0123]
图30:为实施例15中的a-15的h-nmr图谱;
[0124]
图31:为实施例16中的b-1的lc-ms图谱;
[0125]
图32:为实施例16中的b-1的h-nmr图谱;
[0126]
图33:为实施例17中的b-2的lc-ms图谱;
[0127]
图34:为实施例17中的b-2的h-nmr图谱;
[0128]
图35:为实验例1中的nexinhib20对raw264.7细胞的ic50;
[0129]
图36:为实验例2中的a-1、a-2以及b-1对raw264.7细胞的ic50;
[0130]
图37:为实验例3中的nexinhib20体外抑制raw264.7细胞的外泌体释放效果;
[0131]
图38:为实验例4中的a-1体外抑制raw264.7细胞的外泌体释放效果;
[0132]
图39:为实验例5中的a-2体外抑制raw264.7细胞的外泌体释放效果;
[0133]
图40:为实验例6中的b-1体外抑制raw264.7细胞的外泌体释放效果;
[0134]
图41:为实验例7中的a-1体外抑制破骨细胞的外泌体释放效果;
[0135]
图42为实验例8中的nexinhib20和a-1体内破骨细胞外泌体释放结果。
具体实施方式
[0136]
本发明通过以下实施例或实验例进一步说明本发明,但本发明并不受限于此。
[0137]
实施例1化合物(a-1)的制备
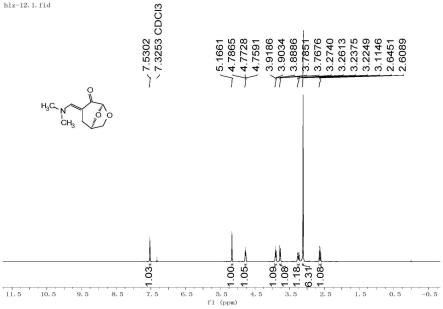
[0138][0139]
实验操作:
[0140]
化合物2的合成:
[0141]
在室温条件下,向溶有br2(1.79g,11.2mmol)的甲醇溶液加入频那酮(1.54g,13.4mmol)。使反应体系降到0℃,并保持此温度下反应6小时。反应结束后(tlc监测),蒸干甲醇并将粗品溶于二氯甲烷中。用去离子水洗涤后干燥并抽滤,然后适当浓缩。经纯化后得到2。
[0142]
1h nmr(400mhz,cdcl3)δ=4.17(s,2h),1.22(s,9h).
[0143]
化合物3的合成:
[0144]
在室温条件下,将溶有2(1g,5.59mmol)的乙腈溶液加入到含有三氮唑(0.5g,7.24mmol)的乙腈溶液中,并加入碳酸铯。在室温,氮气条件下反应8小时。反应结束后(tlc监测),将乙腈蒸干并将剩余物溶解在二氯甲烷中。用去离子水洗涤后干燥,抽滤,浓缩。粗品经纯化后得到3。
[0145]
1h nmr(400mhz,cdcl3)δ=8.16(s,1h),7.95(s,1h),5.19(s,2h),1.27(s,9h).
[0146]
化合物a-1的合成:
[0147]
在室温条件下,将3(30mg,0.18mmol)加入到含有2-羟基苯甲醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-1。
[0148]
lc-ms(esi):rt 5.1;[m h] :272;[m na] :294
[0149]
1h nmr(400mhz,cdcl3)δ=8.92(s,1h),8.04(s,1h),7.29-7.19(m,1h),7.11(dd,j=7.5,1.5hz,1h),7.00(s,1h),6.97-6.85(m,2h),0.84(s,10h).
[0150]
实施例1中相关原料或产物的图参见图1,2。
[0151]
实施例2化合物(a-2)的制备
[0152][0153]
实验操作:
[0154]
化合物2,3的合成方法同实施例1。
[0155]
化合物a-2的合成:
[0156]
在室温条件下,将3(30mg,0.18mmol)加入到含有糠醛(21mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-2。
[0157]
lc-ms(esi):rt 4.77;[m h] :246;[m na] :268
[0158]
1h nmr(400mhz,cdcl3)δ=8.20(s,2h),7.63(s,1h),7.42(d,j=1.4hz,1h),6.41(dd,j=3.5,1.7hz,1h),6.07(d,j=3.6hz,1h),1.20(s,9h).
[0159]
实施例2中相关原料或产物的图参见图3,4。
[0160]
实施例3化合物(a-3)的制备
[0161][0162]
实验操作:
[0163]
化合物2,3的合成方法同实施例1。
[0164]
化合物a-3的合成:
[0165]
在室温条件下,将3(30mg,0.18mmol)加入到含有苯甲醛(23mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-3。
[0166]
lc-ms(esi):rt 5.47;[m h] :256;[m na] :288
[0167]
1h nmr(400mhz,cdcl3)δ=8.16(s,1h),7.98(s,1h),7.59(s,1h),7.36-7.28(m,1h),7.25(ddd,j=8.2,2.5,1.2hz,2h),6.83-6.75(m,2h),1.22(s,9h).
[0168]
实施例3中相关原料或产物的图参见图5,6。
[0169]
实施例4化合物(a-4)的制备
[0170][0171]
实验操作:
[0172]
化合物2,3的合成方法同实施例1。
[0173]
化合物a-4的合成:
[0174]
在室温条件下,将3(30mg,0.18mmol)加入到含有桂醛(29mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-4。
[0175]
lc-ms(esi):rt 5.48;[m h] :282;[m na] :304
[0176]
1h nmr(400mhz,cdcl3)δ=8.17(s,1h),8.10(s,1h),7.41(dd,j=11.2,0.8hz,1h),7.33-7.24(m,6h),7.04(dd,j=15.5,0.7hz,1h),6.41(dd,j=15.5,11.2hz,1h),1.19(s,9h).
[0177]
实施例4中相关原料或产物的图参见图7,8。
[0178]
实施例5化合物(a-5)的制备
[0179][0180]
实验操作:
[0181]
化合物2,3的合成方法同实施例1。
[0182]
化合物a-5的合成:
[0183]
在室温条件下,将3(30mg,0.18mmol)加入到含有2-氟苯甲醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-5。
[0184]
lc-ms(esi):rt 5.50;[m h] :274;[m na] :296
[0185]
1h nmr(400mhz,cdcl3)δ=8.39(s,1h),8.09(s,1h),7.36(ddd,j=8.3,4.7,2.0hz,1h),7.34-7.28(m,1h),7.24(s,1h),7.11(dd,j=12.8,4.7hz,2h),1.00(s,9h).
[0186]
实施例5中相关原料或产物的图参见图9,10。
[0187]
实施例6化合物(a-6)的制备
[0188][0189]
实验操作:
[0190]
化合物2,3的合成方法同实施例1。
[0191]
化合物a-6的合成:
[0192]
在室温条件下,将3(30mg,0.18mmol)加入到含有4-氯苯甲醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-6。
[0193]
lc-ms(esi):rt 6.09;[m h] :290;[m na] :312
[0194]
1h nmr(400mhz,cdcl3)δ8.35(s,1h),8.09(s,1h),7.36-7.32(m,2h),7.29(s,2h),7.15(s,1h),1.01(s,9h).
[0195]
实施例6中相关原料或产物的图参见图11,12。
[0196]
实施例7化合物(a-7)的制备
[0197][0198]
实验操作:
[0199]
化合物2,3的合成方法同实施例1。
[0200]
化合物a-7的合成:
[0201]
在室温条件下,将3(30mg,0.18mmol)加入到含有2-甲氧基苯甲醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-7。
[0202]
lc-ms(esi):rt 5.59;[m h] :286;[m na] :308
[0203]
1h nmr(400mhz,cdcl3)δ8.37(s,1h),8.02(s,1h),7.32-7.23(m,2h),7.15(ddd,j=7.8,1.8,0.8hz,1h),6.89-6.80(m,2h),3.82(s,3h),0.93(s,9h).
[0204]
实施例7中相关原料或产物的图参见图13,14。
[0205]
实施例8化合物(a-8)的制备
[0206][0207]
实验操作:
[0208]
化合物2,3的合成方法同实施例1。
[0209]
化合物a-8的合成:
[0210]
在室温条件下,将3(30mg,0.18mmol)加入到含有2-碘苯甲醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-8。
[0211]
lc-ms(esi):rt 6.14;[m h] :382;[m na] :404
[0212]
1h nmr(400mhz,cdcl3)δ8.39(d,j=0.9hz,1h),8.08(d,j=1.0hz,1h),7.90(d,j=7.9hz,1h),7.33(d,j=3.8hz,2h),7.14(s,1h),7.05(ddd,j=8.0,4.9,3.2hz,1h),0.92(d,j=1.4hz,9h).
[0213]
实施例8中相关原料或产物的图参见图15,16。
[0214]
实施例9化合物(a-9)的制备
[0215][0216]
实验操作:
[0217]
化合物2,3的合成方法同实施例1。
[0218]
化合物a-9的合成:
[0219]
在室温条件下,将3(30mg,0.18mmol)加入到含有2-氯苯甲醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-9。
[0220]
lc-ms(esi):rt 5.90;[m h] :290;[m na] :312
[0221]
1h nmr(400mhz,cdcl3)δ8.84(s,1h),7.99(s,1h),7.25-7.19(m,1h),7.14-7.05(m,1h),6.98(s,1h),6.95-6.85(m,2h),0.84(s,9h).
[0222]
实施例9中相关原料或产物的图参见图17,18。
[0223]
实施例10化合物(a-10)的制备
[0224][0225]
实验操作:
[0226]
化合物2,3的合成方法同实施例1。
[0227]
化合物a-10的合成:
[0228]
在室温条件下,将3(30mg,0.18mmol)加入到含有2-溴-5-甲氧基苯甲醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-10。
[0229]
lc-ms(esi):rt 6.01;[m h] :365;[m na] :387
[0230]
1h nmr(400mhz,cdcl3)δ8.32(s,1h),8.02(s,1h),7.42(d,j=8.8hz,1h),7.16(s,1h),6.83(d,j=3.1hz,1h),6.72(dd,j=8.8,3.1hz,1h),3.70(s,3h),0.90(s,9h).
[0231]
实施例10中相关原料或产物的图参见图19,20。
[0232]
实施例11化合物(a-11)的制备
[0233][0234]
实验操作:
[0235]
化合物2,3的合成方法同实施例1。
[0236]
化合物a-11的合成:
[0237]
在室温条件下,将3(30mg,0.18mmol)加入到含有6-溴藜芦醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-11。
[0238]
lc-ms(esi):rt 5.65;[m h] :395;[m na] :317
[0239]
1h nmr(400mhz,cdcl3)δ8.37(s,1h),8.07(s,1h),7.19(s,1h),7.08(s,1h),6.88(s,1h),3.89(s,3h),3.83(s,3h),0.97(s,9h).
[0240]
实施例11中相关原料或产物的图参见图21,22。
[0241]
实施例12化合物(a-12)的制备
[0242][0243]
实验操作:
[0244]
化合物2,3的合成方法同实施例1。
[0245]
化合物a-12的合成:
[0246]
在室温条件下,将3(30mg,0.18mmol)加入到含有4-溴苯甲醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-12。
[0247]
lc-ms(esi):rt 5.56;[m h] :335;[m na] :357
[0248]
1h nmr(400mhz,cdcl3)δ8.20(s,1h),8.08(s,1h),7.54(s,1h),7.40(d,j=8.5hz,2h),6.67(d,j=8.5hz,2h),1.23(s,9h).
[0249]
实施例12中相关原料或产物的图参见图23,24。
[0250]
实施例13化合物(a-13)的制备
[0251][0252]
实验操作:
[0253]
化合物2,3的合成方法同实施例1。
[0254]
化合物a-13的合成:
[0255]
在室温条件下,将3(30mg,0.18mmol)加入到含有香兰素(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-13。
[0256]
lc-ms(esi):rt 4.35;[m h] :300;[m na] :322
[0257]
1h nmr(400mhz,cdcl3)δ8.37(s,1h),8.15(s,1h),7.81(d,j=8.2hz,2h),7.73(s,1h),6.91(d,j=8.2hz,2h),1.18(s,9h).
[0258]
实施例13中相关原料或产物的图参见图25,26。
[0259]
实施例14化合物(a-14)的制备
[0260][0261]
实验操作:
[0262]
化合物2,3的合成方法同实施例1。
[0263]
化合物a-14的合成:
[0264]
在室温条件下,将3(30mg,0.18mmol)加入到含有3-羟基苯甲醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-14。
[0265]
lc-ms(esi):rt 4.34;[m h] :272;[m na] :294
[0266]
1h nmr(400mhz,methanol-d4)δ8.32(s,1h),8.14(s,1h),7.62(s,1h),7.00(t,j=7.9hz,1h),6.69(ddd,j=8.2,2.5,0.9hz,1h),6.30(ddt,j=7.6,1.5,0.8hz,1h),6.19(t,j=2.1hz,1h),1.16(s,9h).
[0267]
实施例14中相关原料或产物的图参见图27,28。
[0268]
实施例15化合物(a-15)的制备
[0269][0270]
实验操作:
[0271]
化合物2,3的合成方法同实施例1。
[0272]
化合物a-15的合成:
[0273]
在室温条件下,将3(30mg,0.18mmol)加入到含有藜芦醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到a-15。
[0274]
lc-ms(esi):rt 4.70;[m h] :316;[m na] :338
[0275]
1h nmr(400mhz,cdcl3)δ8.22(s,1h),8.09(s,1h),7.68(s,1h),6.77(d,j=8.4hz,1h),6.66(dd,j=8.4,2.0hz,1h),5.93(d,j=2.0hz,1h),3.86(s,3h),3.61(s,3h),1.23(s,9h).
[0276]
实施例15中相关原料或产物的图参见图29,30。
[0277]
实施例16化合物(b-1)的制备
[0278][0279]
实验操作:
[0280]
化合物2的合成方法同实施例1。
[0281]
化合物4的合成:
[0282]
在室温条件下,将溶有2(1g,5.59mmol)的乙腈溶液加入到含有四氮唑(0.5g,7.24mmol)的乙腈溶液中,并加入碳酸铯。在室温,氮气条件下反应8小时。反应结束后(tlc监测),将乙腈蒸干并将剩余物溶解在二氯甲烷中。用去离子水洗涤后干燥,抽滤,浓缩。粗品经纯化后得到4。
[0283]
1h nmr(400mhz,cdcl3)δ=8.693(s,1h),5.439(s,1h),1.22(s,9h).
[0284]
化合物b-1的合成:
[0285]
在室温条件下,将4(30mg,0.18mmol)加入到含有水杨醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到b-1。
[0286]
lc-ms(esi):rt 5.35;[m h] :273;[m na] :295
[0287]
1h nmr(400mhz,meod)δ9.24(s,1h),7.24-7.13(m,2h),7.11(s,1h),6.85(ddd,j=8.2,7.2,3.4hz,2h),0.71(s,9h).
[0288]
实施例16中相关原料或产物的图参见图31,32。
[0289]
实施例17化合物(b-2)的制备
[0290][0291]
实验操作:
[0292]
化合物2的合成方法同实施例1。
[0293]
化合物4的合成方法同实施例16。
[0294]
化合物b-2的合成:
[0295]
在室温条件下,将4(30mg,0.18mmol)加入到含有苯甲醛(27mg,0.22mmol)的甲苯溶液中,并加入哌啶和醋酸。在95℃的条件下反应12个小时。反应结束后(tlc监测),将甲苯蒸干并将剩余物溶解在二氯甲烷中。用盐酸,去离子水依次洗涤后干燥,抽滤,浓缩。粗品经纯化后得到b-2。
[0296]
lc-ms(esi):rt 5.26;[m h] :257;[m na] :288
[0297]
1h nmr(400mhz,cdcl3)δ8.55(s,1h),7.84(s,1h),7.39-7.32(m,1h),7.29-7.22(m,2h),6.75(dd,j=5.1,3.9hz,2h),1.34(s,9h).
[0298]
实施例17中相关原料或产物的图参见图33,34。
[0299]
实验例1化合物nexinhib20体外细胞毒性研究
[0300]
1.实验材料:
[0301]
药物:
[0302]
nexinhib20、来源:市购。
[0303]
细胞培养基(dmem)购买于thermo,胎牛血清购买于hyclone。
[0304]
mtt用于检测细胞活性,购自sigma。
[0305]
实验所用的细胞(raw264.7)于上海细胞库购买。
[0306]
2.实验方法
[0307]
1)细胞培养:
[0308]
raw264.7的培养基为dmem,向dmem培养基中添加胎牛血清和双抗,配成最终含量为10%和1%的完全培养基。将细胞置于温度为37℃、co2浓度为5%的孵育箱中培养。定期观察细胞生长情况并进行计数,所有实验都取对数生长期细胞进行。
[0309]
2)细胞毒性考察:
[0310]
raw264.7细胞以较低密度,(8
×
103,具体数据取决于细胞系,培养条件参照上海细胞库,)均匀铺于96孔板,在培养箱中过夜使之贴壁,倒掉旧培基,更换含药无血清培基。nexinhib20溶于dmso配成浓度为100mm的储备液现配现用。以dmso组作为空白对照,nexinhib20的给药终浓度梯度为:0.25、0.5、1、2、4、8、16μm。在温度为37℃、co2浓度为5%的孵育箱培育24h。用mtt检测细胞活性。平行操作3次。
[0311]
3.实验结果:
[0312]
和空白对照相比,在1μm-16μm的浓度范围内,nexinhib20对raw264.7细胞有明显毒性,通过计算,其ic50为1.5μm。具体参见表1和图35。
[0313]
表1
[0314][0315][0316]
实验例2化合物a-1,a-2以及b-1体外细胞毒性研究
[0317]
1.实验材料:
[0318]
药物:
[0319]
a-1、来源:采用实施例1制备的化合物(a-1);a-2、来源:采用实施例2制备的化合物(a-2);b-1、来源:采用实施例16制备的化合物(b-1)。
[0320]
细胞培养基(dmem)购买于thermo,胎牛血清购买于hyclone。
[0321]
mtt用于检测细胞活性,购自sigma。
[0322]
实验所用的细胞(raw264.7)于上海细胞库购买。
[0323]
2.实验方法
[0324]
3)细胞培养:
[0325]
raw264.7的培养基为dmem,向dmem培养基中添加胎牛血清和双抗,配成最终含量为10%和1%的完全培养基。将细胞置于温度为37℃、co2浓度为5%的孵育箱中培养。定期观察细胞生长情况并进行计数,所有实验都取对数生长期细胞进行。
[0326]
4)细胞毒性考察:
[0327]
raw264.7细胞以较低密度,(8
×
103,具体数据取决于细胞系,培养条件参照上海
细胞库,)均匀铺于96孔板,在培养箱中过夜使之贴壁,倒掉旧培基,更换含药无血清培基。a-1,a-2以及b-1分别溶于dmso配成浓度为100mm的储备液现配现用。以dmso组作为空白对照,a-1,a-2,b-1的给药终浓度梯度为:1、20、100、500μm。在温度为37℃、co2浓度为5%的孵育箱培育24h。用mtt检测细胞活性。平行操作3次。
[0328]
3.实验结果:
[0329]
和空白对照相比,在1μm-500μm的浓度范围内,a-1对raw264.7细胞无明显毒性,a-2在100μm-500μm的浓度范围内有明显的细胞毒性,b-1在500μm的浓度下有明显的细胞毒性。具体参见表2和图36。
[0330]
表2
[0331][0332]
实验例3化合物nexinhib20体外抑制细胞外泌体释放
[0333]
1.实验材料:
[0334]
药物:
[0335]
gw4869(阳性对照药),来源:市购;
[0336]
nexinhib20,来源:市购。
[0337]
细胞培养基(dmem)购买于thermo,胎牛血清购买于hyclone,无外泌体的胎牛血清购买于sbi。
[0338]
exoquick-tc用于提取外泌体,购自sbi,fluorocet exosome quantitation kit用于外泌体定量,购自sbi。
[0339]
实验所用的细胞(raw264.7)于上海细胞库购买。
[0340]
2.实验方法
[0341]
1)细胞培养:
[0342]
raw264.7的培养基为dmem,向dmem培养基中添加胎牛血清和双抗,配成最终含量为10%和1%的完全培养基。将细胞置于温度为37℃、co2浓度为5%的孵育箱中培养。定期观察细胞生长情况并进行计数,所有实验都取对数生长期细胞进行。
[0343]
2)抑制外泌体释放活性考察:
[0344]
raw264.7细胞以适当密度,(1.5*105)均匀铺于6孔板,在培养箱中过夜使之贴壁,倒掉旧培基,更换含药无外泌体血清培基。a-1溶于dmso溶液配成浓度为100mm的储备液,现配现用。以dmso组作为空白对照,以gw4869作为阳性对照,给药浓度为20μm;nexinhib20给药终浓度为20μm。在温度为37℃、co2浓度为5%的孵育箱培育24h。用exoquick-tc提取培养基中的外泌体,用fluorocet exosome quantitation kit检测外泌体含量。每组平行操作4
次。
[0345]
3.实验结果:
[0346]
和空白对照相比,在20μm的浓度下,nexinhib20可以略微抑制hhraw264.7细胞的外泌体释放,具体参见表3和图37。
[0347]
表3
[0348][0349]
实验例4化合物a-1体外抑制细胞外泌体释放
[0350]
4.实验材料:
[0351]
药物:
[0352]
gw4869(阳性对照药),来源:市购;
[0353]
a-1、来源:采用实施例1制备的化合物(a-1)。
[0354]
细胞培养基(dmem)购买于thermo,胎牛血清购买于hyclone,无外泌体的胎牛血清购买于sbi。
[0355]
exoquick-tc用于提取外泌体,购自sbi,fluorocet exosome quantitation kit用于外泌体定量,购自sbi。
[0356]
实验所用的细胞(raw264.7)于上海细胞库购买。
[0357]
5.实验方法
[0358]
3)细胞培养:
[0359]
raw264.7的培养基为dmem,向dmem培养基中添加胎牛血清和双抗,配成最终含量为10%和1%的完全培养基。将细胞置于温度为37℃、co2浓度为5%的孵育箱中培养。定期观察细胞生长情况并进行计数,所有实验都取对数生长期细胞进行。
[0360]
4)抑制外泌体释放活性考察:
[0361]
raw264.7细胞以适当密度,(1.5*105)均匀铺于6孔板,在培养箱中过夜使之贴壁,倒掉旧培基,更换含药无外泌体血清培基。a-1溶于dmso溶液配成浓度为100mm的储备液,现配现用。以dmso组作为空白对照,以gw4869作为阳性对照,给药浓度为20μm;a-1给药终浓度为20μm。在温度为37℃、co2浓度为5%的孵育箱培育24h。用exoquick-tc提取培养基中的外泌体,用fluorocet exosome quantitation kit检测外泌体含量。每组平行操作4次。
[0362]
6.实验结果:
[0363]
和空白对照相比,在20μm的浓度下,a-1能显著抑制raw264.7细胞的外泌体释放,具体参见表4和图38。
[0364]
表4
[0365][0366]
实验例5化合物a-2体外抑制细胞外泌体释放
[0367]
1.实验材料:
[0368]
药物:
[0369]
gw4869(阳性对照药),来源:市购;
[0370]
a-2、来源:采用实施例2制备的化合物(a-2)。
[0371]
细胞培养基(dmem)购买于thermo,胎牛血清购买于hyclone,无外泌体的胎牛血清购买于sbi。
[0372]
exoquick-tc用于提取外泌体,购自sbi,fluorocet exosome quantitation kit用于外泌体定量,购自sbi。
[0373]
实验所用的细胞(raw264.7)于上海细胞库购买。
[0374]
2.实验方法
[0375]
1)细胞培养:
[0376]
raw264.7的培养基为dmem,向dmem培养基中添加胎牛血清和双抗,配成最终含量为10%和1%的完全培养基。将细胞置于温度为37℃、co2浓度为5%的孵育箱中培养。
[0377]
2)抑制外泌体释放活性考察:
[0378]
raw264.7细胞以适当密度,(1.5*105)均匀铺于6孔板,在培养箱中过夜使之贴壁,倒掉旧培基,更换含药无外泌体血清培基。a-2溶于dmso溶液配成浓度为100mm的储备液,现配现用。以dmso组作为空白对照,以gw4869作为阳性对照,给药浓度为20μm;a-2给药终浓度为20μm。在温度为37℃、co2浓度为5%的孵育箱培育24h。用exoquick-tc提取培养基中的外泌体,用fluorocet exosome quantitation kit检测外泌体含量。每组平行操作4次。
[0379]
3.实验结果:
[0380]
和空白对照相比,在20μm的浓度下,a-2能显著抑制raw264.7细胞的外泌体释放,具体参见表5和图39。
[0381]
表5
[0382][0383]
实验例6化合物b-1体外抑制细胞外泌体释放
[0384]
1.实验材料:
[0385]
药物:
[0386]
gw4869(阳性对照药),来源:市购;
[0387]
b-1、来源:采用实施例16制备的化合物(b-1)。
[0388]
细胞培养基(dmem)购买于thermo,胎牛血清购买于hyclone,无外泌体的胎牛血清购买于sbi。
[0389]
exoquick-tc用于提取外泌体,购自sbi,fluorocet exosome quantitation kit用于外泌体定量,购自sbi。
[0390]
实验所用的细胞(raw264.7)于上海细胞库购买。
[0391]
2.实验方法
[0392]
1)细胞培养:
[0393]
raw264.7的培养基为dmem,向dmem培养基中添加胎牛血清和双抗,配成最终含量为10%和1%的完全培养基。将细胞置于温度为37℃、co2浓度为5%的孵育箱中培养。
[0394]
2)抑制外泌体释放活性考察:
[0395]
raw264.7细胞以适当密度,(1.5*105)均匀铺于6孔板,在培养箱中过夜使之贴壁,倒掉旧培基,更换含药无外泌体血清培基。b-1溶于dmso溶液配成浓度为100mm的储备液,现配现用。以dmso组作为空白对照,以gw4869作为阳性对照,给药浓度为20μm;b-1给药终浓度为20μm。在温度为37℃、co2浓度为5%的孵育箱培育24h。用exoquick-tc提取培养基中的外泌体,用fluorocet exosome quantitation kit检测外泌体含量。每组平行操作4次。
[0396]
3.实验结果:
[0397]
和空白对照相比,在20μm的浓度下,b-1能显著抑制raw264.7细胞的外泌体释放,具体参见表6和图40。
[0398]
表6
[0399][0400]
实验例7化合物a-1体外抑制破骨细胞外泌体释放
[0401]
1.实验材料:
[0402]
药物:
[0403]
gw4869(阳性对照药),来源:市购;
[0404]
a-1、来源:采用实施例1制备的化合物(a-1)。
[0405]
细胞培养基(dmem)购买于thermo,胎牛血清购买于hyclone,无外泌体的胎牛血清购买于sbi,rankl购买于r&d systems。
[0406]
exoquick-tc用于提取外泌体,购自sbi,fluorocet exosome quantitation kit用于外泌体定量,购自sbi。
[0407]
实验所用的细胞(raw264.7)于上海细胞库购买。
[0408]
2.实验方法
[0409]
1)细胞培养:
[0410]
raw264.7的培养基为dmem,向dmem培养基中添加胎牛血清和双抗,配成最终含量为10%和1%的完全培养基。将细胞置于温度为37℃、co2浓度为5%的孵育箱中培养。定期观察细胞生长情况并进行计数,所有实验都取对数生长期细胞进行。
[0411]
2)抑制外泌体释放活性考察:
[0412]
raw264.7细胞以适当密度,(1.5*105)均匀铺于6孔板,在培养箱中过夜使之贴壁,倒掉旧培基,加入含有30ng/ul的rankl的培养基诱导,48h后再次加入含有30ng/ul的rankl的培养基,再次培养48h后,即得到破骨细胞。更换含药无外泌体血清培基。a-1溶于dmso溶液配成浓度为100mm的储备液,现配现用。以dmso组作为空白对照,以gw4869作为阳性对照,给药浓度为20μm;a-1给药终浓度为20μm。在温度为37℃、co2浓度为5%的孵育箱培育24h。用exoquick-tc提取培养基中的外泌体,用fluorocet exosome quantitation kit检测外泌体含量。每组平行操作4次。
[0413]
3.实验结果:
[0414]
和空白对照相比,在20μm的浓度下,a-1能显著抑制破骨细胞的外泌体释放,具体参见表7和图41。
[0415]
表7
[0416][0417]
实验例8化合物nexinhib20和a-1体内破骨细胞外泌体释放
[0418]
1.实验材料:
[0419]
药物:
[0420]
nexinhib20,来源:市购。
[0421]
a-1、来源:采用实施例1制备的化合物(a-1)。
[0422]
exoquick-tc用于提取外泌体,购自sbi,fluorocet exosome quantitation kit用于外泌体定量,购自sbi。
[0423]
无水乙醇,生理盐水等。
[0424]
实验动物:8周龄雄性c57bl/6小鼠。
[0425]
2.实验方法
[0426]
3)实验动物分组及给药:
[0427]
受试药物配置:称取nexinhib20和a-1,分别溶于50∶50乙醇/生理盐水溶液中,各配置成浓度为22mg/ml的药物溶液,置于4℃冰箱备用。
[0428]
实验分组及处理:取18只小鼠,随机分为a,b,c组。其中a组腹腔注射乙醇/生理盐水溶液;b组按22.0mg/kg剂量腹腔注射nexinhib20的乙醇/生理盐水溶液;c组组按22.0mg/kg剂量腹腔注射a-1的乙醇/生理盐水溶液。于24h时,对每组老鼠采用腹腔注射戊巴比妥钠麻醉,采用心脏穿刺取血。血样于4℃以3000rpm离心20min,取血清备用。
[0429]
4)检测血清中外泌体含量:
[0430]
用exoquick-tc提取血清中的外泌体,用fluorocet exosome quantitation kit检测外泌体含量。
[0431]
5)统计学分析:
[0432]
实验数据采用平均值
±
标准差(sd)表示,数据处理采用graphpad prism 6.0统计
软件。差异显著性检验采用t检验和方差分析法进行。
[0433]
4.实验结果:
[0434]
和a组相比,在22.0mg/kg的剂量下,c组小鼠血清当中的外泌体浓度显著降低,b组小鼠血清当中的外泌体浓度并无显著降低。具体参见图42和表8。
[0435]
表8
[0436]
检查项目a组(n=6)b组(n=6)c组(n=6)外泌体丰度(*107)18.465 3.15416.148
±
1.23811.758
±
4.458
[0437]
实验例9化合物nexinhib20和a-1体内毒性考察
[0438]
1.实验材料:
[0439]
药物:
[0440]
nexinhib20,来源:市购。
[0441]
a-1、来源:采用实施例1制备的化合物(a-1)。
[0442]
无水乙醇,生理盐水等。
[0443]
实验动物:8周龄雄性c57bl/6小鼠。
[0444]
2.实验方法
[0445]
6)实验动物分组及给药:
[0446]
受试药物配置:称取nexinhib20和a-1,分别溶于50∶50乙醇/生理盐水溶液中,各配置成浓度为22mg/ml的药物溶液,置于4℃冰箱备用。
[0447]
实验分组及处理:取18只小鼠,随机分为a,b,c组。其中a组腹腔注射乙醇/生理盐水溶液;b组按50.0mg/kg剂量腹腔注射nexinhib20的乙醇/生理盐水溶液;c组组按50.0mg/kg剂量腹腔注射a-1的乙醇/生理盐水溶液。实验期间自由饮水,密切观察小鼠整个给药期间的一般状况,包括活动状态、毛色、摄食、饮水及大、小便等。给药一周后,眼球采血,用生理盐水稀释一倍放于1ml抗凝ep管中,立即送检,测定血液常规。
[0448]
7)统计学分析:
[0449]
实验数据采用平均值
±
标准差(sd)表示,数据处理采用graphpad prism 6.0统计软件。差异显著性检验采用t检验和方差分析法进行。
[0450]
5.实验结果:
[0451]
结果可见,给药1周后,b组小鼠血液中lym(淋巴细胞计数)、mid(中间细胞计数)较a组有降低的趋势,而wbc(白细胞计数)、rbc(红细胞计数)、hgb(血红蛋白浓度)无明显下降趋势。c组的血液相关指标无明显下降。具体参见表9。
[0452]
表9
[0453][0454]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。