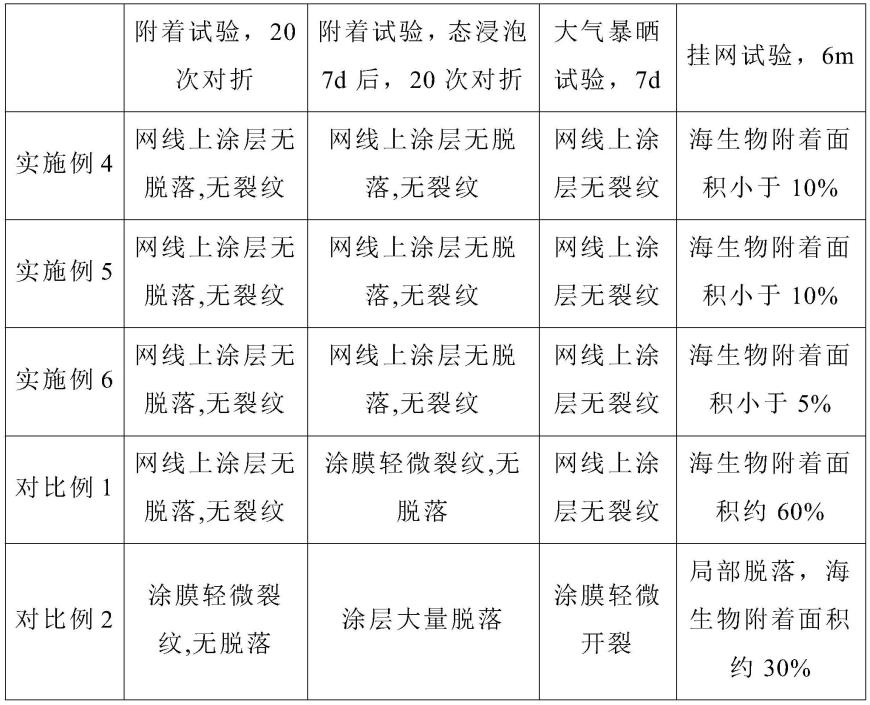
1.本发明涉及生物技术领域,具体地,本发明涉及一种单细胞转录组测序的方法。
背景技术:
2.单细胞转录组测序技术是在单细胞水平对转录组进行扩增与测序的一项新技术。其原理是将分离的单个细胞的微量转录组rna进行扩增后进行高通量测序。目前市场上被广泛使用的单细胞转录组测序方法为ht kit和10xgenomics单细胞转录组测序平台。采用ht kit可以从单个细胞中获得全长的cdna,并进行下游的扩增,建库测序,但是通量很小,价格昂贵。而10xgenomics单细胞转录组测序平台一次可以对上万个细胞进行单细胞转录组测序,但是这种方法的原理使得只能获得转录组3'端信息。而且上述两种方法都只能针对新鲜的活的单细胞进行单细胞转录组测序。
3.在研究过程中,常常会碰到目标细胞在整个单细胞悬液中的比列很低的情况,需要花费较长时间进行筛选,在这个过程中会导致单细胞的活性减弱,转录本发生变化,如果能够在筛选前将细胞进行固定,使得转录本不再发生改变,将留给实验者更多的时间进行细胞筛选,同时获得更准确的单细胞转录本信息。
4.目前已发表的研究成果例如elliot r thomsen等人,nat methods.2016;13(1):87-93和johannes w bagnoli等人,nat commun.2018;9(1):2937表明固定的单细胞样本也可以进行单细胞转录组文库的构建,并进行后续的建库测序。但是在elliot r thomsen等人,nat methods.2016;13(1):87-93中提到的针对固定单细胞样本进行转录组扩增的过程中需要对释放出mrna进行纯化,而在johannes w bagnoli等人,nat commun.2018;9(1):2937中提到的针对固定单细胞样本进行转录组扩增的过程中需要对逆转录产物进行纯化,针对微量的mrna和cdna的纯化会造成低丰度转录本信息的丢失。
5.因此,本领域迫切需要开发一种新的单细胞转录组测序方法。
技术实现要素:
6.本发明的目的就是提供了一种单细胞转录组扩增、建库和测序的方法。
7.本发明的第一方面,提供了一种单细胞转录组测序方法,所述方法主要包括以下步骤:
8.(a)提供单细胞样品并置于一反应容器中;
9.(b)使用含有蛋白酶k的缓冲液对样品进行裂解(即解交联),从而裂解产物;
10.(c)以所述裂解产物为模板,进行逆转录反应,从而得到含cdna的逆转录产物;
11.(d)对所述的逆转录产物进行pcr扩增,从而获得扩增产物;
12.(e)对所述的扩增产物进行纯化,从而获得经纯化的扩增产物;和
13.(f)对所述经纯化的扩增产物进行建库和测序,从而获得单细胞转录组测序数据;
14.其中,在步骤(b)、(c)和(d)各步骤以及其间均不包括核酸纯化操作;
15.并且,在步骤(b)、(c)和(d)均在同一反应容器中进行。
16.在另一优选例中,所述的步骤(e)也在同一反应容器中进行。
17.在另一优选例中,所述的单细胞是新鲜的单细胞或固定后的单细胞。
18.在另一优选例中,所述的单细胞选自人肾胚细胞、神经元细胞或其他类型细胞。
19.在另一优选例中,在步骤(b)中,蛋白酶k的用量为0.2-1.5mg/ml(μg/μl),即(0.4-4.5μg)蛋白酶k/(2-3μl)裂解反应体积。
20.在另一优选例中,在步骤(b)中,所述缓冲液为te缓冲液。
21.在另一优选例中,所述te缓冲液包括以下组分:10mm tris
·
hcl和1mm edta和溶剂(例如水)。
22.在另一优选例中,所述te缓冲液的ph值为7.0-8.8,较佳地约8.0。
23.在另一优选例中,步骤(b)中裂解(解交联)的反应温度为50-70℃,较佳地55-65℃,最佳地约56℃。
24.在另一优选例中,步骤(b)中裂解(解交联)的反应时间为10分钟-3小时,较佳地0.25-2小时,较佳地0.5-1.5小时,最佳地约1小时。
25.在另一优选例中,所述的裂解产物含有释放出的rna。
26.在另一优选例中,在步骤(b)和(c)之间还包括:对裂解产物进行灭活处理,从而使得蛋白酶k失活。
27.在另一优选例中,所述的灭活处理包括95
±
3℃加热处理一段时间(如5-30分钟)。
28.在另一优选例中,在步骤(c)中所述的逆转录反应的反应体系中含有大分子聚乙二醇,所述大分子聚乙二醇选自下组:peg6000、peg7000、peg8000、peg9000或其组合。
29.在另一优选例中,在步骤(c)中所述的逆转录反应的反应体系中含有peg8000。
30.在另一优选例中,所述peg8000在反应体系中的终浓度为6-10%(v/v),优选地为7.5%。
31.在另一优选例中,所述的反应体系中还包括tso引物、oligo-dt引物、以及逆转录反应所需的其它必要试剂。
32.在另一优选例中,所述tso引物的3'末端含有rgrg g修饰。
33.在另一优选例中,所述oligo-dt引物的3'末端含有poly t修饰。
34.在另一优选例中,所述逆转录反应所需的其他必要试剂包括逆转录酶、反应缓冲液、还原剂(例如dtt)、和rna酶抑制剂。
35.在另一优选例中,所述裂解或步骤(b)在体积为v1的第一反应体系进行。
36.在另一优选例中,所述逆转录或步骤(c)在体积为v2的第二反应体系进行。
37.在另一优选例中,所述pcr反应或步骤(d)在体积为v3的第三反应体系进行。
38.在另一优选例中,v1<v2<v3。
39.在另一优选例中,v2/v1=1.5-4,较佳地2-3。
40.在另一优选例中,v3/v2=1.5-4,较佳地2-3。
41.在另一优选例中,所述的v1为2-5微升。
42.在另一优选例中,所述的v2为5-15微升。
43.在另一优选例中,所述的v3为15-30微升。
44.在另一优选例中,在步骤(e)中,采用磁珠进行纯化。
45.本发明的第二方面,提供了一种用于单细胞转录组测序的试剂盒,所述试剂盒包
括细胞裂解试剂、逆转录试剂、pcr扩增试剂和一反应容器。
46.在另一优选例中,所述试剂盒还包含标签和说明书。
47.在另一优选例中,所述试剂盒可选地包含dna扩增产物纯化试剂。
48.在另一优选例中,所述细胞裂解试剂包括蛋白酶k和te缓冲液。
49.在另一优选例中,所述细胞裂解试剂为含有蛋白酶k的te缓冲液。
50.在另一优选例中,所述蛋白酶k和te缓冲液被各自独立地提供。
51.在另一优选例中,所述蛋白酶k和te缓冲液可以为固态制剂或液态制剂。
52.在另一优选例中,所述蛋白酶k的工作浓度为0.2-1.5mg/ml(μg/μl),即(0.4-4.5μg)蛋白酶k/(2-3μl)裂解反应体积。
53.在另一优选例中,所述te缓冲液包括以下组分:10mm tris
·
hcl和1mm edta和溶剂(例如水)。
54.在另一优选例中,所述te缓冲液的ph值为7.0-8.8,较佳地约8.0。
55.在另一优选例中,所述逆转录试剂包括peg8000、tso引物、oligo-dt引物、逆转录酶、反应缓冲液、还原剂(例如dtt)、和rna酶抑制剂。
56.在另一优选例中,所述peg8000的工作浓度为终浓度为6-10%(v/v),优选地为7.5%。
57.本发明的第三方面,提供了一种单细胞转录组测序装置,所述装置包括:
58.(m1)加样模块,所述加样模块被配置为:将单细胞样品置于一反应容器中,所述反应容器为第一容器;
59.(m2)裂解模块,所述裂解模块被配置为:将含有蛋白酶k的缓冲液加入到所述反应容器中对样品进行裂解,得到裂解产物;
60.(m3)逆转录模块,所述逆转录模块被配置为:将逆转录反应试剂加入到所述反应容器中对裂解产物进行逆转录反应,得到含cdna的逆转录产物;
61.(m4)pcr模块,所述pcr模块被配置为:将pcr反应试剂加入到所述反应容器中对逆转录产物进行pcr扩增,得到扩增产物;
62.(m5)纯化模块,所述纯化模块被配置为:对所述反应容器中的扩增产物进行纯化,并将纯化的扩增产物转移至第二容器,所述的第二容器不同于第一容器;
63.(m6)测序模块,所述测序模块被配置为:对第二容器中的纯化的扩增产物进行测序;
64.其中,所述反应容器为同一个反应容器。
65.在另一优选例中,所述的测序装置还包括:(m7)控制模块,用于控制模块(m1)加样模块、(m2)裂解模块、(m3)逆转录模块、(m4)pcr模块、(m5)纯化模块和(m6)测序模块的运作。
66.在另一优选例中,所述的控制模块控制所述单细胞转录组测序装置中的以下模块依次运作:(m1)加样模块、(m2)裂解模块、(m3)逆转录模块、(m4)pcr模块、(m5)纯化模块和(m6)测序模块,即按(m1)
→
(m2)
→
(m3)
→
(m4)
→
(m5)
→
(m6)的顺序依次运行。
67.在另一优选例中,所述(m2)裂解模块还包括一灭活子模块,所述灭活子模块被配置为对于裂解产物进行灭活,从而获得经灭活的裂解产物。
68.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具
体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
69.图1显示了通过单细胞转录组扩增技术lf-seq-v1扩增的阴性对照的dna产物检测结果。左侧峰图显示了dna产物的大小分布,右侧显示了dna产物的凝胶毛细管电泳结果。
70.图2显示了通过单细胞转录组扩增技术lf-seq-v1扩增的阳性对照的dna产物检测结果。左侧峰图显示了dna产物的大小分布,右侧显示了dna产物的凝胶毛细管电泳结果。
71.图3显示了通过单细胞转录组扩增技术lf-seq-v1扩增的新鲜293t细胞的dna产物检测结果。左侧峰图显示了dna产物的大小分布,右侧显示了dna产物的凝胶毛细管电泳结果。
72.图4显示了通过单细胞转录组扩增技术lf-seq-v1扩增的固定293t细胞的dna产物检测结果。左侧峰图显示了dna产物的大小分布,右侧显示了dna产物的凝胶毛细管电泳结果。
73.图5显示了使用ht kit和lf-seq-v1进行单细胞转录组扩增后的基因测序统计结果。其中t组表示样本为活的单个293t细胞,并使用ht kit进行单细胞转录组扩增。fresh组表示样本为活的单个293t细胞,并使用本技术lf-seq-v1进行单细胞转录组扩增。fixed组表示样本为固定的单个293t细胞,并使用本技术lf-seq-v1进行单细胞转录组扩增。数字表示基因数。
74.图6显示了6580个基因的go分析结果。
75.图7显示了使用ht kit对活的单个293t细胞和使用lf-seq-v1对固定的单个293t细胞进行扩增后,扩增样品中组蛋白基因h1-4的pcr分析结果。其中图中标记和样品的对应关系为:ladder:250bp dna ladder(transgen);ht-1:t_sample_1;ht-2:t_sample_2;ht-3:t_sample_3;fl1:fixed_sample_1;fl2:fixed_sample_2;fl3:fixed_sample_3。其中ht-1(t_sample_1)、ht-2(t_sample_2)、和ht-3(t_sample_3)为使用3(t_sample_3)为使用ht kit的样品;fl1(fixed_sample_1)、fl2(fixed_sample_2)、和fl3(fixed_sample_3)为使用本发明lf-seq-v1的样品。
76.图8显示了使用ht kit对活的单个293t细胞和使用lf-seq-v1对固定的单个293t细胞进行扩增后,扩增样品中低丰度膜蛋白和胞外基质蛋白基因pecam1、pdgfrb、chat和gfap的pcr分析结果。其中图中标记和样品的对应关系为:ladder:250bp dna ladder(transgen);ht-2:t_sample_2;fl1:fixed_sample_1;fl2:fixed_sample_2;fl3:fixed_sample_3。其中ht-2(t_sample_2)为使用ht kit的样品;fl1(fixed_sample_1)、fl2(fixed_sample_2)、和fl3(fixed_sample_3)为使用lf-seq-v1的样品。
77.图9显示了所用293t样品对应的pecam1、pdgfrb、chat和gfap基因表达的免疫组化染色结果。
具体实施方式
78.本发明人经过广泛而深入的研究,首次发现并开发出了一种活细胞和固定细胞均适用的单细胞转录组扩增测序方法。通过优化试剂和精简实验步骤,可以在单一反应容器中完成样品裂解、逆转录、pcr扩增以及产物纯化步骤,从而显著提高对细胞转录组中低丰度rna以及特殊结构中的rna扩增的灵敏度,减少了转录组信息的丢失,提高了单细胞转录组扩增和测序效率。在此基础上,完成了本发明。
79.术语
80.单细胞转录组测序
81.单细胞转录组测序技术是在单细胞水平对转录组进行扩增与测序的一项新技术。其原理是将分离的单个细胞的微量转录组rna进行扩增后进行高通量测序。
82.单细胞转录组前期主要依赖于三种方法:smart-seq2技术、10
×
genomics技术及andeplete技术。
83.smart-seq2技术可用于单细胞mrna测序,对rna质量要求高,rna降解会引起5'端信息丢失,能够获得rna全长扩增cdna产物,打断后全部用于文库构建及测序。anydeplete技术可用于单细胞mrna及lncrna测序,对rna质量要求不高,可用于降解性样本测序。10
×
genomics技术可用于单细胞mrna测序,对rna质量要求高,rna降解会引起5'端信息丢失,其一次性能够分离500~10000个细胞,并能够将分离的单个细胞中的微量mrna通过高效扩增后再进行测序,只能测3'端一小段序列。
84.蛋白酶k
85.蛋白酶k是一种从白色念珠菌分离出来的强力蛋白溶解酶,具有很高的比活性,是dna提取的关键试剂。该酶在较广的ph范围(4~12.5)内及高温(50~70℃)均有活性,用于质粒或基因组dna、rna的分离。在dna提取中,主要作用是酶解与核酸结合的组蛋白,使dna游离在溶液中,随后用不同方法进行抽提,除去杂质,收集dna。
86.本发明的方法中,将细胞裂解步骤中常规使用的tritonx-100更换为蛋白酶k,在达到裂解细胞目的同时,可进行解交联反应,消化蛋白质,释放转录组rna。
87.peg
88.在本发明中,本发明人意外地发现使用特定种类的peg,可以高效地对裂解产物进行逆转录,并且当以优选含量存在时,可不经纯化残留在反应容器中,而不会对后续的pcr扩增以及产物纯化等造成不利影响。
89.在本发明中,优选的peg为peg6000-10000,较佳地为peg7000-peg9000,即分子量为7000~9000的peg。例如,peg8000(即聚氧乙醇8000,别名聚氧乙烯8000)。
90.在本发明的优选例中,在逆转录步骤中使用peg8000(而不采用常规方法的甜菜碱(betaine)),并通过反复试验确定了peg8000的最佳反应浓度。本发明方法中所用的peg8000的浓度,在保证逆转录反应高效进行的同时,保留在反应液中不进行去除也不会对后续pcr反应产生影响。因此,在本发明的方法中,省略了逆转录后的纯化步骤,简化了整体操作流程,并减少了因纯化步骤导致的低丰度基因的损失。
91.用于单细胞转录组测序的试剂盒
92.如本文所述的“用于单细胞转录组测序的试剂盒”是指包含本发明所述的细胞裂解液、逆转录试剂、pcr扩增试剂和一反应容器的用于单细胞转录组测序前样品制备的试剂
盒,所述试剂盒还应包含标有本发明的方法的说明书或标签。此外,所述试剂盒可选地包含dna扩增产物纯化试剂。
93.在本发明的优选例中,所述的细胞裂解液包括蛋白酶k和te缓冲液,其可以是含有蛋白酶k的te缓冲液(蛋白酶k工作浓度为0.2-1.5mg/ml(μg/μl),即(0.4-4.5μg)蛋白酶k/(2-3μl)裂解反应体积),也可以是分开提供的蛋白酶k制剂和te缓冲液制剂。所述蛋白酶k制剂和te缓冲液制剂可以是固态制剂或液态制剂,在使用时,将蛋白酶k制剂加入te缓冲液中,配制成工作浓度为0.2-1.5mg/ml(或μg/μl)的细胞裂解液。
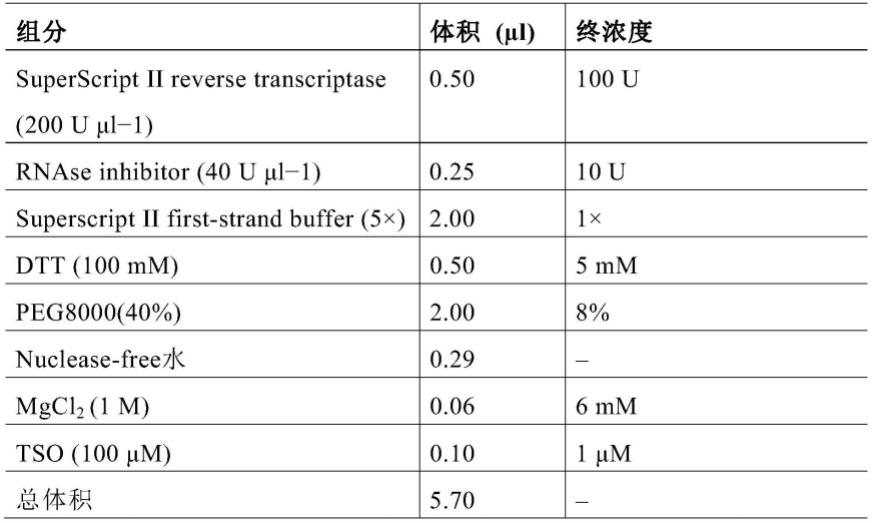
94.在本发明的优选例中,所述te缓冲液按照以下配方配制:10mm tris
·
hcl和1mm edta和溶剂(例如水)。在另一优选例中,所述te缓冲液的ph值为7.0-8.8,较佳地约8.0。
95.在本发明的一个优选例中,所述逆转录试剂包括peg8000、tso引物、oligo-dt引物、逆转录酶、反应缓冲液、还原剂(例如dtt)、和rna酶抑制剂。所述peg8000的工作浓度为终浓度为6-10%(v/v),优选地为7.5%。
96.在本发明的优选例中,所述的pcr扩增试剂为常规pcr使用的试剂,包括前置引物、后置引物、pcr扩增酶、dntp和反应缓冲液。
97.单细胞转录组测序装置
98.本发明还提供了一种可人工控制或通过仪器自动化进行的单细胞转录组测序装置,该装置可以在加入单细胞样品后,对细胞进行裂解(解交联)、逆转录、pcr扩增、dna扩增产物纯化以及测序分析,从而获得单细胞转录组数据。该装置可实现大规模的单细胞转录组数据采集,适用于单细胞转录组信息建库。
99.本发明的装置包括(m1)加样模块、(m2)裂解模块、(m3)逆转录模块、(m4)pcr模块、(m5)纯化模块和(m6)测序模块,可实现细胞裂解、逆转录、pcr扩增、dna产物纯化和测序的功能。
100.在另一优选例中,所述的测序装置还包括:(m7)控制模块,用于控制模块(m1)加样模块、(m2)裂解模块、(m3)逆转录模块、(m4)pcr模块、(m5)纯化模块和(m6)测序模块的运作。
101.在另一优选例中,所述的控制模块控制所述单细胞转录组测序装置中的以下模块依次运作:(m1)加样模块、(m2)裂解模块、(m3)逆转录模块、(m4)pcr模块、(m5)纯化模块和(m6)测序模块,即按(m1)
→
(m2)
→
(m3)
→
(m4)
→
(m5)
→
(m6)的顺序依次运行。
102.在另一优选例中,所述(m2)裂解模块还包括一灭活子模块,所述灭活子模块被配置为对于裂解产物进行灭活,从而获得经灭活的裂解产物。
103.本发明的装置还可进一步包括计算机、数据存储器、降温、加温和恒温孵育装置以及其他连接部件,以组成完整的装置。
104.本发明的主要优点在于:
105.(1)本发明提供的单细胞转录组测序方法既适用于新鲜的活的单细胞样品,也适用于固定后的单细胞样品。
106.(2)本发明所述的方法中,裂解、逆转录、pcr扩增步骤均在同一个反应容器内完成,减少了实施过程中因转移样品所造成的样品信息丢失,极大的保留了单细胞转录组的完整性。
107.(3)本发明所述的方法中,在裂解步骤中使用的te缓冲液既适合蛋白酶k的裂解,
而且与后续pcr是特别兼容的。
108.(4)本发明所述的方法中,省略了样品逆转录后去除反应体系中大分子(例如peg8000)的纯化步骤,减少了低丰度基因的损失。
109.(5)本发明提供的方法提高了对于低丰度rna以及一些特殊结构中的rna(表达组蛋白、膜蛋白和一些胞外基质蛋白)的扩增灵敏度。
110.综上,本发明提供了一种步骤简便、灵敏度高、完整性好且适用范围更广的优化的单细胞转录组扩增测序方法。
111.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
112.实施例中所用的材料、试剂(包括逆转录引物、tso引物)、仪器等,如无特殊说明,均可从商业途径得到。
113.实施例1单细胞转录组扩增技术lf-seq-v1的实验过程
114.实验步骤
115.1.单细胞rna的释放
116.1.1准备细胞裂解液(用于8个反应):15μl te 1μl 20mg/ml pk(在te缓冲液中)。按照2μl/管分装于0.2ml ep管中。
117.1.2单细胞样品制备:通过单细胞获取装置,将固定的(使用4%的多聚甲醛固定)或者活的单细胞放入上述裂解液中。并准备阳性对照组(10pg 293t total rna)和阴性对照组(从细胞悬液中吸取的少量上清,不含细胞,成分为pbs 0.04%bsa)。
118.1.3裂解(解交联):将细胞与裂解液混合物在56℃孵育1小时,随后加入1μl oligo(dt)
30
引物 1μl dntp(终体系为4.3μl=2μl裂解液 1μl oligo(dt)
30
引物 1μl dntp 0.3μl 293t total rna/单细胞(在pbs 0.04%bsa中)/pbs 0.04%bsa),在热循环仪中56℃反应2分钟,95℃反应10分钟灭活。
119.2.逆转录
120.2.1按照表1中所列的配方配置逆转录反应液。
121.表1
[0122][0123]
其中,tso引物序列如下所示:
[0124]5’‑
aagcagtggtatcaacgcagagtacatrgrg g-3’(seq id no.:1)。
[0125]
2.2在步骤1.3的裂解(解交联)产物中,加入5.7μl步骤2.1中逆转录反应液,得到最终反应体积为10μl。混匀后,按照如下步骤(如表2所示)进行逆转录反应:
[0126]
表2
[0127][0128]
反应结束后,得到含有单链cdna的产物,此cdna相比rna增加了一段tso上的序列作为下一轮pcr引物结合的位点。
[0129]
3.pcr扩增
[0130]
3.1按照如下表3所示配方,配置pcr反应液:
[0131]
表3
[0132][0133]
其中,is pcr primers序列如下所示:
[0134]5’‑
aagcagtggtatcaacgcagagt-3’(seq id no.:2)。
[0135]
3.2往步骤2.2中的反应体系中加入15μl步骤3.1中的pcr反应液,得到终体积为25μl的反应液。使用pcr仪按照如下表4过程进行转录组扩增,扩增的循环数依据样本的类型做调整。
[0136]
表4
[0137][0138]
4.dna纯化
[0139]
使用ampure xp beads对步骤3.2中pcr产物进行纯化。具体步骤如下所述:
[0140]
(1)在开始纯化步骤之前,在室温下平衡ampure xp珠子15分钟,然后漩涡数秒。
[0141]
(2)向经步骤3.2得到的每个pcr样品(25μl)中加入20μl的ampure xp珠子(比例为1:0.8),上下吸液10次或直到溶液均匀。
[0142]
(3)在室温下孵育8分钟,让dna与珠子结合。
[0143]
(4)将步骤(3)中混合有pcr产物和磁珠的pcr管放在磁铁架上静置5分钟或直到溶液澄清,使珠子在管的一侧聚集。
[0144]
(5)保持步骤(4)中pcr管放在磁铁架上时,小心地将上清液体移除,不要干扰磁珠。
[0145]
(6)往步骤(5)的pcr管中加入200μl 80%(体积/体积)的乙醇溶液,室温与样品孵育30秒,用于清洗磁珠,然后去除乙醇。重复此步骤。
[0146]
(7)去除残留乙醇,让珠子完全干燥,将步骤(6)中pcr管在室温下放置5分钟,或者直到珠子表面出现一个小裂缝。
[0147]
(8)将步骤(7)中的pcr管从磁力架上取下,加入17μl eb溶液(或无核酸酶的水),混合十次使珠子重悬。
[0148]
(9)将步骤(8)中的pcr管在室温孵育2分钟。
[0149]
10)将步骤(9)中的pcr管放在磁铁架上,静置2分钟,直到溶液变得澄清,并使珠子
在管的一侧聚集。
[0150]
(11)将移液管的移液体积设置为15μl,收集上清,避免吸到珠子,并将上清液转移到另一个0.2ml的薄壁pcr管中。
[0151]
应注意,在纯化步骤中,珠子的体积不要增加到1:0.8以上的比例。低于标准数量的珠子保证了底物二聚体携带量保持在最低限度。
[0152]
实验结果
[0153]
在fragment analyzer tm全自动毛细管电泳系统系统中,采用fragment analyzer large fragment analysis kits(货号为:dnf-464-500)检测所提取dna产物大小分布。一个好的文库主要的峰值应该在1.5-2kb左右。
[0154]
阴性对照的检测结果如图1所示。
[0155]
阳性对照的检测结果如图2所示。
[0156]
新鲜293t细胞的检测结果如图3所示。
[0157]
固定293t细胞的检测结果如图4所示。
[0158]
结果表明:本方法能够很好的从阳性对照(10pg 293t total rna)、新鲜的293t单细胞样品、固定的293t单细胞样品中很好的扩增转录组文库,而不会从阴性对照(293t细胞悬液(不含细胞))中非特异性扩增出转录组。
[0159]
上述单细胞转录组扩增产物,可进一步进行测序。
[0160]
实施例2单细胞转录组扩增技术lf-seq-v1与ht kit的对比
[0161]
分别使用本发明所述的单细胞转录组扩增技术lf-seq-v1和市购的ht kit进行单细胞转录组扩增。lf-seq-v1扩增技术的具体操作步骤如实施例1中所述;ht kit的单细胞转录组扩增按照试剂盒中说明书方案进行。其中,ht kit法所用样品为活的单个293t细胞;lf-seq-v1扩增技术所用样品为活的单个293t细胞和固定的单个293t细胞。扩增结束后,对扩增样品进行测序,测序结果如图5所示。
[0162]
结果表明,用本发明所述的单细胞转录组扩增技术lf-seq-v1从固定单个293t细胞和活的单个293t细胞中获取的基因中相比用传统ht kit从活的单个293t细胞中获取的基因多出6580个。
[0163]
针对这6580个基因进行go分析(如图6所示),发现这些基因大多为膜蛋白和胞外基质蛋白,以及高表达的组蛋白。由于这些蛋白翻译后都需要经过内质网和高尔基体的修饰,这些基因对应的mrna的定位可能有一些结构特殊性,导致用传统的triton x-100的裂解方法很难释放出来。但是用蛋白酶k解交联的方法却能很好的释放出来。
[0164]
并且,通过pcr和免疫组化的方法进一步验证了多出来的基因确实是真实表达的。例如图7所示,使用ht kit无法获得高丰度组蛋白基因h1-4的转录本,但是用本文所述的方法就可以很好的获得。此外,通过pcr(图8)和免疫组化(图9)的方法证明使用ht kit无法获得低丰度膜蛋白和胞外基质蛋白的转录本(例如pecam1、pdgfrb、chat和gfap),使用本方法就可以很好的获得。图8为pcr后的凝胶电泳结果,显示了使用两种不同的方法所获得的dna扩增产物的凝胶电泳结果,从图中可以看出,使用本文所
述的方法经得到的产物中的pecam1、pdgfrb、chat和gfap的转录本的量明显多于使用ht kit得到的产物。图9显示了所用293t细胞的中pecam1、pdgfrb、chat和gfap基因的表达情况,从图中可以看出,pecam1、pdgfrb、chat和gfap在293t细胞中的表达都处于较低水平。
[0165]
通过以上实验证明,本文所述的单细胞扩增方法lf-seq-v1既可以用于活的单细胞扩增也可以用于固定的单细胞扩增,并且相对于现有方法,减少了低丰度转录本的丢失,提高了低丰度转录本获取的灵敏性。
[0166]
讨论
[0167]
在本发明所述的单细胞转录组扩增方法中,将细胞的裂解体系从现有技术常用的triton x-100改为蛋白酶k裂解,并更换了裂解缓冲液为te缓冲液,这使得本发明所述的技术既可以用于活的单细胞的扩增也可以用于固定单细胞的扩增。并且,使用蛋白酶k的裂解方法还能够释放细胞内一些特殊结构中的rna,使得能够检测到更多的基因。
[0168]
在目前的现有技术中,在rna释放结束后,通常对mrna进行纯化,或者在第一轮pcr结束之后对pcr产物进行纯化。纯化步骤增加了实验的复杂性和难度,并会造成一些低丰度rna的丢失。而本发明所述的单细胞转录组扩增方法的整个反应均在同一个体系中完成,实验更加便捷。通过后续的数据分析进一步表明,本发明所述的单细胞转录组扩增方法在低丰度转录本的获取方面更为灵敏。
[0169]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。