一种与黄瓜抗靶斑病相关的snp标记及其应用
技术领域
1.本发明涉及生物技术领域中,一种与黄瓜抗靶斑病相关的snp标记及其应用。
背景技术:
2.黄瓜(cucumis sativus l.)在世界上广泛栽培,中国是世界上黄瓜栽培面积最大、总产量最高的国家。
3.黄瓜棒孢叶斑病,又称靶斑病,是一种世界性分布的病害。目前已成为危害黄瓜露地和保护地栽培的重要病害之一,尤以越冬温室、冬春温室、春大棚等保护地内发生严重。主要危害叶部,病斑初呈淡褐色后变褐绿色,严重时叶片枯死。该病导致落叶率低于5%时,病情扩展慢,约2周,而后一周内发展快,落叶率可由5%发展至90%。棚室内反季节种植黄瓜在冬春季节和初夏均易流行发病。田间发病率一般在10%~25%,严重时一般在60%~70%,造成损失达30%以上。靶斑病采用化学防治效果不理想,不仅使生产投入增加且会造成环境安全隐患,倒茬嫁接使技术困难和劳动成本增加。因此选育抗病品种是解决靶斑病危害的最佳途径。
4.分子标记辅助选择技术(marker-assisted selection,mas)是现代分子生物学和传统遗传育种相结合的新型育种模式,可以利用分子标记在植物发育的任何时期从dna水平对目标植株进行选择(tanksley等,rflp mapping in plant breeding:new tools for an old science.1989,biotechnology,7:257-263),从而弥补传统育种中出现的诸多弊端,因此成为解决抗病品种选育难这一问题的有效途径。其中,利用高通量分子检测平台进行分子标记辅助选择则是增加抗病育种准确度与提高育种效率的有效手段。
5.单核苷酸多态性(single-nucleotide polymorphism,snp)是指基因组核苷酸序列中由单个核苷酸水平上的变异而引起的基因组水平上的dna序列多态性,主要包括单个碱基的缺失、插入、转换及颠换等(唐立群等,snp分子标记的研究及其应用进展.2012,中国农学通报,28(12):154-158.)。snp标记即为在此基础上发展起来的第三代分子标记,该标记类型具有突变频率低,遗传稳定性高;位点丰富,分布广泛;检测快速,筛选规模化等特点。与第二代分子标记相比,snp标记不需要根据dna片段大小进行分型,能够摆脱传统凝胶电泳这种步骤相对繁琐,低通量,价格又较贵的检测方法。因此,更加适用于现阶段飞速发展的高通量分子检测平台。
6.黄瓜靶斑病抗病基因影响黄瓜对靶斑病的抗性,它的研究将会推动抗病育种进程。用与目的性状紧密连锁的分子标记,可在苗期进行标记辅助选择,在黄瓜遗传育种中十分有效。因此,开发用于辅助鉴定黄瓜靶斑病抗病基因的分子标记十分重要。
技术实现要素:
7.本发明所要解决的技术问题是如何检测黄瓜靶斑病抗性。
8.为解决上述技术问题,本发明首先提供了黄瓜抗病分子标记(其名称为cssnp4)或检测所述黄瓜抗病分子标记的物质在检测或辅助检测黄瓜靶斑病抗性中的应用;所述黄瓜
抗病分子标记为对应于黄瓜基因组中序列表中序列4的第54位所示的核苷酸,所述黄瓜抗病分子标记为a或g。
9.所述黄瓜抗病分子标记位于黄瓜第五染色体24908267-24908367bp。
10.上述应用中,所述检测所述黄瓜抗病分子标记的物质可为cssnp4引物组,所述cssnp4引物组由名称分别为f1、f2和r的单链dna组成;
11.所述f1为(b1)或(b2):
12.(b1)序列表的序列1的第22-47位所示的单链dna;
13.(b2)将序列1的第22-47位经过一个或几个核苷酸的取代和/或缺失和/或添加得到的单链dna;
14.所述f2为(b3)或(b4):
15.(b3)序列表的序列2的第22-47位所示的单链dna;
16.(b4)将序列2的第22-47位经过一个或几个核苷酸的取代和/或缺失和/或添加得到的单链dna;
17.所述r为序列表的序列3所示的单链dna。
18.上述应用中,(b2)可为序列表中序列1所示的单链dna;(b4)可为序列表中序列2所示的单链dna。
19.本发明还提供了黄瓜基因型的检测方法,所述基因型为aa基因型、ag基因型和gg基因型,所述方法包括:检测待测黄瓜染色体中对应于序列表中序列4的第54位的核苷酸,如所述待测黄瓜两条染色体均为下述g1)的染色体,所述待测黄瓜为aa基因型黄瓜;如所述待测黄瓜两条染色体均为下述g2)的染色体,所述待测黄瓜为gg基因型黄瓜;如所述待测黄瓜两条染色体中一条为下述g1)的染色体,另一条为下述g2)的染色体,所述待测黄瓜为ag基因型黄瓜;
20.g1)对应于序列表中序列4的第54位的核苷酸为a;
21.g2)对应于序列表中序列4的第54位的核苷酸为g。
22.上述方法中,检测待测黄瓜染色体中对应于序列表中序列4的第54位的核苷酸可采用所述cssnp4引物组进行。
23.采用所述cssnp4引物组检测待测黄瓜染色体中对应于序列表中序列4的第54位的核苷酸可采用荧光定量pcr仪ab-q6 flex检测。
24.上述方法具体可包括:采用所述cssnp4引物组进行反应,得到反应产物,检测所述反应体系的荧光信号,仅有vic荧光信号的待测黄瓜为aa基因型黄瓜(即所述黄瓜抗病分子标记为a的纯合型),仅有fam荧光信号的待测黄瓜为gg基因型黄瓜(即所述黄瓜抗病分子标记为g的纯合型),有vic与fam荧光信号的待测黄瓜为ag基因型黄瓜(即所述黄瓜抗病分子标记为a和g的杂合型)。
25.采用所述cssnp4引物组进行反应的反应体系可为:黄瓜基因组dna 50ng,引物混液0.07μl(所述f1与所述f2的浓度均为50pmol
·
l-1
,所述r的浓度为50pmol
·
l-1
),lgc公司2
×
kasp mix(low rox)2.5μl,水补至8μl。
26.采用所述cssnp4引物组进行反应的反应条件可为:95℃预变性10min,1个循环;95℃变性20s,55-62℃(优选55℃)退火60s,设置32-40个循环(优选40个循环)。
27.本发明还提供了检测黄瓜靶斑病抗性的方法,所述方法包括:按照所述黄瓜基因
型的检测方法检测待测黄瓜的基因型,aa基因型待测黄瓜的靶斑病抗性高于或候选高于gg基因型黄瓜,ag基因型待测黄瓜的靶斑病抗性高于或候选高于gg基因型黄瓜,aa基因型待测黄瓜的靶斑病抗性高于或候选高于ag基因型黄瓜。
28.上述方法中,所述待测黄瓜可为纯合系黄瓜。所述待测黄瓜具体可为aa因型黄瓜或gg基因型黄瓜。
29.本发明还提供了黄瓜育种方法,所述方法包括:按照所述黄瓜基因型的检测方法检测黄瓜的基因型,选择aa基因型或ag基因型黄瓜作为亲本进行育种。
30.上述黄瓜育种方法还可包括选择后代为aa基因型的黄瓜作为抗靶斑病的目的黄瓜,实现黄瓜育种。
31.所述黄瓜抗病分子标记,也属于本发明的保护范围。
32.本发明还提供了具有如下y1)-y4)中任一用途的物质,包括所述cssnp4引物组:
33.y1)检测黄瓜抗病分子标记;
34.y2)制备检测黄瓜抗病分子标记的产品;
35.y3)检测或辅助检测黄瓜靶斑病抗性;
36.y4)制备检测或辅助检测黄瓜靶斑病抗性产品。
37.所述物质还可包括检测所述黄瓜抗病分子标记所需的其他试剂,如lgc公司2
×
kasp mix(low rox)。
38.所述物质可为试剂盒。所述物质可仅为所述cssnp4引物组,还可为由所述cssnp4引物组与检测所述黄瓜抗病分子标记所需的其他试剂组成的成套试剂。
39.本发明还提供了下述任一应用:
40.h1)所述黄瓜抗病分子标记在黄瓜育种中的应用;
41.h2)检测所述黄瓜抗病分子标记的物质在黄瓜育种中的应用;
42.h3)检测所述黄瓜抗病分子标记的物质在制备检测或辅助检测黄瓜靶斑病抗性产品中的应用;
43.h4)所述黄瓜基因型的检测方法在检测或辅助检测黄瓜靶斑病抗性中的应用。
44.本发明中所述黄瓜可为表1中120份黄瓜中的任一种或多种,但不限于表1中120份黄瓜。
45.在本发明的实施例中,所述靶斑病由黄瓜棒孢叶斑病病原菌多主棒孢菌(corynespora cassiicola(berk.curt.)wei)引发。
46.本发明的黄瓜抗病分子标记与黄瓜靶斑病抗性有关,分子标记鉴定结果与田间抗病表型一致性可达到93.33%,说明该标记可以用于检测黄瓜抗靶斑病抗性,并进一步可用于黄瓜分子标记辅助育种。本发明的黄瓜抗病分子标记为snp标记,可以用于高通量的分子检测平台,与第二代分子标记相比,检测方式更为简便、准确,检测效率更高。
附图说明
47.图1为标记分布。
48.图2为定位结果。
49.图3与图4为cssnp4标记在120份黄瓜自交系中的分型图。注:红色的数据点(两幅图的左上角)代表具有等位位点a的材料集合,蓝色的数据点(两幅图的右下角)代表具有等
位位点g的材料集合。
具体实施方式
50.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
51.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna/rna的5
′
末端核苷酸,末位均为相应dna/rna的3
′
末端核苷酸。
52.下述实施例中的黄瓜gy14(yuhui wang et al..staygreen,stay healthy:a loss-of-susceptibility mutation in the staygreen gene provides durable,broad-spectrum disease resistances for over 50years of us cucumber production.new phytologist(2019)221:415
–
430doi:10.1111/nph.15353),经威斯康星大学翁益群教授实验室同意后,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
53.下述实施例中的黄瓜q10(张桂华,等。与黄瓜抗白粉病基因连锁的aflp标记的获得,园艺学报,2004,31(2):189-192),公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
54.下述实施例中的黄瓜棒孢叶斑病病原菌多主棒孢菌(corynespora cassiicola berk&m.a.curtis c t wei)hb8菌株记载在“高苇等,河北青县黄瓜棒孢叶斑病病原菌种群分化的研究,华北农学报,2001,26(5):9-15”一文中,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
55.实施例1、与黄瓜抗靶斑病cca基因紧密连锁snp标记的获得及验证
56.1、试验材料
57.黄瓜gy14,高抗靶斑病;黄瓜q10,高感靶斑病。利用上述材料配制杂交组合gy14
×
q10(即f1代),然后自交得到f2分离群体。
58.2、表型鉴定
59.采用喷雾法对亲本及f2各单株进行人工接种抗性鉴定。鉴定方法如下:
60.菌株:黄瓜棒孢叶斑病病原菌多主棒孢菌(corynespora cassiicola berk&m.a.curtis c t wei)hb8菌株。
61.采用阐琳娜等(黄瓜褐斑病防治药剂的活体筛选,中国蔬菜,2007,(4):22~24)的方法利用黄瓜棒孢叶斑病病原菌多主棒孢菌(corynespora cassiicola berk&m.a.curtis c t wei)hb8菌株制备黄瓜棒孢叶斑病病原菌多主棒孢菌菌液,浓度为1
×
105个孢子/ml,血球计数板测定孢子浓度。待第一或第二真叶展开后利用所得菌液喷雾接种黄瓜棒孢叶斑病病原菌多主棒孢菌(corynespora cassiicola berk&m.a.curtis c t wei)hb8菌株,接种温度为25~28℃,接种后保湿24h,以后夜间塑料薄膜覆盖保湿;进行3次重复,每次重复28株。将接种当天记为接种0天,在接种后7d调查所有叶片的病情,计算病情指数。
62.病情分级标准:
63.0级:无病症;
64.1级:接种叶出现少数病斑,病斑占叶片面积的1/10以下(包括1/10);
65.2级:病斑占叶面积的1/10-1/3(不包括1/10,包括1/3);
66.3级:病斑占叶面积的1/3-1/2(不包括1/3,包括1/2);
67.4级:病斑占叶面积的1/2-2/3(不包括1/2,包括2/3);
68.5级:病斑占叶面积的2/3以上(不包括2/3)。
69.病情指数di=∑(si·
ni)/9n
×
100,其中di——病情指数;si——发病级别(i=0,1,2,3,4,5);ni——相应病级级别的株数;n——调查总株数。
70.病情指数小于等于35时,待测植株为抗病植株,病情指数大于55时,待测植株为感病植株。
71.3、初定位
72.将抗病亲本gy14、感病亲本q10及其f2后代中由60个极端抗病单株(病情指数小于15)组成的抗病池以及由59个极端感病单株(病情指数大于75)组成的抗病池进行重测序,并对测序数据进行分析。初步将抗病基因定位在了黄瓜第五染色体末端大约10m的区域内。定位区间共有5226个snp,注释的基因共486个。
73.4、精细定位
74.根据bsa初定位的结果,进一步使用抗病亲本gy14和感病亲本q10构建的f2群体(1500单株)进行精细定位。在bsa初定位区间一共开发了97个snp标记,两个亲本之间多态性标记为90个,过滤掉一个在子代中基因型缺失率大于10%的标记,剩下89个标记。过滤掉2个偏分离标记后,最终22个标记上图。
75.使用r软件包r/qtl及asmap构建遗传图谱,总图距为29.59cm,标记分布如图1。
76.使用mapqtl6的mqm算法进行qtl定位,1000次置换检验得到95%置信区间的lod阈值为1.9,定位结果见图2。
77.定位的区间中含有一个snp位点,记为cssnp4。
78.5、kasp标记设计及扩增
79.设计检测cssnp4的引物,具体如下:
80.正向引物f1:5
′-
gaaggtcggagtcaacggattttgataaatttcaaggtcaacagaaa-3
′
(序列表中序列1),加粗部分为vic接头,用于与vic结合;
81.正向引物f2:5
′-
gaaggtgaccaagttcatgctttgataaatttcaaggtcaacagaag-3
′
(序列表中序列2),加粗部分为fam接头,用于与fam结合;
82.反向引物r:5
′-
cgggttcgaactagagacagtaa-3
′
(序列表中序列3)。
83.以黄瓜基因组dna为模板,利用正向引物f1/f2与反向引物r进行pcr扩增所得pcr产物的序列为:5
′-
ttttatatttgaatctaggtaacgacagttgataaatttcaaggtcaacagaargattatatattactgtctctagttcgaacccgctttgtggggcacct-3
′
(序列表中序列4),r表示a或g,序列4的第54位为cssnp4。
84.具体检测方法:
85.a)snp标记检测及反应体系:
86.荧光定量pcr仪ab-q6 flex检测:
87.8μl pcr荧光定量仪检测反应体系包括:基因组dna 50ng,引物混液0.07μl(引物
混液中,正向引物f1与f2的浓度均为50pmol
·
l-1
,反向引物r的浓度为50pmol
·
l-1
),lgc公司2
×
kasp mix(low rox)2.5μl,水补至8μl。
88.按照荧光定量pcr仪ab-q6仪器操作手册,编辑样品表,执行运行程序,保存数据。反应条件:95℃预变性10min,1个循环;95℃变性20s,55℃退火60s,40个循环。
89.使用cssnp4优选引物组合进行扩增,并检测荧光信号,检测到vic荧光信号的待测植株为aa基因型,为抗病基因型;检测到fam荧光信号的待测植株为gg基因型,为感病基因型;检测到vic与fam荧光信号的待测植株为ag基因型,为杂合抗病基因型。
90.6、与材料的表现型进行关联分析:
91.按照步骤2的方法利用苗期人工接种鉴定方法对120份黄瓜高代自交系的靶斑病抗性进行表型鉴定,每份自交系播种28株,并按照步骤5的方法检测各自交系的基因型(图3与图4)。
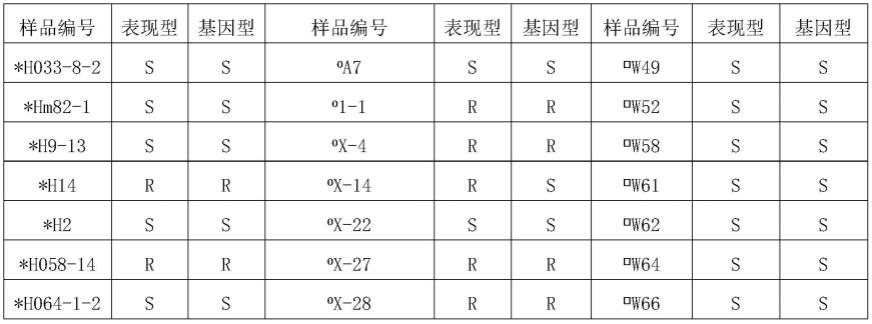
92.将基因型检测结果与表型鉴定结果进行关联分析,结果如表1所示,“表现型”列中,r表示抗病性检测鉴定为抗病植株(病情指数均小于35),s表示抗病性检测鉴定为感病植株(病情指数均大于55);“基因型”列中,r表示基因型检测时鉴定为aa型植株,根据基因型判定为抗病植株,s表示基因型检测时鉴定为gg基因型,根据基因型判定为感病植株。
93.分析结果表明,在所检测120份自交系材料中,根据基因型判定的抗病性情况与表型鉴定的一致性达到93.33%,表明cssnp4可以用于黄瓜靶斑病的辅助检测,并用于分子标记辅助育种。
94.表1 120份黄瓜材料表型与基因型数据
95.[0096][0097][0098]
注:标注有*的材料均记载在“张桂华,等。黄瓜种质资源遗传多样性的aflp分析。华北农学报,2007,22(3):21-24”一文中;
[0099]
标注有的材料均记载在“杜胜利,张桂华,等。黄瓜抗白粉病基因aflp标记的scar
转换。园艺学报2005,32(6):1095~1097”一文中;
[0100]
标注有的材料均记载在“付海朋,等。est-ssr标记与人工接种鉴定黄瓜种质褐斑病抗性。中国园艺文摘20 12年第2期:1-3”。
[0101]
实施例2、与黄瓜抗靶斑病基因cca紧密连锁snp标记在分子标记辅助选择黄瓜抗靶斑病植株中的应用
[0102]
1.基因组dna的提取
[0103]
利用ctab法提取待测黄瓜材料的基因组dna。
[0104]
2.pcr扩增
[0105]
snp标记扩增及反应体系(荧光定量pcr仪ab-q6 flex检测):
[0106]
8μl pcr荧光定量仪检测反应体系包括:基因组dna 50ng,引物混液0.07μl(引物混液中,实施例1的正向引物f1与f2的浓度均为50pmol
·
l-1
,实施例1的反向引物r的浓度为50pmol
·
l-1
),lgc公司2
×
kasp mix(low rox)2.5μl,水补至8μl。按照荧光定量pcr仪ab-q6仪器操作手册,编辑样品表,执行运行程序,保存数据。
[0107]
以上反应体系为ab-q6 flex的优选反应体系,其他合理的反应体系也可以达到相同的检测目的。
[0108]
或者使用普通pcr仪,采用以下扩增程序:95℃预变性10min,1个循环;95℃变性20s,55-62℃(优选55℃)退火60s,设置32-40个循环(优选40个循环)。扩增完成后在荧光定量pcr仪ab-q6 flex上进行分型。
[0109]
注:以上为推荐检测方法,其他能够达到相同检测目的的检测方法也可以应用到上述标记的分子标记辅助育种过程中。
[0110]
3.结果分析
[0111]
使用cssnp4优选引物组合进行扩增,基因型aa为抗病基因型,gg为感病基因型,ag为杂合抗病基因型。
[0112]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。