conh2、-conhme、-nhcome、-nhcoet、f、cl中的任意一种;r2为c1-c6的烷基、芳香环、芳杂环中的任意一种。
12.r2为et、n-pr、i-pr、n-bu、i-bu、t-bu、-ch2(chr4)r5、、中的任意一种,其中r4为h、-(ch2)n、-me、et中的任意一种;r5为h、me、f、cl、cf3、nh2、nh(ch3)、oh中的任意一种;r6为h、f、cl、br、ch3、t-bu、cf3、cn、oh、och3、ocf3、nh2、nhch3、n(ch3)2、nhc2h5、n(c2h5)2、nhcoch3、conh2、conhch3中的任意一种,r6为单取代、双取代、三取代中的任意一种;所述-(ch2)n中n=0-3。
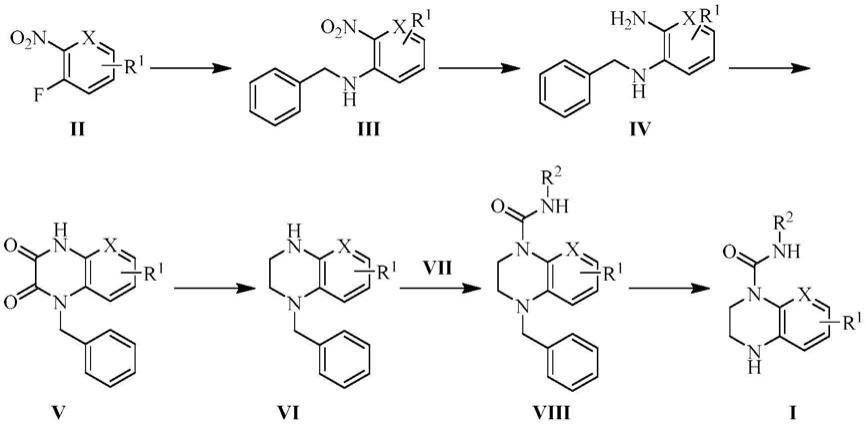
13.上述通式(i)化合物的制备方法为:
[0014][0015]
其中:x=ch或n;
[0016]
r1为h、-or3、-coor3、-ocor3、-nhcor3、-conhr3、-oh、f、cl、br中的任意一种,r1为单取代或双取代;
[0017]
r2为c1-c6的烷基、c3-c8的环烷基、c2-c6的杂环烷基、芳香环、芳杂环中的任意一种,所述杂环烷基为含有1~3个o、n或s原子的三元、四元、五元、六元饱和杂环中的任意一种。
[0018]
具体制备步骤为:
[0019]
(1)化合物iii的制备
[0020]
以化合物ⅱ为起始原料,乙腈或n,n-二甲基甲酰胺(dmf)为溶剂,在碳酸钾或碳酸铯的作用下与苄胺进行亲核取代反应生成化合物iii;
[0021]
(2)化合物ⅳ的制备
[0022]
由化合物iii制备化合物ⅳ,可以采用两种方法:1)以甲醇为溶剂,以pd/c作为催化剂,在氢气作用下还原硝基得到化合物ⅳ;2)以乙醇为溶剂,以fe粉和hcl(0.15m)还原硝基得到化合物ⅳ;
[0023]
(3)化合物v的制备
[0024]
化合物ⅳ与草酸二甲酯或草酸二乙酯在70-100℃环合得到化合物v;
[0025]
(4)化合物ⅵ的制备
[0026]
将化合物v溶于无水四氢呋喃(thf)中,采用硼烷-四氢呋喃络合物还原羰基得到化合物ⅵ;
[0027]
(5)化合物viii的制备
[0028]
化合物ⅵ溶于无水二氯甲烷(dcm)中,在三乙胺(tea)的作用下,与相应的异氰酸酯衍生物ⅶ反应生成化合物viii;
[0029]
其中异氰酸酯衍生物为2-甲氧基异氰酸酯、4-甲氧基异氰酸酯、4-三氟甲氧基异氰酸酯、4-硝基苯基异氰酸酯、3-甲氧基苯基异氰酸酯、氯乙基异氰酸酯、1-萘基异氰酸酯、2-甲基苯基异氰酸酯、2-三氟甲基苯基异氰酸酯、2,5-二甲氧基苯基异氰酸酯、2,6-二甲基苯基异氰酸酯、环己基异氰酸酯、异氰酸乙酯、叔丁基异氰酸酯、叔丁基异氰酸酯、4-甲基苯基异氰酸酯中的任意一种;
[0030]
(6)目标化合物i的制备
[0031]
化合物viii溶于甲醇中,以raney ni作为催化剂,在氢气作用下脱除苄基得到目标化合物i。
[0032]
所述的脲基化合物的药用盐,其中:药用盐为通式(i)化合物的酸加成盐,其中用于成盐的酸为:氯化氢、溴化氢、硫酸、碳酸、草酸、柠檬酸、琥珀酸、酒石酸、磷酸、乳酸、丙酮酸、乙酸、马来酸、甲磺酸、苯磺酸、对甲苯磺酸、阿魏酸中的任意一种。
[0033]
本发明还公开了一种药物组合物,其含有上述通式(i)化合物或其药用盐及药学上可接受的载体。所述的化合物可以添加药学上可接受的载体制成常见的药用制剂,如片剂、胶囊、糖浆、悬浮剂、注射剂,可以加入香料、甜味剂、液体或固体填料或稀释剂等常用药用辅料。
[0034]
本发明所述的通式(i)化合物及其立体异构体、水合物、溶剂合物或结晶在制备微管聚合抑制剂药物中的应用也在本发明的保护范围内。其中,微管聚合抑制剂为用于制备治疗恶性肿瘤的药物,所述的恶性肿瘤为乳腺癌、肝癌、肺癌、结肠癌、前列腺癌等。
[0035]
本发明具有以下有益效果:
[0036]
1、本发明公开了一种通式(i)所示的脲基化合物衍生物,其药理实验结果显示,本发明的化合物(i)对肿瘤细胞具有增殖抑制活性,可以将细胞周期阻滞在g2/m期,免疫荧光实验显示化合物在细胞水平上可以抑制微管蛋白的聚合,分子对接结果显示化合物作用于微管蛋白秋水仙碱位点。
[0037]
2、本发明公开的化合物可用于制备治疗微管蛋白动态平衡失衡导致的恶性肿瘤。
[0038]
3、本发明还公开了所述脲基化合物的制备方法。
[0039]
4、与传统的秋水仙碱结合位点抑制剂相比,本发明公开的脲基化合物衍生物与微管蛋白的作用方式有很大区别,化合物未与α微管蛋白的t5 loop形成氢键作用,而是占据秋水仙碱位点的深处,揭示了化合物与微管蛋白新的作用模式,这种作用模式可能有利于增强化合物对肿瘤细胞的增殖抑制活性,提高化合物的抗肿瘤效果。
附图说明
[0040]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本
发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0041]
图1为本发明实施例6(i-6)化合物、实施例10(i-10)化合物对细胞周期的影响,如图1所示,化合物i-6(zln-06)和i-10(zln-11)可以将细胞阻滞在g2/m期。其中,图a、b、c分别为化合物i-6(zln-06)在1、3、6μm下对hela细胞的周期阻滞;图d、e、f分别为化合物i-10(zln-11)在4、8、12μm下对hela细胞的周期阻滞;图g为化合物i-6(zln-06)和i-10(zln-11)对细胞周期的统计图。
[0042]
图2为本发明实施例6(i-6)化合物对细胞内微管蛋白聚合的影响,如图2所示,化合物i-6(zln-06)在细胞水平上抑制微管的聚合,作用方式与秋水仙碱位点抑制剂ca-4一致。
[0043]
图3为本发明实施例6(i-6)化合物与微管的对接图,如图3所示,分子对接结果显示四氢喹喔啉环占据秋水仙碱结合位点的一个疏水空腔,同时环上的nh与β微管蛋白lys352形成氢键作用,脲基上的羰基与β微管蛋白cys241的侧链巯基形成氢键作用。
具体实施方式
[0044]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0045]
实施例1
[0046]
6-甲氧基-n-(2-甲氧基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-1)的合成
[0047][0048]
n-苄基-5-甲氧基-2-硝基苯胺(iii-1)的合成
[0049]
将苄胺(2.07g,19.28mmol)溶于乙腈(40ml)中,加入3-氟-4-硝基苯甲醚(
ⅱ‑
1)(3.00g,17.50mmol)和无水碳酸钾(4.84g,35.02mmol),85℃回流搅拌。90min后tlc(展开剂pe:ea=5:1)监测反应是否完全,原料反应完全后,停止加热,冷至室温,抽滤,滤液用水(20ml
×
3)洗涤,饱和氯化钠溶液(20ml
×
3)洗涤,无水硫酸钠干燥过夜。抽滤,滤液经减压浓缩得黄色固体3.92g,产率86.6%。产物不经进一步纯化,直接投下一步。1h nmr(300mhz,dmso-d6)δ8.87(t,j=5.7hz,1h),8.06(d,j=9.7hz,1h),7.46-7.41(m,2h),7.40-7.34(m,2h),7.32-7.27(m,1h),6.35-6.25(m,2h),4.64(d,j=5.9hz,2h),3.74(s,3h).
[0050]n1-苄基-5-甲氧基苯基-1,2-二胺(
ⅳ‑
1)的合成
[0051]
将iii-1(817mg,3.16mmol)溶于甲醇(40ml)中,搅拌情况下分批加入钯炭(67mg,0.63mmol),氢气三通三放,室温反应。90min后tlc(展开剂pe:ea=5:1)监测反应是否完全。原料反应完全后,硅藻土抽滤,滤液减压浓缩,柱层析(展开剂pe:ea=10:1)分离,得深灰色
油状物679mg,产率93.9%。1h nmr(300mhz,cdcl3)δ7.50-7.35(m,5h),6.73(d,j=8.3hz,1h),6.36(d,j=2.7hz,1h),6.28(dd,j=8.3,2.7hz,1h),4.37(s,2h),3.79(s,3h),3.16(br,3h).
[0052]
1-苄基-7-甲氧基-1,4-二氢喹喔啉-2,3-二酮(v-1)的合成
[0053]
将
ⅳ‑
1(100mg,0.44mmol)、草酸二乙酯(517mg,4.38mmol)依次加入单颈瓶中,140℃反应4h。tlc(展开剂pe:ea=5:1)监测反应是否完全。原料反应完全后,停止加热,冷至室温,加入乙醚(20ml)搅拌1h,抽滤得棕色固体95mg,产率76.9%。产物不经进一步纯化,直接投下一步。
[0054]
1-苄基-7-甲氧基-1,2,3,4-四氢喹喔啉(
ⅵ‑
1)的合成
[0055]
将v-1(1.00g,3.55mmol)加入到双颈瓶中,氮气保护,无水四氢呋喃(60ml)溶解,0℃下缓慢滴加1mol/l硼烷四氢呋喃络合物(8.80ml),滴加完毕搅拌30min。然后移至室温反应12h,tlc(展开剂pe:ea=2:1)监测反应是否完全。原料反应完全后,0℃滴加甲醇淬灭未反应的硼烷,无气泡产生后再搅拌20min,二氯甲烷萃取(20ml
×
3),合并有机层,水(20ml
×
3)洗涤,饱和氯化钠溶液(20ml
×
3)洗涤,无水硫酸钠干燥过夜。抽滤,滤液经减压浓缩,柱层析(pe:ea=8:1)分离,得白色固体350mg,产率38.8%。1h nmr(300mhz,cdcl3)δ7.28-7.14(m,6h),6.39(d,j=8.3hz,1h),6.14-6.00(m,2h),4.36(s,2h),3.57(s,3h),3.33(s,4h).
[0056]
4-苄基-6-甲氧基-n-(2-甲氧基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-1)的合成
[0057]
将
ⅵ‑
1(258mg,1.02mmol)溶于二氯甲烷(20ml)中,加入三乙胺(206mg,2.04mmol),0℃下缓慢滴加含2-甲氧基异氰酸酯(
ⅶ‑
1)(182mg,1.22mmol)的二氯甲烷溶液,滴加完毕,室温反应2h,tlc(展开剂pe:ea=5:1)监测反应是否完全。待原料反应完全后,减压除去溶剂,乙酸乙酯(20ml)溶解,水(20ml
×
3)洗涤,饱和氯化钠溶液(20ml
×
3)洗涤,无水硫酸钠干燥过夜。抽滤,滤液减压浓缩得白色固体294mg,产率71.6%。1h nmr(300mhz,cdcl3)δ8.30-8.25(m,1h),8.04(s,1h),7.36-7.26(m,3h),7.25-7.19(m,3h),6.99-6.94(m,2h),6.84-6.79(m,1h),6.30-6.25(m,2h),4.54(s,2h),3.93(t,j=5.0hz,2h),3.76(s,3h),3.71(s,3h),3.47(t,j=5.2hz,2h).
[0058]
6-甲氧基-n-(2-甲氧基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-1)的合成
[0059]
将1ml雷尼镍(用煤油封存)加入到100ml单颈瓶中,用无水甲醇(10ml
×
3)洗三遍,然后加入viii-1(250mg,0.62mmol),氢气置换三次,60℃反应4h,tlc监测(pe:ea=2:1)反应。反应完毕,硅藻土抽滤,减压除去溶剂,柱层析(展开剂pe:ea=5:1)纯化,得白色固体129mg,产率66.2%。1h nmr(300mhz,cdcl3)δ8.29-8.23(m,1h),8.03(s,1h),7.17(d,j=8.7hz,1h),6.98-6.91(m,2h),6.84-6.77(m,1h),6.29(dd,j=8.7,2.7hz,1h),6.18(d,j=2.7hz,1h),4.24(s,1h),3.81(t,j=4.9hz,2h),3.77(s,3h),3.75(s,3h),3.41(t,j=5.1hz,2h).13c nmr(75mhz,cdcl3)δ158.23,153.50,147.85,139.21,128.67,124.93,122.25,121.18,118.55,117.34,109.88,102.72,99.71,55.75,55.40,42.11,39.70.
[0060]
实施例2
[0061]
6-甲氧基-n-(4-甲氧基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-2)的合成
[0062][0063]
4-苄基-6-甲氧基-n-(4-甲氧基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-2)的合成
[0064]
以
ⅵ‑
1(300mg,1.18mmol)和4-甲氧基异氰酸酯(
ⅶ‑
2)(188mg,1.42mmol)为原料,操作过程同中间体viii-1,得白色固体327mg,产率68.7%。1h nmr(300mhz,cdcl3)δ7.36-7.26(m,5h),7.21(d,j=7.1hz,2h),7.13(d,j=8.2hz,1h),7.06(s,1h),6.83(d,j=8.9hz,2h),6.31-6.21(m,2h),4.54(s,2h),3.90(t,j=4.8hz,2h),3.77(s,3h),3.70(s,3h),3.46(t,j=5.2hz,2h).
[0065]
6-甲氧基-n-(4-甲氧基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-2)的合成
[0066]
以viii-2(300mg,0.74mmol)为原料,操作过程同目标化合物i-1,得白色固体162mg,产率69.9%。1h nmr(300mhz,cdcl3)δ7.31-7.26(m,2h),7.11(d,j=8.7hz,1h),7.05(s,1h),6.87-6.80(m,2h),6.28(dd,j=8.7,2.7hz,1h),6.19(d,j=2.7hz,1h),4.20(s,1h),3.81(t,j=5.0hz,2h),3.78(s,3h),3.77(s,3h),3.42(t,j=5.0hz,2h).13c nmr(75mhz,cdcl3)δ158.30,155.73,154.05,139.33,131.77,124.88,121.36,117.26,114.14,102.82,99.93,55.56,55.42,42.13,39.73.
[0067]
实施例3
[0068]
6-甲氧基-n-(4-(三氟甲氧基)苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-3)的合成
[0069][0070]
4-苄基-6-甲氧基-n-(4-(三氟甲氧基)苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-3)的合成
[0071]
以
ⅵ‑
1(300mg,1.18mmol)和4-三氟甲氧基异氰酸酯(
ⅶ‑
3)(262mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体399mg,产率74.0%。1h nmr(300mhz,cdcl3)δ7.45-7.39(m,2h),7.36-7.27(m,3h),7.25-7.22(m,2h),7.20(s,1h),7.17-7.08(m,3h),6.30-6.24(m,2h),4.54(s,2h),3.91(t,j=5.3hz,2h),3.71(s,3h),3.47(t,j=5.3hz,2h).
[0072]
6-甲氧基-n-(4-(三氟甲氧基)苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-3)的合成
[0073]
以
ⅶ‑
3(350mg,0.77mmol)为原料,操作过程同目标化合物i-1,得白色固体170mg,产率60.3%。1h nmr(300mhz,cdcl3)δ7.43-7.36(m,2h),7.23(s,1h),7.19-7.10(m,2h),7.08(d,j=8.7hz,1h),6.28(dd,j=8.7,2.7hz,1h),6.19(d,j=2.7hz,1h),4.26(s,1h),3.80(t,j=5.0hz,2h),3.77(s,3h),3.42(t,j=5.0hz,2h).13c nmr(75mhz,cdcl3)δ158.58,153.52,144.47(q,3jc-f=1.9hz),139.49,137.47,124.74,121.75,120.55(q,1jc-f=254.8hz),120.28,116.81,102.96,100.04,55.39,42.12,39.75.
[0074]
实施例4
[0075]
n-(4-氨基苯基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-4)的合成
[0076][0077]
n-(4-硝基苯基)-4-苄基-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-4)的合成
[0078]
以
ⅵ‑
1(300mg,1.18mmol)和4-硝基苯基异氰酸酯(
ⅶ‑
4)(212mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体397mg,产率70.1%。1h nmr(300mhz,cdcl3)δ8.23-8.15(m,2h),7.62-7.53(m,3h),7.38-7.29(m,3h),7.24-7.22(m,1h),7.21(s,1h),7.13-7.07(m,1h),6.32-6.26(m,2h),4.56(s,2h),3.99-3.88(m,2h),3.73(s,3h),3.50(t,j=5.3hz,2h).
[0079]
n-(4-氨基苯基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-4)的合成
[0080]
以viii-4(350mg,0.90mmol)为原料,操作过程同目标化合物i-1,得白色固体180mg,产率67.3%。1h nmr(300mhz,cdcl3)δ7.17-7.12(m,2h),7.10(d,j=8.7hz,1h),6.98(s,1h),6.68-6.60(m,2h),6.27(dd,j=8.7,2.7hz,1h),6.18(d,j=8.7hz,1h),3.84-3.74(m,5h),3.39(t,j=5.1hz,2h).13c nmr(75mhz,cdcl3)δ158.23,154.21,142.38,139.30,130.00,124.87,121.71,117.37,115.62,102.76,99.89,55.42,41.98,39.72.
[0081]
实施例5
[0082]
6-甲氧基-n-(3-甲氧基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-5)的合成
[0083]
[0084]
4-苄基-6-甲氧基-n-(3-甲氧基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-5)的合成
[0085]
以
ⅵ‑
1(300mg,1.18mmol)和3-甲氧基苯基异氰酸酯(
ⅶ‑
5)(192mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体365mg,产率76.8%。1h nmr(300mhz,cdcl3)δ7.36-7.26(m,3h),7.24-7.15(m,5h),7.14-7.09(m,1h),6.82(dd,j=8.0,1.3hz,1h),6.59(dd,j=8.2,2.3hz,1h),6.30-6.23(m,2h),4.54(s,2h),3.91(t,j=4.6hz,2h),3.80(s,3h),3.71(s,3h),3.47(t,j=5.3hz,2h).
[0086]
6-甲氧基-n-(3-甲氧基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-5)的合成
[0087]
以viii-5(350mg,0.87mmol)为原料,操作过程同目标化合物i-1,得白色固体191mg,产率70.3%。1h nmr(300mhz,cdcl3)δ7.21-7.17(m,2h),7.15(d,j=8.2hz,1h),7.09(d,j=8.7hz,1h),6.81(dd,j=8.0,1.2hz,1h),6.59(dd,j=8.3,2.4hz,1h),6.28(dd,j=8.7,2.7hz,1h),6.19(d,j=2.7hz,1h),4.20(s,1h),3.84-3.79(m,5h),3.78(s,3h),3.46-3.39(m,2h).13c nmr(75mhz,cdcl3)δ160.24,158.43,153.52,139.97,139.38,129.59,124.83,117.00,111.27,109.13,104.58,102.89,99.97,55.43,55.33,42.15,39.67.
[0088]
实施例6
[0089]
n-(2-氯乙基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-6)的合成
[0090][0091]
4-苄基-n-(2-氯乙基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-6)的合成
[0092]
以
ⅵ‑
1(300mg,1.18mmol)和氯乙基异氰酸酯(
ⅶ‑
6)(125mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体275mg,产率65.3%。1h nmr(300mhz,cdcl3)δ7.36-7.25(m,3h),7.23-7.16(m,2h),7.14-7.08(m,1h),6.27-6.20(m,2h),5.73(t,j=5.6hz,1h),4.52(s,2h),3.84(t,j=5.0hz,2h),3.70-3.62(m,5h),3.58(t,j=5.2hz,2h),3.41(t,j=5.2hz,2h).
[0093]
n-(2-氯乙基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-6)的合成
[0094]
以viii-6(250mg,0.70mmol)为原料,操作过程同目标化合物i-1,得白色固体115mg,产率61.4%。1h nmr(300mhz,cdcl3)δ7.08(d,j=8.7hz,1h),6.26(dd,j=8.7,2.7hz,1h),6.17(d,j=2.7hz,1h),5.73(t,j=5.5hz,1h),3.77-3.71(m,5h),3.67-3.61(m,2h),3.60-3.53(m,2h),3.36(t,j=5.2hz,2h).13c nmr(75mhz,cdcl3)δ158.11,156.25,139.11,124.69,117.36,102.69,99.94,55.37,44.65,42.57,42.00,39.91.
[0095]
实施例7
[0096]
6-甲氧基-n-(萘-1-基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-7)的合成
[0097][0098]
4-苄基-6-甲氧基-n-(萘-1-基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-7)的合成
[0099]
以
ⅵ‑
1(300mg,1.18mmol)和1-萘基异氰酸酯(
ⅶ‑
7)(218mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体394mg,产率78.9%。1h nmr(300mhz,cdcl3)δ8.03(d,j=7.5hz,1h),7.86-7.78(m,1h),7.72(s,1h),7.63-7.53(m,2h),7.49-7.39(m,3h),7.35-7.27(m,3h),7.27-7.19(m,3h),6.36-6.27(m,2h),4.55(s,2h),3.96(t,j=4.7hz,2h),3.70(s,3h),3.49(t,j=5.2hz,2h).
[0100]
6-甲氧基-n-(萘-1-基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-7)的合成
[0101]
以viii-7(350mg,0.83mmol)为原料,操作过程同目标化合物i-1,得白色固体201mg,产率72.7%。1h nmr(300mhz,cdcl3)δ8.01(d,j=7.5hz,1h),7.87-7.79(m,1h),7.70(s,1h),7.64-7.56(m,2h),7.50-7.41(m,3h),7.29(d,j=8.7hz,1h),6.34(dd,j=8.7,2.7hz,1h),6.24(d,j=2.7hz,1h),4.23(s,1h),3.87(t,j=5.2hz,2h),3.79(s,3h),3.46(t,j=5.2hz,2h).13c nmr(75mhz,cdcl3)δ158.56,154.34,139.51,134.16,133.57,128.81,126.79,126.10,126.00,125.79,125.04,124.39,120.48,118.81,117.21,102.93,100.07,55.46,42.12,39.96.
[0102]
实施例8
[0103]
6-甲氧基-n-(邻甲基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-8)的合成
[0104][0105]
4-苄基-6-甲氧基-n-(邻甲基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-8)的合成
[0106]
以
ⅵ‑
1(300mg,1.18mmol)和2-甲基苯基异氰酸酯(
ⅶ‑
8)(172mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体301mg,产率65.9%。1h nmr(300mhz,cdcl3)δ7.95(d,j=8.0hz,1h),7.36-7.27(m,3h),7.24-7.20(m,3h),7.18(s,1h),7.17-7.09(m,2h),7.03-6.95(m,1h),6.32-6.22(m,2h),4.56(s,2h),3.92(t,j=5.0hz,2h),3.71(s,3h),3.48(t,j=5.2hz,2h),2.07(s,3h).
[0107]
6-甲氧基-n-(邻甲基苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-8)的合成
[0108]
以viii-8(250mg,0.65mmol)为原料,操作过程同目标化合物i-1,得白色固体133mg,产率68.8%。1h nmr(300mhz,cdcl3)δ7.94(d,j=8.1hz,1h),7.24-7.14(m,3h),
7.11(d,j=7.4hz,1h),7.02-6.94(m,1h),6.28(dd,j=8.7,2.7hz,1h),6.20(d,j=2.7hz,1h),4.22(s,1h),3.82(t,j=5.0hz,2h),3.77(s,3h),3.43(t,j=5.0hz,2h),2.08(s,3h).13c nmr(75mhz,cdcl3)δ158.46,153.94,139.38,136.91,130.31,127.43,126.88,125.03,123.55,121.08,117.21,102.72,99.92,55.41,42.01,39.82,17.91.
[0109]
实施例9
[0110]
6-甲氧基-n-(2-(三氟甲基)苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-9)的合成
[0111][0112]
4-苄基-6-甲氧基-n-(2-(三氟甲基)苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-9)的合成
[0113]
以
ⅵ‑
1(300mg,1.18mmol)和2-三氟甲基苯基异氰酸酯(
ⅶ‑
9)(241mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体393mg,产率75.6%。1h nmr(300mhz,cdcl3)δ8.22(d,j=8.6hz,1h),7.69(s,1h),7.57-7.50(m,2h),7.36-7.26(m,3h),7.23-7.09(m,4h),6.32-6.22(m,2h),4.56(s,2h),3.97-3.87(m,2h),3.71(s,3h),3.47(t,j=5.3hz,2h).
[0114]
6-甲氧基-n-(2-(三氟甲基)苯基)-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-9)的合成
[0115]
以viii-9(350mg,0.79mmol)为原料,操作过程同目标化合物i-1,得白色固体162mg,产率58.5%。1h nmr(300mhz,cdcl3)δ8.22(d,j=8.7hz,1h),7.68(s,1h),7.57-7.48(m,2h),7.18-7.08(m,2h),6.30(dd,j=8.7,2.7hz,1h),6.19(d,j=2.7hz,1h),4.21(s,1h),3.83(t,j=5.0hz,2h),3.77(s,3h),3.48-3.40(m,2h).13c nmr(75mhz,cdcl3)δ158.72,153.66,139.39,136.58(q,3jc-f=1.9hz),132.78,125.90(q,3jc-f=5.4hz),125.12,124.10(q,1jc-f=271.2hz),123.54,123.05,119.46(q,2jc-f=29.0hz),116.43,102.78,99.95,55.39,42.00,40.10.
[0116]
实施例10
[0117]
n-(2,5-二甲氧基苯基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-10)的合成
[0118][0119]
4-苄基-n-(2,5-二甲氧基苯基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-10)的合成
[0120]
以
ⅵ‑
1(300mg,1.18mmol)和2,5-二甲氧基苯基异氰酸酯(
ⅶ‑
10)(231mg,
1.29mmol)为原料,操作过程同中间体viii-1,得白色固体342mg,产率66.9%。1h nmr(300mhz,cdcl3)δ8.09(s,1h),8.04(d,j=3.0hz,1h),7.36-7.27(m,3h),7.26-7.17(m,3h),6.73(d,j=8.9hz,1h),6.49(dd,j=8.8,3.0hz,1h),6.31-6.25(m,2h),4.55(s,2h),3.93(t,j=4.9hz,2h),3.80(s,3h),3.71(s,3h),3.71(s,3h),3.48(t,j=5.1hz,2h).
[0121]
n-(2,5-二甲氧基苯基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-10)的合成
[0122]
以viii-10(300mg,0.69mmol)为原料,操作过程同目标化合物i-1,得白色固体157mg,产率66.5%。1h nmr(300mhz,cdcl3)δ8.07(s,1h),8.02(d,j=3.0hz,1h),7.15(d,j=8.7hz,1h),6.72(d,j=8.9hz,1h),6.47(dd,j=8.9,3.0hz,1h),6.29(dd,j=8.7,2.6hz,1h),6.18(d,j=2.6hz,1h),4.23(s,1h),3.84-3.77(m,5h),3.76(s,3h),3.70(s,3h),3.41(t,j=5.0hz,2h).13c nmr(75mhz,cdcl3)δ158.30,154.12,153.41,142.04,139.22,129.49,124.91,117.18,110.91,107.21,104.51,102.73,99.72,56.44,55.78,55.39,42.09,39.68.
[0123]
实施例11
[0124]
n-(2,6-二甲基苯基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-11)的合成
[0125][0126]
4-苄基-n-(2,6-二甲基苯基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-11)的合成
[0127]
以
ⅵ‑
1(300mg,1.18mmol)和2,6-二甲基苯基异氰酸酯(
ⅶ‑
11)(190mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体347mg,产率73.3%。1h nmr(300mhz,cdcl3)δ7.36-7.28(m,2h),7.26-7.19(m,4h),7.05(s,3h),6.57(s,1h),6.31(d,j=2.5hz,1h),6.25(dd,j=8.5,2.5hz,1h),4.58(s,2h),3.90(t,j=5.2hz,2h),3.70(s,3h),3.46(t,j=5.2hz,2h),2.23(s,6h).
[0128]
n-(2,6-二甲基苯基)-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-11)的合成
[0129]
以viii-11(300mg,0.75mmol)为原料,操作过程同目标化合物i-1,得白色固体162mg,产率69.3%。1h nmr(300mhz,cdcl3)δ7.21(d,j=8.6hz,1h),7.05(s,3h),6.58(s,1h),6.26(dd,j=8.7,2.7hz,1h),6.19(d,j=2.7hz,1h),3.79(t,j=5.2hz,2h),3.75(s,3h),3.39(t,j=5.2hz,2h),2.23(s,6h).13c nmr(75mhz,cdcl3)δ158.32,154.93,139.23,135.77,134.86,128.17,126.83,125.33,117.76,102.74,100.01,55.40,42.10,40.25,18.63.
[0130]
实施例12
[0131]
n-环己基-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-12)的合成
[0132][0133]
4-苄基-n-环己基-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-12)的合成
[0134]
以
ⅵ‑
1(300mg,1.18mmol)和环己基异氰酸酯(
ⅶ‑
12)(161mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体353mg,产率78.9%。1h nmr(300mhz,cdcl3)δ7.35-7.28(m,2h),7.26-7.16(m,3h),7.02(d,j=8.3hz,1h),6.26-6.17(m,2h),5.13(d,j=7.8hz,1h),4.52(s,2h),3.83(t,j=5.0hz,2h),3.76-3.62(m,4h),3.40(t,j=5.2hz,2h),1.98-1.87(m,2h),1.73-1.66(m,1h),1.62-1.53(m,1h),1.45-1.24(m,3h),1.22-1.03(m,3h).
[0135]
n-环己基-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-12)的合成
[0136]
以viii-12(300mg,0.79mmol)为原料,操作过程同目标化合物i-1,得白色固体169mg,产率74.1%。1h nmr(300mhz,cdcl3)δ7.00(d,j=8.6hz,1h),6.23(dd,j=8.6,2.7hz,1h),6.16(d,j=2.6hz,1h),5.14(d,j=7.6hz,1h),4.23(s,1h),3.81-3.60(m,6h),3.42-3.29(m,2h),1.99-1.86(m,2h),1.72-1.52(m,3h),1.44-1.25(m,2h),1.21-1.01(m,3h).13c nmr(75mhz,cdcl3)δ157.80,155.81,139.10,124.73,117.85,102.56,99.78,55.33,49.43,41.89,39.74,33.56,25.64,24.90.
[0137]
实施例13
[0138]
n-乙基-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-13)的合成
[0139][0140]
4-苄基-n-乙基-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-13)的合成
[0141]
以
ⅵ‑
1(300mg,1.18mmol)和异氰酸乙酯(
ⅶ‑
13)(92mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体296mg,产率77.1%。1h nmr(300mhz,cdcl3)δ7.36-7.24(m,3h),7.23-7.17(m,2h),7.03(dd,j=7.7,1.2hz,1h),6.26-6.18(m,2h),5.23(t,j=5.3hz,1h),4.52(s,2h),3.84(t,j=5.2hz,2h),3.69(s,3h),3.41(t,j=5.2hz,2h),3.34-3.24(m,2h),1.13(t,j=7.2hz,3h).
[0142]
n-乙基-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-13)的合成
[0143]
以viii-13(250mg,0.77mmol)为原料,操作过程同目标化合物i-1,得白色固体115mg,产率63.3%。1h nmr(300mhz,cdcl3)δ7.01(d,j=8.6hz,1h),6.24(dd,j=8.7,2.7hz,1h),6.16(d,j=2.7hz,1h),5.23(t,j=5.4hz,1h),4.18(s,1h),3.80-3.70(m,5h),3.39-3.22(m,4h),1.11(t,j=7.2hz,3h).13c nmr(75mhz,cdcl3)δ157.94,156.63,139.17,124.90,117.83,102.56,99.79,55.37,42.03,39.84,35.67,15.43.
[0144]
实施例14
[0145]
n-叔丁基-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-14)的合成
[0146][0147]
4-苄基-n-叔丁基-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-14)的合成
[0148]
以
ⅵ‑
1(300mg,1.18mmol)和叔丁基异氰酸酯(
ⅶ‑
14)(128mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体333mg,产率80.3%。1h nmr(300mhz,cdcl3)δ7.36-7.25(m,3h),7.22-7.17(m,2h),7.01(d,j=8.3hz,1h),6.24-6.17(m,2h),5.19(s,1h),4.53(s,2h),3.80(t,j=5.1hz,2h),3.69(s,3h),3.40(t,j=5.1hz,2h),1.34(s,9h).
[0149]
n-叔丁基-6-甲氧基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-14)的合成
[0150]
以viii-14(300mg,0.85mmol)为原料,操作过程同目标化合物i-1,得白色固体161mg,产率72.7%。1h nmr(300mhz,cdcl3)δ6.99(d,j=8.7hz,1h),6.23(dd,j=8.6,2.7hz,1h),6.16(d,j=2.6hz,1h),5.20(s,1h),4.26(s,1h),3.75(s,3h),3.69(t,j=4.8hz,2h),3.39-3.31(m,2h),1.33(s,9h).13c nmr(75mhz,cdcl3)δ157.77,155.65,139.07,124.76,118.11,102.59,99.77,55.29,50.79,42.02,39.38,29.30.
[0151]
实施例15
[0152]
6-甲氧基-n-对甲基苯基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-15)的合成
[0153][0154]
4-苄基-6-甲氧基-n-对甲基苯基-3,4-二氢喹喔啉-1(2h)-甲酰胺(viii-15)的合成
[0155]
以
ⅵ‑
1(300mg,1.18mmol)和4-甲基苯基异氰酸酯(
ⅶ‑
15)(165mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体306mg,产率67.4%。1h nmr(300mhz,cdcl3)δ7.36-7.26(m,5h),7.24-7.19(m,2h),7.15-7.06(m,4h),6.29-6.22(m,2h),4.54(s,2h),3.91(t,j=4.9hz,2h),3.70(s,3h),3.46(t,j=5.3hz,2h),2.29(s,3h).
[0156]
6-甲氧基-n-对甲基苯基-3,4-二氢喹喔啉-1(2h)-甲酰胺(i-15)的合成
[0157]
以viii-15(300mg,0.78mmol)为原料,操作过程同目标化合物i-1,得白色固体155mg,产率67.1%。1h nmr(300mhz,cdcl3)δ7.28-7.26(m,1h),7.25-7.22(m,1h),7.14-7.04(m,4h),6.26(dd,j=8.7,2.7hz,1h),6.17(d,j=2.7hz,1h),4.30(s,1h),3.78(t,j=4.8hz,2h),3.75(s,3h),3.42-3.33(m,2h),2.28(s,3h).13c nmr(75mhz,cdcl3)δ158.35,153.85,139.46,136.09,132.66,129.46,124.84,119.45,117.12,102.79,99.93,55.40,
7.27(m,1h),7.00(s,1h),6.85(d,j=8.9hz,2h),4.34(s,1h),3.90(s,3h),3.85(t,j=4.8hz,2h),3.78(s,3h),3.51-3.44(m,2h).13c nmr(75mhz,dmso)δ166.89,155.32,154.05,138.03,133.19,129.42,124.84,122.69,122.00,116.82,115.21,114.12,55.63,52.21,41.77,41.49.
[0172]
实施例17
[0173]
1-((4-甲基苯基)氨基甲酰基)-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(i-17)的合成
[0174][0175]
4-苄基-1-((4-甲基苯基)氨基甲酰基)-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(viii-17)的合成
[0176]
以
ⅵ‑
2(330mg,1.17mmol)和4-甲基苯基异氰酸酯(
ⅶ‑
15)(172mg,1.29mmol)为原料,操作过程同中间体viii-1,得白色固体285mg,产率58.8%。1h nmr(300mhz,cdcl3)δ7.46(d,j=1.5hz,1h),7.41-7.23(m,9h),7.14-7.06(m,3h),4.63(s,2h),3.93(t,j=5.0hz,2h),3.85(s,3h),3.48(t,j=5.1hz,2h),2.30(s,3h).
[0177]
1-((4-甲基苯基)氨基甲酰基)-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(i-17)的合成
[0178]
以viii-17(280mg,0.67mmol)为原料,操作过程同目标化合物i-1,得白色固体107mg,产率48.7%。1h nmr(300mhz,cdcl3)δ7.39-7.33(m,2h),7.29-7.24(m,3h),7.10(d,j=8.3hz,2h),7.05(s,1h),3.90(s,3h),3.85(t,j=4.8hz,2h),3.48(t,j=5.1hz,2h),2.30(s,3h).13c nmr(75mhz,cdcl3)δ166.75,152.85,136.98,135.60,133.18,129.56,128.23,127.36,122.83,119.59,118.77,116.71,52.21,42.12,39.41,20.80.
[0179]
下面是本发明所述的部分药理实验及结果:
[0180]
应用例1:对肿瘤细胞的增殖抑制实验(mtt实验)
[0181]
测试本发明所述化合物对人慢性髓系白血病细胞(k562)、人肝癌细胞(hepg2)、人乳腺癌细胞(mcf-7)和人宫颈癌细胞(hela)的细胞增殖抑制活性。以上细胞株均由本实验室冻存和传代。取对数生长期的肿瘤细胞以4000~5000个/孔接种于96孔板,24h后加入不同浓度的目标化合物或对照药(选取化合物abt-751为阳性对照药),37℃、5%co2培养72h。每孔加入mtt溶液50μl(5mg/ml),继续培养4h后弃去培养基和mtt溶液。每孔加入100μl dmso溶液,震荡后用酶标仪在570nm波长处测其吸光度(od值),计算细胞抑制率:生长抑制率=(od对照-od实验)/(od对照-od空白)
×
100%(od对照、od实验及od空白分别表示各组的平均光吸收值),然后使用graphpad软件拟合化合物的ic
50
。
[0182]
实验结果
[0183]
实验结果如表1所示,结果显示部分化合物具有较强的增殖抑制活性。其中化合物i-6和i-10对部分肿瘤细胞的增殖抑制活性与阳性药abt-751相当甚至优于阳性药abt-751。
[0184]
a:ic
50
﹤20μm,b:20《ic
50
《100μm,c:ic
50
》100μm
[0185]
表1化合物对肿瘤细胞的增殖抑制活性数据
[0186][0187]
应用例2:细胞周期实验
[0188]
取对数生长期的hela细胞,以合适浓度均匀接种于6孔板中,于37℃、5%co2下孵育24h,每孔加入不同浓度的待测化合物,继续孵育24h。收集细胞,离心(1000r/min,10min)。弃去上清液,加500μl预冷的pbs溶液,吹打均匀,缓慢垂直滴入10ml预冷的70%(v/v)乙醇中。置于-20℃下固定48h。离心(1000r/min,10min)。弃去上清液,加1ml预冷的pbs溶液,离心(1000r/min,10min),弃去上清液。每个样品加入500μl的染色剂(50μg/ml的pi和100μg/ml的rnasea),4℃避光孵育1h,离心(1000r/min,10min),弃去染料。加1ml预冷的pbs溶液,离心(1000r/min,10min),弃去上清液。加入500μl的pbs溶液重悬,用300目筛网过滤,使用流式细胞仪于580nm处检测。
[0189]
实验结果
[0190]
化合物i-6(zln-06)和i-10(zln-11)可以将细胞阻滞在g2/m期,如图1所示,与对照组相比,化合物显著增加处于g2/m期细胞的数量,降低g0/g1期细胞的数量。
[0191]
应用例3:免疫荧光实验
[0192]
取对数生长期的hela细胞,均匀接种于96孔板中,37℃、5%co2下孵育24h,每孔加入不同浓度的待测化合物,继续孵育24h,弃去溶液,pbs洗三次。每孔各加入50μl 3.7%的多聚甲醛,25℃避光固定5min,弃去多聚甲醛,pbs洗一次。每孔加入50μl 0.1%的triton x-100,25℃孵育10min,pbs洗三次。每孔加入50μl 1%的bsa,25℃孵育1h,弃去溶液,pbs洗三次。每孔加入50μl配制好的β-tubulin一抗(β-tubulin:1%bsa=1:100),置于4℃冰箱过夜。回收一抗,pbs洗三次,每孔加入50μl配置好的有cy3标记的二抗(cy3标记二抗:1%bas=1:100),25℃避光孵育2h后,回收二抗,pbs洗三次。然后每孔加入50μl浓度为10μg/ml的hoechst 33342,室温条件下避光孵育25min后,弃去染料,pbs洗三次,在免疫荧光显微镜下观察细胞内微管蛋白的形态,拍照记录。
[0193]
实验结果
[0194]
化合物i-6(zln-06)在细胞水平上抑制微管的聚合,干扰微管的动态平衡,作用方式与秋水仙碱位点抑制剂ca-4一致,如图2所示,说明化合物与ca-4一样,作用于秋水仙碱位点,属于微管聚合抑制剂。
[0195]
应用例4:i-6与微管的对接图
[0196]
利用maestro11.5软件进行分子对接研究化合物与微管的结合模式。首先从pdb数据库中下载秋水仙碱与微管的共晶复合物(pdb:1sa0),通过蛋白质准备选项给蛋白加氢、去水、补充缺失的残基或片段、进行能量最小化。随后通过软件推荐的标准操作,利用受体网格生成选项生成网格。通过opls3力场对化合物加氢、生成3d结构、离子化和优化,然后利用glide docking中标准精确模式进行分子对接。
[0197]
实验结果
[0198]
分子对接结果显示四氢喹喔啉环占据秋水仙碱结合位点的一个疏水空腔,同时环上的nh与β微管蛋白lys352形成氢键作用,脲基上的羰基与β微管蛋白cys241的侧链巯基形成氢键作用,如图3所示。对接结果表明与传统的秋水仙碱结合位点抑制剂相比,脲基化合物与微管蛋白的结合方式有很大区别,化合物未与α微管蛋白的t5 loop形成氢键作用,而是占据秋水仙碱位点的深处,揭示了化合物与微管蛋白新的作用模式,这种作用模式可能有利于增强化合物对肿瘤细胞的增殖抑制活性,提高化合物的抗肿瘤效果。
[0199]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。