1.本发明属于蛋白质组学研究方向蛋白质组亲和富集研究领域,尤其涉及一种活细胞作为基质,利用细胞质膜的屏障作用以及细胞表面蛋白质与生物分析广泛的相互作用来对生物样本进行高灵敏度亲和富集分析的方法。
背景技术:
2.传统的免疫亲和色谱技术,是一种利用抗原和抗体特异性可逆结合的亲和富集方法,为应用最成熟的研究非共价结合相互作用蛋白质组的蛋白质组学技术。通过将待研究的分子的抗体以合理的分子构象偶联于固定相表面,可以方便地对与其相互作用蛋白质进行选择性富集和洗脱操作。该方法操作简单,快捷,富集效率高,但是抗体昂贵的价格在一定程度上限制了其广泛使用,且该方法仅限于特定蛋白质的亲和富集和纯化。上个世纪九十年代,人们利用免疫细胞表面主要组织相容性复合物ⅰ类分子(mhcⅰ)与肿瘤抗原肽的亲和作用成功的利用酸洗脱的方式洗脱直接从免疫细胞得到相应的肿瘤抗原肽,为找出高效肿瘤抗原肽疫苗,为癌症的治疗和预防奠定基础(sugawara,s.;abo,t.;kumagai,k.,j.immunol.methods 1987,100(1-2),83-90.;falk,k.;rotzschke,o.;rammensee,h.g.,nature 1990,348(6298),248-251.)。细胞质膜由磷脂质双层分子作为基本单位重复而成,其上镶嵌有各种类型的膜蛋白以及与膜蛋白结合的糖和糖脂,为细胞内外环境的分界。细胞表面上的蛋白大部分为受体蛋白、转运蛋白、通道蛋白、酶等,与生物体内的各种各样的分子存在广泛的相互作用,并在许多细胞生物学过程发挥重要的调控作用,如细胞内外的信号转导、物质交换、细胞的迁移等(damaris bausch-flucka;ulrich goldmanna;sebastian m
ü
llera;marc van oostrum;maik m
ü
llera;olga t.schuberta;wollscheid,b.,proceedings of the national academy of sciences of the united states of america 2018,115(46),10)。超过60%药物靶标为细胞表面,因此,细胞表面蛋白也成为疾病诊断和治疗的生物标志物筛选的宝库。此外,细胞表面蛋白也常被作为生物标志物分子用于细胞的分离,分类等(li,y.;qin,h.;ye,m.,.j.sep.sci.2019.)。目前很多信号分子为亲水性的,通过与细胞表面蛋白结合来完成细胞-细胞或者细胞-环境间的转导信号。大部分分子,包括水分子,需要细胞质膜的参与来进入或者转出细胞。在多细胞生物体系中,不同的细胞有着其特殊的生物学功能,其细胞质膜蛋白组成也有所不同,从而对相同的生物样品有着不同的相互作用蛋白组。借助于细胞表面蛋白与生物分子广泛的相互作用可以细胞特异性的亲和富集待分析样品,降低待分析样品的复杂度,提高对相互作用的生物分子,尤其是低丰度的生物分子的检测能力。
3.综上所述,我们拟将活细胞作为富集基质,利用细胞质膜的屏障作用以及细胞表面蛋白质与生物分子广泛的相互作用实现与细胞表面蛋白质亲和作用的生物分子的高选择性和高灵敏度富集分析。
技术实现要素:
4.本发明的目的在于提供一种活细胞作为基质,操作简单,成本低,选择性好,灵敏度高的亲和富集策略。利用细胞质膜的屏障作用以及细胞表面蛋白质与生物分析广泛的相互作用可以实现生物样本的高灵敏度分析,可以克服传统的亲和色谱富集材料制备复杂,价格昂贵,可分析蛋白种类有限等缺点,具有广泛的应用价值。
5.一种活细胞作为基质,利用细胞质膜的屏障作用以及细胞表面蛋白质与生物分子广泛的相互作用来对生物样本进行高选择性,高灵敏度亲和富集分析的方法。
6.该方法的步骤为:
7.a.培养细胞;
8.b.移除细胞培养体系中的培养基或取出细胞培养体系中的细胞;
9.c.于移除培养基的细胞培养体系中加入待分析溶液或将取出的细胞与待分析溶液混合;
10.d.孵育,移去孵育体系中的待分析溶液或取出孵育体系中的细胞;
11.e.对保留在活细胞表面的生物分子进行检测分析。
12.所述步骤a的细胞为具有完整质膜结构的活细胞,组织等中的一种或二种。
13.所述步骤c中的待分析样品可以为含有待分析药物、肽段、蛋白质及其它可能与细胞表面蛋白质有相互作用的物质中的一种或二种以上的体系,或者可以为血清,尿液,汗液、泪液等体液样本中的一种或二种以上;但不局限于以上这些体系。
14.所述步骤b-d应该避免细胞质膜结构完整性的破坏。步骤b中移除细胞培养体系中的培养基或取出细胞培养体系中的细胞后,细胞不进行清洗,或可以对细胞进行清洗;步骤d中移去孵育体系中的待分析溶液或取出孵育体系中的细胞后,可以对细胞进行清洗;步骤d的清洗操作应该尽量去除未与活细胞体系发生亲和作用的其他分子,但是尽量避免对生物分子与细胞表面蛋白的相互作用的破坏。步骤b和d的清洗溶液可以为ph为6-9的磷酸盐缓冲溶液,ph为6-9的tbs缓冲盐溶液,0.9%的生理盐水,ph为6-9的1640、dmem等培养基溶液中的一种或两种以上;优选,清洗溶液为ph 7.4的pbs溶液。
15.所述步骤c应使待分析样品溶液均匀覆盖细胞,步骤d中的孵育温度可以为4℃-37℃,孵育时间可以为10秒-1小时。
16.所述步骤e对与细胞的细胞表面蛋白发生相互作用的生物分子进行检测分析的方式为下述中的一种或二种以上:方式一:通过破坏分析物与细胞表面蛋白质之间的亲和作用而将生物分子洗脱下来进行蛋白质组学分析;方式二:通过化学探针选择性标记暴露在细胞表面蛋白质及其相互作用的生物分子,结合定量技术对生物分子进行分析;方式三:通过生物酶选择性酶切暴露在细胞表面的蛋白质及其相互作用的生物分析,收集酶切下来的肽段后结合定量技术对生物分子进行分析;但不局限于以上三种检测分析方式。其中,方式一中的洗脱溶液应可以破坏生物分子与细胞表面蛋白之间的相互作用,但是避免对细胞质膜结构完整性的破坏而引入细胞胞质内蛋白质的干扰,洗脱溶液可以为柠檬酸-磷酸盐缓冲溶液体系(ph2.0-4.0),0.01%-1%三氟乙酸(0.9%氯化钠(每100毫升溶液中加入0.9克氯化钠)),0.01%-1%甲酸(0.9%氯化钠(每100毫升溶液中加入0.9克氯化钠))中的一种或两种以上,但不局限于这几种洗脱体系;方式二中的化学探针可以选择性的与暴露在细胞表面的生物分子发生反应;方式二中的化学探针可以为双功能或多功能探针,探针上带
有的功能基团如:带有n-羟基琥珀酰亚胺(nhs)基团、酰肼基团、光交联基团、巯基、酚羟基、芳香叠氮基等中的一种或二种以上可与暴露在细胞表面的生物分子上的氨基、羧基、糖链等中的一种或二种以上发生共价反应的反应基团,带有生物素、点击化学反应基团、荧光基团等中的一种或二种以上捕获基团;方式三中的生物酶可以选择性的酶切暴露在细胞表面的生物分子,但是尽量避免对完整细胞质膜结构的影响;方式三中的生物酶可以为胰蛋白酶、蛋白酶k、糜蛋白酶、胃蛋白酶、胞内蛋白酶lys-c、蛋白内切酶glu-c等中一种或两种以上,但不局限于这几种酶。
17.所述蛋白质组学分析方式包括凝胶电泳技术分析,免疫印迹分析,免疫荧光分析以及定量蛋白质组学分析。但不局限于这些分析方式。
18.所述定量技术分析方法包括标记定量技术(如稳定同位素二甲基标记法、串联质谱标签法(tmt)和等重同位素标签标记法(itraq)、同位素标记亲和标签法(icat)、细胞培养稳定同位素技术(silic)等)、无标记定量技术(包括非靶向蛋白组学定量技术和靶向蛋白质组学定量技术,如选择反应监测技术(srm)、多重反应监测技术(mrm)、平行反应监测技术(prm)、swath/dia(sequential window acquisition of all theoretical fragment ions/data independent acquisition)等。但不局限于这些分析方式。
19.本发明公开了一种活细胞作为基质亲和富集分析方法,具体涉及一种利用细胞质膜的屏障作用以及暴露在细胞表面的蛋白质与生物分子之间广泛的相互作用来选择性亲和富集生物分子的方法。向一定数量的活细胞中加入待分析样品溶液。孵育一段时间后,经过温和的清洗,孵育溶液中与暴露在细胞表面的蛋白质存在相互作用的生物分子由于亲和作用而可能被保留在细胞上。通过对保留在活细胞表面的生物分子进行选择性分子从而实现低丰度生物分子的高灵敏度检测分析:1)通过破坏分析物与细胞表面蛋白质之间的亲和作用而将生物分子洗脱下来进行蛋白质组学分析;2)通过化学探针选择性标记暴露在细胞表面蛋白质及其相互作用的生物分子,结合定量技术对生物分子进行分析;3)通过生物酶选择性酶切暴露在细胞表面的蛋白质及其相互作用的生物分子,收集酶切下来的肽段后结合定量技术对生物分子进行分析。该方法一方面得益于细胞质膜的屏障作用,另一方面得益于细胞表面蛋白质的特殊组成,即很多细胞表面蛋白质为受体蛋白质,转运蛋白质,离子通道蛋白质,酶等,与生物分子具有广泛的相互作用,从而有望利用活细胞作为富集基质实现对生物分子的选择性高灵敏度检测分析。该方法操作简单,价格低廉,选择性好,可以实现对生物分子的高灵敏度分析,具有广泛的应用价值。
20.本发明具有如下优点:
21.1.操作简单,成本低。不需要传统亲和色谱技术的富集分子的纯化、固载等,此技术富集基质为活细胞,可以通过细胞培养大量获得,成本低。
22.2.灵敏度高,可以实现对生物分子的细胞特异的亲和富集分析。生理条件下,细胞表面蛋白质与生物样品存在广泛的相互作用,待分析样本中与细胞表面蛋白之间发生亲和作用的分子实现富集而被检测,可以大大降低样品复杂度,有利于低丰度相互作用分子的富集分析。
23.3.通量高。该方法允许多个样本的同时富集分析。
附图说明
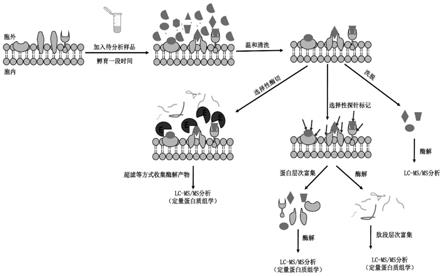
24.图1为所述将活细胞作为富集基质,利用细胞质膜的屏障作用以及细胞表面蛋白质与生物分子广泛的相互作用对生物样品进行亲和富集分析(cellap)的流程图。
25.图2说明cellap方法可以特异性的捕获与细胞表面蛋白质存在亲和作用的生物分子。已知生物分子胰岛素(2a)、转铁蛋白(2b)和曲妥珠单抗(2c)可以分别和细胞表面受体蛋白质胰岛素受体、转铁蛋白质受体以及人表皮生长因子受体-2存在相互作用,因此理论上可能与细胞表面受体蛋白质的亲和作用而被截留于细胞表面,接着被氨基反应的化学探针(ez-link
tm sulfo-nhs-ss-biotin)成功标记带上生物素捕获标签,结合亲和富集和超滤管辅助酶解,实现生物分子的富集分析。对照组中没有加入相应生物分子(胰岛素、转铁蛋白和曲妥珠单抗),因此亲和富集样品中的生物分子的丰度理论上应低于上述实验组亲和富集样品。每个样品进行了三次质谱运行准备进行无标记定量(label-free quantification,lfq)结果分析。无标记定量分析由maxquant软件version 1.3.0.5中进行检索并在perseus软件进行数据分析。经过benjamini-hochberg方法进行two-sample t检验分析发现,胰岛素(2a)、转铁蛋白(2b)和曲妥珠单抗(2c)(圆圈内数据点,即图2d中列出的蛋白质)在实验组中的丰度发生显著性(p-value《0.0001)上调(差异变化倍数分别为44.5倍,206倍,22(igkc)和28(ighg1,ighg3)倍)。如图2d所示,相比较对照组,胰岛素、转铁蛋白和曲妥珠单抗无标记定量值显著上调。以上结果说明cellap方法成功实现了与细胞表面蛋白质存在亲和作用的胰岛素、转铁蛋白以及曲妥珠单抗的选择性富集分析。
26.图3说明cellap结合无标记定量分析可以实现复杂样品的低丰度蛋白质的高灵敏检测。生物样品蛋白质组分含量动态范围极宽,如常见血清蛋白质组包含的高丰度蛋白与低丰度蛋白之间的浓度差异在10个数量级以上。因此,蛋白质组学的研究急需发展高通量和高灵敏度的分离和检测技术。这里我们利用cellap技术结合无标记定量分析方法用于人正常血清样品中低丰度蛋白质的富集分析。其中以同样蛋白质浓度的bsa样品溶液作为对照组。每个样品进行了三次质谱运行准备进行无标记定量(label-free quantification,lfq)结果分析。无标记定量分析由maxquant软件version 1.3.0.5中进行检索并在perseus软件进行数据分析。经过benjamini-hochberg方法进行two-sample t检验分析发现,如图3a可以看到与bsa阴性对照组相比,血清孵育组共定量到71个(右上第一象限虚线框内,在血清处理组的丰度变化倍数大于等于2,即log2fc大于等于1)显著性差异(p value小于等于0.05,即-log10 p-value大于等于1.3)的蛋白质(p value《0.05,ratio》2),其中49个在人血清数据库(plasma proteome database,http://www.plasmaproteomedatabase.org/)中既有质谱鉴定信息又有浓度信息(图3b),22个只有质谱鉴定信息,无浓度信息。如图3b,49个有浓度信息的血清蛋白中15个仅在cellap方法中定量到(图3b十字架标识,蛋白质基因名和人血清数据库中该蛋白质在血清中的浓度列举于图3c),而在血清全蛋白质组分析中没有鉴定到,且大部分蛋白质在实际血清样本中的浓度在g/ml以下(图3c),以上结果说明cellap结合无标记定量技术可以实现血清样本中低丰度血清蛋白质的富集分析。
27.图4说明cellap结合二甲基标记定量分析可以实现血清的低丰度蛋白的高灵敏检测。这里我们利用cellap技术结合无标记定量分析方法用于人正常血清样品中低丰度蛋白质的富集分析。其中以同样蛋白质浓度的bsa样品溶液作为对照组。定量方式为二甲基标记技术。实验进行了两次生物学重复,如图4a所示,横、纵坐标值为相比较对照组蛋白质在血
清孵育组的丰度差异变化倍数变化。可以看到,与bsa处理组相比,血清孵育组两次生物学重复共同定量到39个显著性差异蛋白(在两次生物学重复血清处理组的丰度变化倍数均大于等于2,即横纵坐标轴log2fc值均大于等于1,右上第一象限虚线框内),其中24个在人血清数据库(plasma proteome database,http://www.plasmaproteomedatabase.org/)中有既有质谱鉴定信息又有浓度信息(图4b),15个只有质谱鉴定信息,无浓度信息。如图4b,22个只有质谱鉴定信息,无浓度信息。如图4b所示,24个有浓度信息的血清蛋白中3个(图4b十字架标识,蛋白质基因名和人血清数据库中该蛋白质在血清中的浓度列举于图4c)仅在cellap方法中定量到,而在血清全蛋白质组分析中没有鉴定到。以上结果说明cellap结合二甲基标记定量技术可以实现血清样本中低丰度血清蛋白的富集分析。
具体实施方式
28.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
29.图1为所述将活细胞作为富集基质,利用细胞质膜的屏障作用以及细胞表面蛋白质与生物分子广泛的相互作用对生物样品进行亲和富集分析(cellap)的流程图:
30.向活细胞体系中加入待分析样品溶液,孵育一段时间后,经过温和的清洗以去除与细胞表面的蛋白质未发生相互作用的生物分子,这样与细胞表面发生相互作用的蛋白质被选择性保留在活细胞表面。接着,或通过一定的洗脱条件将发生亲和作用保留的生物分子直接洗脱下来进行蛋白质组学分析;或加入适量生物酶选择性酶切暴露在细胞表面的生物分子,收集酶切肽段进行定量技术分析;或加入化学探针选择性标记暴露在细胞表面的生物分子,经过蛋白层次或者肽段层次富集以及定量技术,从而实现与细胞表面蛋白质发生亲和作用的生物分子的分析。
31.本发明实施例提供的将活细胞作为富集基质,利用细胞质膜的屏障作用以及细胞表面蛋白质与生物分子广泛的相互作用实现与细胞表面蛋白质亲和作用的生物分子的高选择性和高灵敏度富集分析方法具体实施例如下:
32.实施例1
33.对于胰岛素(insulin,sigma-aldrich,货号:i9278)或者转铁蛋白(holo-transferrin,sigma-aldrich,货号:t0665),hela细胞培养至覆盖10厘米培养皿面积的80%后,pbs磷酸盐缓冲液(内含0.01m磷酸二氢钠、0.15m氯化钠,ph 7.4,余量为水,预先平衡至37℃)洗涤三次,分别加入5毫升含有200纳摩胰岛素或者5微克/毫升转铁蛋白的rpmi 1640培养基(预先平衡至37℃)37℃孵育5分钟,作为实验组。同时,向上述洗涤后的hela细胞培养皿中加入5毫升不含胰岛素和转铁蛋白质的rpmi1640培养基(预先平衡至37℃)37℃孵育5分钟,作为对照组。对于曲妥珠单抗(trastuzumab,selleck,货号:a2007),bt474细胞培养至覆盖10厘米培养皿面积的80%后,pbs洗涤三次,分别加入5微克/毫升曲妥珠单抗的rpmi1640培养基(预先平衡至37℃,实验组)或者同样体积5微克/毫升免疫球蛋白g的rpmi1640培养基(预先平衡至37℃,对照组)37℃孵育5分钟。
34.接下来,10毫升4℃预冷的pbs洗涤两次,分别加入预冷的含有0.25毫克/毫升ez-link
tm sulfo-nhs-ss-biotin(thermo fisher scientific,货号:21331)的pbs,4℃脱色摇
床上缓慢震摇孵育30分钟,加入4℃预冷的终止溶液,即含100毫摩甘氨酸的pbs溶液,洗涤两次,分别加入1毫升4℃预冷的含有终体积浓度2%蛋白酶抑制剂混合物(内含aebsf、aprotinin、bestatin hydrochloride、e-64、leupeptin hemisulfate salt、pepstatin a等,可抑制丝氨酸、半胱氨酸、酸性蛋白酶和氨基肽酶,sigma-aldrich,货号:p8340,每100毫升裂解液中加入2毫升蛋白酶抑制剂混合物)的强ripa裂解液(内含50mm三羟甲基氨基甲烷,150mm氯化钠,0.2%十二烷基磺酸钠(每100毫升溶液中加入0.2克十二烷基磺酸钠),0.5%脱氧胆酸钠(每100毫升溶液中加入0.5克脱氧胆酸钠),1%(v/v)triton x-100,余量为水,ph 8.0),冰上将细胞刮下来置于1.5毫升离心管。超声破碎细胞,10个循环,超30秒,间隔30秒,16000g离心15分钟收集上清,即为细胞蛋白质提取液。
35.bca(beyotime,货号:p0009)测定蛋白浓度后,取1毫克实验组和对照组细胞蛋白提取液分别与35微升中性亲和素琼脂糖材料(thermo fisher scientific,货号:29200)体积于1.5毫升离心管中室温翻转孵育3小时,500g离心1分钟,移除上清,1毫升pbs洗涤6次。最后分别加入100微升洗脱液【0.2%十二烷基磺酸钠(每100毫升溶液中加入0.2克十二烷基磺酸钠),6m尿素,50mm二硫苏糖醇(dtt,sigma-aldrich),pbs】,65℃反应30分钟,500g离心1分钟收集上清与新的600微升离心管;固体中再加入100微升上述洗脱液,65℃反应30分钟,500g离心1分钟收集上清。合并两次细胞表面蛋白质组分洗脱液。转移入2k超滤管(sartorius,截留分子量为2000道尔顿,体积为0.5毫升)内进行超滤管辅助酶解(fasp)细胞表面蛋白质组分,具体步骤为如下:2k超滤管中加入100微升超纯水,于14000g,20℃条件下离心15分钟;将上述实验组和对照组收集的洗脱液分别转移到2k超滤管中,于14000g,20℃条件下离心30分钟,离干;加入100微升含有8m尿素和100mm碳酸氢铵溶液(余量为水),于14000g,20℃条件下离心30分钟,离干,重复一次;加入100微升含50mm碘乙酰胺、8m尿素和100mm碳酸氢铵溶液,室温避光反应30分钟,于14000g,20℃条件下离心30分钟,离干;加入100微升20mm新鲜配置的碳酸氢铵溶液,于14000g,20℃条件下离心30分钟,离干,重复一次;加入100微升20mm新鲜配置的碳酸氢铵溶液,按照1:25(w/w)比例加入胰蛋白酶(tpck-trypsin,购自sigma-aldric,货号:9002-07-7)37℃酶切过夜。超滤管倒置14000g离心20分钟,收集超滤液,酸化至3%fa,酶解液冻干后0.1%(v/v)甲酸/水复溶后进行液质联用分析(质谱:orbitrap q-exactive,高效液相色谱分离仪:dionex ultimate 3000 rslcnano,thermo scientific,usa)。
36.图2说明cellap方法可以特异性的捕获与细胞表面蛋白质存在亲和作用的生物分子。已知生物分子胰岛素(2a)、转铁蛋白(2b)和曲妥珠单抗(2c)可以分别和细胞表面受体蛋白质胰岛素受体、转铁蛋白质受体以及人表皮生长因子受体-2存在相互作用,因此理论上可能与细胞表面受体蛋白质的亲和作用而被截留于细胞表面,接着被氨基反应的化学探针(ez-link
tm sulfo-nhs-ss-biotin)成功标记带上生物素捕获标签,结合亲和富集和超滤管辅助酶解,实现生物分子的富集分析。对照组中没有加入相应生物分子(胰岛素、转铁蛋白和曲妥珠单抗),因此亲和富集样品中的生物分子的丰度理论上应低于上述实验组亲和富集样品。每个样品进行了三次质谱运行准备进行无标记定量(label-free quantification,lfq)结果分析。无标记定量分析由maxquant软件version 1.3.0.5中进行检索并在perseus软件进行数据分析。经过benjamini-hochberg方法进行two-sample t检验分析发现,胰岛素(2a)、转铁蛋白(2b)和曲妥珠单抗(2c)(圆圈内数据点,即图2d中列出
scientific,usa)。
41.图3说明cellap结合无标记定量分析可以实现复杂样品的低丰度蛋白质的高灵敏检测。生物样品蛋白质组分含量动态范围极宽,如常见血清蛋白质组中高丰度蛋白与低丰度蛋白之间的浓度差异在10个数量级以上。因此,蛋白质组学的研究急需发展高通量和高灵敏度的分离和检测技术。这里我们利用cellap技术结合无标记定量分析方法用于人正常血清样品中低丰度蛋白质的富集分析。其中以同样蛋白质浓度的bsa样品溶液作为对照组。每个样品进行了三次质谱运行准备进行无标记定量(label-free quantification,lfq)结果分析。无标记定量分析由maxquant软件version1.3.0.5中进行检索并在perseus软件进行数据分析。经过benjamini-hochberg方法进行two-sample t检验分析发现,如图3a可以看到与bsa阴性对照组相比,血清孵育组共定量到71个(右上第一象限虚线框内,在血清处理组的丰度变化倍数大于等于2,即log2fc大于等于1)显著性差异(p value小于等于0.05,即-log10 p-value大于等于1.3)的蛋白质,其中49个在人血清数据库(plasma proteome database,http://www.plasmaproteomedatabase.org/)中既有质谱鉴定信息又有浓度信息(图3b),22个只有质谱鉴定信息,无浓度信息。如图3b,49个有浓度信息的血清蛋白中15个仅在cellap方法中定量到(图3b十字架标识,蛋白质基因名和人血清数据库中该蛋白质在血清中的浓度列举于图3c),而在血清全蛋白质组分析中没有鉴定到,且大部分蛋白质在实际血清样本中的浓度在μg/ml以下(图3c),以上结果说明cellap结合无标记定量技术可以实现血清样本中低丰度血清蛋白质的富集分析。
42.实施例3
43.过程同实施例2,与实施例2不同之处在于蛋白质组定量方式不同。
44.hela细胞培养至覆盖10厘米培养皿面积的80%后,pbs磷酸盐缓冲液(内含0.01m磷酸二氢钠、0.15m氯化钠,ph 7.4,余量为水,预先平衡至37℃)洗涤三次,分别加入2毫升正常人血清(实验组)或者2毫升溶解70毫克/m毫升牛血清白蛋白(bsa,sigma-aldrich,货号:a1933,对照组)的rpmi1640培养基(预先平衡至37℃)37℃孵育5分钟。接下来,10毫升4℃预冷的pbs洗涤两次,分别加入预冷的含有0.25毫克/毫升ez-link
tm sulfo-nhs-ss-biotin(thermo fisher scientific,21331)的pbs,4℃脱色摇床上缓慢震摇孵育30分钟,加入预冷的终止溶液,即含100毫摩甘氨酸的pbs溶液,洗涤两次,分别加入1毫升预冷的含有2%蛋白酶抑制剂混合物(内含aebsf、aprotinin、bestatin hydrochloride、e-64、leupeptin hemisulfate salt、pepstatin a等,可抑制丝氨酸、半胱氨酸、酸性蛋白酶和氨基肽酶,sigma-aldrich,货号:p8340,每100毫升裂解液中加入2毫升蛋白酶抑制剂混合物)的强ripa裂解液(内含50mm三羟甲基氨基甲烷,150mm氯化钠,0.2%十二烷基磺酸钠(每100毫升溶液中加入0.2克十二烷基磺酸钠),0.5%脱氧胆酸钠(每100毫升溶液中加入0.5克脱氧胆酸钠),1%(v/v)triton x-100,余量为水,ph 8.0),冰上将细胞刮下来置于1.5毫升离心管。超声破碎细胞,10个循环,超30秒,间隔30秒,16000g离心15分钟收集上清。
45.bca(beyotime,货号:p0009)测定蛋白浓度后,取1毫克实验组和对照组蛋白提取液与35微升中性亲和素琼脂糖材料(thermo fisher scientific,货号:29200)体积于1.5毫升离心管中室温翻转孵育1-3小时,500g离心1分钟,移除上清,1毫升pbs洗涤6次。最后分别加入100微升洗脱液【0.2%十二烷基磺酸钠(每100毫升溶液中加入0.2克十二烷基磺酸钠),6m尿素,50mm二硫苏糖醇(dtt,sigma-aldrich),pbs】,65℃反应30分钟,500g离心1分
钟收集上清与新的600微升离心管;再加入100微升上述洗脱液,65℃反应30分钟,500g离心1分钟收集上清。合并两次细胞表面蛋白质组分洗脱液。转移入2k超滤管(sartorius,截留分子量为2000道尔顿,体积为0.5毫升)内进行超滤管辅助酶解(fasp)细胞表面蛋白质组分,具体步骤为如下:2k超滤管中加入100微升超纯水,于14000g,20℃条件下离心15分钟;将上述实验组和对照组收集的洗脱液分别转移到2k超滤管中,于14000g,20℃条件下离心30分钟,离干;加入100微升含有8m尿素和50mm 4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)溶液(余量为水,ph 8.0),于14000g,20℃条件下离心30分钟,离干,重复一次;加入100微升含50mm碘乙酰胺、8m尿素和50mm hepes溶液(余量为水,ph 8.0),室温避光反应30分钟,于14000g,20℃条件下离心30分钟,离干;加入100微升50mm hepes溶液(余量为水,ph 8.0),于14000g,20℃条件下离心30分钟,离干,重复一次;加入100微升50mm hepes溶液(余量为水,ph 8.0),按照1:25(w/w)比例加入胰蛋白酶(tpck-trypsin,购自sigma-aldric,货号:9002-07-7)37℃酶切过夜。超滤管倒置14000g离心20分钟,收集超滤液。分别取20微克实验组和对照组肽段进行二甲基中、轻标记,然后将标记后的肽段进行混合并用c18固相萃取柱进行除盐。最后,冻干后0.1%(v/v)甲酸/水复溶后进行液质联用分析(质谱:orbitrap q-exactive,高效液相色谱分离仪:dionex ultimate 3000 rslcnano,thermo scientific,usa)。
46.图4说明cellap结合二甲基标记定量分析可以实现血清的低丰度蛋白的高灵敏检测。这里我们利用cellap技术结合无标记定量分析方法用于人正常血清样品中低丰度蛋白质的富集分析。其中以同样蛋白质浓度的bsa样品溶液作为对照组。定量方式为二甲基标记技术。实验进行了两次生物学重复,如图4a所示,横、纵坐标值为相比较对照组蛋白质在血清孵育组的丰度差异变化倍数变化。可以看到,与bsa处理组相比,血清孵育组两次生物学重复共同定量到39个显著性差异蛋白(在两次生物学重复血清处理组的丰度变化倍数均大于等于2,即横纵坐标轴log2fc值均大于等于1,右上第一象限虚线框内),其中24个在人血清数据库(plasma proteome database,http://www.plasmaproteomedatabase.org/)中有既有质谱鉴定信息又有浓度信息(图4b),15个只有质谱鉴定信息,无浓度信息。如图4b,22个只有质谱鉴定信息,无浓度信息。如图4b所示,24个有浓度信息的血清蛋白中3个(图4b十字架标识,蛋白质基因名和人血清数据库中该蛋白质在血清中的浓度列举于图4c)仅在cellap方法中定量到,而在血清全蛋白质组分析中没有鉴定到。以上结果说明cellap结合二甲基标记定量技术可以实现血清样本中低丰度血清蛋白的富集分析。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。