1.本发明涉及一种光控基因开关及其应用,属于生物技术领域。
背景技术:
2.在合成生物学领域中,人工精确调控基因表达用以控制目的蛋白已经成为一种不可或缺的手段。目前,世界上已经有很多通过人工调控诱导蛋白表达的系统,通过化学诱导物或物理的方法来诱导调控目标蛋白表达在特定条件下表达的系统。
3.近年来,通过化学物质来诱导调控基因表达系统有了很大的发展。但是,这些化学诱导物本身存在对细菌本身有毒性、纯化成本高以及对环境污染严重等一些潜在的问题。并且,当在细菌中进行诱导表达这些化学诱导物用于发酵生产时,有可能对细菌正常的代谢过程产生影响。此外,化学物质在诱导调控基因表达时很难做到在时空上精确调控。
4.在发酵生产中,温度控制的分子开关可以通过合成生物传感器动态调节代谢途径,并通过基因回路改道代谢流,提高产率和生产力。然而,大多数生物传感器需要工作量巨大的基因回路元件调试,来适配特定的发酵条件下的目标菌株,对菌体负荷较大。而且,高温会影响菌株生长过程中某些酶和蛋白的活性。
5.光是一种理想的基因表达诱导物,由于其具有低毒性、易获取、易操控、高时空分辨率等,因此,光可作为一种非常理想的诱导剂。并且,相比于化学物质调控系统,物理方法诱导的调控系统因便捷性、无需添加其他诱导物等优势越来越受到人们的关注。因此,利用光作为诱导剂来调控目标蛋白表达进而控制发酵生产或疾病治疗非常有应用价值。
6.目前,已经有强紫外线被用来释放被锁的转录因子或者化学诱导物来诱导基因的表达,但是,强紫外线很可能会造成细胞的不可逆性损伤,并且,在被锁住的转录因子导入活细胞存在困难。也有研究利用远红外光产生热量来控制热激效应介导的基因表达系统,但是,远红外激光控制热激效应则可能激活菌体其他内源基因的表达,并且,其设备复杂且昂贵。
7.因此,急需找到一种无害、成本低且可以在时空上精确调控目的蛋白表达量的方法。
技术实现要素:
8.[技术问题]
[0009]
本发明要解决的技术问题是提供一种无害、成本低且可以在时空上精确调控目的蛋白表达量的方法。
[0010]
[技术方案]
[0011]
为解决上述技术问题,本发明提供了一种光控基因开关,所述光控基因开关为(a)、(b)或(c):
[0012]
(a)为表达ycgz启动子和目的基因的重组质粒;
[0013]
(b)为在(a)上连接编码蓝光感受器蛋白bluf的基因的重组质粒;
[0014]
(c)为在(a)上连接编码调控蛋白blur的基因和编码蓝光感受器蛋白bluf的基因的重组质粒。
[0015]
在本发明的一种实施方式中,当光控基因开关为(a)时,所述目的基因位于ycgz启动子的下游;当光控基因开关为(b)时,所述目的基因位于ycgz启动子的下游,所述编码蓝光感受器蛋白bluf的基因位于ycgz启动子的上游;当光控基因开关为(c)时,所述目的基因位于ycgz启动子的下游,所述编码蓝光感受器蛋白bluf的基因位于ycgz启动子的上游,所述编码调控蛋白blur的基因位于编码蓝光感受器蛋白bluf的基因的上游。
[0016]
在本发明的一种实施方式中,所述重组质粒以pet-28a质粒、pcl1920质粒、pft24质粒或pbad33质粒为载体。
[0017]
在本发明的一种实施方式中,所述ycgz启动子来源于ncbi编号为cp046033.1、cp014768.1、cp024695.1、cp041513.1、cp026797.1、cp026866.1、cp026814.1、cp026811.1、cp026762.1、cp026731.1、cp024470.1、cp011511.1、cp001063.1、cp032513.1、cp026795.1、cp026872.1、cp026098.1、cp041620.1、cp026875.1、cp026845.1、cp026877.1、cp026836.1、cp026846.1、cp026824.1、cp027027.1或cp026867.1的菌株。
[0018]
在本发明的一种实施方式中,所述ycgz启动子的核苷酸序列如seq id no.1所示。
[0019]
在本发明的一种实施方式中,所述编码调控蛋白blur的基因来源于ncbi编号为cp046033.1、cp026872.1、cp026867.1、cp026866.1、cp026762.1、cp024695.1、cp014768.1、cp032513.1、cp026875.1、cp026836.1、cp026846.1、cp026098.1、cp024470.1、cp026845.1、cp026877.1、cp044191.1、cp044151.1、cp041511.1、cp032523.1、cp029794.1、cp026802.1、he616528.1、cp046286.1、cp045932.1、cp041322.1、cp037997.1、cp035008.1、cp034067.1、lr213458.1、lr213449.1、cp022672.1、cp014099.2、cp023645.1、cp022457.1、cp022455.1、cp022459.1、cp019689.1、cp021144.1、cp000038.1、cp041513.1、cp026795.1、cp026797.1、cp026814.1、cp010829.1、cp001063.1、cp041620.1、cp026824.1、cp027027.1、cp026731.1、cp011511.1、cp026811.1、cp026803.1或cp037864.1的菌株。
[0020]
在本发明的一种实施方式中,所述编码蓝光感受器蛋白blur的基因的核苷酸序列如seq id no.2所示。
[0021]
在本发明的一种实施方式中,所述编码蓝光感受器蛋白bluf的基因来源于ncbi编号为cp051430.1、cp046033.1、cp041513.1、cp026795.1、cp026797.1、cp026814.1、cp026731.1、cp011511.1、cp001063.1、cp047094.1、cp024695.1、cp026867.1、cp026866.1、cp026762.1、cp026872.1、cp026839.1、cp024470.1、cp045522.1、cp026803.1、cp032513.1、cp026098.1、cp026875.1、cp026845.1、cp026877.1、cp044191.1、cp044151.1、cp041511.1、cp032523.1、cp029794.1、cp027027.1、cp026802.1、cp026836.1、he616528.1、cp045526.1、cp045524.1、cp046286.1、cp045932.1、cp041322.1、cp037997.1、cp035008.1、cp034067.1、lr213458.1、lr213449.1、cp022672.1、cp014099.2、cp022455.1、cp022459.1、cp019689.1cp021144.1、cp010829.1、cp000038.1、cp026824.1、cp026846.1、cp023645.1、cp022457.1、cp014768.1、cp041620.1、cp007215.3、cp016337.1、cp029727.1、cp044101.1、cp024675.1或cp007557.1的菌株。
[0022]
在本发明的一种实施方式中,所述编码蓝光感受器蛋白bluf的基因的核苷酸序列如seq id no.3所示。
[0023]
在本发明的一种实施方式中,所述目的基因为编码绿色荧光蛋白的基因。
[0024]
在本发明的一种实施方式中,所述编码绿色荧光蛋白的基因的核苷酸序列如seq id no.4所示。
[0025]
本发明还提供了一种宿主细胞,所述宿主细胞携带上述光控基因开关;或者,所述宿主细胞的基因组整合有含有ycgz启动子和目的基因的基因片段;或者,所述宿主细胞的基因组整合有含有编码蓝光感受器蛋白bluf的基因、ycgz启动子和目的基因的基因片段;或者,所述宿主细胞的基因组整合有含有编码调控蛋白blur的基因、编码蓝光感受器蛋白bluf的基因、ycgz启动子和目的基因的基因片段。
[0026]
在本发明的一种实施方式中,当宿主细胞的基因组整合有含有ycgz启动子和目的基因的基因片段时,所述目的基因位于ycgz启动子的下游;当宿主细胞的基因组整合有含有编码蓝光感受器蛋白bluf的基因、ycgz启动子和目的基因的基因片段时,所述目的基因位于ycgz启动子的下游,所述编码蓝光感受器蛋白bluf的基因位于ycgz启动子的上游;当宿主细胞的基因组整合有含有编码调控蛋白blur的基因、编码蓝光感受器蛋白bluf的基因、ycgz启动子和目的基因的基因片段时,所述目的基因位于ycgz启动子的下游,所述编码蓝光感受器蛋白bluf的基因位于ycgz启动子的上游,所述编码调控蛋白blur的基因位于编码蓝光感受器蛋白bluf的基因的上游。
[0027]
在本发明的一种实施方式中,所述宿主细胞为细菌或真菌。
[0028]
在本发明的一种实施方式中,所述宿主细胞为革兰氏阴性细菌。
[0029]
在本发明的一种实施方式中,所述宿主细胞为大肠杆菌。
[0030]
本发明还提供了一种控制目的蛋白表达量的方法,所述方法为先将上述宿主细胞接种至培养基中进行发酵,得到发酵液,然后将发酵液分离,得到目的蛋白;发酵过程中,通过控制蓝光照射剂量,控制目的蛋白的表达量。
[0031]
在本发明的一种实施方式中,所述目的蛋白为绿色荧光蛋白。
[0032]
本发明还提供了上述光控基因开关或上述宿主细胞或上述方法在生产目的蛋白中的应用。
[0033]
在本发明的一种实施方式中,所述目的蛋白为绿色荧光蛋白。
[0034]
[有益效果]
[0035]
(1)本发明提供了一种光控基因开关,此光控基因开关为表达编码调控蛋白blur的基因、编码蓝光感受器蛋白bluf的基因、ycgz启动子和目的基因的重组质粒,其中,当无蓝光照射时,blur编码的调控蛋白blur会结合在ycgz启动子上抑制ycgz,当有蓝光照射时,bluf基因编码的蓝光感受器蛋白bluf会解除调控蛋白blur对ycgz的抑制以启动目的基因的表达;使用此光控基因开关,可通过控制蓝光照射剂量,控制目的蛋白的表达量,以达到在时空上精确控制目的蛋白表达的目的。
[0036]
(2)本发明提供了一种控制目的蛋白表达量的方法,使用此方法,可通过控制蓝光照射剂量,控制目的蛋白的表达量,以达到在时空上精确控制目的蛋白表达的目的,并且,蓝光照射具有对宿主细胞无害、成本低的优势。
附图说明
[0037]
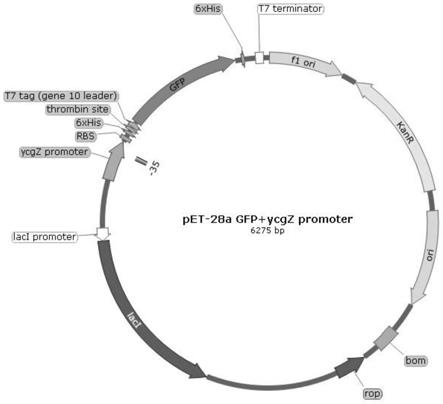
图1:光控基因开关pet28a-p
ycgz-gfp的质粒图谱。
[0038]
图2:不同重组大肠杆菌发酵获得的发酵液的荧光强度。
[0039]
图3:重组大肠杆菌bl21/pet28a-p
ycgz-gfp发酵不同时间获得的发酵液的荧光强度。
[0040]
图4:光控基因开关pet28a-blur-p
ycgz-gfp的质粒图谱。
[0041]
图5:不同重组大肠杆菌发酵获得的发酵液的荧光强度。
[0042]
图6:光控基因开关pet28a-bluf-p
ycgz-gfp的质粒图谱。
[0043]
图7:重组大肠杆菌bl21/pet28a-bluf-p
ycgz-gfp发酵不同时间获得的发酵液的荧光强度。
具体实施方式
[0044]
下述实施例中涉及的大肠杆菌(escherichia coli)bl21和大肠杆菌(escherichia coli)w3110购自优宝生物;下述实施例中涉及的pet-28a质粒和pwsk129质粒购自biovector质粒载体菌种细胞基因保藏中心;下述实施例中涉及的一步克隆试剂盒clonexpress multis one step cloning kit购自南京诺唯赞生物科技有限公司,货号为c113-01。
[0045]
下述实施例中涉及的培养基和试剂如下:
[0046]
lb液体培养基:蛋白胨10g/l、酵母膏5g/l、nacl 10g/l。
[0047]
lb固体培养基:蛋白胨10g/l、酵母膏5g/l、nacl 10g/l、琼脂15g/l。
[0048]
实施例1:光控基因开关pet28a-p
ycgz-gfp的构建
[0049]
具体步骤如下:
[0050]
(1)光控基因开关pet28a-p
ycgz-gfp的构建
[0051]
合成编码绿色荧光蛋白的基因gfp(seq id no.4);将编码绿色荧光蛋白的基因gfp和pet-28a质粒通过bamhⅰ和ecorⅰ双酶切后,使用一步克隆试剂盒clonexpress multis one step cloning kit连接,得到连接产物;将连接产物转化大肠杆菌bl21,得到转化产物;将转化产物涂布在lb固体培养基(含有30μg
·
ml-1
卡那霉素)上,于37℃恒温培养箱中倒置培养8~12h,得到转化子;挑取转化子接种至lb液体培养基中,于37℃、200rpm的条件下摇瓶培养8~12h后提取质粒进行pcr验证,验证正确即获得重组大肠杆菌bl21/pet28a-gfp和重组质粒pet28a-gfp;
[0052]
其中,pcr验证所用引物如下:
[0053]
pet28a-gfp (seq id no.5):
[0054]
cagcaaatgggtcgcggatccatgagtaaaggagaagaacttttcactg;
[0055]
pet28a-gfp-(seq id no.6):
[0056]
ttgtcgacggagctcgaattcctatttgtatagttcatccatgccatg。
[0057]
合成来源于大肠杆菌(escherichia coli)mg1655的ycgz启动子(seq id no.1);将ycgz启动子和重组质粒pet28a-gfp通过bglⅰ和xbaⅰ双酶切后,使用一步克隆试剂盒clonexpress multis one step cloning kit连接,得到连接产物;将连接产物转化大肠杆菌bl21,得到转化产物;将转化产物涂布在lb固体培养基(含有12.5μg
·
ml-1
卡那霉素)上,于37℃恒温培养箱中倒置培养8~12h,得到转化子;挑取转化子接种至lb液体培养基中,于37℃、200rpm的条件下摇瓶培养8~12h后提取质粒进行pcr验证,验证正确即获得重组大肠
杆菌bl21/pet28a-p
ycgz-gfp和重组质粒pet28a-p
ycgz-gfp(质粒图谱见图1,质粒的核苷酸序列为seq id no.7);
[0058]
其中,一步克隆所用引物如下:
[0059]
pet28a-p
ycgz-gfp promoter (seq id no.8)
[0060]
cggcgtagaggatcgagatcttcttttaataccaaaacataacc;
[0061]
pet28a-p
ycgz-gfp promoter-(seq id no.9)
[0062]
aacaaaattatttctagagctacgcctctgttaaa;
[0063]
pcr验证所用引物如下:
[0064]
pet28a-p
ycgz-gfp promoter test (seq id no.10):
[0065]
ctctcccttatgcgactcct;
[0066]
pet28a-p
ycgz-gfp promoter test-(seq id no.11):
[0067]
gccaactagtgttcaactttttcca。
[0068]
(2)光控基因开关pet28a-p
ycgz-gfp的第一次验证
[0069]
以重组大肠杆菌bl21/pet28a-gfp为对照,将重组大肠杆菌bl21/pet28a-p
ycgz-gfp的单菌落接种至lb液体培养基中,于37℃、200rpm、自然光照的条件下摇瓶培养3h后,分别于37℃、200rpm、蓝光照射或37℃、200rpm、黑暗的条件下发酵15h,得到发酵液;其中,蓝光由415nm led灯发出,光照频率为15min关/15min开。
[0070]
通过酶标仪检测重组大肠杆菌bl21/pet28a-gfp和重组大肠杆菌bl21/pet28a-p
ycgz-gfp发酵获得的发酵液的荧光强度(激发波长488nm,发射波长516nm),检测结果见图2。
[0071]
如图2所示,在不添加iptg诱导时,重组大肠杆菌bl21/pet28a-gfp发酵获得的发酵液的荧光强度为2000au/od
600
、重组大肠杆菌bl21/pet28a-p
ycgz-gfp发酵获得的发酵液的荧光强度为80000au/od
600
。可见,光控基因开关pet28a-p
ycgz-gfp的能够调控目的基因gfp的表达,并且,随着光照时间的延长,目的基因gfp的表达量逐渐增加。
[0072]
(3)光控基因开关pet28a-p
ycgz-gfp的第二次验证
[0073]
为证明发明的光控基因开关pet28a-p
ycgz-gfp可以控制目的蛋白的表达量,将重组大肠杆菌bl21/pet28a-p
ycgz-gfp的单菌落接种至lb液体培养基中,于37℃、200rpm、自然光照的条件下摇瓶培养3h后,分别于37℃、200rpm、蓝光照射或37℃、200rpm、黑暗的条件下发酵9h,得到发酵液;其中,蓝光由415nm led灯发出,光照频率为15min关/15min开。
[0074]
通过酶标仪检测重组大肠杆菌bl21/pet28a-p
ycgz-gfp发酵不同时间获得的发酵液的荧光强度(激发波长488nm,发射波长516nm),检测结果见图3。
[0075]
如图3所示,在蓝光照射前荧光强度/od
600
几乎相同,而在打开蓝光照射15h时,大肠杆菌bl21/pet28a-p
ycgz-gfp发酵获得的发酵液的荧光强度为80000au/od
600
,黑暗条件下相同菌株表达量仅为45000au/od
600
。
[0076]
实施例2:光控基因开关pet28a-blur-bluf-p
ycgz-gfp的构建
[0077]
具体步骤如下:
[0078]
(1)光控基因开关pet28a-blur-bluf-p
ycgz-gfp的构建
[0079]
合成来源于大肠杆菌(escherichia coli)mg1655的编码调控蛋白blur的基因(seq id no.2)和来源于大肠杆菌(escherichia coli)mg1655的编码蓝光感受器蛋白bluf
和bamhⅰ双酶切后,使用一步克隆试剂盒clonexpress multis one step cloning kit连接,得到连接产物;将连接产物转化大肠杆菌bl21,得到转化产物;将转化产物涂布在lb固体培养基(含有30μg
·
ml-1
卡那霉素)上,于37℃恒温培养箱中倒置培养8~12h,得到转化子;挑取转化子接种至lb液体培养基中,于37℃、200rpm的条件下摇瓶培养8~12h后提取质粒进行pcr验证,验证正确即获得重组大肠杆菌bl21/pet28a-bluf-p
ycgz-gfp和重组质粒pet28a-bluf-p
ycgz-gfp(质粒图谱见图6,质粒的核苷酸序列为seq id no.17);
[0099]
其中,一步克隆所用引物如下:
[0100]
pet28a-bluf-p
ycgz-gfp (seq id no.18)
[0101]
tggggccgccatgccggcttattttttctctggccacgct;
[0102]
pet28a-bluf-p
ycgz-gfp-(seq id no.19)
[0103]
ttaaacaaaattatttctagagctacgcctctgttaaaaatgttaa;
[0104]
pcr验证所用引物如下:
[0105]
pet28a-bluf-p
ycgz-gfp test (seq id no.20):
[0106]
gtaggtgttccacagggtag;
[0107]
pet28a-bluf-p
ycgz-gfp test-(seq id no.21):
[0108]
ctatttgtatagttcatccatgccatg。
[0109]
(2)光控基因开关pet28a-bluf-p
ycgz-gfp的验证
[0110]
将重组大肠杆菌bl21/pet28a-bluf-p
ycgz-gfp的单菌落接种至lb液体培养基中,于37℃、200rpm、自然光照的条件下摇瓶培养3h后,分别于37℃、200rpm、蓝光照射或37℃、200rpm、黑暗的条件下发酵6.5h,得到发酵液;其中,蓝光由415nm led灯发出,光照频率为15min关/15min开。
[0111]
通过酶标仪检测重组大肠杆菌bl21/pet28a-bluf-p
ycgz-gfp发酵获得的发酵液的荧光强度(激发波长488nm,发射波长525nm),检测结果见图7。
[0112]
如图7所示,由于检测波长不同,重组大肠杆菌发酵获得的发酵液的荧光强度与前两个光控开关有所不同。发酵液的荧光强度在蓝光照射6.5h时为2300au/od
600
、在黑暗条件下仅为300au/od
600
。可见,光控基因开关bl21/pet28a-bluf-p
ycgz-gfp能够调控目的基因gfp的表达。并且,随着光照时间的延长,目的基因gfp的表达量逐渐增加,可见,光控基因开关bl21/pet28a-bluf-p
ycgz-gfp的灵敏性更佳。
[0113]
实施例4:其他光控基因开关的构建
[0114]
具体步骤如下:
[0115]
在实施例1的基础上,将来源于大肠杆菌(escherichia coli)mg1655的ycgz启动子分别替换为表1中不同来源的ycgz启动子,经过效果检测发现,表1中的ycgz启动子用于光控基因开关表达系统中时均有相似效果。
[0116]
表1 ycgz启动子的来源及其ncbi编号
[0117]
启动子来源ncbi编号salmonella sp.hnk130cp046033.1shigella sp.pamc 28760cp014768.1shigella boydii strain 192cp024695.1shigella boydii strain 83-578cp026814.1
[0118]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
