1.本发明属于细胞工程技术领域,具体涉及一种组合因子对及其应用。
背景技术:
2.最新的流行病学研究发现,肥胖及其代谢并发症已成为最严重的公共卫生危机之一。随着肥胖高危人群的增加,持续、长时间的高能量饮食摄入增加了发生包括肥胖、高脂血症、高脂血症以及严重的心脑血管疾病等全身性代谢综合征的风险。事实上,非酒精性脂肪性肝病(nafld)等与肥胖相关的共病的患病率同步增加,nafld已经是最常见的慢性肝病。nafld 的严重程度从单纯脂肪变性到伴有恶性转化和坏死性炎症改变的肝细胞损伤,以非酒精性脂肪性肝炎(nash)为特征,揭示了患者更容易发生肝纤维化和肝细胞癌。更严重的是,形成的 nash反过来将进一步促进其并发症,例如,胰岛素抵抗的发展,高血压,慢性肾病(ckd)和2 型糖尿病(t2d)。然而不幸的是,到目前为止,世界上还没有经过批准和证明的完全有效的治疗nash的药物治疗方法,缓解该疾病引起的相关并发症的努力也没有完全达到预期。 nafld/nash的有效药物和治疗方案的开发,主要依赖于靶向关键信号调节或与致病机制密切相关的调控过程。
3.rhomboid 5homolog 2(rhbdf2),也被称为irhom2,是rhomboid膜内蛋白酶家族的非活性成员,已被确定为炎症相关疾病的关键致病调节因子,如肥胖、关节炎、肾炎、动脉粥样硬化和纤维化等疾病。而且rhbdf2通过招募map3k7显著提高其磷酸化水平并激活下游炎症信号。rhbdf2-map3k7信号通路的激活有助于nafld的发生,而nafld可导致肝纤维化。同时,rhbdf2具有被泛素化(另一个重要的调控修饰)调控的能力。有研究推测,在蛋白酶抑制剂的存在下,rhbdf2的半衰期显著延长,进一步表明在细胞质结构域可能存在k48 连接的泛素化位点,从而发生蛋白酶体降解。然而,是否存在某些调控因子调控rhbdf2泛素化和rhbdf2介导的nafld/nash发病机制仍不清楚。
4.同时考虑到nash的复杂发病机制,目前尚无临床有效的治疗nash的药物。因此,全面细致地了解非酒精性脂肪性肝病的发病机制和过程,寻找关键的信号调节因子,已成为nash 治疗药物开发的迫切问题。
技术实现要素:
5.鉴于nafld和nash的病理过程是一种与代谢综合征和全身炎症反应综合征(sirs)相关的纠缠性进展,应针对致病信号通路中的关键因素设计完善的靶点。胰岛素抵抗、肝脏脂肪变性、长期炎症、胶原沉积等因素共同促进了代谢综合征和nash的病理形成。而且,长期高热量饮食治疗能够刺激肝脏产生严重的胰岛素抵抗,使肝脏中胰岛素调节葡萄糖代谢的正常功能被抑制。然而,胰岛素促进脂肪生成的功能被完全保留。因此,严重的胰岛素抵抗导致肝脏中过量脂质的异常积累。此外,高脂的摄入也会引发炎症反应,并协同促进胰岛素抵抗的产生和发展。
6.具体地,e3泛素连接酶——三结构域蛋白31(trim31)的三部分已经被确定为先天
免疫应答的“janus-faced”调控因子,通过泛素修饰促进目标底物降解或信号转导。trim31 失调的动物通常表现出严重的肠道炎症和肠道菌群失衡,trim31失调会诱导内毒素血症的产生,并提高nlrp3炎症小体的活化。另一方面,在败血症中,trim31通过促进细胞凋亡和nf-κb 信号通路,导致心肌功能障碍。而nf-κb信号介导的慢性炎症可增强结直肠癌的侵袭和转移。这些看似矛盾的发现揭示了trim31在不同的病理过程中发挥了完全不同的功能。
7.所以,本发明目的在于提供一种组合因子对,所述组合因子分别为肝细胞来源的 trim31、rhbdf2。所述trim31包含如sequenceno:1或sequenceno:2所示的氨基酸序列;所述rhbdf2包含如sequenceno:3或sequenceno:4所示的氨基酸序列。其中编码trim31 的核酸序列包括如sequenceno:5或sequenceno:6所示的序列;编码rhbdf2的核酸序列包括如sequenceno:7或sequenceno:8所示的序列。
8.在某些具体实施例中,编码trim31的核酸序列也可以是sequenceno:6所示的序列的人源化序列;编码rhbdf2的核酸序列也可以是sequenceno:8所示的序列的人源化序列。
9.进一步,所述trim31与所述rhbdf2存在此消彼长的关系。即若所述trim31分泌增加,则会抑制rhbdf2分泌,即rhbdf2分泌减少。
10.具体地,在某些具体实施例中,使用肝细胞特异性trim31敲除的小鼠(thko)/转基因小鼠(thtg)和慢病毒介导的离体基因治疗(lv-trim31)小鼠,本发明确定肝脏trim31是高脂饮食(hfd/hfhf)诱导或遗传诱导的慢性炎症、胰岛素抵抗、肝脏脂肪变性和nash的显著负调节因子。对潜在分子机制的研究发现,在长期的高热量饮食下,体内和体外实验中明显观察到trim31的减少,这导致rhbdf2-ma3k7信号通路激活的增加。在trim31功能失调的情况下,强烈激活的rhbdf2-map3k7信号传导进一步介导下游信号通路表达的增加,包括jnk-irs1相关的胰岛素信号传导、iκbα-nf-κb-c-jun通路、akt-gsk3β-foxo1磷酸化水平的抑制和 ctgf-timp1通路,促进受损的胰岛素信号传导(胰岛素抵抗)、慢性炎症作用、异常的葡萄糖代谢紊乱和肝脏中的胶原沉积的发生,从而加重异常的脂质代谢,以及肝脏脂肪变性和nash 表型的产生。
11.在复杂的肝脏代谢调节的网络中,高脂饮食诱导的肝脏脂肪变性期间rhbdf2-map3k7 信号通路活性和下游促炎因子的增加被肝脏特异性trim31过表达显著抑制,表明trim31对 rhbdf2-map3k7介导的炎症反应、胰岛素抵抗和脂肪变性具有抑制作用。利用阳性离体基因治疗恢复小鼠trim31的表达也表明,它能有效抑制rhbdf2的活性,缓解上述三种病理表型。而且,有研究发现trim31的功能可能在调节免疫相关疾病中具有“janus-face”(双面)作用,表现为可催化靶向底物降解或者通过泛素化的信号转导使底物降解。有研究表明,trim31缺乏失去了对结肠炎炎症反应的抑制作用;但另一方面,trim31被确定为阳性启动子,可加剧炎症相关信号引发的心肌病。这些看似相反的结论可能表明trim31的功能与器官类型和细胞类型密切相关。
12.本发明目的在于还提供一种前述的组合因子对作为nafld/nash和/或代谢紊乱的标志物中的应用。所述trim31包含如sequenceno:1或sequenceno:2所示的氨基酸序列;所述rhbdf2包含如sequenceno:3或sequenceno:4所示的氨基酸序列。其中编码trim31的核酸序列包括如sequenceno:5或sequenceno:6所示的序列;编码rhbdf2的核酸序列包括如 sequenceno:7或sequenceno:8所示的序列。
13.本发明目的在于还提供一种trim31作为制备nafld/nash和代谢紊乱的抑制因子/
抑制剂中的应用。所述trim31包含如sequenceno:1或sequenceno:2所示的氨基酸序列;编码trim31的核酸序列包括如sequenceno:5或sequenceno:6所示的序列。
14.本发明目的在于还提供一种trim31的促进剂作为制备nafld、nash或代谢紊乱的药物中的应用。所述trim31包含如sequenceno:1或sequenceno:2所示的氨基酸序列;编码 trim31的核酸序列包括如sequenceno:5或sequenceno:6所示的序列。
15.进一步,所述促进剂包括以下几种物质中的一种或多种组合:
16.(1)生物碱类化合物或组合物,包括小檗碱,木兰花碱,骆驼蓬碱,蛇根碱,益母草碱,粉防己碱,常山碱,浙贝母碱,秋水仙碱,胡椒碱,钩藤碱,喜树碱,延胡索乙素,药根碱,白屈菜碱,石蒜碱,山油柑碱,苦参碱,氧化苦参碱中的一种化合物或多种化合物组成的组合物;
17.(2)黄酮类化合物或组合物,包括槲皮素,二氢槲皮素,木犀草素,桑色素,桑皮黄素,芹菜素,香叶木素,白杨素,苜蓿素,葛根素,花青素,原花青素,大豆黄素,芹菜素,黄芩素,野黄芩素,白杨素,汉黄芩素,矢车菊素,水飞蓟素,水飞蓟宾,黄豆苷元,染料木素,高良姜黄素,山奈酚,漆黄素,异鼠李素,杨梅黄酮,橙皮素,柚皮素,甘草素,儿茶素,表儿茶素,没食子儿茶素,矢车菊素,飞燕草素,花葵素,灯盏花素,阿福豆素,芦丁,木犀草苷,黄芩苷,芹菜苷,胡桃苷中的一种化合物或多种化合物组成的组合物;
18.(3)多酚类化合物或组合物,包括绿原酸,洋蓟酸,菜蓟糖苷,菜蓟苦素,茶多酚,白藜芦醇,石榴多酚,姜黄素,阿魏酸中的一种化合物或多种化合物组成的组合物;
19.(4)胺类化合物或组合物:青霉胺,泊马度胺,来那度胺,沙利度胺中的一种化合物或多种化合物组成的组合物;
20.(5)中药提取物,包括黄芪、党参、丹参、当归、山药、三七、五味子、黄精、灵芝、云芝、洋蓟、小蓟、水飞蓟、葛根、黄连、黄柏、姜黄、金银花、枳椇、陈皮、桑叶、银杏叶、百合、熊胆、猪胆、茵陈、枳壳、甘草、虎杖、槐米、丹皮、垂盆草、栀子、枸杞、白芍、川芎、桃仁、大黄、菊花、溪黄草、白花蛇舌草、防己、白茅根、半枝莲、柴胡、茯苓、山药中的一种提取物或多种提取物组成的组合物;
21.(6)甘草酸,甘草酸苷,腺苷蛋氨酸,熊去氧胆酸,牛磺熊去氧胆酸,鹅去氧胆酸,牛磺鹅去氧胆酸,双环醇,联苯双酯,索拉非尼,瑞戈非尼,乐伐替尼,甜菜红素,二甲双胍,胭脂红酸中的一种或多种。
22.进一步,所述药物还包括一些可药物的辅料。
23.本发明目的在于还提供一种trim31作为rhbdf2的抑制剂中的应用。所述trim31包含如sequenceno:1或sequenceno:2所示的氨基酸序列;其中编码trim31的核酸序列包括如sequenceno:5或sequenceno:6所示的序列。
24.在某些具体实施例中,编码trim31的核酸序列也可以是sequenceno:6所示的序列的人源化序列。
25.本发明目的在于还提供一种trim31作为胰岛素抵抗或肝脂肪变性或炎症和肝纤维化的消除剂的应用。
26.所述trim31包含如sequenceno:1或sequenceno:2所示的氨基酸序列;其中编码 trim31的核酸序列包括如sequenceno:5或sequenceno:6所示的序列。
27.在某些具体实施例中,编码trim31的核酸序列也可以是sequenceno:6所示的序列
的人源化序列。
28.具体地,由高脂饮食触发的上调的rhbdf2显著驱动体内所有三种病理表型,揭示了 rhbdf2在肝脏脂肪变性相关代谢疾病中的潜在治疗前景。通过对rhbdf2的研究,发现e3泛素连接酶的重要成员trim31是rhbdf2表达的潜在有效抑制剂。而且,随着研究的进一步深入,发现肝细胞trim31的保护功能不仅只局限于肝脏,还影响整个代谢系统,包括减少体重增加和内脏脂肪,改善血脂异常,以及下调血清炎症细胞因子和趋化因子。因为肝脏是人体最大的代谢、免疫器官,这可能是trim31调节肝脏进而调节整个人体的原因。而且,我们证实了trim31功能失调,导致随后rhbdf2水平显著上调,且与炎症相关疾病密切相关。此外, rhbdf2已被证明受泛素化修饰调节。同样的,我们确定高脂饮食的小鼠和肝脂肪变性患者的肝脏中trim31水平显著降低。
29.本发明目的在于还提供一种促进rhbdf2降解的方法,其特征在于,将所述trim31 通过k48连接的多泛素化促进rhbdf2降解。
30.本发明目的在于还提供一种trim31作为肝细胞变性的诊断标志物中的应用。
31.本发明目的在于还提供一种判断肝细胞变性的方法,其特征在于,检测待测离体样本中的trim31的表达水平,并与正常组进行比较,当所述待测离体样本中的trim31的表达水平低于正常组时,判定为肝细胞变性。
32.进一步,检测待测离体样本中的rhbdf2的表达水平,并与正常组进行比较,当所述待测离体样本中的rhbdf2的表达水平低于正常组时,判定为肝细胞变性。
33.本发明目的在于还提供一种trim31的表达量调节剂作为肝糖原储备调节剂中的应用。
34.进一步,trim31的表达量促进剂是作为肝糖原储备抑制剂中的应用。
35.本发明目的在于还提供一种trim31作为高脂饮食诱发胰岛素抵抗和糖代谢紊乱的抑制剂中的应用。
36.具体地,本发明发现trim31通过k48连接的泛素修饰促进rhbdf2降解,进一步抑制 rhbdf2-map3k7活性和下游信号通路的表达,从而具有抑制肝脏脂肪变性、受损胰岛素信号传导和肝脏炎症的能力。trim31主要基于不同的基序在分子水平上发挥其生物学功能。据报道,trim31的c端卷曲螺旋结构域(cc)基本上负责与靶标的结合和相互作用,而n端ring 结构域则负责泛素连接酶活性和催化功能。
37.本发明发现k48连接的rhbdf2泛素化可以在体外被催化,并且trim31的缺失极大使 rhbdf2的这种内源性泛素化修饰无效。分子生物学功能的体外研究表明,trim31通过螺旋结构域(cc)直接结合rhbdf2以靶向rhbdf2活性,然后trim31的ring finger通过k48介导 rhbdf2蛋白酶体泛素化降解而泛素化rhbdf2。然而,内源性rhbdf2和trim31在肝细胞中的相互作用仍需进一步研究。一旦rhbdf2和trim31之间的相互作用被阻断,trim31对高脂诱导的肝脂肪变性的保护作用就终止了。而且,非功能性trim31(ring结构域突变体)失去了其e3连接酶活性,以继续降低rhbdf2-map3k7信号通路和下游jnk1/2-nf-kb通路的激活,并提高胰岛素信号传导。所以带有ring结构域突变体的trim31对pa诱导的肝细胞中异常的脂质代谢也有相当大的影响。因此,trim31-rhbdf2的结合和随后的rhbdf2泛素化修饰是肝细胞rhbdf2-map3k7信号诱导的肝脏脂肪变性、胰岛素抵抗和肝脏炎症缓解所必需的。
38.而且,rhbdf2作为菱形膜内蛋白酶家族的一个重要的非活性成员,已被证实与炎
症信号的调节和传递有关。但是,以前研究表明,在免疫细胞以外的细胞中,促炎因子tnf-α的产生与rhbdf2无关。现有文献也表明,非免疫细胞中rhbdf2的缺失并不影响炎症因子如 tnf-α、il-6和il-β的表达和分泌。但是,尽管tnf-α在非免疫细胞如肝细胞中的释放并不完全依赖于rhbdf2的转运,但它能够在刺激条件下大量地募集map3k7下游信号通路,激活nf-κb炎症信号并加速炎症因子的分泌。本发明中,发现在棕榈酸(pa)诱导的肝细胞中, trim31通过k48泛素连接显著促进rhbdf2的降解,随后tnf-α和其他炎症因子的表达大大降低。
39.本发明确定了肝脏trim31表达与非酒精性脂肪性肝病/非酒精性脂肪肝炎和代谢紊乱相关,例如人类和小鼠的胰岛素抵抗和糖代谢紊乱。此外,小鼠肝脏trim31表达对饮食干预有反应,饮食干预通过调节rhbdf2蛋白酶体降解显著缓解胰岛素抵抗、肝脏脂肪变性和炎症表型。这些发现促使trim31可作为非酒精性脂肪性肝病/非酒精性脂肪性肝炎(nafld/nash) 和相关代谢疾病的可行治疗靶点,并使trim31与这些疾病的诊断和治疗方案相关联。本发明有益效果在于
40.本发明提供的trim31、rhbdf2组合因子作为代谢紊乱的标志物,可以精确有效的鉴定nafld/nash和/或代谢紊乱或肝细胞变性。
41.本发明提供的trim31制备的促进因子/促进剂可以有效改善nafld/nash和/或代谢紊乱的情况。
42.本发明采用的trim31作为或者制备胰岛素抵抗或肝脂肪变性或炎症和肝纤维化的消除剂可以有效缓解胰岛素抵抗或肝脂肪变性或炎症和肝纤维化的情况。
43.本发明提供的判断肝细胞变性的方法可以准确的鉴定出肝细胞是否产生变性。
附图说明
44.图1a为hfd小鼠和ncd小鼠肝脏样本中trim31表达情况。
45.图1b为ob/ob小鼠肝脏样本中trim31表达情况。
46.图1c为hfd小鼠0-16周trim31表达情况。
47.图1d为nash患者的肝脏中trim31的表达情况。
48.图1e为给药棕榈酸(pa)和tnf-α后trim31表达情况。
49.图1f为加入活性氧清除剂n-acetyl-l-cysteine(nac)和抗氧化过氧化氢酶(cat)后 trim31表达情况。
50.图1g为pa chx处理后的rhbdf2的表达情况。
51.图1h为pa chx 氯喹处理后的rhbdf2的表达情况。
52.图1i为pa chx mg132处理后的rhbdf2的表达情况。
53.图1j为小鼠肝脏免疫荧光分析情况。
54.图1k为免疫组化分析人肝脏切片情况及腺病毒介导的trim31表达(adtrim31)转染的 l02细胞中细胞内甘油三酯(tg)情况。
55.图2a为hfd小鼠、ncd小鼠、ob/ob小鼠肝脏样本中rhbdf2表达情况。
56.图2b为hfd小鼠在0-16周肝脏样本油红染色和he染色情况。
57.图2c为hfd小鼠和ncd小鼠tc、tg、nefa含量情况。
58.图2d为nash患者的肝脏中rhbdf2的表达情况。
59.图2e为给药棕榈酸(pa)和tnf-α后rhbdf2表达情况。
60.图2f为体内rhbdf2的泛素化情况。
61.图3a为thko小鼠生产流程示意图。
62.图3b为thko小鼠身体各组分表达trim31情况。
63.图3c为ncd和hfd处理的thko小鼠食物摄入量情况。
64.图4a为thtg小鼠生产流程示意图。
65.图4b为thtg小鼠身体各组分表达trim31情况。
66.图4c为ncd和hfd处理的thtg小鼠食物摄入量情况。
67.图4d为pa处理的原代肝细胞的trim 31表达情况。
68.图5a为长时间hfd的thtg小鼠0-16周体重情况。
69.图5b为长时间hfd的thtg小鼠0-16周空腹血糖情况。
70.图5c为长时间hfd的thtg小鼠0-16周空腹空腹胰岛素水平情况。
71.图5d为长时间hfd的thtg小鼠0-16周胰岛素抵抗情况。
72.图5e为葡萄糖耐量试验(gtt)试验测试thtg小鼠血糖水平情况。
73.图5f为胰岛素耐量试验(itt)试验测试thtg小鼠血糖水平情况。
74.图5g为trim31过表达与肝糖原储备情况。
75.图5h为thtg小鼠-hfd饮食引起的肝胰岛素信号失调情况。
76.图6a为不同处理的thko小鼠0-16周体重情况。
77.图6b为不同处理的thko小鼠0-16周空腹血糖情况。
78.图6c为不同处理的thko小鼠0-16周空腹胰岛素水平情况。
79.图6d为不同处理的thko小鼠0-16周胰岛素抵抗情况。
80.图6e为葡萄糖耐量试验(gtt)试验测试thko小鼠血糖水平情况。
81.图6f为胰岛素耐量试验(itt)试验测试thko小鼠血糖水平情况。
82.图6g为trim31缺失与肝糖原储备情况。
83.图6h为thko小鼠-hfd饮食引起的肝胰岛素信号失调情况。
84.图7a为hfd-thko小鼠的肝重和肝重/体重情况。
85.图7b为hfd-thko小鼠的血清丙氨酸转氨酶(alt)情况。
86.图7c为hfd-thko小鼠的血清天冬氨酸转氨酶(ast)情况。
87.图7d为hfd-thko小鼠的血清碱性磷酸酶(akp)情况。
88.图7e为hfd-thko小鼠的脂肪酸摄取和合成相关基因、脂肪酸β氧化相关基因表达情况。
89.图7f为高脂饮食的thtg小鼠与ntg小鼠肝重和肝脏/体重比例情况。
90.图7g为高脂饮食的thtg小鼠肝脏脂肪实图。
91.图7h为高脂饮食的thtg小鼠的肝脏功能相关指标情况。
92.图7i为高脂饮食的thtg小鼠肝脏样本油红染色和he染色情况。
93.图7j为高脂饮食的thtg小鼠的脂肪酸摄取和合成相关基因的表达和脂肪酸β氧化相关基因表达情况。
94.图7k为pa处理的原代肝细胞的实图与trim 31表达情况。
95.图8a为高脂饮食的thko和thtg小鼠内脏脂肪情况。
96.图8b为脂饮食的thko和thtg小鼠脂肪细胞的大小情况。
97.图9a为hfd-thko小鼠内炎症相关的信号通路中因子表达情况。
98.图9b为hfd-thtg小鼠内炎症相关的信号通路中因子表达情况。
99.图9c为高脂饮食的thko小鼠血清中炎症相关的因子分泌情况。
100.图9d为pa处理的原代肝细胞中通过活化nf-κb介导的炎症信号情况。
101.图10a为慢病毒包裹完整的鼠trim31基因序列(lv-trim31)流程示意图。
102.图10b为高脂饲料-thko小鼠重量、体重、肝重/体重比情况。
103.图10c为高脂饲料-thko小鼠ast和alt情况。
104.图10d为高脂饲料-thko小鼠肝脏脂质堆积情况。
105.图10e为gtt测试thko小鼠血糖浓度情况。
106.图10f为itt测试thko小鼠血糖浓度情况。
107.图10g为thko小鼠肝脏tg、tc和nefa情况。
108.图10h为肝细胞trim31的表达与高脂饮食-thko小鼠脂肪酸β-氧化基因表达情况。
109.图10i为thko小鼠受损的胰岛素信号和激活的炎症相关信号情况。
110.图10j为thko小鼠受损的胰岛素信号和激活的炎症相关信号情况。
111.图11a为trim31在缓解肝脏脂质堆积、胰岛抵抗和炎症中的作用。
112.图11b为慢病毒介导的trim31表达高饮脂血液中il-1β/ynf-α/il-6水平。
113.图11c为慢病毒介导的trim31表达高饮脂血液中信号因子的mrna水平。
114.图12a为lv-htrim31介导的体外基因治疗流程示意图及trim 31表达情况。
115.图12b为lv-htrim31介导的体外基因治疗修复trim31的小鼠肝脏重量和体重情况。
116.图12c为lv-htrim31介导的体外基因治疗修复trim31的小鼠肝脏样本油红染色和 he染色情况。
117.图12d为lv-htrim31介导的体外基因治疗修复trim31的小鼠血清ast、alt情况。
118.图12e为lv-htrim31介导的体外基因治疗修复trim31的小鼠空腹血糖水平。
119.图12f为lv-htrim31介导的体外基因治疗修复trim31的小鼠血糖水平。
120.图12g为lv-htrim31介导的体外基因治疗修复trim31的小鼠胰岛素抵抗情况。
121.图12h为lv-htrim31介导的体外基因治疗修复trim31的小鼠tg、tc、nefa情况。
122.图12i为lv-htrim31介导的体外基因治疗修复trim31的小鼠相关的因子分泌情况。
123.图12j为lv-htrim31介导的体外基因治疗修复trim31的小鼠相关蛋白表达情况。
124.图12k为lv-htrim31介导的体外基因治疗修复trim31的小鼠血清细胞因子分泌情况。
125.图13a为高脂饮食-thko小鼠与thtg小鼠免疫荧光切片结果。
126.图13b为小鼠体内adam17,tnfr1/2,和p-map3k7及其下游成分情况。
127.图13c为小鼠体外adam17,tnfr1/2,和p-map3k7及其下游成分情况。
128.图13d为转染了adshrhbdf2的thtg肝细胞对pa诱导受损胰岛素信号情况。
129.图14a为转染了adrhbdf2的thtg肝细胞对pa诱导受损胰岛素信号情况。
130.图14b为rhbdf2与trim31的相互结合免疫荧光切片结果。
131.图14c为转染的鼠肝细胞中的trim31和rhbdf2结合情况。
132.图15a为体外相互作用试验情况。
133.图15b为谷胱甘肽硫转移酶(gst)标记情况。
134.图15c为trim31的结构示意简图。
135.图15d为体内rhbdf2的泛素化情况。
136.图15e为具有ring-finger结构域切除突变体的trim31表达载体催化rhbdf2的泛素化情况。
137.图15f为trim31缺陷的l02细胞(thko-l02)中,rhbdf2与k63连接的泛素化情况。
138.图15g为泛素突变质粒体外转染实验情况。
139.图15h为载体转染的trim31缺陷型l02细胞(thko-l02)中,用pa刺激的细胞内tg 浓度变化情况。
140.图16a为带有ring-finger敲除的慢病毒负载trim 31(lv-trim 31ring)的流程示意图。
141.图16b为trim31 ring-finger敲除-肝细胞移植(thko)(lv )的小鼠hfd诱导的肝脏重量、体重、肝重/体重比率情况。
142.图16c为trim31 ring-finger敲除-肝细胞移植(thko)(lv )的小鼠hfd诱导的ast 和alt情况。
143.图16d为trim31 ring-finger敲除-肝细胞移植(thko)(lv )的小鼠hfd诱导的肝脏脂质累计情况。
144.图16e为trim31 ring-finger敲除-肝细胞移植(thko)(lv )的小鼠hfd诱导的空腹血糖水平情况。
145.图16f为trim31 ring-finger敲除-肝细胞移植(thko)(lv )的小鼠hfd诱导的血糖水平情况。
146.图16g为trim31 ring-finger敲除-肝细胞移植(thko)(lv )的小鼠hfd诱导的肝甘油三酯、总胆固醇和nefa含量情况。
147.图16h为高脂饮食的thko(lv )小鼠与脂肪酸摄取、合成过程有关的基因表达和与脂肪酸β-氧化过程有关的基因表达情况。
148.图16i为高脂饮食的thko(lv )小鼠rhbdf2-map3k7信号通路免疫印迹、mrna水平和促炎介质浓度情况。
149.图16j为高脂饮食的thko(lv )小鼠rhbdf2-map3k7下游通路免疫印迹情况。
150.图17a为带有ring-finger敲除的慢病毒负载trim 31(lv-trim 31ring)的流程示意图2。
151.图17b高脂饮食的thko(lv )小鼠促炎介质浓度情况。
152.图17c为高脂饮食的thko(lv )小鼠mrna水平情况。
153.图18a为lv-htrim31体外基因疗法流程示意图。
154.图18b为lv-htrim31体外基因疗法获得的小鼠肝脏重量、体重、肝重/体重比率情况。
155.图18c为lv-htrim31体外基因疗法获得的小鼠肝脏样本油红染色和he染色情况。
156.图18d为lv-htrim31体外基因疗法获得的小鼠血清ast、alt情况。
157.图18e为lv-htrim31体外基因疗法获得的小鼠血糖水平。
158.图18f为lv-htrim31体外基因疗法获得的小鼠tg、tc、nefa情况。
159.图18g为lv-htrim31体外基因疗法获得的小鼠胰岛素抵抗情况。
160.图19a为aav-trim31 ring wt小鼠rhbdf2的表达情况。
161.图19b为aav-trim31 ring wt小鼠体重情况。
162.图19c为aav-trim31 ring wt小鼠空腹血糖水平情况。
163.图19d为aav-trim31 ring wt小鼠血糖水平情况。
164.图19e为aav-trim31 ring wt小鼠肝脏重量情况。
165.图19f为aav-trim31 ring wt小鼠肝脏样本油红染色和he染色情况。
166.图19g为aav-trim31 ring wt小鼠rhbdf2相关表达情况。
167.图19h为aav-trim31 ring wt小鼠rhbdf2下游炎症信号情况。
168.图19i为aav-trim31 ring wt小鼠相关信号的mrna表达水平。
169.图20a为dhko小鼠蛋白质印迹分析肝脏样品情况。
170.图20b为dhko小鼠体重、肝重、肝重/体重比情况。
171.图20c为dhko小鼠空腹血糖水平情况。
172.图20d为dhko小鼠肝脏样本油红染色和he染色情况。
173.图20e为dhko小鼠tg、tc、nefa情况。
174.图20f为dhko小鼠rhbdf2-map3k7轴和下游信号级联情况。
175.图20g为dhko小鼠肝脂质沉积情况。
176.图21a为不同小鼠血糖水平情况。
177.图21b为不同小鼠异常血糖水平情况。
178.图21c为不同小鼠肝脏pas分析图。
179.图21d为不同小鼠促炎症相关基因表达情况。
180.图21e为不同小鼠rhbdf2-map3k7轴信号表达情况。
181.图22为为腺病毒载体诱导的肝细胞的转染效率。
182.图23a为thtg-hfhf小鼠脏重量、肝重/体重比情况。
183.图23b为thtg-hfhf小鼠体重情况。
184.图23c为thtg-hfhf小鼠肝脏tg、tc和nefa浓度情况。
185.图23d为thtg-hfhf小鼠肝脏样本油红染色和he染色情况。
186.图23e为thtg-hfhf小鼠炎症和胶原相关基因表达情况。
187.图23f为thtg-hfhf小鼠肝脂质沉积情况。
188.图23g为thtg-hfhf小鼠脂肪酸合成相关基因表达情况。
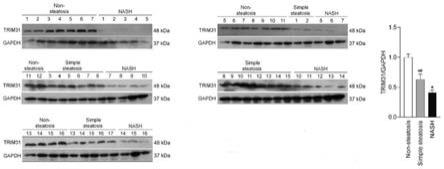
189.图23h为thtg-hfhf小鼠肝脏样品masson染色情况。
190.图23i为thtg-hfhf小鼠炎症相关基因表达情况。
191.图23j为thtg-hfhf小鼠肝纤维化和胶原蛋白合成相关基因表达情况。
192.图23k为thtg-hfhf小鼠rhbdf2-map3k7信号传导示意图。
193.图24为肝细胞特异性trim31缺失(thko)小鼠生产流程示意图。
194.图25为甜菜红素干预对thtg小鼠的相关蛋白表达的影响。
195.图26为漆黄素干预对thtg小鼠的相关蛋白基因的mrna水平的影响。
196.图27为胭脂红酸干预对thtg小鼠的相关蛋白表达或mrna水平的影响。
具体实施方式
197.所举实施例是为了更好地对本发明进行说明,但并不是本发明的内容仅局限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
198.实施例试剂
199.本发明实施例中,使用的一抗及其稀释比例包括:anti-gapdh(#2118,dilution1:10000),p-akt(#4060,dilution1:1000),akt(#4691,dilution1:1000),p-gsk3β(#9322,dilution1:1000),gsk3β(#12456,dilution1:1000),foxo1(#2880,dilution1:1000),anti-p-jnk(#4668,dilution1:1000),anti-jnk(#9258,dilution1:1000),anti-map3k7(#4505,dilution1:1000),anti-p-map3k7(#9339,dilution1:1000)andp-iκbα(#2859,dilution1:1000)购自cst公司;anti-tnfr1(#ab223352,dilution1:1000),anti-tnfr2(#ab109322,dilution1:1000),anti-mkk7(#ab52618,dilution1:1000),anti-p-mkk7(#ab192592,dilution1:1000),anti-c-jun(#ab40766,dilution1:1000),anti-p-c-jun(#ab32385,dilution1:1000),anti-irs-1(#ab52167,dilution1:1000),anti-nf-κb(#ab16502,dilution1:1000),anti-p-nf-κb(#ab86299,dilution1:1000),p-foxo1(#ab131339,dilution1:1000),anti-iκbα(#ab32518,dilution1:1000),anti-ikkβ(#ab124957,dilution1:1000)andanti-rhbdf2(#ab116139,dilution1:1000)购自abcam公司;anti-p-map3k7(#pa5-99340,dilution1:1000),anti-p-ikkβ(#pa5-36653,dilution1:1000),anti-trim31(#pa5-40961,dilution1:1000),anti-adam17(#pa5-27395,dilution1:1000)andanti-p-irs-1(ser
307
)(#pa1-1054,dilution1:1000)购自赛默飞公司。
200.本发明实施例中,其他抗体购自santa公司和密理博公司。
201.实施例动物模型
202.本发明实施例中,使用crispr/cas9介导的基因工程系统构建基于c57bl/6n背景的trim31
flox/flox
小鼠。选择trim31的外显子4和5作为条件性敲除区域(cko)。选定的trim31外显子两侧作为loxp位点,随后设计两个靶向trim31内含子的向导rna(grna1和grna2)。含有侧翼为两个loxp位点和两个同源臂的trim31外显子4和5的靶向载体作为模板。将靶向载体、向导rna1和引导rna2和cas9mrna共同注射到受精卵中,用于cko小鼠生产。获得的小鼠在外显子4和5两个等位基因两侧都具有loxp位点,然后作为trim31
flox/flox
小鼠。通过将trim31
flox/flox
小鼠与alb-cre(alb-cre)小鼠(jacksonlaboratory,barharbor,maine,usa)交配而产生的后代子鼠,并选取纯合子作为肝细胞特异性trim31缺失(thko)小鼠使用(如图24所示)。同时使用trim31
flox/flox
小鼠的同窝小鼠作为获得的thko小鼠的对照。
203.本发明实施例中,使用crispr/cas9系统通过特异性敲除肝细胞中rhbdf2的第4个外显子来创建肝细胞特异性rhbdf2基因敲除(rhko)小鼠。有关这些小鼠的建立和基因型测定的详细方法和信息已在xumin-xuan,tanjun,etal.,dysfunctionalrhbdf2of
trim31 ring
δ
(含有2
×
10
11
vg的100μl病毒),然后用hfd喂养另外 10周。将空载体(aav-gfp)注射到小鼠体内作为相应的对照。
214.本发明实施例中,进行动物实验4#,建立脂肪肝小鼠模型的方法为:将6-8周龄的雄性thko、rhko、dhko、thtg小鼠及其对应的同窝对照小鼠喂食hfd饲料16周,观察病理变化。此外,周龄相当的thko、rhko、dhko、thtg小鼠和同窝仔鼠分别用ncd饲料喂养16 周并作为对照处理。
215.本发明实施例中,进行动物实验5#,为了进一步验证trim31对肝脂肪变性的保护作用,先建立非酒精性脂肪性肝炎(nash)小鼠模型,然后用hfhf饮食(14%蛋白质,42%脂肪、44%碳水化合物、0.2%胆固醇和总共42g/l的碳水化合物以55%果糖和45%蔗糖的重量比混合在饮用水中)饲喂16周,以产生nash表型。此外,在此设计中使用的ntg小鼠作为对照,并被同步允许随意获取这种饮食16周。
216.本发明实施例中,使用pa进行于体外实验,以前的研究表明游离脂肪酸从脂肪细胞里释放增加会导致肝细胞中甘油三酯(tg)的累积,促进脂肪变性向脂肪肝炎发展。饱和脂肪包括棕榈酸(pa)和硬脂酸比其他脂肪酸毒性更大,在脂肪肝炎模型中促进肝细胞毒性。在肝脏中tg的大量沉积是由脂质代谢紊乱引起的。代谢紊乱不但促进脂肪变性和肝损伤,而且还显著抑制胰岛素信号,促进胰岛素抵抗。
217.细胞培养与处理
218.本发明实施例中,使用的l02细胞系(人类正常肝细胞系)获自中国科学院典型培养物保藏中心,本发明申请人的实验室使用的所有复苏细胞系均传代不超过30次。参与本发明实施例的细胞系需要通过pcr分析检测以排除支原体污染。l02细胞培养在含有10%胎牛血清(#16140071,gibco
tm
)和1%青霉素-链霉素(#15140-122;gibco
tm
)和在5%co2、 37℃水套式细胞培养箱(thermo fisher scientific)中。
219.本发明实施例中,使用的原代肝细胞通过肝脏灌注方法从相应的实验小鼠中分离和收集。简而言之,在无痛麻醉条件下,打开小鼠腹腔。通过肝脏门静脉用1
×
肝脏灌注培养基 (#17701-038,gibco
tm
)和1
×
肝脏消化培养基(#17703-034,gibco
tm
)仔细灌注。然后,用100μm钢网研磨和过滤消化后的肝组织。将滤液以800rpm、4℃5min离心收集原代肝细胞,并用50%percoll细胞分离液(#17-0891-01,ge healthcare life sciences)进一步纯化。获得的肝细胞在含10%胎牛血清和1%青霉素-链霉素的dmem培养基中培养,在5% co2、37℃细胞培养箱中培养。
220.本发明实施例中,为了构建体外脂质沉积的细胞模型,制备并获得相应浓度的棕榈酸 (pa)(溶于0.5%不含脂肪酸的牛血清白蛋白bsa)。然后,原代肝细胞或l02细胞用含有细胞培养基的pa处理10小时或4小时。单独使用不含脂肪酸的bsa(0.5%)作为载体对照。
221.敲除细胞系的建立
222.本发明实施例中,使用的trim31敲除细胞系的构建和方法为:通过crispr/cas9基因编辑系统构建trim31缺失的细胞系,产生靶向人类trim31基因的sgrna并将其包装到慢病毒crispr-v2载体中以形成cas9-sgrna慢病毒。用于生成sgrna表达载体的寡核苷酸序列为:sgrna-f:cacccaactcgctgttgcggaatc;和sgrna-r:aaacgattccgcaacagcgagttg。然后使用6转染试剂将包装载体pspax2和pmd2。g以及sgrna表达载体分别转染到hek293t细胞中42小时。接下来,将获得的含有慢病毒的上清液转入l02细胞以构建基因敲除细胞
系。通过免疫印迹法选择靶基因缺失的细胞克隆。
223.质粒构建与转染
224.本发明实施例中,通过基于pcr的cdna扩增建立人或小鼠全长rhbdf2和trim31表达质粒,然后克隆到3
×
flag-tagged pcdna3.1载体或3
×
ha-tagged pcdna3.1载体 (invitrogen)中。使用标准pcr获得截断的rhbdf2和trim31片段表达载体,包括 trim31-flag ring
δ
、trim31-flag box
δ
、trim31-flag cc
δ
、rhbdf2-ha tmd
δ
、rhbdf2-ha irhd
δ
和rhbdf2-ha tail
δ
,如图例所示方法,然后克隆到相应的载体中。基于pcdna3.1载体构建 myc-标记的泛素wt表达载体。此外,泛素和相应的衍生物包括仅含有唯一完整的氨基酸残基的泛素-k48o、泛素-k63o、泛素-k33o、泛素-k6o、泛素-k29o、泛素-k27o和对照载体,然后荷载入myc标记的pcdna3.1质粒(thermo fisher scientific)。根据使用说明书,使用lipofectamine
tm
3000转染试剂(invitrogen
tm
)将载体小心地转染到l02细胞中。
225.本发明实施例中,构建一个负载腺病毒的trim31表达载体方法为:分别将针对靶向人trim31序列的特异性短发夹rna寡核苷酸序列(shtrim31)(shrna序列rnai#1: ttcccgtcaaaggaagtttgg;rnai#2:tatgatggactcatgccttgc),通过easy adenoviral vectorsystem kit试剂盒(#240009,安捷伦科技)荷载入腺病毒(adtrim31;adshtrim31)中。adshgfp 分别用作敲除或过表达的对照。纯化重组腺病毒并滴定至5
×
10
10
(pfu)。之后用培养基稀释的腺病毒感染肝细胞,感染次数为50次,感染时间为24小时。
226.腺相关病毒和慢病毒构建与制备
227.本发明实施例中,cag启动子序列如sequenceno:9所示,cmv启动子序列如 sequenceno:10所示。
228.本发明实施例中,小鼠的trim31表达基因如sequenceno:6所示,小鼠的rhbdf2 表达基因如sequenceno:8所示。
229.本发明实施例中,使用的aav8-tbg载体是一种预包装的8血清型aav,具有gfp 过表达,用于生产重组aav8-tbg-目的基因-gfp表达载体。重组aav8-tbg-目的基因-gfp表达载体包含来自甲状腺素结合球蛋白(tbg)启动子的转录控制元件、用于插入互补dna和 polya信号的克隆位点。aav血清型2的末端重复位于表达框的两侧。
230.本发明实施例中,将鼠全长trim31序列或具有ring结构域缺失的trim31序列分别克隆到载体aav8-tbg-gfp中。通过virabind
tm
aav purification mega kit试剂盒 (vpk-141/vpk-141-5,cell biolabs,vpk-141/vpk-141-5,san diego,usa)将新创建的载体aav-tbg-trim31-gfp或aav-tbg-trim31 ring
△-gfp被包装到aav8中,并相应地通过quicktiter
tm
aav quantitaiton kit(cell biolabs,vpk-145)进行滴定。注射前立即用生理盐水将病毒颗粒稀释至50μl的总体积。
231.本发明实施例中,为了构建慢病毒-trim31(lv-trim31)或具有ring结构域缺失的慢病毒-trim31(lv-trim31 ring
△
)载体,将全长trim31 cdna序列荷载入 plenti-cmv-gfp-puro(addgene)中以进行上调trim31表达(plenti-cmv-trim31-gfp-puro 或plenti-cmv-trim31 ring
△-gfp-puro)。通过商业化的lenti-pac hiv表达包装试剂盒 (lt002,genecopoeia,md,美国)和相应的lenti-pac 293ta细胞系用于制备lv颗粒。接下来,根据产品说明,收集含有病毒颗粒的293t细胞培养基上清液。新创建的载体通过 virabind
tm
plus慢病毒浓缩和纯化试剂盒(cell biolabs,vpk-095)进行浓缩和纯化,然后通过
quicktiter
tm
慢病毒定量试剂盒(cell biolabs,vpk-112)进行滴定。病毒产出量介于106tu/ml范围内的功能性lv滴度,并且在浓缩后保证达到109tu/ml的滴度产量。
232.本发明实施例中,细胞内甘油三酯检测的为:根据试剂盒实验使用说明,使用商业化甘油三酯检测试剂盒定量(#ab65336,abcam)检测细胞内甘油三酯(tg)水平。
233.本发明实施例中,代谢指标与血清细胞因子的检测为:为进行葡萄糖耐量试验(gtt) 和胰岛素耐量试验(itt),本部分实验小鼠禁食8h,以确保生理反应正常,而后给小鼠腹腔注射葡萄糖(2g/kg bw)(#158968,sigma-aldrich,上海,china)。然后,使用市售血糖试纸(accu-roche diabetes care gmbh,上海,中国)进行小鼠血糖含量检测。为了检查胰岛素耐受性测试,给小鼠腹膜内注射定量的胰岛素(1u/kg bw,sigma aldrich),而后测定小鼠血液中的胰岛素含量。在注射后0分钟、15分钟、30分钟、60分钟和120分钟时从尾静脉采集血样,用于检测葡萄糖水平。稳态模型评估(homa)-ir指数分别根据空腹血糖和血清胰岛素水平计算。使用相应的商业化酶联免疫吸附测定(elisa)试剂盒评估小鼠血清中的细胞因子和趋化因子水平。tnf-α(#mta00b)、il-1β(#mlb00c)、il-10(#m1000b)、 il-6(#m6000b)和ccl-2(#mje00b)elisa试剂盒购自r&d system(上海,中国),并按产品使用说明使用。所有相应的血清在使用前均保证储存在-80℃冰箱中。
234.本发明实施例中,肝功能参数和肝脂水平检测为:血清丙氨酸转氨酶(alt)(#mak052, sigma-aldrich)、天冬氨酸转氨酶(ast)(#mak055,sigma-aldrich)、碱性磷酸酶(akp) (#ab83369,abcam)、血清胰岛素(#ab277390,abcam)和肝甘油三酯(tg)(#mak266, sigma-aldrich)、总胆固醇(tc)(#ab65359,abcam)和非酯化游离脂肪酸(nefa)(#e-bc-k014, elabscience,inc.,休斯顿,美国)均使用市售检测试剂盒在指定的实验组中进行检测。
235.本发明实施例中,病理组织学检查方法为:为了进行组织学和免疫组织化学分析,肝脏样本相应地用10%中性福尔马林组织固定剂(#ht501128,sigma-aldrich)固定,石蜡包埋(#ya0010,solarbio life sciences,beijing,china),然后切片机薄切组织切片。薄肝样品切片用苏木精和伊红(h&e)(#abs9217,苏木精和伊红染色试剂盒,absin,上海,中国)染色,以可视化脂质沉积和组织损伤。为了显示肝脏中的脂质积累,将切片在tissue-tek (oct)(#4583,tissue-tek,sakura finetek,usa)中冷冻包埋,然后用油红o染色试剂盒(#ab150678,abcam)染色10分钟,后用60%异丙醇(#i9030,sigma-aldrich)冲洗后,将组织切片用苏木精重新染色以显色脂质沉积水平。此外,为了可视化肝脏样品中的糖原水平,切片用高碘酸-希夫染色(pas)(#g1281,索莱宝生命科学,北京,中国)染色。为了进行免疫组织化学测定,在用包括抗rhbdf2(#orb386934,biobyt,稀释1:250)、抗trim31 (#pa5-40961,稀释1:200)或抗p-map3k7在内的一抗处理之前,对包埋切片进行脱石蜡处理(#pa5-99340,稀释1:200)后,进行染色。相应的山羊抗小鼠或抗兔igg抗体(abcam) 用作二抗。
236.本发明实施例中,免疫沉淀法为:使用lipofectamine
tm
3000转染试剂 (invitrogen
tm
)转染相应载体进入l02细胞,而后再培养36小时。随后,收集细胞并在4℃下将细胞匀浆到免疫沉淀(ip)特异性裂解液(#87787,pierce
tm
ip裂解缓冲液,thermoscientific pierce)中,然后在冷冻离心机中以13000rpm离心20分钟。将收集的细胞裂解物与protein a/g magnetic agarose beads(#78609,thermo scientific pierce)在室温下混合孵育2小时,然后与指定的抗体在4℃下混合过夜。在用免疫沉淀缓冲液洗涤后收获
免疫化合物,并通过与指定的一抗和相应的二抗孵育进行蛋白质印迹分析。
237.本发明实施例中,谷胱甘肽s-转移酶(gst)pulldown测定法为:trim31和rhbdf2之间的直接蛋白质相互作用结合使用gstpulldown测定法进行。pierce
tm
gst蛋白质相互作用pulldown试剂盒(#21516,thermofisherscientific)用于本部分实验检测。简言之,用质粒pgex-4t-1-gst-trim31或pgex-4t-1-gst-rhbdf2转化rosetta(de3)大肠杆菌细胞,然后与0.5mm异丙基β-d-孵育诱导表达硫代吡喃半乳糖苷(iptg)(#i5502,sigma-aldrich)共同孵育。而后,将裂解的e.coli提取物与gst珠子在4℃下混合1小时。然后将gst珠子与带flag标签的trim31或带flag标签的rhbdf2一起孵育4小时。而后通过洗脱缓冲液中洗脱相互作用的蛋白质复合物,并使用抗flag抗体进行蛋白质印迹分析。仅表达gst标签的大肠杆菌构建的载体用作阴性对照。
238.本发明实施例中,体外结合与泛素化实验方法为:将trim31、rhbdf2和具有ring结构域缺失的trim31蛋白使用快速偶联转录/翻译系统(promega)在体外微管中表达。通过混合相应的flag进行蛋白质相互作用结合测定。将rhbdf2和trim31标记在一起,然后用flag抗体进行免疫沉淀并用trim31抗体进行免疫印迹。泛素化水平使用泛素化试剂盒(bostonbiochem)进行分析测定。
239.本发明实施例中,免疫印迹分析方法为:将细胞或肝组织匀浆到ripa裂解液和提取缓冲液(#9806,cst)中以获得单一匀浆。然后,在13500rpm、4℃下离心30分钟浓缩液体上清液。蛋白质浓度通过pierce
tm
rapidgoldbca蛋白质测定试剂盒(thermofisherscientific)以牛血清白蛋白作为标准测定匀浆液中的总蛋白浓度。然后对总蛋白质提取样品进行蛋白质印迹分析。等量的细胞或组织总蛋白上样10%或12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)系统,然后转移到0.45μmpvdf膜(milliporecompany,usa),使用指定的免疫印迹一抗进行一抗孵育。接下来,将pvdf膜置于含有0.1%tween-20(#1247ml100,biofroxx,德国)的1
×
tbs缓冲液(#t1080,solarbio,北京,中国)的5%脱脂牛奶(difcotm脱脂牛奶,bd,美国)中一起孵育(tbst)1小时,并在4℃下与一抗混合过夜。随后,膜在1
×
tbst中冲洗3次,随后与hrp偶联的抗兔或抗小鼠二抗(abcam)在室温(25℃)下孵育1-2小时。通过pierce
tm
eclpluswesternblottingsubstrate(#32134,thermofisherscientific)观察免疫印迹条带,并于暗室中曝光于kodak(eastmankodakcompany,usa)x射线胶片上。然后将相应的蛋白质表达标定为灰度值(version1.52g,macosxsnowleopard,imagej,美国国立卫生研究院)并标准化为管家基因(gapdh),并表示为对照的倍数。
240.本发明实施例中,提出的相关实验至少独立进行了三次,所有的数据都使用该统计方法进行分析,除另有说明外。统计方法为:数据的定量值均以均数
±
均数标准误差表示。比较采用单因素方差分析(anova),多组采用dunnett多重比较检验,两组采用双尾t检验。数据分析采用graphpadprism软件(version8.2.0formacosxsnowleopard;graphpadsoftware,inc.,sandiego,ca)和spss统计软件(version26.0.0.2formacosxsnowleopard;ibm,inc.,newyork,usa)。p值小于0.05(p《0.05)被认为有统计学意义。动物实验数据的采集是随机的。在最终的统计分析中没有数据被排除。
241.实施例1在肝脂肪变性的肝脏中,trim31的活性受到抑制验证
242.本发明实施例为了验证trim31参与了肝脏脂肪变性和代谢,从正常饮食小鼠模型
trim31直接与rhbdf2相互作用。
276.体外相互作用试验表明,trim31的外源表达可以直接与rhbdf2结合,反之亦然(图 15a)。随后,谷胱甘肽硫转移酶(gst)标记的rhbdf2很明显地与trim31结合,gst标记的trim31也与rhbdf2结合(图15b)。这些数据揭示了trim31与rhbdf2的直接相互作用。
277.作为e3泛素连接酶的关键成员,trim31主要由三部分组成:n端环指结构域、b盒结构域和c端螺旋结构域(图15c)。为了确定trim31的哪一个结构域与rhbdf2结合,本发明实施例选择了产生一系列带有标记载体的截短的trim31突变体,包括野生型(trim31-flagwt)、环指结构域切除突变体(trim 31-flag ring)、b-box结构域缺失突变体(trim 31-flagbox)和螺旋结构域缺失突变体(trim 31-flagcc)载体,用于以下结合实验。
278.免疫共沉淀分析表明rhbdf2与野生型、环指结构域切除突变体和b-box结构域缺失突变体共沉淀。这些结果表明,卷曲螺旋结构域有助于其结合rhbdf2的能力。
279.接下来,本发明实施例还建立了3个带有ha标签的质粒的rhbdf2截短突变体,一共包括野生型(rhbdf2-ha wt)、跨膜结构域(tmd)缺失突变体(rhbdf2-ha tm)、非活性菱形同源结构域(irhd)缺失突变体(rhbdf2-ha irhdd)和n末端细胞质尾(tail)结构域缺失突变体 (rhbdf2-ha tail)载体。用这些rhbdf2突变体进行的免疫共沉淀结果表明,rhbdf2-ha tail 没有与trim31结合的能力。
280.因此,rhbdf2的氮末端胞质尾区(tail)结构域对于与trim31的相互结合作用是必需的(图15c和图14b)。
281.另外,因为人体内trim31的cc结构域和rhbdf2的n端结构域(tail)对于它们的相互作用是必须的,所以本发明实施例检验了它们是否在老鼠身上也有相似的生物功能。因此,老鼠trim31和rhbdf2的结合域也用trim31-flag ccδ,rhbdf2-ha tail
δ
,和相应的野生型载体来检测。与蛋白结合实验结果一致,在转染的鼠肝细胞中,cc域缺失的trim31 不能和rhbdf2结合(图14c)。
282.实施例7验证trim31通过k48连接的多泛素化促进rhbdf2的降解
283.本发明实施例验证trim31通过k48连接的多泛素化能促进rhbdf2的降解,之前推测 rhbdf2在细胞质内的结构域上可能会有k48泛素化的结合位点,由此使蛋白酶体降解。实施例6已经确认了trim31和rhbdf2能够相互作用(图15c)。
284.因此,本发明实施例验证通过trim31及其相应的e3泛素化连接酶是否能rhbdf2的活性对进行调控,实验结果表明,体内外rhbdf2的泛素化水平显著提高(图15d和图2f)。
285.此外,本发明实施例将rhbdf2和myc-ubiquitin和标记的野生型trim31一起转入 l02细胞。此时rhbdf2泛素化水平伴随着trim31载体的存在而显著上升。而且,具有 ring-finger结构域切除突变体的trim31表达载体不能催化rhbdf2的泛素化,这表明功能性trim31需要ring-finger结构域来调节rhbdf2的泛素修饰(图15e)。
286.此外,之前的研究表明rhbdf2可以通过k63连接的泛素化进行修饰。而与之前的研究一致,在pa处理的l02细胞中内源性rhbdf2几乎是泛素化的,且能和k48和k63连接。在trim31缺陷的l02细胞(thko-l02)中,只有rhbdf2的k48连接的多泛素化被显著抑制,但是对rhbdf2与k63连接的泛素化的影响可以忽略不计(图15f)。
287.此外,为了准确研究trim31调节rhbdf多泛素化的方式,本发明实施例用泛素突变质粒k48、k63、k33、k6、k29和k27进行体外转染实验。k48o、k63o、k33o、k6o、k29o和 k27o中“o”的标记揭示了泛素中除了它们本身之外的所有赖氨酸残基都被完全突变。相反,在k48载体存在的情况下,可以观察到大量的trim31介导的rhbdf2多泛素化的增加,但在其他载体中没有(图15g)。
288.所以本发明实施例验证了,ring-finger结构域突变体实际上消除了trim31的e3泛素连接酶活性。鉴于ring-finger结构域在trim31功能中的重要作用,trim31的 ring-finger结构域缺失不仅消除了rhbdf2的多泛素化,而且阻碍了trim31抑制rhbdf2-map3k7通路及其下游信号级联的激活的能力(e.g.,adam17,p-nf-κb,p-iκbαandp-jnk1/2)(图15g)。
289.本发明实施例在载体转染的trim31缺陷型l02细胞(thko-l02)中,用pa刺激的细胞内tg浓度变化进一步证明了ring-finger结构域缺失对trim31功能的负面影响(图15h)。
290.综上所述,trim31诱导的rhbdf2通过k48连接的多泛素化降解依赖于其e3泛素连接酶活性。
291.实施例8验证trim31-rhbdf2相互作用是trim31调节的肝脂肪变性和炎症所必需的
292.考虑到rhbdf2活性与trim31的e3泛素连接酶活性之间的紧密相关性,为了彻底了解trim31-rhbdf2相互作用是否是trim31对肝脂肪变性的保护功能所必需的。
293.本发明实施例建立了一个带有ring-finger敲除的慢病毒负载trim 31(lv-trim 31 ring),并再次用于进一步研究trim 31ring对hfd诱导的肝脂肪变性、胰岛素抵抗和炎症的影响(图16a和图17a)。正如本发明在细胞实验中所预期的结果,与对照组(thko)(lv-) 相比,采用trim31 ring-finger敲除-肝细胞移植(thko)(lv )的小鼠未能改变hfd诱导的肝脏重量、体重、肝重/体重比率、肝功能指标ast和alt以及肝脏脂质累计(图16b-16d)。
294.此外,血糖水平和肝甘油三酯、总胆固醇和nefa含量的分析表明没有显著差异(图 16e-16g)。同时,在高脂饮食的thko(lv )小鼠中,缺失ring-finger结构域的肝细胞trim31 不能调节与脂肪酸摄取、合成过程有关的基因表达和与脂肪酸β-氧化过程有关的基因表达 (图16h)。更重要的是,与对照组相比,胰岛素信号传导没有任何活性变化,并且可以明显观察到rhbdf2-map3k7信号通路和下游通路,如免疫印迹、mrna水平和促炎介质浓度没有显著性改变(图16i,16j和图17b,17c)。
295.与这些发现一致,本发明实施例还用lv-htrim31体外基因疗法进一步证实了老鼠被移植了人trim31 ring-肝细胞也没有明显缓解高脂饮食诱导的胰岛素抵抗,肝脂肪变性和炎症(图18a-18g)。这些结果进一步表明鼠和人的trim31的ring结构对e3泛素蛋白连接酶的保护性功能是必须的。
296.另外,携带有ring-finger结构域突变体(aav-trim31 ring)的trim31的腺相关病毒亚型8(aav8)-甲状腺素结合球蛋白(tbg)被相应地产生并和aav-trim31平行注射到6周 hfd喂养的预处理wt小鼠中,注射aav-gfp的小鼠作为对照(图19a)。毫无疑问,注射 aav-trim31 ring结构突变体在体重、血糖水平、血胰岛素水平、肝脏重量、lw/bw比值、肝功能指标ast、alt和akp、病理表型改变以及肝脏tg、tc和nefa水平方面调节功能的能力丧失,而aav-trim31则没有(图19b-19f)。同时,与细胞实验得出的数据一致,给予aav-trim31 ring结构域突变体的小鼠在改善受损的胰岛素信号、脂肪酸摄取/合成和脂肪酸β-氧化的基因表达变化以及rhbdf2相关的下游炎症信号级联方面没有显示任何显著变化(图19g-19i)。
总的来说,trim31-rhbdf2相互作用和trim31的ring-finger结构域对于trim31调节的肝脂肪变性和炎症至关重要。
297.实施例9验证trim31通过靶向rhbdf2调节保护肝脏脂肪变性
298.本发明实施例为了进一步研究抑制rhbdf2信号介导trim31对脂肪肝的保护作用,将肝细胞特异性trim31缺乏小鼠(thko)与rhbdf2
flox/flox
小鼠(alb-cre;如“实施例动物模型”一节所述,使用rhbdf2
flox/flox
(以下简称rhko)产生肝细胞特异性trim31和rhbdf2双缺失小鼠(alb-cre;rhbdf2
flox/flox
,trim31flox/flox,以下简称dhko)。通过蛋白质印迹分析确定肝脏样品中trim31和rhbdf2的含量(图20a)。之前的研究已经证实了rhbdf2缺失能缓解长期 hfd诱导引起的脂肪性肝炎。rhbdf2缺失阻断了trim31消融对hfd刺激的rhbdf2-map3k7轴和下游信号级联、体重、肝重、肝重/体重比、受损胰岛素信号、异常血糖水平、肝脂质沉积和促炎症相关基因表达升高的影响(图20a-20f和图21a-21e)。此外,在体外检测pa诱导的细胞内甘油三酯水平的变化也有相同的趋势(图20g和图22)。这些结果都证明了trim31对 nafld的保护作用是通过rhbdf2信号途径进行调控的。
299.实施例10非酒精性脂肪性肝炎靶向trim31-rhbdf2信号治疗的可行性和效果评价
300.基于trim31对非酒精性脂肪性肝病的有效保护作用,本发明实施例验证了靶向 trim31-rhbdf2-map37k通路在nash发展和进展中的治疗可行性和效果。然后用含14%蛋白质、 42%脂肪、44%碳水化合物、0.2%胆固醇的hfhf饮食喂养thtg小鼠,并以55%果糖和45%蔗糖的重量比在饮用水中混合总共42g/l的碳水化合物,持续16周,以构建具有nash表型的小鼠(thtg-hfhf)。
301.此外,ntg小鼠被用作对照(ntg-hfhf),并用相同的饮食随意喂养16周。不出所料,在hfhf诱导产生的nash模型中,在hfhf饮食16周后,thtg组的肝脏重量、肝重/体重比以及肝脏tg、tc和nefa浓度明显低于ntg对照组,同时thtg-hfhf和ntg-hfhf小鼠之间的体重没有显著差异(图23a-23c)。
302.而且,与ntg小鼠相比,在hfhf饮食处理后,通过h&e染色、油红o染色、f4/80 免疫组化分析、天狼星红染色、masson染色、炎症和胶原相关基因表达水平测定,在thtg 小鼠中观察到肝脂质沉积,脂肪酸合成相关基因表达(e.g.,cd36,fasn,and acaca),炎症相关基因表达(e.g.,tnf-α,il-1β,il-6,and ccl-2),肝纤维化(i.e.,collagendeposition)和胶原蛋白合成相关基因表达(e.g.,timp1,ctgf,col1a1,and col3a1)显著减少(图23d-23i)。在16周的hfhf饮食后,trim31的过度表达还明显下调了小鼠血清ast、 alt和akp水平、促炎细胞因子tnf-α、il-6和il-1β的浓度以及trim31调节的 rhbdf2-map3k7信号通路和下游信号通路。总的来说,本发明实施例数据揭示了trim31在治疗小鼠脂肪性肝炎和相关代谢综合征中的疗效。
303.在本发明实施例中,使用肝细胞特异性trim31敲除的小鼠(thko)/转基因小鼠(thtg) 和慢病毒介导的离体基因治疗(lv-trim31)小鼠,本发明确定肝脏trim31是高脂饮食 (hfd/hfhf)诱导或遗传诱导的慢性炎症、胰岛素抵抗、肝脏脂肪变性和nash的显著负调节因子。对潜在分子机制的研究发现,在长期的高热量饮食下,体内和体外实验中明显观察到 trim31的减少,这导致rhbdf2-ma3k7信号通路激活的增加。在trim31功能失调的情况下,强烈激活的rhbdf2-map3k7信号传导进一步介导下游信号通路表达的增加,包括jnk-irs1相关的胰岛素信号传导、iκbα-nf-κb-c-jun通路、akt-gsk3β-foxo1磷酸化水平的抑制
和 ctgf-timp1通路,促进受损的胰岛素信号传导(胰岛素抵抗)、慢性炎症作用、异常的葡萄糖代谢紊乱和肝脏中的胶原沉积的发生,从而加重异常的脂质代谢,以及肝脏脂肪变性和nash 表型的产生(图23k)。
304.实施例11甜菜红素(bcn)激活trim31缓解小鼠肝纤维化和炎症
305.按照实施例10构建具有nash表型的小鼠(thtg-hfhf)。设空白组(ctrl)、nash组 (thtg)和给药组(bcn),给药组采用0.2g/kg比例将甜菜红素(bcn)与饲料混合后喂养。如图25所示,16周后,thtg-hfhf小鼠肝脏中的胶原蛋白i(collagen i),tgf-β1,keap1 蛋白表达水平显著升高,trim31蛋白表达显著降低,说明高糖高脂引起胶原蛋白积累和氧化应激导致非酒精性脂肪肝炎。用bcn给药干预的小鼠肝组织中胶原蛋白i(collagen i), tgf-β1,keap1蛋白表达水平显著降低,trim31蛋白表达显著升高,接近控制组正常水平,有效缓解了肝脏纤维化和炎症。
306.实施例12漆黄素(fis)激活trim31缓解小鼠肝纤维化和炎症
307.按照实施例10构建具有nash表型的小鼠(thtg-hfhf)。设空白组(con)、nash-thtg 组(hfd)和给药组(fis),给药组采用20mg/kg,40mg/kg,80mg/kg剂量的漆黄素(fis) 灌胃。如图26所示,16周后,thtg-hfhf小鼠肝脏中的α-sma、胶原蛋白i(collagen i), tgf-β1,fibronectin等蛋白基因的mrna水平显著升高,trim31蛋白基因的mrna水平显著降低,说明高糖高脂引起胶原蛋白积累和氧化应激导致非酒精性脂肪肝炎。用低、中、高剂量的fis治疗的小鼠肝组织中α-sma,胶原蛋白i(collagen i),tgf-β1,fibronectin 蛋白基因的mrna水平显著降低,trim31蛋白基因的mrna水平显著升高,特别是高剂量给药组接近控制组正常水平,有效缓解了肝脏纤维化和炎症。
308.实施例12胭脂红酸(ca)激活trim31缓解小鼠肝纤维化和炎症
309.按照实施例10构建具有nash表型的小鼠(thtg-hfhf)。设空白组(con)、nash-thtg 组(fru),低剂量给药组(cal,0.5%ca fru),高剂量给药组(cah,1%ca fru),给药组采用0.5%和1%的胭脂红酸(ca)灌胃。如图27所示,16周后,thtg-hfhf小鼠肝脏中的α-sma、胶原蛋白i(collagen i),tgf-β1,mmp-9等蛋白基因的mrna水平显著升高,keap1蛋白表达水平显著升高,trim31蛋白表达显著降低,说明高糖高脂引起胶原蛋白积累和氧化应激导致非酒精性脂肪肝炎。用低、高剂量的ca治疗的小鼠肝组织中α-sma,胶原蛋白i(collageni),tgf-β1,mmp-9蛋白基因的mrna水平显著降低,keap1蛋白表达水平显著降低,trim31 蛋白表达显著升高,特别是高剂量给药组接近控制组正常水平,有效缓解了肝脏纤维化和炎症。
310.需要说明的是,除了本发明实施例11-实施13提供的甜菜红素、漆黄素、胭脂红酸可以激活trim31缓解小鼠肝纤维化和炎症外,以下几种物质((1)-(6))的一种或多种组合均可以达到激活trim31缓解小鼠肝纤维化和炎症的效果:
311.(1)生物碱类化合物或组合物,包括小檗碱,木兰花碱,骆驼蓬碱,蛇根碱,益母草碱,粉防己碱,常山碱,浙贝母碱,秋水仙碱,胡椒碱,钩藤碱,喜树碱,延胡索乙素,药根碱,白屈菜碱,石蒜碱,山油柑碱,苦参碱,氧化苦参碱中的一种化合物或多种化合物组成的组合物;
312.(2)黄酮类化合物或组合物,包括槲皮素,二氢槲皮素,木犀草素,桑色素,桑皮黄素,芹菜素,香叶木素,白杨素,苜蓿素,葛根素,花青素,原花青素,大豆黄素,芹菜素,黄芩
素,野黄芩素,白杨素,汉黄芩素,矢车菊素,水飞蓟素,水飞蓟宾,黄豆苷元,染料木素,高良姜黄素,山奈酚,异鼠李素,杨梅黄酮,橙皮素,柚皮素,甘草素,儿茶素,表儿茶素,没食子儿茶素,矢车菊素,飞燕草素,花葵素,灯盏花素,阿福豆素,芦丁,木犀草苷,黄芩苷,芹菜苷,胡桃苷中的一种化合物或多种化合物组成的组合物;
313.(3)多酚类化合物或组合物,包括绿原酸,洋蓟酸,菜蓟糖苷,菜蓟苦素,茶多酚,白藜芦醇,石榴多酚,姜黄素,阿魏酸中的一种化合物或多种化合物组成的组合物;
314.(4)胺类化合物或组合物:青霉胺,泊马度胺,来那度胺,沙利度胺中的一种化合物或多种化合物组成的组合物;
315.(5)中药提取物,包括黄芪、党参、丹参、当归、山药、三七、五味子、黄精、灵芝、云芝、洋蓟、小蓟、水飞蓟、葛根、黄连、黄柏、姜黄、金银花、枳椇、陈皮、桑叶、银杏叶、百合、熊胆、猪胆、茵陈、枳壳、甘草、虎杖、槐米、丹皮、垂盆草、栀子、枸杞、白芍、川芎、桃仁、大黄、菊花、溪黄草、白花蛇舌草、防己、白茅根、半枝莲、柴胡、茯苓、山药中的一种提取物或多种提取物组成的组合物;
316.(6)甘草酸,甘草酸苷,腺苷蛋氨酸,熊去氧胆酸,牛磺熊去氧胆酸,鹅去氧胆酸,牛磺鹅去氧胆酸,双环醇,联苯双酯,索拉非尼,瑞戈非尼,乐伐替尼,二甲双胍中的一种或多种。
317.最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
