1.本发明涉及基因工程全菌生物传感器及基因表达调控领域,具体是涉及一种四环素调控蛋白突变体基因及其在调控基因表达和环境检测中的应用。
背景技术:
2.四环素转录调控因子tetr(tetracycline repressor)调控蛋白是来自于大肠杆菌tn10转座子,控制四环素溢出泵基因的表达,与细菌耐药性相关。tetr与tet操纵子(tet operator,teto)能够特异性结合。tet表达调控系统通过诱导药物(如四环素)改变调控蛋白的构象,从而达到调控目标蛋白表达的目的。当细胞内无tet存在时,tetr会与teto结合,从而阻断下游抗性基因表达;当有tet存在时,tet使tetr构象发生改变,导致tetr与teto分离,下游抗性基因得以表达,细菌获得耐药性。基于tetr调控蛋白蛋白可与特定核苷酸序列结合并调控下游基因表达的特点,tetr常被用于构建tet表达调控系统,用于环境中四环素类抗生素的检测及蛋白表达调控。
3.四环素类抗生素以其价格低廉、广谱抗菌等特点而被广泛使用,由于难以在环境中降解,其引起的环境污染问题引起了广泛关注。有研究表明,环境中的抗生素除了会造成化学污染外,还可能会诱导和加速环境中抗性微生物和抗性基因的产生,加速抗生素抗性基因的传播和扩散。这些抗性微生物通过直接或间接接触的方式进入人体,增强人体的耐药性,给人类安全健康造成威胁。致病菌耐药性的增加和扩散已经成为全球疾病治疗面临的一个巨大问题。要解决这一根本问题,准确检测环境中的抗生素并对环境中抗生素药物的去除机制及其环境行为开展研究是十分必要的。
4.由于环境中抗生素类药物的浓度相对较低,并且环境基质复杂,传统检测方法准确定量环境中的四环素类抗生素需要一套完整的样品预处理方法和仪器检测技术如气相色谱(gc)、高效液相色谱(hplc)等。然而,这些方法虽然精确灵敏却需要繁琐的预处理且操作过程复杂,需要投入专业人员及高昂的资金设备。因此,开发一种更加便捷、廉价易操作的新型抗生素检测手段是目前亟待解决的问题。
5.近年来,随着生物技术的快速发展及基因工程手段的日趋成熟,生物传感器技术的出现为环境抗生素的检测提供了一种新的手段。生物传感器可通过生物感应元件将待测物浓度与可检测的信号建立浓度梯度关系,在污染物的分析中具有极大的发展潜力和前景。四环素类抗生素生物传感器利用大肠杆菌中tet阻遏蛋白可与tet操纵子特异性结合的特性,以tetr调控蛋白作为感应元件,对四环素类抗生素进行检测。野生型的tetr调控蛋白仅对tet、dox等少数几种结构极其相近的四环素类抗生素具有响应,而对替加环素、米诺环素等几种近几年来使用更加广泛的四环素衍生物类药物响应性低甚至无响应,并且野生型的tetr表达调控系统需要一个相对较高的诱导物浓度才能启动。这也导致了现有四环素类抗生素生物传感器检测限低、不够广谱、不够灵敏等缺陷。
6.tet调控系统除被应用于环境抗生素检测外,还常被用于调控基因表达。目前研究
人员发展了多种类型的tet调控系统,根据其表达特点可以归为两大类:tet-off抑制型系统和tet-on激活型系统。
7.抑制型tet-off基因表达调控系统最早是由是gossen等人建立的,该系统由调控元件和反应元件两个主要部分组成。调控元件包含一个由人巨细胞病毒早期启动子(p
hcmv
)启动的tet转录活化因子(tetracycline transcriptional activator,tta),tet转录活化因子由tetr与单纯疱疹病毒(hsv)vp16蛋白质c端的一段转录激活区融合而成。反应元件由最小cmv启动子(minimal cmv promoter,p
mincmv
)、tet响应元件(tet-responsive element,tre)、及目的基因组成。其中tre为重复7次的teto序列,目的基因位于tre和p
mincmv
的下游。p
mincmv
缺少增强子,因此在tta与tre未结合时,p
mincmv
无法启动,目的基因不表达;相反,当tta与tre结合时,vp16的存在会使p
mincmv
活化从而使下游目的基因表达。当细胞内无tet或强力霉素(doxycycline,dox)的存在时,tta可与tre结合,而当细胞内含有tet或dox存在时,tet或dox与tta中的tetr部分结合,使tetr构象发生变化,rta从tre上脱落,p
mincmv
处于未激活状态,下游基因表达终止。
8.tet-on调控系统与tet-off调控系统的区别在于tet-on系统的调控蛋白为反义tet转录活化因子(reverse tetracycline transcriptional activator,rtta)。rtta是由反义tetr(reverse tetr,rtetr)与vp16的转录活化区域融合而成的。rtetr与tetr相比发生了4个氨基酸突变(e71
→
k71,d95
→
n95,l101-s101,g102
→
d102)。rtetr的表型与tetr相反,当无dox存在时不能与tre结合,下游基因表达关闭;而当有dox存在时才能与tre结合,使下游基因表达。
9.tet-off/tet-on基因表达系统自推出以来,由于其严密、高效、可控性强、表达泄露小等优点,在很多方面得到了广泛的应用,尤其是在基因的表达调控及基因治疗方面。如今已被广泛应用于各种细胞系、植物、酵母、线虫、小鼠、大鼠及人源细胞的基因诱导表达。虽然tet-off/tet-on系统为基因功能研究提供了便利,但是长期使用抗生素,已知可导致临床不良反应。四环素浓度过高可能对生物实验带来负面影响:四环素会改变线粒体基因组的表达,并且破坏细胞呼吸链的功能。即使在低浓度时,四环素也能诱导线粒体蛋白毒性压力,导致核基因表达的变化,改变线粒体功能。因此,开发一种可以低浓度dox启动的tet-off调控基因表达系统是及其有必要的。
技术实现要素:
10.本发明的目的在于提供了一种可特异性响应四环素类抗生素的四环素调控蛋白突变体基因及其在环境检测和调控基因表达中的应用,以解决现有技术的基于四环素调控系统构建的细菌生物传感器检测限低、不够灵敏、广谱性低;以及在运用tet-off基因表达调控系统调控基因表达中四环素处理浓度过高对生物实验带来负面影响的技术问题。
11.为了实现上述目的,本发明所采用的技术方案为:一种四环素调控蛋白突变体基因,为四环素类抗生素诱导型操纵子基因,具有如seq id no:1所示的核苷酸序列。
12.本发明还提供了一种含有四环素调控蛋白突变体基因的重组载体,含有与所述的四环素类抗生素诱导型操纵子基因可操作性连接的标记基因,所述标记基因位于所述四环素类抗生素诱导型操纵子基因的下游。
13.所述标记基因为绿色荧光蛋白表达基因,所述重组载体的出发载体为psb1k3载
sfgfp的质粒图谱。
28.图2为进化后的细菌生物传感器四环素类抗生素剂量效应检测的两组标准曲线,其中,图2-a为dox终浓度为0~60μg/l时测定的标准曲线,图2-b为dox终浓度为0~300μg/l时测定的标准曲线。
29.图3为进化后的细菌生物传感器与野生型tetr细菌生物传感器的诱导灵敏度的对比实验结果柱形图。
30.图4为进化后的四环素类抗生素细菌生物传感器的时间效应曲线,dox诱导终浓度为200μg/l。
31.图5为进化后的四环素类抗生素细菌生物传感器的广谱性检测曲线,各种抗生素终浓度均为600μg/l。
32.图6为进化后的四环素类抗生素细菌生物传感器的专一性检测曲线,各类抗生素终浓度均为1000μg/l。
33.图7为经pdisplay-tetr、pdisplay-eptetr与puhd10-3-egfp共转染的293t细胞经1μg/ml的dox处理24h后的荧光表达情况。
34.图8为经pdisplay-tetr、pdisplay-eptetr与puhd10-3-egfp共转染的293t细胞沉默下游基因表达的时间依赖效应,dox处理浓度为1μg/ml。
具体实施方式
35.下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,以便本领域的技术人员更了解本发明,但本发明的保护范围不限于下述的实施例。
36.其中,lb培养基的制备方法为:
37.lb液体培养基:10g/l胰蛋白胨,5g/l酵母提取物,10g/l氯化钠;
38.lb固体培养基:每升lb液体培养基中加入琼脂15g;
39.卡那霉素抗性的lb固体培养基:将配置好的lb固体培养基加热完全溶解,待温度降至55℃左右加入总重量2
‰
的卡那霉素。
40.实施例1四环素调控系统基因的获得:
41.1)、野生型四环素调控系统基因的获得:
42.以质粒puc57-tetr-sfgfp为模板,以seq id no:2和seq id no:3所述的引物进行pcr扩增,获得含有调控蛋白基因tetr、tetr调控蛋白结合位点teto、诱导型启动子p
tetr
以及报告基因sfgfp的野生型四环素诱导系统,
43.所述质粒puc57-tetr-sfgfp是根据质粒pfs_0271_pet30_pcat-tetr-term-pteta-sfgfp-rrnbterm_fusicatenibacter_saccharivorans_array2_faqi的tetr调控系统部分合成而来的,质粒pfs_0271_pet30_pcat-tetr-term-pteta-sfgfp-rrnbterm_fusicatenibacter_saccharivorans_array2_faqi的获得方法参见schmidt f等人于2018年发表的论文(schmidt,florian,mariia y.cherepkova randall j.platt*.transcriptional recording by crispr spacer acquisition from rna.nature 2018;doi:10.1038/s41586-018-0569-1.)。
44.表1:引物序列及酶切位点
[0045][0046]
利用bamhi和sfii双酶切psb1k3-merr-gfp载体和步骤1)扩增获得的野生型四环素调控操纵子,t4连接酶连接,使野生型四环素诱导型操纵子替代psb1k3-merr-gfp载体中原本的merr调控蛋白基因、j23109组成型启动子,gfp绿色荧光蛋白基因获得野生型四环素诱导型重组载体psb1k3-tetr-sfgfp,所述psb1k3-tetr-sfgfp的质粒图谱如图1-c所示;同步构建psb1k3-aid-sfgfp空白对照质粒,用无功能序列aid(activation-induced cytidine deaminase)替换psb1k3-tetr-sfgfp质粒中的野生型tetr诱导型操纵子,所述psb1k3-aid-sfgfp的质粒图谱图附图1-a所示,所述aid序列是以如下表2所示的seq id no:4和seq id no:5为引物,以psb1k3-aid-gfp为模板克隆获得的,psb1k3-aid-gfp是参照质粒pci-maid由实验是构建的,所述pci-maid的构建获得方法参见wu等人于2005年发表的论文(wu,x.,geraldes,p.,platt,j.l.,andcascalho,m.(2005).the double-edged sword of activationinduced cytidinedeaminase.j im-munol 174,934
–
941.)。
[0047]
所述pdisplay-tetr的图谱如1-b所示,其中vp16是单纯疱疹病毒(hsv)vp16蛋白c端的一段转录激活区域。在质粒pdisplay-tetr中tetr与vp16融合,由如下表2所示的seq id no:6和seq id no:7为引物,以psb1k3-tetr-vp16-sfgfp为模板扩增而来。所述psb1k3-tetr-vp16-sfgfp是在psb1k3-tetr-sfgfp的基础上建立的。
[0048]
表2:aid的pcr引物及其酶切位点
[0049][0050]
2)、定向进化获得新型四环素诱导型生物传感器
[0051]
以psb1k3-tetr-sfgfp质粒为模板,对四环素诱导型操纵子的调控蛋白tetr基因区域进行易错pcr,获得随机突变体文库,对随机突变体文库进行流式高通量筛选,易错pcr是以如下表3所示的seq id no:8和seq id no:9为引物进行的;利用apai和kpni进行双酶切,用获得的随机突变体替换psb1k3-aid-sfgfp中的aid基因,构建重组突变体文库,其中连接体系中,插入片段和载体的摩尔比为4:1,或在每100ul连接体系中加入50ng载体以及200ng片段,连接反应条件为22℃连接1小时;连接产物经电转化,导入top10感受态细胞,获得流式筛选文库,进行流式高通量筛选;流式筛选文库构建时,库容量达到107个克隆,以保证能有足够突变基因型以供筛选。
[0052]
表3:易错pcr引物序列及其酶切位点
[0053][0054]
所述易错pcr的反应体系如表4所示:
[0055]
表4:易错pcr反应体系
[0056][0057]
所述易错pcr的反应程序为:94℃预变性5min,94℃变性30s,60℃退火30s,72℃延伸1min,30个循环后,再在72℃下继续延伸10min后,置于4℃下保存备用。
[0058]
经过三轮流式高通量筛选,最终获得进化后的含有psb1k3-eptetr-sfgfp载体的top10工程菌,即为进化后的细菌生物传感器,其中psb1k3-eptetr-sfgfp是由psb1k3-eptetr-sfgfp经三轮定向进化而来,eptetr在tetr的基础上发生了突变,其第二轮定向进化得到的eptetr突变体被命名为eps2-22。eptetr具有如seq id no:1所示的核苷酸序列,该eps2-22序列也可以通过人工合成的方式获得。
[0059]
实施例2
[0060]
进化后的细菌生物传感器对dox的剂量效应实验
[0061]
1)将进化后的细菌生物传感器接种于含卡那霉素抗性的lb固体培养基平板上。
[0062]
2)37℃培养过夜;同时,将野生型四环素诱导型重组载体psb1k3-tetr-sfgfp转化至e.coli dh5α感受态细胞中,获得野生型的细菌生物传感器,同步培养野生型的细菌生物传感器。
[0063]
3)挑取单克隆,接种于3ml含有kana霉素抗性的lb液体培养基中,在37℃,200rpm下过夜培养,获得过夜菌液。
[0064]
4)将步骤2)的过夜菌液以1:20接种于含有卡那霉素抗性的新鲜lb液体培养基中与37℃,200rpm扩大至对数生长期(od
600
=0.4-0.6),获得对数期菌液。
[0065]
5)使用去离子水配置两组不同系列梯度浓度的四环素类抗生素标准液,分别为dox浓度为0~60μg/l的抗生素标准液,dox浓度为0~300μg/l的抗生素标准液。
[0066]
6)分别将两组不同浓度的抗生素标准液加入步骤3)的对数期菌液中使诱导物终浓度为0~60μg/l、0~300μg/l,作为诱导组,于37℃,200rpm下培养1h,获得诱导菌液;同步取对数期菌液加入等量去离子水,作为空白对照,在37℃,200rpm下培养1h,获得对照菌液。
[0067]
7)将步骤5)的诱导菌液置于12000rpm下离心,收集上清,再用1
×
pbs缓冲液漂洗3次,检测荧光表达,获得如附图2所示的两组标准曲线;或将诱导菌液以200μl每孔加入96孔板中用酶标仪检测,获得荧光表达情况。
[0068]
检测结果如图2所示,由图2-a中可看出,进化后的细菌生物传感器有着良好的dox剂量依赖效应,并且进化后的细菌生物传感器对dox具有极高的灵敏度,野生型在低浓度dox浓度下对dox基本无响应而进化后的细菌生物传感器即使在低至0-60μg/l的dox浓度下仍有极高的响应;由图2-b可以看出,进化后的细菌生物传感器较之野生型的细菌生物传感器,在检测限上有明显的提升。检测限由野生型的大于600μg/l优化至5μg/l,检测范围为0-100μg/l。
[0069]
实施例3
[0070]
进化后的细菌生物传感器的灵敏度实验
[0071]
1)将进化后的细菌生物传感器接种于含卡那霉素抗性的lb固体培养基平板上,37℃培养过夜,同步培养野生型的细菌生物传感器。
[0072]
2)挑取单菌落,接种于3ml含有卡那霉素抗性的lb液体培养基中,在37℃,200rpm下过夜培养,获得过夜菌液。
[0073]
3)将步骤2)的过夜菌液1:20扩大于含有卡那霉素抗性的新鲜lb液体培养基中,37℃,200rpm摇床培养至od
600
=0.4-0.6,获得对数期菌液。
[0074]
4)使用超纯水配制200mg/l的dox储备液。
[0075]
5)dox储备液加入至3)获得的对数期菌液中,使诱导物终浓度为200μg/l,作为诱导组;同步取对数期菌液加入等体积的超纯水,作为空白对照;在37℃,200rpm下培养1h,获得诱导菌液。
[0076]
6)将步骤5)的诱导菌液置于12000rpm下离心,收集上清,再用1
×
pbs缓冲液漂洗3次,检测荧光表达,或将诱导菌液以200μl每孔加入96孔板中用酶标仪检测,获得荧光表达情况。获得野生型和突变型细菌生物传感器的诱导荧光强度值和背景荧光强度值。
[0077]
结果如图3所示,图中可以看出,进化后的细菌生物传感器诱导强度远远大于野生型的细菌生物传感器的诱导活性,突变型的诱导强度在dox终浓度为200μg/l下可最高强于野生型传感器23倍。说明进化后的细菌生物传感器的灵敏性相比于野生型的细菌生物传感器具有显著提升。
[0078]
实施例4
[0079]
进化后的细菌生物传感器的时间诱导实验
[0080]
1)挑取单菌落,接种于3ml含有卡那霉素抗性的lb液体培养基中,在37℃,200rpm下过夜培养,获得检测菌液。
[0081]
2)将步骤1)的过夜菌液以1:20接种于含有卡那霉素抗性的新鲜lb液体培养基中与37℃,200rpm扩增至od600=0.4-0.6,获得对数期菌液。
[0082]
3)使用超纯水配制200mg/l的dox储备液。
[0083]
4)将dox储备液加入至步骤2)获得的对数期菌液中,使诱导物终浓度为200μg/l,
作为诱导组;同步取对数期菌液加入等体积的超纯水,作为空白对照;在37℃,200rpm下培养1、2、3、4、5h,获得诱导菌液。
[0084]
5)将步骤4)的诱导菌液置于12000rpm下离心,收集上清,再用1
×
pbs缓冲液漂洗3次,检测荧光表达,或将诱导菌液以200μl每孔加入96孔板中用酶标仪检测,获得荧光表达情况。
[0085]
检测结果如图4所示,结果表明,进化后的细菌生物传感器对诱导物的响应具有较好的时间依赖效应,诱导荧光响应随着dox诱导时间的增加而增强。
[0086]
实施例5
[0087]
进化后的细菌生物传感器的广谱性实验
[0088]
1)将进化后的细菌生物传感器接种于含卡那霉素抗性的lb固体培养基平板上,37℃培养过夜。
[0089]
2)挑取单菌落,接种于3ml含有卡那霉素抗性的lb液体培养基中,在37℃,200rpm下过夜培养,获得过夜菌液。
[0090]
3)将步骤2)的过夜菌液以1:20接种于含有卡那霉素抗性的新鲜lb液体培养基中与37℃,200rpm扩增至od
600
=0.4-0.6,获得对数期菌液。
[0091]
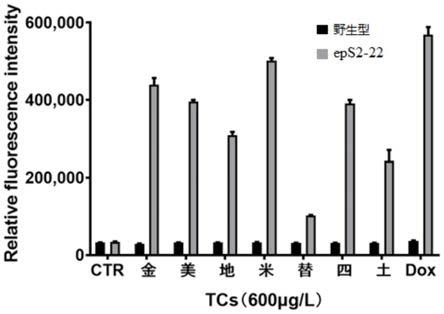
4)使用去离子水配置一系列不同种类四环素类抗生素溶液,所有种类抗生素浓度均为600mg/l;四环素类抗生素共八种,分别为四环素、dox、地美环素、米诺环素、美他环素、土霉素、金霉素、替加环素。
[0092]
5)将八种四环素类抗生素溶液分别加入至步骤3)获得的对数期菌液中,使诱导物终浓度为600μg/l,作为诱导组;同步取去离子水加入至步骤3)获得的对数期菌液中,作为空白对照组;在37℃,200rpm下培养1h,获得诱导菌液。
[0093]
6)将步骤5)的诱导菌液置于12000rpm下离心,收集上清,再用1
×
pbs缓冲液漂洗3次,检测荧光表达,或将诱导菌液以200μl每孔加入96孔板中用酶标仪检测,获得荧光表达情况。
[0094]
获得如下图5所示的结果,图5中可看出,进化后的细菌生物传感器较之于野生型传感器对八种四环素类抗生素都有着良好的响应性,野生型只对八种四环素类抗生素中的少数几种抗生素具有较好的响应,对其他四环素类抗生素响应低甚至无响应如替加环素,而突变型传感器对八种四环素类抗生素的响应都大大提高。
[0095]
实施例6
[0096]
进化后的细菌生物传感器的专一性实验
[0097]
1)将进化后的细菌生物传感器接种于含卡那霉素抗性的lb固体培养基平板上,37℃培养过夜。
[0098]
2)挑取单菌落,接种于3ml含有卡那霉素抗性的lb液体培养基中,在37℃,200rpm下过夜培养,获得过夜菌液。
[0099]
3)将步骤2)的过夜菌液以1:20接种于含有卡那霉素抗性的新鲜lb液体培养基中与37℃,200rpm扩增至od
600
=0.4-0.6,获得对数期菌液。
[0100]
4)使用去离子水配置一系列不同种类抗生素的标准溶液,所有种类抗生素浓度均为1mg/ml;不同种类抗生素分别为链霉素、庆大霉素、万古霉素、林可霉素、dox。
[0101]
5)将不同种类的抗生素标准溶液分别加入至步骤3)获得的对数期菌液中,使诱导
物终浓度为1μg/ml,作为诱导组;同步取去离子水加入至步骤3)获得的对数期菌液中,作为空白对照组;在37℃,200rpm下培养1h,获得诱导菌液。
[0102]
6)将步骤5)的诱导菌液置于12000rpm下离心,收集上清,再用1
×
pbs缓冲液漂洗3次,检测荧光表达,或将诱导菌液以200μl每孔加入96孔板中用酶标仪检测,获得荧光表达情况。
[0103]
获得如下图6所示的结果,图6中可看出,进化后的细菌生物传感器对四环素类抗生素有着良好的专一性,该传感器对于四环素类抗生素在1μg/ml的浓度下有着4倍于背景对照的荧光响应,而对其他种类的抗生素基本无响应。
[0104]
实施例7
[0105]
含tetr突变子eps2-22的稳转293t细胞与含野生型tetr的稳转293t细胞沉默下游基因表达的能力,具体表现为稳转293t细胞经相同浓度dox(1μg/ml)处理24h后的荧光表达情况,含三次重复实验。
[0106]
1)称取1mg dox加入1ml无菌水中,充分溶解得到浓度为1mg/ml的dox储备液,于-20℃冰箱冻存。
[0107]
2)称取1g g418溶于1ml无菌水中,充分溶解,补加蒸馏水至10ml,0.22μm滤膜过滤,-20℃冻存。
[0108]
3)取g418储备液25μl加入至50ml含10%的fbs及青链霉素的dmem培养液中,配置成含g418浓度为50μg/ml的dmem培养液,为稳转293t细胞培养液。
[0109]
4)取1mg/ml的dox储备液,以1:1000的比例加入上述步骤四中的dmem培养液中,配置成含dox浓度为1μg/ml的dmem培养液,为稳转293t细胞诱导培养液。
[0110]
5)将稳转293t细胞以2万/孔的接种量接种在96孔板中,补加浓度为50μg/ml g418的dmem培养液至100μl,37℃、5%的co2含量培养12h,获得贴壁细胞。
[0111]
6)将96孔板中的培养液替换为含dox浓度为1μg/ml的dmem稳转293t细胞诱导培养液,于37℃、5%的co2含量培养箱培养24h,荧光显微镜或高内涵检测荧光表达情况。
[0112]
获得如下图7所示的结果,其中,图7-a分别为含野生型tetr调控蛋白的293t共转细胞未经dox处理及经dox(1μg/ml)处理24h后的荧光表达情况;图7-b分别为含突变体eps2-22的293t共转细胞未经dox处理及经dox处理24h后的荧光表达情况。由图7结果可知,在处理相同dox浓度处理相同时间后,含突变子eps2-22的tet-off基因表达调控系统在沉默下游基因表达时的能力要强于野生型调控系统。
[0113]
实施例8
[0114]
含tetr突变子eps2-22的稳转293t细胞与含野生型tetr的稳转293t细胞沉默下游基因表达的时间依赖效应。具体表现为稳转293t细胞经相同浓度dox(1μg/ml)处理不同时间后的荧光表达情况。
[0115]
1)称取1mg dox加入1ml无菌水中,充分溶解得到浓度为1mg/ml的dox储备液,于-20℃冰箱冻存。
[0116]
2)称取1g g418溶于1ml无菌水中,充分溶解,补加蒸馏水至10ml,0.22μm滤膜过滤,-20℃冻存。
[0117]
3)取g418储备液25μl加入至50ml含10%的fbs及青链霉素的dmem培养液中,配置成含g418浓度为50μg/ml的dmem培养液,为稳转293t细胞培养液。
[0118]
4)取1mg/ml的dox储备液,以1:1000的比例加入上述步骤四中的dmem培养液中,配置成含dox浓度为1μg/ml的dmem培养液,为稳转293t细胞诱导培养液。
[0119]
5)将稳转293t细胞以2万/孔的接种量接种在96孔板中,补加浓度为50μg/ml g418的dmem培养液至100μl,37℃、5%的co2含量培养12h,获得贴壁细胞。
[0120]
6)将96孔板中的培养液替换为含dox浓度为1μg/ml的dmem稳转293t细胞诱导培养液,于37℃、5%的co2含量培养箱培养,每隔12h用荧光显微镜或高内涵检测荧光表达情况。
[0121]
获得如下图8所示的结果,其中,实心圆为含野生型tetr调控蛋白的293t共转细胞经dox处理后的荧光表达情况;实心正方形为含突变体eps2-22的293t共转细胞经dox处理后的荧光表达情况。由图8结果可知,含突变子eps2-22的tet-off基因表达调控系统与野生型调控系统相比在沉默下游基因表达时具有更强的时间依赖性。
[0122]
综上所述,本发明提供了一种可特异性响应四环素类抗生素的四环素调控蛋白突变体基因及其在环境检测和调控基因表达中的应用,该四环素调控蛋白基因是野生型四环素调控蛋白tetr基因的突变子,基于该调控蛋白优化的四环素类抗生素细菌生物传感器,其灵敏度高,对环境中的四环素类抗生素检测专一、背景荧光低、响应强度高、并且能够检测包括替加环素、地美环素等在内的八种四环素类抗生素。
[0123]
以上内容仅仅是对本发明的构思所作的举例和说明,所属本技术领域的技术人员对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,只要不偏离发明的构思或者超越本权利要求书所定义的范围,均应属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。