一株红霉素降解菌rjjtx
‑
3及其应用
技术领域
1.本发明属于生物技术领域,具体为一株红霉素降解菌rjjtx
‑
3以及该菌对环境中红霉素的降解应用。
背景技术:
2.红霉素生产主要是通过发酵法,在发酵液中提取完抗生素之后,得到的固体废弃物是红霉素菌渣,其主要成分包括产生红霉素、菌体分泌的代谢产物和培养基的降解产物等。红霉素菌渣中的发酵基质并无较大危害,然而残留的红霉素进入环境后,可抑制生态系统中一些特定属性下的微生物并杀灭,通过食物链的累积后,打破了生态系统中原有的生态平衡,进而产生超级细菌,对环境和人类造成极大危害。因此,亟需开发出一种新型高效环保的方法来处理红霉素菌渣。
3.根据市场调研,目前国内外红霉素废料处理上并没有完整的处理体系,而现有体系无法解决大多数药厂的后顾之忧。目前红霉素菌渣处理方法多样,如焚烧,安全填埋,资源化等。然而生物发酵技术产品不仅价格低,降解率高,而且降解周期短,所得产品绿色环保,可以达到废物利用的目的。利用微生物降解法和厌氧发酵法降解红霉素菌渣中残留的污染环境的红霉素,前者在通过相关安全机构检测后,可应用于饲料,化肥等农业生产领域进行资源的循环利用,后者使红霉素菌渣发酵生成甲烷,用于生产供社会利用的能源。这两项技术在国家大力提倡环保和可持续性发展的背景下将是未来可行的红霉素菌渣降解处理技术,为抗生素菌渣的减量化、无害化、可持续化的新理念提供保障,这将会给抗生素制药行业带来较高的经济收益,节省资金用于研发更先进的处理技术,对社会的前进发展具有重要意义。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的第一个目的在于提供一株红霉素降解菌rjjtx
‑
3,该红霉素降解菌为纤维菌属(cellulosimicrobium aquatile)rjjtx
‑
3,该菌已于2021年07月29日在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏号为cgmcc no.22979。
6.本发明的第二个目的在于提供所述红霉素降解菌rjjtx
‑
3对红霉素污染环境后的修复作用。
7.本发明的第三个目的在于提供所述红霉素降解菌rjjtx
‑
3对红霉素污染水体后的修复作用。
8.本发明的第四个目的在于提供所述红霉素降解菌rjjtx
‑
3对红霉素污染土壤后的修复作用。
9.本发明的第五个目的在于提供所述红霉素降解菌rjjtx
‑
3对红霉素污染水体后的降解作用。
10.本发明的第六个目的在于提供所述红霉素降解菌rjjtx
‑
3对红霉素污染土壤后的
降解作用。
11.本发明的第七个目的在于提供一种降解红霉素的方法,其特征在于,将所述的纤维菌属(cellulosimicrobium aquatile)rjjtx
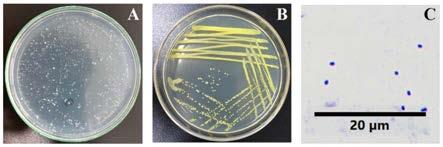
‑
3接种于含有红霉素的体系中培养,即可实现红霉素的降解。
12.本发明筛选出红霉素降解菌的方法如下所示,包括以下步骤:
13.(1)从下水道排污口称取污泥,加入到红霉素降解菌筛选液体培养基进行富集,在35℃、180r/min恒温摇床中培养4
‑
7天;
14.(2)吸取步骤1中所得的培养基加入到新的红霉素降解菌筛选液体培养基进行传代,如此传代3
‑
6次;
15.(3)取步骤2中所得培养液在红霉素降解菌筛选固体培养基上稀释涂布分离,这一过程可初步筛选出优良、具有较高红霉素降解活性的菌株。
16.(4)挑取步骤3所得的单个菌落,在lb平板上进行2
‑
4次化线分离,得到单个菌落接种到lb液体培养基中培养。同时挑取lb固体平板上纯的单克隆菌株,置于显微镜下观察细胞形态。
17.(5)采用细胞破碎法提取纯菌株的基因组dna。以引物16s 27f和16s 1492r扩增。取5μl pcr产物进行琼脂糖凝胶电泳检测。pcr产物送武汉天一生物工程股份有限公司测序,测序结果在ncbi上进行blast同源序列搜索比对。
18.(6)分析分离得到的不同菌种的生长性能及对培养基中红霉素的降解效率,筛选获得红霉素降解效果最佳的菌株。
19.所述步骤(1)中,从江苏省常州市武进区常州大学下水道排污口称取污泥。
20.所述步骤(1)中,称取污泥5g,加入100ml红霉素降解菌筛选液体培养基中进行富集,在35℃、180r/min恒温摇床中培养5
‑
7天。
21.所述步骤(1)中,其中红霉素降解菌筛选培养基成分为:每1l去离子水中含有100mg/l红霉素,硝酸钠1.06g,硫酸铵0.66g,磷酸二氢钾(kh2po4)0.5g,七水合硫酸镁(mgso4·
7h2o)0.1g,磷酸氢二钾(k2hpo4)1.5g,氯化钠0.35g,ph 7.0,121℃灭菌20min。
22.所述步骤(2)中,吸取5ml步骤1中所得的培养基加入到新的红霉素降解菌筛选液体培养基进行传代,如此传代5次;
23.所述步骤(3)中,吸取步骤2中所得培养液,稀释至10
‑3‑
10
‑5,保证菌株在固体培养基中生长不过分密集,避免生长过程中形成干扰,影响观察。
24.所述步骤(4)中,lb固体培养基成分为:蛋白胨10g,酵母粉5g,氯化钠10g,琼脂粉15g,以去离子水补足体积至1l,121℃灭菌20min。
25.所述步骤(4)中,菌株镜检前需将挑取的菌株经草酸铵结晶紫简单染色,再置于显微镜下观察细胞形态。
26.所述步骤(4)中,运用平板划线法对菌株进行纯化,次数至少达2
‑
3次,保证尽量获得纯菌。
27.所述步骤(5)中,pcr反应体系总体积为20μl。每个pcr管中加入顺序及体积分别为:prime star max 10μl,引物16s 27f和16s 1492r各0.5μl,基因组dna 0.3μl,无菌水8.7μl。
28.所述步骤(5)中,pcr循环为:98℃预变性5min,98℃变性15s,54℃退火15s,72℃延
伸50s,共31次循环,最后10℃充分延伸5min,
‑
20℃保存。
29.所述步骤(6)中,将菌液以1%的接种量接种到含有100mg/l红霉素的msm基础培养基,在35℃、180r/min恒温摇床中培养7天,平行重复3次。
30.所述步骤(6)中,降解率分析如下所示:
31.(ⅰ)标品的制备:精确称取1.00g红霉素于100ml容量瓶中,用甲醇定容至标线,制备成10g/l红霉素的标准溶液。然后向9个10ml的容量瓶中,加甲醇配比,用甲醇定容至标线,配制成浓度梯度为25、50、75、100、150、200和250mg/l红霉素甲醇溶液作红霉素标准曲线。
32.(ⅱ)液相色谱(hplc)条件:反相柱(250
×
4.6mm,5μm),柱温35℃。流动相为乙腈和0.01mol/l的k2hpo4(60:40,v:v),流速为0.6ml/min。紫外检测波长为210nm。进样量为10μl。
33.本发明的有益效果为:根据红霉素特性,通过微生物技术手段,从特地环境中筛选出能降解红霉素的菌株。实验证明,本发明的红霉素降解菌rjjtx
‑
3具有较高的红霉素降解活性,红霉素降解率可达到82.29%。本发明所提供的红霉素降解菌rjjtx
‑
3可应用于污染环境中红霉素的降解,具有良好的应用价值。
附图说明
34.图1
‑
a为红霉素降解菌筛选培养基稀释涂布。
35.图1
‑
b为红霉素降解菌rjjtx
‑
3在lb培养基菌落形态。
36.图1
‑
c为红霉素降解菌rjjtx
‑
3的细胞形态(1000x)。
37.图2为红霉素降解菌rjjtx
‑
3的16s rdna结构域序列的系统发育树。
38.图3为红霉素降解菌rjjtx
‑
3的降解率。
39.图4为红霉素降解菌rjjtx
‑
3在土壤中的降解率。
40.图5为红霉素降解菌rjjtx
‑
3在废水中的降解率。
具体实施方式
41.本发明实施案例涉及一种红霉素降解菌,保藏号为cgmcc no.22979。该菌株名为rjjtx
‑
3,是从江苏省常州市武进区常州大学下水道排污口的污泥种筛选得到的。该菌种的保存地址是北京市朝阳区北辰西路1号院3号。
42.实施例1:
43.本发明实施案例涉及一种红霉素降解菌,保藏号为cgmcc no.22979。该菌株名为rjjtx
‑
3,genbank submitter为ok047544,该菌从江苏省常州市武进区常州大学下水道排污口的污泥种筛选得到的。该菌种的保存地址是北京市朝阳区北辰西路1号院3号。
44.本发明实施案例还涉及该红霉素降解菌的筛选方法,包括以下步骤:
45.(1)从下水道排污口称取污泥,加入到红霉素降解菌筛选液体培养基进行富集,在35℃、180r/min恒温摇床中培养4
‑
7天;
46.本发明的一个实施例中,污泥取自江苏省常州市武进区常州大学下水道排污口。取5g污泥,加入100ml红霉素降解菌筛选液体培养基中进行富集培养。
47.本发明的一个实施例中,红霉素降解菌筛选培养基成分为:每1l去离子水中含有100mg/l红霉素,硝酸钠1.06g,硫酸铵0.66g,磷酸二氢钾(kh2po4)0.5g,七水合硫酸镁
(mgso4·
7h2o)0.1g,磷酸氢二钾(k2hpo4)1.5g,氯化钠0.35g,ph7.0,121℃灭菌20min。
48.(2)吸取步骤1中所得的培养液加入到新的红霉素降解菌筛选液体培养基进行传代,如此传代3
‑
6次;
49.本发明的一个实施例中,以5%的接种量,将培养液移接到新的红霉素降解菌筛选液体培养基,进行传代培养。
50.(3)取步骤2中所得培养液在红霉素降解菌筛选固体培养基上稀释涂布分离,这一过程可初步筛选出优良、具有较高红霉素降解活性的菌株。
51.本发明的一个实施例中,稀释的作用是使发酵液中的酵母菌含量适中,有利于下一步的初步筛选。
52.本发明的一个实施例中,lb固体培养基成分为:蛋白胨10g,酵母粉5g,氯化钠10g,琼脂粉15g,以去离子水补足体积至1l,121℃灭菌20min。
53.(4)挑取步骤3所得的单个菌落,在lb平板上进行2
‑
4次化线分离,得到单个菌落接种到lb液体培养基中培养。同时挑取lb固体平板上纯的单克隆菌株,置于显微镜下观察细胞形态,结果如图1所示。
54.本发明的一个实施例中,菌株镜检前需将挑取的菌株经草酸铵结晶紫简单染色,再置于显微镜下观察细胞形态。
55.本发明的一个实施例中,运用平板划线法对菌株进行纯化,次数至少达2
‑
3次,保证尽量获得纯菌。
56.本发明的一个实施例中,lb液体培养基成分为:蛋白胨10g,酵母粉5g,氯化钠10g,以去离子水补足体积至1l,121℃灭菌20min。
57.步骤(1)、(2)、(3)和(4)是对菌株进行初筛,作用是在培养基中筛选出外观形态不同并能降解红霉素的菌株。所述rjjtx
‑
3单菌形态为:圆形绿色菌落,边缘完整,表面光滑湿润。
58.(5)采用细胞破碎法提取纯菌株的基因组dna。以引物16s27f和16s1492r扩增。取5μlpcr产物进行琼脂糖凝胶电泳检测。pcr产物送武汉天一生物工程股份有限公司测序,16srrna(genbank submitter:ok047544)序列在ncbi上进行blast同源序列搜索比对。
59.在本发明的一个实例中,利用相邻法的系统发育方法构建酵母菌rjjtx
‑
3的系统发育树。结果如图2所示。
60.(6)分析分离得到的不同菌种的生长性能及对培养基中红霉素的降解效率,筛选获得红霉素降解效果最佳的菌株。
61.在本发明的一个实例中,利用高效液相色谱仪测红霉素降解率,分析如下所示:
62.(ⅰ)标品的制备:精确称取1.00g红霉素于100ml容量瓶中,用甲醇定容至标线,制备成10g/l红霉素的标准溶液。然后向9个10ml的容量瓶中,加甲醇配比,用甲醇定容至标线,配制成浓度梯度为25、50、75、100、150、200和250mg/l红霉素甲醇溶液作红霉素标准曲线。
63.(ⅱ)液相色谱(hplc)条件:反相柱(250
×
4.6mm,5μm),柱温35℃。流动相为乙腈和0.01mol/l的k2hpo4(60:40,v:v),流速为0.6ml/min。紫外检测波长为210nm。进样量为10μl。
64.降解率结果如图3所示。
65.本发明还涉及红霉素降解菌在环境修复方面的应用。
66.实施例2:
67.取100g灭菌的红霉素药厂排污水道附近的土壤,将红霉素降解菌rjjtx
‑
3按1%的接种量接种,并加入100mg红霉素,于35℃条件下培养7d,经测定,测定降解率为:60.77%,如图4所示。
68.实施例3:
69.取100ml灭菌的红霉素药厂的废水,将红霉素降解菌rjjtx
‑
3按1%的接种量接种,经测定该废水的红霉素浓度为120mg/l,于35℃条件下培养7d,测定红霉素降解率为:71.21%,如图5所示。
70.本发明是根据红霉素特性,通过微生物技术手段,从江苏省常州市武进区常州大学下水道排污口的污泥中筛选出能降解红霉素的菌株。实验证明,本发明的红霉素降解菌rjjtx
‑
3具有较高的红霉素降解活性,红霉素降解率可达到82.29%。本发明所提供的红霉素降解菌rjjtx
‑
3可应用于污染环境中红霉素的降解,具有良好的应用价值。
71.最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
72.73.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。