1.本发明涉及生物技术领域,具体涉及测定dna病毒感染滴度的方法,更具体涉及测定重组腺病毒感染滴度的方法。
背景技术:
2.腺病毒呈无囊膜的球形结构,直径为70~90nm,其病毒粒子在感染的细胞核内常呈晶格状排列,每个病毒颗粒包含一个36kb的线性双链dna,两端各有一个100~600bp的反向末端重复序列(inverted terminal re-peat,itr),itr的内侧为病毒包装信号,是病毒包装所需要的顺式作用元件。基因组包含早期表达的与腺病毒复制相关的e1~e4基因和晚期表达的与腺病毒颗粒组装相关的l1~l5基因。线状双股dna与核心蛋白形成直径为60~65nm的髓芯,被包裹于衣壳内。衣壳呈二十面体对称,由252个直径8~10nm的壳粒组成,壳粒排列在三角形的面上,每边6个,其中240个为六邻体(非顶点壳粒),另12个为五邻体基底(顶点壳粒)。上个世纪50年代发现并成功分离腺病毒以来,已陆续发现了100余个血清型,其中人腺病毒有47种,分为a、b、c、d、e和f六个亚群(subgroup)。由于腺病毒具有宿主范围广、高转基因表达能力的特点,腺病毒载体作为极具潜力的哺乳动物基因转移载体而得到广泛应用,尤其是在基因治疗相关领域。目前有许多人用治疗或者预防性重组腺病毒药物正用于临床试验。目前被广泛应用的腺病毒载体是人血清型腺病毒ad2和ad5型。
3.腺病毒的生活周期有两个阶段:第一阶段,腺病毒颗粒粘附和进入宿主细胞,将基因组释放到宿主细胞核中,以及有选择性地转录和翻译早期基因;第二阶段,病毒基因组复制和腺病毒晚期基因表达并最终释放成熟的感染颗粒。第一阶段通常在2~8个小时内完成。感染滴度测定是重组腺病毒制品生产中的一个关键质量控制指标。目前药典推荐的测定方法仅限于经典的tcid50法,该检测方法耗时长(通常10天左右),要求操作者有一定的操作经验(主要是低浓度腺病毒感染细胞引起的细胞病变不明显,不容易镜检观察判定),可重复性有限,为精确测定带来极大挑战。
4.因此,亟需开发一种稳定、快捷、精确的测定腺病毒感染滴度的方法。
技术实现要素:
5.本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明的一个目的在于提供一种测定dna病毒感染滴度的方法,利用该方法可以精确、快捷的检测多种dna病毒感染滴度。尤其是提供一种经优化的qpcr检测重组腺病毒感染滴度的方法,在保证被病毒感染的细胞完整性的前提下,通过在基因组提取前处理中先后使用蛋白酶k及benzonase核酸酶消除非感染性重组腺病毒基因组,使得测定结果与经典的tcid50测定结果相一致。该方法精确、快捷、稳定性好。
6.为此,本发明第一方面提供一种测定dna病毒感染滴度的方法。根据本发明的实施例,所述方法包括以下步骤:
7.1)病毒接种细胞样品,获得病毒感染后的细胞样品;
8.2)对病毒感染后的细胞样品进行蛋白酶k消化,后进行核酸酶消化,之后使核酸酶失活,获得处理后细胞样品;
9.任选地,在感染后的细胞样品进行蛋白酶k消化后,加入蛋白酶k抑制剂抑制蛋白酶k活性,随后进行核酸酶消化;
10.3)提取处理后细胞样品总dna,获得待测病毒感染滴度的dna样品;
11.4)利用qpcr检测待测病毒感染滴度的dna样品中病毒的基因组拷贝数,获得病毒感染滴度。
12.本发明提供的测定dna病毒感染滴度的方法,通过在基因组提取前处理中先后使用蛋白酶k及核酸酶消除非感染性dna病毒基因组,使得测定结果与经典的tcid50测定结果相一致。该方法精确、快捷、稳定性好。
13.根据本发明的实施例,在步骤2)中,所述核酸酶选自dnase i、dnaseⅱ和benzonase核酸酶中的至少一种,优选地,所述核酸酶为benzonase核酸酶和/或dnase i,进一步优选地,所述核酸酶为benzonase核酸酶。
14.根据本发明的实施例,在步骤2)中,所述蛋白酶k的终浓度为0.05~5mg/ml,优选0.1~4mg/ml,进一步优选为1~3mg/ml;所述蛋白酶k的处理时间为0.15~4h,优选0.25~3h,进一步优选0.5~2h;所述蛋白酶k的处理温度为20~40℃,优选25~38℃,进一步优选30~37℃。
15.细胞外膜蛋白含量约占30%,脂质约70%,一般实验中在使用蛋白酶k裂解细胞,还会搭配一定量的去垢剂(sds、tritonx-100等),并且细胞膜上、膜间隙也存在些对蛋白酶k具有抗性的蛋白,像大肠杆菌中具有的麦芽糖结合蛋白(mbp)之类。蛋白酶k的浓度过高、消化时间过长或孵育温度过高时,都会对细胞的结构有一定的破坏,导致膜内核酸外泄;但浓度过低,消化时间短,孵育温度过低又会影响酶的活性和酶解效率。本发明的发明人探索出了特定的蛋白酶k浓度范围、处理时间、孵育温度,发现可以不使用去垢剂,蛋白酶k也能在消化未侵入293ft细胞的重组腺病毒颗粒外壳的基础上,还尽可能降低因蛋白酶k破坏细胞膜导致的细胞内病毒核酸外泄(细胞膜外非感染性病毒颗粒优先被裂解完全)。
16.根据本发明的一些优选的实施例,在步骤2)中,所述蛋白酶k的终浓度为1.8mg/ml;所述蛋白酶k的处理时间为2h;所述蛋白酶k的处理温度为37℃。
17.根据本发明的实施例,在步骤2)中,所述核酸酶的终浓度为25~500u/ml,优选100~400u/ml,更优选150~300u/ml,进一步优选200u/ml;所述核酸酶的处理时间为0.5~24h,;所述核酸酶的处理温度为20~40℃,优选25~38℃,进一步优选30~37℃。
18.根据本发明的一些优选的实施例,在步骤2)中,所述核酸酶的终浓度为200u/ml;所述核酸酶的处理时间为16h;所述核酸酶的处理温度为37℃。
19.根据本发明的实施例,在步骤2)中,所述蛋白酶k抑制剂选自odanacatib、e64、亮肽素、dfp、aebsf、pmsf中的至少一种,优选地,所述蛋白酶k抑制剂为pmsf。
20.由于蛋白酶k对后续添加的benzonase核酸酶活性有一定的抑制作用,因此需要在进行核酸酶消化之前,加入蛋白酶k抑制剂以抑制蛋白酶k的活性,以便benzonase核酸酶更加高效的降解感染细胞外的重组腺病毒核酸。
21.根据本发明的实施例,在步骤2)中,使核酸酶失活包括热失活。
22.根据本发明的实施例,除了热失活之外,也可以采用其他的本领域常用的核酸酶
失活方法。
23.根据本发明的实施例,在步骤4)中,以待测病毒感染滴度的dna样品为模板,利用所述dna病毒的特异性引物对进行qpcr扩增,根据ct值及系列梯度浓度标准品的标准曲线,获得病毒滴度。
24.在一定范围内,模板样品的拷贝数(含量或浓度)的对数值与qpcr测定的ct值成线性关系。根据标准曲线计算模板拷贝数的对数,从而推算待测重组腺病毒样品的感染滴度。
25.根据本发明的实施例,所述系列梯度浓度标准品的标准曲线通过以下方法获取:
26.对已知浓度的标准品质粒进行与所述待测病毒感染滴度的dna样品同样的qpcr扩增过程,获得模板样品拷贝数与qpcr测定的ct值之间的关系,绘制标准曲线,
27.其中,所述标准品质粒中含有所述dna病毒特异性引物扩增序列,所述dna病毒特异性引物扩增序列是指利用所述dna病毒特异性引物对获得的扩增产物的序列。
28.本发明第二方面提供一种试剂盒。根据本发明的实施例,所述试剂盒用于检测dna病毒感染滴度,所述试剂盒包括所述dna病毒的特异性引物对和已知浓度的标准品质粒,其中,所述标准品质粒中含有所述dna病毒特异性引物扩增序列。
29.利用本发明的试剂盒,能够准确、快捷的确定dna病毒感染滴度。
30.根据本发明的实施例,所述dna病毒为重组腺病毒,所述dna病毒的特异性引物对的核酸序列如seq id no.1和seq id no.2所示。
31.所述特异性引物对上游引物ql2-f:ttgtggttcttgcagatatggc;
32.所述特异性引物对下游引物ql2-r:tcggaatcccggcacc。
33.本发明第三方面提供本发明第二方面所述的试剂盒在检测dna病毒感染滴度中的用途,其中,所述dna病毒为重组腺病毒。本发明提供一种测定dna病毒感染滴度的方法,特别是利用qpcr测定重组腺病毒感染滴度的方法。该方法包括如下步骤:接种一定体积的待测重组腺病毒样品于293ft细胞中,感染数小时后收获293ft细胞进行总dna提取前处理,使用蛋白酶k消化未侵入293ft细胞的重组腺病毒颗粒外壳,释放其内的核酸;加入蛋白酶k抑制剂pmsf失活蛋白酶k;加入benzonase核酸酶消化293ft细胞外的重组腺病毒核酸;热失活benzonase核酸酶后使用dna提取试剂盒提取经前处理操作后的样品总dna,再进行qpcr定量测定。本发明方法测定重组腺病毒的感染滴度结果与使用药典中的tcid50法的测定结果相一致,且更加稳定、快捷。
34.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
35.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
36.图1a-1c显示了利用实施例1中的qpcr测定重组腺病毒感染滴度的方法,由已知系列稀释浓度(拷贝数)的标准品质粒进行qpcr获得的标准曲线、扩增曲线、熔解曲线;
37.图2显示了利用实施例1中的qpcr测定重组腺病毒感染滴度的方法,获得的8种不同处理下的ct值统计结果;
38.图3显示了利用实施例1中的qpcr测定重组腺病毒感染滴度的方法,接毒时分别使
用第14代细胞和第18代细胞进行3次生物学重复测定获得的ct值统计结果,blank指未接毒的对照细胞;
39.图4显示了利用实施例1中的qpcr测定重组腺病毒感染滴度的方法,铺板时在不同的293ft细胞密度下获得的ct值统计结果,blank指未接毒的对照细胞;
40.图5显示了利用实施例1中的qpcr测定重组腺病毒感染滴度的方法,在不同的接毒感染时间下获得的ct值统计结果;
41.图6显示了利用实施例1中的qpcr测定重组腺病毒感染滴度的方法,接毒感染后收取的细胞样品直接提取dna和冻存过夜后提取dna获得的ct值统计结果;
42.图7显示了利用实施例1中的qpcr测定重组腺病毒感染滴度的方法,在不同的酶解缓冲液以及不同核酸酶和不同公司生产的蛋白酶下获得的ct值统计结果;
43.图8显示了利用实施例1中的qpcr测定重组腺病毒感染滴度的方法,在不同的酶解缓冲液以及不同浓度的benzonase核酸酶以及处理时间下获得的ct值统计结果;
44.图9显示了利用实施例1中的qpcr测定重组腺病毒感染滴度的方法,在不同的核酸酶用量以及处理时间下获得的ct值统计结果。
45.图10显示了蛋白酶k处理不同的时间下,293ft细胞的细胞形态变化。
具体实施方式
46.在本发明的一些实施方案中,提供一种qpcr测定重组腺病毒感染滴度的方法,主要步骤如下:
47.(1)接毒:取一定体积(2.5~100μl)待测重组腺病毒样品,接种于适量293ft细胞中;
48.(2)收细胞:接毒感染一段时间后(2~8h),离心收集293ft细胞;
49.(3)dna提取前处理:先后使用蛋白酶k(处理时间10min~2h)和benzonase核酸酶(处理时间30min~16h)消化带毒细胞样品;
50.(4)提取总dna:失活蛋白酶k和benzonase核酸酶后使用dna提取试剂盒提取总dna;
51.(5)qpcr定量计算:根据重组腺病毒基因组序列设计特异性引物,并使用含该引物扩增序列的质粒载体为定量参考品,根据待测样品qpcr测定的ct值及系列梯度浓度参考品的标准曲线即可定量待测重组腺病毒样品中具有感染性的病毒量(感染滴度)。
52.特异性引物序列如下:
53.ql2-f:ttgtggttcttgcagatatggc,如seq id no.1所示;
54.ql2-r:tcggaatcccggcacc,如seq id no.2所示。
55.在本发明的一些实施方案中,在dna提取前处理中,所用的酶解缓冲液为0.9%nacl,20mm tris-hcl,ph8.0;所添加的蛋白酶k终浓度为0.05~5mg/ml,优选0.1~4mg/ml,进一步优选为1~3mg/ml,处理时间0.15~4h,优选0.25~3h,进一步优选0.5~2h;所添加的benzonase核酸酶终浓度为25~500u/ml,优选100~400u/ml,进一步优选150~300u/ml,处理时间0.5~24h。
56.在本发明的一些具体的实施方案中,qpcr测定重组腺病毒感染滴度的方法的具体步骤如下:
57.1)铺板:选用5至25代293ft细胞铺12孔板,稀释细胞密度至100k~1000k cells/ml,每孔加1ml细胞;每个样品对应3个孔的细胞,并留3个孔的细胞作为空白对照。37℃,5%co2培养箱中静置培养24h;
58.所用的细胞除了293ft之外,也可以是其他293细胞系;优选地,选用10~20代的293细胞系,稀释细胞密度至500k cells/ml;
59.2)接毒:铺板24h后,吸取一定量待测重组腺病毒样品加入对应的一列3孔293ft细胞中,可设置梯度添加量如100μl、50μl、25μl或10μl、5μl、2.5μl;也可设置等量添加重复,如每孔均添加50μl或5μl待测重组腺病毒样品;
60.3)收细胞:接毒感染2~8h后(优选2h)收取各孔内的293ft细胞。用移液器将细胞从板底吹下,转移至1.5ml ep管中,300g离心8min(避免高速离心造成细胞破裂),弃上清,留取细胞沉淀。使用pbs悬浮沉淀细胞,轻柔漂洗后300g离心8min,弃上清,留取细胞沉淀。再重复漂洗、离心弃上清步骤2次;
61.因低温冻存会导致细胞破裂,影响后续操作,不能将收集的细胞沉淀冻存于-20℃或-80℃冰箱;
62.4)dna提取前处理:使用200μl酶解缓冲液悬浮细胞沉淀,加入20mg/ml蛋白酶k溶液20μl,37℃孵育2h;加入终浓度为1mm的蛋白酶k抑制剂pmsf孵育10min;加入终浓度为200u/ml的benzonase核酸酶消化12~16h,以尽可能消化细胞外的非感染性病毒的基因组;
63.本发明方法的关键点是在保证细胞完整性的前提下尽可能消除未侵染细胞的重组腺病毒基因组,虽然蛋白酶k的最适酶解温度为56℃左右,但该温度下细胞膜易变性导致细胞内基因组外溢;
64.5)总dna提取:70℃处理30min灭活benzonase核酸酶后,使用天根细胞/组织基因组提取试剂盒或其他试剂盒、其他试剂,裂解细胞后提取样品的总基因组dna(含293ft细胞基因组及侵染进细胞的重组腺病毒基因组);
65.6)qpcr定量计算:配制标准品溶液:将标准品质粒(含重组腺病毒特定引物扩增序列)用无菌水稀释到每微升5
×
109拷贝数(然后用无菌水做10倍梯度稀释,依次稀释至5
×
108、5
×
107、5
×
106、5
×
105、5
×
104、5
×
103、5
×
102、0拷贝(copies)/μl共8个梯度,或依次稀释至108、107、106、105、104、103、102、0copies/μl);
66.配制定量pcr反应体系:
[0067]2×
sybr green i(擎科t5 fast)10μl10μmol/l ql2-f0.5μl10μmol/l ql2-r0.5μl模板2μlh2o7μl总体积20μl
[0068]
系列浓度标准品及待测重组腺病毒dna样品均设3个重复孔;将配制好的体系(未加模板)加入定量pcr板中,按顺序加好模板;贴紧封板膜,使每个孔的边缘都密封,以防pcr反应液受热挥发;
[0069]
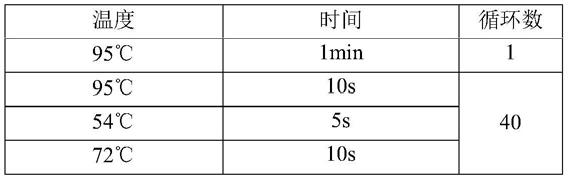
按以下参数设置运行荧光定量pcr仪:
[0070][0071]
在一定范围内,模板样品的拷贝数(含量或浓度)浓度对数值与qpcr测定的ct值成线性关系。根据标准曲线计算模板拷贝数的对数,从而推算待测重组腺病毒样品的感染滴度(单位iu/ml)。
[0072]
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0073]
本发明实施例中所用的供试重组腺病毒参考品由深圳源兴基因技术有限公司生产纯化(hplc检测纯度约100%,颗粒数为5
×
10
11
vp/ml),经tcid50法测定的感染滴度值为2.9
×
10
10
iu/ml。
[0074]
实施例1 qpcr测定重组腺病毒感染滴度
[0075]
1、铺板:选用10-20代293ft细胞铺12孔板,稀释细胞密度至500k cells/ml,每孔加1ml细胞;每个样品对应3个孔的细胞,并留3个孔的细胞作为空白对照。37℃,5%co2培养箱中静置培养24h。
[0076]
2、接毒:铺板24h后,吸取一定量待测重组腺病毒样品加入对应的一列3孔293ft细胞中(根据待测样品预估滴度,可设置梯度添加量为100μl、50μl、25μl或10μl、5μl、2.5μl;也可设置等量添加重复,如每孔均添加50μl或5μl待测重组腺病毒样品);
[0077]
3、收细胞:接毒感染2h后收取各孔内的293ft细胞。用移液器将细胞从板底吹下,转移至1.5ml ep管中,300g离心8min,弃上清,留取细胞沉淀。使用pbs悬浮沉淀细胞,轻柔漂洗后300g离心8min,弃上清,留取细胞沉淀。再重复漂洗、离心弃上清步骤2次;
[0078]
4、dna提取前处理:使用200μl酶解缓冲液(0.9%nacl,20mm tris-hcl,ph8.0)悬浮细胞沉淀,加入20mg/ml蛋白酶k溶液20μl,37℃孵育2h;加入终浓度为1mm的蛋白酶k抑制剂pmsf孵育10min;加入终浓度为200u/ml的benzonase核酸酶消化16h。
[0079]
5、总dna提取:70℃处理30min灭活benzonase核酸酶后,使用天根细胞/组织基因组提取试剂盒参照使用说明书提取样品的总基因组dna。
[0080]
6、qpcr定量计算:配制标准品溶液:将标准品质粒(含重组腺病毒特定引物扩增序列)用无菌水稀释到每微升5
×
109拷贝数(然后用无菌水做10倍梯度稀释,依次稀释至5
×
108、5
×
107、5
×
106、5
×
105、5
×
104、5
×
103、5
×
102、0拷贝(copies)/μl共8个梯度,或依次稀释至108、107、106、105、104、103、102、0copies/μl);
[0081]
配制定量pcr反应体系:
[0082]2×
sybr green i(擎科t5 fast)10μl10μmol/l ql2-f0.5μl10μmol/l ql2-r0.5μl模板2μl
h2o7μl总体积20μl
[0083]
系列浓度标准品及待测重组腺病毒dna样品均设3个重复孔;将配制好的体系(未加模板)加入定量pcr板中,按顺序加好模板;贴紧封板膜,使每个孔的边缘都密封,以防pcr反应液受热挥发;
[0084]
按以下参数设置运行荧光定量pcr仪:
[0085][0086]
图1a-1c显示了标准品质粒进行qpcr获得的标准曲线、扩增曲线、熔解曲线。在一定范围内,模板样品的拷贝数(含量或浓度)浓度对数值与qpcr测定的ct值成线性关系。根据标准曲线计算模板拷贝数的对数,从而推算待测重组腺病毒样品的感染滴度(单位iu/ml)。
[0087]
实施例2 dna提取前处理过程的优化(pbs漂洗及蛋白酶k、核酸酶处理时间)参照实施例1的基本检测流程,在dna提取前处理步骤设置了如下8种处理:
[0088]
组1:收细胞时不漂洗样品,蛋白酶k处理2h后提基因组;
[0089]
组2:收细胞时不漂洗样品,直接提基因组;
[0090]
组3:收细胞时不漂洗样品,蛋白酶k处理2h,pmsf处理10min,benzonase核酸酶过夜处理后提基因组;
[0091]
组4:收细胞时不漂洗样品,蛋白酶k处理2h,pmsf处理10min,benzonase核酸酶处理2h后提基因组;
[0092]
组5:收细胞时用pbs漂洗3次,蛋白酶k处理30min,pmsf处理10min,benzonase核酸酶过夜处理后提基因组;
[0093]
组6:收细胞时用pbs漂洗3次,蛋白酶k处理2h,pmsf处理10min,benzonase核酸酶过夜处理后提基因组;
[0094]
组7:收细胞时用pbs漂洗3次,蛋白酶k处理2h,pmsf处理10min,benzonase核酸酶处理2h后提基因组;
[0095]
组8:收细胞时用pbs漂洗3次,蛋白酶k处理2h,benzonase核酸酶过夜处理后提基因组。
[0096]
组1~8中,qpcr测定的ct值以及重组腺病毒样品的感染滴度如表1所示:
[0097]
表1
[0098]
处理ct滴度(10
10
iu/ml)114.38968.69217.7129.95317.7569.67417.8209.31519.7573.04
620.1982.49719.5173.49819.4703.57
[0099]
附图2也显示了组1~8处理下qpcr测定的ct值结果,结合从表1和附图2中结果,表明收细胞时若不漂洗样品,将导致测定的感染滴度值偏高,这是由于粘附于细胞表面的病毒颗粒、病毒核酸含量较高;对比组6与组8处理获得的结果,表明添加pmsf一定程度上可通过抑制蛋白酶k的活性而使benzonase核酸酶活性充分发挥;对比组1和组2的处理获得的结果,表明蛋白酶k可有效消化细胞外的病毒外壳,并释放其内的基因组,且消化30min~2h效果基本一致(对比组5与组6处理);benzonase处理2h或过夜(12~16h)处理可基本消化经蛋白酶k处理后暴露的病毒基因组(对比组6与组7处理)。组5和组6的测定结果与重组腺病毒参考品tcid50法测定的感染滴度值更接近。
[0100]
实施例3接毒用293ft细胞代次选择
[0101]
参照实施例1的基本检测流程,接毒时普遍使用的是第10~20代之间的细胞,同一样品的感染滴度测定结果未见显著差异。附图3展示的是使用第14代细胞和第18代细胞进行3次生物学重复测定的统计结果,两者无显著性差异。
[0102]
实施例4铺板用293ft细胞密度(用量)选择
[0103]
参照实施例1的基本检测流程,附图4表明,铺板时使用的293ft细胞密度为2.5
×
105至7.5
×
105cells/ml时,相同样品的感染滴度测定结果未见显著差异。
[0104]
实施例5接毒感染时间的选择
[0105]
参照实施例1的基本检测流程,附图5表明,接毒感染时间为2~6h后收取细胞样品进行测定,相同样品的感染滴度测定结果未见显著差异。接毒0~1h后,具有感染性的腺病毒颗粒没能充分侵染细胞。本发明中选择接毒感染2h后收取细胞进行后续操作。
[0106]
实施例6接毒收细胞后样品存放
[0107]
参照实施例1的基本检测流程,附图6表明,接毒感染后收取的细胞样品若冻存(-80℃)过夜,将导致测定的感染滴度值偏低(ct增大)。其原因在于低温冻存导致细胞破裂,已感染侵入细胞的重组腺病毒基因组外溢,在后续benzonase核酸酶消化步骤中被降解。因此,收取接毒细胞样品后应尽快进行dna提取前处理操作。
[0108]
实施例7酶解缓冲液、酶的用量与消化时间选择
[0109]
参照实施例1的基本检测流程,发明人筛选了若干酶解缓冲液,从中选择含生理盐水组分,ph8.0的tris缓冲体系——考虑到该溶液环境下细胞可维持较佳完整性、dna稳定性也较佳。检测前需测试筛选活性较佳的蛋白酶k、dnase i和benzonase。蛋白酶k和benzonase核酸酶都具有很高活性且稳定性较佳。
[0110]
附图7表明,供试的天根ga缓冲液不利于核酸酶发挥最优活性(ct偏低),磷酸盐缓冲液(pbs)和生理盐水(0.9%nacl)条件下dnasei和benzonase的活性都较佳;供试的两款蛋白酶k(合生基因pk和天根pk)活性相近,不加核酸酶处理组测定的病毒感染滴度值显著高于tcid50法测定值(ct偏低),与核酸酶处理组有显著差异。
[0111]
附图8表明,核酸酶用量为37.5-87.5u/ml、处理时间为0.5-1.5h时,相同样品的感染滴度测定结果总体上未见显著差异;添加了20mm tris(ph8.0)的生理盐水缓冲体系下,测定结果的平均值相对只添加生理盐水处理组波动不明显,可能是ph8.0条件下dna稳定性
更好,在试验操作中可以较大程度避免降解等不稳定因素。
[0112]
附图9表明,核酸酶用量为50-200u/ml、处理时间为0.5-24h时,相同样品的感染滴度测定结果未见显著差异。
[0113]
实施例8蛋白酶k消化时间对细胞形态的影响
[0114]
参照实施例1的基本检测流程,附图10显示了在蛋白酶k终浓度为1.8mg/ml的情况下,在消化时间10min-24h范围内,接毒后293ft细胞的形态变化,结果显示,消化时间10min-2h未见293ft细胞明显细胞裂解现象;4h-24h可见细胞形态变圆、透明、膜结构被破坏、通透性增加,大部分内容物释放。
[0115]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0116]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。