1.本发明涉及一种多重基因检测产品以及该产品所用到的检测体系,属于生物技术领域。
背景技术:
2.血流感染(bloodstream infection)是一种在住院患者中很常见的一种危重症,它发病率很高,全球每年发生超过180万例重症血流感染,根据我国多中心流行病学调查显示,每年我国有约373万重症血流感染病例。并且,血流感染病情进展迅速,危重病人较多,病死率高。据国外流行病学调查显示,在重症监护病房,血流感染的病死率已经超过心肌梗死成为非心脏病人死亡的主要原因,若同时并发感染性休克,血流感染的病死率可高达80%。全球每天约14,000人死于血流感染及其并发症,中国的血流感染病死率也高达48.7%。
3.血流感染发病急、病程进展迅速、病死率很高,所以快速、准确的病原学诊断对血流感染防治及其重要,是采用积极、精准的抗菌治疗的依据,能够挽救血流感染患者生命。目前国内外血流感染病原菌检测的常规方法是血培养,它也是血流感染病原学鉴定的金标准。血培养的优点是特异性高,可以直接为临床提供明确的病原学检测结果,并可以进行后续的体外药敏试验,能够为临床选用特异的抗菌药物提供指导。但是采用血培养方法检测血流感染病原体尚存在一些问题,不能满足临床诊疗需求。第一,检出率低:国外报道的血培养阳性检出率大约为34.2%,国内血培养的阳性检出率也仅为21.4%。如果患者采样前使用过抗菌药物,或者未选择好适合的分离培养条件,将会导致假阴性率进一步升高;第二,耗时长:血培养检测时间较长,因为它需要有增菌过程,往往是数小时~数天,对于生长缓慢且培养条件苛刻的病原菌可能需要更长的时间。而且血培养报阳后还需要进行转种培养和生化鉴定,所以通常血培养的检测结果至少需要3个工作日;第三,污染率和假阳性率高:由于血培养采样高营养条件的增菌过程,所以在样本采集或培养过程中即使污染极少量的细菌,也会导致假阳性的发生,尤其是皮肤表面寄生的表皮葡萄球菌等凝固酶阴性葡萄球菌。
4.所以目前微生物实验室尝试采用分子生物学方法检测血流感染病原体。近年来,国内外部分实验室尝试采用聚合酶链式反应(pcr)、实时定量pcr(rt
‑
pcr)或多重pcr等方法,通过检测血流感染样本中病原体的特异性基因片段进行快速鉴定,pcr检测耗时短、灵敏度高,有望大大缩短检测时间、提高阳性检出率。但是这些以pcr为基础的方法用于检测血流感染样本中的病原体时也遇到一些问题:首先是血流感染患者血液中病原体浓度很低,通常<10cfu/ml,这个浓度显著低于pcr方法的检出下限,导致假阴性率较高;其次,如果首先对血液样本进行孵育增菌,然后再采用pcr防范进行检测,虽然病原体浓度可以得到提升,但是血培养瓶中的pcr抑制物又将会干扰pcr的检测,仍然导致阳性率很低。
5.综上所述,目前血流感染病原体的检测方法不能满足临床需求,急需一种可以对血液样本中病原体进行增菌、富集并且能够去除血液和血培养瓶中pcr抑制物的方法,使得
后续的分子生物学检测方法能够顺利进行,为临床提供及时准确的病原学诊断依据。
技术实现要素:
6.本发明所要解决的技术问题是提供一种可以快速、全面、准确、低成本的血流感染病原体多重基因检测体系,以及试剂盒,以及采用该检测体系在制备诊断产品方面的应用。
7.本发明为解决上述技术问题提出的一种技术方案是:一种血流感染病原体多重基因检测体系,包括分别针对肺炎克雷伯菌、洋葱伯克氏菌、奇异变形杆菌、卡他莫拉菌、粘质沙雷菌、流感嗜血杆菌、铜绿假单胞菌、阴沟肠杆菌、大肠埃希菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌、肠炎沙门菌、葡萄球菌属、金黄色葡萄球菌、链球菌属、化脓链球菌、无乳链球菌、肺炎链球菌、粪肠球菌、屎肠球菌、白色念珠菌、热带念珠菌、近平滑念珠菌、光滑念珠菌进行检测的正反向引物,检测样本为增菌培养后的血液。
8.针对肺炎克雷伯菌的正向引物的核苷酸序列如seq id no.1所示,针对肺炎克雷伯菌的反向引物的核苷酸序列如seq id no.2所示;
9.针对洋葱伯克氏菌的正向引物的核苷酸序列如seq id no.3所示,针对洋葱伯克氏菌的反向引物的核苷酸序列如seq id no.4所示;
10.针对奇异变形杆菌的正向引物的核苷酸序列如seq id no.5所示,针对奇异变形杆菌的反向引物的核苷酸序列如seq id no.6所示;
11.针对卡他莫拉菌的正向引物的核苷酸序列如seq id no.7所示,针对卡他莫拉菌的反向引物的核苷酸序列如seq id no.8所示;
12.针对粘质沙雷菌的正向引物的核苷酸序列如seq id no.9所示,针对粘质沙雷菌的反向引物的核苷酸序列如seq id no.10所示;
13.针对流感嗜血杆菌的正向引物的核苷酸序列如seq id no.11所示,针对流感嗜血杆菌的反向引物的核苷酸序列如seq id no.12所示;
14.针对铜绿假单胞菌的正向引物的核苷酸序列如seq id no.13所示,针对铜绿假单胞菌的反向引物的核苷酸序列如seq id no.14所示;
15.针对阴沟肠杆菌的正向引物的核苷酸序列如seq id no.15所示,针对阴沟肠杆菌的反向引物的核苷酸序列如seq id no.16所示;
16.针对大肠埃希菌的正向引物的核苷酸序列如seq id no.17所示,针对大肠埃希菌的反向引物的核苷酸序列如seq id no.18所示;
17.针对鲍曼不动杆菌的正向引物的核苷酸序列如seq id no.19所示,针对鲍曼不动杆菌的反向引物的核苷酸序列如seq id no.20所示;
18.针对嗜麦芽窄食单胞菌的正向引物的核苷酸序列如seq id no.21所示,针对嗜麦芽窄食单胞菌的反向引物的核苷酸序列如seq id no.22所示;
19.针对肠炎沙门菌的正向引物的核苷酸序列如seq id no.23所示,针对肠炎沙门菌的反向引物的核苷酸序列如seq id no.24所示;
20.针对葡萄球菌属的正向引物的核苷酸序列如seq id no.25所示,针对葡萄球菌属的反向引物的核苷酸序列如seq id no.26所示;
21.针对金黄色葡萄球菌的正向引物的核苷酸序列如seq id no.27所示,针对金黄色葡萄球菌的反向引物的核苷酸序列如seq id no.28所示;
22.针对链球菌属的正向引物的核苷酸序列如seq id no.29所示,针对链球菌属的反向引物的核苷酸序列如seq id no.30所示;
23.针对人型支原体的正向引物的核苷酸序列如seq id no.31所示,针对人型支原体的反向引物的核苷酸序列如seq id no.32所示;
24.针对化脓链球菌的正向引物的核苷酸序列如seq id no.33所示,针对化脓链球菌的反向引物的核苷酸序列如seq id no.34所示;
25.针对无乳链球菌的正向引物的核苷酸序列如seq id no.35所示,针对无乳链球菌的反向引物的核苷酸序列如seq id no.36所示;
26.针对粪肠球菌的正向引物的核苷酸序列如seq id no.37所示,针对粪肠球菌的反向引物的核苷酸序列如seq id no.38所示;
27.针对屎肠球菌的正向引物的核苷酸序列如seq id no.39所示,针对屎肠球菌的反向引物的核苷酸序列如seq id no.40所示;
28.针对白色念珠菌的正向引物的核苷酸序列如seq id no.41所示,针对白色念珠菌的反向引物的核苷酸序列如seq id no.42所示;
29.针对热带念珠菌的正向引物的核苷酸序列如seq id no.43所示,针对热带念珠菌的反向引物的核苷酸序列如seq id no.44所示;
30.针对近平滑念珠菌的正向引物的核苷酸序列如seq id no.45所示,针对近平滑念珠菌的反向引物的核苷酸序列如seq id no.46所示;
31.针对光滑念珠菌的正向引物的核苷酸序列如seq id no.47所示,针对光滑念珠菌的反向引物的核苷酸序列如seq id no.48所示。
32.上述血流感染病原体多重基因检测体系还包括针对系统质控内参进行检测的正反向引物;针对系统质控内参的正向引物的核苷酸序列如seq id no.49所示,以及针对系统质控内参的反向引物的核苷酸序列如seq id no.50所示。
33.所有正向引物和反向引物在检测体系中的终浓度均为400nm。
34.上述血流感染病原体多重基因检测体系还包括多重pcr预混液、多重pcr酶液和无核酸酶纯水;所述多重pcr预混液由10
×
pcr缓冲液、mgcl2和dntps混合而成;所述多重pcr酶液由热启动dna聚合酶和ung酶混合而成。
35.所有正向引物上设有荧光标记,所述荧光标记为cy5或cy3或fam。
36.上述血流感染病原体多重基因检测体系还包括阳性对照物和阴性对照物;所述阳性对照物是包括所有目的基因靶点的质粒混合物;所述阴性对照物是无核酸酶超纯水。
37.反应时体系中的组分用量为10
×
的pcr缓冲液1体积,10μm的dntps共0.2体积,25mmol/l的mgcl2溶液0.8体积,引物混合物1体积,5u/μl的热启动dna聚合酶0.4体积,1u/μl的ung酶0.5体积,dna模板5体积,无核酸酶纯水1.1体积;所述dna模板的使用量为5~50ng/体系。
38.本发明为解决上述技术问题提出的另一种技术方案是:一种包括上述检测体系的血流感染病原体多重基因检测试剂盒。
39.本发明为解决上述技术问题提出的又一种技术方案是:一种采用上述的检测体系制备血流感染病原体多重基因检测和诊断产品的应用。
40.本发明具有积极的效果:
41.(1)本发明的血流感染病原体多重基因检测产品可以通过检测增菌培养后的血液,同时鉴别24种血流感染病原体,将所有目的基因的质粒等拷贝数混合在一起,通过调整各病原体的引物浓度,使各靶点出现的峰高相当,达到等效扩增所有靶基因的目的。该方法能对常见血流感染患者或疑似患者的血液样本进行检测,提供关于常见血流感染病原体的病原学诊断信息,帮助临床医师在及时明确病原体种类并采取有效治疗方案,同时减少经验性抗生素使用,降低医疗成本。
42.(2)本发明的血流感染病原体多重基因检测产品,加入了防污染的ung酶,在基因扩增前有效消除基因扩增片段污染,确保结果的可靠性和准确性。
43.(3)本发明的血流感染病原体多重基因检测产品,不同于传统凝胶电泳分析模式,可将非特异性扩增产物、引物、引物二聚体和特异性扩增产物分离,因而检测结果无杂峰,确保了检测的特异性和灵敏度。经测试,本方法杂峰较少,显示高特异性;并可检测低至10拷贝/μl的病原体,灵敏度较高。
44.(4)本发明的血流感染病原体多重基因检测产品同步加入了ic内参,确保了检测的可靠性准确性。ic可监控样本核酸提取、pcr和毛细电泳的反应过程,ic特征峰不出现说明反应失败,可有效避免假阴性。
45.(5)不同的病原体引起的血流感染的用药方案和治疗方法各不相同。《国家卫计委2015年抗菌药物临床应用指导原则》明确指出:“抗菌药物的应用必须根据患者的症状、体征和实验室检查结果,明确诊断后可应用”。但是,目前的常规检测方法存在检出率低、耗时长、尤其无法同时对多种病原体进行准确鉴定等缺点,导致临床普遍采用广谱性抗菌药物进行经验性治疗,造成疗效低下、不能及时控制常见血流感染、耐药菌株高发和增加医患医疗成本等问题。本发明采用建立了一种高通量、快速、准确、低成本的常见血流感染病原体鉴定系统,可以同步检测24种常见血流感染病原体,有效弥补常规检测方法检出率低、耗时长和不能同时进行多种病原体鉴定等缺点,可在第一时间内明确血流感染病原体种类,以便临床采取正确的治疗方案,有效防止感染加剧和减少耐药菌株的产生。
附图说明
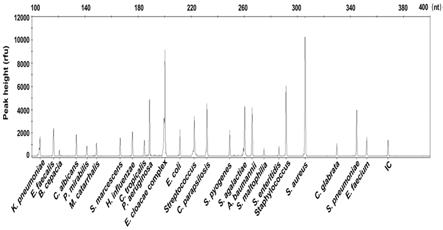
46.图1是本发明实施例1的试剂盒对混合阳性对照进行pcr反应后进行毛细管电泳分析后的图谱;
47.图2是本发明实施例1的试剂盒对阴性对照进行pcr反应后进行毛细管电泳分析后的图谱;
48.图3是本发明实施例1的试剂盒对样本1进行pcr反应后进行毛细管电泳分析后的图谱;
49.图4是本发明实施例1的试剂盒对样本2进行pcr反应后进行毛细管电泳分析后的图谱;
50.图5是本发明实施例1的试剂盒对样本3进行pcr反应后进行毛细管电泳分析后的图谱;
51.图6是本发明实施例1的试剂盒对样本4进行pcr反应后进行毛细管电泳分析后的图谱。
具体实施方式
52.下面通过实施例对本发明进行具体的描述,有必要在此指出的是以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,该领域的技术人员可以根据上述本发明内容对本发明作出一些非本质的改进和调整。下述实施例中,若非特意表明,所用的试剂均为分析纯,所用试剂均可从商业渠道获得。文中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著的科学出版社2002年出版的《分子克隆实验指南》一书中所述的条件,或按照制造商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。
53.实施例1
54.一、试剂盒的组成
55.本实施例的血流感染病原体多重基因检测试剂盒包括:多重pcr预混液、多重pcr酶液、引物混合物、阳性对照物、阴性对照物、系统质控内参(ic)和无核酸酶纯水。多重pcr预混液由10
×
pcr缓冲液、mgcl2和dntps混合而成。多重pcr酶液由热启动dna聚合酶和ung酶混合而成。
56.多重pcr预混液和多重pcr酶液均来自roche公司(货号:210212)。
57.阳性对照物是包括所有目的基因靶点的质粒混合物。
58.阴性对照物是无核酸酶超纯水。
59.引物混合物包括分别检测24种病原体靶基因的引物对和检测系统质控内参(ic)的引物对,各引物序列的特征如表1所示,引物均由上海生工生物工程股份有限公司合成。
60.表1引物序列特征表
61.[0062][0063]
其中阴沟肠杆菌是一个鉴定到该细菌复合群水平靶点病原体,该复合群还包含有几种公认的类似于“亚种”的细菌。葡萄球菌属和链球菌属是两个鉴定到属水平的靶点病原体。肺炎克雷伯菌、洋葱伯克氏菌、奇异变形杆菌、卡他莫拉菌、粘质沙雷菌、流感嗜血杆菌、铜绿假单胞菌、阴沟肠杆菌、大肠埃希菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌和肠炎沙门菌属于革兰阴性细菌。葡萄球菌属、金黄色葡萄球菌、链球菌属、化脓链球菌、无乳链球菌、肺炎链球菌、粪肠球菌、屎肠球菌属于革兰阳性细菌。白色念珠菌、热带念珠菌、近平滑念珠菌、光滑念珠菌属于真菌。
[0064]
反应时体系中的组分用量为10
×
的pcr缓冲液1体积,10μm的dntps共0.2体积,
25mmol/l的mgcl2溶液0.8体积,引物混合物1体积,5u/μl的热启动dna聚合酶0.4体积,1u/μl的ung酶0.5体积,dna模板5体积,无核酸酶纯水1.1体积。dna模板的使用量为5~50ng/体系。
[0065]
二、试剂盒的使用方法
[0066]
本实施例的血流感染病原体多重基因检测试剂盒的具体检测步骤如下:
[0067]
(1)采集患者血液样本:采集疑似血流感染患者的血液样本,同时采取左右两侧需养和厌氧血培养瓶各一瓶,每瓶血培养推荐的采血量为10ml。采集后的2瓶血培养瓶立即送往临床微生物实验室,立即置全自动血培养系统内增菌培养。血培养报阳后进行后续操作。
[0068]
(2)样本核酸提取:取300μl血培养瓶中的混合液体进行核酸提取,阳性对照和阴性对照各取80μl进行提取,每个参与提取的样本需加入5μl的ic共同提取。
[0069]
(3)配制反应体系:根据说明书,按照每个反应多重pcr预混液2μl、多重pcr酶液0.9μl、引物混合物1μl、无核酸酶纯水1.1μl的比例配制反应体系,涡旋混匀后,用离心机进行离心,然后分装于pcr反应管中。
[0070]
(4)加入核酸模板:将提取好的核酸加入到装有配制好的反应体系的pcr反应管中,每人份加入5μl核酸。
[0071]
(5)多重pcr扩增;本试剂盒的pcr扩增反应条件见表2。
[0072]
表2多重pcr扩增条件
[0073][0074][0075]
(6)对扩增产物进行毛细电泳分析,并根据峰型图进行结果判读。
[0076]
取3500dx遗传分析仪配套高度去离子甲酰胺(hidi)8.75μl、size
‑
500plus0.25μl,混合后加入pcr产物1μl进行毛细电泳分离样品。根据峰型图的出峰位置大小判断常见血流感染病原体种类。
[0077]
三、试剂盒的检测结果判定
[0078]
1.试剂盒有效性判定
[0079]
同时满足下列条件,才可进行结果判定:
[0080]
1)阴性对照:只检测到一个系统质控内参特异峰,即ic。
[0081]
2)阳性对照:在各扩增片段长度处各检测到一个荧光信号,且荧光信号值高于500。
[0082]
2.样本有效性判定:
[0083]
若检测样本的荧光信号值均低于500,则样本加入量较低,可适当增加pcr产物加入量或增加pcr反应循环数;若仍然不符合要求,需重新制备样本。
[0084]
3.结果判定标准
[0085]
常见血流感染病原体鉴定。
[0086]
系统质控内参和血流感染病原体基因的目的片段区域出现了相应的峰且荧光信号值均高于500,可以判断感染了相关病原体。
[0087]
4.结果判断实例
[0088]
采用本实施例的试剂盒使用方法对单个阳性对照分别进行pcr反应后采用毛细管电泳分析。基因的目标片段区域24种病原体和1个系统质控内参(ic)均出现了相应的峰。该结果非常直观,基因均扩增良好。说明每对引物能有效扩增对应的目的基因,特异性好。
[0089]
采用本实施例的试剂盒使用方法对所有阳性对照的混合液进行pcr反应后采用毛细管电泳分析后图谱如图1所示。基因的目标片段区域和系统质控内参共25个检测靶点均出现了相应的峰。该结果非常直观,基因均扩增良好。说明各引物之间没有干扰,能同时有效扩增所有目的基因。
[0090]
采用本实施例的试剂盒使用方法对阴性对照进行pcr反应后采用毛细管电泳分析后的图谱如图2所示,只出现了系统质控内参(ic)的特征峰,没有出现任何病原体的特征峰,只在小于100nt处有非特异性背景荧光信号。说明该检测体系特异性良好。
[0091]
采用本实施例的试剂盒使用方法对单个血流感染病原体的阳性对照进行系列稀释,进行pcr反应后采用毛细管电泳分析,用于评估本方法检测24种病原体的灵敏度。如表3所示,本方法对24种病原体的灵敏度可达到10copies/μl。说明该检测系统对常见血流感染病原体单重感染检测的灵敏度很高。
[0092]
表3血流感染病原体多重基因检测灵敏度
[0093]
[0094][0095]
采用本实施例的试剂盒使用方法对样本1进行pcr反应后采用毛细管电泳分析后的图谱如图3所示。系统质控内参出现且信号值大于500,铜绿假单胞菌(p.aeruginosa)基因的目标片段区域出现了相应的峰且信号值大于500。根据结果判定标准,说明该患者感染铜绿假单胞菌。检测结果非常直观。
[0096]
采用本实施例的试剂盒使用方法对样本2进行pcr反应后采用毛细管电泳分析后的图谱如图4所示。系统质控内参出现且信号值大于500,粪肠球菌(e.faecalis)基因的目标片段区域出现了相应的峰且信号值大于500。根据结果判定标准,说明该患者感染粪肠球菌。检测结果非常直观。
[0097]
采用本实施例的试剂盒使用方法对样本3进行pcr反应后采用毛细管电泳分析后的图谱如图5所示。系统质控内参出现且信号值大于500,大肠埃希菌(e.coli)和屎肠球菌(e.faecium)基因的目标片段区域均出现了相应的峰且信号值大于500。根据结果判定标准,说明该患者同时感染大肠埃希菌和粪肠球菌。检测结果非常直观。
[0098]
采用本实施例的试剂盒使用方法对样本4进行pcr反应后采用毛细管电泳分析后的图谱如图6所示。系统质控内参出现且信号值大于500,葡萄球菌(staphylococcus)和近平滑念珠菌(c.parapsilosis)基因的目标片段区域均出现了相应的峰且信号值大于500。根据结果判定标准,说明该患者同时感染葡萄球菌和近平滑念珠菌。检测结果非常直观。
[0099]
显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而这些属于本发明的精神所引伸出的显而易见的变化或变动仍处于本发明的保护范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。