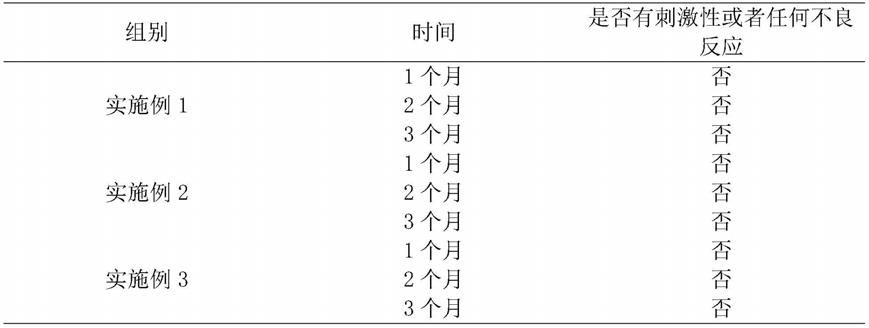
1.本发明涉及细胞培养领域,尤其涉及一种制备高纯度的诱导性多能干细胞来源的人脑多巴胺能神经元的方法。
背景技术:
2.帕金森病(parkinson’s disease),又称为“震颤麻痹”,是一种常见的老年神经系统退行性疾病,目前我国已有超300万的患者群体,患者数量居世界第一,占全球帕金森患者总数一半以上。帕金森病的特征性运动症状包括静止性震颤、运动迟缓、肌强直和姿势平衡障碍等,此外还会伴有便秘、嗅觉障碍、睡眠障碍、自主神经功能障碍及精神、认知障碍等非运动症状。目前已明确帕金森病的发生与大脑黑质多巴胺能神经元的变性死亡有关,但其生物学机理机制仍不明确,可能与遗传因素、环境因素、神经系统老化等多种因素相关。目前对于帕金森病的治疗仍局限于传统药物治疗和手术治疗。药物治疗分为疾病修饰治疗类药物和对症治疗类药物,主要包括抗胆碱能药物(苯海索等)、金刚烷胺、多巴胺前体物(左旋多巴)、儿茶酚
‑
o
‑
甲基转移酶(comt)抑制剂(恩他卡朋等)、多巴胺受体激动剂(普拉克索等)、b型单胺氧化酶(mao
‑
b)抑制剂(司来吉兰等)等。由于帕金森病患者需要终身服药,因此需时刻注意药物副作用的影响,必要时调整药物组合和剂量。而对于病情发展快、药物治疗已基本无效的患者可考虑进行手术治疗,手术方法主要有神经核团毁损术和脑深部电刺激术(dbs),其原理都是为了抑制脑细胞的异常活动,达到改善症状的目的。具体来说,神经核团毁损术是在异常活跃的神经核团上制造一个直径约3毫米的毁损灶,dbs则是埋植刺激器,通过高频电刺激达到类似毁损的效果。就目前来说,这两种手术方法均为改善帕金森病症状的有效方法,但dbs的安全性、可控性、长效性优于神经核团毁损术。但这些手术副作用均较大,能够导致永久性认知障碍。
3.上述用于治疗帕金森病的药物基本都有较大的副作用,包括口干口苦、胃肠道不适、排便异常、头晕恶心、体位性低血压、脚踝水肿、睡眠障碍以及精神类症状如神志模糊、意识障碍、幻觉、妄想等,大大降低了患者的生活质量。而手术治疗虽然能改善帕金森病的症状,但仅对运动症状如肢体震颤和肌强直有较好的疗效,对姿势步态障碍等躯体性中轴症状无明显作用,且术后仍需药物治疗来维持,因此有许多患者不愿意或者不适合进行手术治疗。综上所述,现有的针对帕金森病的药物和外科疗法治疗方案大多旨在解决由多巴胺能神经元缺失引起的症状,存在“治标不治本”的弊端,只能暂时缓解症状,根本无法逆转神经变性,并没有从根源上解决多巴胺能神经元变性死亡的问题。因此寻求一种从病因上提高神经系统细胞数目的治疗具有重要意义。
技术实现要素:
4.本发明的目的在于克服现有技术的不足,提供一种制备高纯度的诱导性多能干细胞来源的人脑多巴胺能神经元的方法。
5.针对帕金森病这种类型的与神经元变性死亡相关的神经退行性疾病最根本的治疗手段就是对异常死亡的神经元进行治疗或者替换。在过去的十几年间,干细胞领域研究的兴起将这一治疗手段变成了现实。2006年日本科学家山中伸弥在世界著名学术期刊《细胞》上率先发表了关于成功制备诱导性多能干细胞(induced pluripotent stem cells,简称ips细胞)的技术方法,并在2012年凭借此技术获得了诺贝尔生理医学奖。具体来说,ipsc技术利用特定的转录因子,可以将终末分化的体细胞(如外周血细胞、尿液细胞、皮肤细胞等)逆转为具有全能性的干细胞,即诱导性多能干细胞,这一逆转的过程即为细胞的重编程(cell reprogramming)。由于ips细胞具有与胚胎干细胞类似的全能性,可以分化为人体多种组织和器官细胞,如神经元、胶质细胞、心肌细胞、肝细胞、胰岛细胞、免疫细胞等,实现了对这些难以获取、难以扩增的细胞的大量制备,为相关疾病的机理机制研究提供了全新平台。此外值得注意的是,区别于经典的胚胎干细胞技术和体细胞核移植技术,ips细胞技术由于不涉及胚胎细胞或卵细胞的使用,因此不存在伦理问题。
6.另一方面,ips细胞技术的兴起为细胞替代性治疗以及以人源细胞为平台的药物筛选提供了可能性。通过对患者体细胞的重编程,科学家们可以获得大量个体特异性的ips细胞,从而可以分化出1)患者特异的、2)与该疾病直接相关的、3)可以有针对性的进行致病基因修复、4)无需细胞配型,无免疫排斥反应的自体细胞类型用于个体精准化细胞移植治疗或个性化药物筛选。当患者数量足够大时还可以进行群体化的药物筛选,找出对该患者群体最有效的药物。
7.本发明正是基于ips细胞技术及干细胞分化技术对帕金森病提出的全新治疗方案,即细胞移植治疗。本发明详细阐述了一种可以高效快速制备高纯度的中脑foxa2
lmx1
th
多巴胺能神经元(mesda neurons)的方法,产出的多巴胺能神经元具有多种用途,包括但不限于在神经科学研究中的用途、药物的筛选及开发,以及治疗与多巴胺能神经元缺乏相关的疾病或损伤(如帕金森病)。
8.为实现上述目的,本发明采取的技术方案为:提供一种用于快速高效制备高纯度的中脑foxa2
lmx1
th
多巴胺能神经元的培养液,包括分化培养液一、分化培养液二、分化培养液三、分化培养液四和分化培养液五;
9.所述分化培养液一含有以下组分:dmem/f12、knockout serum replacement、glutamax、neaa、β
‑
me、sb431542和shh
‑
c24ii;
10.所述分化培养液二含有以下组分:dmem/f12、knockout serum replacement、glutamax、neaa、β
‑
me、sb431542、shh
‑
c24ii、chir99021和fgf8b;
11.所述分化培养液三含有以下组分:dmem/f12、neurobasal、glutamax、n2 supplement和fgf8b;
12.所述分化培养液四含有以下组分:neurobasal、glutamax、b27 without vitamin a、fgf8b、bdnf、gdnf、l
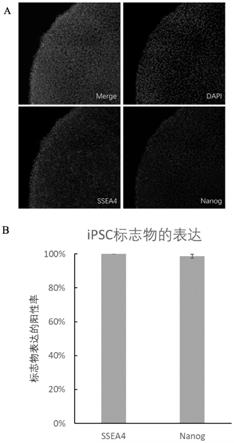
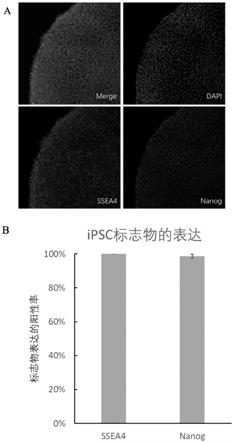
‑
aa和db
‑
camp;
13.所述分化培养液五含有以下组分:neurobasal、glutamax、b27 without vitamin a、bdnf、gdnf、l
‑
aa、db
‑
camp、dapt和tgfβ3。
14.本发明还提供了一种快速高效制备高纯度的中脑foxa2
lmx1
th
多巴胺能神经元的方法,包括以下步骤:
15.(1)培养人类诱导多能干细胞;
16.(2)中脑多巴胺能神经元前体细胞诱导;
17.(3)中脑多巴胺能神经元前体细胞的鉴定及神经元的分化。
18.作为本发明所述方法的优选实施方式,步骤(1)具体步骤为:细胞每7天使用relesr消化以1:6的细胞数目比例进行传代;待细胞密度达到70%后可进行后续神经诱导实验。
19.作为本发明所述方法的优选实施方式,步骤(2)具体步骤为:
20.第0天:使用所述分化培养液一制备ipsc单细胞悬液,在经过聚合物基质lam
‑
111预处理的培养板孔中以一定密度加入单细胞悬浮液,轻摇培养板使细胞均匀分布,5%co2的湿润环境下37℃培养;
21.第1~2天:吸除全部旧的培养液,并向培养板中每个孔加入预热的所述分化培养液一,放回37℃,5%co2的湿润环境中培养;
22.第3~7天:每隔一天吸除全部旧的培养液,并向培养板中每个孔内加入预热的所述分化培养液二,放回37℃,5%co2的湿润环境中培养;
23.第8~9天:吸除全部旧的培养液,并向培养板中每个孔内加入预热的所述分化培养液三,放回37℃,5%co2的湿润环境中培养;
24.第10天:采用accutase消化细胞后使用所述分化培养液四制备ipsc单细胞悬液,在经过聚合物基质lam
‑
111预处理的培养板孔中以一定密度加入单细胞悬浮液,轻摇培养板使细胞均匀分布,5%co2的湿润环境下37℃培养;
25.第11~15天:每隔一天吸除全部旧的培养液,并向培养板中每个孔加入预热的所述分化培养液四,放回37℃,5%co2的湿润环境中培养。
26.作为本发明所述方法的优选实施方式,步骤(3)具体步骤为:
27.第16天:采用accutase消化细胞后使用所述分化培养液五制备ipsc单细胞悬液,取少量细胞做免疫荧光染色检测中脑多巴胺能神经元前体细胞的标志物的表达;其余细胞以一定密度接种至经过聚合物基质lam
‑
111预处理的培养板孔中,轻摇培养板使细胞均匀分布,在5%co2的湿润环境下37℃培养;
28.第17天起:每隔两天吸除全部旧的培养液,并向培养板中每个孔加入预热的所述分化培养液五,放回37℃,5%co2的湿润环境中培养;待细胞具有典型神经元形态后可进行免疫荧光染色鉴定。
29.作为本发明所述方法的优选实施方式,所述中脑多巴胺能神经元前体细胞的标志物为lmx1、foxa2、otx2和nestin中的至少一种。
30.本发明同时提供所述培养液或所述的方法在快速高效制备高纯度的中脑foxa2
lmx1
th
多巴胺能神经元中的应用。
31.本发明的有益效果:
32.(1)本发明提供一种人类多巴胺能神经元诱导方法和相关培养液配方。培养液中包括无血清基础培养基、细胞添加剂、神经发育因子和抑制剂。其中,利用无血清基础培养基可以避免引入外源性物质,降低污染风险,同时,多种营养成分,如细胞添加剂和神经发育因子,能够使ipsc细胞受到信号刺激,活化ipsc细胞,促进分化。本发明提供的细胞培养方法,简单高效、成本低、短周期内可诱导获得高质量的人类多巴胺能神经元细胞。
33.(2)本发明方法分化所得的中脑foxa2
lmx1
th
多巴胺能神经元前体细胞纯度高、
功能成熟,且全过程耗时短,适宜进行大规模制备。
附图说明
34.图1:a.免疫荧光染色显示ipsc细胞标志物的表达;b.ipsc各标志物表达阳性率。
35.图2:a.免疫荧光染色显示npc细胞标志物的表达;b.npc各标志物表达阳性率。
36.图3:a.免疫荧光染色显示ipsc诱导的da细胞标志物的表达;b.da各标志物表达阳性率。
具体实施方式
37.为更清楚地表述本发明的技术方案,下面结合具体实施例进一步说明,但不能用于限制本发明,此仅是本发明的部分实施例。
38.本发明阐述了一种高效快速制备高纯度的诱导性多能干细胞来源的人脑多巴胺能神经元的方法。本发明以培养ips细胞为起始,不包含将体细胞重编程为ips细胞的过程。具体内容如下:
39.(1)培养人类诱导多能干细胞(ipsc):细胞每7天使用relesr消化以1:6的细胞数目比例进行传代;待细胞密度达到70%后可进行后续神经诱导实验。
40.(2)中脑多巴胺能神经元前体细胞诱导:
41.第0天:使用如实施例1所述分化培养液一制备ipsc单细胞悬液,在经过聚合物基质lam
‑
111预处理的培养板孔中以一定密度加入单细胞悬浮液,轻摇培养板使细胞均匀分布,5%co2的湿润环境下37℃培养;
42.第1~2天:吸除全部旧的培养液,并向培养板中每个孔加入预热的如实施例1所述分化培养液一,放回37℃,5%co2的湿润环境中培养;
43.第3~7天,每隔一天吸除全部旧的培养液,并向培养板中每个孔内加入预热的如实施例1所述分化培养液二,放回37℃,5%co2的湿润环境中培养;
44.第8~9天,吸除全部旧的培养液,并向培养板中每个孔内加入预热的如实施例1所述分化培养液三,放回37℃,5%co2的湿润环境中培养;
45.第10天:采用accutase消化细胞后使用如实施例1所述分化培养液四制备ipsc单细胞悬液,在经过聚合物基质lam
‑
111预处理的培养板孔中以一定密度加入单细胞悬浮液,轻摇培养板使细胞均匀分布,5%co2的湿润环境下37℃培养;
46.第11~15天:每隔一天吸除全部旧的培养液,并向培养板中每个孔加入预热的如实施例1所述分化培养液四,放回37℃,5%co2的湿润环境中培养。
47.(3)中脑多巴胺能神经元前体细胞的鉴定及神经元的分化:
48.第16天:采用accutase消化细胞后使用如实施例1所述分化培养液五制备ipsc单细胞悬液,取少量细胞做免疫荧光染色检测中脑多巴胺能神经元前体细胞的标志物(lmx1,foxa2,otx2,nestin或其组合)的表达。其余细胞以一定密度接种至经过聚合物基质lam
‑
111预处理的培养板孔中,轻摇培养板使细胞均匀分布,在5%co2的湿润环境下37℃培养;
49.第17天起:每隔两天吸除全部旧的培养液,并向培养板中每个孔加入预热的如实施例1所述分化培养液五,放回37℃,5%co2的湿润环境中培养。待细胞具有典型神经元形态后可进行免疫荧光染色鉴定。
50.实施例1分化培养液配方
51.本发明中所采用的分化培养液配方如表1所示。
52.表1分化培养液配方
[0053][0054]
实施例2人脑多巴胺能神经元的制备
[0055]
本实施例阐述了一种高效快速制备高纯度的诱导性多能干细胞来源的人脑多巴
胺能神经元的方法。本发明以培养ips细胞为起始,不包含将体细胞重编程为ips细胞的过程。具体内容如下:
[0056]
(1)人源ipsc的培养:
[0057]
人源ipsc在已铺有lam
‑
521的培养板内进行贴壁培养,采用mtesrtm作为培养液,且每天全量换液。ipsc细胞每7天进行一次传代,采用relesr作为消化液,待细胞悬浮后取少量接种于新的、已铺有lam
‑
521的培养板里(传代比例约为1:6)。每5
‑
10代进行一次免疫荧光染色实验或rt
‑
pcr定量分析实验来检定ipsc细胞的纯度及状态,常用的ipsc细胞特异性生物标记为ssea4、tra
‑1‑
60、nanog等。
[0058]
由图1可知,ipsc细胞的标志物(oct4、ssea4、sox2、tra
‑1‑
60、nanog及tra
‑1‑
81)均有表达,说明其处于未分化状态,具备全能分化的功能。
[0059]
(2)中脑多巴胺能神经元前体细胞诱导:
[0060]
第0天:准备用于诱导分化的ipscs。待ipsc密度达到70%后采用edta消化,37℃碳培箱内静置7分钟后吸去edta,向孔内加入基础培养液,轻轻吹打使其成为单细胞悬液后转入15ml离心管,300g离心5分钟,去上清后重悬至适量实施例1所述分化培养液一中,计数,按每平方厘米1~4
×
104个细胞接种至已铺有lam
‑
111的培养板中,轻摇培养板使细胞均匀分布,5%co2的湿润环境下37℃培养;
[0061]
第1~2天:采用无菌的移液管吸除全部旧的培养液,并向培养板中每个孔加入预热的如实施例1所述分化培养液一,放回37℃,5%co2的湿润环境中培养;
[0062]
第3~7天,每隔一天,采用无菌的移液管吸除全部旧的培养液,并向培养板中每个孔加入预热的如实施例1所述分化培养液二,放回37℃,5%co2的湿润环境中培养;
[0063]
第8~9天,采用无菌的移液管吸除全部旧的培养液,并向培养板中每个孔加入预热的如实施例1所述分化培养液三,放回37℃,5%co2的湿润环境中培养;
[0064]
第10天:采用accutase消化细胞,37℃碳培箱内静置5分钟后轻轻吹打使其成为单细胞悬液,转入15ml离心管后立即加入约10倍体积的基础培养液进行稀释,300g离心5分钟,去上清后重悬至适量如实施例1所述分化培养液四中,计数,按每平方厘米5~10
×
105个细胞接种至已铺有lam
‑
111的培养板中,轻摇培养板使细胞均匀分布,5%co2的湿润环境下37℃培养;
[0065]
第11~15天:每隔一天,采用无菌的移液管吸除全部旧的培养液,并向培养板中每个孔加入预热的如实施例1所述分化培养液四,放回37℃,5%co2的湿润环境中培养;
[0066]
(3)中脑多巴胺能神经元前体细胞的鉴定及神经元的分化:
[0067]
第16天:采用accutase消化细胞后使用如实施例1所述分化培养液五制备ipsc单细胞悬液,取少量细胞做免疫荧光染色检测中脑多巴胺能神经元前体细胞的标志物(lmx1,foxa2,otx2,nestin或其组合)的表达(见图2)。其余细胞以每平方厘米5~10
×
105个细胞的密度接种至经过聚合物基质lam
‑
111预处理的培养板孔中,轻摇培养板使细胞均匀分布,在5%co2的湿润环境下37℃培养;
[0068]
第17天起:每隔两天,采用无菌的移液管吸除全部旧的培养液,并向培养板中每个孔加入预热的如实施例1所述分化培养液五,放回37℃,5%co2的湿润环境中培养。在第27天前,如果细胞密度过大,可进行一次传代,以每平方厘米5~10
×
105个细胞的密度接种至经过聚合物基质lam
‑
111预处理的培养板孔中,轻摇培养板使细胞均匀分布后继续在5%
co2的湿润环境下37℃培养。待细胞具有典型神经元形态后可进行免疫荧光染色鉴定(见图3:map2 th 细胞比率达80%以上),标志物为th,nurr1,pitx3,map2或其组合。
[0069]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。