1.本发明涉及一种可循环利用的配体及其制备方法,还涉及其在烯醇氢甲酰化制备线性二元醇中的应用。
背景技术:
2.氢甲酰化是一种以烯烃为原料来制备多一个碳原子醛的合成方法,在工业化生产中有着巨大的应用;其下游产品醇/酸也应用于化工的各个领域。
3.线性二元醇例如1,4
‑
丁二醇、1,6
‑
己二醇作为聚酯关键单体有着巨大的产能与利益,氢甲酰化
‑
加氢是一种合成线性二元醇的非常经济的方法。例如,烯丙醇氢甲酰化
‑
加氢制备1,4
‑
丁二醇已经大规模应用于工业生产。
4.目前已有工业化的催化剂体系中常以rh、co为活性金属中心体配合不同配体共同催化;而双齿膦配体用大咬合角和优异的空间位阻效应能提高直链醛的选择性,从而收到广泛关注,但目前配体的可循环利用性较差,通常重复应用5 次后便出现明显的失活。
5.公开专利cn109922882a提出了一种通过添加过氧化物来原位再生利用氢甲酰化催化剂的方法,但需要去除溶液里的产物醛,并且效率低,且再生后催化效率也低,因此,需要寻求一种循环利用率高的新配体,应用于氢甲酰化反应中。
技术实现要素:
6.为克服现有技术中存在的上述缺陷,本发明的目的是提供一种用于烯醇氢甲酰化反应中的配体,所述配体稳定性好,具有高反应活性,可最大重复套用 30次并且再生简单。
7.本发明的另一个目的在于提供所述的配体的制备方法。
8.本发明的再一目的是提供一种所述配体在烯醇氢甲酰化制备线性二元醇中的应用,具有高反应活性和线性选择性。
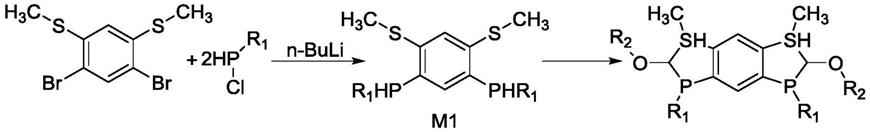
9.本发明提出的一种双齿膦型配体,其结构通式i如下:
[0010][0011]
其中r1、r2相同或不同,优选的为相同;r1、r2为c1‑
c
10
的直链或支链烷基、苯基中一种,优选的为正丙基、异丁基、异戊基或苯基。
[0012]
本发明所述配体的制备方法:将(4,6
‑
二溴
‑
1,3
‑
亚苯基)双(甲基硫烷)(又称为1,5
‑
二溴
‑
2,4
‑
二甲硫基苯)与取代氯化磷在有机碱存在下反应生成中间体m1;中间体m1与ch(or2)3在催化剂的条件下反应生成最终配体,方程式如下:
[0013][0014]
本发明所述中间体m1的制备方法中:取代氯化磷的加入量为(4,6
‑
二溴
‑
1,3
‑ꢀ
亚苯基)双(甲基硫烷)摩尔量的2.0
‑
5.0倍,优选的为2.5
‑
3.0倍;有机碱优选正丁基锂、异丙基锂,其加入量为(4,6
‑
二溴
‑
1,3
‑
亚苯基)双(甲基硫烷)摩尔量的1.0
‑
3.0 倍,优选的为1.2
‑
1.5倍,优选反应在溶剂中进行,溶剂为苯、甲苯、四氢呋喃之中的一种;优选的为四氢呋喃、甲苯;反应温度为
‑
78至
‑
30℃,反应时间为1.0
‑
5.0h,优选的为1.0
‑
1.5h。溶剂的用量为(4,6
‑
二溴
‑
1,3
‑
亚苯基)双(甲基硫烷)摩尔量的4.0
‑
7.0倍,优选的为5.5
‑
6.5倍。
[0015]
本发明所述配体的制备方法:ch(or2)3的加入量为中间体m1摩尔量的 2.0
‑
5.0倍,优选的为2.2
‑
2.5倍;催化剂为对甲苯磺酸、硫酸、盐酸之中的一种,优选的为对甲苯磺酸;催化剂的加入量为中间体m1摩尔量的1%
‑
10%,优选的为5%
‑
7%;优选反应在溶剂中进行,溶剂为苯、甲苯、二甲苯中的一种,优选的为甲苯,反应温度为100
‑
120℃,优选的为105
‑
110℃,反应时间为0.5
‑
3.0h,优选的为0.5
‑
1.0h。溶剂的用量为ch(or2)3摩尔量的4.0
‑
7.0倍,优选的为 5.0
‑
6.0倍。
[0016]
本发明所述的配体用于催化烯烃加氢
‑
氢甲酰化制备线性醇。
[0017]
本发明所述氢甲酰化反应原料烯醇为c3‑
c
10
的单烯醇,优选的为烯丙醇、巴豆醇、异戊烯醇、叶醇。
[0018]
本发明所述氢甲酰化反应的催化剂为醋酸铑、辛酸铑、乙酰丙酮铑、乙酰丙酮羰基铑、二羰基乙酰丙酮铑、三苯基膦乙酰丙酮铑、醋酸钴、辛酸钴、乙酰丙酮钴、乙酰丙酮羰基钴、三苯基膦乙酰丙酮钴中的一种或多种,优选的为二羰基乙酰丙酮铑和/或三苯基膦乙酰丙酮钴。
[0019]
本发明所述氢甲酰化反应为:将烯醇、催化剂、配体溶解于溶剂中,通入合成气,升温至反应温度,反应一定时间得到氢甲酰化产品;催化剂的加入量为烯醇摩尔量的0.001
‑
0.03倍,优选的为0.005
‑
0.01倍;配体的加入量为催化剂摩尔量的30
‑
100倍,优选的为40
‑
70倍;溶剂为苯、甲苯、氯仿中的一种或多种,优选的为苯、甲苯。溶剂的用量为烯醇摩尔量的4.0
‑
7.0倍,优选的为5.0
‑
6.0 倍。本发明所述氢甲酰化反应压力为1.0
‑
10.0mpag,优选的为1.0
‑
6.0mpag;反应温度为80
‑
200℃,优选的为90
‑
120℃,反应时间为1.0
‑
5.0小时,优选的为 2.0
‑
3.0小时。
[0020]
本发明所述线性二元醇的合成方法中,加氢
‑
氢甲酰化反应中还加入nabh4, nabh4的加入量为烯醇摩尔量的1.0
‑
3.0倍,优选的为1.5
‑
2.0倍,反应温度与氢甲酰化温度相同,反应时间为1.0
‑
5.0小时,优选的为2.0
‑
3.0小时。
[0021]
本发明所述配体的再生方法为:加入r2oh至反应液中,r2oh的加入量为配体摩尔量的2.0
‑
4.0倍,优选的为2.0
‑
2.3倍;反应时间为0.5h,反应温度为室温。r2为c1‑
c
10
的直链或支链烷基、苯基中一种,优选的为正丙基、异丁基、异戊基或苯基。
[0022]
本发明的配体,其线性催化原理是利用在反应过程中双齿膦配体与金属配位时的大咬合角结合配体中的o原子柔性链段使得空间位阻增大;同时在反应时在酸性条件下烯醇结合到配体的氧原子上,由于氧原子的吸电子能力使得烯烃端基的电负性减小,从而使
co倾向于端基加成,保证了反应选择性,在反应结束后加入r2oh通过交换使产物与配体分离,而配体重新生成,产物脱除。
[0023]
使用该配体得到线性醇,催化活性高、线性选择性好(选择性可以达 90~95%),与金属有较强的鳌合能力,循环套用性能好,特别适用于大规模的工业化生产。
具体实施方式
[0024]
以下结合具体实施例对本发明的技术方案做进一步详细说明。
[0025]
本发明实施例和对比例中使用的试剂原料来源如下:
[0026]
(4,6
‑
二溴
‑
1,3
‑
亚苯基)双(甲基硫烷)、二羰基乙酰丙酮铑、三苯基膦乙酰丙酮钴、正丁基锂、异丁基氯化磷、丙基氯化磷、异戊基氯化磷购自百灵威试剂公司;对甲苯磺酸、烯丙醇、巴豆醇、异戊烯醇、叶醇、四氢呋喃、甲苯购自上海国药试剂有限公司。
[0027]
其余试剂原料如无特别说明,均为市售产品。
[0028]
以上试剂均购买后直接使用。
[0029]
本发明实施例和对比例中使用的测试方法如下:
[0030]
产物结构由元素分析仪器测定,仪器为德国elementar公司vario el cube 分析仪。核磁仪器为bruker avanceiii 500mhz分析仪。
[0031]
色谱分析为agilent 7890b气相色谱仪:安捷伦db
‑
5色谱柱,进样口温度: 220℃;检测器温度:250℃;h2流量:40/min;空气流量:360ml/min。柱箱升温程序为:初始温度20℃,升温速率为20℃/min,保持4min;100
‑
250℃,升温速率 15℃/min,保持10min。
[0032]
以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
[0033]
实施例1
[0034]
(1)催化剂的制备
[0035]
中间体m1的制备:将(4,6
‑
二溴
‑
1,3
‑
亚苯基)双(甲基硫烷)(328.08g,1mol)、丙基氯化磷(276.3g,2.5mol)、正丁基锂(76.9,1.2mol)溶于450ml四氢呋喃中,液氮浴
‑
78℃,反应1.0小时,恢复到室温,得到中间体m1(302.5g, 0.95mol),结构如下:
[0036][0037]
元素分析:c:52.80;h:7.65;s:20.18;p:19.37
[0038]1h nmr(500mhz,chloroform
‑
d)δ7.11
–
6.96(m,1h),6.91(m,1h),3.29 (dtd,1h),2.91(dtd,1h),2.54(dtd,4h),2.46(dtd,6h),1.56(qt,4h),0.98(t,6h)。
[0039]
配体的制备:将中间体m1(329.1g,0.95mol)、ch(oc3h7)3(400.0g, 2.1mol)、对甲苯磺酸(8.3g,0.048mol)溶解到550ml甲苯中,反应温度为105℃,反应时间为0.5h;得到配体(416.4g,0.90mol),结构如下:
[0040][0041]
元素分析:c:57.15;h:8.70;s:13.75;o:6.98;p:13.42
[0042]1h nmr(500mhz,chloroform
‑
d)δ7.49(s,2h),7.33(t,1h),7.22(t,1h),4.88(q, 2h),3.50(dt,4h),2.44
–
2.32(m,4h),2.30(d,6h),1.70
–
1.60(m,8h),0.92(t,6h), 0.82(t,6h)。
[0043]
(2)烯丙醇加氢
‑
氢甲酰化制备1,4
‑
丁二醇
[0044]
以摩尔比:烯丙醇:三苯基膦乙酰丙酮钴:配体:甲苯=1:0.005:0.2:5.0加入到反应釜中,在co/h2摩尔比为1:1,压力为1mpa,温度90℃,反应2.0小时;加入nabh4(56.7g,1.5mol),反应2.0小时,经分析转化率为98.9%;由气相色谱分析得到1,4
‑
丁二醇,选择性为98.2%。
[0045]
实施例2
[0046]
(1)催化剂的制备
[0047]
中间体m1的制备:将(4,6
‑
二溴
‑
1,3
‑
亚苯基)双(甲基硫烷)(328.08g,1mol)、异丁基氯化磷(373.7g,3.0mol)、正丁基锂(96.1g,1.5mol)溶于500ml 四氢呋喃中,液氮浴
‑
58℃,反应1.5小时,恢复到室温,得到中间体m1 (339.5g,0.98mol),结构如下:
[0048][0049]
元素分析:c:55.49;h:8.19;p:17.84;s:18.48
[0050]1h nmr(500mhz,chloroform
‑
d)δ7.04(q,1h),6.91(p,1h),3.29(dtd,2h), 2.49(dt,4h),2.46(s,6h),1.76(dtt,2h),0.94(d,12h)。
[0051]
配体的制备:将中间体m1(339.5g,0.98mol)、ch(oc4h9)3(569.3g, 2.45mol)、对甲苯磺酸(12.0g,0.07mol)溶解到600ml甲苯中,反应温度为115℃,反应时间为1.0h;得到配体(477.2g,0.92mol),结构如下:
[0052][0053]
元素分析:c:60.22;h:9.35;s:12.38;o:6.19;p:11.86
[0054]1h nmr(500mhz,chloroform
‑
d)δ7.45(s,2h),7.37(t,1h),7.22(t,1h), 4.88(q,2h),3.50(dt,4h),2.40
‑
2.30(ddd,10h),1.70(dp,2h),1.56
–
1.45(m,4h), 1.37(m,4h),0.92(t,6h),0.85(d,6h),0.80(d,6h)。
[0055]
(2)巴豆醇加氢
‑
氢甲酰化制备2
‑
甲基
‑
1,4
‑
丁二醇
[0056]
以摩尔比:巴豆醇:rh(acac)(co)2:目标配体m:甲苯=1:0.01:0.7:6.0 加入到反应釜中,在co/h2质量比为1:1,压力为6mpa,温度120℃,反应3.0 小时;加入nabh4(75.7g,2.0mol),反应3.0小时,转化率为97.9%;由气相色谱分析得到线性产物2
‑
甲基
‑
1,4
‑
丁二醇,选择性为98.8%。
[0057]
实施例3
[0058]
(1)催化剂的制备
[0059]
中间体m1的制备:将(4,6
‑
二溴
‑
1,3
‑
亚苯基)双(甲基硫烷)(328.08g,1mol)、异戊基氯化磷(374.1g,2.7mol)、正丁基锂(83.3g,1.3mol)溶于甲苯中,液氮浴
‑
30℃,反应1.2小时,恢复到室温,得到中间体m1(363.3g,0.97mol),结构如下:
[0060][0061]
元素分析:c:57.70;h:8.65;p:16.50;s:17.15
[0062]1h nmr(500mhz,chloroform
‑
d)δ7.11
–
6.96(m,1h),6.91(p,1h),3.29 (dtd,2h),2.56(dtd,4h),2.46(s,6h),1.80
–
1.69(m,2h),1.55
–
1.38(m,4h),0.89 (d,12h)。
[0063]
配体的制备:将中间体m1(363.3g,0.97mol)、ch(oc5h
11
)3(617.3g, 2.43mol)、对甲苯磺酸(10.3g,0.06mol)溶解到500ml甲苯中,反应温度为 108℃,反应时间为0.8h;得到配体(599.4g,0.95mol),结构如下:
[0064][0065]
元素分析:c:64.70;h:10.25;s:10.18;o:5.01;p:9.86
[0066]1h nmr(500mhz,chloroform
‑
d)δ7.45(s,2h),7.37(t,1h),7.22(t,1h), 4.88(q,2h),3.50(dt,4h),2.70
‑
2.60(ddd,2h),2.50
‑
2.40(m,4h),2.30(d,3h),1.56
–
1.35(m,24h),0.92(t,9h),0.85(d,6h),0.80(d,6h)。
[0067]
(2)叶醇加氢
‑
氢甲酰化制备
[0068]
按摩尔比:叶醇:rh(acac)(co)2:目标配体m:甲苯=1:0.007:0.35: 5.0加入到反应釜中,在co/h2质量比为1:1,压力为4.0mpa,温度110℃,反应2.5小时,随后加入nabh4(64.3g,1.7mol),反应3.0小时,转化率为98.1%;由气相色谱分析得到线性产物2
‑
乙基
‑
1,5
‑
戊二醇,选择性为97.9%。
[0069]
实施例4
[0070]
中间体m1的制备:将(4,6
‑
二溴
‑
1,3
‑
亚苯基)双(甲基硫烷)(328.08g,1mol)、苯基氯化磷(365.4g,2.5mol)、正丁基锂(76.9,1.2mol)溶于450ml四氢呋喃中,液氮浴
‑
78℃,反应1.0小时,恢复到室温,得到中间体m1(371.0g,0.96mol),结构如下:
[0071][0072]1h nmr(500mhz,chloroform
‑
d)δ7.43(ddd,11h),7.43
–
7.29(m,9h),7.32
ꢀ–
7.18(m,1h),6.93(p,1h),3.29(qq,1h),2.91(dddd,1h),2.51(s,6h)。
[0073]
配体的制备:将中间体m1(371.0g,0.96mol)、ch(oc3h7)3(400.0g, 2.1mol)、对甲苯磺酸(8.3g,0.048mol)溶解到550ml甲苯中,反应温度为105℃,反应时间为0.5h;得到配体(477.6g,0.90mol),结构如下:
[0074][0075]1h nmr(500mhz,chloroform
‑
d)δ7.50(dtd,4h),7.38
–
7.30(m,9h),7.33
–
7.29 (m,1h),4.90(q,2h),3.53(dt,4h),2.34(d,6h),1.54(dtdd,4h),0.92(t,6h)。
[0076]
(2)烯丙醇加氢
‑
氢甲酰化制备1,4
‑
丁二醇
[0077]
以摩尔比:烯丙醇:三苯基膦乙酰丙酮钴:配体:甲苯=1:0.005:0.2:5.5加入到反应釜中,在co/h2摩尔比为1:1,压力为1mpa,温度90℃,反应2.0小时;随后加入nabh4(56.7g,1.5mol)反应2.0小时,经分析转化率为99.2%;由气相色谱分析得到1,4
‑
丁二醇,选择性为98.4%。
[0078]
实施例5
[0079]
(1)配体的循环套用
[0080]
采用实施例1中的加氢
‑
氢甲酰化方法,配体循环套用30次,结果如下表:
[0081]
套用次数转化率(%)选择性(%)598.898.21098.798.01598.497.62098.197.12597.996.73097.796.5
[0082]
(2)配体的再生
[0083]
配体套用30次后将异丁醇(28.17g,0.38mol)加入到实施例1中分离出氢甲酰化产物1,4
‑
丁二醇的反应液中(其中,经气相色谱检测配体为 0.19mol),室温反应0.5h,得到再生配体,再生配体的应用参考实施例1的加氢
‑
氢甲酰化反应,转化率和选择性与实施例1基本相同。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。