一种高纯度辅酶q10纯化工艺
技术领域
1.本公开涉及生物领域,尤其涉及辅酶q10分离纯化技术领域,特别地涉及一种从微生物发酵产物中分离纯化制备高纯度符合国际最高标准ep要求的辅酶q10原料药的纯化工艺。
背景技术:
2.辅酶q10(coenzyme q10,简写为coq10)又名泛醌,英文名:coenzyme q10,cas no.303
‑
98
‑
0,分子式c
59
h
90
o4,分子量863.36,为黄色至橙黄色结晶性粉末,无臭无味,遇光易分解,在正己烷中易溶,在丙酮中溶解,在乙醇中极微溶解,在水中不溶。是一种自然界广泛存在的脂溶性醌类化合物,是一种维生素类物质,生命体必要的重要元素之一,在动植物及微生物中广泛存在。
3.辅酶q10是生物自发合成的细胞代谢激活剂和抗氧化剂,辅酶q10在呼吸过程中是发挥着电子和质子的传递体的重要作用,它能作用于某些酶,使之发生三维结构的变化,从而影响其生理活动。辅酶q10作为细胞代谢的激活剂和天然抗氧化剂,具有增强机体免疫力、延缓衰老和提高人体活力等功效,并且它对人体安全,几乎没有毒副作用,因此在医学领域得到较好的应用,尤其是心血管系统疾病的治疗。过去的研究及临床试验证明辅酶q10具有增加机体免疫力,预防心脑血管硬化的作用,对改善高血压,充血性心衰竭,神经系统疾病以及肿瘤的治疗等都有帮助。现代药理研究表明,辅酶q10在体内主要有两个作用:一是在营养物质在线粒体内转化为能量的过程中起重要的作用;二是有明显的抗脂质过氧化作用。辅酶q10在临床上的应用主要有:抗衰老、保护皮肤、保护心脏、抗疲劳、增强肌肉能量、抗高血压、抗慢性疲劳综合症。
4.目前国内辅酶q10的研究应用主要在三个方面:一是用于化妆品,辅酶q10能清除人体自由基因达到抗衰老的美容作用;二是用于医药行业,辅酶q10可辅助治疗心血管等疾病。三是应用于保健食品原料。2020年国家市场监督管理总局将辅酶q10列入《保健食品原料目录》,主要用于增强免疫力抗氧化。
5.辅酶q10的制备方法主要有三种:化学合成法、动植物组织提取法和微生物发酵法。直接提取法主要从大豆、烟叶或动物内脏中进行分离和提取。提取法制备工艺较简单,但提取成本高,且受原料及季节等的限制,不适合于现代化工业大生产。化学合成法主要分为不以茄尼醇作为原料的全化学合成法、以茄尼醇作为原料的半化学合成法。化学合成法合成过程反应复杂、步骤多、转化效率低、往往还存在许多副产物,这些因素都影响了其产业化发展。微生物发酵法是目前生产辅酶q10的最主要方法。该方法由于原料廉价丰富,产物分离过程相对简单,产物为天然品,不存在化合物手性问题,生物活性好,易被人体吸收,且可以通过发酵罐实现规模化工业化生产,因此成为最有发展潜力的辅酶q10生产方法。微生物发酵法相较于前两种方法有以下优点:微生物资源丰富,生产成本低,不产生光学异构,生物活性高等,目前工业生产辅酶q10主要采用微生物发酵法。
6.由于微生物发酵液成分复杂,当从微生物中分离提取辅酶q10时,大量杂质也会被
一起提取出来,这直接影响后续提纯精制操作的难易程度。提取工艺的优劣也直接影响到提取的收率、产品的质量、提纯的成本等。
7.根据目前的文献报道,从辅酶q10发酵液中提取辅酶q10的方法主要有碱醇皂化法、碱化皂化法、超声波破碎法、超临界co2萃取法、层析、离子交换或大孔树脂吸附、硅胶柱层析等。
8.授权号为cn104694613a的中国专利文献公开了一种碱醇皂化法提取辅酶q10的方法,以辅酶q10发酵液为原料,通过有机溶剂萃取、碱醇皂化、硅胶柱层析、无水乙醇结晶、抽滤、真空干燥得到辅酶q10产品,此工艺能在一定程度上提高辅酶q10粗提物的纯度,但工艺过程中有机溶剂消耗量大,提取效率不高,产生大量皂化废水和洗涤废水,严重污染环境,是环境不友好型工艺。
9.授权号为cn102557912a的中国专利文献公开了一种皂化法制备辅酶q10粗提物的方法。用碱液皂化辅酶q10提取液,有机相水洗后得到皂化后的提取液,用于进一步的纯化精制,该工艺中,不生成单或双乙氧基衍生物,但萃取过程乳化严重,影响萃取收率和质量,提取效率低。
10.授权号为cn103819326a的中国专利文献公开了一种超声破碎提取、层析纯化制备辅酶q10的方法。该工艺中,能提高提取效率,但超声波处理过程大量放热,需增加冷冻降温设备,超声波随处理层厚度增加能量衰减快,限制处理量,而且超声波设备价值昂贵,大生产应用生产成本高,不适用于工业化生产。
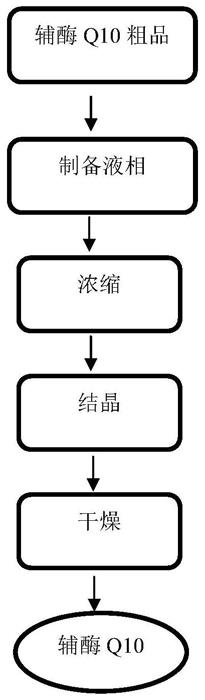
11.授权号为cn108218681b的中国专利文献公开了一种辅酶q10的纯化方法,包括将辅酶q10粗提物溶解,吸附洗脱除去杂质,收集洗脱液得到纯化的辅酶q10,所述的吸附中吸附材料选自有机烃类键合硅胶或含有极性有机官能团的有机烃类键合硅胶,所述的吸附材料在辅酶q10的纯化中具有反朗格缪尔等温吸附性质,所述的吸附温度为30
‑
65℃。采用本发明所述的方法可得到纯度大于99.7%的辅酶q10单体,得率最高可达到90%,同时该发明所述的吸附材料可实现数百至上千次的重复使用,工艺稳定,非常易于工业生产的自动化,并且吸附材料使用后经过简单处理就可以实现再生使用,大大降低了对环境的破坏。纯化方法,其特征在于,所述的辅酶q10粗提物为化学合成法、植物细胞培养法或微生物发酵法制备得到的产物,经选自过滤、离子交换或大孔树脂吸附中的一种或两种以上的方法纯化后的生成物。
12.授权号为cn101987815b的中国专利文献公开了一种从来自菌体发酵得到的辅酶q10粗提物中,制备高纯度辅酶q10的纯化工艺,其特征在于依次包括下列步骤:将辅酶q10粗提物经吸附树脂吸附、洗脱、浓缩、结晶、重结晶,然后上硅胶柱层析,以石油醚
‑
乙醚或正己烷
‑
乙酸乙酯混合溶剂作为洗脱剂纯化精制。本发明具有以下优点:选用吸附树脂,对辅酶q10具有良好的吸附性能,解吸操作简单,稳定性好且重复利用次数高;选用吸附树脂与硅胶层析方法结合,硅胶利用率高,不仅所需硅胶量小,而且重复利用10次以上仍能保持良好的纯化效果,硅胶废弃量少,溶剂可回收利用,有利环保。生产操作简便,所得辅酶q10纯度≥98%。
13.授权号为cn108863743b的中国专利涉及辅酶q10的提取纯化方法及由其制备的辅酶q10。该方法从辅酶q10菌体中提取纯化辅酶q10,包括提取、沉淀、脱色和层析(本公开方法的步骤中使用硅胶层析柱)精制步骤,针对性地去除了细菌色素、非极性脂类、中性脂类、
极性脂类以及醌类同系物等杂质,操作步骤简单、产品损失少,产品辅酶q10的纯度可达到99.8%以上,总收率可达到98.5%以上。
14.授权号为cn103819326b的中国专利公开一种从微生物中分离纯化辅酶q10的方法,包括以下步骤:(1)破碎;(2)提取;(3)层析(将步骤(2)中所得有机相经脱水后,进行硅胶柱层析,层析温度38-42℃,层析柱用溶剂进行洗涤、洗脱,收集洗脱液,减压浓缩至辅酶q10:有机溶剂质量比为1:5
‑
20);(4)结晶。
15.授权号为cn107337593b的中国专利涉及一种辅酶q10纯品的制备方法,其工艺步骤为:首先将辅酶q10发酵液经陶瓷膜微滤和喷雾干燥得到粗品,然后将该粗品用丙酮浸提,所得浸提液分相、减压浓缩得到辅酶q10提取浓缩液,之后用石油醚萃取、硅胶柱层析、减压蒸馏浓缩洗脱液,最后加入辅酶q10晶种结晶,减压干燥即可得到辅酶q10纯品。本发明采用陶瓷膜微滤、喷雾干燥方法粉碎菌丝,再经丙酮回流浸提、陶瓷膜过滤器分离,将菌丝细胞破壁、分离,富集辅酶q10。
16.授权号为cn102557912b的中国专利公开一种辅酶q10提取液的皂化方法,工艺过程是辅酶q10提取液与碱液按一定比例进入静态混合器充分混合皂化后,经过离心机分离,使有机相和废碱液相分开,有机相再与水按一定比例进入另一静态混合器充分混合水洗,经过另一台离心机分离,使有机相和废水相分开,所得有机相即为皂化后的辅酶q10提取液。皂化后的提取液杂质含量较皂化前明显减少,浓缩物的辅酶q10含量显著提高,有效提高后续层析提纯的收率、层析填料的使用次数和产品的质量。
17.授权号为cn106117033b的中国专利公开了一种同时分离制备高纯度辅酶q10和还原型辅酶q10的工艺,以菌渣为原料进行渗漉提取得到含辅酶q10和还原型辅酶q10的渗漉提取液,通过结晶分离出大部分辅酶q10,并将结晶母液还原得还原液,还原液经萃取得到含有还原型辅酶q10的萃取液,将萃取液进行结晶处理分离出还原型辅酶q10,最终得到了纯度达98%以上的高纯度辅酶q10和纯度达98%以上的高纯度还原型辅酶q10,总收率为94%以上,整个工艺简单可靠、易操作,易于实现,参数便于控制。
18.采用微生物发酵法生产辅酶q10提纯工艺一般为:发酵液处理获得菌渣,加入有机溶剂进行浸提,浸提液减压浓缩后进行萃取,萃取液减压浓缩再进行柱层析,有机溶剂进行洗脱,洗脱液减压浓缩干,最后采用乙醇结晶。在柱层析过程中,往往需要消耗大量洗脱溶剂,产生大量的洗脱液,工业上主要采用减压蒸馏方式进行洗脱液的溶剂脱除,其过程耗时长、能耗高、产品纯度低。
19.制备液相色谱(preparative chromatography)是用大直径柱分离纯化大量纯组分的技术。随着药物现代化以及生物化工的迅速发展,制备液相色谱作为一种快速高效的制备分离技术,受到医药、生物化工等各个科研和工业领域的重视,应用越来越广泛,成为一种必不可少的分离分析手段,很多高纯样品只能用制备液相色谱技术进行分离。
20.制备型hplc是制备纯化杂质的一种很有效的手段,具有产品纯度高、产率高、分离速度快等优点。随着合成、植化、生化和制药等领域对高纯度组分的需求不断增加,以及在药物杂质中的应用将得到更广泛的应用与发展。通过查阅相关报道,并未检索到辅酶q10使用制备型液相色谱进行分离纯化的相关报道和相关专利。
技术实现要素:
21.发明人提供了一种高纯度辅酶q10原料药纯化工艺,包括:
22.(1)粗品溶解:辅酶q10粗品加入流动相溶解;
23.(2)色谱柱装填:液相色谱柱填料为c18或c8等有机烃类键合硅胶或含有极性有机官能团的有机烃类键合硅胶(10
‑
50μm);
24.(3)制备型高效液相纯化:粗品流动相溶解液上柱,用流动相进行洗脱,在波长275nm处检测,收集有紫外吸收的馏分;
25.(4)将合格馏分进行浓缩得稀浸膏;
26.(5)结晶:用乙醇溶解稀浸膏,经粗结晶和精结晶,离心分离得到辅酶q10精结晶滤饼;
27.(6)干燥:将辅酶q10精结晶滤饼干燥3~5h后得辅酶q10成品。
28.在一个优选的实施方案中,在步骤(1)中,所述辅酶q10粗品,是由类球红细菌(rhodobacter sphaeroides)作为原始菌种,经过扩大培养获得发酵液,发酵液经过酸化、过滤、干燥后制成干菌丝,干菌丝用有机溶剂萃取、水洗、固相萃取、色谱分离、浓缩得辅酶q10粗品。
29.在一个优选的实施方案中,在步骤(1)中,所述流动相为丙酮和甲醇的混合液。
30.在一个优选的实施方案中,在步骤(2)中,使用2~3倍量乙醇或异丙醇等匀浆填柱,保压20~30min,乙醇或异丙醇循环冲洗20~30min,流动相冲洗30min。
31.在一个优选的实施方案中,在步骤(3)中,所述流动相流速:1.0~8.0l/min;流动相为丙酮和甲醇。
32.在一个优选的实施方案中,在步骤(3)中,丙酮:甲醇的体积比为20
‑
40:60
‑
80。
33.在一个优选的实施方案中,在步骤(5)中,包括:
34.(1)粗结晶:加入稀浸膏体积的20~35倍的乙醇(甲醇、丙醇),浓度大于85%,搅拌升温溶解,降温至10~20℃,停止搅拌,结晶1~5h,离心,得到粗结晶滤饼;
35.(2)精结晶:加入粗结晶滤饼体积的20~35倍的乙醇(甲醇、丙醇),浓度大于等于95体积%,搅拌升温使粗结晶滤饼完全溶解,降温至10~20℃,结晶时间1~5h,离心得到精结晶滤饼。
36.在一个优选的实施方案中,搅拌转速为20~60r/min。
37.在一个优选的实施方案中,在步骤(6)中,使用干燥机进行干燥。
38.在一个优选的实施方案中,在步骤(6)中,将精结晶滤饼加入一次双锥干燥机中,控制真空度
‑
0.02~
‑
0.09mpa、频率20hz、温度30~40℃,干燥3~5h后得辅酶q10成品。
39.有益效果
40.本公开通过制备液相色谱高效快速的制备了高纯度的辅酶q10原料药,杂质含量低,质量标准符合《欧盟药典》的有关规定,且对环境极为友好。
41.本公开制得的辅酶q10原料药的质量标准符合《欧盟药典》的有关规定,
42.(1)将特定杂质(相对保留时间1.46)降低到0.1%以下。
43.(2)杂质d(相对保留时间0.7)不大于0.3%;其它杂质不大于0.10%;总杂不大于0.6%。
44.(3)辅酶q10含量≥99.7%。
45.(4)产品符合ep质量要求。
46.(5)产品收率≥85%。
附图说明
47.附图示出了本公开的示例性实施方式,并与其说明一起用于解释本公开的原理,其中包括了这些附图以提供对本公开的进一步理解,并且附图包括在本说明书中并构成本说明书的一部分。
48.图1为示出了本公开高纯度辅酶q10纯化工艺的流程图。
49.图2为示出了辅酶q10对照品图谱。辅酶q10在保留时间15.543min处有峰。
50.图3为示出了杂质d和辅酶q10对照品图谱。杂质d在保留时间10.741min处有峰,辅酶q10在保留时间15.578min处有峰。
51.图4为示出了对比例1的低纯度辅酶q10的检验图谱。由图4可见,辅酶q10(保留时间14.837min)相对保留时间0.7(保留时间10.267min)处的杂质d峰峰面积占比是0.20%,辅酶q10相对保留时间1.46(保留时间21.674min)处特定杂质峰面积占比是0.35%,辅酶q10(保留时间14.837min)纯度为99.15%。
52.图5为示出了本公开高纯度辅酶q10的检验图谱。由图5可见,辅酶q10(保留时间14.774min)相对保留时间0.7(保留时间应为10.342min)处无峰,说明杂质d已消除;辅酶q10相对保留时间1.46(保留时间应为21.570min)处无峰,说明该特定杂质已消除;其他单杂的峰面积占比分别为0.06%、0.05%、0.02%、0.09%、0.10%,所有单杂的量已经降低至0.1%以下;总杂0.32%,已降至0.6%以下;辅酶q10纯度达到99.68%。
53.由图5和图4对比,杂质d已经消除,相对保留时间1.46处特定杂质已经降低至0.1%以下且已经消除,其他杂质也降低至0.1%以下,总杂不大于0.6%,辅酶q10纯度也相应提高,使辅酶q10达到ep对原料药的要求。
具体实施方式
54.下面结合附图和实施方式对本公开作进一步的详细说明。可以理解的是,此处所描述的具体实施方式仅用于解释相关内容,而非对本公开的限定。另外还需要说明的是,为了便于描述,附图中仅示出了与本公开相关的部分。
55.需要说明的是,在不冲突的情况下,本公开中的实施方式及实施方式中的特征可以相互组合。下面将参考附图并结合实施方式来详细说明本公开。
56.实施例
57.实施例1
58.(1)粗品溶解:称取辅酶q10粗品2.0kg,置于溶样罐中,加入50l丙酮,加热搅拌,再加入甲醇200l,继续搅拌30min;
59.(2)色谱柱装填:液相色谱柱填料为c18有机烃类键合硅胶(10μm);
60.(3)制备型高效液相纯化:溶解样品上样后,经流动相进行洗脱,在波长275nm处检测,收集有紫外吸收的馏分;
61.(4)将合格馏分进行浓缩得稀浸膏;
62.(5)结晶:
63.①
粗结晶:加入稀浸膏体积的20倍的乙醇,乙醇浓度大于85%,搅拌升温至45℃使溶解至溶液澄清透亮,降温至10℃,停止搅拌,结晶1h,离心,得到粗结晶滤饼;
64.②
精结晶:加入粗结晶滤饼20倍的乙醇,乙醇浓度大于95%,搅拌升温使粗结晶滤饼完全溶解,降温至10℃,结晶时间1h,离心得到精结晶滤饼。
65.(6)干燥:对辅酶q10精结晶滤饼干燥3h后得辅酶q10成品。
66.实施例2
67.(1)粗品溶解:称取辅酶q10粗品6.3kg,置于溶样罐中,加入180l丙酮,加热搅拌,再加入甲醇700l,继续搅拌30min;
68.(2)色谱柱装填:液相色谱柱填料为c8有机烃类键合硅胶(25μm);
69.(3)制备型高效液相纯化:溶解液上样后经流动相进行洗脱,在波长275nm处检测,收集有紫外吸收的馏分;
70.(4)将合格馏分进行浓缩得稀浸膏;
71.(5)结晶:
72.①
粗结晶:加入稀浸膏体积25倍的乙醇,乙醇浓度大于等于85%,搅拌升温至55℃使溶解至溶液澄清透亮,降温至15℃,停止搅拌,结晶3h,离心,得到粗结晶滤饼;
73.②
精结晶:加入粗结晶滤饼25倍的乙醇,乙醇浓度大于等于95%,搅拌升温使粗结晶滤饼完全溶解,降温至15℃,结晶时间3h,离心得到精结晶滤饼。
74.(6)干燥:对辅酶q10精结晶滤饼干燥4h后得辅酶q10成品。
75.实施例3
76.(1)粗品溶解:称取辅酶q10粗品2.0kg,置于溶样罐中,加入50l丙酮,加热搅拌,再加入甲醇200l,继续搅拌30min;
77.(2)色谱柱装填:液相色谱柱填料为含有极性有机官能团的有机烃类键合硅胶(50μm);
78.(3)制备型高效液相纯化:溶解液上样后,经流动相进行洗脱,在波长275nm处检测,收集有紫外吸收的馏分;
79.(4)将合格馏分进行浓缩,得稀浸膏;
80.(5)结晶:
81.①
粗结晶:加入稀浸膏体积35倍的乙醇,乙醇浓度大于等于85%,搅拌升温至65℃使溶解至溶液澄清透亮,降温至20℃,停止搅拌,结晶5h,离心,得到粗结晶滤饼;
82.②
精结晶:加入粗结晶滤饼体积的35倍的乙醇,乙醇浓度大于等于95%,搅拌升温使粗结晶滤饼完全溶解,降温至20℃,结晶时间5h,离心得到精结晶滤饼。
83.(6)干燥:对辅酶q10精结晶滤饼干燥5h后得辅酶q10成品。
84.对比例1:
85.低纯度辅酶q10的制备方法:
86.(1)粗品溶解:称取辅酶q10粗品6.3kg,加入粗品25倍的乙醇,乙醇浓度大于等于85%。
87.(2)结晶:
88.①
粗结晶:搅拌升温至55℃使溶解至溶液澄清透亮,降温至15℃,停止搅拌,结晶3h,离心,得到粗结晶滤饼;
89.②
精结晶:加入粗结晶滤饼25倍的乙醇,乙醇浓度大于等于95%,搅拌升温使粗结晶滤饼完全溶解,降温至15℃,结晶时间3h,离心得到精结晶滤饼。
90.(3)干燥:对辅酶q10精结晶滤饼干燥4h后得辅酶q10
91.由图4可见,低纯度辅酶q10(保留时间14.837min)相对保留时间0.7(保留时间10.267min)处的杂质d峰峰面积占比是0.20%,辅酶q10相对保留时间1.46(保留时间21.674min)处特定杂质峰面积占比是0.35%,辅酶q10(保留时间14.837min)峰面积占比为99.15%。
92.该低纯度辅酶q10杂质不符合ep要求,主要原因为在相对保留时间1.46左右杂质的占比达到0.4%左右,超出ep要求。ep标准要求杂质d不大于0.3%,其他杂质不大于0.10%,总杂不大于0.6%。
93.ep检验方法如下:
94.高效液相色谱法,测试过程避光操作。
95.测试溶液:将实施例1的25.0mg样品溶于25.0ml无水乙醇中。约50℃加热2分钟,放凉。
96.参比溶液(a):将25.0mg辅酶q10标准品溶于25.0ml无水乙醇中。约50℃加热2分钟,放凉。
97.参比溶液(b):将2mg辅酶q10杂质d标准品溶于2ml测试溶液中。约50℃加热2分钟,放凉。吸取1.0ml该溶液用无水乙醇稀释至50ml。
98.参比溶液(c):吸取1.0ml测试溶液用无水乙醇稀释至100.0ml。吸取5.0ml该溶液用无水乙醇稀释至10.0ml。
99.色谱柱:尺寸:长0.2米,直径4.6mm。
100.固定相:封端的液相色谱级ods凝胶(5μm)。
101.流动相:乙醇:甲醇(20:80v/v)。
102.流速:1.7ml/分钟。
103.检测波长:275nm。
104.进样量:测试溶液、参比溶液(b)和(c)均为10μl。
105.运行时间:2倍辅酶q10保留时间。
106.杂质的鉴别:通过参比溶液(b)的液相图谱对杂质d峰进行鉴别。杂质d与辅酶q10(保留时间=约在14分钟)相对保留时间计算:杂质d约为辅酶q10的0.7倍。
107.系统适用性:对照溶液(b)杂质d与辅酶q10分离度最少为6.5。
108.图3为示出了杂质d和辅酶q10对照品图谱。杂质d在保留时间10.741min处有峰,辅酶q10在保留时间15.578min处有峰。
109.图5为示出了本公开实施例1的高纯度辅酶q10的检验图谱。由图5可见,辅酶q10(保留时间14.774min)相对保留时间0.7(保留时间应为10.342min)处无峰,说明杂质d已消除;辅酶q10相对保留时间1.46(保留时间应为21.570min)处无峰,说明该特定杂质已消除;其他单杂的峰面积占比分别为0.06%、0.05%、0.02%、0.09%、0.10%,所有单杂的量已经降低至0.1%以下;总杂0.32%,已降至0.6%以下;辅酶q10纯度达到99.68%。由图5和图4对比,杂质d已经消除,相对保留时间1.46处特定杂质已经降低至0.1%以下且已经消除,其他杂质也降低至0.1%以下,总杂不大于0.6%,辅酶q10纯度也相应提高,使辅酶q10达到ep
对原料药的要求。
110.在本说明书的描述中,参考术语“一个实施例/方式”、“一些实施例/方式”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例/方式或示例描述的具体特征、结构、材料或者特点包含于本技术的至少一个实施例/方式或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例/方式或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例/方式或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例/方式或示例以及不同实施例/方式或示例的特征进行结合和组合。
111.此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本技术的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
112.本领域的技术人员应当理解,上述实施方式仅仅是为了清楚地说明本公开,而并非是对本公开的范围进行限定。对于所属领域的技术人员而言,在上述公开的基础上还可以做出其它变化或变型,并且这些变化或变型仍处于本公开的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。