1.本发明涉及植物病害病原菌分离技术领域,特别是涉及一种玉米真菌性病原菌的分离方法。
背景技术:
2.植物在生长过程中,易受致病菌侵染,并引发病害的发生。从发病组织中成功分离和获得目标病原菌是植物病理学研究及病害防治的关键环节。
3.玉米鞘腐病、茎腐病、纹枯病、根腐病等是世界玉米生产上重要的茎部和根部病害,其病原复杂,有真菌性病原菌和细菌性病原菌,其中真菌性病原菌包括多种镰孢菌、腐霉菌、丝核菌,病原单一或复合侵染玉米根部、根茎部、茎部(叶鞘、小穗、维管束)组织引起玉米根茎部发病,表现为根系腐烂、叶鞘变色、茎杆、小穗坏死、叶片黄化、植株枯萎或折断、倒伏。
4.然而发病株病组织随着病情发展或标本采集分离不及时,极易受后期腐生杂菌或细菌感染,增加该类病害标本病原菌分离、纯化难度。目前对上述病害病菌分离多采用病组织常规消毒法,常用消毒剂有体积百分含量的75%乙醇、质量百分含量的0.1%升汞、质量百分含量的1%次氯酸钠等,然而目标病菌对消毒液敏感,含菌量少的病组织病菌在这些消毒液单一使用或联合使用处理过程中易被杀死,杂菌往往在培养基上却能快速生长,极大影响病原菌的分离效果和成功率。
技术实现要素:
5.为了解决上述问题,本发明提供了一种玉米真菌性病原菌分离方法。本发明所述的分离方法无需对发病组织进行消毒,且具有分离病菌成功率高优势,同时对发病后期含菌量少或受细菌感染的病样中真菌性病原菌的识别和分离具有较好的适用性。
6.为了实现上述目的,本发明提供如下技术方案:
7.本发明提供了一种玉米真菌性病原菌分离方法,包括以下步骤:
8.(1)在玉米病株发病部分的病健交界处截取发病组织,无菌水清洗后对所得发病组织进行第一培养,得培养物;
9.(2)将培养物转移到玉米幼苗茎杆的切口处进行第二培养,得染菌茎杆;所述染菌茎杆的病症包括染菌茎杆变色、染菌茎杆呈水渍发病状和染菌茎杆切口处及其邻近组织出现绒状、絮状或稀薄状菌丝;
10.(3)将染菌茎杆上的病原菌菌丝转置pda培养基进行第三培养,得病原真菌纯培养物。
11.优选的,所述真菌性病原菌包括鞘腐病病原菌、茎腐病病原菌、纹枯病病原菌和根腐病病原菌中的一种或几种。
12.优选的,所述玉米幼苗为2~4叶龄幼苗。
13.优选的,步骤(1)所述第一培养的温度为20~25℃,时间为1~3d,湿度为85~
100wt.%;所述第一培养的方式为黑暗培养。
14.优选的,步骤(2)所述第二培养的温度为20~25℃,时间为1~2d,湿度为85~100wt.%;所述第二培养的光强强度为1000lx,光照时间为10~14h。
15.优选的,步骤(3)所述第三培养包括初培养和纯化培养;所述初培养和纯化培养的温度均为25~28℃,时间均为2~3d,培养的方式均为黑暗培养。
16.优选的,步骤(2)所述转移培养物前,对玉米幼苗茎杆进行表面消毒。
17.优选的,步骤(1)所述发病组织的长度为1~3cm。
18.优选的,步骤(1)所述培养物包括菌丝和/或孢子。
19.优选的,所述切口为无杂菌污染的切口。
20.有益效果:
21.本发明提供了一种玉米真菌性病原菌的分离方法,包括以下步骤:在病株发病部分的病健交界处取发病组织,无菌水清洗后,进行第一培养,得培养物;将培养物转移到玉米幼苗茎杆的切口处进行第二培养,得染菌茎杆;所述染菌茎杆的病症包括染菌茎杆变色、染菌茎杆呈水渍发病状和染菌茎杆切口处及其邻近组织出现绒状、絮状或稀薄状菌丝;将染菌茎杆上的病原菌菌丝转置pda培养基进行第三培养,得病原真菌纯培养物。本发明所述方法并没有对病株发病部位进行消毒,能够避免消毒剂对发病部位的少量病菌存活力影响,而且通过病株发病组织的培养物对玉米幼苗茎杆进行侵染,使得玉米幼苗茎杆的切口处直接接触目标病原菌,能使目标病原菌快速繁殖和扩展,减少杂菌对标本目标病原菌分离过程中的干扰,最终实现对目标病原菌的快速识别、选择和诱捕,减少病样中病原菌分离保存的盲目性,具有简便、高效等优点,能较为全面地从病株上分离获得多种病原菌菌株,具有简便高效、分离病菌成功率高、种类多的优势,本发明提供的方法特别适用于发病后期含菌量少或受杂菌感染的病样中病原真菌的分离,本发明方法的应用对开展玉米茎部病害病原菌种类多样性研究及病害科学治理具有重要意义。
22.而且,当玉米幼苗茎杆切口接触有目标病原菌,染菌茎杆出现变色、呈水渍发病状,并有绒状、絮状或稀薄状菌丝长出;若茎杆切口接触有其他疑似病原真菌的杂菌或细菌,茎杆表现为无菌丝出现,或出现有一些致密菌丝,或徒长的黑根霉菌丝出现,能快速识别、选择和诱捕目标病原菌,进而保证实现简便、高效的技术效果。
23.进一步的,本发明采用的2~4叶龄的玉米幼苗茎杆具有易于获得和消毒的优势,玉米幼苗茎杆消毒后,其表面及切口仍尚余有少量消毒液,当切口瞬间接触病组织上的菌丝表层时,可对病组织及菌丝表层上少量杂菌起到消毒作用,同时对细菌也起到一定的生物过滤作用,可快速识别并诱捕到目标病原菌。
附图说明
24.图1为发病组织(病组织)在保湿盒中保湿培养情况图;
25.图2为用于识别和诱捕病菌的玉米幼苗及玉米幼苗茎杆,其中a为玉米幼苗,b为玉米幼苗茎杆;
26.图3为在保湿处理病组织中出现疑似病原菌菌丝和杂菌菌丝,其中培养皿左侧为疑似病原菌菌丝,右侧为杂菌菌丝;
27.图4为含菌量多和含菌量少病组织保湿培养3天菌丝长出情况,其中a为含菌量多
的病组织,b为含菌量少的病组织;
28.图5为玉米苗茎杆切口醮取保湿病组织中疑似病原菌菌丝后培养2天,部份玉米幼苗茎杆及切口发病及菌丝生长图片,其中左图为感染鞘腐病病菌的茎杆,右图从左至右依次为感染根腐病病菌、纹枯病病菌和腐霉病病菌的茎杆;
29.图6为从染菌的幼苗茎杆上分离出目标菌株镰刀菌且未见细菌伴生,其中a为培养3天的病菌,b为培养2天的病菌;
30.图7为从染菌的幼苗茎杆上分离出目标菌株腐霉菌、纹枯丝核菌且未见细菌伴生,其中a为腐霉菌,b为纹枯丝核菌;
31.图8为长泰采集病株分离的菌株表现平板形态多样,其中a
‑
f均为镰刀菌;
32.图9为标本3病组织采用采用常规的分离方法(75%乙醇30~45s)分离的结果,第一排从左到右均为从病组织分离的菌落感染细菌明显的结果,第二排从左到右均为从病组织分离的菌落感染细菌不明显的结果;
33.图10为染菌的玉米幼苗茎杆分离出的菌落图和接种针挑取菌丝在pda平板上划线的菌落,其中左侧为玉米幼苗茎杆分离出的菌落图,中间和右侧为划线的菌落图;
34.图11为长有菌丝的保湿培养病组织采用常规的分离方法(75%乙醇3045s)分离获得病菌情况,其中第一排和第二排从左到右均为从病组织分离的菌落感染杂菌明显的结果;
35.图12为用玉米成株期叶鞘、水稻苗茎杆和玉米幼苗茎杆醮取菌丝3天后的菌丝生长情况,从左到右依次为玉米成株期叶鞘、水稻苗茎杆和玉米幼苗茎杆;
36.图13为用玉米成株期茎杆、叶鞘醮取菌丝3天后的菌丝生长情况;
37.图14为水稻苗茎杆醮取菌丝后的病原菌分离情况;
38.图15为玉米成株期茎杆、叶鞘醮取菌丝后的病原菌分离情况,其中左侧为玉米成株期茎杆,右侧为叶鞘;
39.图16为用根霉菌处理玉米苗茎杆切口3天无菌丝长出或长出菌丝徒长;
40.图17为用木霉菌、未知真菌、细菌处理的玉米苗茎杆切口3天无菌丝长出;
41.图18为醮取平板培养感染细菌病原菌后染病菌的玉米苗茎杆及病菌再分离纯化效果,其中左侧的图片为感染细菌病原菌菌落,中间的图片为染菌的玉米苗茎杆,右侧的图片为从染菌的玉米苗茎杆成功分离出病菌,从左到右均为尚无细菌感染的病原菌菌落。
具体实施方式
42.本发明提供了一种玉米真菌性病原菌分离方法,包括以下步骤:
43.(1)在玉米病株发病部分的病健交界处截取发病组织,无菌水清洗后对所得发病组织进行第一培养,得培养物;
44.(2)将培养物转移到玉米幼苗茎杆的切口处进行第二培养,得染菌茎杆;所述染菌茎杆的病症包括染菌茎杆变色、染菌茎杆呈水渍发病状和染菌茎杆切口处及其邻近组织出现绒状、絮状或稀薄状菌丝;
45.(3)将染菌茎杆上的病原菌菌丝转置pda培养基进行第三培养,得病原真菌纯培养物。
46.本发明在玉米病株发病部分的病健交界处截取发病组织,无菌水清洗后对所得发
病组织进行第一培养,得培养物。本发明将发病组织直接进行培养,无需对发病组织进行消毒,保证了从含菌量少的标本病组织中诱捕到目标病原菌。
47.在本发明中,所述清洗的次数优选为2~3次。在本发明中,所述发病组织的长度优选为1~3cm,更优选为1.5~2.0cm;本发明在病健交界处截取特定长度的发病组织,有利于少量病菌在病组织保湿条件下扩繁,并使其产生孢子和菌丝,而且病健交界处组织通常是分离病菌的有效部位,此处病菌更有活力,杂菌少,而且病健交界处截取的发病组织上的病原菌还能利用发病组织的残余营养进行生长扩繁。本发明对所述截取的方式没有特殊限定,采用本领域技术人员所熟知的方式即可;在本发明具体实施例中,所述截取的方式优选为利用无菌剪刀剪取发病组织。
48.在本发明中,所述玉米病株包括玉米鞘腐病病株、玉米茎腐病病株、玉米根腐病病株、玉米纹枯病病株和玉米复合病病株;所述复合病包括鞘腐病茎腐病,鞘腐病和纹枯病;所述真菌性病原菌优选包括鞘腐病病原菌、茎腐病病原菌、纹枯病病原菌和根腐病病原菌中的一种或几种。
49.在本发明中,所述发病部分优选包括叶鞘、茎杆或根茎部;本发明对所述玉米病株的生育期没有特殊限定,即玉米病株的整个生育期均能进行分离。
50.在本发明中,当所述真菌性病原菌为鞘腐病病原菌时,所述发病部分优选为叶鞘,携带有鞘腐病病原菌的病株的生育期优选为8~9叶期、抽雄期、籽粒建成期、乳熟期;当所述真菌性病原菌为茎腐病病原菌时,所述发病部分优选为叶鞘、茎杆,携带有茎腐病病原菌的病株的生育期优选籽粒建成期、乳熟期和抽雄期;当所述真菌性病原菌为纹枯病病原菌时,所述发病部分优选为叶鞘,携带有纹枯病病原菌的病株的生育期优选为抽雄期、籽粒建成期;当所述真菌性病原菌为根腐病病原菌时,所述发病部分优选为根部、根茎部和茎基部中的一种或几种,携带有根腐病病原菌的病株的生育期优选为3~4叶苗期和拔节期。
51.在本发明中,所述第一培养的温度优选为20~25℃,更优选为21~24℃;所述第一培养的时间优选为1~3d,更优选为1.5~2.5d;所述第一培养的湿度优选为85~100wt.%,更优选为90~95wt.%;所述第一培养的方式优选为黑暗培养。在本发明的实施例中,所述第一培养优选在培养皿中进行;所述培养皿优选为无菌培养皿;所述培养皿优选置于塑料保湿盒;所述塑料的颜色优选为透明。在本发明中,所述培养物优选包括菌丝和/或孢子,更优选包括菌丝。
52.得培养物后,本发明将培养物转移到玉米幼苗茎杆的切口处进行第二培养,得染菌茎杆;所述染菌茎杆的病症包括染菌茎杆变色、染菌茎杆呈水渍发病状和染菌茎杆切口处及其邻近组织出现绒状、絮状或稀薄状菌丝。本发明所述切口优选为无杂菌污染的切口,更优选为中间切口;所述中间切口优选为从消毒好的茎杆的中间切断所得切口;本发明在茎杆的中间进行切断所得的切口可确保无污染,而从育苗盘培养的苗中获取茎杆过程中采用工具剪或切造成的切口或剪口有可能受剪具、植物表面杂菌及环境空气杂菌等因子的感染。在本发明中,所述玉米幼苗优选为2~4叶龄幼苗。在本发明中,所述第二培养的温度优选为20~25℃,更优选为21~24℃;所述第二培养的时间优选为1~2d;所述第二培养的湿度优选为85~100wt.%,更优选为90~95wt.%;所述第二培养的光强优选为1000lx;所述第二培养的光照优选为10~14h,更优选为10~12h。在本发明中,所述第二培养优选在培养皿中进行;所述培养皿优选为无菌培养皿;所述培养皿优选置于塑料保湿盒;所述塑料的颜
色优选为透明。在本发明中,所述培养物优选包括菌丝和/或孢子,更优选包括菌丝。
53.在本发明中,本发明对所述培养物转移的方式没有任何限定,采用本领域技术人员所熟知的方式即可;在本发明具体实施例中,所述培养物转移的方式优选为蘸取。
54.在本发明中,所述2~4叶龄的玉米幼苗的来源优选为室内营养土培育10~20天的玉米幼苗,室内培养的玉米苗通常较弱,本发明利用其茎杆易诱捕到目标病原菌,而且能够使病原菌快速生长。本发明对所述营养土的来源没有特殊限定,采用本领域技术人员常规购买所得即可;在本发明具体实施例中,所述营养土优选为品氏托普泥炭土。本发明对所述玉米幼苗的培育方法没有特殊限定,采用本领域技术人员所熟知的方式即可;在本发明具体实施例,所述玉米幼苗的培育方法优选为利用室内营养土培育;所述培育的温度优选为20~25℃;所述培养的方式优选为光暗交替,更优选光照时间:黑暗时间为12h:12h;所述光强优选为1000lx。
55.在本发明中,所述玉米幼苗茎杆的长度优选为4~6cm;所述玉米幼苗茎杆优选为去除叶片和根后所得的茎杆;本发明对所述去除叶片和根的方式没有任何限定,采用本领域技术人员所熟知的方式即可;在本发明具体实施例中,所述去除叶片和根的方式优选采用无菌剪刀去除叶片和根。
56.所述转移培养物前,本发明优选对玉米幼苗茎杆进行表面消毒。在本发明中,所述消毒采用的消毒剂优选为乙醇;所述乙醇的体积百分含量优选为75%;所述消毒的时间优选为30~45s;所述消毒优选在超净工作台上进行。在本发明中,所述消毒后,优选将消毒所得消毒茎杆放于培养皿中;所述培养皿优选为无菌培养皿。
57.得染菌茎杆后,本发明将染菌茎杆上的病原菌菌丝转置pda培养基进行第三培养,得病原真菌纯培养物。在本发明中,所述第三培养采用的培养基优选为pda培养基;所述pda培养基优选包括以下质量的组分:马铃薯200g、葡萄糖20g和水1000ml;所述第三培养优选包括初培养和纯化培养;所述初培养的温度优选为25℃;所述初培养的时间优选为2~3d;所述初培养的方式优选为黑暗培养;所述纯化培养的温度优选为25℃;所述纯化培养的时间优选为2~3d。
58.为了进一步说明本发明,下面结合附图和实施例对本发明提供的一种玉米真菌性病原菌的分离方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
59.实施例1
60.供试标本:
61.(1)玉米鞘腐病病株(采自长泰,生育期乳熟期)、(2)玉米茎腐病病株(采自建阳,生育期抽雄期)、(3)玉米根腐病病株(采自福州,4~5叶苗期)、(4)玉米纹枯病病株(采自闽候,生育期抽雄期)。
62.试验方法:
63.从发病田中采集具有典型的玉米鞘腐病病症病株、典型的病症玉米茎腐病病株、典型的玉米根腐病病症病株和典型的玉米纹枯病病症病株,病株去除根部土壤和叶片后,用灭菌报纸单独包扎带回实验室。
64.在上述4个病株的病组织病健交界处,用无菌剪刀剪取1~3cm的发病组织(其中标本1、2、3、4随机剪取病组织数分别为30、10、10、10个,玉米鞘腐病病株在叶鞘部的病健交界处组织剪取发病组织,玉米茎腐病病株在叶鞘、茎杆部的病健交界处组织剪取发病组织,玉
米根腐病病株在根部、根茎部的病健交界处组织剪取发病组织,玉米纹枯病病株在叶鞘部的健交界处组织剪取发病组织),用无菌水洗净2~3遍后,置于无菌培养皿内,培养皿放置在透明的塑料保湿盒中(内垫有润湿抽纸4层)于20~25℃、湿度为85~100wt.%条件下第一培养(保湿培养)1~3天,得到四种病样病组织菌丝(培养过程记录照片如图1)。
65.培养过程发现若含菌量多的病组织保湿培养1天便有菌丝出现,若含菌量少的病组织需要3天才可见稀薄菌丝,因此能够通过保湿处理后新长出的菌丝量多和少来进行初步判断该病组织含菌量的多少。其中,培养2天时结果如图3所示,由图3可见,发病组织在保湿盒中保湿处理2天,有病原菌菌丝长出,但也有杂菌出现,因此有的病样病组织中有明显的杂菌出现,我们可以在此基础上对目标病菌进行一次筛选,如果觉得可疑症状不明显的菌丝可以不要;培养3天结果如图4所示,由图4可见,采用本发明的分离方法含菌量多和含菌量少病组织保湿培养3天均能长出菌丝。
66.取室内20~25℃、光暗交替(12h光/12h暗,即光照时间:黑暗时间为12h:12h,光强1000lx)条件下育苗盘营养土(品氏托普泥炭土)培育10天的2叶1心玉米苗,用无菌剪刀去除叶片和根,保留玉米幼苗茎杆长4~6cm(图2)。
67.在超净工作台上,将玉米幼苗茎杆用体积百分含量为75%的乙醇浸泡消毒30~45s后,放入无菌培养皿内,并用无菌刀将茎杆从中间切成2段。用无菌镊子夹取消毒好的玉米苗茎杆,并将中间切口的一端快速醮取保湿培养发病组织上目标菌丝,得染菌茎杆,供试玉米幼苗茎杆为60个,每个病组织上的菌丝蘸取1个玉米幼苗茎杆。
68.将各个玉米苗茎杆分别放在无菌培养皿内,培养皿放置在上述透明的塑料保湿盒中20~25℃、湿度为85~100wt.%,光强1000lx的条件下进行第二培养(保湿处理)1~2天,得染菌茎杆,其中标本1、2、3、4分别有25、8、8、6个茎杆染菌成功,即共有47个染菌茎杆的切口有真菌菌丝长出,13个茎杆没有感染上菌丝,有可能感染细菌或没有感染上病菌。以出现染菌茎杆变色、染菌茎杆呈水渍发病状、染菌茎杆切口处及其邻近组织有绒状、絮状或稀薄状菌丝病症的作为染菌茎杆。转染成功后结果如图5所示,可见,玉米幼苗茎杆染鞘腐病、茎腐病病菌后,菌丝表现绒状、絮状,玉米幼苗茎杆染纹枯病病菌后,菌丝表现稀薄但不徒长且无孢囊,玉米幼苗茎杆感染根腐病菌后,菌丝表现为绒状、絮状,有的为稀薄状;
69.蘸取镰刀菌的茎杆培养2天和3天的结果如图6。对染腐霉菌或纹枯丝核菌的幼苗茎秆分离菌,分离结果如7所示。由图6和图7可见,采用本发明所述方法得到的染菌的幼苗茎杆上长出目标菌株菌落,均未见细菌伴生。
70.用无菌刀将染菌茎杆上有菌丝的部位切成2~3mm发病组织后移入pda培养基(马铃薯200g、葡萄糖20g和水1000ml)中初培养,其中初培养为暗培养,初培养的温度为25
‑
28℃,时间为2~3d,将分离出的病菌菌落边缘菌丝连同培养基一起切下,置于新pda培养基上进行纯化培养,纯化培养的温度为25~28℃,时间为2~3d,得病原真菌纯培养物。对所得培养物进行观察,利用镰孢菌的菌丝为绒状,腐霉菌的菌丝为絮状,纹枯丝核菌的菌丝为稀薄状的菌丝形态进行鉴定。
71.试验结果为:从第1个供试标本分离获得的菌株均为镰孢菌,第2个供试标本分离获得菌株均为腐霉菌,第3个供试标本分离获得菌株为镰孢菌,第4个供试标本分离获得菌株均为纹枯丝核菌(4个供试样本分别取自具有典型的玉米鞘腐病病症病株、典型的病症玉米茎腐病病株、典型的玉米根腐病病症病株和典型的玉米纹枯病病症病株)。其中转染自长
泰病样的菌株表现出明显的形态多样性,由图8可见,镰刀菌种类丰富,采用本发明方法可以分离出多种镰刀菌。可见采用本发明所述分离方法分离病菌效率高、成功率高、种类多的优势,而且对发病后期一些含菌量少或受细菌感染的病株中病原真菌的识别和分离具有较好的适用性,而且采用本发明所述方法能够多次分离病原菌成功,可见本发明所述方法具有良好的重复性。
72.实施例2
73.供试标本:
74.标本1:玉米鞘腐病病株,病株叶鞘组织见有菌丝(采自长泰,生育期籽粒建成期),标本新鲜,分离时间与采样时间相差1天。待分离病菌的叶鞘病病组织均等分2份。
75.标本2:玉米鞘腐病、茎腐病混合感染病株,病株组织未见有菌丝,且病株伴随细菌感染(采自建瓯,生育期抽穗初期),标本不新鲜,分离时间与采样时间相差3天。待分离病菌的叶鞘、茎基部病病组织均等分3份。
76.标本3:玉米鞘腐病病株,病株组织未见菌丝,且病株伴随细菌感染(采自闽候,生育期8~9叶期),因邮寄过程处理不当,标本不新鲜,萎蔫,分离时间与采样时间相差4天。待分离病菌的叶鞘病病组织均等分3份。
77.实验方法:
78.采用实施例1的试验方法,唯一区别在于:每个病组织培养所得菌丝醮取1个玉米幼苗茎杆切口,每个标本提供10个病组织,即重复10次。
79.对比例1
80.供试标本:
81.同实施例2。
82.实验方法(常规的分离方法1):
83.将病组织的病健交界处组织剪成0.5~0.8cm发病组织,共10个病组织,其中该发病组织与实施例2的发病组织来自同一植株,用无菌水清洗2~3遍后,用体积百分含量的75%乙醇消毒30~45s后,再用无菌水清洗2~3遍后,用无菌滤纸吸去多余水份移入含利福平最终浓度为60ppm的pda培养基(每升pda培养基的组分为马铃薯200g、葡萄糖20g、琼脂15~17g和蒸馏水1000ml)中,3~4天后观察病原菌分离结果。
84.对比例2
85.供试标本:
86.同实施例2,但未对标本1进行分离。
87.实验方法(常规的分离方法2):
88.将病组织的病健交界处组织剪成0.5~0.8cm发病组织,共10个病组织,其中该发病组织与实施例2的发病组织来自同一植株,用无菌水清洗2~3遍后,用体积百分含量的75%乙醇浸泡消毒30~45s后,0.1%升汞3min,再用无菌水冲净2~3遍后,用无菌滤纸吸去多余水份移入含利福平60ppm的pda培养基中,3~4天后观察病原菌分离结果。
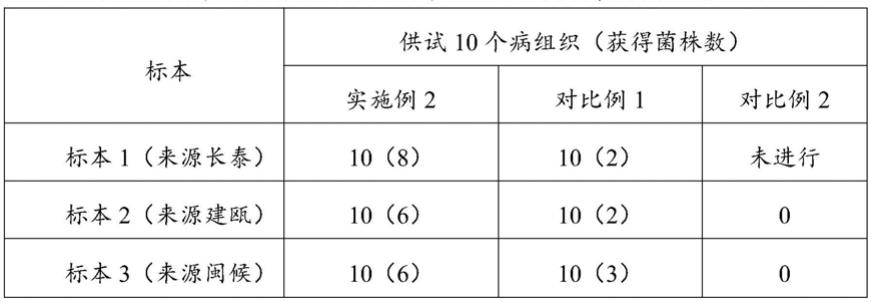
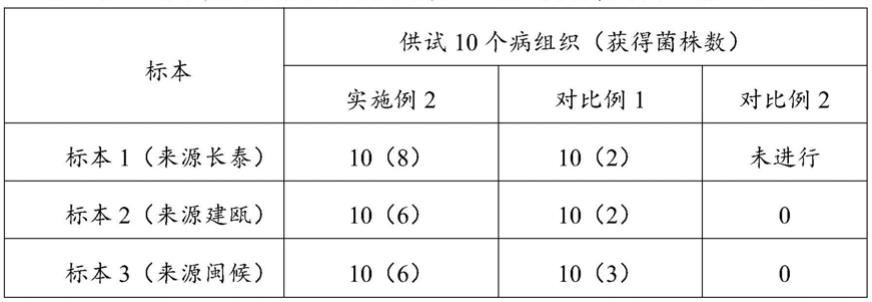
89.实施例2、对比例1和对比例2的病原菌调查结果见表1。
90.表1不同来源标本采用不同方法分离获得病菌结果比较
[0091][0092]
结果如表1所示,其中标本1:采用本发明所述分离方法,供试的10个病组织中,保湿后长出的疑似病原菌菌丝(根据菌丝形态初步与目标菌丝相似)的病组织有10个,切口有真菌菌丝长出的玉米幼苗茎杆8个,切口没有真菌菌丝长出的玉米幼苗茎杆2个,原因有可能未获取到病菌,也有可能感染病组织上的细菌,在切口有真菌菌丝长出的8个玉米幼苗茎杆中分离出病原真菌菌株8个,未见细菌伴生,茎杆病原真菌菌株分离成功率100%,最终分离获得8株镰孢菌;采用对比例1的分离方法,供试的10个病组织中,感染细菌的病组织3个,未长菌丝病组织5个,长有菌丝的病菌组织2个且未见细菌伴生,最终分离获得2株镰孢菌;
[0093]
标本2:采用本发明所述分离方法,供试的10个病组织中,保湿后长出的疑似病菌菌丝块有8个,切口有真菌菌丝长出的茎杆6个,分离出病原真菌菌株6个,未见细菌伴生,最终分离获得6株镰孢菌;采用对比例1的分离方法,供试的10个病组织中,感染细菌的病组织6个,未长菌丝病组织2个,长有菌丝的病菌组织2个且未见细菌伴生,最终分离获得2株镰孢菌;采用对比例2的分离方,供试的10个病组织中,感染细菌的病组织0个,未长菌丝病组织10个,最终分离获得0株真菌;
[0094]
标本3:采用本发明分离方法,供试的10个病组织中,保湿后长出的疑似病菌菌丝块有7个,切口有真菌菌丝长出的玉米幼苗茎杆6个,最终分离获得6株镰孢菌;采用对比例1的分离方法,供试的10个病组织中,感染细菌的病组织2个,长有菌丝的病组织8个且有5个伴有细菌伴生,最终分离获得3株病菌,其中分离出的5个伴有细菌伴生病组织如图9所示,其中第一排从左到右均为病组织的菌落感染细菌明显,第二排从左到右均为病组织的菌落感染细菌不明显;采用对比例2的分离方法,供试的10个病组织中,感染细菌的病组织3个,未长菌丝病组织7个,最终分离获得0株真菌。
[0095]
由此可见,玉米茎腐病和鞘腐病病原菌对0.1%的升汞敏感,不能分离出来引起玉米茎腐病和鞘腐病的病原菌,采用75%乙醇进行分离,对病组织中的少量存活病菌有一定的杀伤力。同时样本新鲜度能直接影响病原菌的分离效果,有的样本还会受到细菌感染,在采用常规分离方法过程中,极少量细菌易在pda培养基上快速生长,从而影响目标病原菌分离,因此,出现真菌与细菌共生的菌落出现,采用常规分离方法通常需要增加其他步骤进行纯化。采用本发明的方法分离获得的菌株数明显高于常规分离法,具有分离病原菌菌株多、分离效率高的优势。
[0096]
实施例3
[0097]
供试材料:玉米鞘腐病病株,病株组织未见有菌丝,且伴随细菌感染(采自建瓯,生育期抽穗初期),分离时间与采样时间相差3天。
[0098]
试验方法:
[0099]
与实施例1相同,2~3天后观察切口菌丝生长效果和菌株分离效果。
[0100]
对比例3
[0101]
供试标本:
[0102]
同实施例3。
[0103]
试验方法:
[0104]
在实施例1基础上,从长有菌丝的8个玉米幼苗茎杆切口处,用接种针挑取菌丝直接在pda平板(将pda培养基倒入平板,得到pda平板,其中,每升pda培养基的组分为马铃薯200g、葡萄糖20g、琼脂15~17g和蒸馏水1000ml)上划线8处,2~3天后观察切口菌丝生长效果和菌株分离效果。
[0105]
对比例4
[0106]
供试标本:
[0107]
同实施例3。
[0108]
试验方法:
[0109]
在实施例1基础上,将长有菌丝的8个玉米幼苗茎杆采用75%乙醇消毒30~45s,无菌水清洗1~2次,将病健组织切成2~3mm发病组织移入pda培养基中,2~4天后观察切口菌丝生长效果和菌株分离效果。
[0110]
对比例5
[0111]
供试标本:
[0112]
同实施例3。
[0113]
试验方法:
[0114]
在实施例1基础上,将长有菌丝的8个保湿培养病组织采用体积百分含量为75%乙醇消毒30~45s后,无菌水清洗2~3次,将病组织切成2~3mm发病组织移入pda培养基中,2~3天后切口菌丝生长效果和菌株分离效果。
[0115]
对比例6
[0116]
供试标本:
[0117]
同实施例3。
[0118]
试验方法:
[0119]
与实施例1步骤相同,区别点在于:取播种18天水稻苗茎杆(长2~3cm,宽0.3cm)代替玉米幼苗茎杆,共8个处理,2~5天后观察切口菌丝生长效果和菌株分离效果。
[0120]
对比例7
[0121]
供试标本:
[0122]
同实施例3。
[0123]
试验方法:
[0124]
在实施例1基础上,取田间种植的8~10叶玉米成株期茎杆叶鞘(长2
‑
3cm,宽0.3cm代替玉米幼苗茎杆,共12个处理,2~5天后观察切口菌丝生长效果和菌株分离效果。
[0125]
对比例8
[0126]
供试标本:
[0127]
同实施例3。
[0128]
试验方法:
[0129]
与实施例1步骤相同,区别点在于:将剥去叶鞘的成株期玉米茎杆(长3~4cm,宽3cm)代替玉米幼苗茎杆,共8个处理,2~5天后观察切口菌丝生长效果和菌株分离效果,调查结果见图10~15。
[0130]
实施例3和对比例3~8的切口所醮取的病组织菌丝来源相同,2~3天后对实施例3和对比例3~8的切口菌丝生长效果和菌株分离效果进行观察。
[0131]
采用本发明分离方法,发现处理的8个玉米幼苗茎杆,其切口有真菌菌丝长出的茎杆有7个;继续保湿处理2天的结果如图12最右侧图片所示,玉米苗茎杆切口菌丝旺盛。同时有真菌菌丝的玉米幼苗茎杆处分离真菌菌株成功率为100%。由此可见,玉米幼苗茎杆切口能快速诱捕病组织上的优势病原菌,并可使茎杆优先选择病菌1次,且易于目标病原菌分离纯化。
[0132]
采用对比例3的分离方法培养4天,发现未长菌丝6个,长出目标菌2个,接种针挑取染菌的玉米幼苗茎杆分离出的菌丝在pda平板上划线的菌落的结果如图10(左侧为玉米幼苗茎杆分离出的菌落图,中间和右侧为划线的菌落图)所示,可以看出,该菌丝长出菌落小,菌丝稀薄;
[0133]
采用对比例4的分离方法,培养3天,发现有5个茎杆分离出目标病菌,3个茎杆未长出菌丝,表明75%乙醇对病菌有影响;
[0134]
采用对比例5的分离方法培养3天的结果如图11所示,虽有病原菌分离出,但也伴随着多种杂菌及细菌出现,可见该方法影响目标菌的进一步分离效果。
[0135]
采用实施例6的分离方法保湿处理24h后,处理的8个水稻苗茎杆切口中,有4个长出菌丝,但菌丝极为稀薄,病原菌分离情况如图14所示,从4个长有菌丝的水稻苗茎杆中分离出病原菌2株,未见细菌伴生,分离出杂菌2株(根霉菌及未知真菌);继续保湿处理2天的处理结果如图12中间图片所示,原有水稻苗茎杆切口长出的菌丝退化,切口干缩;
[0136]
采用实施例7的分离方法保湿处理24h后,处理的12个成株期玉米叶鞘中,未长有菌丝,继续保湿处理2天的结果如图12最右侧图片和图13所示,大部分是不会成功染菌的,12个玉米成株期茎杆叶鞘中,有2个长出菌丝,从2个长有菌丝的叶鞘中分出病原菌2株且伴生细菌。从2个长有菌丝的玉米成株期茎杆中未分离出病原菌,且均为杂细菌;
[0137]
采用实施例8的分离方法保湿处理24h后,处理的8个剥去叶鞘的成株期玉米茎杆,未长有菌丝;继续保湿处理2天结果如图13所示,大部分是不会成功染菌的,8个剥去叶鞘的玉米成株期茎杆切口,有2个长出稀薄菌丝,从2个长有菌丝的玉米成株期茎杆中未分离出病原菌,且均为杂细菌,如图15所示,平板上的病组织有明显的杂菌长出,可见玉米成株期茎杆采用75%乙醇消毒不易透彻。
[0138]
由上述可知,采用水稻苗茎杆、田间种植8~10叶玉米成株期叶鞘虽能诱捕到病原菌,但其诱捕病原菌效果以及病原菌菌丝繁殖量、分离效果均不及玉米幼苗茎杆。
[0139]
实施例4
[0140]
试验菌株:
[0141]
根霉菌、非致病性细菌、木霉菌、未知真菌(在pda平板上菌落暗色),上述四种菌均来自玉米茎部病组织,疑为腐生菌。
[0142]
试验方法:
[0143]
与实施例1的步骤相同,区别仅在于,将消毒后的玉米幼苗茎杆切口直接醮取pda
平板培养的供试菌株(微生物)菌丝、孢子或菌苔,重复6次。
[0144]
将玉米苗茎杆放在无菌培养皿内,培养皿放置在上述透明的塑料盒中及保湿条件下保湿处理2~3天,观察玉米幼苗茎杆切口及茎杆组织病症。
[0145]
对实施例的切口及茎杆组织病症进行调查,结果如图16和17所示:
[0146]
实施例4采用根霉菌处理的玉米幼苗茎杆切口3天的结果如图16所示,玉米幼苗茎杆切口有的无菌丝产生,有的有白色菌丝产生,但菌丝表现徒长,而采用木霉菌、未知真菌、细菌处理的玉米幼苗茎杆切口3天的结果如图17所示,玉米幼苗茎杆切口均无白色菌丝产生。
[0147]
由此可见,可通过玉米幼苗茎杆切口有无菌丝长出及菌丝形态初步识别病组织上的菌丝是否为病原菌。
[0148]
实施例5
[0149]
取用75%乙醇消毒45s、长4cm玉米苗茎杆切口一端醮取平板培养感染细菌的鞘腐病镰孢菌后,保湿培养2~3天,发现处理的玉米苗茎杆切口有菌丝产生。
[0150]
取远离菌丝接触端0.5mm处的染病菌组织茎杆2~3mm发病组织后移入pda培养基中培养,培养3天的结果如图18所示,将发病组织移入pda培养基培养后均有病原菌长出,尚无细菌感染。
[0151]
病原真菌感染细菌后很难纯化,常规方法反复纯化多代后仍有细菌伴随。采用本发明提供的玉米苗茎杆切口对平板培养感染细菌的病原菌具有较好的纯化效果,经过处理的玉米苗茎杆对非病原细菌具有一定的消毒作用和生物过滤作用。
[0152]
由上述实施例记载的可知,本发明所述方法在处理病株发病部位无需进行灭菌,能够避免消毒剂对病组织中少量病菌存活力影响,而且采用玉米幼苗茎杆的切口处接触有目标病原菌,能使病原菌快速繁殖和扩展,减少杂菌对标本目标真菌分离过程中的干扰,最终有目的地对病原菌进行快速识别、选择和诱捕,减少病样中病原菌分离保存的盲目性,具有简便、高效等优点,能较为全面地从病株上分离获得多种病原菌菌株,具有简便高效的优势,本发明提供的方法特别适用于发病后期含菌量少或受杂菌感染的病样中病原真菌的分离,本发明方法的应用对开展玉米茎部病害病原菌种类多样性研究及病害科学治理具有重要意义。而且,当玉米幼苗茎杆切口若接触有目标病原菌,染菌茎杆出现变色、呈水渍发病状,并有绒状、絮状或稀薄状菌丝长出,若茎杆切口接触有其他疑似病原真菌的杂菌或细菌,茎杆表现为无菌丝出现,或出现有一些致密,或徒长的黑根霉菌丝出现,能快速识别、选择和诱捕病原菌,进而保证实现简便、高效的技术效果。另外,本发明采用的2~4叶龄的玉米幼苗茎杆具有易于获得和消毒的优势,玉米幼苗茎杆用消毒后,其表面及切口仍尚余有少量消毒液,当切口瞬间接触病组织上的菌丝表层时,可对病组织及菌丝表层上少量杂菌起到消毒作用,同时对细菌也起到一定的生物过滤作用,可快速识别并诱捕到病原菌。
[0153]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。